Биология моря, 2022, T. 48, № 1, стр. 62-66
Родственные отношения гольца Salvelinus sp. 4 (Salmoniformes: Salmonidae) из озера Начикинское (Камчатка) по данным анализа полных митохондриальных геномов
А. Г. Олейник 1, *, А. Д. Кухлевский 1, Л. А. Скурихина 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского (ННЦМБ) ДВО РАН
690041 Владивосток, Россия
* E-mail: alla_oleinik@mail.ru
Поступила в редакцию 01.04.2021
После доработки 20.04.2021
Принята к публикации 22.04.2021
- EDN: YGXCDR
- DOI: 10.31857/S0134347522010089
Аннотация
Проведен сравнительный анализ изменчивости трех полных митохондриальных геномов эндемичного гольца Salvelinus sp. 4 из оз. Начикинское (Камчатка, Россия) и близкородственных гольцов из Азии и Северной Америки. Результаты филогенетического анализа полных митохондриальных геномов подтверждают близость Salvelinus sp. 4 и Salvelinus alpinus erythrinus из Северной Америки (NWT) и свидетельствуют о том, что таксоны представляют Арктическую филогенетическую группу гольца Таранца Salvelinus taranetzi. Получены новые доказательства того, что популяция Salvelinus sp. 4 из оз. Начикинское является изолированной популяцией S. taranetzi. Предполагая общее происхождение гольцов Salvelinus sp. 4 и S. a. erythrinus из географически изолированных популяций, мы оценили дивергенцию полных митохондриальных геномов, появившуюся в результате фрагментации ареала общего предка.
Исследование полных митохондриальных геномов (митогеномов) лососевых рыб в последнее время достигло определенных успехов (Horreo, 2017). В то же время информации о гольцах рода Salvelinus Richardson, 1836, который является доминирующим по биоразнообразию и численности, еще недостаточно для реконструкции непротиворечивой филогении. Для представителей рода Salvelinus характерны высокая морфологическая и экологическая изменчивость, быстрая радиация, интрогрессивная гибридизация и локальные адаптации (Klemetsen, 2010; Taylor, 2016), которые затрудняют филогенетические исследования, могут приводить к неточному определению видовой принадлежности отдельных популяций и, как следствие, к некорректным филогенетическим выводам. Однако ревизия возможна только при наличии митогеномов всех таксонов рода.
Филогенетические исследования узкоареальных, эндемичных и спорных таксонов гольцов, оригинальные описания большинства из которых основаны исключительно на морфологических признаках, значительно выиграют от секвенирования митогеномов (Balakirev et al., 2016; Oleinik et al., 2019, 2020). Среди таких таксонов выделяется Salvelinus sp. – эндемичный голец из оз. Начикинское (Викторовский, 1978). По мнению Викторовского (1978), своеобразие Salvelinus sp. обусловлено древностью депрессии ледникового озера, которое никогда не подвергалось влиянию трансгрессий. Значительный вклад в изучение морфологии и экологии озерного гольца внесла Савваитова (1989), показавшая, что этот голец представляет внутривидовую биологическую форму мальмы в составе комплекса Salvelinus alpinus (Linnaeus, 1758). Впоследствии озерный голец рассматривался в ранге подвида Salvelinus czerskii Drjagin, 1932 (см.: Глубоковский, 1995). Однако Черешнев (1990), а затем Богуцкая и Насека (2004) отнесли его к виду Salvelinus sp. 4. Несмотря на то, что предыдущие молекулярные исследования Salvelinus sp. 4 ограничены анализом нескольких митохондриальных генов (Олейник, Скурихина, 2007; Олейник и др., 2015, 2019; Сенчукова и др., 2015), они позволили выявить филогенетическую близость изолированной популяции из оз. Начикинское и гольцов Арктической филогруппы Чукотки и Северной Америки (Олейник и др., 2019). Ранее был секвенирован митогеном Salvelinus taranetzi Kaganovsky, 1955 из места первоописания (Oleinik et al., 2019), но для дальнейшего изучения и более точной филогении рода важно было получить митогеномы Salvelinus sp. 4. и S. a. erythrinus из Северной Америки (NWT).
Анализ выполнен для трех экземпляров гольца Salvelinus sp. 4 из оз. Начикинское, п-ов Камчатка, Россия (53°01′ N, 157°50′ E) и для двух экземпляров S. a. erythrinus из р. Джейко (Jayko R.), о-в Виктория, Канада (69°42.56′ N, 103°16.82′ W). Геномная ДНК выделена из мышечной ткани и плавников по стандартной методике (Sambrook et al., 1989). Амплификацию и последующее секвенирование геномных фрагментов проводили с использованием 23 пар специфических праймеров и набора BigDye Terminator v3.1 (Applied Biosystems, США). Специфические праймеры для амплификации и секвенирования разработаны авторами на основе опубликованных в GenBank митогеномов гольцов рода Salvelinus с помощью программы mitoPrimer_V1 (Yang et al., 2011). Последовательности нуклеотидов определяли в генетическом анализаторе GA3500 (Applied Biosystems, США). Секвенированные фрагменты собраны в митогеномы и аннотированы с использованием Geneious R11 (http://www.geneious.com/).
Для представления филогенетических отношений построены дендрограммы BioNJ на основе LogDet дистанций и наибольшего правдоподобия (ML) для GTR + G + I модели нуклеотидных замещений, выбранной на основе BIC-критерия. Эвристический поиск ML-деревьев выполнен в 100 повторностях со случайным включением последовательностей и с перестановками по SPR-алгоритму. Устойчивость топологий всех деревьев оценивали с помощью бутстрэп анализа (1000 реплик). Статистический и филогенетический анализы проводили в программе MEGA X (Kumar et al., 2018). Для подтверждения филогенетического положения Salvelinus sp. 4 и S. a. erythrinus из базы данных GenBank в анализ включены 27 митохондриальных геномов представителей рода Salvelinus и внешних групп (Parahucho, Salmo) (табл. 1).
Таблица 1.
Список таксонов гольцов рода Salvelinus и внешних групп (Parahucho, Salmo) с Genbank-номерами полных митохондриальных геномов, включенных в филогенетический анализ
| Таксон | Видовое название | Длина (пн) | GenBank-номер |
|---|---|---|---|
| Salvelinus albus | Белый голец | 16 653 | KT266870 |
| Salvelinus albus | Белый голец | 16 653 | KT266871 |
| Salvelinus alpinus | Арктический голец | 16 659 | NC000861 |
| Salvelinus alpinus alpinus | Арктический голец | 16 657 | MN957795 |
| Salvelinus alpinus alpinus | Арктический голец | 16 655 | MN957796 |
| Salvelinus alpinus alpinus | Арктический голец | 16 655 | MN957797 |
| Salvelinus alpinus erythrinus | Арктический голец | 16 652 | MW664921 |
| Salvelinus alpinus erythrinus | Арктический голец | 16 652 | MW664922 |
| Salvelinus boganidae | Боганидский голец | 16 655 | MK695623 |
| Salvelinus curilus | Южная мальма | 16 654 | NC024585 |
| Salvelinus curilus | Южная мальма | 16 652 | NC037502 |
| Salvelinus elgyticus | Малоротая палия | 16 654 | MK695624 |
| Salvelinus elgyticus | Малоротая палия | 16 654 | MK695625 |
| Salvelinus fontinalis | Американская малоротая палия | 16 624 | NC000860 |
| Salvelinus leucomaenis | Кунджа | 16 655 | KF974451 |
| Salvelinus levanidovi | Голец Леванидова | 16 624 | MK695626 |
| Salvelinus malma kuznetzovi | Каменный голец | 16 654 | KU674351 |
| Salvelinus malma kuznetzovi | Каменный голец | 16 654 | KU674352 |
| Salvelinus malma malma | Северная мальма | 16 654 | KJ746618 |
| Salvelinus namaycush | Озерная палия | 16 653 | NC036392 |
| Salvelinus sp. 4 | Начикинский голец | 16 654 | MW181766 |
| Salvelinus sp. 4 | Начикинский голец | 16 654 | MW181767 |
| Salvelinus sp. 4 | Начикинский голец | 16 654 | MW181768 |
| Salvelinus taranetzi | Голец Таранца | 16 654 | MK695630 |
| Salvelinus taranetzi | Голец Таранца | 16 654 | MK695631 |
| Salvethymus svetovidovi | Длинноперая палия Световидова | 16 655 | MK695627 |
| Salvethymus svetovidovi | Длинноперая палия Световидова | 16 655 | MK695628 |
| Salvethymus svetovidovi | Длинноперая палия Световидова | 16 655 | MK695629 |
| Salmo salar | Атлантический лосось | 16 669 | AF133701 |
| Salmo trutta trutta | Кумжа | 16 677 | AM910409 |
| Parahucho perryi | Сахалинский таймень | 16 652 | KJ816315 |
| Parahucho perryi | Сахалинский таймень | 16 653 | KJ816316 |
Размер митогеномов составил 16 654 пар нуклеотидов (пн) для Salvelinus sp. 4 (MW181766–MW181768) и 16 652 пн для S. a. erythrinus (MW664921, MW664922). Геномная организация была идентична типичным митогеномам лососевых рыб и включала два гена рРНК, 13 генов, кодирующих белки, 22 гена тРНК, а также некодирующие участки начала репликации легкой цепи (OL) и контрольной области (CR). Одинаковое расположение генов для всех новых митогеномов одновременно является типичным для видов рода Salvelinus (Balakirev et al., 2016; Oleinik et al., 2019, 2020). Процентное содержание нуклеотидных оснований составило: A – 28.0%, T – 26.4%, C – 28.6% и G – 17.0% с небольшим преобладанием AT оснований (54.4%). Между последовательностями митогеномов Salvelinus sp. 4 и S. a. erythrinus обнаружены 23 нуклеотидные замены и одно различие в длине, обусловленное вставкой (GA) в некодирующем участке (OL). Большая часть замен (16) располагалась в общих белок-кодирующих последовательностях (ND1, ND3, ND4L, ND4, ND5, ND6, COI, COIII, Cytb), для которых соотношение синонимичных и несинонимичных замен составило 11/5. В то же время между митогеномами Salvelinus sp. 4 и S. taranetzi обнаружены 44 нуклеотидные замены, 36 из которых располагались в белок-кодирующих последовательностях (ND1, ND2, ND3, ND4L, ND4, ND5, ND6, COI, COII, COIII, ATP6, Cytb). Соотношение синонимичных и несинонимичных замен в этом случае составило 31/5. Гены, кодировавшие белки, имели разную степень изменчивости, самую высокую – для субъединиц NADP-дегидрогеназы (47.8 и 52.3% от всех вариабельных сайтов для двух пар сравнения). При этом общая длина генов тРНК была одинаковой (1560 пн) у новых митогеномов и S. taranetzi.
Минимальные оценки дивергенции обнаружены между митогеномами Salvelinus sp. 4 и S. a. erythrinus (Dxy = 0.0011 ± 0.0002, использовались LogDet дистанции). Дивергенция последовательностей (в среднем 0.00242 ± 0.00061) между исследованными образцами Salvelinus sp. 4 и митогеномами S. taranetzi (MK695630, MK695631) не превышала уровень внутривидовой изменчивости для S. taranetzi (Олейник и др., 2015, 2019). В то же время Salvelinus sp. 4 и S. a. erythrinus показали одинаковый уровень дивергенции (в среднем 0.0110 ± 0.0007) с митогеномами S. a. alpinus (MN957795–MN957797) и S. a. oquassa (AF154851), соответствующий межвидовой изменчивости гольцов (Олейник и др., 2015). Филогенетические деревья гольцов рода Salvelinus (BioNJ, ML), полученные на основе митогеномов, имели одинаковую топологию с идентичным составом кластеров, длинами ветвей и статистической поддержкой узлов (рис. 1).
Рис. 1.
ML-дерево, построеное на основе сравнения полных митохондриальных геномов Salvelinus sp. 4 и других представителей гольцов рода Salvelinus. Цифры в узлах соответствуют значениям бутстрэп поддержки для ML- и BioNJ-деревьев соответственно. Вставка – бескорневое BioNJ-дерево гольцов Арктической филогенетической группы (по: Олейник и др., 2015). Жирным шрифтом выделены полные митохондриальные геномы, исследованные в настоящей работе.
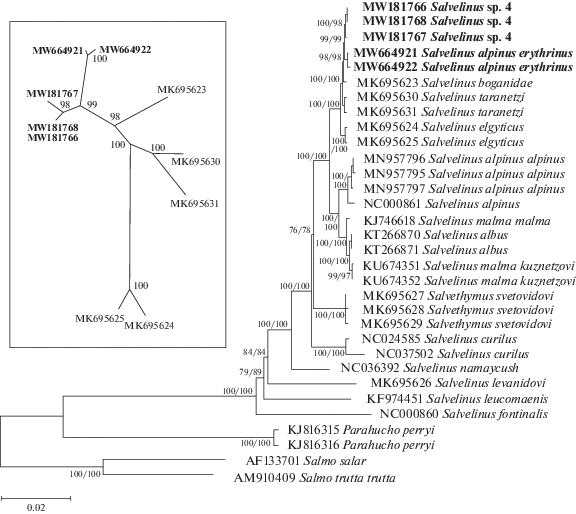
Современные взгляды на филогению рода основаны на изучении изменчивости CR мтДНК (Brunner et al., 2001; Yamamoto et al., 2014). Выделено несколько филогенетических групп, объединяющих близкородственных гольцов (Атлантическая, Сибирская, Акадийская, Арктическая, Берингийская, Западная и Восточная тихоокеанские). Предложено также выделить самостоятельную Арктическую филогенетическую группу S. taranetzi (Олейник и др., 2015), в которую входят азиатские и североамериканские гольцы с соответствующими гаплотипами. Наши результаты свидетельствуют о том, что Salvelinus sp. 4 и S. a. erythrinus (NWT) принадлежат к Арктической филогруппе S. taranetzi. В целом это согласуется с предыдущими результатами, полученными для последовательностей генов Cytb, COI и CR (Сенчукова и др., 2015; Олейник и др., 2019; Esin et al., 2017). Положение Salvelinus sp. 4 на филограмме строго определено и статистически подтверждено (99%), так же как и сестринские отношения между Salvelinus sp. 4 – S. a. erythrinus и S. taranetzi (100%). Ранее нам удалось решить проблему взаимоотношений S. taranetzi из Азии и S. a. erythrinus из Северной Америки (NWT), доказав их филогенетическую близость (Олейник и др., 2019). Не вызывает сомнений, что гольцы Арктической филогруппы из Северной Америки S. a. erythrinus (синонимы: S. a. stagnalis, S. a. taranetzi) и Северо-Восточной Азии принадлежат к одному виду, который впервые был описан как голец Таранца S. taranetzi Кагановский, 1955 из оз. Аччен (Чукотка). При сравнении митогеномов мы получили новые доказательства того, что популяция гольцов из оз. Начикинское, характеризующихся уникальным набором морфологических признаков (Савваитова, 1989), тем не менее является изолированной популяцией S. taranetzi.
Филогения рода Salvelinus на основе митогеномов свидетельствует о том, что генетическое сходство географических выборок Salvelinus sp. 4 и S. a. erythrinus обусловлено послеледниковой колонизацией из общих источников. Низкий уровень дивергенции митогеномов при наличии хоминга и отсутствии проходной стадии у озерных гольцов, вероятно, сформировался в результате фрагментации ареала общего предка.
Список литературы
Богуцкая Н.Г., Насека А.М. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: Товарищество науч. изд. КМК. 2004. 389 с.
Викторовский Р.М. Механизмы видообразования у гольцов Кроноцкого озера. М.: Наука. 1978. 111 с.
Глубоковский М.К. Эволюционная биология лососевых рыб. М.: Наука. 1995. 343 с.
Олейник А.Г., Скурихина Л.А. Генетическая дивергенция симпатричных гольцов рода Salvelinus из озера Начикинское (Камчатка) // Генетика. 2007. Т. 43. № 8. С. 1097−1106.
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. Филогения гольцов рода Salvelinus по данным анализа митохондриальной ДНК // Генетика. 2015. Т. 51. № 1. С. 63−77.
Олейник А.Г., Скурихина Л.А., Кухлевский А.Д., Бондарь Е.И. Генетическая дифференциация гольцов Арктической группы Северо-Восточной Азии и Северной Америки // Генетика. 2019. Т. 55. № 3. С. 325−336.
Савваитова К.А. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат. 1989. 224 с.
Сенчукова А.Л., Павлов С.Д., Есин Е.В. и др. Гольцы рода Salvelinus из озера Начикинское (Камчатка) и их положение в филогенетической системе S. alpinus – S. malma // Вопр. ихтиологии. 2015. Т. 55. № 1. С. 74−81.
Черешнев И.А. Состав ихтиофауны и особенности распределения пресноводных рыб в водоемах Северо-востока СССР // Вопр. ихтиологии. 1990. Т. 30. № 5. С. 836−844.
Balakirev E.S., Parensky V.A., Kovalev M.Yu., Ayala F.J. Complete mitochondrial genome of the stone char Salvelinus kuznetzovi (Salmoniformes, Salmonidae) // Mitochondrial DNA, Part B: Resources. 2016. V. 1. № 1. P. 287–288.
Brunner P.C., Douglas M.R., Osinov A. et al. Holarctic phylogeography of Arctic charr (Salvelinus alpinus L.) inferred from mitochondrial DNA sequences // Evolution. 2001. V. 55. № 3. P. 573–586.
Esin E.V., Bocharova E.S., Mugue N.S., Markevich G.N. Occurrence of sympatric charr groups, Salvelinus, Salmonidae, in the lakes of Kamchatka: a legacy of the last glaciations // J. Fish Biol. 2017. V. 91. № 2. P. 628–644.
Horreo J.L. Revisiting the mitogenomic phylogeny of Salmoninae: new insights thanks to recent sequencing advances // PeerJ. 2017. V. 5. Art. ID e3828. https://doi.org/10.7717/peerj.3828
Klemetsen A. The charr problem revisited: Exceptional phenotypic plasticity promotes ecological speciation in postglacial lakes // Freshwater Rev. 2010. V. 3. P. 49–74.
Kumar S., Stecher G., Li M. et al. MEGA X: Molecular evolutionary genetics analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547−1549.
Oleinik A.G., Skurikhina L.A., Kukhlevsky A.D., Semenchenko A.A. Complete mitochondrial genome and phylogenetic position of the Taranetz charr Salvelinus taranetzi Kaganovsky, 1955 (Salmoniformes: Salmonidae) // Mitochondrial DNA, Part B: Resources. 2019. V. 4. № 2. P. 2491−2492.
Oleinik A.G., Skurikhina L.A., Kukhlevsky A.D., Semenchenko A.A. Complete mitochondrial genomes of the Arctic charr Salvelinus alpinus alpinus Linnaeus (Salmoniformes: Salmonidae) // Mitochondrial DNA, Part B: Resources. 2020. V. 5. № 3. P. 2895−2897. https://www.tandfonline.com/doi/full/10.1080/ 23802359.2020.1791015.
Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. N.Y.: Cold Spring Harbor Lab. Press. 1989. 1626 p.
Taylor E.B. The Arctic char (Salvelinus alpinus) “complex” in North America revisited // Hydrobiologia. 2016. V. 783. № 1. P. 283–293.
Yamamoto S., Maekawa K., Morita K. et al. Phylogeography of the salmonid fish, Dolly Varden Salvelinus malma: Multiple glacial refugia in the North Pacific rim // Zool. Sci. 2014. V. 31. № 10. P. 660–670.
Yang C.-H., Chang H.-W., Ho C.-H. et al. Conserved PCR primer set designing for closely-related species to complete mitochondrial genome sequencing using a sliding window-based PSO algorithm // PLoS One. 2011. V. 6. Art. ID. e17729. https://doi.org/10.1371/journal.pone.0017729
Дополнительные материалы отсутствуют.


