Биология моря, 2022, T. 48, № 2, стр. 101-110
Сезонная и годовая изменчивость склеритограмм чешуи горбуши Oncorhynchus gorbuscha (Walbaum, 1792) (Salmonidae)
А. М. Каев 1, *, Л. В. Ромасенко 1, Д. А. Каев 2
1 Сахалинский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии (СахНИРО)
693023 Южно-Сахалинск, Россия
2 Дальневосточный федеральный университет (ДВФУ)
690922 Владивосток, Россия
* E-mail: kaev@outlook.com
Поступила в редакцию 19.04.2021
После доработки 28.10.2021
Принята к публикации 27.01.2022
- EDN: MCXGOT
- DOI: 10.31857/S0134347522020061
Аннотация
Объектом исследования послужила горбуша Oncorhynchus gorbuscha (Walbaum, 1792), пойманная в морском прибрежье и реках юго-восточного побережья о-ва Сахалин в 2005–2020 гг. На чешуе рыб в среднем насчитывали по 36.3 (SD = 2.43) склерита − от 33.6 до 38.1 у разных поколений. Для сравнения межсклеритных расстояний на чешуе разных рыб все склеритограммы были нормализованы к 36 склеритам. Значение критерия Фишера при оценке разности межсклеритных расстояний у рыб из проб, собранных в течение сезона, в среднем составило 1.95, а у рыб, собранных в разные годы, – 29.89, что свидетельствует о существенных различиях в профиле склеритограмм чешуи у рыб разных поколений.
При изучении такой регистрирующей структуры, как чешуя рыб, со второй половины ХХ в. применяются склеритограммы (Дгебуадзе, Чернова, 2009). Статистический анализ промеров межсклеритных расстояний, несмотря на критические замечания (Чернова и др., 2017), позволяет решать разные задачи. Определение возраста и темпа роста по чешуе в ряде случаев оказывается достовернее, чем по отолитам (Courtney et al., 2000; Kaneto et al., 2017). При изучении тихоокеанских лососей рода Oncorhynchus склеритограммы широко используются для выяснения происхождения рыб (Каев, 1998, 2015а; Бугаев и др., 2012; Fukuwaka, 1998; Walker et al., 1998; Howard et al., 2016; Yasumiishi et al., 2016). В то же время практически отсутствуют работы, в которых темп роста рассматривается как один из показателей динамики стада (Никольский, 1974). В связи с этим целью данного исследования является изучение сезонной и межгодовой динамики межсклеритных расстояний на чешуе горбуши O. gorbuscha (Salmonidae) для сравнения роста рыб разных поколений.
МАТЕРИАЛ И МЕТОДИКА
Объектом исследования послужила горбуша юго-восточного побережья о-ва Сахалин, которое характеризуется наиболее высокой численностью этого вида. Образцы чешуи были собраны в 2005–2020 гг. по стандартной методике (McLellan, 1987) у рыб, пойманных закидными неводами или сетями в нижней части рек и ставными неводами вдоль сравнительно небольшого участка побережья (рис. 1). Число изученных чешуй зависело не только от объема собранных проб (ежегодно по 2–6 проб, как правило, по 100 рыб в каждой), но и от качества чешуйных пластинок (отбраковывались образцы с поврежденным краем, с выраженной деформацией склеритного рисунка, а также с разрушенной или сильно деформированной центральной частью). Всего изучено 2946 образцов. Подсчет числа склеритов и их измерение проводили от центра чешуи по визуально выбираемому наибольшему радиусу. Сначала измерения выполняли с помощью системы анализа биологических препаратов (OPRS) фирмы “Биосоникс”. Последующий отказ от данного метода был связан с необходимостью многочисленных исправлений из-за дублирования измерений одного и того же склерита, его пропуска при нечетком рисунке, а также из-за измерения расстояний до попадавшихся на чешуе точечных загрязнений. Измерения стали проводить с точностью до 0.5 мм на распечатках фотографий чешуи с радиусом около 25 см. До начала измерений изучали характер склеритных образований и выбирали оптимальное направление радиуса для минимизации завышения или занижения количества подсчитываемых склеритов вследствие хаотичного расположения мест их раздвоения или слияния. При этом изменения последовательно расположенных межсклеритных расстояний, связанные с небольшим смещением выбираемого радиуса (до 15°), не выходили за пределы внутригрупповой изменчивости данного параметра в исследуемой пробе (Каев, Пулькина, 2016). Следующим нюансом, вносящим коррективы в процесс измерения, является деформация центральной части чешуи, в первую очередь, центральной чешуйной пластинки (ЦЧП), у рыб с развивающимися брачными изменениями. Поэтому измерение расстояний до каждого последующего склерита начинали от ЦЧП. По краю чешуи часто встречались склериты с незавершенным ростом. В этих случаях, если дистанция от предыдущего склерита до края чешуи не превышала трети предыдущего межсклеритного расстояния, данный прирост добавляли к таковому предыдущего завершенного склерита.
Рис. 1.
Район сбора проб горбуши Oncorhynchus gorbuscha на юго-восточном побережье о-ва Сахалин (эллипс) и генерализованная схема теплых (темные стрелки) и холодных (светлые стрелки) течений в южной части Охотского моря и в прикурильских водах Тихого океана.

Межсклеритные расстояния могут значительно меняться по периметру соседних склеритов, поэтому первичные данные измерений сглажены с применением минимального шага (по трем смежным значениям), чтобы сохранить все имеющиеся на чешуе чередования групп сужающихся или расширяющихся межсклеритных расстояний. Для стандартизации данных (вариации направлений измеряемого радиуса, изменения формы и размеров чешуи) межсклеритные расстояния выражены в процентах к их суммарному значению. В публикациях разных авторов не оговаривается принцип выделения как первой годовой зоны роста (ПГЗ), так и второй (ВГЗ). Во избежание субъективности внешней границей ПГЗ считали средний из пяти смежных склеритов в зоне годового кольца с минимальной суммой межсклеритных расстояний. В случае наличия разных вариантов (смещение на 1–2 склерита не изменяло результат) выбирали вариант с наибольшим удалением от центра чешуи (Каев, 2015а). Прямое сопоставление межсклеритных расстояний затруднительно из-за вариации числа склеритов в ПГЗ на чешуе разных рыб, поэтому анализ проводится или по отдельным группам склеритов (Иванков и др., 1996; Вялова и др., 1999; Бугаев, 2005), или по расчетной ширине условных склеритов при нормировании их числа к какому-либо единому значению (Темных, 1998). В данном исследовании использовано нормирование.
При попарном сравнении склеритограмм, усредненных для тех или иных групп горбуши, оценивали различия между средними значениями межсклеритных расстояний в соответствии с их порядковым номером. Достоверность различия между средними значениями оценена по критерию Фишера. Статистическая обработка материалов проведена в среде Windows в программе Microsoft Office Excel. Проверка для каждого поколения горбуши всей совокупности значений межсклеритных расстояний, использованных при построении склеритограмм, на соответствие нормальному распределению (по критерию X 2(k)) выполнена с применением программы “Statistica”. В тексте использованы следующие обозначения: M – среднее значение, SD – среднее квадратичное отклонение, r – коэффициент корреляции Пирсона, p – уровень значимости нуль-гипотезы, n – объем выборки, F – критерий Фишера, FL – длина по Смитту.
РЕЗУЛЬТАТЫ
На чешуе горбуши в среднем насчитывалось по 36.3 склерита − от 33.6 до 38.1 у разных поколений (табл. 1). Размах индивидуальных колебаний был существенно шире; в разные годы у рыб разных поколений наименьшее число склеритов варьировало от 28 до 33, наибольшее – от 40 до 44. Наименьшая амплитуда (от 33 до 42 склеритов) отмечена у рыб в 2009 г., однако это связано не только с небольшой выборкой, так как при наибольшей выборке в 2016 г. размах индивидуальных колебаний (от 31 до 44 склеритов) не был экстремально большим. Проанализированные образцы чешуи были собраны в разные годы с 21 июля по 31 августа, при этом 72.7% проб – с 6 по 25 августа, т.е. в период наиболее интенсивных подходов горбуши. В этой связи рассмотрим распределения по числу склеритов в ПГЗ и ВГЗ на чешуе рыб в 2016 г. с широким диапазоном сроков их поимки (рис. 2). В пяти пробах распределения в ПГЗ были практически идентичными, и лишь в одной пробе (3 августа) модальные группы были несколько смещены в сторону бόльших порядковых номеров склеритов. В результате данная проба по среднему значению числа склеритов в ПГЗ (табл. 2) отличалась от первой (p < 0.05) и последующих проб (p < 0.01). Распределения по числу склеритов и их средние значения для ВГЗ чешуи во всех пробах были идентичными.
Таблица 1.
Средние значения длины тела (FL) и числа склеритов на чешуе у горбуши Oncorhynchus gorbuscha на юго-восточном побережье о-ва Сахалин в разные годы
| Год | FL, см | Число склеритов | N, экз. | |||
|---|---|---|---|---|---|---|
| первая годовая зона | вся чешуя | |||||
| M | SD | M | SD | |||
| 2005 | 44.4 | 22.7 | 2.13 | 35.0 | 2.29 | 137 |
| 2006 | 46.8 | 24.0 | 1.70 | 37.1 | 2.30 | 142 |
| 2007 | 45.8 | 24.0 | 1.84 | 37.2 | 2.59 | 117 |
| 2008 | 48.0 | 23.7 | 1.73 | 37.4 | 2.49 | 121 |
| 2009 | 50.2 | 25.0 | 1.66 | 38.1 | 2.07 | 81 |
| 2010 | 47.2 | 23.1 | 1.72 | 36.8 | 2.57 | 144 |
| 2011 | 45.9 | 22.6 | 1.90 | 35.9 | 2.46 | 214 |
| 2012 | 44.9 | 22.2 | 1.67 | 36.0 | 2.40 | 149 |
| 2013 | 49.6 | 24.5 | 1.79 | 36.7 | 2.65 | 202 |
| 2014 | 47.6 | 24.0 | 1.90 | 36.7 | 2.58 | 227 |
| 2015 | 50.2 | 23.3 | 2.06 | 37.4 | 2.36 | 165 |
| 2016 | 45.6 | 23.5 | 1.63 | 36.8 | 2.36 | 475 |
| 2017 | 49.9 | 22.8 | 1.95 | 35.6 | 2.68 | 186 |
| 2018 | 44.8 | 22.7 | 1.94 | 33.6 | 2.43 | 215 |
| 2019 | 48.2 | 23.9 | 1.83 | 35.7 | 2.38 | 189 |
| 2020 | 46.9 | 22.4 | 1.78 | 34.4 | 2.31 | 182 |
Рис. 2.
Распределения по числу склеритов в первой (а) и второй (б) годовых зонах роста чешуи горбуши Oncorhynchus gorbuscha из проб с разными датами сбора на юго-восточном побережье о-ва Сахалин в 2016 г.

Таблица 2.
Средние значения числа склеритов в первой (ПГЗ) и второй (ВГЗ) годовых зонах роста чешуи горбуши Oncorhynchus gorbuscha с юго-восточного побережья о-ва Сахалин в разные даты сбора в 2016 г.
| Дата сбора | Число склеритов | N, экз. | |||
|---|---|---|---|---|---|
| ПГЗ | ВГЗ | ||||
| M | SD | M | SD | ||
| 29 июля | 23.44 | 1.590 | 13.48 | 2.233 | 80 |
| 3 августа | 24.09 | 1.737 | 13.38 | 1.803 | 76 |
| 8 августа | 23.69 | 1.718 | 13.42 | 1.905 | 85 |
| 12 августа | 23.35 | 1.666 | 13.02 | 1.705 | 89 |
| 19 августа | 23.28 | 1.522 | 13.09 | 1.706 | 74 |
| 25 августа | 23.28 | 1.365 | 12.97 | 1.594 | 71 |
Судя по средним значениям длины тела горбуши и числу склеритов на ее чешуе, количество последних увеличивается в поколениях с более быстрым ростом рыб (r = 0.50, p < 0.05). Однако такая связь становится существенно слабее при сопоставлении индивидуальных значений − в среднем r = 0.27 (от 0.06 до 0.55 у разных поколений). Примерно две трети радиуса чешуи приходится на ПГЗ, в которой в среднем насчитывается по 23.4 склерита (от 22.2 до 25.0 у разных поколений) по сравнению с 12.9 склерита (от 10.9 до 14.1 у разных поколений) в ВГЗ роста чешуи. У поколений с более крупными рыбами число склеритов на чешуе было, как правило, больше, что особенно заметно в ПГЗ (r = 0.53, p < 0.05) по сравнению с ВГЗ (r = 0.20, p > 0.05). Однако и в этом случае результат существенно корректируется при сопоставлении индивидуальных значений этих параметров. Так, корреляция числа склеритов в ПГЗ с длиной тела рыб у разных поколений изменялась от −0.10 до 0.28 (в среднем 0.12), в ВГЗ – от 0.10 до 0.46 (в среднем 0.25). Обратим внимание и на такую особенность, как различие по числу склеритов в ПГЗ и ВГЗ – от 8.5 до 12.4 у разных поколений. В случае пропорционального увеличения числа склеритов в ПГЗ и ВГЗ корреляция между данным увеличивающимся различием и суммарным числом склеритов на чешуе стремилась бы к 1, однако фактически отмечено отсутствие корреляции между этими параметрами при анализе как средних значений для поколений (r = −0.07), так и индивидуальных значений в поколениях (r = 0.02).
Учитывая расхождения по числу склеритов, для сопоставления межсклеритных расстояний склеритограммы всех рыб каждого из поколений были нормированы к 36 склеритам, т.е. к их среднему значению у горбуши за изученный период. Анализ полученных массивов данных показал, что из 560 эмпирических распределений в 61 случае уровень отличия от нормального распределения превышал первый (p < 0.05), в 18 случаях второй (p < 0.01) и только в 9 случаях третий уровень статистической значимости (p < 0.001), что приемлемо для биологических исследований (Плохинский, 1970). Необходимо отметить, что появление больших значений X2(k) было не хаотичным, а приуроченным в основном к определенным фрагментам склеритограмм (рис. 3).
Рис. 3.
Средняя для всех изученных поколений горбуши Oncorhynchus gorbuscha склекритограмма чешуи (1) и средние значения критерия X2(k) (2) при анализе распределений межсклеритных расстояний.

При сопоставлении склеритограмм чешуи рыб разного пола установлено их почти полное сходство (рис. 4). Так, при оценке разности расстояний между склеритами с одинаковыми порядковыми номерами у самцов и самок в каждом поколении из 560 сравниваемых пар только в 40 парах значения превысили первый (F от 3.90 до 6.71), в четырех парах – второй (от 7.10 до 8.80) и в двух парах – третий порог статистической значимости (11.83 и 11.92). Наибольшие значения критерия Фишера характеризовали разницу в значениях расстояний между склеритами последних порядковых номеров.
Рис. 4.
Средние для всех изученных поколений горбуши Oncorhynchus gorbuscha склеритограммы чешуи рыб разного пола (1 – самцы, 2 – самки) и значения критерия Фишера (3) при сопоставлении межсклеритных расстояний.
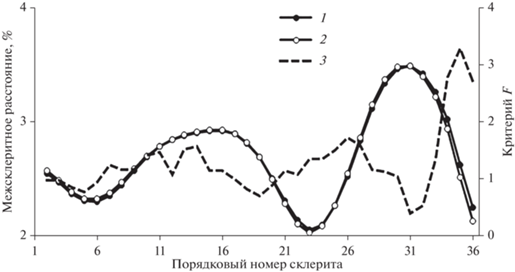
Большое сходство склеритограмм у рыб разного пола позволило провести их суммарное сравнение между разными пробами одного года сбора, а также между разными поколениями горбуши. Различия по величине межсклеритных расстояний у рыб из разных проб в среднем были существенно меньше. Так, из 1645 сравниваемых пар только в 151 паре значения F (от 3.90 до 6.85, в среднем 5.11) превысили первый, в 75 парах (от 6.88 до 11.37, в среднем 8.60) – второй, в 32 парах (от 11.61 до 21.40, в среднем 14.91) – третий уровень статистической значимости. Иная ситуация наблюдалась при сопоставлении склеритограмм разных поколений горбуши. Из 4200 сравниваемых пар межсклеритных расстояний значения F превысили первый, второй и третий уровни статистической значимости соответственно в 360 (от 3.90 до 6.79, в среднем 5.30), 387 (от 6.70 до 11.7, в среднем 8.81) и 2082 (от 11.01 до 538.49, в среднем 56.92) парах. Принципиальное различие между этими вариантами состоит не только в огромной разнице значений F (в среднем 1.95 при сезонном сопоставлении против 29.89 при межгодовом сопоставлении склеритограмм), но и в соотношении количества полученных значений F, соответствующих рангам p < 0.05, 0.01 и 0.001. Если при сопоставлении склеритограмм рыб из разных проб одного года число значений, соответствующих этим рангам, уменьшается (9.2, 4.6 и 1.9% от суммарного количества измерений), то при сопоставлении склеритограмм рыб разных поколений, напротив, увеличивается (8.6, 9.2 и 49.5%). Расхождения между межсклеритными расстояниями на чешуе рыб разных поколений с наиболее высоким уровнем статистической достоверности расположены не хаотично, а сгруппированы по отдельным фрагментам склеритограмм (рис. 5).
ОБСУЖДЕНИЕ
Чешую рыб используют для изучения их роста, поскольку количество склеритов отражает реальный возраст особей, хотя существует иная точка зрения, в соответствии с которой темп нарастания регистрирующих структур на чешуе и отолитах связан с темпом линейного роста рыб (Гончаров, 1981; Secor, Dean, 1985). Данное мнение, очевидно, справедливо, так как скорость обменных процессов и развития рыб как пойкилотермных животных неминуемо должна корректироваться температурой среды. Однако, исходя из полученных результатов (Каев, 2003; Thomas et al., 2019), можно полагать, что динамика закладки склеритов на чешуе лососевых рыб более консервативна, чем динамика соматического роста, и менее подвержена влиянию среды. Вследствие этого амплитуда изменения числа склеритов на чешуе рыб изученных поколений довольно мала (M = 36.3, SD = 2.43, n = 16 поколений). Даже у экстремальных по этому признаку поколений расхождение в темпе прироста склеритов на чешуе рыб составило лишь 0.32 склерита в месяц. Диссонансом могут выглядеть отдельные пробы с отличающимся числом склеритов на чешуе рыб по сравнению с другими пробами, собранными в этом же году, например, в 2016 г. Причиной отчасти послужила большая площадь дополнительной зоны суженных склеритов в зоне годового кольца. В то же время увеличение числа склеритов в ПГЗ не отразилось на профиле склеритограммы, судя по тому, что величина средних значений критерия F при сопоставлении межсклеритных расстояний на чешуе рыб этой пробы с таковыми других проб (от 0.90 до 1.12) не показала статистически достоверных различий, как и при их сравнении между остальными пробами (от 0.56 до 2.58). Тем самым подтверждено ранее сделанное заключение о более лабильном характере числа склеритов на чешуе по сравнению с профилем склеритограмм, отражающим реальные условия жизни горбуши конкретного поколения (Каев, 2015б). Это заключение вполне согласуется с результатами изучения кеты Oncorhynchus keta и нерки O. nerka, свидетельствующими о том, что межсклеритное расстояние является показателем скорости соматического роста лососей (Fukuwaka, 1998). Сходство числа склеритов в ПГЗ и ВГЗ на чешуе горбуши с разными сроками подхода к побережью вполне объясняется соответствием динамик покатной и нерестовой миграций в пределах одного поколения, т.е. рано скатившиеся из рек особи раньше возвращаются на нерест, и наоборот (Каев, 2003). Продолжительность морского периода жизни горбуши мало меняется у разных поколений, так как изменение сроков подхода к побережью основной массы рыб в большей мере связано с соотношением численности в нерестовой части популяции разных темпоральных форм, чем с продолжительностью их жизни в морских водах (Каев, 2015б).
Можно полагать, что профили склеритограмм чешуи горбуши хорошо отражают основные изменения в хронологии ее морского периода жизни. Первые 1.5–2.0 мес. мальки нагуливаются в прибрежных районах моря вблизи рек своего нереста. Освоение открытых вод Охотского моря начинается в конце июля и продолжается в августе, хотя в этом месяце основная часть молоди все еще находится в пределах внутреннего шельфа. Быстрое заселение молодью горбуши открытой эпипелагиали происходит в сентябре, но уже в конце этого месяца начинается ее постепенное смещение в южную глубоководную часть моря, где во второй половине осени сосредоточивается преобладающая часть сеголеток (Шунтов, Темных, 2008). Прибрежные зоны южной части Сахалина и южных Курильских островов находятся под воздействием вихревых образований теплого течения Соя, что, по-видимому, определяет большие приросты при формировании первых склеритов. Наличие последующего локального минимума связано, возможно, с миграцией молоди через относительно холодные воды Восточно-Сахалинского течения (Чернявский, 1981). По более поздним данным интенсивность этого течения в летний период сильно ослабевает (Пищальник и др., 2003), поэтому локальный минимум на склеритограммах чешуи у горбуши о-ва Итуруп выражен слабее (Каев, Животовский, 2017). У горбуши с западного побережья Камчатки аналогичный локальный минимум на склеритограммах чешуи не прослеживается (Темных, 1998), вследствие того, что водный режим вдоль этого побережья, как и в южно-центральной части Охотского моря, определяется притоком вод из океана через северные проливы Курильской гряды.
Основным районом летне-осеннего нагула сеголеток горбуши в Охотском море служит его глубоководная часть (Шунтов, Темных, 2008), где наблюдается самое большое количество макрозоопланктона на единицу биомассы нектона (Шунтов, 2001; Дулепова, 2002). При изобилии кормовой базы у ювенильных лососей с повышением температуры воды (в пределах оптимума) увеличивается уровень обмена и возрастает доля энергетических трат на рост, вследствие чего в сентябре–октябре наблюдаются наибольшие приросты их тела (Ерохин, Шершнева, 2007). Тем не менее и в этом весьма благоприятном для нагула районе у некоторых поколений отмечалось снижение темпа роста, что привело к пиковым величинам значений F при сопоставлении межсклеритных расстояний (рис. 5).
Поздней осенью начинается выход горбуши в океан в основном через проливы южной половины Курильской островной гряды. В это же время сильно замедляется ее линейный рост (Шунтов, Темных, 2008). Зимовальные скопления охотоморских стад горбуши занимают в северо-западной части Тихого океана огромную акваторию, главным образом вдоль Субарктического фронта с широким диапазоном температур, причем выраженного предпочтения более холодных или теплых водных масс не отмечено (Шунтов, Темных, 2011; Фигуркин, Найденко, 2013). Скопления годовиков горбуши были обнаружены даже в южной части Охотского моря в первой декаде марта 1990 г. и во второй половине января 1991 г. (Радченко и др., 1997). Судя по уловам зоопланктона и наполнению желудков, проблем с обеспеченностью пищей горбуши в зимних условиях не наблюдалось (Найденко, Темных, 2016). Существенное замедление роста рыб в это время связано не с дефицитом пищи, а с неминуемым замедлением обменных процессов в условиях низких температур. Следствием столь большой вариабельности как сроков перемещения из Охотского моря в Тихий океан, так и условий обитания в период зимовки, очевидно, было появление очередных пиковых величин рассчитанных значений F при сопоставлении межсклеритных расстояний на чешуе, формируемой у разных поколений горбуши при переходе от зимовки к летнему нагулу (рис. 5). Вероятно, с этим связана и диспропорция в соотношении числа склеритов в ПГЗ и ВГЗ как у разных поколений рыб, так и в пределах одного поколения. Более того, у некоторых рыб на чешуе отмечено как бы по два годовых кольца из двух–четырех склеритов, разделенных одним–двумя склеритами со значительно более широкими межсклеритными расстояниями.
Почти полное сходство склеритограмм чешуи рыб разного пола дает возможность увеличить объем выборок при изучении особенностей роста разных поколений горбуши. Небольшое расхождение в склеритограммах у рыб разного пола наблюдается лишь при завершении морского периода жизни, когда у самок быстрее снижается темп роста вследствие интенсивного полового созревания (рис. 4). Сопоставление склеритограмм показало, что они имеют весьма сходный профиль у рыб из разных проб, собранных в течение одного года, но существенно различаются у разных поколений горбуши. Как следствие, значения F при оценке разности межсклеритных расстояний в среднем составили в первом случае 1.95 (p > 0.05), а во втором – 29.89 (p < 0.001), что сопоставимо с таковыми у горбуши из разных районов воспроизводства (Каев, 2015а; Каев и др., 2020). Таким образом, профиль склеритограмм позволяет судить об особенностях нагула того или иного поколения горбуши. В то же время подобный уровень различий межсклеритных расстояний у рыб разных поколений исключает возможность использования структуры чешуи для выяснения происхождения горбуши в смешанных уловах в случаях, когда исследуемые и тестовые образцы чешуи собраны в разные годы.
В связи с установленными особенностями формирования склеритов на чешуе горбуши при обитании в морских водах становится понятным происхождение двух групп пиковых значений X2(k) при анализе степени нормальности распределений межсклеритных расстояний (рис. 3). В первом случае эти значения связаны с изменяющимся расположением годовой зоны суженных склеритов, в результате чего при одном и том же порядковом номере склерита у одних рыб происходит снижение межсклеритных расстояний, а у других особей уже начинается период быстрого роста. Последнее побудило перейти к нормированию числа склеритов в целом на чешуе, а не только в пределах ПГЗ, как это делали ранее для выявления различий в росте горбуши из разных территориальных группировок (Темных, 1998; Каев, 2015а). Во втором случае пиковые значения X2(k) обусловлены сначала разным темпом снижения приростов рыб при подходе к районам нереста, особенно у особей разного пола, а затем наличием диспропорции в размерах последнего склерита, формирование которого уже завершено или только начинается.
ЗАКЛЮЧЕНИЕ
На профилях склеритограмм чешуи горбуши хорошо отражаются особенности ее роста в соответствии с основными этапами морского периода жизни: заметное разнообразие межсклеритных расстояний в течение раннего морского периода; ускорение роста при откочевке в открытые морские воды с последующим замедлением при перемещении к районам зимовки в океане вплоть до появления минимальных межсклеритных расстояний; ускорение роста в ходе обратной миграции до достижения максимальных значений с последующим их снижением уже в морских водах, что связано, скорее всего, с интенсивным половым созреванием. До начала полового созревания профили склеритограмм самцов и самок сходны, что позволяет использовать единый массив данных при изучении роста рыб разного пола. Не выявлено существенных расхождений в склеритограммах рыб, пойманных в течение одного сезона, в то время как склеритограммы рыб, пойманных в разные годы, существенно различались, что позволяет выявить особенности роста горбуши разных поколений.
Список литературы
Бугаев А.В. Некоторые методические аспекты идентификации локальных стад тихоокеанских лососей рода Oncorhynchus по чешуйным критериям // Изв. ТИНРО. 2005. Т. 142. С. 104–112.
Бугаев А.В., Шапорев Р.А., Коваль М.В. и др. Распределение региональных комплексов азиатских стад кеты Oncorhynchus keta в период преднерестовых миграций в экономической зоне России // Изв. ТИНРО. 2012. Т. 171. С. 3–25.
Вялова Г.П., Иванова И.М., Стексова В.В., Омельченко В.Т. Горбуша Сахалино-Курильского региона: дифференциация и популяционный состав морских скоплений // Рыбохозяйственные исследования в Сахалино-Курильском районе и сопредельных акваториях. Южно-Сахалинск: Изд-во СахНИРО. 1999. Т. 2. С. 52–58.
Гончаров А.И. Особенности склеритной структуры чешуи одноразмерных рыб разного возраста // Тр. ИБВВ АН СССР. 1981. № 47/50. С. 116–123.
Дгебуадзе Ю.Ю., Чернова О.Ф. Чешуя костистых рыб как диагностическая и регистрирующая структура. М.: Товарищество науч. изд. КМК. 2009. 315 с.
Дулепова Е.П. Сравнительная биопродуктивность макроэкосистем дальневосточных морей. Владивосток: Изд-во ТИНРО-центра. 2002. 274 с.
Ерохин В.Г., Шершнева В.И. Динамика потребления и расходования энергии у молоди лососей в период посткатадромного нагула в Охотском и Беринговом морях // Изв. ТИНРО. 2007. Т. 150. С. 122–136.
Иванков В.Н., Добрицкий О.Ю., Скуба Н.С., Карпенко А.И. Дифференциация популяций горбуши Oncorhynchus gorbuscha южного Сахалина // Биол. моря. 1996. Т. 22. № 3. С. 167–173.
Каев А.М. Идентификация происхождения и истории жизни охотоморской кеты Oncorhynchus keta по чешуе // Вопр. ихтиологии. 1998. Т. 38. № 5. С. 650–658.
Каев А.М. Особенности воспроизводства кеты в связи с ее размерно-возрастной структурой. Южно-Сахалинск: Изд-во СахНИРО. 2003. 288 с.
Каев А.М. Ретроспективная оценка роста горбуши Oncorhynchus gorbuscha по чешуе: региональная изменчивость // Вопр. ихтиологии. 2015а. Т. 55. № 3. С. 298–312.
Каев А.М. Ретроспективная оценка роста горбуши Oncorhynchus gorbuscha по чешуе: межгодовая изменчивость // Вопр. ихтиологии. 2015б. Т. 55. № 5. С. 570–585.
Каев А.М., Животовский Л.А. О вероятном перераспределении горбуши Oncorhynchus gorbuscha между районами воспроизводства разных стад в Сахалино-Курильском регионе // Вопр. ихтиологии. 2017. Т. 57. № 3. С. 264–274.
Каев А.М., Пулькина А.А. К методике изучения количества и размера склеритов на чешуе горбуши // Изв. ТИНРО. 2016. Т. 185. С. 95–101.
Каев А.М., Ромасенко Л.В., Каев Д.А. Сравнительная характеристика роста чешуи у горбуши из возвратов на острова Сахалин (юго-восточное побережье) и Итуруп в 2017 и 2018 гг. // Изв. ТИНРО. 2020. Т. 200. Вып. 4. С. 809–818.
Найденко С.В., Темных О.С. Выживаемость тихоокеанских лососей в Северной Пацифике в зимне-весенний период // Изв. ТИНРО. 2016. Т. 185. С. 67–94.
Никольский Г.В. Теория динамики стада рыб. М.: Пищ. пром-сть. 1974. 448 с.
Пищальник В.М., Архипкин В.С., Юрасов Г.И., Ермоленко С.С. Сезонные вариации циркуляции вод в прибрежных районах Сахалина // Метеорология и гидрология. 2003. № 5. С. 87–95.
Плохинский Н.А. Биометрия. М.: Изд-во МГУ. 1970. 367 с.
Радченко В.И., Горбатенко К.М., Старцев А.В. и др. Особенности экологии тихоокеанских лососей, зимующих в южной части Охотского моря в 1990–1991 гг. // Комплексные исследования экосистемы Охотского моря. М.: Изд-во ВНИРО. 1997. С. 231–234.
Темных О.С. Региональная изменчивость склеритограмм чешуи азиатской горбуши // Изв. ТИНРО. 1998. Т. 124. С. 375–390.
Фигуркин А.Л., Найденко С.В. Пространственное распределение горбуши в зоне Субарктического фронта в зимне-весенний период // Изв. ТИНРО. 2013. Т. 174. С. 69–84.
Чернова О.Ф., Запорожец О.М., Дгебуадзе Ю.Ю. Сканирующая электронная микроскопия чешуи кеты Oncorhynchus keta (Salmonidae) // Вопр. ихтиологии. 2017. Т. 57. № 6. С. 743–749.
Чернявский В.И. Циркуляционные системы Охотского моря // Изв. ТИНРО. 1981. Т. 105. С. 13–19.
Шунтов В.П. Биология дальневосточных морей России. Владивосток: Изд-во ТИНРО-центра. 2001. Т. 1. 580 с.
Шунтов В.П., Темных О.С. Тихоокеанские лососи в морских и океанических экосистемах. Владивосток: Изд-во ТИНРО-центра. 2008. Т. 1. 481 с.
Шунтов В.П., Темных О.С. Тихоокеанские лососи в морских и океанических экосистемах. Владивосток: Изд-во ТИНРО-центра. 2011. Т. 2. 473 с.
Courtney D.L., Mortensen D.G., Orsi J.A. Digitized scale and otolith microstructures as correlates of juvenile pink salmon size // Recent Changes in Ocean Production of Pacific Salmon / North Pacific Anadromous Fish Commission Bulletin. Vancouver: NPAFC. 2000. № 2. P. 337–345.
Fukuwaka M. Scale and otolith patterns prove growth history of Pacific salmon // Assessment and Status of Pacific Rim Salmonid Stocks / North Pacific Anadromous Fish Commission Bulletin. Vancouver: NPAFC. 1998. № 1. P. 190–198.
Howard K.G., Murphy J.M., Wilson L.I. et al. Size-selective mortality of Chinook salmon in relation to body energy after the first summer in nearshore marine habitats // Pacific Salmon and Steelhead Production in a Changing Climate: Past, Present, and Future / North Pacific Anadromous Fish Commission Bulletin. Vancouver: NPAFC. 2016. № 6. P. 1–11.
Kaneto Y., Katayama S., Iida M. Age determination of Chum salmon using scales and otoliths // Nippon Suisan Gakkaishi. 2017. V. 83. № 5. P. 758–763 (In Japanese with English abstract).
McLellan S.E. Guide for sampling structures used in age determination of Pacific salmon. Nanaimo: Dept. Fish. Oceans, Fish. Res. Branch, Pac. Biol. Stn. 1987. 27 p.
Secor D.H., Dean J.M. Daily increment formation and growth of otoliths in larval striped bass (Morone saxatilis) // Estuaries. 1985. V. 8. № 2B. P. 31A.
Thomas K., Hansen T., Brophy D. et al. Experimental investigation of the effects of temperature and feeding regime on scale growth in Atlantic salmon Salmo salar post-smolts // J. Fish Biol. 2019. V. 94. № 6. P. 896–908.
Walker R.V., Myers K.W., Ito S. Growth studies from 1956-95 collections of pink and chum salmon scales in the central North Pacific Ocean // Assessment and Status of Pacific Rim Salmonid Stocks / North Pacific Anadromous Fish Commission Bulletin. Vancouver: NPAFC. 1998. № 1. P. 54–65.
Yasumiishi E.M., Farley E.V., Ruggerone G.T. et al. Trends and factors influencing the length, compensatory growth, and size-selective mortality of juvenile Bristol Bay, Alaska, sockeye salmon at sea // Mar. Coastal Fish.: Dyn., Manage. Ecosyst. Sci. 2016. V. 8. № 1. P. 315–333.
Дополнительные материалы отсутствуют.



