Биология моря, 2022, T. 48, № 2, стр. 90-100
Пространственное распределение и состав поселений двустворчатого моллюска Tetrarca boucardi (Jousseaume, 1894) (Arcidae) в заливе Восток Японского моря
Н. И. Селин *
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: nikselin@yandex.ru
Поступила в редакцию 26.02.2021
После доработки 01.04.2021
Принята к публикации 22.04.2021
- EDN: GKVBVC
- DOI: 10.31857/S0134347522020085
Аннотация
Исследование вертикального распределения двустворчатого моллюска Tetrarca boucardi (Jousseaume, 1894) в нескольких районах зал. Восток, в значительной мере характеризующих многообразие биотопов верхней сублиторали зал. Петра Великого Японского моря, показало, что в этой части ареала на глубине 0.5–10 м моллюск образует устойчивые регулярно пополняемые молодью многолетние поселения, время существования которых, по-видимому, многократно превышает индивидуальную продолжительность жизни животных. Максимальная длина раковины особей T. boucardi составляла 74 мм, возраст достигал 19 лет. Наиболее обильные скопления тетрарки Боукарда зарегистрированы в мелководных полузакрытых хорошо прогреваемых летом внутренних частях залива на глубине около 3 м, где биомасса моллюсков достигала 530 г/м2, или 36.7% от общей биомассы макрозообентоса. Впервые установлено, что благоприятными для данного вида являются также прибойные скальные рифы, где животные обитают на относительно защищенных от волнобоя участках преимущественно на глубине 0.5–1.5 м. Здесь их биомасса в среднем составляла 72.7 г/м2 (11.2%). Тетрарка Боукарда обычна и на мягких грунтах на глубине 1–10 м в друзах крупных двустворчатых моллюсков Modiolus kurilensis и Crenomytilus grayanus. В таком биотопе биомасса тетрарки Боукарда в среднем составляла 22.2 г/м2 (около 2%). Локальные различия обилия и состава поселения T. boucardi обсуждаются в связи с условиями обитания вида.
Двустворчатый моллюск Tetrarca boucardi (Jousseaume, 1894) – тихоокеанский приазиатский субтропическо-низкобореальный вид, распространенный от о-ва Тайвань почти до северной границы Приморского края (Закс, 1933; Разин, 1934; Скарлато, 1981; Lutaenko, 1999; Lutaenko, Noseworthy, 2012). Обычным местом обитания этого вида считается также япономорское и тихоокеанское прибрежье Японских островов, отмечен он и у о-ва Кунашир (Higo et al., 1999; Lutaenko, 1999; Okutani, 2000; Кантор, Сысоев, 2005). Севернее зал. Петра Великого вдоль материкового побережья России сколько-нибудь плотные скопления T. boucardi не зарегистрированы, встречаются лишь редкие единичные экземпляры или молодь, как и на Южно-Курильском мелководье и у о-ва Сахалин (Евсеев, Яковлев, 2006). В зал. Петра Великого Японского моря этот вид является одним из обычных элементов фауны мелководий бухт и заливов второго порядка (Скарлато и др., 1967; Погребов, Кашенко, 1976). В полузакрытых бухтах заливов Посьета и Восток тетрарка Боукарда является руководящей формой биоценоза Crenomytilus grayanus (Modiolus difficilis) + Tetrarca boucardi, образуя вместе с мидией Грея и/или модиолусом поселения на валунах и скалах. По-видимому, значительна роль этих моллюсков и в ряде других донных сообществ, где отмечены относительно высокие показатели их обилия (Голиков, Скарлато, 1967). Несмотря на частые находки и локальную высокую численность, популяционная биология T. boucardi почти не изучена. Большая часть исследований, в которых отмечен этот вид, касается биологии двустворчатых моллюсков в целом. Имеются фрагментарные сведения о встречаемости в планктоне и о морфологии личинок данного вида, об ультраструктуре сперматозоидов, устойчивости к изменению солености воды и о морфофункциональных особенностях пищеварительной железы (Бергер и др., 1982; Куликова и др., 1987; Токмакова и др., 2006; Дроздов и др., 2009). В связи с этим цели настоящего исследования – изучение современной картины пространственного распределения T. boucardi в зал. Петра Великого Японского моря, а также анализ размерного и возрастного состава локальных скоплений, отражающих особенности воспроизводства популяции моллюсков в данной части ареала.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили в апреле 2020 г. в зал. Восток (зал. Петра Великого Японского моря; 42°53′ с.ш., 132°45′ в.д.) (рис. 1). Литературные данные (Погребов, Кашенко, 1976) и результаты наших многолетних наблюдений за распределением донной фауны этой акватории показали, что Tetrarca boucardi встречается единично почти на всех твердых грунтах, но скопления образует лишь в нескольких местах. В соответствии с этим пространственное распределение моллюсков анализировали на трех обширных полигонах, различающихся условиями среды. Полигон 1 представлял собой пологое (уклон в среднем около 2°) заиленное дно в бухточке Тихая Заводь, характерное для мелководной кутовой части залива, защищенной от сильных ветров и волн открытой части моря. Полигон 2, располагавшийся вблизи пирса биостанции Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН, имел бóльший, чем в первом случае, уклон дна (в среднем около 7°) и характеризовался более активной гидродинамикой, обусловленной в штормовую погоду волнами, отраженными от противоположного берега залива. Полигон 3 – это один из скальных рифов залива, подверженных периодическому значительному воздействию волн особенно во время прохождения летне-осенних циклонов. В работе использовали трансекту, которую располагали от уреза воды и до максимальной глубины распространения T. boucardi. На полигоне 1 были выполнены три трансекты, на полигоне 2 – две; расстояние между трансектами составляло 100 м. На полигоне 3 выполнены две протяженные (около 150 м) трансекты, пересекавшие риф вдоль и поперек. Вдоль трансект были визуально намечены выделы – однотипные по характеру грунта и населению участки дна (Лукин, Фадеев, 1982), в пределах которых случайным образом в 30-ти учетных рамках площадью 1 м2 подсчитали численность тетрарки и сопутствующих крупных эпибентосных форм макрозообентоса (далее – зообентос). Эти сведения служили основой для расчета средних величин плотности поселения моллюсков и других животных. Для характеристики размерного и возрастного состава T. boucardi и корректировки данных по обилию мелких форм зообентоса на каждой станции из 5–8 рамок площадью 1.0 и 0.01 м2 отбирали всех животных. Штангенциркулем с точностью до 1 мм измеряли длину раковины и оценивали прижизненную массу тела каждой особи T. boucardi, удалив эпибионтов. У других животных оценивали среднюю массу тела, взвесив 30–50 случайно взятых особей. Измерения длины раковины T. boucardi использовали для анализа размерного состава моллюсков из разных мест обитания, а данные по массе тела животных – для расчета биомассы. Индивидуальный возраст тетрарки Боукарда оценивали по меткам на наружной поверхности раковины и на ее поперечном спиле. В большинстве случаев эти метки хорошо различимы визуально и формируются с годовой периодичностью (Золотарев, 1976, 1989).
Рис. 1.
Карта-схема района работ в зал. Восток. 1–3 – расположение полигонов и скоплений Tetrarca boucardi.

Статистическая обработка данных выполнена на ПК с использованием пакета программ SPSS 17. При сравнении размерного и возрастного состава моллюсков на трех полигонах дна применен непараметрический критерий Крускала–Уоллиса. Апостериорные сравнения выполнены с помощью критерия Манна–Уитни при скорректированном уровне статистической значимости р' < 0.05.
РЕЗУЛЬТАТЫ
Пространственное распределение
По характеру биотопа и обилию населения в районе полигона 1 условно можно выделить три зоны. От береговой линии на 3–37 м до глубины около 1 м простирался крупный песок с включениями гальки, гравия, ракуши и макроводорослями Sargassum sp. Население составляли раки-отшельники и немногочисленные (менее 1 экз. на 5 м2) брюхоногие моллюски Littorina spp., Tegula rustica, Boreotrophon candelabrum и Cryptonatica janthostoma. На обширной площади отмечены лишь 4 особи Tetrarca boucardi, прикрепившиеся биссусом к предметам антропогенного происхождения. Биомасса зообентоса в среднем составляла 2.3 г/м2.
На глубине 1–3 м отмечен пояс морской травы Zostera, встречались валуны разного размера, местами в виде нагромождения и в той или иной мере выраженного небольшого свала. Биомасса зообентоса в среднем составляла 1424.7 г/м2. Это место наибольшего скопления T. boucardi в кутовой части залива с плотностью поселения 83.1 ± ± 62.0 экз/м2 (максимальная величина – 219 экз/м2) и биомассой 522.9 ± 397.8 г/м2 (максимальная – 1381.8 г/м2), что составило 36.7% от общей биомассы зообентоса. Обычно моллюски образовывали плотные скопления-щетки, обрастая одним слоем верхнюю и боковую поверхности нескольких соседних валунов (рис. 2а). Иногда в такое скопление были вкраплены несколько крупных особей Modiolus kurilensis, но чаще модиолусы располагались между валунами, в большей или меньшей степени погрузившись в гравий и мелкообломочный осадок, местами сильно заиленный. Это второй по биомассе вид животных на данном участке дна (198.2 г/м2); плотность поселения модиолуса была значительно ниже, чем у арки (2.2 ± 2.0 экз/м2), и сопоставима с таковой столь же обычных, но более мелких раков-отшельников Pagurus spp. (9.9 ± 9.0 экз/м2), брюхоногих моллюсков T. rustica (5.7 ± 4.5 экз/м2) и B. candelabrum (2.1 ± 2.0 экз/м2), морской звезды Patiria pectinifera (4.5 ± 3.8 экз/м2), серого морского ежа Strongylocentrotus intermedius (3.9 ± 3.4 экз/м2) и многощетинковых червей из семейства Serpulidae. Значительно реже (1 экз. на 2–10 м2) встречались черный морской еж Mesocentrotus nudus, дальневосточный трепанг Apostichopus japonicus, асцидия Styela clava, моллюски Azumapecten farreri, Crenomytilus grayanus и Mitrella burchardi, а также водорослевой краб Pugettia quadridens. Плотность поселения других беспозвоночных животных (губки, мшанки, десятиногие раки, асцидии и др.) не превышала 0.1 экз/м2 (колония/м2). Протяженность этой зоны валунов вдоль трансект варьировала от 5 до 84 м.
Рис. 2.
Внешний вид поселений двустворчатого моллюска Tetrarca boucardi в разных биотопах. а, б – полигон 1, кутовая часть залива, валуны, илистый песок; в, г – полигон 2, район биостанции, илистый песок; д, е – полигон 3, скальный прибойный риф (часть филлоспадикса удалена).

Мористее валунного свала до максимальной глубины (около 6 м) уклон дна уменьшался, валуны становились все более редкими, на заиленном песке были обычны смешанные друзы мидии Грея и модиолуса (рис. 2б). Биомасса зообентоса составляла 881.3 г/м2. Плотность поселения тетрарки Боукарда, встречавшейся в этой зоне на валунах и в меньшей степени в друзах моллюсков митилид, была в несколько раз ниже, чем на глубине 1–3 м (средняя – 8.1 ± 7.9 экз/м2, максимальная – 45 экз/м2). Биомасса составляла 51.1 ± 49.8 г/м2 (максимальная – 283.5 г/м2), или 5.8% от общей биомассы зообентоса. Обилие тетрарки Боукарда уступало таковому крупной и наиболее массовой в данной зоне мидии Грея, для которой эти показатели составляли в среднем 18.0 ± 14.3 экз/м2 и 535.0 ± 499.7 г/м2 соответственно. Плотность поселения модиолуса не превышала 3.1 ± 3.0 экз/м2, а биомасса – 274.2 ± 244.4 г/м2. Из состава населения исчез осьминог Enteroctopus dofleini, на заиленном песке между друзами встречался приморский гребешок Mizuhopecten yessoensis (1 экз. на 10 м2). Средняя плотность поселения T. boucardi в этой части залива в целом составляла около 30 экз/м2; биомасса достигала 190.3 г/м2, или около 14.3% от общей биомассы зообентоса (рис. 3).
Рис. 3.
Доля Tetrarca boucardi в сообществе зообентоса в районе полигонов 1, 2 и 3. Столбики – средняя биомасса зообентоса, г/м2; линия – биомасса T. boucardi, % от средней биомассы зообентоса.

В районе полигона 2 уклон дна был значительнее, а максимальная глубина больше, чем в близлежащей кутовой части залива. Каменисто-валунная гряда отсутствовала, грунт был представлен довольно однообразным заиленным песком с включением мелкой гальки и ракуши. Поэтому условно в районе полигона 2 можно выделить лишь две вертикальные зоны. На расстоянии почти на 15–20 м от берега до глубины около 1 м население состояло из многочисленных особей норного рака Upogebia issaeffi, морской звезды патирии, раков-отшельников, брюхоногих моллюсков натики, литорин, единичных особей тегулы и мелких крабиков. Тетрарка Боукарда здесь не встречалась; биомасса зообентоса составляла 5.7 г/м2.
Другая зона располагалась ниже вплоть до максимальной глубины 9–10 м. Основой населения являлись крупные моллюски-митилиды, серый и черный правильные морские ежи и некоторые другие формы. Биомасса зообентоса в среднем составляла 1167.1 г/м2. У верхней границы этой протяженной зоны отмечены единичные особи и небольшие друзы модиолуса из 2–3 взрослых моллюсков, к которым были прикреплены столь же немногочисленные особи T. boucardi (рис. 2в). С увеличением глубины заиление грунта постепенно возрастало, в составе друз модиолуса появлялась мидия Грея, доля которой постепенно увеличивалась, так же как увеличивались размер и встречаемость агрегаций (рис. 2г). Вместе с тем росла численность и T. boucardi, но лишь до глубины 3.0–3.5 м, на большей глубине она вновь снижалась. Так, на глубине 1.0–1.5 м плотность поселения T. boucardi составляла около 2 экз. на 5 м2, на глубине 3–4 м – 5.0 ± 4.8 экз/м2, на глубине 6 м – 1 экз. на 2 м2, а на глубине 9–10 м, где проходила внешняя граница распространения друз митилид и отсутствовал твердый субстрат, необходимый для прикрепления тетрарки, была отмечена только ее молодь прошлого года оседания. Биомасса тетрарки составляла соответственно 4.1, 50.6, 5.1 и около 0.5 г/м2. Средние величины плотности поселения и биомассы этого вида составляли соответственно 2.2 экз/м2 и 22.2 г/м2, что на фоне обилия других животных в данной части залива выглядит довольно скромно: 1.9% от общей биомассы зообентоса (рис. 3). Наиболее массово были представлены модиолус (8.3 ± 7.7 экз/м2 и 497.0 ± 459.3 г/м2), серый морской еж (1.2 экз/м2 и 35.3 г/м2) и мидия Грея (около 2 экз/м2 и 40 г/м2). Повсеместно были отмечены раки-отшельники и морская звезда патирия (1–2 экз/м2), однако их биомасса, как правило, не превышала 1.4–8.4 г/м2. Биомасса брюхоногих моллюсков, ракообразных, многощетинковых червей и других мелких организмов была меньше 1.0 г/м2.
Полигон 3 представлял собой каменистую гряду из подводных и выступающих на поверхность небольших скал и системы промоин, глубина которых по мере продвижения от мористой приглубой оконечности рифа к берегу постепенно уменьшалась. Население протяженной мелководной рифовой платформы и склона рифа различалось по составу и обилию, поэтому здесь условно можно было выделить две зоны обитания T. boucardi. В первой зоне (рис. 2д), распространявшейся от нижней границы литорали до глубины 50–70 см, биомасса зообентоса в среднем составляла 105.6 г/м2. Наиболее высокой плотности поселения (до 350 экз/м2) достигали мелкие седентарные полихеты семейства Serpulidae, известковые трубочки которых почти сплошь покрывали скалы, свободные от проростков бурой водоросли Sargassum sp. Их биомасса составляла 21.3 ± 19.7 г/м2. Повсеместно на открытых скалах и в расщелинах встречались литорины (плотность поселения 93.8 ± ± 79.7 экз/м2, биомасса – 17.8 ± 11.9 г/м2). Многочисленным здесь был усоногий рак Chthamalus dalli, однако его биомасса, как и ряда других мелких животных, была сравнительно низкой. По этому показателю доминировали модиолусы (31.2 ± 29.0 г/м2) с плотностью поселения около 1 экз/м2. Тетрарка Боукарда, как и модиолусы, обычно селится в небольших промоинах, используя для прикрепления шероховатости скального субстрата. Плотность поселения данного вида здесь была выше, чем модиолусов (5.5 ± 4.5 экз/м2), а биомасса ниже (28.7 ± 22.8 г/м2).
За этой зоной в местах, защищенных от прямого воздействия волн, на скалах по периметру рифа на его гребне, склоне и в наиболее глубоких промоинах до 1.0–1.5 м произрастали кусты морской травы Phyllospadix iwatensis. К ней была приурочена обильная макрофауна, биомасса которой в среднем составляла 1188.8 г/м2. Среди населения преобладали модиолусы с биомассой 460.1 ± ± 369.6 г/м2 и плотностью поселения 7.0 ± 6.6 экз/м2. Значительной здесь была биомасса серого морского ежа S. intermedius (224.2 ± 198.0 г/м2) и двустворчатого моллюска Mytilisepta keenae (132.3 ± ± 129.7 г/м2). Обильно была представлена и T. boucardi (рис. 2е; 3), максимальная плотность которой в ряде случаев превышала 100 экз/м2, а биомасса достигала 597.0 г/м2 (в среднем 116.7 ± 117.6 г/м2). В относительно защищенных местах встречались единичные особи мидии Грея, черного морского ежа M. nudus и колонии губки Halichondria sp. Другие животные (брюхоногие моллюски, хитоны, полихеты, актинии и ракообразные), хотя и были довольно обычными, но в сумме составляли сравнительно небольшую долю от общей биомассы сообщества (9.1%; около 109 г/м2) (рис. 3). Глубже пояса филлоспадикса скалы, распространявшиеся в сторону моря в виде ниспадающих гребней и промоин, как и несколько более защищенные от прямых волн глыбы боковых сторон рифа, были почти лишены макробентоса. С глубины 4–5 м встречались единичные особи мидии Грея и баланусы. T. boucardi отмечена в виде немногочисленной молоди лишь в агрегациях митилид у основания склона на глубине 10–12 м.
Размерный состав поселений
В районе полигона 1 в кутовой части залива зарегистрированы особи T. boucardi с длиной раковины от 11 до 60 мм (рис. 4). Моллюски размером менее 30 мм были довольно немногочисленны (около 17%), наиболее обильно были представлены особи с длиной раковины 41–44 мм (более 22%). В размерно-частотном распределении наблюдался сдвиг в сторону преобладания относительно крупных животных.
Рис. 4.
Размерный (слева) и возрастной (справа) состав поселений Tetrarca boucardi в районе полигонов 1, 2 и 3.
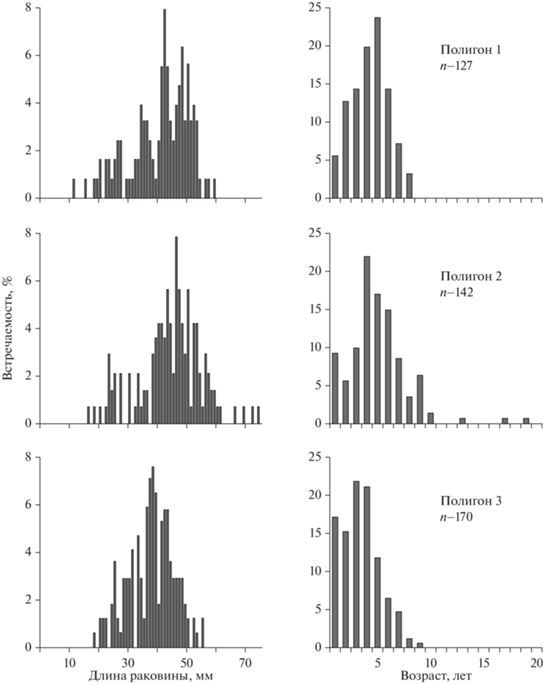
В районе полигона 2 были зарегистрированы особи T. boucardi более широкого размерного диапазона с длиной раковины от 16 до 74 мм. В размерно-частотном распределении условно можно выделить две группы особей с длиной раковины менее 30 мм и от 30 до 60 мм. Почти 4% населения составляли моллюски с длиной раковины более 60 мм.
На прибойном скальном рифе полигона 3 население T. boucardi было представлено особями с длиной раковины от 18 до 55 мм. Размерно-частотное распределение одномодальное, по численности преобладали (около 30%) моллюски размером 36–38 мм.
При множественном сравнении выборок моллюсков из разных районов залива с использованием критерия Крускала–Уоллиса зарегистрировано значимое различие их размерного состава (Р < 0.05).
Возрастной состав поселений
В районе полигона 1 население T. boucardi было представлено особями от одного года до восьми лет (рис. 4). По численности заметно преобладали (43.3%) моллюски четырех и пяти лет. На полигоне 2 зарегистрированы особи от одного года до 19 лет. Основную часть населения (97.9%) представляли 1–10-летние моллюски. Пик численности (53.5%) формировали моллюски от четырех до шести лет. На полигоне 3 население T. boucardi было представлено особями в возрасте от одного года до девяти лет. Основную часть поселения (75.3%) составляли 1–4-летние моллюски.
При сравнении выборок моллюсков из разных частей залива зарегистрировано значимое (парный критерий Манна–Уитни; Р < 0.05) отличие возрастного состава T. boucardi в районе полигона 3 от такового на полигонах 1 и 2, для которых различие носило случайный характер (Р = 0.051).
ОБСУЖДЕНИЕ
Пространственное распределение донных организмов определяется комплексом факторов среды, среди которых важное значение имеют температура, характер грунта и гидродинамическая активность. Тесную связь распределения гидробионтов с их термопатией демонстрируют многочисленные натурные и экспериментальные свидетельства, полученные на разном уровне организации живых систем (см., например: Жирмунский, 1969; Zhirmunsky, 1973; Скарлато, 1981). В многолетнем аспекте температура является довольно консервативным фактором среды для каждой из географических локальностей. Поэтому не удивительно, что в настоящее время в распределении Tetrarca boucardi наблюдаются характерные черты, отмеченные 50–60 лет назад при исследовании состава, структуры и распределения донных биоценозов в прибрежных водах зал. Петра Великого (Скарлато и др., 1967): теплолюбивый вид образует наиболее плотные поселения в хорошо прогреваемых кутовых частях мелководных бухт и заливов. Было установлено, что в зал. Посьета в полузакрытых бухтах на сравнительно небольшой глубине 1.5–3.0 м преимущественно на твердых грунтах тетрарка Боукарда являлась руководящей формой и образовывала мощные поселения с биомассой до 1.2 кг/м2 (Голиков, Скарлато, 1967; Скарлато и др., 1967; Скарлато, 1981). Смешанное поселение моллюсков, в котором T. boucardi являлась руководящей формой, известно и для кутовой части зал. Восток (полигон 1), где верхние слои воды летом прогреваются до 23–25°С (Степанов, 1976). Биомасса тетрарки здесь достигала почти 1.5 кг/м2 (Погребов, Кашенко, 1976). Нами также отмечено это давнее поселение, хотя и с несколько меньшей биомассой моллюсков.
Результаты проведенного исследования показали, что глубже 3.0–3.5 м численность тетрарки Боукарда постепенно снижалась. Особенно отчетливо это было видно в районе полигона 2, характеризующегося относительной неизменностью биотопа, стабильной соленостью воды, отсутствием волнового воздействия и обилием крупных митилид – субстрата, потенциально пригодного для прикрепления этого моллюска (Селин, 2018). Заметно изменяются с глубиной температурные условия. На глубине около 5 м наблюдается термоклин, в результате которого температура воды, например, в июле–августе на 2–4°С ниже, чем у поверхности, – 16–18°С (Степанов, 1976; личные многолетние наблюдения). Здесь и вплоть до глубины 10 м наиболее благоприятная для жизнедеятельности тетрарки Боукарда температура, сравнимая с поверхностной, наблюдается в течение очень непродолжительного периода, поскольку уже в конце августа – начале сентября происходит перемешивание воды и образуется гомотермический слой. С дальнейшим увеличением глубины и, соответственно, со снижением температуры воды к изобате 20 м до 12–13°С численность тетрарки Боукарда уменьшается еще стремительнее, и ее находки в защищенных от волнобоя районах зал. Петра Великого на глубине более 10 м довольно немногочисленны и скудны, хотя не исключено, что в значительной мере это связано с возрастающим дефицитом благоприятного субстрата.
У открытых морских побережий и прибойных скальных участков численность тетрарки Боукарда низкая, обычно встречаются единичные особи и молодь (Скарлато и др., 1967; настоящее исследование). Вместе с тем нами обнаружены поселения этого вида на риффлете скальных рифов от нижней границы литорали до глубины 1.5 м. Возрастной состав и относительно высокая доля молоди в районе полигона 3 (рис. 4б) свидетельствуют о регулярном пополнении населения спатом и его высокой выживаемости. Это обусловлено тем, что вода на мелководье рифа в значительной мере ограждена поясом морской травы Phyllospadix iwatensis от активного перемешивания с прилежащей открытой частью залива и в весенне-летнее время в сублиторальных и литоральных ванночках и промоинах прогревается быстрее и значительнее, чем в других местах обитания тетрарки. Кроме этого, филлоспадикс, под пологом зарослей которого в переплетении корней концентрируется молодь моллюсков, по-видимому, защищает ее от выедания хищниками, как, например, сеть биссусных нитей мидии Грея и щетинки периостракума модиолусов способствуют выживанию их молоди (Свешников, 1977; Селин, 2018).
Согласно классификации биономических типов сублиторали (Лукин, Фадеев, 1982), обследованный риф относится к побережью третьей степени прибойности, т.е. умеренно защищенному. Летом и осенью в штормовую погоду во время подхода с юга и юго-запада циклонов население рифа испытывает повышенное гидродинамическое воздействие. В отдельные годы наблюдаются особенно сильные тайфуны. В этом случае большие волны с силой ударяются о фронтальную часть рифа, накрывают риф и стремительно распространяются над рифовой платформой, смывая животных и растения, вымывая из промоин и трещин мелкообломочный осадок, а вместе с ним и многих его обитателей. После шторма в береговых выбросах наряду с другими эпи- и инфаунальными животными обычны многочисленные одиночные особи T. boucardi и сростки из нескольких особей, к которым крепится пучок морской травы P. iwatensis, с помощью которого моллюски могут разноситься течением на большое расстояние. Это свидетельствует о том, что численность и продолжительность жизни тетрарки Боукарда в поселении на скальном рифе существенно зависят от частоты и силы волнового воздействия в штормовую погоду. Максимальный возраст тетрарки из этого поселения составил 8 лет, что значительно меньше отмеченной ранее продолжительности жизни моллюсков данного вида – 20 лет (Золотарев, 1980).
Сравнительно низкая продолжительность жизни тетрарки Боукарда (9 лет) и в районе полигона 1, что значительно меньше времени существования этого поселения. Поселение расположено в хорошо прогреваемой и закрытой от волнового воздействия кутовой части залива, что обеспечивает его регулярное, хотя и менее обильное, чем на прибойном рифе, пополнение молодью. Поселение характеризуется очень высокой скученностью моллюсков на камнях в пределах отдельных скоплений-щеток, не зарегистрированной в каком-либо другом месте. Здесь их численность и продолжительность жизни в значительной мере определяются факторами, зависящими от плотности поселения. Достаточно отметить, что большинство моллюсков старше трех лет имеют почти сквозные повреждения раковины, возникшие от постоянного механического стачивания створок в местах соприкосновения с соседними особями. Разрушению кальцитовой раковины также способствует слабокислотная среда, обычно характерная для подобных мелководных заиленных участков с высоким содержанием гуминовых соединений (Даувальтер, 2006).
В районе полигона 2 отсутствуют твердые грунты (скалы, валуны), характерные для станций 1 и 3. Для оседания, закрепления с помощью биссуса на субстрате и последующей жизнедеятельности молодь тетрарки Боукарда использует единственную относительно устойчивую поверхность – раковины модиолусов и мидии Грея. На начальном этапе жизни этот субстрат является благоприятным для тетрарки. Щетинистые выросты периостракума, сплошь покрывающие раковину относительно молодых модиолусов и присутствующие в области макушек у старых, защищают концентрирующуюся среди них молодь разных животных от выедания рыбой, ракообразными и другими хищниками (Селин, 2018). По мере роста тетрарке Боукарда требуется все бóльшая площадь для прикрепления биссуса, который у этого вида представляет собой монолитный массивный тяж, в отличие от многочисленных тонких ниточек биссуса митилид, заканчивающихся крохотной подошвой-диском (Иванов, Стрелков, 1949; Скарлато, 1981; Price, 1983; Вехова, 2007; Селин, 2021). Участки раковины модиолусов, покрытые щетинками, оказываются непригодными для прикрепления взрослеющих моллюсков, а свободные участки старых особей часто бывают заняты другими организмами или в какой-то степени погружены в осадок (Селин, 2011, 2018). Некоторые подрастающие моллюски отбрасывают биссус и переползают в иное место в поисках благоприятных условий, а другие погибают. В целом, несмотря на высокую плотность поселения модиолусов и мидии Грея, площадь субстрата, благоприятного для прикрепления тетрарки, здесь весьма ограничена, что является фактором, снижающим ее численность. Наряду с этим сравнительно низкая плотность поселения T. boucardi в условиях отсутствия неблагоприятного волнового воздействия способствует тому, что в данном биотопе моллюски имеют неповрежденную раковину, достигают больших размеров тела и продолжительность их жизни здесь почти в 2 раза выше, чем в других местах обитания.
Таким образом, результаты проведенного исследования свидетельствуют о том, что в зал. Петра Великого Японского моря T. boucardi обитает не только в местах, защищенных от воздействия волн, но и у относительно открытых прибойных побережий. Моллюски образуют устойчивые регулярно пополняемые молодью многолетние поселения и являются доминирующим, руководящим или просто банальным видом донного населения, составляющим от 2 до 26% от суммарной биомассы сопутствующего зообентоса. Наиболее обильные поселения T. boucardi приурочены к твердым грунтам, обеспечивающим прочное биссусное прикрепление. На мягких грунтах моллюски встречаются, когда спат находит достаточно устойчивый субстрат в виде друз мидий и модиолусов, предметов антропогенного происхождения, возвышающихся над осадком, либо в случае заноса моллюсков, смытых со скал и валунов в штормовую погоду. Возможно также расселение тетрарки Боукарда и ранней весной с уносимыми от мелководья льдинами и вмерзшими в них растениями и животными. В зал. Петра Великого массовые скопления моллюски образуют на глубине до 3–4 м, но встречаются и на глубине до 20 м. В прибрежных водах Японии на глубине 140–200 м и у о-ва Монерон недалеко от юго-западного побережья о-ва Сахалин на глубине 40–80 м обнаружены лишь молодые однолетние особи и пустые раковины тетрарки (Ромейко, Каменев, 1985; Lutaenko, 1999). По-видимому, здесь отсутствуют условия, пригодные для формирования устойчивых многовозрастных поселений этих моллюсков.
Список литературы
Бергер В.Я., Ярославцева Л.М., Ярославцев П.В. Устойчивость к опреснению и эффективность изолирующей реакции некоторых моллюсков Японского моря // Биол. моря. 1982. № 2. С. 24–28.
Вехова Е.Е. Сравнительная морфология биссусных нитей трех представителей семейства Mytilidae (Bivalvia) из Японского моря // Зоол. журн. 2007. Т. 86. № 2. С. 154–162.
Голиков А.Н., Скарлато О.А. Моллюски залива Посьет (Японское море) и их экология // Тр. ЗИН АН СССР. 1967. Т. 42. С. 5–152.
Даувальтер В.А. Исследование физического и химического состава донных отложений при оценке экологического состояния водоемов: учеб. пособие. Мурманск: Изд-во МГТУ. 2006. 84 с.
Дроздов А.Л., Шарина С.Н., Тюрин С.А. Ультраструктура сперматозоидов у представителей шести семейств двустворчатых моллюсков из залива Петра Великого Японского моря // Биол. моря. 2009. Т. 35. № 3. С. 205–211.
Евсеев Г.А., Яковлев Ю.М. Двустворчатые моллюски дальневосточных морей. Владивосток: ПК Поликон. 2006. 120 с.
Жирмунский А.В. Сравнительное исследование теплоустойчивости клеток моллюсков Белого моря в связи с вертикальным распределением видов и историей формирования фауны // Журн. общ. биол. 1969. Т. 30. № 6. С. 686–703.
Закс И.Г. Морские беспозвоночные Дальнего Востока. М.; Хабаровск: Дальневост. краевое изд-во. 1933. 116 с.
Золотарев В.Н. Строение раковин двустворчатых моллюсков залива Восток Японского моря // Биол. исслед. зал. Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 99–121.
Золотарев В.Н. Продолжительность жизни двустворчатых моллюсков Японского и Охотского морей // Биол. моря. 1980. № 6. С. 3–12.
Золотарев В.Н. Склерохронология морских двустворчатых моллюсков. Киев: Наукова думка. 1989. 112 с.
Иванов А.В., Стрелков А.А. Промысловые беспозвоночные дальневосточных морей. Описание строения и атлас анатомии. Владивосток: Приморское краевое изд-во. 1949. 104 с.
Кантор Ю.И., Сысоев А.В. Каталог моллюсков России и сопредельных стран. М.: Товарищество науч. изд. КМК. 2005. 627 с.
Куликова В.А., Калашникова С.А., Айздайчер Н.А. Развитие и морфология личинок Arca boucardi (Mytilida, Arcidae), полученных в культуре // Зоол. журн. 1987. Т. 66. Вып. 5. С. 770–773.
Лукин В.И., Фадеев В.И. Особенности планирования гидробиологических работ на акваториях большой протяженности // Подводные гидробиологические исследования. Владивосток: ДВНЦ АН СССР. 1982. С. 13–20.
Погребов В.Б., Кашенко В.П. Донные сообщества твердых грунтов залива Восток Японского моря // Биол. исслед. зал. Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 63–82.
Разин А.И. Морские промысловые моллюски южного Приморья // Изв. ТИНРО. 1934. Т. 8. 100 с.
Ромейко Л.В., Каменев Г.М. Двустворчатые моллюски сублиторальной зоны острова Монерон // Бентос шельфа острова Монерон. Владивосток: ДВНЦ АН СССР. 1985. С. 85–101.
Селин Н.И. Использование фотометода в исследованиях состава и обилия гидробионтов, обитающих на мягких грунтах // Биол. моря. 2011. Т. 37. № 3. С. 222–228.
Селин Н.И. Состав и структура смешанных поселений Crenomytilus grayanus (Dunker, 1853) и Modiolus kurilensis (Bernard, 1983) (Bivalvia: Mytilidae) в заливе Петра Великого Японского моря // Биол. моря. 2018. Т. 44. № 5. С. 307–316.
Селин Н.И. Морфология биссуса и прочность прикрепления к субстрату двустворчатого моллюска Arca boucardi Jousseaume, 1894 (Arcidae) // Биол. моря. 2021. Т. 47. № 5. С. 355–358.
Свешников В.А. Структура жизненного цикла дальневосточной мидии Crenomytilus grayanus (Dunker) // Докл. АН СССР. 1977. Т. 236. № 4. С. 1028–1031.
Скарлато О.А. Двустворчатые моллюски умеренных широт западной части Тихого океана. Л.: Наука. 1981. 479 с.
Скарлато О.А., Голиков А.Н., Василенко С.В. и др. Состав, структура и распределение донных биоценозов в прибрежных водах залива Посьет (Японское море) // Исслед. фауны морей. 1967. Т. 5(13). С. 5–61.
Степанов В.В. Характеристика температуры и солености вод залива Восток Японского моря // Биол. исслед. зал. Восток. Владивосток: ДВНЦ АН СССР. 1976. С. 12–22.
Токмакова Н.П., Галимулина Н.А., Анисимов А.П. Морфофункциональная характеристика и уровни плоидности клеток пищеварительной железы двустворчатых моллюсков в связи с проблемой соматической полиплоидии // Биол. моря. 2006. Т. 32. № 4. С. 270–276.
Higo S., Callomon P., Goto Y. Catalogue and bibliography of the marine shell-bearing Mollusca of Japan: Gastropoda, Bivalvia, Polyplacophora, Scaphopoda. Elle Sci. Publ. 1999. 748 p.
Lutaenko K.A. Additional data on the fauna of bivalve mollusks of the Russian continental coast of the Sea of Japan: Middle Primorye and Nakhodka Bay // Publ. Seto Mar. Bioi. Lab. 1999. V. 38. № 5–6. P. 255–286.
Lutaenko K.A., Noseworthy R.G. Catalogue of the living Bivalvia of the continental coast of the Sea of Japan (East Sea). Vladivostok: Dalnauka. 2012. 247 p.
Okutani T. Marine mollusks in Japan. Tokyo: Tokai Univ. Press. 2000. 1174 p.
Price H.A. Structure and formation of the byssus complex in Mytilus (Mollusca, Bivalvia) // J. Molluscan Stud. 1983. V. 49. P. 9–17.
Zhirmunsky A.V. Vertical distribution and cellular heat resistance of bottom animals from the Possyet Bay (Japan Sea) // Helgol. Wiss. Meeresunters. 1973. V. 24. P. 247–255.
Дополнительные материалы отсутствуют.


