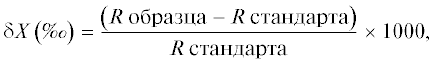Биология моря, 2022, T. 48, № 3, стр. 160-170
Трофические отношения симпатрических видов рыб родов Opisthocentrus и Pholidapus (Perciformes: Opisthocentridae) в Японском море
О. А. Рутенко 1, 2, *, В. Н. Иванков 1, С. И. Кияшко 2, Н. А. Некрасова 1
1 Лаборатория экологии и эволюционной биологии водных организмов, Институт Мирового океана,
Дальневосточный федеральный университет
690922 Владивосток, Россия
2 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
690041 Владивосток, Россия
* E-mail: orutenko@gmail.com
Поступила в редакцию 09.03.2021
После доработки 11.12.2021
Принята к публикации 27.01.2022
- EDN: AJFLDP
- DOI: 10.31857/S013434752203007X
Аннотация
Определены трофические отношения четырех видов опистоцентровых рыб (Perciformes: Opisthocentridae): Opisthocentrus ocellatus, O. tenuis, O. zonope и Pholidapus dybowskii по результатам исследования содержимого желудков и анализа соотношений стабильных изотопов азота (δ15N) и углерода (δ13С) в мягких тканях. Средние значения соотношений изотопов углерода варьировали от –20.04 ± 0.95 до ‒15.44 ± 0.98, что свидетельствует о широком спектре первичных источников углерода. Наибольшие средние значения показателей азота (10.71 ± 0.55) и максимальная площадь изотопной ниши обнаружены у Ph. dybowskii. Основным объектом питания всех изученных видов рыб являются амфиподы, что подтверждено высокой вероятностью пересечения изотопных ниш. Разделение трофических ниш обусловлено избирательным потреблением отдельных видов амфипод, специфичных для каждого вида рыб, а также использованием в качестве дополнительного источника пищи водных беспозвоночных, принадлежащих к разным таксономическим группам. Индекс сходства Шенера, рассчитанный на основе относительной численности определенных до вида кормовых объектов, обнаруженных в желудках рыб, показал отсутствие конкурентных отношений между всеми исследованными видами рыб; минимальные значения индекса отмечены между наиболее филогенетически близкими видами O. ocellatus и O. tenuis.
Опистоцентровые рыбы родов Opisthocentrus и Pholidapus – типичные представители донных прибрежных ихтиоценов дальневосточных морей (Соколовский и др., 2009), обитающие в прибрежных зарослях макрофитов и морских трав (Ochiai, Fuji, 1980; Баланов и др., 2010; Маркевич, 2014, 2015а, 2015б, 2018; Маркевич и др., 2015). Опоясанный опистоцентр O. zonope Jordan et Snyder, 1902 – теплолюбивый вид, обычный в южных районах Приморья, который встречается также среди валунов и на каменистых склонах (Маркевич, 2015а). Наиболее фенотипически схожие глазчатый опистоцентр O. ocellatus (Tilesius, 1811) и белоносый опистоцентр O. tenuis Bean et Bean, 1897 (Shiogaki, 1984) часто встречаются в уловах совместно; безногий опистоцентр Pholidapus dybowskii (Steindachner, 1880) обычен в более северных водах Японского моря (Соколовский и др., 2014). Сеголетки вышеперечисленных опистоцентровых рыб составляют значительную долю прибрежного ихтиоцена, однако до настоящего времени их биология, в частности трофические отношения, изучены крайне слабо (Ochiai, Fuji, 1980).
На примере других совместно обитающих видов рыб показано, что дифференциация трофических ниш между ними может быть реализована благодаря разнесению во времени их пищевой активности (Kronfeld-Schor et al., 2003; Fox et al., 2011; Sánchez-Hernández et al., 2011), избирательности по размерам пищевых объектов (Colloca et al., 2010), дифференцированному использованию пространства (Маркевич, 1998; Sánchez-Hernández et al., 2013; Murillo-Cisneros et al., 2019) или особенностям биохимических процессов расщепления пищи (German et al., 2015). Показано, что чем ближе друг к другу расположены таксоны на эволюционном древе, тем более разобщены их пищевые предпочтения (Пианка, 1981; Fedosov et al., 2014). Даже высокие индексы сходства спектров питания не всегда означают высокий уровень конкурентных отношений, так как при этом могут быть задействованы разные стратегии использования пищевых ресурсов (Sánchez-Hernández et al., 2011) или же кормового объекта достаточно для питания двух и более видов, обитающих совместно (Kwak et al., 2005).
Для оценки трофических отношений используют данные о содержимом желудка (SCA – sto-mach contents analyses) (Berg, 1979) и результаты анализа природных соотношений стабильных изотопов (SIA – stable isotope analysis) углерода (13C/12C) и азота (15N/14N), определяемых как величины δ13С и δ15N соответственно (Post, 2002; Кияшко и др., 2011). Оба метода имеют достоинства и недостатки, но дополняют друг друга при совместном использовании (Pacioglu et al., 2019). Одно из преимуществ SCA заключается в том, что он дает информацию о таксономической принадлежности кормовых объектов, которая отсутствует в случае использования SIA (Layman et al., 2007). В то же время SIA предоставляет интегрированные данные о первичных источниках углерода и положении в пищевой цепи в более длительных временных масштабах, чем анализ содержимого желудка (Peterson, Fry, 1987). По мере роста организма изменяются его пищевые предпочтения и происходит онтогенетическое смещение пищевой ниши (German et al., 2014), а изменение питания отражается в изотопной подписи организма (Hertz et al., 2016; Choi et al., 2021). Использование обоих методов позволяет более полно проследить трофоэкологические связи исследуемых организмов (Davis et al., 2012; Pacioglu et al., 2019; Varela et al., 2019) и наглядно представить онтогенетическое смещение экологической ниши (Rudolf, 2020).
Симпатрические виды опистоцентровых рыб – хороший модельный объект для понимания того, как разделяются трофические ниши близкородственных видов при совместном обитании. Цель настоящей работы – изучение трофических отношений четырех видов опистоцентровых рыб: глазчатого, белоносого, опоясанного и безногого опистоцентров в прибрежных акваториях Японского моря.
МАТЕРИАЛ И МЕТОДИКА
В основу работы положен материал, собранный в трех районах ареала на базах морских экспериментальных станций в бухтах Киевка, Витязь и в зал. Восток Японского моря в период с мая по октябрь 2005 и 2006 гг., а также в 2018 г. Отлов рыб проводили тралом Сигсби (размер рамы 2.5 × 0.7 м) на глубине 0.5–5.0 м и неводом (высота 1.3 м, раскрытие 7.25 м, размер ячеи 0.5 см, в кутце мельничный газ) на глубине 0.5–1.3 м на илисто-песчаных грунтах в сообществах многолетних растений Zostera marina + Sargassum miyabei, Chorda filum и Z. asiatica. Площадь облова составляла около 1000–1400 м2 в зависимости от локации. Всего проанализировано 438 экз. рыб. Из них для анализа SCA отобрано 82 экз. глазчатого (15/67 – молодь/взрослые особи), 153 экз. белоносого (63/90), 30 экз. опоясанного (10/20) и 138 экз. безногого (36/102) опистоцентров. Половой зрелости эти виды рыб достигают на втором году жизни (Ochiai, Fuji, 1980), сеголеток и взрослых особей (второго года жизни и старше) анализировали отдельно. Возраст определяли по целым отолитам (sagitta) в проходящем свете под микроскопом Zeiss Stemi DV4. Для изотопного анализа использовали навески мышечной ткани рыб: по 12 экз. глазчатого, тонкого и опоясанного опистоцентров, пойманных в летний период (июль), а также 1 экз. опоясанного и по 5 экз. глазчатого, тонкого и безногого опистоцентров, отловленных в осенний период (октябрь).
Пробы для SCA обрабатывали в соответствии с методиками (Методическое пособие…, 1974). Наполнение желудков определяли по шестибалльной шкале (Лебедев, 1960). Все пищевые компоненты, кроме остракод и гарпактицид, взвешивали на электронных весах Pioneer PA 214 (цена деления 0.0001 г.) Массу остракод и гарпактицид восстанавливали по номограммам (Численко, 1968).
Для характеристики спектра питания использовали следующие показатели: частота встречаемости (F, %), число кормовых объектов на желудочно-кишечный тракт одной особи (N, %), доля каждого компонента пищи от общей массы пищевого комка (P, %) (Методическое пособие…, 1974), а также модифицированный (Попова, Решетников, 2011) индекс относительной значимости (IR – index of relative significance):
где Fi – частота встречаемости каждого объекта питания; Pi – доля по массе, величина i меняется от 1 до n (n – число видов кормовых организмов в пищевом комке). Индекс нормирован, поэтому его колебания находятся в пределах от 0 до 100% независимо от числа видов кормовых организмов.Для выявления дискриминирующих пищевых групп использовали SIMPER анализ (Kruskal, Wish, 1978). На основании данных, переведенных в матрицу сходства Брея–Кертиса (Beals, 1984), проведен одномерный анализ ANOSIM (Clarke, 1993). Степень сходства спектров питания (IS) рассчитана при помощи индекса Шенера (Schoener, 1970) по формуле:
где pxi и pyi – относительное количество пищевого компонента i в желудках видов x и y. Пищевые объекты были определены до вида, что значимо увеличило информативность анализа.Изотопный анализ проведен в Лаборатории стабильных изотопов Дальневосточного геологического института ДВО РАН. Относительное содержание тяжелых изотопов 13С и 15N в образцах определяли в общепринятой форме как величины отклонений δ13С и δ15N в промилле от соответствующего стандарта изотопного состава:
где X – стабильные изотопы углерода и азота (13C, 15N), а R – отношение содержаний стабильных изотопов (13C/12C, 15N/14N). Все приведенные ниже значения δ13С и δ15N даны в отношении к общепринятым международным стандартам изотопного состава: карбоната PDB, атмосферного азота AIR для углерода и азота. Точность определения величин δ13С и δ15N составляла ± 0.1‰.Липидный состав тканей, вычисленный как соотношение С/N (Layman et al., 2007), имел небольшую дисперсию для всех образцов (3.25 ± 0.03), что позволило пренебречь этими значениями. Различия между выборками рассчитывали, используя непараметрический метод дисперсионного анализа по Краскелу–Уоллесу (p ≤ 0.05). Для визуализации трофических взаимоотношений с помощью пакета SIBER (Jackson et al., 2011) построены эллипсы с поправкой на малый объем выборки (SEAc), так как ранее показано, что общая площадь проекции изотопной ниши (ТА) зависит от объема выборки (Jackson et al., 2011), в то время как размер SEAc (SEA для малых выборок), построенного байесовским методом, не чувствителен к объему выборки. Расчеты и визуализация данных выполнены с помощью пакета статистических программ Statistica 10 (StatSoft) и программной среды R (R Core Team, 2020).
РЕЗУЛЬТАТЫ
Трофические отношения по данным содержимого желудков
За период наблюдений наименьший индекс наполнения желудков (43‰) отмечен у белоносого опистоцентра. У глазчатого и безногого опистоцентров индекс составлял соответственно 67 и 68‰ или 3 балла по шкале Лебедева (Лебедев, 1960). Доля пустых желудков варьировала от 9% у глазчатого опистоцентра до 19% у белоносого.
Наиболее значимым компонентом в питании сеголеток опоясанного опистоцентра были амфиподы (F = 100%, IR = 92.24%) (табл. 1), в основном амфипода Crassicorophium bonellii (табл. 2). В желудках часто встречались гарпактициды и остракоды (F = 100%), однако они были менее значимой пищей (IR = 7.61 и 0.15% соответственно). Роль амфипод оставалась ведущей и в питании взрослых рыб (табл. 1). Из шести видов амфипод, обнаруженных в желудках опоясанного опистоцентра, самым массовым был вид C. bonellii. Среди остракод взрослые особи опоясанного опистоцентра предпочитали Xestoleberis hanaii и Boreostoma coniforme. Специфичным пищевым объектом для этого опистоцентра был брюхоногий моллюск Lottia angusta. Присутствие кумового рака Alamprops quadriplicatus – еще одна особенность питания опоясанного опистоцентра.
Таблица 1.
Таксономическая принадлежность пищевых объектов и количественные характеристики питания четырех видов опистоцентровых рыб из прибрежных вод западной части Японского моря
| Кормовой объект | Opisthocentrus zonope, n = 10/20* |
Opisthocentrus ocellatus, n = 15/67 |
Opisthocentrus tenuis, n = 63/90 |
Pholidapus dybowskii, n = 36/102 |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| F, % | P, % | IR, % | F, % | P, % | IR, % | F, % | P, % | IR, % | F, % | P, % | IR, % | |
| Amphipoda | 100/93 | 92.2/73.1 | 92.2/95.8 | 100/80 | 53.3/30.4 | 58.1/71.43 | 84/39 | 33.3/65.6 | 58.2/83.4 | 96/64 | 30.13/48.7 | 60.7/73.1 |
| Ostracoda | 100/36 | 0.15/01 | 0.15/0.01 | 100/0 | 0.12/0 | 0.1/0 | 43/1.4 | 0.01/0.2 | 0/0.1 | 66/20 | 0.05/0.1 | 0.1/0.1 |
| Harpacticoida | 100/36 | 7.61/01 | 7.61/0.01 | 100/0 | 5.19/0 | 5.7/0 | 64/2.8 | 1/8.2 | 1.3/0.1 | 93/8 | 3.4/0.2 | 6.7/0.1 |
| Gastropoda | 0/21 | 0/6.9 | 0/2.08 | 0/12 | 0/27.6 | 0/9.5 | 39/1.6 | 41.9/8.2 | 34/0.4 | 36/36 | 36.7/17.4 | 27.7/14.6 |
| Izopoda | 0/7 | 0/6.0 | 0/0.61 | 80/18 | 41.4/34 | 36.1/18.3 | 0/0 | 0/0 | 0/0 | 6/36 | 29.7/10.7 | 3.7/7.1 |
| Mysida | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/63 | 0/6.8 | 0/14.5 | 0/3 | 0/3.3 | 0/0.3 |
| Cumacea | 0/7 | 0/6.9 | 0/0.7 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
| Tanaidacea | 0/7 | 0/7.1 | 0/0.7 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 |
| Decapoda | 0/0 | 0/0 | 0/0 | 0/3 | 0/8.1 | 0/7.9 | 0/4.3 | 0/6.7 | 0/0.93 | 0/16 | 0/2.2 | 0/0.9 |
| Polychaeta | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 0/0 | 13/2.8 | 23.8/11.3 | 6.4/1.1 | 3/9.8 | 17.4/17.2 | 1.1/3.94 |
Таблица 2.
Видовой состав кормовых объектов опистоцентровых рыб из прибрежных вод Японского моря на основе анализа содержимого желудков рыб
| Таксон/вид | Opisthocentrus zonope | Opisthocentrus ocellatus | Opisthocentrus tenuis | Pholidapus dybowskii |
|---|---|---|---|---|
| Amphipoda | ||||
| Crassicorophium bonellii | +*/+ | +*/+ | –/– | +/+ |
| Atylus collingi | –/+ | –/+* | –/– | –/+* |
| Atylus ekmani | –/– | –/– | –/+ | –/+ |
| Pontogeneia intermedia | –/+ | +/+ | –/+ | –/+ |
| Ampithoe dyakonovi | +/+* | +/– | –/– | +/+ |
| Ampithoe lacertosa | –/– | –/+ | –/– | +/+ |
| Sunamphithoe mea | –/– | –/+ | –/– | +/+ |
| Caprella cristibrachium | –/– | +/+ | +*/– | +/+ |
| Caprella bispinosa | –/– | –/+ | –/+ | –/– |
| Caprella eximia | –/– | –/+ | –/+ | –/+ |
| Caprella penantis | –/– | –/– | –/+ | –/– |
| Caprella acanthogaster | –/– | –/– | –/– | –/+ |
| Accedomoera melanophthalma | –/– | –/– | –/– | –/+ |
| Anisogammarus locustoides | –/– | –/+ | –/– | –/– |
| Anisogammarus pugettensis | –/– | –/+ | –/– | –/+* |
| Parapleustes derzhavini | –/– | –/+ | –/– | –/– |
| Ischyrocerus elongatus | –/– | –/+ | –/– | –/– |
| Ischyrocerus anguipes | –/– | –/+ | –/+* | –/– |
| Protomedeia fasciatoides | –/– | –/– | –/– | –/+ |
| Vonimetopa zernovi | –/+ | –/– | –/– | –/– |
| Pareurystheus gurjanovae | –/+ | –/– | –/– | –/– |
| Aoroides sp. | –/– | –/– | –/– | +/– |
| Photis sp. | –/– | +/– | –/– | +/– |
| Parhyale zibellina | –/– | –/– | +/– | –/– |
| Mysida | ||||
| Neomysis mirabilis | –/– | –/– | –/+* | –/+ |
| Cumacea | ||||
| Alamprops quadriplicatus | –/+ | –/– | –/– | –/– |
| Tanaidacea | ||||
| Pseudotanais sp. | –/+ | –/– | –/– | –/– |
| Decapoda | ||||
| Pandalus latirostris | –/– | –/+ | –/+ | –/+ |
| Heptacarpus longirostris | –/– | –/– | –/– | –/+ |
| Eualus leptognathus | –/– | –/– | –/– | –/+ |
| Ostracoda | ||||
| Xestoleberis hanai | +/+ | +/– | +/+ | +/+ |
| Hemicytherura sp. | –/– | –/– | –/– | +/+ |
| Boreostoma coniforme | –/+ | –/– | –/– | –/– |
| Boreostoma ussuricum | –/– | –/– | –/– | –/+ |
| Cythere nishinipponica | –/– | –/– | –/– | –/+ |
| Harpacticoida | ||||
| Parathalestris sp. | –/– | +/– | –/+ | +/– |
| Scutellidium sp. | +/+ | +/– | +/– | +/+* |
| Paramenophia platysoma | –/– | –/– | –/– | +/– |
| Zaus sp. | –/– | +/– | +/– | +/– |
| Harpacticoida gen. sp. 1 | –/– | +/– | –/– | –/– |
| Harpacticoida gen. sp 2 | –/– | +/– | –/– | –/– |
| Gastropoda | ||||
| Siphonacmea oblongata | –/– | +/+ | +*/+ | +/+* |
| Pusillina plicose | –/– | –/– | –/– | –/+ |
| Lottia angusta | –/+ | –/– | –/– | –/– |
| Isopoda | ||||
| Idotea ochotensis | –/– | –/+* | –/– | –/+ |
| Syniodotea brashnikovi | –/+ | –/– | –/– | –/+ |
| Idoteidae gen. sp. | –/– | –/– | –/– | –/+ |
| Sphaeromatidae gen. sp. | –/– | –/– | –/– | –/+ |
| Isopoda spp. | +/– | +/– | –/– | +/– |
| Polychaeta spp. | ||||
| –/– | –/– | +/+ | +/+ | |
| Pisces spp. | ||||
| –/– | –/– | –/+ | –/– | |
Амфиподы играли ведущую роль и в питании сеголеток глазчатого опистоцентра (F = 100%, IR = 58.1%). В желудках рыб встречались преимущественно виды C. bonellii, Pontogeneia intermedia и Caprella cristibranchium (табл. 2). Второстепенным кормовым объектом глазчатого опистоцентра были изоподы (IR = 36.1%). Гарпактициды (F = 100%, IR = 5.7%), которых использовали в пищу все сеголетки, в основном относились к роду Parathalestris. Остракоды (F = 100%, IR = 0.1%) были представлены всего двумя видами, наиболее многочисленным из которых был вид X. hanaii. Спектр питания взрослых рыб этого вида был значительно уже. Основным объектом питания оставались амфиподы (IR = 71.43%), среди которых доминировали Atylus collingi, P. intermedia и Caprella bispinosa. Необходимо отметить, что только в желудках глазчатого опистоцентра встречались амфиподы Anisogammarus locustoides, Parapleustes derzhavini и Ischyrocerus elongatus. Второстепенными компонентами пищи были изопода Idotea ochotensis и брюхоногий моллюск Siphonacmea oblongata. Гарпактициды и остракоды в желудках взрослых рыб глазчатого опистоцентра не обнаружены.
Наряду с амфиподой C. cristibrachium основным объектом питания сеголеток белоносого опистоцентра был брюхоногий моллюск S. oblongata (IR 58.2 и 34% соответственно). Более часто по отношению к другим кормовым объектам в желудках рыб встречались остракоды и гарпактициды (F = 43 и 64% соответственно), однако из-за малой массы они не были значимым компонентом питания (IR = 0.1 и 1.3% соответственно). Спектр питания взрослых рыб был представлен в основном амфиподами, среди которых наиболее значимыми были Ischyrocerus anguipes и Caprella eximia (табл. 2). Следующим по значимости компонентом питания была мизида Neomysis mirabilis (IR = 14.05%).
Основным компонентом пищи сеголеток безногого опистоцентра были амфиподы и брюхоногие моллюски (IR = 60.7%, IR = 27.7%) (табл. 1), второстепенные компоненты были представлены гарпактицидами (IR = 6.7%) и остракодами, в основном X. hanaii и редко Hemicytherura sp. (табл. 2). У взрослых рыб основу питания также составляли амфиподы (IR = 73.13%) и брюхоногие моллюски (IR = 14.62%). Изоподы и остракоды имели второстепенное значение. Видовой состав остракод в пищевом комке расширился за счёт потребления Boreostoma ussuricum и Cythere nishinipponica, отмеченных в составе пищи только безногого опистоцентра. Случайными компонентами пищи были мизиды и декаподы. Безногий опистоцентр характеризовался наиболее широким спектром пищевых объектов, который включал 29 видов беспозвоночных.
Сравнение спектров питания сеголеток всех исследованных видов рыб с использованием ANOSIM-анализа не показало значимых различий в процентном соотношении пищевых объектов на уровне высоких таксонов (R = 0.06, P = 0.063). Достоверные различия определены только при попарном сравнении состава пищи белоносого и безногого (R = 0.12, P = 0.002), глазчатого и опоясанного опистоцентров (R = 0.34, P = 0.01). Согласно данным SIMPER-анализа, глазчатый и белоносый опистоцентры различались по соотношению количества брюхоногих моллюсков в содержимом желудков, глазчатый и опоясанный – по соотношению гарпактицид, а глазчатый и безногий – по потреблению остракод. Спектр питания белоносого опистоцентра отличался высокой частотой встречаемости брюхоногих моллюсков (табл. 1).
Исследование трофических отношений взрослых рыб с помощью ANOSIM-анализа показало, что выборка белоносого опистоцентра значимо отличалась от выборок остальных видов опистоцентров (R = 0.2, P = 0.001). Согласно данным SIMPER, присутствие Mysida являлось отличительной особенностью питания белоносого опистоцентра. По результатам этого анализа достоверные различия обнаружены также между глазчатым и безногим опистоцентрами.
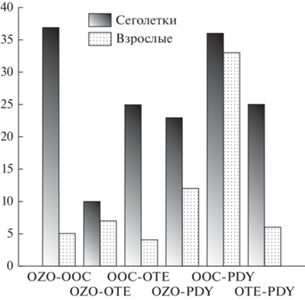
Рассчитанные попарные индексы сходства Шенера (Schoener, 1970) не выявили конкурентных отношений (рис. 1). Обнаружено, что сходство состава пищи у сеголеток изученных видов было выше, чем у взрослых рыб: значение индекса сходства варьировало от 10 до 37% у сеголеток и от 4 до 12% у взрослых рыб, за исключением пары опоясанный/безногий опистоцентры с индексом сходства 34%.
Пищевые отношения на основе анализа изотопного состава
Исследованные рыбы имели сходный изотопный состав азота. В летний период диапазон межвидовых вариаций δ15N составил 0.43‰, а δ13С – 2.64‰. Наименьшие значения тяжелого углерода (–20.04 ± 0.95) отмечены у опоясанного опистоцентра, который значимо отличался (H = 19.66290, p = 0.0014) от остальных видов рыб по обоим показателям. В осенний период соотношение стабильных изотопов значимо отличалось от летних данных. Максимальное значение δ15N отмечено у безногого опистоцентра (10.71 ± 0.55), а минимальное – у белоносого (9.74 ± 0.54). Осенние выборки характеризовались большей гетерогенностью соотношений изотопов азота, чем летние; диапазон вариаций составил 0.97‰. Самые низкие значения δ13С отмечены у белоносого опистоцентра (–18.08 ± 0.98).
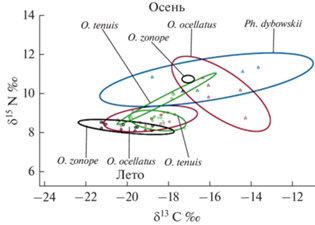
В летний период площадь изотопной ниши глазчатого опистоцентра, скорректированная для малой выборки SEAc, составила 0.812, что в два с лишним раза больше этих показателей для белоносого (SEAc = 0.396) и опоясанного (SEAc = 0.407) опистоцентров. В осенний период самую широкую нишу занимал безногий опистоцентр (SEAc = = 0.3902). Площадь изотопной ниши белоносого опистоцентра (SEAc = 0.3648) уменьшилась по сравнению с таковой в летний период, тогда как у глазчатого опистоцентра, напротив, осенью нишевое пространство было больше, чем летом (рис. 2).
ОБСУЖДЕНИЕ
Анализ, основанный на двух взаимодополняющих методах, показал существование достоверных видоспецифических различий в спектрах питания четырех опистоцентровых рыб. По разнообразию пищевых компонентов доминирует безногий опистоцентр: у сеголеток и взрослых рыб этого вида самый широкий спектр питания, включающий 14 и 29 таксонов соответственно. Для остальных видов характерны более узкие пищевые ниши. По результатам нашего исследования наиболее специализированным оказался белоносый опистоцентр, изотопная ниша которого была наименьшей и ее площадь уменьшалась по мере роста рыб (рис. 2).
Показано, что изотопный состав тела рыб формируется в период интенсивного соматического роста и затем изменяется в онтогенезе (Горбатенко и др., 2015). Согласно нашим результатам, значимое изменение значений δ15N у молоди глазчатого и белоносого опистоцентров в течение трех месяцев (с июля по октябрь) свидетельствует об их смещении в пищевой сети на один уровень и о высокой скорости метаболических процессов, приводящих к накоплению тяжелых изотопов.
Отмечено, что разные виды опистоцентров после перехода от пелагического образа жизни к демерсальному держатся в толще воды поблизости от куртин бурых водорослей (Галеев и др., 2015) или антропогенных строений, покрытых обрастателями (личные наблюдения), образуют общие стайки и имеют сходный характер питания, что подтверждается перекрыванием изотопных ниш, обнаруженным в результате изотопного анализа. Однако по первичным источникам углерода выявлены межвидовые различия. Смещение изотопной ниши в сторону накопления тяжелого углерода предполагает увеличение доли бентосных организмов в рационе.
Достоверное различие первичных источников углерода отмечено для наиболее филогенетически близких глазчатого и белоносого опистоцентров. Меньшие значения δ13С в тканях белоносого опистоцентра обусловлены заметным вкладом в его пищу пелагических организмов, что подтверждалось значительным количеством особей мизиды Neomysis mirabilis (F = 62%, IR = 14.05%) в составе пищевого комка. Подобное дифференцированное использование водного пространства показано ранее и для других симпатрических видов рыб (Dineen et al., 2007; Sánchez-Hernández et al., 2013).
Использование амфипод как основного источника питания исследованных видов рыб предполагает возможность конкурентных пищевых отношений, что подтверждается значительным перекрыванием изотопных ниш (рис. 2). Для более точного понимания механизма разделения пищевых ресурсов необходимо рассматривать таксоны объектов питания на более низком уровне, вплоть до видового (Шорыгин, 1952). Индекс сходства Шенера, рассчитанный на основе относительной численности кормовых объектов, определенных до вида, показал незначительный уровень конкуренции за пищу, которая уменьшалась с возрастом и ростом рыб (рис. 1). Сходный изотопный профиль, а также высокий уровень вероятности перекрытия изотопных и пищевых ниш при более детальном анализе пищевых объектов показали, что опистоцентры демонстрируют пищевую избирательность на видовом уровне. Основа рациона исследованных рыб – амфиподы, однако для глазчатого опистоцентра это Atylus collingi, для опоясанного – Crassicorophium bonellii, для белоносого – Ischyrocerus anguipes, а для безногого – Atylus collingi и Anisogammarus pugettensis. Питание этими ракообразными дает сходную изотопную подпись, что при отсутствии данных о видовом составе пищи в желудках может быть интерпретировано как конкурентные отношения.
Исследование пищевых отношений симпатрических видов опистоцентровых рыб путем определения содержимого желудков, а также анализа соотношений стабильных изотопов азота и углерода в мягких тканях позволило выявить механизмы разделения трофических ниш. Амфиподы – это основной объект питания всех изученных видов рыб, что наглядно демонстрируют пересечения изотопных ниш. Разделение трофических ниш достигается за счет избирательного потребления разных видов амфипод, специфичных для каждого вида рыб, а также благодаря использованию в качестве дополнительного источника пищи водных беспозвоночных других таксономических групп – Gastropoda, Polychaeta, Decapoda и др.
По разнообразию пищевых объектов доминировал безногий опистоцентр, который имел самый широкий спектр питания. Согласно результатам нашего исследования, наиболее специализированным видом оказался белоносый опистоцентр. Индекс сходства Шенера, рассчитанный на основе относительной численности определенных до вида кормовых объектов в содержимом желудков рыб, показал отсутствие конкурентных отношений между изученными видами рыб; минимальные значения этого индекса отмечены у наиболее филогенетически близких видов O. ocellatus и O. tenuis.
В заключение следует отметить, что совокупное использование двух методов дает целостное представление о трофоэкологических взаимоотношениях изучаемых объектов, позволяя наглядно представить пищевые ниши и их пересечения, избежав при этом возможной неверной интерпретации трофических отношений.
Список литературы
Баланов А.А., Епур И.В., Земнухов В.В., Маркевич А.И. Состав и сезонная динамика видового обилия ихтиоцена бухты Средней (зал. Петра Великого, Японское море) // Изв. ТИНРО. 2010. Т. 163. С. 158–171.
Галеев А.И., Баланов А.А., Маркевич А.И., Некрасов Д.А. Использование молодью Opisthocentrus sp. бурой водоросли Desmarestia viridis (Desmarestiacae) в качестве убежища // Вопр. ихтиологии. 2015. Т. 55. Вып. 1. С. 110–113.
Горбатенко К.М., Кияшко С.И., Лаженцев А.Е. и др. Донно-пелагические связи в глубоководной части Охотского моря по данным анализа стабильных изотопов С и N // Изв. ТИНРО. 2015. Т. 183. С. 200–2016.
Кияшко С.И., Веливецкая Т.А., Игнатьев А.В. Состав стабильных изотопов серы, углерода и азота в мягких тканях и пищевые отношения рыб из прибрежных вод залива Петра Великого // Биол. моря. 2011. Т. 37. № 4. С. 286–291.
Лебедев Н.В. Опыт учета размеров выедания рыбами моллюсков и определения численности рыб в промысловом скоплении на местах питания // Вопр. ихтиологии. 1960. Вып. 16. С. 34–55.
Маркевич А.И. Состав группировок, экология и поведение морских окуней рода Sebastes Дальневосточного морского заповедника (залив Петра Великого, Японское море): Автореф. дис. … канд. биол. наук. Владивосток: Дальнаука. 1998. 17 с.
Маркевич А.И. Характеристика сообщества рыб небольшой бухты острова Большой Пелис (Дальневосточный морской биосферный заповедник) // Биота и среда заповедников Дальнего Востока. 2014. Вып. 2. С. 144–166.
Маркевич А.И. Мониторинг рыб Дальневосточного морского заповедника // Биота и среда заповедников Дальнего Востока. 2015а. № 5. С. 46–55.
Маркевич А.И. Список видов рыб и рыбообразных Дальневосточного морского заповедника // Биота и среда заповедников Дальнего Востока. 2015б. № 1. С. 109–137.
Маркевич А.И. Мониторинг рыб прибрежных биотопов южного участка Дальневосточного морского заповедника (залив Петра Великого Японского моря) // Изв. ТИНРО. 2018. Вып. 192. С. 37–46.
Маркевич А.И., Суботэ А.Е., Зимин П.С., Фищенко В.К. Первый опыт использования системы долговременного подводного видеонаблюдения для биологического мониторинга в заливе Петра Великого (Японское море) // Вестн. ДВО РАН. 2015. Т. 1. № 179. С. 86–92.
Методическое пособие по изучению питания и пищевых отношений рыб в естественных условиях. М.: Наука. 1974. 253 с.
Пианка Э. Эволюционная экология. М.: Мир. 1981. 400 с.
Попова О.А., Решетников Ю.С. О комплексных индексах при изучении питания рыб // Вопр. ихтиологии. 2011. Т. 51. № 5. С. 712–717.
Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. Рыбы залива Петра Великого. Владивосток: Дальнаука. 2009. 375 с.
Соколовский А.С., Соколовская Т.Г., Харин В.Е., Долганов С.М. Ихтиофауна залива Восток Японского моря // Биота и среда заповедников Дальнего Востока. 2014. № 1. С. 71–99.
Численко Л.Л. Номограммы для определения веса водных организмов по размерам и форме тела: морской мезобентос и планктон. Л.: Наука. 1968. 106 с.
Шорыгин А.А. Питание и пищевые взаимоотношения рыб Каспийского моря. М.: Пищепромиздат. 1952. Т. 1. 268 с.
Beals E.W. Bray-Curtis ordination: an effective strategy for analysis of multivariate ecological data // Adv. Ecol. Res. 1984. V. 14. P. 1–55.
Berg J. Discussion of methods of investigating the food of fishes, with reference to a preliminary study of the prey of Gobiusculus flavescens (Gobiidae) // Mar. Biol. 1979. V. 50. № 3. P. 263–273.
Choi B., Kim W.-S., Ji C.W. et al. Application of combined analyses of stable isotopes and stomach contents for understanding ontogenetic niche shifts in silver croaker (Pennahia argentata) // Int. J. Environ. Res. Public Health. 2021. V. 18. № 8. P. 4073–4083.
Clarke K.R. Non-parametric multivariate analyses of changes in community structure // Aust. J. Ecol. 1993. V. 18. № 1. P. 117–143.
Colloca F., Carpentieri P., Balestri E., Ardizzone G. Food resource partitioning in a Mediterranean demersal fish assemblage: the effect of body size and niche width // Mar. Biol. 2010. V. 157. № 3. P. 565–574.
Davis A.M., Blanchette M.L., Pusey B.J. et al. Gut content and stable isotope analyses provide complementary understanding of ontogenetic dietary shifts and trophic relationships among fishes in a tropical river // Freshwater Biol. 2012. V. 57. № 10. P. 2156–2172.
Dineen G., Harrison S.S.C., Giller P.S. Diet partitioning in sympatric Atlantic salmon and brown trout in streams with contrasting riparian vegetation // J. Fish Biol. 2007. V. 71. № 1. P. 17–38.
Fedosov A.E., Tiunov A.V., Kiyashko S.I., Kantor Yu.I. Trophic diversification in the evolution of predatory marine gastropods of the family Terebridae as inferred from stable isotope data // Mar. Ecol.: Prog. Ser. 2014. V. 497. P. 143–156.
German D.P., Gawlicka A.K., Horn M.H. Evolution of ontogenetic dietary shifts and associated gut features in prickleback fishes (Teleostei: Stichaeidae) // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 2014. T. 168. P. 12–18.
German D.P., Sung A., Jhaveri P., Agnihotri R. More than one way to be an herbivore: convergent evolution of herbivory using different digestive strategies in prickleback fishes (Stichaeidae) // Zoology. 2015. T. 118. № 3. P. 161–170.
Hertz E., Trudel M., El-Sabaawi R. et al. Hitting the moving target: modelling ontogenetic shifts with stable isotopes reveals the importance of isotopic turnover // J. Anim. Ecol. 2016. T. 85. № 3. P. 681–691.
Fox R.J., Bellwood D.R. Unconstrained by the clock? Plasticity of diel activity rhythm in a tropical reef fish, Si-ganus lineatus // Funct. Ecol. 2011. V. 25. № 5. P. 1096–1105.
Jackson A.L., Inger R., Parnell A.C., Bearhop S. Comparing isotopic niche widths among and within communities: SIBER – Stable Isotope Bayesian Ellipses in R // J. Anim. Ecol. 2011. V. 80. № 3. P. 595–602.
Kronfeld-Schor N., Dayan T. Partitioning of time as an ecological resource // Annu. Rev. Ecol. Evol. Syst. 2003. V. 34. № 1. P. 153–181.
Kruskal J.B., Wish M. Multidimensional Scaling / Sage University Papers Series: Quantitative Application in the Social Sciences, № 07-011. Newbury Park, Calif.: Sage Publications. 1978. 120 p.
Kwak S.N., Baeck G.W., Klumpp D.W. Comparative feeding ecology of two sympatric greenling species, Hexagrammos otakii and Hexagrammos agrammus in eelgrass Zostera marina beds // Environ. Biol. Fishes. 2005. V. 74. № 2. P. 129–140.
Layman C.A., Arrington D.A., Montaña C.G., Post D.M. Can stable isotope ratios provide for community-wide measures of trophic structure? // Ecology. 2007. V. 88. № 1. P. 42–48.
Murillo-Cisneros D.A., O’Hara T.M., Elorriaga-Verplancken F.R. et al. Trophic assessment and isotopic niche of three sympatric ray species of western Baja California Sur, Mexico // Environ. Biol. Fishes. 2019. V. 102. № 12. P. 1519–1531.
Ochiai T., Fuji A. Energy transformations by a blenny (Opisthocentrus ocellatus) population of Usu Bay, southern Hokkaido // Bull. Fac. Fish., Hokkaido Univ. 1980. V. 31. № 4. P. 314–326.
Pacioglu O., Zubrod J.P., Schulz R. et al. Two is better than one: combining gut content and stable isotope analyses to infer trophic interactions between native and invasive species // Hydrobiologia. 2019. V. 839. № 1. P. 25–35.
Peterson B.J., Fry B. Stable isotopes in ecosystem studies // Annu. Rev. Ecol. Syst. 1987. V. 18. № 1. P. 293–320.
Post D.M. Using stable isotopes to estimate trophic position: Models, methods, and assumptions // Ecology. 2002. V. 83. № 3. P. 703–718.
R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/. Electron version accessed 30.04.2020.
Rudolf V.H.W. A multivariate approach reveals diversity of ontogenetic niche shifts across taxonomic and functional groups // Freshwater Biol. 2020. V. 65. № 4. P. 745–756.
Sánchez-Hernández J., Cobo F. Summer food resource partitioning between four sympatric fish species in Central Spain (River Tormes) // J. Vertebr. Biol. 2011. V. 60. № 3. P. 189–202.
Sánchez-Hernández J., Servia M.J., Vieira-Lanero R., Cobo F. Prey trait analysis shows differences in summer feeding habitat use between wild YOY Atlantic salmon and brown trout // Ital. J. Zool. 2013. V. 80. № 3. P. 449–454.
Schoener T.W. Nonsynchronous spatial overlap of lizards in patchy habitats // Ecology. 1970. V. 51. № 3. P. 408–418.
Shiogaki M. A review of the genera Pholidapus and Opisthocentrus (Stichaeidae) // Jpn J. Ichthyol. 1984. V. 31. P. 213–224.
StatSoft, Inc. STATISTICA (data analysis software system), version 10. https://www.statsoft.com. Electron version accessed 30.04.2020.
Varela J.L., Sorell J.M., Laiz-Carrión R. et al. Stomach content and stable isotope analyses reveal resource partitioning between juvenile bluefin tuna and Atlantic bonito in Alboran (SW Mediterranean) // Fish. Res. 2019. V. 215. P. 97–105.
Дополнительные материалы отсутствуют.