Биология моря, 2022, T. 48, № 6, стр. 397-401
Оценка состояния популяций двух видов рыб Siganus fuscescens (Houttuyn, 1782) и Gerres oblongus (Cuvier, 1830) (Actinopterygii: Perciformes), обитающих в сублиторальной зоне острова Малапаскуа (Филиппины)
А. Г. Селюков 1, *, О. Н. Жигилева 1, А. И. Боричевская 1, С. С. Шадрина 1
1 Тюменский государственный университет
625003 Тюмень, Россия
* E-mail: ags-bios@yandex.ru
Поступила в редакцию 27.12.2021
После доработки 15.06.2022
Принята к публикации 06.10.2022
- EDN: GROBCX
- DOI: 10.31857/S0134347522060110
Аннотация
Представлены данные о состоянии органов и генетическом полиморфизме темного сигана Siganus fuscescens и низкотелого герреса Gerres oblongus. Массовые патологические изменения в жаберном эпителии и печени этих рыб, а также низкие показатели генетического полиморфизма, выявленные в результате исследования, свидетельствуют о неблагоприятных экологических условиях в сублиторальной зоне о-ва Малапаскуа, представляющих угрозу жизнеспособности популяций данных видов.
Усиление антропогенного давления на морские экосистемы, изменение климата и ряд других факторов стали причиной снижения биопродуктивности и биоразнообразия Мирового океана. Довольно остро эта проблема проявляется в сублиторальной зоне тропических островов, испытывающих круглогодичную рекреационную нагрузку. Филиппинский архипелаг − часть Малайского архипелага в Индо-Вест-Пацифике, он находится в глобальном центре морского биоразнообразия, в так называемом Коралловом треугольнике. Комфортный климат и видовое богатство коралловых рифов привлекают сюда многочисленных туристов, что негативно отражается на состоянии прибрежных вод (Ong et al., 2011). При этом вызывает опасения экологическая ситуация, связанная с загрязнением, сейсмической активностью и изменением климата. Сообщается о влиянии органического и микробного загрязнения (Reichardt et al., 2007; Cuvin-Aralar et al., 2016), а также обилия микропластика на морскую прибрежную среду в водах архипелага (Todd et al., 2010; Alcala et al., 2020).
Наиболее удобным и значимым биоиндикатором состояния прибрежных экосистем являются массовые виды рыб, морфофункциональное состояние которых имеет важное экологическое значение (Руднева, Залевская, 2004). В сублиторальной зоне о-ва Малапаскуа к таким видам относятся Siganus fuscescens (Houttuyn, 1782) и Gerres oblongus (Cuvier, 1830). Оба вида ассоциированы с коралловыми рифами, но G. oblongus может обитать в опресненной воде эстуариев.
Темный сиган S. fuscescens – представитель семейства сигановых, фитофаг сублиторальной зоны Западной Пацифики, встречается от берегов Японии до Северной Австралии, а также у Филиппинских островов и Индонезии. В центральных районах Филиппин его существованию угрожают чрезмерный промысел и загрязнение среды микропластиком, приводящие к уменьшению размеров рыб в период половой зрелости и к снижению их плодовитости (Alcala et al., 2020).
Питающийся беспозвоночными низкотелый геррес G. oblongus имеет сходные экологию и распространение, однако его ареал включает также северную часть Индийского океана. Вид важен с коммерческой точки зрения для удовлетворения экономических потребностей населения прибрежных районов (Yeragi, Yeragi, 2015).
В генетическом отношении оба вида изучены неравноценно. S. fuscescens вызывает интерес генетиков из-за сложной постплейстоценовой истории вида, а также незавершенного видообразования, связанного с эволюционной молодостью таксона и несовершенной межвидовой изоляцией. В связи с этим среди сигановых, с одной стороны, нередки случаи межвидовой гибридизации (Kuriiwa et al., 2007), с другой – возможно существование криптических форм внутри известных видов, что подтверждается генетическими и морфологическими различиями (Ravago-Gotanco et al., 2018), а также данными по молекулярной генетике их специфичных паразитов (Brooks et al., 2017).
Цель настоящей работы – используя гистопатологические и генетические маркеры, оценить состояние популяций двух видов рыб из прибрежных вод о-ва Малапаскуа (Филиппинские острова).
МАТЕРИАЛ И МЕТОДИКА
Материалом послужили 13 экз. темного сигана и 10 экз. низкотелого герреса, отловленных мелкоячейной сетью в сублиторальной зоне у западной части о-ва Малапаскуа в феврале 2020 г. Для гистологического анализа жабры и печень фиксировали в 4% нейтральном формалине. Гистологическую обработку этих органов проводили по общепринятым методикам (Микодина и др., 2009). Площадь нарушений эпителия жабр оценивали с использованием видеокамеры AxioCam MRc5 и лицензионного программного обеспечения AxioVision 4.7.1. На пяти выбранных случайным образом гистологических срезах каждой особи площадь очерченного участка с патологическими изменениями относили к общей площади и выражали в процентах с последующим осреднением. Для генетических исследований образцы мышц фиксировали в 70% этаноле. ДНК экстрагировали методом щелочного лизиса (Bender et al., 1983). Для оценки генетического полиморфизма использовали метод полимеразной цепной реакции последовательностей, ограниченных простыми повторами (ISSR-PCR) с четырьмя видами праймеров: (AG)8C (UBC-808), (AG)8T (UBC-807), (AC)8T (UBC-825) и (TC)8C (UBC-823). Амплификацию проводили в 25 мкл реакционной смеси, содержавшей ПЦР буфер (0.01 M трис-HCl, 0.05 M KCl и 0.1% тритон Х-100), 4 мМ MgCl2, 0.2 мМ каждого из dNTPs, 1 мкл раствора тотальной ДНК, 2.5 мМ праймера и 0.2 ед/мкл Taq-полимеразы в следующем режиме: 94°С – 7 мин, затем 94°С – 30 с, 52°С – 45 с, 72°С – 2 мин (40 циклов), 72°С – 7 мин. Разделение ампликонов осуществляли методом электрофореза в 2% агарозном геле. Длины фрагментов определяли с помощью маркера молекулярной длины ДНК 100 bp.
Стандартные популяционно-генетические характеристики рассчитывали с использованием программы POPGEN32 (Yeh et al., 1999). Для оценки генетического полиморфизма использовали долю полиморфных локусов (P), среднее наблюдаемое (na) и эффективное число аллелей на локус (ne), а также показатель генетического разнообразия (h), предложенный Неи (Nei, 1973) и аналогичный показателю средней ожидаемой гетерозиготности (H).
РЕЗУЛЬТАТЫ
У исследованных рыб почти вся площадь жаберного эпителия была подвержена патологическим изменениям разной степени. Цито-гистологический анализ жаберного аппарата рыб позволил установить относительно нормальное состояние лишь отдельных участков. Помимо отека респираторного эпителия (рис. 1а) выявлены обширные участки деструкции и некротизации ламелл вплоть до их превращения в клеточный детрит (рис. 1б). Нередко отмечали хондромы хрящевой основы филаментов (рис. 1в). Слияние респираторных ламелл, отек и отслоение респираторного эпителия, хондромы филаментов и некротизация жаберного эпителия у обоих видов прибрежных рыб, выловленных у о-ва Малапаскуа, привели к тому, что только 1.5 ± 0.78% площади жабр у темного сигана и 1.7 ± 0.53% у низкотелого герреса не имели тех или иных патологий.
Рис. 1.
Состояние жаберного эпителия и печени у низкотелого герреса и темного сигана из прибрежных вод о-ва Малапаскуа. а – отек респираторных ламелл у темного сигана; б – нарушения респираторного эпителия у герреса: образование аневризмы; превращение респираторных ламелл в клеточный детрит; в – дегенеративные изменения в жаберном аппарате темного сигана: хондромы в основании филаментов, искривления хрящевой основы филаментов и их деструкция; г – фрагмент печени сигана: фиброзы с дегенерирующими гепатоцитами. Условные обозначения: al – аневризма респираторной ламеллы, ch – хондрома хрящевой основы филамента, fh – фиброз ткани печени.
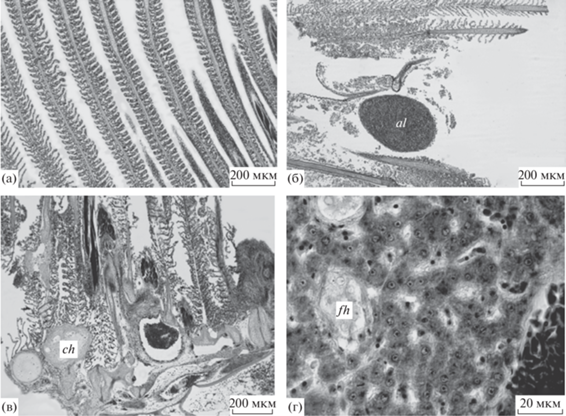
В печени рыб обоих видов явные нарушения были редкими. В гепатоцитах всех особей низкотелого герреса присутствовали липидные включения. Кроме того, у сигана выявлены фиброзы печеночной паренхимы (рис. 1г). Отмечена также кавернизация ткани печени, выявленная у большинства особей сигана, занимавшая не более 1% площади среза. Данная аномалия у особей герреса встречалась реже (у 29% особей).
Для оценки генетического полиморфизма популяций проведено генотипирование особей с использованием четырех ISSR-праймеров. Всего интерпретировано 47 ампликонов у сигана и 49 – у герреса. Количество ампликонов по разным праймерам варьировало от 7 до 16 у темного сигана и от 6 до 13 у низкотелого герреса. Количество полиморфных ампликонов изменялось от 2 до 13 в зависимости от применяемого праймера. Как качественные, так и количественные (частотные) характеристики паттернов у исследованных видов существенно различались. Доля полиморфных локусов составляла 32.8% у сигана и 56.9% у герреса; генетическое разнообразие Неи (h) составляло 0.14 и 0.23, наблюдаемое число аллелей на локус (na) – 1.3 и 1.6, эффективное (ne) – 1.2 и 1.4 у S. fuscescens и G. oblongus соответственно.
ОБСУЖДЕНИЕ
Цито-гистологический анализ выявил в жабрах всех исследованных особей темного сигана и низкотелого герреса многочисленные патологии, которые свидетельствовали о значительном угнетении респираторной системы или даже прекращении ее функционирования в отдельных участках. Известно, что жаберный аппарат наиболее чувствителен к загрязнению. Ранее подобные патологии были отмечены в жаберном аппарате черноморской скорпены (Scorpaena porcus Linnaeus, 1758) из загрязненных вод севастопольских бухт (Селюков и др., 2018). Нарушения в печени исследованных рыб регистрировали реже и у меньшего числа особей. Причинами выявленных гистопатологий могли стать цианиды, арсениды и другие токсиканты, в значительном количестве встречающиеся в водах архипелага (Todd et al., 2010; Abreo, 2018).
Согласно результатам генетических исследований, оценки ISSR-полиморфизма оказались довольно низкими для этих широкоареальных морских видов, а также для использованного типа генетических маркеров, для которого полиморфность достигает 80–100%, а генетическое разнообразие – 0.32. Кроме того, оценки оказались существенно ниже, чем для многих изученных нами ранее пресноводных рыб (Zhigileva et al., 2013; 2017).
Несмотря на эволюционную молодость и незавершенность видообразования сиганов, полученные данные указывают на довольно низкое генетическое разнообразие у этих рыб, особенно у S. fuscescens. Исследователи, изучавшие генетический полиморфизм темного сигана с использованием микросателлитных маркеров (Ravago-Gotanco, Juinio-Meñez, 2010), выявили у этого вида уровни полиморфизма от умеренного до высокого, с 5–28 аллелями на локус и наблюдаемую гетерозиготность (HOBS) в диапазоне от 0.111 до 0.921. По аллозимным данным, у данного вида также выявлены высокие уровни HOBS = 0.085 (Magsino, Juinio-Meñez, 2008), однако авторы отметили значительную генетическую структуризацию среди популяций как в разных регионах, так и внутри одного из них, при этом более низкая генетическая изменчивость наблюдалась в районах с нарушением среды обитания, влияющим на смертность личинок и успех пополнения. В частности, значительное влияние на уровень полиморфизма и генетическую структуру популяций темного сигана в регионе могут оказывать тайфуны и критическое падение температуры (Magsino, Juinio-Meñez, 2008; Hsu, Gwo, 2017).
При сопоставимых объемах выборок и числе изученных ампликонов уровень генетического полиморфизма у G. oblongus был в 1.6 раза выше, чем у S. fuscescens, что согласуется с данными о более широкой экологической толерантности первого вида и свидетельствует о его большем потенциале к изменчивости. Сравнение с популяциями близкородственного симпатрического вида S. argenteus выявило бóльшую уязвимость S. fuscescens (Magsino, Juinio-Meñez, 2008); авторы связывают это с особенностями размножения темного сигана, в частности, с пелагическим способом откладки икры и длительной пелагической личиночной стадией.
Таким образом, сублитораль о-ва Малапаскуа – широко известного туристического и дайвинг-центра – можно характеризовать как зону экологического неблагополучия, где даже молодые особи тропических прибрежных видов рыб обладают набором патологий некоторых органов. В других регионах подобные патологии не всегда присутствуют даже у рыб старшего возраста. Сокращение генетического разнообразия, сильно выраженное у S. fuscescens, может быть следствием массовой гибели икры и личинок в прибрежной зоне. Полученные результаты позволяют говорить о негативном прогнозе жизнеспособности популяций изученных видов рыб у побережья о-ва Малапаскуа.
Список литературы
Микодина Е.В., Седова М.А., Чмилевский Д.А. и др. Гистология для ихтиологов: опыт и советы. М.: ВНИРО. 2009. 112 с.
Руднева И.И., Залевская И.Н. Личинки атерины (Athe-rina hepsetus L.) как биоиндикаторы загрязнения прибрежных акваторий Черного моря // Экология. 2004. № 2. С. 107−111.
Селюков А.Г., Чернов В.С., Жуков Г.В. и др. Гистопатологические изменения жаберного аппарата черноморской скорпены Scorpaena porcus как индикатора состояния прибрежных морских вод // Загрязнение морской среды: экологический мониторинг, биоиндикация, нормирование. Материалы Всерос. науч. конф. с междунар. участием, посвящ. 125-летию проф. В.А. Водяницкого, г. Севастополь, 28 мая–01 июня 2018. Севастополь: Колорит. 2018. С. 228–233.
Abreo N.A.S. Marine plastics in the Philippines: a call for research // Philipp. Science Lett. 2018. V. 11. № 1. P. 18–19.
Alcala A.C., Bucol A.A., Bucol L.A. et al. Microplastics in the mottled rabbitfish (Siganus fuscescens) in Negros Oriental, Philippines with notes on the siganid fishery // Silliman J. 2020. V. 61. № 1. P. 19–36.
Bender W., Spiere P., Hogness D.S. Chromosomal walking and jumping to isolate DNA from Ace and rosy loci of bithorax complex in Drosophila melanogaster // J. Mol. Biol. 1983. V. 168. P. 17–33.
Brooks X., Cribb T.H., Yong R.Q.Y., Cutmore S.C. A re-eva-luation of diversity of the Aporocotylidae Odhner, 1912 in Siganus fuscescens (Houttuyn) (Perciformes: Siganidae) and associated species // Syst. Parasitol. 2017. V. 94. P. 717–737.
Cuvin-Aralar M.L.A., Ricafort C.H., Salvacion A. An overview of agricultural pollution in the Philippines: The fisheries sector. Prepared for the World Bank. Washington, D.C. 2016. 79 p.
Hsu T.H., Gwo J.C. Fine-scale genetic structure of rabbitfish, Siganus fuscescens, in Penghu Archipelago following a mass mortality event caused by extreme cold winter weather // Genes Genomics. 2017. V. 39. P. 645–652.
Kuriiwa K., Hanzawa N., Yoshino T. et al. Phylogenetic relationships and natural hybridization in rabbitfishes (Teleostei: Siganidae) inferred from mitochondrial and nuclear DNA analyses // Mol. Phylogenet. Evol. 2007. V. 45. № 1. P. 69–80.
Magsino R.M., Juinio-Meñez M.A. The influence of contrasting life history traits and oceanic processes on genetic structuring of rabbitfish populations Siganus argenteus and Siganus fuscescens along the eastern Philippine coasts // Mar. Biol. 2008. V. 154. P. 519–532.
Nei M. Analysis of gene diversity in subdivided populations // Proc. Natl. Acad. Sci. U.S.A. 1973. V. 70. № 12. P. 3321–3323.
Ong L.T.J., Storey D., Minnery J. Beyond the beach: balan-cing environmental and socio-cultural sustainability in Boracay, the Philippines // Tourism Geogr. 2011. V. 13. № 4. P. 549–569.
Ravago-Gotanco R., de la Cruz T.L., Pante M.J., Borsa P. Cryptic genetic diversity in the mottled rabbitfish Si-ganus fuscescens with mitochondrial introgression at a contact zone in the South China Sea // PLoS One. 2018. V. 13. № 2. Art. ID e0193220.
Ravago-Gotanco R., Juinio-Meñez M.A. Phylogeography of the mottled spinefoot Siganus fuscescens: Pleistocene divergence and limited genetic connectivity across the Philippine archipelago // Mol. Ecol. 2010. V. 19. № 20. P. 4520–4534.
Reichardt W., McGlone M.L.S.D., Jacinto G.S. Organic pollution and its impact on the microbiology of coastal marine environments: a Philippine perspective // Asian J. Water, Environ. Pollut. 2007. V. 4. P. 1–9.
Todd P.A., Ong X., Chou L.M. Impacts of pollution on marine life in Southeast Asia // Biodiversity Conserv. 2010. № 19. P. 1063−1082.
Yeh F.C., Yang R., Boyle T. POPGENE version 1.31: based freeware Microsoft Window − for population genetic analysis. University of Alberta and Centre for International Forestry Research. 1999.
Yeragi S.S., Yeragi S.G. Gonado-somatic index of Gerres oblongus (Cuvier) from Mithbav estuary, Sindhudurg district, Maharashtra, India // Int. J. Life Sci. 2015. V. 3. № 4. P. 375–378.
Zhigileva O.N., Baranova O.G., Pozhidaev V.V. et al. Comparative analysis of using isozyme and Issr-Pcr markers for population differentiation of cyprinid fish // Turk. J. Fish. Aquat. Sci. 2013. V. 13. P. 159–168.
Zhigileva O.N., Kultysheva M.E., Svatov A.Yu., Urupina M.V. Genetic diversity in populations of silver crucian carp Carassius auratus gibelio (Cyprinidae, Cypriniformes), depending on the type of reproduction and reservoir size // Biol. Bull. 2017. V. 44. № 10. P. 1278–1283.
Дополнительные материалы отсутствуют.


