Биология моря, 2022, T. 48, № 6, стр. 388-396
Динамика репродуктивных характеристик у самок северного морского котика Callorhinus ursinus (Linnaeus, 1758) острова Тюлений на фоне активного промысла самцов
О. Л. Жданова 1, *, А. Е. Кузин 2, Е. Я. Фрисман 3
1 Институт автоматики и процессов управления ДВО РАН
690041 Владивосток, Россия
2 Тихоокеанский филиал ФГБНУ “ВНИРО” (“ТИНРО”)
690950 Владивосток, Россия
3 Институт комплексного анализа региональных проблем
679016 Биробиджан, Россия
* E-mail: axanka@iacp.dvo.ru
Поступила в редакцию 19.04.2022
После доработки 18.07.2022
Принята к публикации 06.10.2022
- EDN: DZWSLM
- DOI: 10.31857/S013434752206016X
Аннотация
На основе данных о физиологическом состоянии добытых Японией и СССР в западной части Тихого океана и Охотском море в 1958–1980 гг. самок северного морского котика о-ва Тюлений проанализирована динамика их репродуктивных характеристик. Проведено сравнение динамики репродуктивных характеристик самок популяции о-ва Тюлений, где коммерческий наземный промысел самок практически отсутствовал, и самок популяций островов Прибылова, где применялась экспериментальная стратегия изъятия самок наряду с промыслом самцов. Показано, что, несмотря на значительную разницу в стратегиях промысла морских котиков, репродуктивные характеристики у самок этих популяций в период интенсивного изъятия демонстрировали похожую динамику: увеличение возраста первых родов и снижение доли беременных среди молодых самок. В популяции о-ва Тюлений наиболее вероятной причиной этой негативной тенденции, очевидно, был дефицит молодых секачей и полусекачей, возникший в результате интенсивного изъятия самцов.
В 1957 г. Канада, СССР, США и Япония заключили Международную конвенцию по сохранению северного морского котика (Interim Convention on Conservation of North Pacific Fur Seals), которая строго регламентировала промысел животных и предполагала проведение масштабных наблюдений, включающих сбор значительного объема биологической информации по данному виду морских млекопитающих.
В популяциях северного морского котика Callorhinus ursinus, лежбища которого расположены на островах Прибылова (Аляска), сосредоточены наибольшие запасы этих животных. Даже в период действия конвенции данные популяции подвергались значительному промысловому давлению, а с 1956 по 1968 г. на островах Прибылова помимо постоянного изъятия неполовозрелых самцов добывали и самок этого вида. Всего было выбито около 315 тыс. самок (Summary of northern…, 1980а). Предполагали, что в результате повысится продуктивность стада северных морских котиков. На основе теоретических расчетов (Chapman, 1961; Nagasaki, 1961) ожидалось, что из-за снижения плотности популяции увеличится количество беременностей и снизится возраст первых родов у самок. Как следствие, возрастет количество новорожденных щенков, что в дальнейшем позволит увеличить допустимый объем промыслового изъятия неполовозрелых самцов. Однако ожидаемого увеличения рождаемости в этих популяциях не произошло, более того, ежегодное количество новорожденных щенков продолжало снижаться. Вопреки ожиданиям, снизилась и доля беременных самок, а также увеличился возраст первых родов. Это убедительно показал анализ данных (Trites, York, 1993), полученных при исследовании более чем 10 тыс. самок северного морского котика, добытых в море (в северной части Тихого океана от Калифорнии до Берингова моря) Канадой и США в рамках программы пелагических исследований с 1958 по 1974 г. (Summary of northern…, 1980a).
Благодаря программе пелагических исследований, мы имеем аналогичный набор данных (пелагическую базу данных), характеризующих физиологическое состояние самок северного морского котика, лежбища которого находятся на о-ве Тюлений, расположенном в юго-западной части Охотского моря южнее мыса Терпения (о-в Сахалин). Было исследовано более 11 тыс. самок, добытых Японией и СССР в западной части Тихого океана и Охотском море в 1958–1980 гг. Результаты представлены в отчетах сотрудников ТИНРО и его отделений за 1958–1980 гг., которые хранятся в архиве института, а также в материалах, опубликованных штаб-квартирой Комиссии по морским котикам северной части Тихого океана (Summary of northern… 1980b). Эти данные позволяют сравнить тенденции развития популяций Callorhinus ursinus о-ва Тюлений и островов Прибылова.
Отметим, что на фоне продолжительного регламентируемого промысла самцов на о-ве Тюлений численность этой популяции начала снижаться (Кузин, 2010, 2014а), как и численность других популяций, подверженных такому промыслу (Корнев и др., 2008; Болтнев, 2011; Lee et al., 2014). Вместе с тем после сокращения промысла самцов, а также его запрета в популяции о-ва Тюлений не отмечено заметных темпов восстановления (Zhdanova et al., 2017).
В результате проведенного ранее детального изучения динамики численности самцов популяции о-ва Тюлений не выявлена причина снижения рождаемости. Темпы роста этой популяции значительно снизились в постпромысловый период, что проявилось в значительном снижении среднего количества новорожденных щенков, приходящихся на одного секача, на фоне увеличения средней выживаемости самцов практически всех возрастных групп (Zhdanova et al., 2017). Такие процессы могут быть связаны с изменением “качества” самцов в результате промысла, в течение длительного времени изымавшего самцов данной популяции (Фрисман и др., 2019). Однако рождаемость в популяции определяется не только активностью и качеством самцов, но и состоянием самок репродуктивного возраста. Поэтому для адекватной оценки процессов, происходящих в популяции, необходимо иметь представление о состоянии ее женской части.
Цель настоящей работы – на основе существующей пелагической базы данных проанализировать динамику репродуктивных характеристик у самок северного морского котика популяции о-ва Тюлений и сравнить полученные результаты с данными, полученными для популяций островов Прибылова. В частности, оценить изменение в течение периода наблюдений доли повторнородящих самок ранних возрастов, а также среднего возраста первых родов, дополнив исследование оценками показателей беременности самок, попавших в выборку (т.е. добытых в западной части Тихого океана и в Охотском море).
Коммерческий наземный промысел самок в популяции о-ва Тюлений практически отсутствовал, поэтому сравнение изменений репродуктивных характеристик у самок этой популяции и популяций островов Прибылова позволит сопоставить последствия разных стратегий промысла и понять, насколько стратегия изъятия только самцов (практикуемая в популяции о-ва Тюлений) выигрывает в плане сохранения репродуктивных возможностей популяции по сравнению с экспериментальной стратегией промысла самцов и самок, которая применялась в эти же годы в популяциях островов Прибылова.
МАТЕРИАЛ И МЕТОДИКА
Физиологическое состояние самок в морских пробах
Для анализа использовали набор данных, характеризующих физиологическое состояние самок северного морского котика популяции о-ва Тюлений, добытых Японией и СССР в западной части Тихого океана и Охотском море в 1958–1980 гг. в рамках Международной конвенции. Репродуктивные органы самок морских котиков, добытых в море с научно-исследовательскими целями, подвергали полному биологическому анализу. По результатам анализа самок делили на нерожавших (никогда не были оплодотворены), первородящих (беременных только один раз, независимо от того, была ли беременность доношенной) и повторнородящих (беременных более одного раза); кроме этого определяли возраст самки и наличие беременности в текущий момент. Объем выборки составлял 8449 самок в возрасте от одного года до 10 лет и 2875 самок старше 10 лет; в качестве примера приведены данные за 1958–1960 гг. (табл. 1).
Таблица 1.
Физиологическое состояние самок северного морского котика разного возраста, добытых в западной части Тихого океана и Охотском море в 1958–1960 гг.
| Возраст (лет) | 1958 г. | 1959 г. | 1960 г. | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Н/б | Б | Н/б | Б | H/б | Б | ||||||||||
| N | P | M | P | M | N | P | M | P | M | N | P | M | P | M | |
| 1 | 9 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 4 | 0 | 0 | 0 | 0 |
| 2 | 33 | 0 | 0 | 0 | 0 | 60 | 0 | 0 | 0 | 0 | 33 | 0 | 0 | 0 | 0 |
| 3 | 79 | 0 | 0 | 0 | 0 | 90 | 0 | 0 | 4 | 0 | 56 | 0 | 0 | 0 | 0 |
| 4 | 37 | 0 | 1 | 16 | 3 | 61 | 2 | 0 | 49 | 16 | 36 | 0 | 0 | 18 | 2 |
| 5 | 3 | 1 | 2 | 11 | 9 | 17 | 0 | 2 | 40 | 28 | 4 | 6 | 2 | 24 | 13 |
| 6 | 0 | 0 | 0 | 1 | 13 | 3 | 1 | 1 | 22 | 37 | 2 | 1 | 3 | 10 | 32 |
| 7 | 0 | 0 | 0 | 0 | 3 | 2 | 0 | 1 | 7 | 17 | 0 | 0 | 4 | 3 | 32 |
| 8 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 6 | 11 | 0 | 0 | 1 | 0 | 26 |
| 9 | 0 | 0 | 1 | 0 | 2 | 1 | 0 | 2 | 1 | 8 | 0 | 0 | 0 | 0 | 11 |
| 10 | 0 | 0 | 0 | 0 | 2 | 2 | 3 | 3 | 1 | 23 | 1 | 0 | 0 | 0 | 2 |
| 10+ | 2 | 0 | 1 | 0 | 3 | 0 | 0 | 3 | 0 | 27 | 0 | 0 | 3 | 0 | 36 |
Оценка доли беременных и повторнородящих самок в зависимости от возраста
Для оценки возраста, в котором самки исследуемой популяции активно вступают в размножение, использовали данные о физиологическом состоянии самок, добытых в море (табл. 1). Для каждого возраста (a) определяли долю беременных самок (λa), долю самок, не имевших беременности (s0,a), а также имевших беременность один раз (s1,a) и более одного раза (sm,a):
(1)
$\begin{gathered} {{\lambda }_{a}} = {{{{N}_{{pr,a}}}} \mathord{\left/ {\vphantom {{{{N}_{{pr,a}}}} {{{N}_{a}}}}} \right. \kern-0em} {{{N}_{a}}}};\,\,\,\,{{s}_{{0,a}}} = {{{{N}_{{0,a}}}} \mathord{\left/ {\vphantom {{{{N}_{{0,a}}}} {{{N}_{a}}}}} \right. \kern-0em} {{{N}_{a}}}}; \\ {{s}_{{1,a}}} = {{{{N}_{{1,a}}}} \mathord{\left/ {\vphantom {{{{N}_{{1,a}}}} {{{N}_{a}}}}} \right. \kern-0em} {{{N}_{a}}}};\,\,\,{{s}_{{m,a}}} = {{{{N}_{{m,a}}}} \mathord{\left/ {\vphantom {{{{N}_{{m,a}}}} {{{N}_{a}}}}} \right. \kern-0em} {{{N}_{a}}}}, \\ \end{gathered} $Для расчета доверительных интервалов использовалась асимптотика (поскольку объемы выборок достаточно велики, а минимальные частоты не слишком низкие, оценки λ можно считать приблизительно нормально-распределенными): $\lambda \pm {{\sigma }_{\lambda }}{{t}_{\beta }}$, где ${{\sigma }_{\lambda }} = \sqrt {{{\lambda (1 - \lambda )} \mathord{\left/ {\vphantom {{\lambda (1 - \lambda )} n}} \right. \kern-0em} n}} $ – стандартная ошибка, а ${{t}_{\beta }}$ – значение обратной функции нормального распределения при заданном уровне значимости β и количестве наблюдений n.
Динамика доли беременных и повторнородящих самок на фоне снижения численности секачей и в начальный период ее восстановления
Для расчета долей беременных самок для конкретного года t формулы (1) модифицировали следующим образом:
Наблюдения 1973, 1977 и 1979 гг. исключены из расчетов данных показателей, так как выборки этих лет содержат крайне малое количество самок в возрасте от одного года до 10 лет: соответственно 36, 17 и 35 особей.
Средний возраст первых родов самок для каждого года наблюдений оценивали по методу, предложенному ранее (Trites, York, 1993):
(2)
$\bar {A}(t) = {{\sum\limits_{a = 1}^{10} {a \cdot p_{{a,t}}^{'}} } \mathord{\left/ {\vphantom {{\sum\limits_{a = 1}^{10} {a \cdot p_{{a,t}}^{'}} } {\sum\limits_{a = 1}^{10} {p_{{a,t}}^{'}} }}} \right. \kern-0em} {\sum\limits_{a = 1}^{10} {p_{{a,t}}^{'}} }},$Оценку среднего возраста первых родов дополнили 95% доверительными интервалами, полученными с помощью бутстрепа методом процентилей на базе 10 000 псевдореплик (Efron, 1992; Davison, Hinkley, 2006; Шитиков, Розенберг, 2013).
РЕЗУЛЬТАТЫ
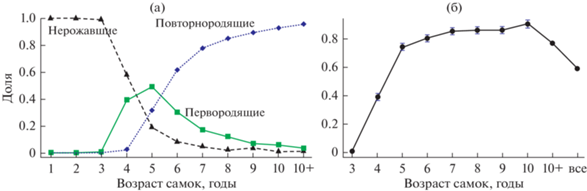
Анализ репродуктивных характеристик самок северного морского котика популяции о-ва Тюлений показал (рис. 1а), что к 4-му году немногие самки морских котиков популяции о-ва Тюлений имели более одной беременности, к 5-ти годам более 1/3 самок попали в категорию повторнородящих, а в 6–7 лет у большей части самок было несколько беременностей. Раннее вступление в размножение самок этой популяции подтверждают и доли беременных особей, рассчитанные отдельно для каждого возраста (рис. 1б). В частности, в выборке практически отсутствовали 3-летние беременные самки, доля беременных среди 4-летних самок достигала почти 0.4, а среди 5-летних превышала 0.7; у самок следующих возрастов она увеличивалась и была стабильно высокой, снижаясь лишь в смешанной группе, включавшей самок старше 10+ лет.
Рис. 1.
Соотношение долей нерожавших, первородящих и повторнородящих самок разных возрастов (а) и средняя доля беременных самок в разном возрасте (б) северного морского котика в популяции о-ва Тюлений в морских пробах 1958–1980 гг. Вертикальные отрезки − 95% доверительный интервал.
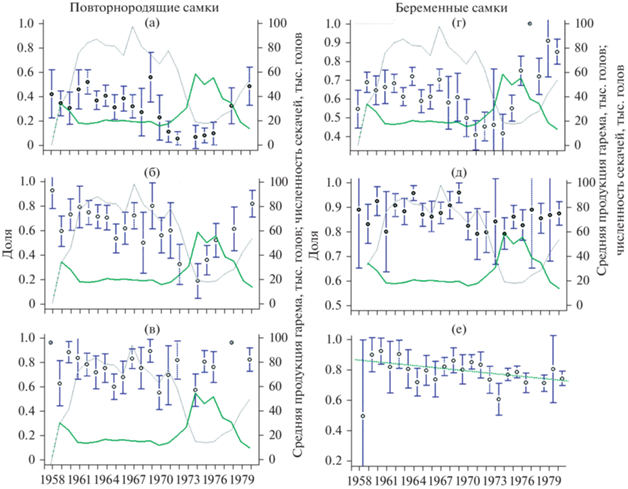
Большинство самок о-ва Тюлений становятся повторнородящими в среднем между пятью и семью годами (рис. 1а), поэтому в выборке 1958–1980 гг. проведен анализ изменения соотношений 5-, 6- и 7-летних повторнородящих самок. Чтобы выяснить, как изменялись доли беременных самок в популяции, самок объединили в группы по возрасту: молодые (4–6 лет), среднего (7–10 лет) и старшего (10+) возраста. У молодых самок ни один из представленных показателей не показал выраженного линейного тренда (рис. 2). Можно выделить лишь непродолжительные по времени периоды, напоминающие линейный убывающий тренд. Значительное снижение доли повторно беременных самок в популяции о-ва Тюлений наблюдалось в начале 1970-х гг. среди 5-летних самок; у 6-летних особей это снижение тоже заметно, однако оно менее продолжительное; далее в обеих возрастных группах произошел уверенный рост этого показателя. Среди 7-летних самок на протяжении всего периода наблюдений не обнаружено каких-либо выраженных тенденций изменения доли повторно беременных особей. Доля беременных молодых самок оставалась примерно на одном уровне до второй половины 1960-х гг., к началу 1970-х гг. она значительно снизилась, а со второй половины 1970-х гг. стала резко расти, причем к концу 1970-х гг. процент беременных молодых самок значительно превысил средние значения раннего периода наблюдений (до снижения). В средней возрастной группе (от 7 до 10 лет) снижение доли беременных самок заметно в начале 1970-х гг., далее отмечен небольшой рост, однако средние значения в конце периода наблюдений оставались немного ниже, чем в начале (до снижения). Единственный показатель, для которого можно отметить значимое, хотя и небольшое снижение в течение всего периода наблюдений, – это доля беременных самок в возрасте 11 лет и старше (взвешенная линейная регрессия с весами, обратно пропорциональными дисперсии наблюдений: p = 0.014, R2 = 0.23, F1,20 = 7.3).
Рис. 2.
Доли повторнородящих (а – 5-летние, б – 6-летние и в – 7-летние) и беременных (г – от 4 до 5 лет, д – от 7 до 10 лет, е – 11 лет и старше) самок северного морского котика о-ва Тюлений в выборке 1958–1980 гг. (вертикальные линии − 95% доверительные интервалы). Правая ось (а–д) – динамика средней продукции гарема (зеленая линия) и численность секачей в предыдущем году (серая линия). Для группы в возрасте 11 лет и старше график дополнен линией тренда (взвешенный метод наименьших квадратов), обозначенной зеленым пунктиром.
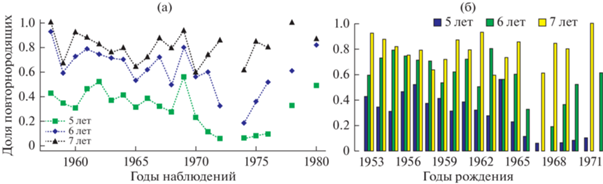
Рассматривая вопрос о репрезентативности имеющихся данных, сравним динамику доли повторных беременностей 5-, 6- и 7-летних самок (рис. 3а). Можно заметить, что в некоторые годы (у самок отдельного поколения) c возрастом данный показатель не увеличивается, а уменьшается, что выглядит неестественно (рис. 3б); такую тенденцию демонстрируют самки, рожденные в 1958 и 1963 гг. Возможными причинами этого помимо ошибок выборочности может быть высокая смертность беременных самок в отдельные годы.
Рис. 3.
Динамика доли повторнородящих самок северного морского котика в популяции о-ва Тюлений в возрасте от 5 до 7 лет в выборке 1958–1980 гг. по годам (а) и поколениям, рожденным в соответствующий год (б).
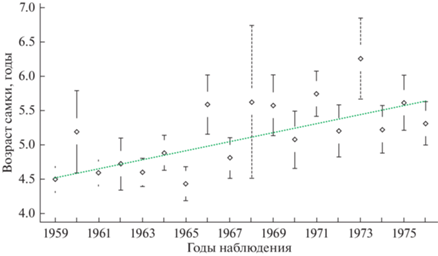
Отмечено некоторое увеличение возраста первых родов в течение периода наблюдения (рис. 4): взвешенная линейная регрессия с весами, обратно пропорциональными дисперсии наблюдений (p = 0.0005, R2 = 0.54, F1,16 = 18.68), показала значимый рост этого показателя. Тренд увеличения возраста первых родов в популяции о-ва Тюлений довольно сложный, визуально можно выделить несколько периодов с различающейся динамикой: первые 7 лет (1959–1965 гг.) показатель оставался примерно на одном уровне (<5), в 1966–1973 гг. наблюдались более высокие значения (около 5.5), в дальнейшем, по-видимому, произошло снижение, которое можно было ожидать, учитывая рост доли беременных и повторнородящих молодых самок (рис. 2). К сожалению, в 1977–1980 гг. наблюдения проводили через год, что не позволяет дать адекватную оценку параметра в этот период.
ОБСУЖДЕНИЕ
Сравнение динамики репродуктивных характеристик самок северного морского котика популяций о-ва Тюлений и островов Прибылова показало, что самки популяции о-ва Тюлений вступали в размножение в среднем на год раньше, чем самки популяций островов Прибылова. Это подтверждается более ранним переходом самок популяции о-ва Тюлений к статусу повторнородящих (рис. 1а). Кроме того, доли беременных самок данной популяции, рассчитанные отдельно для каждого возраста (рис. 1б), на год раньше достигали значений, сходных с отмеченными в популяциях животных островов Прибылова в этот же период времени (1958–1974 гг.) (Lander, 1981). Однако, несмотря на значительно различающуюся стратегию изъятия животных, в популяции морского котика о-ва Тюлений обнаружен ряд наблюдавшихся на фоне интенсивного промысла тенденций, сходных с таковыми в популяциях животных островов Прибылова в 1958–1974 гг.
Если ограничиться периодом от начала наблюдений до середины 1970-х гг., когда возможно сравнение процессов, одновременно происходивших в популяциях о-ва Тюлений и островов Прибылова, можно отметить снижение доли беременных молодых самок и увеличение возраста первых родов. В популяции о-ва Тюлений эти тенденции обусловлены значительным снижением в начале 1970-х гг. доли повторно беременных самок среди 5-летних особей. У 6-летних самок это снижение также присутствовало, хотя было менее продолжительным. Доля беременных молодых самок (от 4 до 6 лет) значительно снизилась к началу 1970-х гг. и оставалась на этом же уровне до второй половины 1970-х гг.; кроме того, в начале 1970-х гг. небольшое снижение доли беременных самок наблюдалось в средней возрастной группе (от 7 до 10 лет).
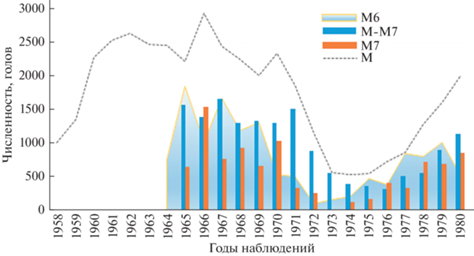
В конце 1960-х гг. численность секачей в популяции о-ва Тюлений начала снижаться, в 1973–1975 гг. достигла катастрофически низких значений и составляла менее 600 голов (Жданова и др., 2017). Затем на фоне резкого сокращения объемов промысла их численность стала восстанавливаться, однако только в 1978 г. превысила 1000 голов (рис. 5). Чтобы увидеть, насколько согласованы изменения рассматриваемых здесь репродуктивных характеристик самок и динамика секачей, значительно определяющаяся действием промысла, на графиках (рис. 2а–2д) мы привели кривую изменения численности секачей со сдвигом на один год (в предыдущий год), поскольку беременность самок текущего года – это результат предыдущего гаремного периода. Для более удобного масштабирования численность секачей разделена на 30 (таким образом, все значения попадают в интервал от 20 до 100 по правой оси). Здесь же приведена динамика средней продукции гарема – отношение количества новорожденных щенков текущего года к количеству секачей на лежбище в предыдущем году: P(n)/M(n − 1). Динамика этого показателя, на наш взгляд, более информативна, так как дает представление о минимальном количестве самок, которых в среднем должен был оплодотворить один секач в предыдущий сезон размножения, чтобы в текущем сезоне получить наблюдаемое количество новорожденных щенков. Учитывая наличие естественной смертности среди самок (в том числе беременных), настоящее количество оплодотворенных самок должно быть еще больше, а реальный средний размер гарема – больше пропорционально величине, обратной доле беременных самок. Интересно, что на представленных графиках (рис. 2а–2д) не видно четкого соответствия высоких и низких значений репродуктивных характеристик самок и количества самцов, а также оплодотворенных самок. Резкое снижение доли повторнородящих самок 5-летнего возраста (рис. 2а) началось еще при достаточно высокой численности секачей и небольшом среднем размере гарема. Небольшое увеличение количества секачей (после нескольких лет минимума их численности) привело к быстрому росту этого показателя. Снижение доли повторнородящих 6-летних самок было еще менее продолжительным, и рост этого показателя происходил при низкой численности секачей в довольно больших гаремах (рис. 2б).
Рис. 5.
Динамика наблюдаемой численности секачей (M) на лежбище о-ва Тюлений, а также расчетная численность полусекачей (M6 – самцов 6-летнего возраста), 7-летних секачей (M7) и секачей старшего возраста (M-M7) (по: Жданова и др., 2017).
Маловероятно, что изменения репродуктивных характеристик у самок были вызваны нехваткой пищи или плохим физическим состоянием самок. Анализ состояния запасов некоторых видов рыб, служащих основными объектами питания морского котика в Охотском море и у о-ва Хоккайдо (Yoshida et al., 1978; Шунтов, 1985), не позволяет сделать вывод о лимитировании его пищевых ресурсов в этом районе. Отсутствие подобного ограничения подтверждается и данными по межгодовой изменчивости длины и массы тела северного морского котика, а также его упитанности (Кузин, 2014б). И хотя к концу 1980-х гг. ресурсы минтая были значительно подорваны (Шунтов, 1985), у холостяков морских котиков наблюдалось увеличение кондиционного индекса, ростовые процессы животных в период депрессии численности морских котиков о-ва Тюлений увеличились. Увеличение размера тела самок северного морского котика отмечено и в популяциях островов Прибылова (Trites, York, 1993). Авторы этой работы в качестве наиболее вероятного объяснения изменений, наблюдавшихся между 1958 и 1974 гг., высказывают предположение об изменении соотношения полов и возраста половозрелых животных, вызванном истощением самок и/или изъятием молодых самцов.
Обширное исследование (Wade et al., 2007), направленное на изучение изменения пищевых цепочек в северной части Тихого океана, не подтвердило предположение о том, что северный морской котик стал добычей касаток. Таким образом, роль экзогенных факторов в выживаемости и, соответственно, в динамике численности популяций северного морского котика, вероятно, малозначима, что подтверждается не только выводами на основе анализа вышеприведенных факторов, но и уже имеющимися данными по выживаемости (Кузин, 2010).
В популяции морских котиков о-ва Тюлений отсутствует четкое соответствие динамики репродуктивных характеристик самок и количества самцов, а также оплодотворенных самок. Резкое снижение доли повторнородящих самок 5-летнего возраста началось еще при достаточно высоких значениях численности секачей и небольшом среднем размере гарема. Но небольшое увеличение количества секачей (после нескольких лет минимума их численности) привело к быстрому росту доли повторнородящих самок в возрасте 5 лет. Снижение доли повторнородящих 6-летних самок было еще менее продолжительным, а последующий рост этого показателя происходил при низкой численности секачей в довольно больших гаремах. Во второй половине 1970-х гг. наблюдался уверенный рост доли 5- и 6-летних повторнородящих самок, доля беременных молодых самок также увеличилась и к концу 1970-х гг. этот показатель значительно превысил средние значения раннего периода наблюдений (еще до его снижения). Единственный показатель, для которого можно отметить значимое, хотя и небольшое, снижение в течение всего периода наблюдений, – это доля беременных самок в возрасте 11 лет и старше.
Ранее было отмечено (Фаулер, 1998), что на общую скорость воспроизводства может повлиять изменение соотношения полов в результате изъятия неполовозрелых самцов, если в достаточном количестве нет молодых самцов для спаривания с молодыми самками, которые появляются на лежбищах поздно. Наблюдения за репродуктивным поведением самцов и самок северного морского котика показали (Gentry, Goebel, 1981), что течка у самок наступает спонтанно между 5- и 7-ми сут после родов и длится около 34 ч. Если самка не сможет спариться в это время, то в текущий сезон размножения такая возможность уже не повторится. Однако в зависимости от размеров самца течка может прекратиться в течение нескольких минут после совокупления, причем более мелкие самцы не так эффективны в этом процессе. Самки восприимчивы к самцам массой от 45 до 135 кг (старше пяти лет), а молодые самцы плодовиты и успешно оплодотворяют самок в конце сезона размножения, поэтому в период размножения соотношение полов и возрастно-половой состав имеют существенное значение для эффективности размножения.
Данные, опубликованные нами ранее (Жданова и др., 2018), позволяют предположить, что на фоне активного промысла в популяции о-ва Тюлений формировалась нехватка молодых секачей (M7) и полусекачей (M6) (рис. 5). Первыми их нехватку ощутили молодые самки. Позже, когда объем изъятия уменьшился и восстановление репродуктивной группировки самцов происходило преимущественно за счет молодых самцов, молодые самки стали вступать в размножение довольно рано.
Таким образом, проведенный нами анализ данных показал, что, несмотря на значительную разницу в стратегии промысла, динамика репродуктивных характеристик самок в популяциях морских котиков островов Прибылова и о-ва Тюлений схожа. В обеих популяциях увеличился возраст первых родов, а доля беременных молодых самок снизилась. Если, по мнению американских исследователей (Trites, York, 1993), в популяции морских котиков островов Прибылова эта негативная тенденция вызвана истощением самок и/или нехваткой молодых самцов, то в популяции о-ва Тюлений явно просматривается тенденция зависимости репродуктивных показателей самок от изменения половозрастного соотношения в результате избыточного изъятия самцов. Снижение промыслового пресса в популяции северного морского котика о-ва Тюлений довольно быстро привело к увеличению доли беременных самок среди молодых особей (снизился возраст первых родов). Однако самки старшей возрастной группы продолжили демонстрировать снижение репродуктивного уровня. Все это говорит об изменении половозрастной структуры и гаремных отношений в популяции в результате интенсивного промысла самцов. Продолжающаяся после 1980 г. депрессия популяции морских котиков о-ва Тюлений может быть результатом выявленных изменений структуры популяции.
Список литературы
Болтнев А.И. Северный морской котик Командорских островов. М.: ВНИРО. 2011. 264 с.
Жданова О.Л., Кузин А.Е., Фрисман Е.Я. Динамика выживаемости самцов северного морского котика (Callorhinus ursinus) острова Тюлений (Охотское море) по данным многолетних наблюдений // Зоол. журн. 2017. Т. 96. № 6. С. 720–739.
Жданова О.Л., Кузин А.Е., Фрисман Е.Я. Оценка ювенильной выживаемости самцов северного морского котика (Callorhinus ursinus): математическое моделирование и анализ данных // Математ. биол. и биоинформатика. 2018. Т. 13. № 2. С. 360–375. https://doi.org/10.17537/2018.13.360
Корнев С.И., Блохин И.А., Генералов А.А., Семеринов А.П. Исторический тренд командорской популяции северного морского котика за 50 лет (1958–2007 гг.) // Исслед. водных биол. ресурсов Камчатки и сев.-зап. части Тихого океана. 2008. № 11. С. 105–120.
Кузин А.Е. Интрапопуляционная структура северного морского котика острова Тюленьего в годы выхода из депрессии (1993–2009 гг.) // Изв. ТИНРО. 2010. Т. 161. С. 53‒67.
Кузин А.Е. Новые данные о численности морского котика (Callorhinus ursinus), сивуча (Eumetopias jubatus) и ларги (Phoca largha) на о. Тюленьем (Охотское море) // Изв. ТИНРО. 2014a. Т. 178. С. 87‒94.
Кузин А.Е. Северный морской котик. Владивосток: ТИНРО-центр. 2014б. 492 с.
Фаулер Ч. Северные морские котики на островах Прибылова // Северный морской котик: систематика, морфология, экология, поведение. М.: ИПЭЭ РАН. 1998. Ч. 2. С. 450–498.
Фрисман Е.Я., Жданова О.Л., Кузин А.Е. К чему привел промысел северного морского котика: результаты калибровки математических моделей по данным наблюдений (на примере популяции о-ва Тюлений) // Экология. 2019. № 2. С. 149–160.
Шитиков В.К., Розенберг Г.С. Рандомизация и бутстреп: статистический анализ в биологии и экологии с использованием R. Тольятти: Кассандра. 2013. 314 с.
Шунтов В.П. Биологические ресурсы Охотского моря. М.: Агропромиздат. 1985. 224 с.
Chapman D.G. Population dynamics of the Alaska fur seal herd // Trans. North Am. Wildl. Nat. Resour. Conf. 1961. V. 26. P. 356–369.
Davison A.C., Hinkley D.V. Bootstrap methods and their application. Cambridge: Cambridge University Press. 2006. 592 p.
Efron B. Bootstrap methods: another look at the jackknife // Breakthroughs in statistics. 1992. New York, NY: Springer. P. 569–593.
Interim Convention on Conservation of North Pacific Fur Seals. http://sedac.ciesin.columbia.edu/entri/texts/acrc /fur.seals.1957.html
Gentry R.L., Goebel M.E. Behavior and biology. Pribilof Islands // NOAA Technical Memorandum NMFS F/NWC-37 Fur Seal Investigations, 1981 Fur seal investigation. 1981. U.S. Dep. Commer. NOAA Tech. Memo. NMFS F/NWC-37. P. 27–33.
Lander R.H. A life table and biomass estimate for Alaskan fur seals // Fisheries Research. 1981. V. 1. P. 55−70.
Lee O.A., Burkanov V., Neill W.H. Population trends of northern fur seals (Callorhinus ursinus) from a metapopulation perspective // J. Exp. Mar. Biol. Ecol. 2014. V. 451. P. 25–34.
Nagasaki F. Population study on the fur seal herd // Spec. Publ. Tokai Fish. Lab. 1961. № 365. P. 60.
Summary of northern fur seal data and collection procedures. Vol. 2: Eastern Pacific pelagic data of the United States and Canada (excluding fur seals sighted). U.S. Dep. Commer. NOAA Tech. Memo. NMFS F/NWC-4. 1980a. 541 p. https://repository.library.noaa.gov/view/noaa/23306
Summary of northern fur seal data and collection procedures. V. 3: Western Pacific pelagic data of the Soviet Union and Japan, 1958–78 (excluding fur seals sighted) // Dep. Commer. NOAA Tech. Memo. NMFS F/NWC-4. 1980b. 304 p. https://repository.library.noaa.gov/view/noaa/5412/-noaa_5412_DS1.pdf
Trites A.W., York A.E. Unexpected changes in reproductive rates and mean age at first birth during the decline of the Pribilof northern fur seal (Callorhinus ursinus) // Can. J. Fish. Aquat. Sci. 1993. V. 50. № 4. P. 858–864. https://doi.org/10.1139/f93-098
Wade P.R., Burkanov V.N., Dahlheim M.E. et al. Killer whales and marine mammal trends in the North Pacific – a re-examination of evidence for sequential megafauna collapse and the prey-switching hypothesis // Mar. Mamm. Sci. 2007. V. 23. № 4. P. 766–802. https://doi.org/10.1111/j.1748-7692.2006.00093.x
Yoshida K., Okumoto N., Baba N. Japanese pelagic investigation of fur seas, 1977 // Far Seas Fish. Res. Lab. (Shimizu, Jpn.), Fur Seal Resour. Sect. 1978. 38 p.
Zhdanova O.L., Kuzin A.E., Skaletskaya E.I., Frisman E.Ya. Why the population of the northern fur seals (Callorhinus ursinus) of Tyuleniy Island does not recover following the harvest ban: analysis of 56 years of observation data // Ecol. Model. 2017. V. 363C. P. 57–67. https://doi.org/10.1016/j.ecolmodel.2017.08.027
Дополнительные материалы отсутствуют.