Биология моря, 2022, T. 48, № 6, стр. 369-379
Видовой состав и количественные характеристики сообщества микроводорослей морского льда в бухтах острова Русский (залив Петра Великого, Японское море)
Е. А. Юрикова 1, *, А. А. Бегун 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН (ННЦМБ)
690041 Владивосток, Россия
* E-mail: komcitykat@mail.ru
Поступила в редакцию 16.10.2021
После доработки 27.01.2022
Принята к публикации 24.03.2022
- EDN: LVFIIL
- DOI: 10.31857/S0134347522060158
Аннотация
Впервые для российского прибрежья Японского моря исследованы видовой состав и определены количественные характеристики сообщества микроводорослей морского льда. Идентифицировано 88 видов микроводорослей из 50 родов и 7 отделов; для водорослей отдела Bacillariophyta отмечено максимальное видовое богатство – 57–99% от общего числа видов. По количеству преобладали планктонные морские преимущественно ледово-неритические диатомовые водоросли Chaetoceros socialis f. radians, Detonula confervacea, Entomoneis gigantea var. decussata, Navicula granii, N. septentrionalis, Nitzschia frigida, Thalassiosira gravida и T. nordenskioeldii. Общая численность микроводорослей в 2020 г. в горизонтах льда в б. Новик варьировала от 23.8 до 68.6 кл/мл и в б. Воевода – от 21.1 до 1296.2 кл/мл; в 2021 г. численность микроводорослей в б. Новик изменялась от 1160.9 до 3296.9 кл/мл, а в б. Воевода – от 32.3 до 1607.5 кл/мл. Количественные характеристики ледовой альгофлоры двух акваторий о-ва Русский различались в зависимости от года исследования, акватории и слоя ледового керна.
Микроводоросли являются основным биологическим компонентом ледового покрова и важным источником пищи для организмов более высокой трофической ступени; в зимние сезоны они дают от 7.5 до 57% общей первичной продукции арктических морей (Gosselin et al., 1997; Dupont, 2012), а также влияют на физико-химические параметры льда (Мельников, 1989). Опубликованы результаты исследований отечественных и зарубежных авторов по альгофлоре льдов полярных регионов (Буйницкий, 1973; Мельников, 1989; Werner et al., 2007; Arrigo et al., 2014; Рябушко, 2016; Kauko et al., 2018). В данных работах приведен видовой состав, выделены доминирующие группы микроводорослей, отмечено их влияние на структуру льда, а также описаны предполагаемые механизмы попадания микроводорослей в лед и прикрепления их к нижней кромке льда аналогично прикреплению к субстрату у бентосных форм. Кроме этого рассмотрены биологические причины процесса приобретения льдом окраски разных оттенков в зависимости от присутствия разных групп микроводорослей и образования разломов в ледовом покрове в областях с их повышенной концентрацией.
Зал. Петра Великого Японского моря – одна из самых южных акваторий Северного полушария, на которой в течение нескольких месяцев формируется устойчивый ледовый покров. Исследования ледовой альгофлоры в данном регионе ограничены работой по изучению хлорофилла и первичной продукции микроводорослей (Кузнецов, 1980), а также сведениями о продукционных характеристиках льда в эстуарии р. Раздольная (Звалинский и др., 2010). Методические трудности пробоотбора, вероятно, стали причиной того, что ледовый биотоп в этой акватории не был охвачен альгологическими исследованиями, тогда как подледный фитопланктон изучен достаточно широко (Бегун и др., 2003, 2011; Пономарева, 2017; Шевченко и др., 2020).
В бухтах Воевода и Новик о-ва Русский проводились гидрологические, гидрохимические и экологические исследования (Мельниченко и др., 2014; Барабанщиков и др., 2015, 2018; Христофорова и др., 2016, 2017; Мельниченко и др., 2017; Бойченко и др., 2019). В б. Воевода были изучены заросли Zostera marina – важного источника формирования органического вещества акватории. После постройки кампуса Дальневосточного федерального университета (ДВФУ) экологическая обстановка в достаточно закрытой от внешних вод акватории б. Новик продолжает изменяться. Влияние предприятий марикультуры, находящихся в б. Воевода, и бытовых стоков кампуса ДВФУ в б. Новик представляет базу для ботанических и экологических исследований трансформаций морской биоты под антропогенным воздействием.
Цель настоящей работы – изучить видовой состав и количественные характеристики ледовой альгофлоры бухт Воевода и Новик о-ва Русский в зимние сезоны 2020 и 2021 гг.
МАТЕРИАЛ И МЕТОДИКА
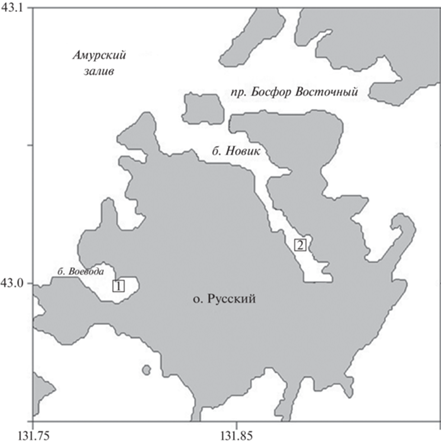
Исследования проводили в феврале 2020 и 2021 гг. в бухтах Воевода и Новик о-ва Русский (рис. 1). Метеорологические условия в периоды отбора проб характеризовались безоблачной погодой и температурой воздуха около −0.3°С. Лед, сформировавшийся за предыдущие 2–2.5 мес., отличался низкой прозрачностью в б. Воевода и высокой прозрачностью в б. Новик. Толщина ледового покрова в 2020 г. в б. Воевода составляла 44 см, в б. Новик – 38 см; в 2021 г. в б. Воевода – 62 см и в б. Новик – 64 см. Наличие снежного покрова было отмечено только в б. Воевода: в 2020 г. – около 10 см, в 2021 г. – около 3 см. В точках пробоотбора измеряли глубину до дна, которая в б. Воевода в 2020 г. составляла 3 м, в 2021 г. – около 2.5 м; в б. Новик в 2020 г. – 7 м, в 2021 г. – 7.5 м.
Для изучения ледовой альгофлоры были отобраны 4 керна льда (рис. 2) и 4 пробы подледной воды. Ледовые керны отбирали кольцевым буром диаметром 15 см; затем их распиливали ножовкой на шайбы длиной по 10 см, которые помещали в стерильные пластиковые контейнеры.
Пробы подледной воды отбирали из пробуренной лунки с поверхностного горизонта при помощи 5-литрового батометра Нискина. В лабораторных условиях образцы кернов растапливали при температуре около 24°С. Фиксировали пробы 5%-ным раствором йодистого калия в соотношении 2.5 мл фиксатора на 1 л пробы. Таким образом, учитывая толщину льда, из каждой бухты в 2020 г. получено по 4 пробы полного объема талой воды, а в 2021 г. – по 6 проб. Следуя методике осаждения Радченко (Радченко и др., 2010), через 12 сут избыток воды из каждой пробы сливали до 100–200 мл остатка.
Видовую идентификацию и подсчет количественных параметров микроводорослей проводили в Лаборатории морской микробиоты ННЦМБ ДВО РАН. При видовой идентификации микроводорослей использовали световой микроскоп “Olympus BX41”, объектив UPLanF1 100×/1/.30 (Япония). Видовой состав уточняли с помощью сканирующего электронного микроскопа (СЭМ) “Sigma 300 VP” (Великобритания). Клетки подсчитывали в камере “Сэдвик-Рафтер” (Sedgewick Rafter Counting cells) объемом 1 мл. Отделы микроводорослей приведены согласно системе классификации (Identifying marine…, 1997) с учетом номенклатурных изменений за последние 10 лет. К массовым относили доминирующие и субдоминирующие виды, численность которых составляла соответственно более 20% и от 5 до 20% от общей численности микроводорослей (Орлова и др., 2009).
Графики сходства ледовых горизонтов построены в программе Primer-e7 (Clarke, Warwick, 2001) с использованием метода неметрического многомерного шкалирования для ординации альгофлор на основании сходства обилия видов в разных слоях ледового покрова и в подледной воде. Перед проведением анализа исходную матрицу обилия видов предварительно трансформировали путем стандартизации по пробам и последующей логарифмизации. Мерой расстояния был избран уровень сходства Брея−Кертиса.
РЕЗУЛЬТАТЫ
В составе фитопланктона и ледовой альгофлоры в бухтах Воевода и Новик в 2020 и 2021 гг. идентифицировано 88 видов микроводорослей из 50 родов и 7 отделов: Ochrophyta (2 вида), Bacilla-riophyta (66 видов), Cryptophyta (1 вид), Dinophyta (14 видов), Chlorophyta (3 вида), Euglenophyta (1 вид) и Haptophyta (1 вид). Из них в кернах льда обнаружено 80 видов из 45 родов и 7 отделов.
В 2020 г. в исследованных бухтах идентифицировано 52 вида микроводорослей из 31 рода и 4 отделов, а в 2021 г. – 63 вида из 41 рода и 7 отделов (табл. 1).
Таблица 1.
Таксономический состав альгофлоры морского льда и подледного фитопланктона в двух бухтах острова Русский
| Отдел | Число видов | |||
|---|---|---|---|---|
| 2020 г. | 2021 г. | |||
| б. Воевода | б. Новик | б. Воевода | б. Новик | |
| Ochrophyta | 1 | 1 | 1 | 2 |
| Bacillariophyta | 26 | 26 | 42 | 31 |
| Cryptophyta | – | – | 1 | 1 |
| Dinophyta | 8 | 9 | 2 | 5 |
| Chlorophyta | – | – | 4 | 3 |
| Euglenophyta | – | 1 | 1 | 1 |
| Haptophyta | – | – | – | 1 |
| Число общих видов/коэффициент Серенсена | 21/0.57 | 32/0.68 | ||
| Преобладающие роды (число видов) | Protoperidinium (5), Navicula (3) | Nitzschia (5), Protoperidinium (4), Navicula (3) | Navicula (8) | Navicula (6) |
Диатомовые водоросли составляли основу ледового сообщества в обеих бухтах. Массовые виды (рис. 3) были представлены мелкоклеточными неидентифицированными видами рода Nitzschia (до 6767 кл./мл), а также Nitzschia frigida Grunow in Cleve & Grunow, 1880 (до 3963 кл./мл); Chaetoceros socialis f. radians (F. Schütt) Proshkina-Lavrenko 1963 (до 2478 кл./мл); Thalassiosira nordenskioeldii Cleve, 1873 (до 2470 кл./мл); Navicula septentrionalis Cleve, 1896 (до 1383 кл./мл); Entomoneis gigantea var. decussata (Grunow) Nizamuddin, 1982 (до 998 кл./мл) и Navicula granii (Jørgensen) Gran, 1908 (до 884 кл./мл).
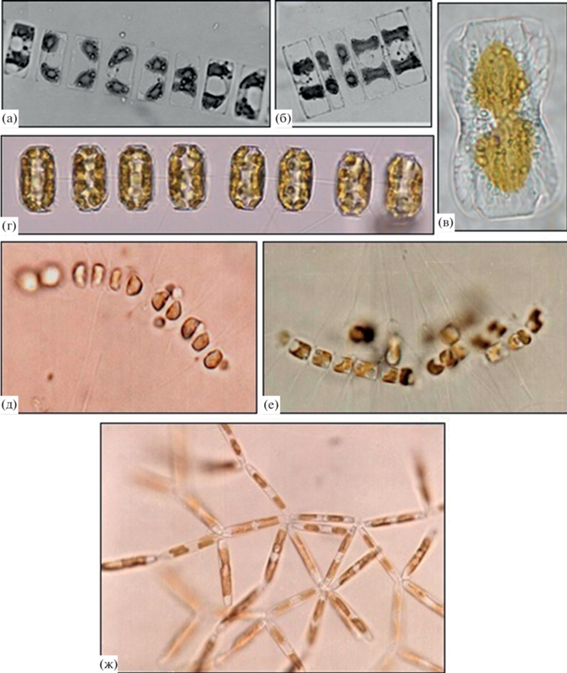
Рис. 3.
Внешний вид некоторых массовых видов микроводорослей: Navicula septentrionalis (а, б); Entomoneis gigantea var. decussata (в); Thalassiosira nordenskioeldii (г); Chaetoceros socialis f. radians (д, е) и Nitzschia frigida (ж).
В 2021 г. впервые для зал. Петра Великого в подледном фитопланктоне отмечено доминирование криптофитовой водоросли рода Plagioselmis, концентрация которой в б. Воевода достигала 4500 кл./мл или 67.6% от общей численности микроводорослей в биотопе, в б. Новик – 1714 кл./мл или 25.6% от общей численности.
В ледовой флоре количественно преобладали морские виды с примесью солоноватоводных, часть из них входит в группу ледово-неритических. Это диатомовые водоросли T. nordenskioeldii; T. gravida Cleve, 1896; N. frigida и Detonula confervacea (Cleve) Gran, 1900, а также виды родов Navicula и Pseudo-nitzschia.
Анализ распределения групп микроводорослей по горизонтам льда и в подледной воде показал, что в 2020 г. в б. Воевода максимальное количество клеток было сосредоточено в верхнем слое ледового керна (0–10 см) и постепенно снижалось по направлению к границе с подледной водой (рис. 4, 5). В то же время в б. Новик численность водорослей распределялась почти равномерно по всей толще льда. При этом численность ледовых микроводорослей в б. Новик была на порядок ниже, чем в б. Воевода, а в подледной воде, напротив, на порядок выше.
Рис. 4.
Общая численность (ОЧ) микроводорослей и доля представителей разных отделов по слоям льда и в подледной воде в двух бухтах о-ва Русский в 2020 г. *Над чертой − толщина льда в б. Воевода, под чертой – в б. Новик.
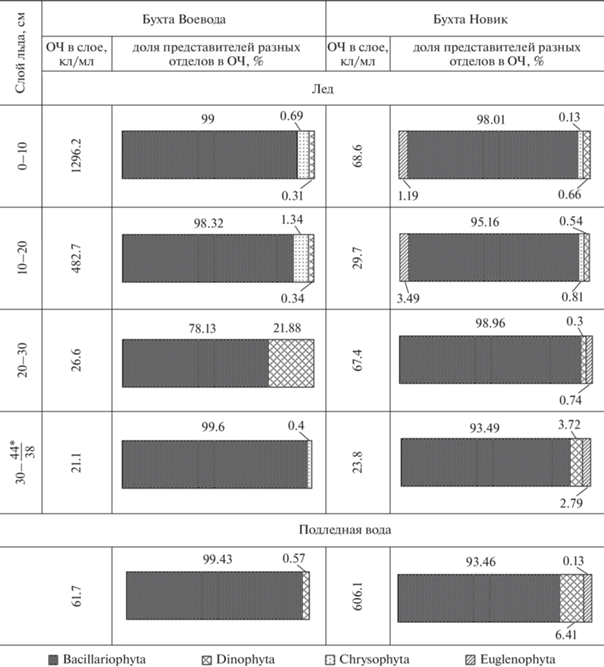
Рис. 5.
Общая численность (ОЧ) микроводорослей и доля представителей разных отделов по слоям льда и в подледной воде в двух бухтах о-ва Русский в 2021 г. *Над чертой − толщина льда в б. Воевода, под чертой – в б. Новик.
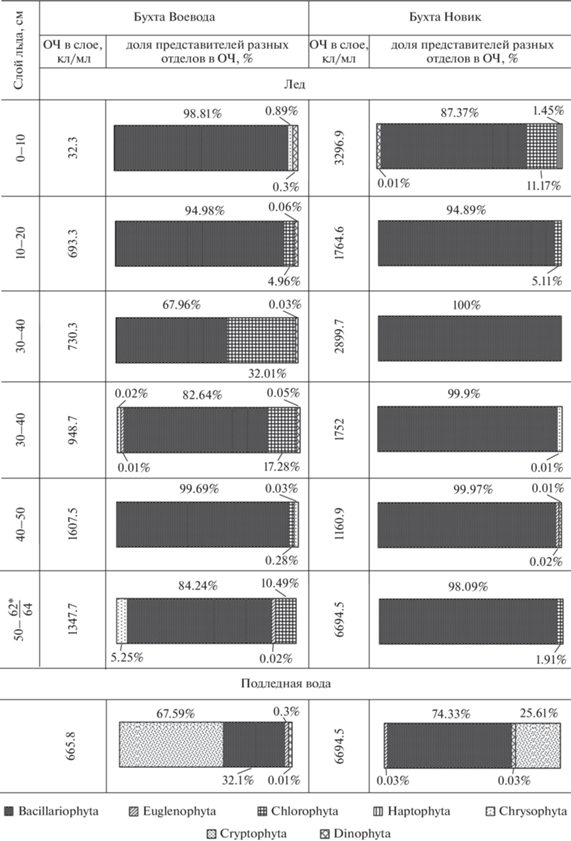
Состав основных групп микроводорослей в ледовых горизонтах и в подледной воде различался. Охрофитовые в б. Воевода были обильны преимущественно в верхних слоях льда (0–20 см), а в б. Новик – в подледном фитопланктоне. Максимальная концентрация динофитовых водорослей в б. Воевода зарегистрирована в среднем горизонте льда; в б. Новик динофитовые равномерно распределялись по всему ледовому керну, однако их максимальная концентрация зарегистрирована в подледной воде. Представители эвгленовых водорослей в 2020 г. были найдены только в б. Новик с наибольшей концентрацией в слое льда 10–20 см.
В 2021 г. в б. Воевода отмечена обратная закономерность – в верхних горизонтах льда численность клеток была минимальной, однако она возрастала с приближением к границе с подледной водой. Численность микроводорослей во льду по сравнению с таковой в предыдущий год была почти в 3 раза выше, а в фитопланктоне – выше на 3 порядка. В б. Новик максимум микроводорослей отмечен в верхнем слое льда, в остальных горизонтах их численность распределялась относительно равномерно. Количественное обилие микроводорослей во льду и в подледной воде в 2021 г. по сравнению с таковым в 2020 г. оказалось выше на порядок. В то же время в б. Воевода снизилась степень доминирования диатомовых водорослей на фоне массового развития зеленых водорослей во льду и криптофитовых в фитопланктоне. В б. Новик, напротив, доля диатомей в ледовом биотопе по сравнению с таковой в предыдущий год повысилась и достигала 100% в слое 20–30 см. Представители группы зеленых водорослей были найдены только во льду. В б. Воевода их наибольшая концентрация была отмечена в среднем горизонте 20–30 см, а в б. Новик – в верхних слоях. Гаптофитовые были найдены только в б. Новик в составе ледовой альгофлоры верхнего горизонта.
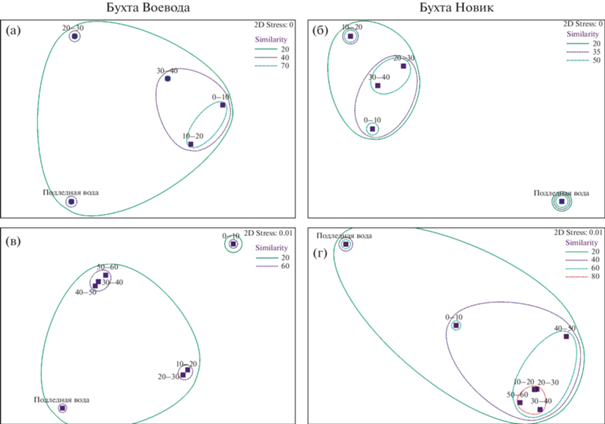
Статистический анализ послойного распределения альгофлоры в ледовых горизонтах и подледной воде показал существенные различия в уровнях сходства горизонтов между собой в зависимости от типа биотопа, а также от бухты и года исследования. В 2020 г. в б. Воевода наибольшее сходство (70%) показали два верхних слоя ледового покрова (рис. 6а), а в б. Новик – два нижних слоя (53%) (рис. 6б). В 2021 г. качественный и количественный состав ледовой альгофлоры в б. Воевода (рис. 6в) был сходным в трех нижних слоях (64%) и двух средних (61%), верхний горизонт оказался наиболее обособленным от остальных слоев (менее 20%). В 2021 г. в б. Новик (рис. 6г) наиболее высокий уровень сходства наблюдался между средними и нижними слоями льда (до 84%) из-за относительно высокого содержания диатомовых водорослей в данных слоях (рис. 5). Самым низким уровнем сходства (от 9 до 23%) во все периоды пробоотбора характеризовался фитопланктон подледной воды, очевидно, из-за различий гидролого-гидрохимических условий ледового и подледного биотопов.
ОБСУЖДЕНИЕ
Для ледовой альгофлоры бухт Воевода и Новик характерно преобладание диатомовых водорослей, определяющее сходство ее таксономической структуры, которое прослеживается и в наличии родов, преобладающих по числу видов, почти идентичных в обеих бухтах (табл. 1). В б. Новик в каждый из исследованных периодов отмечено большее количество групп микроводорослей. Однако число видов ледовых микроводорослей, которое в б. Воевода в 2020 г. было практически идентичным, в 2021 г. оказалось в 1.3 раза выше, чем в б. Новик. Вероятно, наблюдаемое сходство флор определяется достаточно близким географическим положением исследованных бухт, принадлежащих Амурскому заливу, и замкнутым типом циркуляции вод. Расположением бухт можно объяснить отмеченные различия в таксономической структуре ледовой альгофлоры. Бухта Новик глубоко врезается в остров, ее кутовая часть почти отделена от вод прол. Босфор Восточный и благодаря этому обладает высоким уровнем замкнутости экосистемы. Более открытая б. Воевода опресняется стоками р. Русская, поэтому в альгофлоре данной бухты могут чаще встречаться пресноводные виды, например, обнаруженные нами представители пресноводного рода Pinnularia.
В 2021 г. таксономический состав альгофлоры исследуемых бухт оказался богаче, чем в 2020 г. Это может быть связано с особенностями метеорологических условий, которые позволили сформировать ледовый покров большей толщины.
Большинство указанных доминирующих видов диатомовых водорослей альгофлоры морского льда бухт Воевода и Новик широко известны для подледного фитопланктона акваторий зал. Петра Великого Японского моря, развивающегося при отрицательной температуре воды и достигающего интенсивности зимнего или ранневесеннего “цветения” (Семина, 1974; Коновалова и др., 1989; Бегун и др., 2003, 2011; Орлова и др., 2009; Пономарева, 2017; Стоник, 2018; Рябушко и др., 2019; Шевченко и др., 2020). Доминирование этих видов отмечено также в большинстве работ по флористическому составу ледового покрова морей полярных регионов (Усачев, 1949; Буйницкий, 1973; Мельников, 1989; Kauko et al., 2018).
Массовые представители ледовой альгофлоры бухт о-ва Русский являются преимущественно планктонными видами. Однако среди немассовых видов значительную часть составляли бентосные и бенто-планктонные формы, из которых наиболее многочисленными были Navicula distans (W. Smith) Brébisson 1854, Tabularia tabulata (C. Agardh) Snoeijs 1992 и Parlibellus delognei (Van Heurck) E.J. Cox 1988. Их присутствие обусловлено мелководностью бухт и близостью донного биотопа. В результате турбулентного перемешивания вод и поднятия к поверхности воды бентосные виды способны прикрепляться к нижней части ледового покрова как к субстрату, выступая в роли криоперифитона (Буйницкий, 1973; Мельников, Бондарчук, 1987; Ewert, Deming, 2013). В составе ледовой альгофлоры бухт о-ва Русский планктонные микроводоросли были представлены как центрическими, так и пеннатными формами, что характерно и для подледного фитопланктона акваторий зал. Петра Великого (Бегун и др., 2011; Пономарева, 2017; Шевченко и др., 2020).
Известно, что в результате турбулентного перемешивания вод пелагиали клетки микроводорослей включаются в морской лед в процессе его формирования (Kauko et al., 2018). Однако, по мнению некоторых исследователей (Ratkova, Wassmann, 2005; Olsen et al., 2017), бентос, в том числе обитатели донных грунтов, также являются источником пополнения ледового биотопа альгофлорой. Одни авторы считают, что по мере формирования молодого льда центрических диатомовых водорослей становится больше, чем пеннатных (Okolodkov, 1992; Niemi et al., 2011) и динофитовых (Galindo et al., 2017; Campbell et al., 2018). По мнению других авторов, преобладание пеннатных диатомей является основной стадией сукцессии во время “цветения” ледовой флоры (Leu et al., 2015; van Leeuwe et al., 2018).
Исследование сформировавшегося за 2–2.5 мес. морского льда бухт о-ва Русский показало, что максимальное количественное обилие ледовой альгофлоры было представлено преимущественно микроводорослями планктонного биотопа. Это обусловлено тем, что во время закономерного для зимнего сезона массового развития подледного фитопланктона массовые виды способны с большей или меньшей интенсивностью включаться в состав ледового биотопа при формировании морского льда. Данная интенсивность связана с рядом сложных метеорологических и гидрохимических событий, происходящих в акватории в момент льдообразования, что находит отражение в различии количественного обилия микроводорослей в каждом слое ледового покрова.
Таким образом, впервые в российском прибрежье Японского моря проведено исследование видового состава и количественных характеристик сообщества микроводорослей морского льда, которое дополняет опубликованные данные о флористическом составе акваторий зал. Петра Великого и позволяет планировать проведение дальнейших работ по изучению льда как биотопа c уникальными экологическими условиями. Установлено, что видовой состав альгофлоры морского льда акваторий о-ва Русский достаточно разнообразен; определены сравнительно высокие количественные показатели микроводорослей, характеризующие преимущественно планктонные ледово-неритические виды. Видовые и количественные особенности альгофлоры зависели от морфологии бухты и метеорологических условий года наблюдения. Флористический состав б. Воевода по сравнению с таковым более закрытой б. Новик в целом характеризовался большим количеством видов, но меньшим числом групп микроводорослей. При этом количественные характеристики в ледовом биотопе, по-видимому, в большей степени зависели от метеорологических условий конкретного года, что отражается в резком различии численности микроводорослей в бухтах, которая в 2020 г. была больше в б. Воевода, а в 2021 г. – в б. Новик. Кроме этого, прослеживались различия в послойном распределении массовых видов микроводорослей и в их количественном обилии, составлявшие иногда более одного порядка величин в зависимости от конкретного ледового горизонта. В б. Воевода эта дифференциация была значительной, в то время как в б. Новик она прослеживалась слабо, что позволяет сделать вывод о высоком влиянии особенностей расположения акваторий и сложившейся экологической обстановки на формирование ледового биотопа.
Список литературы
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю. и др. Сезонные гидролого-гидрохимические исследования бухты Воевода (Амурский залив, Японское море) // Изв. ТИНРО. 2015. Т. 180. С. 161–178.
Барабанщиков Ю.А., Тищенко П.Я., Семкин П.Ю. и др. Условия образования лечебных грязей в бухте Воевода (Амурский залив, Японское море) // Изв. ТИНРО. 2018. Т. 192. С. 167–176.
Бегун А.А., Орлова Т.Ю., Звягинцев А.Ю. Фитопланктон Амурского залива Японского моря в районе г. Владивостока // Альгология. 2003. Т. 13. № 2. С. 204–215.
Бегун А.А., Звягинцев А.Ю., Масленников С.И. Фитопланктон в районе очистных сооружений г. Владивостока (Амурский залив, Японское море) // Науч. тр. Дальрыбвтуза. 2011. Т. 24. С. 3–12.
Бойченко Т.В., Христофорова Н.К., Емельянов А.А. Микробная индикация загрязнения поверхностных вод бухты Новик (остров Русский, зал. Петра Великого, Японское море) // Изв. ТИНРО. 2019. Т. 198. С. 186–194.
Буйницкий В.Х. Морские льды и айсберги Антарктики. Изд-во ЛГУ. 1973. 256 с.
Звалинский В.И., Марьяш А.А., Стоник И.В. и др. Продукционные и гидрохимические характеристики льда, подледной воды и донных осадков эстуария реки Раздольной (Амурский залив, Японское море) в период ледостава // Биол. моря. 2010. Т. 36. № 3. С. 186–195.
Коновалова Г.В., Орлова Т.Ю., Паутова Л.А. Атлас морского фитопланктона Японского моря. Л.: Наука. 1989. 160 с.
Кузнецов Л.Л. Хлорофиллы и первичная продукция микроводорослей, связанных со льдом Амурского залива Японского моря // Биол. моря. 1980. № 5. С. 72–74.
Мельников И.А. Экосистема арктического морского льда. М.: ИО АН СССР. 1989. 192 с.
Мельников И.А, Бондарчук Л.Л. К экологии массовых скоплений колониальных диатомовых водорослей под арктическим дрейфующим льдом // Океанология. 1987. Вып. 2. С. 317–321.
Мельниченко Н.А., Тювеев А.В., Лазарюк А.Ю. и др. Вертикальное распределение содержания рассола, температуры и солености в припайных льдах бухты Новик (о-в Русский) залива Петра Великого // Вестн. ДВО РАН. 2014. № 5. С. 32–38.
Мельниченко Н.А., Тювеев А.В., Лазарюк А.Ю. и др. Особенности формирования вертикальной структуры льда в бухте Новик (о-в Русский) по данным ЯМР и МРТ // Вестн. ДВО РАН. 2017. № 4. С. 70–80.
Орлова Т.Ю., Стоник И.В., Шевченко О.Г. Флора микроводорослей планктона Амурского залива Японского моря // Биол. моря. 2009. Т. 35. № 1. С. 48–61.
Пономарева А.А. Структура и динамика фитопланктона в бухте Парис (залив Петра Великого, Японское море): Автореф. канд. дис. Владивосток: ННЦМБ ДВО РАН. 2017. 23 с.
Радченко И.Г., Капков В.И., Федоров В.Д. Практическое руководство по сбору и анализу проб морского фитопланктона. М.: Мордвинцев. 2010. 60 с.
Рябушко Л.И. Состояние изученности микрофитобентоса Аргентинских островов Южного океана (Антарктика) // Природная среда Антарктики: современное состояние изученности: Материалы II Международ. научно-практ. конф. ГНПО Научно-практический центр НАН Беларуси по биоресурсам. 2016. С. 307–311.
Рябушко Л.И., Балычева Д.С., Бондаренко А.В. и др. Различные аспекты изучения диатомовой водоросли Cylindrotheca closterium (Ehrenberg) Reimann et Lewin 1964 в природных и лабораторных условиях // Мор. биол. журн. 2019. Т. 4. № 2. С. 52–62.
Семина Г.И. Фитопланктон Тихого океана. М.: Наука. 1974. 237 с.
Стоник И.В. Качественный и количественный состав фитопланктона бухты Золотой Рог Японского моря // Изв. ТИНРО. 2018. Т. 194. С. 167–174.
Усачев И.И. Микрофлора полярных льдов // Тр. Ин-та океанол. 1949. Т. 3. С. 216–258.
Христофорова Н.К., Дегтева Ю.Е., Бердасова К.С. и др. Химико-экологическое состояние бухты Новик (остров Русский, зал. Петра Великого, Японское море) // Изв. ТИНРО. 2016. Т. 186. С. 135−144.
Христофорова Н.К., Бойченко Т.В., Емельянов А.А. и др. Микробиологический контроль состояния вод бухты Новик (залив Петра Великого, Японское море) // Изв. ТИНРО. 2017. Т. 189. С. 121–130.
Шевченко О.Г., Тевс К.О., Шулькин В.М. Комплексный мониторинг фитопланктона в мелководной бухте залива Петра Великого (Японское море): динамика хлорофилла “а” и биогенных элементов // Изв. ТИНРО. 2020. Т. 200. Вып. 1. С. 141–154.
Arrigo K.R., Brown Z.W., Mills M.M. Sea ice algal biomass and physiology in the Amundsen Sea, Antarctica // Elementa: Sci. Anthropocene. 2014. V. 2. 000028. https://doi.org/10.12952/journal.elementa.000028
Campbell K., Mundy C.J., Belzile C. et al. Seasonal dynamics of algal and bacterial communities in Arctic sea ice under variable snow cover // Polar Biol. 2018. V. 41. P. 41–58.
Clarke K.R., Warwick R.M. Software PRIMER. Primer-E Ltd.: Plymouth, UK. 2001.
Dupont F. Impact of sea-ice biology on overall primary production in a biophysical model of the pan-Arctic Ocean // J. Geophys. Res.: Oceans. 2012. V. 117. P. 1–18.
Ewert M., Deming J.W. Sea ice microorganisms: Environmental constraints and extracellular responses // Biology (Basel). 2013. V. 2. № 2. P. 603–628.
Galindo V., Gosselin M., Lavaud J. et al. Pigment composition and photoprotection of Arctic sea ice algae during spring // Mar. Ecol.: Prog. Ser. 2017. V. 585. P. 49–69.
Gosselin M., Levasseur M., Wheeler P.A. et al. New measurements of phytoplankton and ice algal production in the Arctic Ocean // Deep-Sea Res. Part II. 1997. V. 44. № 8. P. 1623–1644.
Identifying marine phytoplankton / Ed. R.T. Carmelo. New York: Acad. Press. 1997. 858 p.
Kauko M.H., Olsen M.L., Duarte P. et al. Algal colonization of young Arctic Sea ice in spring // Front. Mar. Sci. 2018. № 5. P. 1–20.
Leu E., Mundy C.J., Assmy P. et al. Arctic spring awake-ning–steering principles behind the phenology of vernal ice algal blooms // Prog. Oceanogr. 2015. V. 139. P. 151–170.
Niemi A., Michel C., Hille K. et al. Protist assemblages in winter sea ice: setting the stage for the spring ice algal bloom // Polar Biol. 2011. V. 34. P. 1803–1817.
Okolodkov Y.B. Cryopelagic flora of the Chukchi, East Siberian and Laptev Sea // Proc. NIPR Symp. Polar Biol. 1992. V. 5. P. 28–43.
Olsen M.L., Laney S.R., Duarte P. et al. The seeding of ice algal blooms in Arctic pack ice: the multiyear ice seed repository hypothesis // J. Geophys. Res.: Biogeosci. 2017. V. 122. P. 1–20.
Ratkova T.N., Wassmann P. Sea ice algae in the White and Barents seas: composition and origin // Polar Res. 2005. V. 24. P. 95–110.
van Leeuwe M.A., Tedesco L., Arrigo K. R. et al. Microalgal community structure and primary production in Arctic and Antarctic sea ice: a synthesis // Elementa: Sci. Anthropocene. 2018. V. 6. № 4. https://doi.org/10.1525/elementa.267
Werner I., Ikävalko J., Schünemann H. Sea-ice algae in Arctic pack ice during late winter // Polar Biol. 2007. V. 30. P. 1493–1504.
Дополнительные материалы отсутствуют.