Биология моря, 2023, T. 49, № 1, стр. 56-65
Первичная продукция фитопланктона в акватории Шантарского архипелага
П. П. Тищенко 1, *, П. Я. Тищенко 1, П. Ю. Семкин 1, М. Г. Швецова 1
1 Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
690041 Владивосток, Россия
* E-mail: eq15@poi.dvo.ru
Поступила в редакцию 25.05.2022
После доработки 05.08.2022
Принята к публикации 06.10.2022
- EDN: LSKBTH
- DOI: 10.31857/S0134347523010096
Аннотация
В июле 2016 г. проведены исследования в Удской губе и зал. Академии (Ульбанский залив и зал. Николая). Первичную продукцию (ПП) фитопланктона в фотическом слое рассчитывали по толщине эвфотического слоя, концентрации хлорофилла а и ассимиляционному числу фитопланктона. Для расчета использовали представление световой кривой в модифицированной модели непрямоугольной гиперболы. Формирование ПП происходило благодаря поставке биогенных веществ в фотический слой из нижележащих вод интенсивными приливными течениями в условиях слабой стратификации. Высокое содержание гумусовых веществ в Удской губе ограничивало развитие фитопланктона. Значения ПП изменялись для Удской губы и зал. Академии в пределах 250–1000 и 1069–4268 мгС/(м2 ⋅ сут) соответственно.
Охотское море представляет собой бассейн, характеризующийся высокой биопродуктивностью (Shuntov et al., 2019), что обусловлено физико-географическим положением моря и комплексом гидрофизических, гидрохимических и климатических факторов (Чернявский и др., 1993; Шунтов, 1985, 2001). Поскольку одним из обязательных условий формирования первичной продукции (ПП) фитопланктона является наличие в фотическом слое биогенных веществ, то к важнейшему фактору, обусловливающему высокую биопродуктивность района, относят наличие вертикального перемешивания вод в динамически активных зонах (Чернявский и др., 1993). Величина годовой ПП в этих зонах может превышать 25% от ПП всего Охотского моря (Матвеев, Жигалов, 2008). Акватория Шантарского архипелага Охотского моря относится к области высокой динамической активности. Этот район характеризуется высокой плотностью мелкого зоопланктона (Волков, 2008). Во второй половине лета и в первой половине осени сюда на откорм приходят гренландские киты (Берзин, Дорошенко, 1979; Шпак, Парамонов, 2012). Поздней весной и ранней осенью эти животные в ограниченном количестве встречаются преимущественно в районе проливов у о-ва Большой Шантар и в устье зал. Николая (Мельников и др., 2020). В летний сезон высокую продуктивность акватории Шантарского архипелага связывают, главным образом, с двумя процессами, обеспечивающими поступление биогенных веществ в фотический слой: с приливным перемешиванием и речным стоком (Жабин и др., 2018). Однако этот вывод был сделан на основе космических снимков, а не натурных наблюдений.
Изучение механизмов первичного продуцирования на основе данных судовых наблюдений является одним из необходимых условий для понимания того, как происходит формирование кормовой базы гренландских китов. Цель настоящей работы – изучить механизмы формирования ПП фитопланктона в летний сезон и оценить величину продукции зоопланктона в области нагула гренландских китов.
МАТЕРИАЛ И МЕТОДИКА
Работы проводили в период с 11 по 25 июля 2016 г. в 71-м рейсе НИС “Профессор Гагаринский”. Были выполнены 154 гидролого-гидрохимические станции (рис. 1). На каждой станции проводили зондирование профилографами SBE 19 PLUS (Sea Bird Electronics Inc. США) и Rinko-Profiler ASTD102 (JFE Advantech, Япония), оснащенными датчиками температуры, электропроводности, давления, растворенного кислорода, флуоресценции хлорофилла, мутности и ФАР (фотосинтечески активной радиации). В дневное время суток определяли глубину видимости диска Секки. С поверхностного (верхние 100 см) и придонного (100–150 см от дна) горизонтов ‒ 4-литровым батометром Нискина отбирали пробы воды для последующего определения в судовой лаборатории концентраций главных биогенных веществ (фосфатов, силикатов, нитратов) и хлорофилла а (Хл).
Рис. 1.
Схема расположения гидролого-гидрохимических станций при исследовании акватории Шантарского архипелага 11–25 июля 2016 г. Красным отмечены местоположения станций при проведении опытов по определению Ач.

Определение фосфатов выполняли по методу Морфи–Райли в модификации Королева (восстановитель – аскорбиновая кислота) (Методы.., 1988). Относительная ошибка определения составляла 2% при содержании фосфатов ~2 мкмоль/л.
Определение силикатов выполняли “по голубому кремнемолибденовому комплексу” в модификации Королева (восстановитель – аскорбиновая кислота) (Методы.., 1988). Относительная ошибка определения составляла не более 2% при содержании силикатов ~100 мкмоль/л.
Нитраты, предварительно восстановленные до нитритов на кадмиевом редукторе, определяли по методу Грисса в модификации Бендшнейдера–Робинсона (Методы…, 1988). Относительная ошибка определения составляла 2% при содержании ~20 мкмоль/л.
Соленость измеряли на солемере Guildline Autosal 8400B (Guildline Instruments, США), калибровку которого проводили по стандартной морской воде IAPSO. Для каждой пробы воды проводили, как правило, 2–3 параллельных измерения. Максимальная разница между параллельными измерениями составляла 0.002. Точность измерений в соответствии с паспортными данными прибора составляла ±0.003‰.
Содержание Хл определяли спектрофотометрическим методом. Пробы воды объемом 1.5 л фильтровали через мембранные фильтры “Владипор МФАС-ОС-3” диаметром 35 мм с размером пор 0.8 мкм. Затем фильтры высушивали, растворяли в 5 мл 90% раствора ацетона и помещали в холодильник. Через сутки на спектрофотометре Shimadzu РС 3600 (Япония) измеряли оптическую плотность поглощения света в экстракте. Влияние феофитина на содержание Хл учитывали, проводя повторные измерения пробы, предварительно подкислив ее 2–3 каплями раствора соляной кислоты в ацетоне. Концентрацию Хл в пробе с поправкой на содержание феофитина рассчитывали согласно стандартным методикам (Lorenzen, 1967; Jeffrey, Humphrey, 1975).
ПП фитопланктона в фотическом слое была рассчитана по толщине эвфотического слоя (ФС), концентрации хлорофилла а и ассимиляционному числу фитопланктона (Ач). Для расчета использовали представление световой кривой в модифицированной модели непрямоугольной гиперболы (Звалинский и др., 2006; Звалинский, 2008; Тищенко и др., 2017, 2019). Подробное описание модели приведено ранее (Тищенко, 2022).
Величину ПП, отнесенную к произвольному горизонту Zi (Pi), определяли по уравнению (Тищенко и др., 2019):
(1)
$\begin{gathered} {{P}_{i}} = \frac{{1 + 10\exp ({{ - 4.6{{Z}_{i}}} \mathord{\left/ {\vphantom {{ - 4.6{{Z}_{i}}} {{{Z}_{{ph}}}}}} \right. \kern-0em} {{{Z}_{{ph}}}}})}}{{1.9}} \times \\ \times \,\,\left\{ {1 - \sqrt {1 - \frac{{3.8 \times 10\exp ({{ - 4.6{{Z}_{i}}} \mathord{\left/ {\vphantom {{ - 4.6{{Z}_{i}}} {{{Z}_{{ph}}}}}} \right. \kern-0em} {{{Z}_{{ph}}}}})}}{{{{{(1 + 10\exp ({{ - 4.6{{Z}_{i}}} \mathord{\left/ {\vphantom {{ - 4.6{{Z}_{i}}} {{{Z}_{{ph}}}}}} \right. \kern-0em} {{{Z}_{{ph}}}}}/))}}^{2}}}}} } \right\} \times \\ \times \,\,Ач \times {{[Chl]}_{{{{Z}_{i}}}}} \times {{T}_{d}}, \\ \end{gathered} $Значения Ач были получены по результатам измерения скорости продукции кислорода модифицированным скляночным методом, где в качестве регистраторов растворенного кислорода (DO) использовали безынерционные оптические датчики ARO1-USB (Тищенко и др., 2017, 2019; Тищенко, 2022). Для измерения Ач пробы воды отбирали в склянки объемом 1.7 л, к горловинам которых крепили датчики кислорода. С помощью датчиков, вывешенных за борт на глубину отбора проб (2 м), в условиях in situ в течение 4 ч осуществлялась непрерывная регистрация кислорода в светлой и темной склянках с интервалом 1 мин при полной остановке НИС. Расположение станций при проведении опытов по определению Ач представлено на рис. 1. Наша модификация кислородного метода позволяла проследить временную изменчивость содержания кислорода во время инкубации и исключить случайную погрешность, связанную с измерением кислорода в склянках. Ач рассчитывали по формуле:
где dO2= (Olf – Odf) – (Ol0– Od0) – разница между конечным и начальным показаниями датчиков в светлой и темной склянках, мг/л; Ol0 и Olf – соответственно начальная и конечная концентрации кислорода в светлой склянке; Od0 и Odf – начальная и конечная концентрации кислорода в темной склянке; Схл – концентрация Хл, мкг/л; PQ – фотосинтетический коэффициент; t – время экспозиции, ч. Значение фотосинтетического коэффициента принимали равным 1.42 (Laws, 1991; Smith et al., 2012). Для определения Ач весь ряд данных аппроксимировали прямой и использовали начальные и конечные значения DO из уравнения аппроксимации для начального и конечного моментов времени экспозиции проб. В Удской губе, Ульбанском заливе и зал. Николая было выполнено по одному измерению скорости продукции кислорода для расчета Ач, которые применяли далее для расчета ПП соответствующей акватории.РЕЗУЛЬТАТЫ
Во время проведения исследований акватория Шантарского архипелага, за исключением Тугурского залива, была свободна от ледяного покрова. Температура воды на поверхности изменялась от 1.13 до 13.8°С. Наиболее сильно были прогреты воды Удской губы, где температура воды на поверхности принимала значение 13.8°С в куту и понижалась до 4.7°С на северо-восточной границе залива (рис. 2а). В зал. Николая температура во внутренней части составляла 12.35°С, а на внешней границе понижалась до 2.46°С. В Ульбанском заливе температура воды изменялась от 10.36°С в куту до 1.37°С в средней части акватории. Воды зал. Академии были наименее прогреты. Температура воды на поверхности составляла 2–4°С, а на северной границе залива – 12.96°С.
Рис. 2.
Пространственное распределение температуры воды (°С, левый ряд) и солености (‰, правый ряд) в поверхностном (а, в) и придонном (б, г) слоях в акватории Шантарского архипелага 11–25 июля 2016 г.
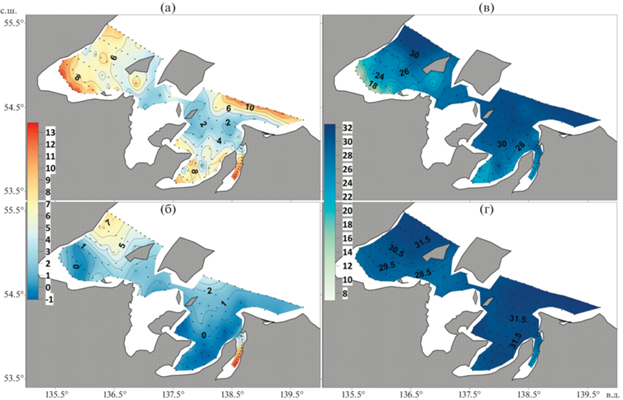
В придонном слое Ульбанского залива и зал. Академии распределение температуры воды было более однородным: –1.03–0.03 и 4°С соответственно. Во внутренней части Удской губы существовало ядро холодных вод с температурой от –0.26 до 7.48°С. В зал. Николая температура воды изменялась от 2.46 до 12.38°С.
Соленость воды в исследуемом районе изменялась от 6.95 до 31.90‰ в поверхностном слое и от 24.64 до 32.52‰ ‒ в придонном. Существовала общая тенденция к увеличению солености в направлении от кутовых частей заливов к открытым акваториям. Наиболее пресными воды (6.95–7.02‰ на поверхности) были в кутовой части Удской губы. Соленость придонных вод здесь составляла 27.13‰. Наблюдалось увеличение солености в направлении северо-восточной границы Удской губы, где воды были однородны по глубине со значением солености 31.8‰. В зал. Николая соленость была однородна по глубине и составляла 24.63–24.66‰ во внутренней его части и 29.70–29.77‰ на внешней границе. В Ульбанском заливе соленость составляла 24.34–28.00‰ на поверхности и 29.94–31.50‰ у дна и возрастала по направлению к внешней границе акватории.
Содержание нитратов в акватории Шантарского архипелага изменялось от 0.05–2.57 до 0.05–6.36 мкмоль/л в поверхностном и придонном слоях соответственно. Наибольшие концентрации нитратов на поверхности были зарегистрированы в северной части Удской губы. В Ульбанском заливе содержание нитратов составляло 0.05–0.30 мкмоль/л, в зал. Николая изменялось от 0.24 до 0.56 мкмоль/л и возрастало в направлении его внешней границы. В поверхностных водах открытой части зал. Академии содержание нитратов достигало 1.31 мкмоль/л.
В придонном слое содержание нитратов было наибольшим в кутовой части Удской губы в области холодных вод и составляло 2.00–6.36 мкмоль/л. В центральной части Удской губы концентрации нитратов уменьшались до 0.84 мкмоль/л, а на севере ‒ до 1.51–2.59 мкмоль/л. В придонных водах кутовой и центральной частях Ульбанского залива концентрации нитратов составляли 0.05 и 0.84 мкмоль/л соответственно. Содержание нитратов в придонных водах зал. Николая и в открытой части зал. Академии составляло 0.20–0.60 и 0.10–0.25 мкмоль/л соответственно.
Концентрации растворенных форм фосфатов на акватории Шантарского архипелага изменялись от 0.13 до 1.09 мкмоль/л (рис. 3в, 3г). В Удской губе обнаружено наиболее высокое содержание фосфатов: 0.13–0.87 и 0.75–1.09 мкмоль/л в поверхностных и придонных водах соответственно. Содержание фосфатов возрастало от кутовой части залива к внешней границе в северном направлении.
Рис. 3.
Пространственное распределение нитратов (мкмоль/л, левый ряд), фосфатов (мкмоль/л, средний ряд) и силикатов (мкмоль/л, правый ряд) в поверхностном (а, в, д) и придонном (б, г, е) слоях в акватории Шантарского архипелага 11–25 июля 2016 г.
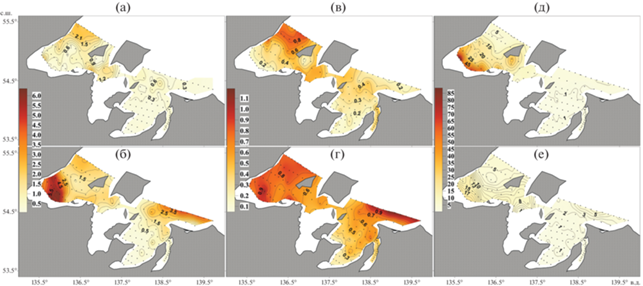
В Ульбанском заливе содержание фосфатов составляло 0.16–0.25 и 0.17–0.31 мкмоль/л в поверхностных и придонных водах соответственно. Наблюдалось увеличение концентрации фосфатов по направлению к внешней границе залива. В зал. Николая концентрации фосфатов изменялись от 0.34–0.49 до 0.37–0.48 мкмоль/л в поверхностных и придонных водах соответственно. В открытой части зал. Академии содержание фосфатов составляло 0.31–0.45 и 0.48–0.62 мкмоль/л в поверхностном и придонном слоях соответственно.
Содержание силикатов в поверхностных и придонных водах зал. Николая, Ульбанского залива и открытой части зал. Академии было низким ‒ 0.17–2.00 мкмоль/л (рис. 3д, 3е). Концентрации силикатов в Удской губе, напротив, были очень высокими: 4.67–88.83 и 4.43–18.33 мкмоль/л в поверхностных и придонных водах соответственно. При этом для всей водной толщи характерно уменьшение концентраций в направлении от кутовой части к северной границе залива.
Интегральное содержание Хл на исследованной акватории составляло 11.33–69.36 мкг/м2 (рис. 4). Удская губа характеризовалась пониженными значениями Хл: на большей части акватории концентрация Хл не превышала 20 мкг/м2, понижаясь до 11.33 мкг/м2 в куту. Лишь у северо-западной границы полигона содержание Хл достигало 36.55–42.55 мкг/м2. В зал. Николая содержание Хл также было низким и составляло 11.69–13.49 мкг/м2. В Ульбанском заливе и зал. Академии содержание Хл было относительно высоким – соответственно 22.88–65.01 и 21.84–69.36 мкг/м2.
Рис. 4.
Пространственное распределение интегральной суммы Хл (мкг/м2) в фотическом слое в акватории Шантарского архипелага 11–25 июля 2016 г.

Ассимиляционные числа фитопланктона в Ульбанском заливе, зал. Николая и Удской губе составили соответственно 4.45, 5.85 и 2.36 мгС/(мгХл ч). Для открытой части зал. Академии величину Ач приняли равной значению, полученному для Ульбанского залива.
Пространственное распределение ПП фитопланктона в фотическом слое вод в общих чертах соответствовало пространственному распределению Хл (рис. 5). Величина интегральной ПП в Удском заливе изменялась от 250 до 1000 мгС/(м2 ⋅ сут), в Ульбанском заливе – от 1285 до 3182 мгС/(м2 ⋅ сут), а в зал. Академии – от 1069 до 4268 мгС/(м2 ⋅ сут). Значения ПП, полученной нами для внешней части акватории Тугурского залива, находились в диапазоне 300–500 мгС/(м2 ⋅ сут). В зал. Николая ПП изменялась от 752 до 828 мгС/(м2 ⋅ сут).
ОБСУЖДЕНИЕ
Наибольшему влиянию речного стока, судя по распределению солености и температуры (рис. 2), подвержена Удская губа, в которую впадает р. Уда со среднегодовым расходом 823 м3/с. Среднегодовые расходы рек Ульбан, Сыран и Усалгин, впадающих в Ульбанский залив и зал. Николая, составляют соответственно 9.62, 10.6 и 37.4 м3/с (Семкин и др., 2022). Поэтому Удскую губу можно рассматривать как бассейн, наиболее подверженный влиянию речного стока по сравнению с Ульбанским заливом и зал. Николая.
Несмотря на существенное различие в объемах речного стока, содержание нитратов и фосфатов в поверхностных водах Удской губы, Ульбанского залива и зал. Николая различалось не более чем в 2 раза. Высокие концентрации нитратов и фосфатов зарегистрированы в областях холодных соленых вод во внутренней части Удской губы у дна и в придонных водах на северной границе зал. Академии. Воды р. Уда содержали малое количество азота и фосфора и для приемного бассейна являлись источником растворенного кремния (Семкин и др., 2020), содержание которого достигало 88.83 мкмоль/л вблизи устья реки.
Наиболее высокие концентрации нитратов и фосфатов соответствовали таковым в придонных водах (рис. 3а, 3б). Источником неорганических форм этих биогенных веществ могло служить разложение органического вещества на дне заливов. Воды зал. Академии содержали меньше азота и фосфора, чем воды Удской губы. Основная причина данного различия, по-видимому, заключалась в разной скорости ассимиляции биогенных веществ при фотосинтетисческой активности фитопланктона. Такой вывод косвенно подкрепляется интегральным содержанием Хл в фотическом слое, средние значения которого в зал. Академии в 4 раза выше, чем в Удской губе.
Существует различие в функционировании экосистем Удской губы и Ульбанского залива, которое приводит к разной фотосинтетической активности фитопланктона. Реки, впадающие в заливы акватории Шантарского архипелага, проходят через болотистые торфяники и поэтому содержат высокие концентрации гумусового вещества (ГВ). Однако реки вносят в приемные бассейны разное количество ГВ. В период наших исследований воды Удской губы были окрашены в темно-коричневый цвет, концентрация ГВ в них была выше, чем в водах зал. Академии (Мельников и др., 2020). Высокое содержание ГВ в воде приводит к быстрому ослаблению ФАР с глубиной (Jones, 1992). Кроме этого при образовании устойчивых комплексов с железом (Catrouillet et al., 2014) снижается биодоступность последнего, что также является причиной ослабления фотосинтетической активности фитопланктона. Действительно, скорость ассимиляции углерода в Ульбанском заливе и зал. Николая была в 2 раза выше, чем в Удской губе. Средние интегральные значения ПП зал. Академии и Ульбанского залива в 5 раз выше средней интегральной ПП в Удской губе.
Значения ПП, полученные нами для внешней части Тугурского залива, составили 300–500 мгС/(м2 ⋅ сут). Ранее ПП фитопланктона Тугурского залива, рассчитанная на основе радиоуглеродного метода, была рассмотрена в работе Дзюбан (2003). По его данным, ПП во внешней части залива в июле–августе во время прилива изменяется в пределах 196–623 мгС/(м2 ⋅ сут) и соответствует олиготрофно-мезотрофному уровню продуктивности вод. В момент отлива ПП понижается до 182 мгС/(м2 ⋅ сут). Учитывая большие изменения уровня воды для разных фаз прилива/отлива, можно считать, что большой воде соответствует ПП, характерная для соленых вод, не подверженных влиянию речного стока. В малую воду воздействие пресного стока наиболее заметно, что выражается в низких значениях ПП. Величины ПП, рассчитанные нами, хорошо согласуются с результатами, полученными А.Н. Дзюбан для высокого уровня воды.
ПП в Охотском море изменяется в широком диапазоне. В прикурильском районе в весенне-летний период ПП варьирует от 500 до 2500 мгС/(м2 ⋅ сут) (Аржанова, Зубаревич, 1997). В районе мыса Евреинова в августе ПП может достигать 7000–10 000 мгС/(м2 ⋅ сут) (Налетова и др., 1997). На шельфе в районе материкового склона о-ва Парамушир и п-ва Камчатка в июле–августе ПП может составлять 920–2730 мгС/(м2 ⋅ сут) (Сорокин, 1997). В открытом море в этот же период ПП изменяется от 280 до 460 мгС/(м2 ⋅ сут) (Сорокин, 1997). Значения продукции фитопланктона, полученные для Удской губы и зал. Николая, находятся в рамках средних величин ПП большей части Охотского моря, составляющих в июле–августе 30–2730 мгС/(м2 ⋅ сут) (Sorokin, Sorokin, 1999). ПП Ульбанского залива и зал. Академии соответствует уровню ПП таких шельфовых областей, как восточный шельф о-ва Сахалин, где ПП летом может изменяться от 4000 до 6000 мгС/(м2 ⋅ сут) (Sorokin, Sorokin, 1999).
В Гданьском заливе, в который впадает р. Висла со среднемноголетним стоком 1080 м3/с, в период с апреля по октябрь ПП изменяется от 820 до 3820 мгС/(м2 ⋅ сут) (Кудрявцева и др., 2018; Witek et al., 1997; Zdun et al., 2021), а в отдельных случаях может достигать 12 900 мгС/(м2 ⋅ сут) (Zdun et al., 2021). В открытых водах Балтийского моря ПП составляет 2090 мгС/(м2 сут) в апреле и 1180 мгС/(м2 ⋅ сут) в сентябре (Zdun et al., 2021). Полученные результаты для вод Балтийского моря и акватории Шантарского региона соизмеримы. Однако в Балтийском море при высокой концентрации Хл (около 35 мкг/л) 80% светового излучения поглощается в слое воды 0.7 м, а при низкой концентрации Хл (около 0.35 мкг/л) – в слое воды до 3 м (Dera, Wozniak, 2010). По нашим данным, толщина ФС, рассчитанная из глубины залегания 1% ФАР по отношению к ее поверхностному значению (Ryther, 1956), изменялась в диапазонах 11.3–20.8 м в Удской губе, 11.9–14.3 м в зал. Николая и 15.6–20.9 м в Ульбанском заливе. Эти бассейны относятся к акваториям, находящимся под большим воздействием приливо-отливных течений. Приливы здесь достигают 6 м, а в Удской губе – 9.7 м (Лоция…, 1998). Подобная динамическая активность способствует перемешиванию и ослаблению вертикальной стратификации вод, что приводит к увеличению ФС.
Формирование ПП на акватории Шантарского архипелага происходит вследствие поставки биогенных веществ в фотический слой из нижележащих слоев благодаря интенсивным приливным течениям в условиях слабой стратификации вод. Высокое содержание гумусовых веществ в Удской губе ограничивает развитие фитопланктона, несмотря на высокое содержание биогенных веществ.
Кормовой базой гренландских китов является зоопланктон. В период нагула они ежедневно потребляют биомассу в количестве 2–3% от общей массы животного, что в среднем составляет 1.5–2 т. (Lowry et al., 2004). В свою очередь, биомасса зоопланктона формируется за счет употребления в пищу фитопланктона, бактериопланктона и растворенного органического вещества (Steinberg, Landry, 2017). Наиболее крупные стада гренландских китов были замечены в кутовой части Ульбанского залива (Мельников, Федорец, 2016; Шпак, Парамонов, 2015, 2018; Ivashchenko, Clapham, 2010). Общая площадь залива составляет 2100 км2 с максимальными глубинами на внешней границе 30–32 м. По представленным в настоящей работе данным, средняя ПП фитопланктона во внутренней части Ульбанского залива составляла 1500 мгС/(м2 ⋅ сут) на площади около 1000 км2. Это соответствует общей величине ПП 1500 тС/сут, или 15000 т/сут сырой массы фитопланктона (Menden-Deuer, Lessard, 2000). При условии, что продукция вторичного звена пищевой цепи составляет 10% от продукции фитопланктона (Odum, 1971), продукция зоопланктона составляет 1500 т/сут. В этот расчет не входят концентрации растворенного органического вещества и бактериопланктона. При условии, что продукция бактериопланктона может быть приблизительно равной продукции фитопланктона (Дзюбан, 2003), величина общей продукции зоопланктона составит 3000 т/сут.
В кутовой части Ульбанского залива количество китов может достигать 60 особей (Мельников, Федорец, 2016). Полученные величины продукции зоопланктона более чем достаточны для их прокорма.
ЗАКЛЮЧЕНИЕ
Проведен анализ результатов исследований акватории Шантарского архипелага, выполненных 11–25 июля 2016 г. Средняя интегральная ПП вод зал. Академии в 5 раз превышала ПП в Удской губе. Поставка биогенных веществ в фотический слой из нижележащих вод благодаря интенсивным приливным течениям в условиях слабой стратификации вод вызывала рост ПП. Высокое содержание гумусовых веществ в Удской губе ограничивало развитие фитопланктона, несмотря на высокое содержание биогенных веществ.
Значения ПП изменялись для заливов Удского, Академии и Николая в диапазонах 250–1000, 1069–4268 и 752–828 мгС/(м2 ⋅ сут) соответственно. Полученные величины ПП соответствуют продукции прибрежных акваторий, находящихся под влиянием речного стока и достаточны для формирования кормовой базы полярных китов.
Список литературы
Аржанова Н.В., Зубаревич В.Л. Сезонные изменения содержания биогенных элементов в Охотском море как основа для оценки продукции фитопланктона // Комплексные исследования экосистемы Охотского моря. М.: ВНИРО. 1997. С. 92–97.
Берзин А.А., Дорошенко Н.В. Сводные материалы по гладким китам Охотского моря // Научно-исследовательские работы по морским млекопитающим северной части Тихого океана в 1978/79 гг. М.: ВНИРО. 1979. С. 56–65.
Волков А.Ф. Интегральные схемы количественного распределения массовых видов зоопланктона дальневосточных морей и северо-западной части Тихого океана по средним многолетним данным (1984–2006) // Изв. ТИНРО. 2008. Т. 154. С. 135–143.
Дзюбан А.Н. Первичные продукционные процессы в воде Тугурского залива Охотского моря // Океанология. 2003. Т. 43. № 3. С. 383–392.
Жабин И.А., Лукьянова Н.Б., Дубина В.А. Структура и динамика вод морской акватории национального парка “Шантарские острова” (Охотское море) по данным спутниковых наблюдений // Исслед. Земли из космоса. 2018. № 5. С. 3–14.
Звалинский В.И. Количественное описание морских экосистем. I. Общие подходы // Изв. ТИНРО. 2008. Т. 152. С. 132–153.
Звалинский В.И., Лобанов В.Б., Захарков С.П., Тищенко П.Я. Хлорофилл, замедленная флуоресценция и первичная продукция северо-западной части Японского моря осенью 2000 г. // Океанология. 2006. Т. 46. № 1. С. 27–37.
Кудрявцева Е.А., Александров С.В., Дмитриева О.А. Сезонная изменчивость первичной продукции и состава фитопланктона в береговой зоне российского сектора Гданьского бассейна Балтийского моря // Океанол. исслед. 2018. Т. 46. № 3. С. 99–115.
Лоция Охотского моря (№ 1406). Вып. 1. Южная часть моря. СПб.: ГУНиО. 1998. 390 с.
Матвеев В.И., Жигалов И.А. Оценка величины первичной продукции динамически активных зон Охотского моря // Вопр. промысл. океанографии. М.: ВНИРО. 2008. Вып. 5. № 2. С. 208–215.
Мельников В.В., Федорец Ю.В. Распределение зоопланктона и полярного кита Balaena mysticetus Linnaeus, 1758 в заливе Академии Охотского моря // Биол. моря. 2016. Т. 42. № 3. С. 189–194.
Мельников В.В., Федорец Ю.В., Семкин П.Ю. и др. Гидробиологические особенности заливов Шантарского района в связи с летним нагулом полярных китов Охотской популяции // Океанология. 2020. Т. 60. № 2. С. 1–6.
Методы гидрохимических исследований основных биогенных элементов. М.: ВНИРО. 1988. 120 с.
Налетова И.А., Сапожников В.В., Метревели М.П. Особенности распределения первичной продукции в летний период и оценка суммарной продукции в Охотском море // Комплексные исследования экосистемы Охотского моря. М.: ВНИРО. 1997. С. 98–103.
Семкин П.Ю., Тищенко П.Я., Павлова Г.Ю. и др. Карбонатная система эстуариев рек Сыран и Ульбан (Ульбанский залив Охотского моря) в период летнего паводка // Водные ресурсы. 2022. Т. 49. № 5. С. 650–661.
Семкин П.Ю., Тищенко П.П., Тищенко П.Я. и др. Характеристика продукционно-деструкционных процессов в эстуариях рек Уда и Усалгин (Охотское море) в период летнего паводка // Вестн. ДВО РАН. 2020. № 2. С. 88–96.
Сорокин Ю.И. Первичная продукция в Охотском море // Комплексные исследования экосистемы Охотского моря. М.: ВНИРО. 1997. С. 103–110.
Тищенко П.П. Первичная продукция фитопланктона на северо-восточном шельфе острова Сахалин в летний период // Морск. биол. журн. 2022. Т. 7. № 4. С. 81–97.
Тищенко П.П., Звалинский В.И., Тищенко П.Я. и др. Первичная продукция Амурского залива (Японское море) в летний сезон 2008 года // Биол. моря. 2017. Т. 43. № 3. С. 195–202.
Тищенко П.П., Тищенко П.Я., Еловская О.А. и др. Условия формирования первичной продукции фитопланктона в заливе Восток (Японское море) весной 2016 г. // Изв. ТИНРО. 2019. Т. 198. С. 164–185.
Чернявский В.И., Жигалов И.А., Матвеев В.И. Океанологические основы формирования зон высокой биологической продуктивности Охотского моря // Охотское море. Гидрометеорология и гидрохимия. Проект “Моря”. Л.: Гидрометеоиздат. 1993. Т. 9. Вып. 2. С. 157–160.
Шпак О.В., Парамонов А.Ю. Наблюдения за белухами (Delphinapterus leucas), косатками (Orcinus orca), гладкими китами (Balaenidae) в Ульбанском заливе Охотского моря // Морские млекопитающие Голарктики. Сб. науч. тр. М.: Совет по морским млекопитающим. 2012. Т. 2. С. 395–400.
Шпак О.В., Парамонов А.Ю. Наблюдения за гренландскими китами (Balaena myscicetus) в Шантарском регионе Охотского моря; потенциальные угрозы для восстановления численности популяции // Морские млекопитающие Голарктики. Сб. науч. тр. М.: Совет по морским млекопитающим. 2015. Т. 2. С. 334–342.
Шпак О.В., Парамонов А.Ю. Гренландский кит Balaena mysticetus Linnaeus, 1758 в западной части Охотского моря (2009–2016 гг.): особенности распределения, поведение, угрозы // Биол. моря. 2018. Т. 4. № 3. С. 179–186.
Шунтов В.П. Биологические ресурсы Охотского моря. М.: Агропромиздат. 1985. 224 с.
Шунтов В.П. Биология дальневосточных морей. Т. 1. Владивосток: ТИНРО-центр. 2001. 580 с.
Catrouillet C., Davranche M., Dia A. et al. Geochemical modeling of Fe (II) binding to humic and fulvic acids // Chemical Geol. 2014. V. 372. P. 109–118.
Dera J., Wozniak B. Solar radiation in the Baltic Sea // Oceanologia. 2010. V. 52. P. 533–582.
Ivashchenko Yu., Clapham P. Bowhead Balaena mysticetus in the Okhotsk Sea // Mammal. Rev. 2010. V. 40. № 1. P. 65–89.
Jeffrey S.W., Humphrey G.F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanz. 1975. V. 167. № 2. P. 191–194.
Jones R.I. The influence of humic substances on lacustrine planktonic food chains // Hydrobiologia. 1992. V. 229. P. 73–91.
Laws E.A. Photosynthetic quotients, new production and net community production in the open ocean // Deep-Sea Res. I. 1991. V. 38. № 1. P. 143–167.
Lorenzen C.J. Determination of chlorophyll and pheo-pigments: spectrophotometric equations // Limnol. Oceanogr. 1967. V. 12. P. 343–346.
Lowry L.F., Sheffield G., George J.C. Bowhead whale fee-ding in the Alaskan Beaufort Sea, based on stomach contents analyses // J. Cetacean Res. Manage. 2004. V. 6. P. 215–223.
Menden-Deuer S., Lessard E.J. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol. Oceanogr. 2000. V. 45. № 3. P. 569–579.
Odum E.P. Fundamentals of ecology. W.B. Saunders Company, 3rd Ed., Philadelphia: 1971. p. 574.
Ryther J.H. Measurement of primary production // Limnol. Oceanogr. 1956. V. 1. № 2. P. 72–84.
Shuntov V.P., Ivanov O.A., Dulepova E.P. Biological resources in the Sea of Okhotsk Large Marine Ecosystem: Their status and commercial use // Deep Sea Res. Part II. 2019. V. 163. P. 33–45.
Sorokin Yu.I., Sorokin P.Yu. Production in the Sea of Okhotsk // J. Plankton Res. 1999. V. 21. № 2. P. 201–230.
Smith L.M., Silver C.M., Oviatt C.A. Quantifying variation in water column photosynthetic quotient with changing field conditions in Narragansett Bay, RI, USA // J. Plankton Res. 2012. V. 34. № 5. P. 437–442.
Steinberg D.K., Landry M.R. Zooplankton and the Ocean Carbon Cycle // Annu. Rev. Mar. Sci. 2017. V. 9. P. 413–444.
Witek Z., Ochocki S., Maciejowska M., Pastuszak M., Nakonieczny J., Podgorska B. Phytoplankton primary production and its utilization by the pelagic community in the coastal zone of the Gulf of Gdansk (southern Baltic) // Mar. Ecol. Prog. Ser. 1997. V. 148. P. 169–186.
Zdun A., Stoń-Egiert J., Ficek D., Ostrowska M. Seasonal and Spatial Changes of Primary Production in the Baltic Sea (Europe) Based on in situ Measurements in the Period of 1993–2018 // Front. Mar. Sci. 2021. V. 7. P. 604532. https://doi.org/10.3389/fmars.2020.604532
Дополнительные материалы отсутствуют.



