Биотехнология, 2022, T. 38, № 2, стр. 37-42
Разработка технологических подходов получения и культивирования примордиальных зародышевых клеток (PGC) кур пушкинской породы
Т. А. Ларкина 1, *, А. А. Крутикова 1, Г. К. Пегливанян 1, Е. А. Полтева 1, Ю. С. Щербаков 1, О. Ю. Баркова 1
1 Всероссийский научно-исследовательский институт генетики и разведения сельскохозяйственных животных – филиал Федерального государственного бюджетного научного учреждения “Федеральный исследовательский центр животноводства – ВИЖ имени академика Л.К. Эрнста”
196601 Пушкин, Санкт-Петербург, Россия
* E-mail: tanya.larkina2015@yandex.ru
Поступила в редакцию 15.03.2022
После доработки 08.04.2022
Принята к публикации 16.04.2022
- EDN: TTJYYO
- DOI: 10.56304/S0234275822020065
Аннотация
Примордиальные зародышевые клетки (PGC) являются предшественниками яйцеклеток и сперматозоидов и их удобно использовать для культивирования и генетической модификации in vitro. При разработке технологических подходов процесса получения и культивирования PGC использовали четыре варианта культуральных сред. Выявлено, что наиболее эффективной из них оказалась бессывороточная базовая среда KnockOut DMEM/F-12, без L-глутамина с добавлением факторов роста Аctivin A и FGF-2/bFGF, обеспечиваюшая высокий рост и пролиферацию клеток PGC кур породы пушкинская из биоресурсной коллекции ВНИИГРЖ. Подтверждением наличия PGC послужил достоверно (p ≤ 0.05) высокий уровень экспрессии специфических генов -маркеров PGC CXCR4 (хемокинового рецептора CXC типа 4) и PIWIL1 (Piwi-подобного белка 1) в культуре выращиваемых клеток. Полученные результаты послужат полезной информацией для культивирования PGC, что активно используются для разных научно-практических целей таких как модели развития зародышевой линии, для получения трансгенных птиц, использования культуральных РGC для сохранения генетических ресурсов диких и домашних птиц.
Примордиальные зародышевые клетки (PGC) являются предшественниками яйцеклеток и сперматозоидов [1]. PGC хорошо подходят для культивирования и генетической модификации in vitro и служат эффективным инструментом как для криоконсервации генетических ресурсов птиц, так и для производства трансгенных кур в том числе и с помощью технологии CRISPR/Cas9. Сразу после становления кровообращения в эмбрионе кур они временно циркулируют в дорсальной аорте зародыша. Это предпочтительное время для их выделения из крови эмбриона, так как на 7–8 сутки инкубации для дальнейшего развития клетки мигрируют в гонады [2].
Поскольку PGC представляют собой очень маленькую популяцию клеток на раннем этапе развития и составляют менее 0,02% всех клеток крови и примерно 2% клеток гонад [3], перенос интактной крови или клеток гонад к эмбрионам-реципиентам приводит к очень низкой эффективности производства химерных цыплят [4].
Целью данной работы являлся подбор культуральных сред для поддержания жизнедеятельности и увеличения количества PGC, разработка метода их выделения и очистки.
УСЛОВИЯ ЭКСПЕРИМЕНТА
Для проведения работ были отобраны яйца (n = 81) кур пушкинской породы яично-мясного типа продуктивности биоресурсной коллекции ВНИИГРЖ [5]. PGC кур отбирали на 3–4 сутки инкубации из дорсальной аорты эмбрионов (стадия Hamburger-Hamilton 14). Яйца инкубировали в лабораторном инкубаторе (ИФХ-250НС, Россия) с периодической сменой положения при 37–38°C и относительной влажности 65–70%. Масса яиц для получения PGC при закладке на инкубацию составляла от 55 до 62 г. Инкубационное яйцо вскрывали помощью дремели (Budget, Германия), в скорлупе выпиливали отверстие диаметром 10–15 мм.
Через полученное отверстие под бинокуляром отбор клеток осуществляли с помощью микроинъектора (Narishige IM-11-2, Japan; диаметр иглы 30 мкм) (рис. 1). Клетки культивировали 21 день при 37°C с 4% CO2 в инкубаторе HF-90 (Китай) в базовых средах (Gibco, Thermo Fisher, США) с добавками.
Рис. 1.
Отбор PGC в дорсальной аорте эмбриона на 3 сутки инкубации. Fig. 1. Selection of PGC in the portal aorta of the embryo on the 3rd day of incubation.
В эксперименте использовали четыре варианта культуральных сред:
K – базовая среда Opti-MEM (Reduced Serum Medium, GlutaMAX Supplement) без добавок;
А – среда К с добавлением различных компонентов;
Б – среда А, дополнительно содержащая антибиотик-антимикотик (Thermo Fisher) до 1Х;
В – базовая среда KnockOut DMEM/F-12 (Gibco, Thermo Fisher), дополнительно содержащая Human Activin A Recombinant Protein (Gibco, Thermo Fisher) и Human FGF-basic Recombinant Protein (Gibco, Thermo Fisher) (табл. 3).
Каждые 2 дня проводили замену 1/2 объема культуральной среды. При культивировании PGC клеток использовали планшеты Nunc Cell-Culture Treated Multidishes (Thermo Fisher) c гидрофильной поверхностью. Контроль пролиферации и жизнедеятельности клеток осуществляли визуально на инвертированном микроскопе Olympus AHMT (Япония) с использованием программы TOP VIEW при увеличении ×400. Отношение живых и мертвых клеток оценивали при помощи красителя трипановый синий (0.5%) по стандартной методике. Подсчет клеток проводили на автоматическом счетчике клеток ТС20 (Bio-Rad, США).
Для идентификации PGC в культуре клеток, проведен анализ экспрессии специфических примордиальных генов в реальном времени в следующей последовательности: клетки в количестве 2.3 × 106 ± 0.06 × 106 культивировали в среде В, промывали 0.1 М фосфатным буфером pH 7.0, лизировали реагентом ExtractRNA (“Евроген”, Россия) согласно инструкции производителя и замораживали при –20°С. Синтез первой цепи кДНК с одноцепочечной матрицы РНК проводили с помощью обратной транскриптазы MINT (“Евроген”). Для инициации реакции использовали праймеры для специфических примордиальных генов (табл. 1). Анализ экспрессии генов выполняли с помощью программы Date analysis амплификатора CFX-96 (Bio-Rad, США). Референсным контролем служил ген домашнего хозяйств GAPDH [6], для внешнего контроля экспрессии генов брали ткани тонкого кишечника взрослой курицы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выявлено, что эмбрионы, полученные из крупных яиц от 63 г и более, плохо развиваются или вовсе не доходят до стадии отбора PGC (табл. 2).
Таблица 2.
Выход эмбрионов кур пушкинской породы от яиц с различной массой (n =100) Table 2. Yield of Pushkin chicken embryos from eggs with different weights (n = 100)
| Масса яйц, г | 55.0–59.9 | 60.0–62.9 | 63.0–65.0 |
|---|---|---|---|
| Выход эмбрионов (%) | 60a | 35b | 5c |
Таблица 3.
Количество живых PGC в различных системах культивирования (время культивирования – 21 день, число экспериментов – 3) Table 3. Number of PGCs in different culture systems (culture time – 21 days, number of experiments – 3)
| Обозначение | Базовая среда | Дополнительные компоненты среды (расчет на 500 мл среды) | Количество живых PGC (средние значения ± ± стандартная ошибка) |
|---|---|---|---|
| К | Базовая среда Opti-MEM (Reduced Serum Medium, GlutaMAX Supplement) | – | 0.36 × 106 ± 0.01 × 106 k |
| А | Базовая среда Opti-MEM (Reduced Serum Medium, GlutaMAX Supplement) | Натрия пируват 1М, нуклеозиды Embryo Max Nucleosides 100X – 2.5 мл, Chicken Serum
– 2%, 2-меркаптоэтанол – 3.9 мкл |
0.34 × 106 ± 0.04 × 106 a |
| Б | Базовая среда Opti-MEM (Reduced Serum Medium, GlutaMAX Supplement) | Натрия пируват 1М, нуклеозиды Embryo Max Nucleosides 100X – 2.5 мл, Chicken Serum
– 20%, 2-меркаптоэтанол – 3.9 мкл, антибиотик-антимикотик до 1Х |
0.47 × 106 ± 0.07 × 106 b |
| В | Базовая среда KnockOut DMEM/F-12, без L-глутамина | Натрия пируват 1М, нуклеозиды Embryo Max Nucleosides 100X – 2.5 мл, Chicken Serum
– 2%, 2-меркаптоэтанол – 3.9 мкл, антибиотик-антимикотик до 1Х Human Activin A Recombinant Protein – 25 нг/мкл, Human FGF-basic (FGF-2/bFGF) Recombinant Protein– 10 нг/мкл, |
0.84 × 106 ± 0.06 × 106c |
Примечание: Концентрация клеток в расчете на 1 млн/мл среды. Достоверность различия сравниваемых значений (t-критерий Стьюдента) k : a, k : b, k : с, a : b, a : с, b : с, при p ≤ 0.05. Note: Cell concentration per 1 million/ml medium. Significance of the difference between the compared values (Student’s t-test) k : a, k : b, k : с, a : b, a : с, b : с, at p ≤ 0.05.
Оптимальное время отбора PGC кур на 3–4 сутки инкубации из дорсальной аорты эмбрионов (стадия Hamburger-Hamilton 14) [7–9]. Взятие клеток на более ранних или более поздних стадиях вызывает комплекс осложнений. На более ранних, аорта слишком тонкая, и отбор затруднен, а на более поздних стадиях количество PGC клеток резко уменьшается в аорте из-за их миграции дальше по кровеносному руслу в зачатки гонад. В первые дни культивирования в среде кроме PGC клеток, много форменных элементов крови, и клетки трудно идентифицировать. К 21 дню культивирования клетки крови деградируют, остаются только PGC.
PGC курицы, выделенные из эмбриональной крови, могут быть пролиферированы в течение длительного времени в комплексных культуральных средах, содержащих куриную сыворотку, фетальную бычью сыворотку (FBS), фактор роста фибробластов 2 (FGF2) и среду, кондиционированную клетками печени буйвола (BRL), сохраняя при этом специфичность клонов и способность к передаче зародышевой линии [10]. Whyte с соавторами установили, что FGF2, инсулин и активин необходимы для пролиферации куриных PGC [11], что позволяет эффективно выращивать и размножать PGC как самцов, так и самок кур.
При использовании базовой среды в качестве контроля (рис. 2a) без дополнительных добавок количество живых PGC составило 28%. При культивировании в среде А без антибиотика-антимикотика была незначительная пролиферация, и часть лунок с клетками зарастала. На 21 день количество живых клеток в культуре достигало 26% (рис. 2b). Среда Б, содержащая антибиотик-антимикотик, была меньше подвержена зарастанию, однако интенсивного роста и пролиферации клеток не наблюдалось, количество живых клеток составляло 32% (рис. 2c). Среда В с добавлением Activin A и FGF-2/bFGF оказалась наиболее эффективной для культивирования клеток, зарастания практически не наблюдалось, клетки активно пролиферировались. Количество живых PGC составило 38% (рис. 2d), то есть в среде В их в 2.3 раза больше, чем в среде К. Готовые к трансформации PGC по морфологическим характеристикам имели неровную шарообразную форму и внутри клеток присутствовали цитоплазматические липиды, которые придавали клеткам гранулезную структуру. Таким образом, из четырех исследованных вариантов сред для культивирования наиболее эффективной оказалась среда В, обеспечивающая высокий рост и пролиферацию клеток кур породы пушкинская из биоресурсной коллекции ВНИИГРЖ (табл. 3).
Рис. 2.
Пролиферация и жизнеспособность PGC клеток в разных средах. a – среда К, b – среда A, c – среда Б, d – среда В. Fig. 2. Proliferation and viability of PGC cells in different media. a – base medium К, b – base medium A, c – base medium Б, d – base medium В.

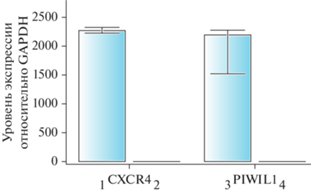
Подтверждением наличия PGC послужил достоверно (p ≤ 0.05) высокий уровень экспрессии специфических генов-маркеров PGC CXCR4 (хемокинового рецептора CXC типа 4) и PIWIL1 (Piwi-подобного белка 1) в культуре выращиваемых клеток [12]. В контрольном образце ткани тонкого кишечнике взрослой курицы (возраст 330 дней) полностью отсутствовала экспрессия вышеуказанных генов (рис. 3).
Рис. 3.
Экспрессия маркеров PGC во время культивирования в среде В (in vitro – 21 день, достоверность различия сравниваемых значений p ≤ 0.05). CXCR4 ген: 1 – культура клеток PGC, 2 – ткань тонкого кишечника Gallus gallus. PIWIL1 ген: 3 – культура клеток PGC, 4 – ткань тонкого кишечника Gallus gallus. Fig. 3. Expression of PGC markers during in vitro culture (21 days, significance of the difference between the compared values p ≤ 0.05). CXCR4 gene: 1 – PGC cell culture, 2 – Tissue of the small intestine Gallus gallus. PIWIL1 gene: 3 – PGC cell culture, 4 – Tissue of the small intestine Gallus gallus.
Таким образом, при проведении экспериментов выявлено критическое значение размера яйца для дальнейшего отбора PGC. Бессывороточная базовая среда KnockOut DMEM/F-12 с добавлением факторов роста Activin A и FGF-2/bFGF, обеспечила значительно больший рост числа живых PGC по сравнению с дорогостоящей сывороточной базовой средой Opti-MEM, содержащей антибиотик-антимикотик. Полученные результаты создают фундаментальную основу для сохранения генетических ресурсов диких и домашних птиц, а также предоставляют возможность внесения генетических модификаций в PGC, что позволит проводить ускоренное совершенствование продуктивных качеств всех видов сельскохозяйственных птиц.
Список литературы
Macdonald J., Glover J.D., Taylor L., Sang H.M., Mc Grew M.J. Characterisation and germline transmission of cultured avian primordial germ cells. PLoS One, 2010, 5(11), e15518. https://doi.org/10.1371/journal.pone.0015518
Nakamura Y., Kagami H., Tagami T. Development, differentiation and manipulation of chicken germ cells. Development Growth Differ, 2013, 55, 20–40. https://doi.org/10.1111/dgd.12026
Mozdziak P.E., Angerman-Stewart J., Rushton B. Pardue S.L., Petitte J.N. Isolation of chicken primordial germ cells using fluorescence-activated cell sorting. Poult. Sci., 2005, 84, 594–600. https://doi.org/10.1093/ps/84.4.594
Yamamoto Y., Usui F., Nakamura Y., Ito Y., Tagami T., Nirasawa K., Matsubara Y., Ono T., Kagami H. A novel method to isolate primordial germ cells and its use for the generation of Germline chimeras in chicken. Biol. Reprod., 2007, 77, 115–119. https://doi.org/10.1095/biolreprod.107.061200
“Генетическая коллекция редких и исчезающих пород кур”. ЦКП Федерального государственного бюджетного научного учреждения “Федеральный исследовательский центр животноводства – ВИЖ имени академика Л.К. Эрнста”, [Электронный ресурс]. (Дата обращения: 11.01.2022). https://vniigen.ru/ckp-geneticheskaya-kollekciya-redkix-i-ische-zayushhix-porod-kur/
Lazar B., Szabadi N.T., Anand M., Toth, R., Ecker A., Urban M., Aponte M.T.S., Stepanova G., Hegyi Z., Homolya L., Várkonyi E.P., Pain B., Gócza E. Effect of miR-302b MicroRNA Inhibition on Chicken Primordial Germ Cell Proliferation and Apoptosis Rate. Genes, 2022, 13, 82.https://doi.org/10.3390/genes13010082
Nakamura Y., Yamamoto Y., Usui F., Mushika T., Ono T., Setioko A.R., Takeda K., Nirasawa K., Kagami H., Tagami T. Migration and proliferation of primordial germ cells in the early chicken embryo. Poult. Sci., 2007, 86(10), 2182–2193. https://doi.org/10.1093/ps/86.10.2182
Yamamoto Y., Usui F., Nakamura Y., Ito Y., Tagami T., Nirasawa K., Matsubara Y., Ono T., Kagami H. A novel method to isolate primordial germ cells and its use for the generation of germline chimeras in chicken. Biol. Reprod., 2007, 77(1), 115–119. https://doi.org/10.1095/biolreprod.107.061200
Jung K.M., Kim Y.M., Ono T., Han J.Y. Size-dependent isolation of primordial germ cells from avian species. Mol. Reprod. Dev., 2017, 84(6), 508–516. https://doi.org/10.1002/mrd.22802
van de Lavoir M.C., Diamond J.H., Leighton P.A., Mather-Love C., Heyer B.S., Bradshaw R., Kerchner A., Hooi L.T., Gessaro T.M., Swanberg S.E., Delany M.E., Etches R.J. Germline transmission of genetically modified primordial germ cells. Nature, 2006, 441, 766–769
Whyte J., Glover J.D., Woodcock M., Brzeszczynska J., Taylor L., Sherman A., Kaiser P., McGrew M.J. FGF, Insulin, and SMAD Signaling Cooperate for Avian Primordial Germ Cell Self-Renewal. Stem Cell Rev., 2015, 5,1171–1182
Chen Y.C., Lin S.P., Chang Y.Y., Chang W.P, Wei L.Y., Liu H.C., Huang J.F., Pain B., Wu S.C. In vitro culture and characterization of duck primordial germ cells. Poult. Sci., 2019, 98(4), 1820–1832. https://doi.org/10.3382/ps/pey515
Дополнительные материалы отсутствуют.


