Биология внутренних вод, 2019, № 2-1, стр. 10-20
Морфологическая изменчивость Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) в водоемах европейской части России
С. М. Жданова 1, *, В. И. Лазарева 1, Н. Г. Баянов 2, Е. В. Лобуничева 3, Н. В. Родионова 4, Г. В. Шурганова 5, Т. В. Золотарева 5, М. Ю. Ильин 6
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Ярославская обл., Некоузский р-н, пос. Борок, Россия
2 Государственный природный биосферный заповедник “Керженский”
603001 Нижний Новгород, ул. Рождественская, д. 23, Россия
3 Вологодское отделение – филиал “Государственного научно-исследовательского института озерного и речного рыбного хозяйства им. Л.С. Берга”
160012 Вологодская обл., Вологда, ул. Лeвичева, д. 5, Россия
4 Институт озероведения Российской академии наук
196105 Санкт-Петербург, ул. Севастьянова, д. 9, Россия
5 Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр. Гагарина, д. 23, корп. 1, Россия
6 Комитет по охране использованию и воспроизводству объектов животного мира Нижегородской обл.
603134 Нижний Новгород, ул. Костина, д. 2, Россия
* E-mail: zhdanova83@gmail.com
Поступила в редакцию 08.08.2017
После доработки 31.10.2017
Принята к публикации 16.11.2017
Аннотация
Проведен морфологический анализ популяций коловратки Kellicottia bostoniensis (Rousselet, 1908) из 23 водных объектов европейской части России. Показано, что наиболее вариабельна длина заднего шипа, наименее – длина панциря. Длина переднего и заднего шипов коррелируют положительно. Отмечено увеличение длины шипов с ростом длины панциря. Размеры коловратки различаются в водоемах и водотоках с разным трофическим статусом, глубиной и величиной pH. Размер тела K. bostoniensis больше в мезотрофных, ацидных и глубоких водных объектах.
ВВЕДЕНИЕ
Североамериканская коловратка Kellicottia bostoniensis (Rousselet, 1908) в настоящее время распространена в >40 водоемах и водотоках европейской части России. Она стала обычным видом в лесных озерах и реках бассейна Балтийского моря, Атлантико-Ледовитоморско-Каспийского водораздела, в бассейне р. Волги расселилась на юг до 55° с.ш. (озера бассейнов рек Ока и Пра) [5, 18, 24, 25] и на восток – до 56°‒57° в.д. (р. Кама, бассейн Средней Волги) [17]. Возможные пути расселения вида на территории Российской Федерации обсуждены в работе [25]. Коловратка обитает в широком диапазоне условий, что свидетельствует о высокой экологической пластичности вида. K. bostoniensis населяет разнотипные водоемы и водотоки, однако данные о морфологических различиях популяций из разных местообитаний отсутствуют.
Цель работы – описание морфологической вариабельности K. bostoniensis в водоемах европейской части России.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Анализ морфометрических характеристик коловратки K. bostoniensis выполнен на популяциях из 23 водоемов и водотоков европейской части России (табл. 1). В работе использованы материалы гидробиологических исследований на Иваньковском водохранилище (Московская и Тверская обл.), небольших (<2.7 км2) озерах Валдайской возвышенности (Новгородская обл.) и Центрально-лесного заповедника (Тверская обл.), и пойменных водоемах Окского заповедника (Рязанская обл.), озерах Нижегородской, Ленинградской и Вологодской обл., реках в Нижегородской обл. и двух ручьях в Вологодской обл. Описание водоемов и водотоков приведено в работе [25].
Таблица 1.
Характеристика исследованных водоемов и водотоков
| Водный объект | с.ш. | в.д. | Глубина, м | Температура, °С | pH | Цветность, °Pt-Co |
Cтатус |
|---|---|---|---|---|---|---|---|
| Ручей из оз. Тонкое | 61 | 37 | 1.5 | 16.5 | 7.0 | – | ‒ |
| Ручей из оз. Кривое | 61 | 37 | 0.3 | 15.5 | 7.0 | – | ‒ |
| р. Керженец | 56 | 44 | 1.5 | 24.0 | 6.8 | 175 | ‒ |
| р. Сережа | 55 | 43 | 15.0 | 20.0 | 7.7 | 66 | ‒ |
| Озера: | |||||||
| Купецкое | 61 | 37 | 5.0 | 17.1 | 7.0 | – | II |
| Экозеро | 61 | 37 | 2.0 | 16.0 | 6.7 | – | I |
| Тонкое | 61 | 37 | 2.0 | 15.3 | 6.8 | – | II |
| Лайнозеро | 61 | 37 | 4.0 | 21.1 | 7.1 | – | » |
| Малое Луговское | 60 | 30 | 5.0 | 20.0 | 5.8 | 560 | III |
| Большое Морозовское | 60 | 29 | 3.1 | 28.0 | 8.0 | 80 | II |
| Симагино | 60 | 30 | 19.0 | 18 | 7.6 | 76 | » |
| Чернявское | 60 | 30 | 4.5 | 19 | 7.1 | 74 | » |
| Еловое | 56 | 42 | 17.0 | 18.5 | 5.7 | 30 | III |
| Чарское | 56 | 43 | 16.0 | 22.0 | 6.2 | 143 | » |
| Свято | 55 | 43 | 14.6 | 22.6 | 7.0 | 54 | » |
| Малое Яичко | 57 | 33 | 4.2 | 20.0 | 5.6 | 170 | II |
| Большое Яичко | 57 | 33 | 1.5 | 22.0 | 6.2 | 370 | » |
| Лопата | 54 | 40 | 5.0 | 23.2 | 7.2 | 440 | » |
| Алексеевское | 54 | 40 | 1.0 | 22.8 | 6.7 | 440 | » |
| Нефёдово | 54 | 40 | 1.0 | 20.4 | 6.9 | 70 | » |
| Белое | 54 | 40 | 1.0 | 20.0 | 6.9 | 380 | » |
| Видогощь | 56 | 36 | 17.0 | 21.9 | – | 50 | » |
| Трестино | 56 | 32 | 4.0 | 20 | 4.8 | 55 | » |
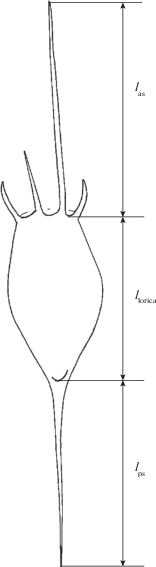
Коловраток выбирали из проб зоопланктона, фиксированных 4%-ным формалином. Для анализа морфологической изменчивости K. bostoniensis промеряли по 10‒100 экз. из каждого водного объекта. Определяли общую длину тела (ltot), длину панциря (llorica), длину самого длинного переднего шипа (las) и заднего (lps) шипа (рис. 1). Измерения проводили с помощью окуляр-микрометра под световым микроскопом МБИ-3 (ЛОМО).
Оценку нормальности распределения морфометрических признаков осуществляли с помощью W-критерия Шапиро–Уилка (Shapiro–Wilk’s W test), данные тестировали на однородность дисперсии с использованием теста Левене (Levene’s test). Поскольку распределение морфометрических признаков коловратки (ltot, llorica, las, lps) отличается от нормального (W-критерий Шапиро–Уилка, p < 0.05), применяли непараметрические методы статистического анализа.
Для сравнения морфометрических параметров коловратки из различных популяций и типов водоемов использовали непараметрический дисперсионный анализ Краскела–Уоллиса, далее проводили множественное сравнение выборок с использованием непараметрического критерия Дана (модифицированный тест Манна–Уитни) (Kruskal–Wallis ANOVA test with post-hoc multiple comparisons of mean ranks for all groups).
Для проведения статистического анализа водные объекты группировали по следующим критериям: максимальной глубине – мелководные (<5 м) и сравнительно глубоководные (>5 м); величине pH воды – ацидные (pH < 5.3), переходные (pH 5.4–6.4) и нейтральные (pH > 6.5); цветности – олигогумозные (<40° Pt-Co шкалы), мезогумозные (40°–80°) и полигумозные (>100°); температуре воды – первая группа (>20°C), вторая группа (20°–25°C), третья группа (<25°C); по трофности – олиготрофные, мезотрофные, эвтрофные, дистрофные и отдельно выделены водотоки, трофический статус которых не определяли; по широте – первая группа (54° с.ш.), вторая группа (55°–57° с.ш.), третья группа (60°‒61° с.ш.) и долготе – первая группа (29°‒30° в.д.), вторая группа (32°‒33° в.д.), третья группа (36°‒37° в.д.), четвертая группа (40° в.д.) и пятая группа (42°‒44° в.д.).
Коэффициент корреляции Спирмена использовали для оценки связи между морфометрическими параметрами K. bostoniensis. Для оценки вариабельности признаков применяли квартильный коэффициент дисперсии:
где Q25 и Q75 – первый и третий квартили соответственно, для каждого набора данных [8].РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Общая длина тела K. bostoniensis из 23 исследованных водных объектов России изменялась от 239 до 480 мкм (табл. 2). Наиболее вариабельна была длина заднего шипа (квартильный коэффициент дисперсии 0.15), наименее вариабельна – длина панциря (квартильный коэффициент дисперсии 0.04). Длина переднего шипа была достоверно (p < 0.05) больше длины заднего шипа и длины панциря. В разных водоемах и водотоках длина панциря коловратки могла быть меньше, равна или больше длины заднего шипа (табл. 2).
Таблица 2.
Морфометрические показатели K. bostoniensis из России и других регионов мира
| Водный объект | n | Длина, мкм | |||
|---|---|---|---|---|---|
| ltot | llorica | las | lps | ||
| Ручей из оз. Тонкое* | 11 | $\frac{{417 \pm 6}}{{367 - 453}}$ | $\frac{{113 \pm 1}}{{106 - 119}}$ | $\frac{{158 \pm 4}}{{128 - 167}}$ | $\frac{{146 \pm 4}}{{125 - 167}}$ |
| Ручей из оз. Кривое* | 100 | $\frac{{320 \pm 2}}{{283 - 414}}$ | $\frac{{105 \pm 4}}{{97 - 111}}$ | $\frac{{121 \pm 1}}{{94 - 161}}$ | $\frac{{93 \pm 1}}{{75 - 142}}$ |
| р. Сережа* | 18 | $\frac{{384 \pm 8}}{{335 - 445}}$ | $\frac{{123 \pm 3}}{{85 - 140}}$ | $\frac{{152 \pm 7}}{{105 - 210}}$ | $\frac{{108 \pm 4}}{{85 - 140}}$ |
| р. Керженец* | 14 | $\frac{{368 \pm 15}}{{272 - 444}}$ | $\frac{{109 \pm 0.5}}{{103 - 119}}$ | $\frac{{139 \pm 7}}{{92 - 167}}$ | $\frac{{120 \pm 8}}{{78 - 164}}$ |
| Озера | |||||
Купецкое* |
50 | $\frac{{312 \pm 4}}{{247 - 364}}$ | $\frac{{100 \pm 1}}{{94 - 111}}$ | $\frac{{124 \pm 2}}{{69 - 150}}$ | $\frac{{88 \pm 2}}{{56 - 125}}$ |
| Экозеро* | 53 | $\frac{{308 \pm 2}}{{261 - 342}}$ | $\frac{{102 \pm 0.4}}{{97 - 111}}$ | $\frac{{119 \pm 1}}{{97 - 139}}$ | $\frac{{88 \pm 1}}{{67 - 106}}$ |
| Тонкое* | 77 | $\frac{{350 \pm 2}}{{311 - 386}}$ | $\frac{{107 \pm 0}}{{97 - 111}}$ | $\frac{{137 \pm 1}}{{117 - 153}}$ | $\frac{{106 \pm 1}}{{83 - 125}}$ |
| Лайнозеро* | 60 | $\frac{{363 \pm 2}}{{325 - 419}}$ | $\frac{{109 \pm 1}}{{103 - 122}}$ | $\frac{{139 \pm 1}}{{111 - 158}}$ | $\frac{{115 \pm 1}}{{92 - 150}}$ |
| Малое Луговское* | 100 | $\frac{{371 \pm 2}}{{267 - 408}}$ | $\frac{{108 \pm 0}}{{97 - 114}}$ | $\frac{{150 \pm 1}}{{117 - 167}}$ | $\frac{{114 \pm 1}}{{42 - 147}}$ |
| Большое Морозовское* | 100 | $\frac{{326 \pm 2}}{{236 - 378}}$ | $\frac{{103 \pm 0.5}}{{92 - 117}}$ | $\frac{{133 \pm 1}}{{103 - 161}}$ | $\frac{{91 \pm 1}}{{64 - 125}}$ |
| Симагино* | 32 | $\frac{{403 \pm 4}}{{364 - 444}}$ | $\frac{{110 \pm 1}}{{100 - 119}}$ | $\frac{{154 \pm 2}}{{128 - 172}}$ | $\frac{{139 \pm 2}}{{117 - 158}}$ |
| Чернявское* | 48 | $\frac{{368 \pm 3}}{{331 - 411}}$ | $\frac{{105 \pm 0.5}}{{100 - 111}}$ | $\frac{{145 \pm 2}}{{117 - 167}}$ | $\frac{{117 \pm 2}}{{92 - 139}}$ |
| Еловое* | 100 | $\frac{{363 \pm 2}}{{317 - 419}}$ | $\frac{{116 \pm 0.5}}{{103 - 131}}$ | $\frac{{132 \pm 1}}{{111 - 167}}$ | $\frac{{115 \pm 1}}{{94 - 150}}$ |
| Чарское* | 56 | $\frac{{378 \pm 3}}{{300 - 427}}$ | $\frac{{110 \pm 1}}{{97 - 117}}$ | $\frac{{145 \pm 2}}{{114 - 172}}$ | $\frac{{123 \pm 2}}{{83 - 144}}$ |
| Свято* | 85 | $\frac{{398 \pm 5}}{{285 - 480}}$ | $\frac{{112 \pm 1}}{{85 - 160}}$ | $\frac{{155 \pm 2}}{{90 - 206}}$ | $\frac{{132 \pm 2}}{{89 - 172}}$ |
| Малое Яичко* | 100 | $\frac{{380 \pm 2}}{{331 - 456}}$ | $\frac{{110 \pm 0}}{{100 - 119}}$ | $\frac{{145 \pm 1}}{{122 - 175}}$ | $\frac{{123 \pm 1}}{{103 - 167}}$ |
| Большое Яичко* | 19 | $\frac{{353 \pm 5}}{{303 - 394}}$ | $\frac{{106 \pm 1}}{{97 - 111}}$ | $\frac{{138 \pm 2}}{{114 - 156}}$ | $\frac{{109 \pm 3}}{{83 - 133}}$ |
| Лопата* | 100 | $\frac{{335 \pm 2}}{{269 - 381}}$ | $\frac{{107 \pm 0}}{{94 - 128}}$ | $\frac{{133 \pm 1}}{{94 - 158}}$ | $\frac{{94 \pm 1}}{{72 - 114}}$ |
| Алексеевское* | 100 | $\frac{{273 \pm 2}}{{234 - 333}}$ | $\frac{{106 \pm 0}}{{94 - 117}}$ | $\frac{{93 \pm 1}}{{72 - 122}}$ | $\frac{{73 \pm 1}}{{56 - 100}}$ |
| Нефёдово* | 100 | $\frac{{309 \pm 2}}{{256 - 358}}$ | $\frac{{105 \pm 0}}{{97 - 117}}$ | $\frac{{119 \pm 1}}{{91 - 147}}$ | $\frac{{86 \pm 1}}{{61 - 111}}$ |
| Белое* | 100 | $\frac{{312 \pm 2}}{{258 - 369}}$ | $\frac{{104 \pm 0}}{{92 - 111}}$ | $\frac{{122 \pm 1}}{{97 - 147}}$ | $\frac{{86 \pm 1}}{{56 - 117}}$ |
| Видогощь* | 12 | $\frac{{345 \pm 4}}{{331 - 372}}$ | $\frac{{105 \pm 1}}{{94 - 111}}$ | $\frac{{140 \pm 2}}{{128 - 153}}$ | $\frac{{101 \pm 2}}{{92 - 117}}$ |
| Трестино* | 100 | $\frac{{379 \pm 0}}{{319 - 439}}$ | $\frac{{112 \pm 0}}{{100 - 119}}$ | $\frac{{143 \pm 0}}{{111 - 166}}$ | $\frac{{124 \pm 0}}{{89 - 152}}$ |
| оз. Веттерн (Швеция) [3] | 100 | $\frac{{380}}{--}$ | – | $\frac{{150}}{--}$ | $\frac{{130}}{--}$ |
| р. Емс (Германия) [22] | 118 | ‒ | $\frac{{115 \pm 1}}{--}$ | $\frac{{113 \pm 2}}{{{\text{м а к с }}.{\text{ }}165}}$ | $\frac{{90 \pm 2}}{{{\text{м а к с }}.{\text{ }}130}}$ |
| Безымянное озеро (США) [3] | – | $\frac{{360}}{--}$ | ‒ | $\frac{{136}}{--}$ | $\frac{{128}}{--}$ |
| оз. Стар (США) [14] | – | $\frac{{368 \pm 3.3}}{--}$ | $\frac{{107 \pm 2}}{--}$ | – | – |
| оз. Тарьянне-веси (Финляндия) [12] | 20 | $\frac{{381 \pm 5.0}}{{340 - 415}}$ | – | $\frac{--}{{130 - 170}}$ | $\frac{{125 \pm 6}}{{100 - 170}}$ |
| оз. Девессе (Франция) [4] | 51 | $\frac{{374 \pm 2.0}}{--}$ | $\frac{{109 \pm 1.0}}{--}$ | $\frac{{139 \pm 1.0}}{--}$ | $\frac{{123 \pm 1.0}}{--}$ |
| вдхр. Фурнас (Бразилия) [6] | 55 | $\frac{{306 \pm 3.0}}{--}$ | $\frac{{101 \pm 1.0}}{--}$ | $\frac{{115 \pm 1}}{--}$ | $\frac{{90 \pm 2.0}}{--}$ |
| оз. Наду (Бразилия) [6] | 65 | $\frac{{285 \pm 2.0}}{--}$ | $\frac{{105 \pm 1.0}}{--}$ | $\frac{{108 \pm 1}}{--}$ | $\frac{{74 \pm 1.0}}{--}$ |
| Бассейн р. Тиетэ (Бразилия) [20] | – | $\frac{--}{{270 - 410}}$ | – | $\frac{--}{{110 - 160}}$ | $\frac{--}{{60 - 120}}$ |
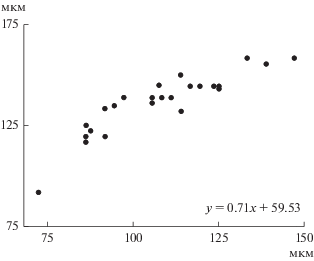
Корреляционный анализ взаимосвязи между медианами длины шипов и панциря K. bostoniensis показал, что длина шипов возрастала с увеличением длины панциря (${{r}_{{{{l}_{{{\text{as}}}}}/{{l}_{{{\text{lorica}}}}}}}}$ = 0.67, p < 0.05; ${{r}_{{{{l}_{{{\text{ps}}}}}/{{l}_{{{\text{lorica}}}}}}}}$ = 0.75, p < 0.05). Длина переднего шипа положительно коррелировала с длиной заднего шипа (${{r}_{{{{l}_{{{\text{as}}}}}/{{l}_{{{\text{ps}}}}}}}}$ = 0.89, p < 0.05) (рис. 2). Однако внутри популяций K. bostoniensis из некоторых водных объектов взаимосвязь между морфометрическими показателями отсутствовала. Так, только в 5 из 23 водоемов и водотоков России прослежена значимая положительная связь между длиной панциря и длиной переднего шипа, в 7 водоемах – между длиной панциря и длиной заднего шипа. Чаще всего (в 19 водных объектах) наблюдали значимое увеличение длины переднего шипа с ростом длины заднего.
Рис. 2.
Взаимосвязь длины переднего и заднего шипов Kellicottia bostoniensis из разных водных объектов. Каждая точка – медиана измерений 10–100 экз. Ось ординат – длина самого длинного переднего шипа, ось абсцисс – длина заднего шипа.
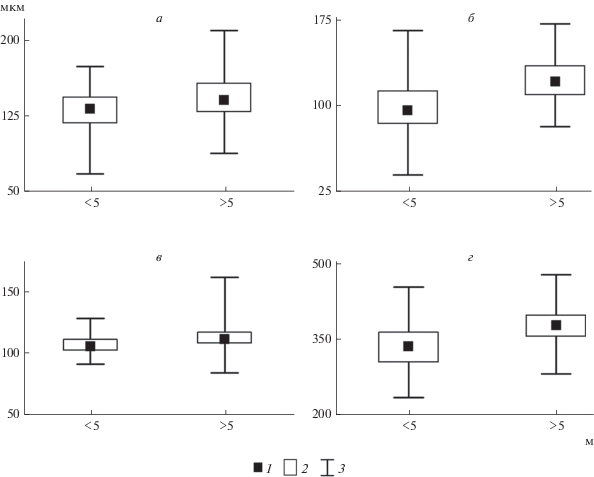
Популяции K. bostoniensis из разных водных объектов статистически значимо различались по морфометрическим показателям (критерий Краскела–Уоллиса, p < 0.05). В мелководных объектах (<5 м) длина панциря и длина шипов K. bostoniensis меньше (p < 0.05), чем в более глубоких (рис. 3).
Рис. 3.
Длина шипов и панциря Kellicottia bostoniensis в водоемах и водотоках c различной глубиной: а – длина переднего шипа, б – длина заднего шипа, в – длина панциря, г – общая длина тела; 1 – медиана, 2 – межквартильный 25–75%-ный интервал, 3 – минимум и максимум. Различия (критерий Краскела–Уоллиса) достоверны при р < 0.05.
Морфометрические показатели K. bostoniensis различались в водоемах и водотоках разного трофического статуса (критерий Краскела–Уоллиса, p < 0.05). Длина панциря и длина шипов коловраток из водотоков и эвтрофных водоемов были сходными, но значимо меньше, чем из мезотрофных водоемов (рис. 4, табл. 3). У коловраток из дистрофных озер эти параметры были значимо (p < 0.05) меньше, чем из эвтрофных и мезотрофных водоемов. Наибольшие размеры панциря и шипов зарегистрированы в мезотрофных озерах, значительно меньшие – в эвтрофных, минимальные – в дистрофных водоемах.
Рис. 4.
Длина шипов и панциря Kellicottia bostoniensis в водоемах различного трофического статуса: а – длина переднего шипа, б – длина заднего шипа, в – длина панциря, г – общая длина тела; I – дистрофный, II – эвтрофный, III – мезотрофный, IV – водотоки. Остальные обозначения, как на рис. 3.
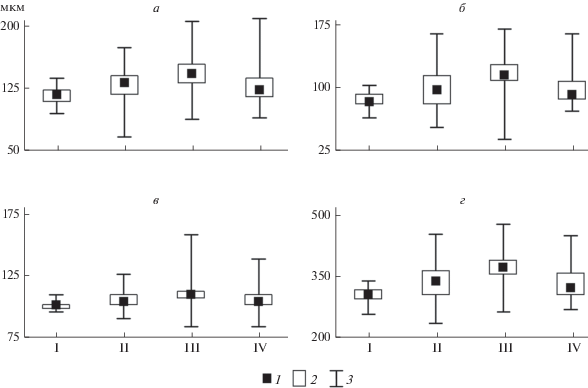
Таблица 3.
Морфометрические показатели K. bostoniensis в водных объектах разного типа
| Параметр водного объекта | n | Длина, мкм | |||
|---|---|---|---|---|---|
| ltot | llorica | las | lps | ||
| Трофический cтатус: | |||||
| мезотрофный | 341 | $\frac{{375}}{{358 - 391}}$ | $\frac{{111}}{{108 - 114}}$ | $\frac{{144}}{{133 - 156}}$ | $\frac{{118}}{{111 - 130}}$ |
| эвтрофный | 998 | $\frac{{342}}{{308 - 367}}$ | $\frac{{106}}{{102 - 111}}$ | $\frac{{133}}{{119 - 142}}$ | $\frac{{100}}{{83 - 117}}$ |
| дистрофный | 53 | $\frac{{308}}{{297 - 319}}$ | $\frac{{103}}{{100 - 102}}$ | $\frac{{119}}{{111--125}}$ | $\frac{{86}}{{83 - 94}}$ |
| водоток | 143 | $\frac{{325}}{{308 - 361}}$ | $\frac{{106}}{{103 - 111}}$ | $\frac{{125}}{{117 - 139}}$ | $\frac{{194}}{{89 - 110}}$ |
| Глубина: | |||||
| мелководный | 1232 | $\frac{{339}}{{308 - 367}}$ | $\frac{{106}}{{103 - 111}}$ | $\frac{{133}}{{119 - 144}}$ | $\frac{{97}}{{86 - 114}}$ |
| относительно глубоководный | 303 | $\frac{{381}}{{358 - 400}}$ | $\frac{{111}}{{108 - 117}}$ | $\frac{{141}}{{131 - 158}}$ | $\frac{{122}}{{111 - 136}}$ |
| Цветность: | |||||
| олигогумозный | 100 | $\frac{{364}}{{347 - 377}}$ | $\frac{{116}}{{111 - 119}}$ | $\frac{{131}}{{122 - 138}}$ | $\frac{{113}}{{111 - 122}}$ |
| мезогумозный | 459 | $\frac{{358}}{{325 - 389}}$ | $\frac{{108}}{{103 - 111}}$ | $\frac{{139}}{{128 - 150}}$ | $\frac{{110}}{{92 - 127}}$ |
| полигумозный | 589 | $\frac{{344}}{{306 - 375}}$ | $\frac{{108}}{{106 - 111}}$ | $\frac{{136}}{{117 - 147}}$ | $\frac{{100}}{{83 - 119}}$ |
| pH | |||||
| нейтральный | 1048 | $\frac{{328}}{{306 - 356}}$ | $\frac{{106}}{{103 - 111}}$ | $\frac{{131}}{{116 - 142}}$ | $\frac{{94}}{{83 - 111}}$ |
| переходный | 375 | $\frac{{372}}{{358 - 386}}$ | $\frac{{111}}{{108 - 111}}$ | $\frac{{142}}{{136 - 153}}$ | $\frac{{117}}{{111 - 125}}$ |
| ацидный | 100 | $\frac{{347}}{{367 - 390}}$ | $\frac{{111}}{{111 - 114}}$ | $\frac{{144}}{{139 - 150}}$ | $\frac{{124}}{{117 - 131}}$ |
| Температура, °C | |||||
| <20 | 471 | $\frac{{342}}{{317 - 367}}$ | $\frac{{108}}{{102 - 111}}$ | $\frac{{131}}{{122 - 142}}$ | $\frac{{106}}{{92 - 117}}$ |
| 20–25 | 964 | $\frac{{353}}{{317 - 381}}$ | $\frac{{108}}{{106 - 111}}$ | $\frac{{138}}{{122 - 147}}$ | $\frac{{108}}{{89 - 122}}$ |
| >25 | 100 | $\frac{{327}}{{310 - 344}}$ | $\frac{{103}}{{100 - 106}}$ | $\frac{{133}}{{122 - 142}}$ | $\frac{{92}}{{83 - 99}}$ |
| Широта, ° с.ш. | |||||
| 54 | 400 | $\frac{{308}}{{283 - 331}}$ | $\frac{{106}}{{103 - 108}}$ | $\frac{{119}}{{103 - 131}}$ | $\frac{{86}}{{75 - 94}}$ |
| 55–57 | 504 | $\frac{{375}}{{358 - 394}}$ | $\frac{{111}}{{108 - 114}}$ | $\frac{{141}}{{133 - 153}}$ | $\frac{{122}}{{111 - 131}}$ |
| 60–61 | 631 | $\frac{{344}}{{317 - 369}}$ | $\frac{{106}}{{103 - 108}}$ | $\frac{{136}}{{125 - 147}}$ | $\frac{{102}}{{89 - 117}}$ |
| Долгота, ° в.д. | |||||
| 29–30 | 280 | $\frac{{361}}{{335 - 381}}$ | $\frac{{106}}{{103 - 108}}$ | $\frac{{144}}{{136 - 153}}$ | $\frac{{111}}{{97 - 122}}$ |
| 32–33 | 219 | $\frac{{375}}{{364 - 389}}$ | $\frac{{111}}{{108 - 111}}$ | $\frac{{142}}{{139 - 150}}$ |
$\frac{{122}}{{117 - 131}}$ |
| 36–37 | 363 | $\frac{{331}}{{311 - 356}}$ | $\frac{{106}}{{103 - 108}}$ | $\frac{{131}}{{119 - 139}}$ | $\frac{{97}}{{89 - 111}}$ |
| 40 | 400 | $\frac{{308}}{{283 - 331}}$ | $\frac{{106}}{{103 - 108}}$ | $\frac{{119}}{{102 - 131}}$ | $\frac{{86}}{{75 - 94}}$ |
| 42–44 | 273 | $\frac{{378}}{{355 - 397}}$ | $\frac{{111}}{{108 - 117}}$ | $\frac{{139}}{{131 - 156}}$ | $\frac{{122}}{{111 - 133}}$ |
Морфометрические показатели коловратки значимо различались в водоемах и водотоках с разным уровнем цветности (критерий Краскела–Уоллиса, p < 0.05). Общая длина тела, длина панциря и заднего шипа были больше в олигогумозных водоемах (p < 0.05), тогда как размер переднего шипа – больше в мезогумозных (p < 0.05). В полигумозных водных объектах морфометрические показатели были ниже или близки к таковым в мезогумозных (рис. 4, табл. 3).
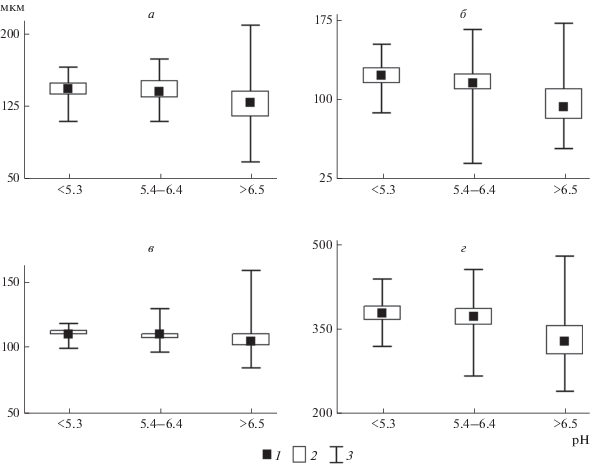
По морфометрическим показателям коловратки значимо различались в водоемах с разной величиной pH (критерий Краскела–Уоллиса, p < 0.05). Общая длина тела и размеры шипов были сходны в водных объектах ацидного и переходного типов (p > 0.05), но достоверно больше таковых у коловраток из незакисленных водоемов (рис. 5, табл. 3).
Рис. 5.
Длина шипов и панциря Kellicottia bostoniensis в водоемах с различной величиной pH воды. а – длина переднего шипа, б – длина заднего шипа, в – длина панциря, г – общая длина тела. Остальные обозначения, как на рис. 3.
Температура воды влияла на общую длину тела, длину панциря и заднего шипа (критерий Краскела–Уоллиса, p < 0.05) и не влияла на размер переднего шипа (p > 0.05). В оз. Большое Морозовское с температурой воды >25°C морфометрические показатели были ниже, чем в водных объектах с более низкой температурой воды (15‒20°C) (табл. 3).
Морфометрические параметры значимо различались в водоемах и водотоках, имеющих разное географическое положение (критерий Краскела–Уоллиса, p < 0.05). Наиболее крупные особи K. bostoniensis отмечены между 55° и 57° с.ш., наименьшие размеры панциря и шипов были у коловраток из водных объектов, расположенных южнее (табл. 3). Коловратки из водоемов и водотоков западных (западнее 33° в.д.) и восточных (восточнее 40° в.д.) районов имели бóльшие размеры шипов (p < 0.05), чем из водоемов, расположенных между ними (табл. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В сем. Brachionidae различные морфотипы Keratella hiemalis Carlin, K. cochlearis (Gosse), K. quadrata (Müller), Brachionus calyciflorus Pallas и B. forficula Wierzejski индуцируются факторами окружающей среды, глубокой генетической дивергенции между морфами не обнаружено [9, 13, 19, 23]. Вариации размера тела коловраток могут быть вызваны рядом факторов – температурой воды и еe вязкостью, количеством пищи, численностью самих животных и наличием хищников [2, 6, 15, 16, 21].
У Kellicottia bostoniensis, как и у Keratella cochlearis и K. quadrata [1], наименее вариабельна длина панциря. Длина шипов наиболее изменчива, она чаще определяла вариации общего размера тела Kellicottia bostoniensis. Для близкого вида Kellicottia longispina из водоемов Северной Америки [11] описана морфологическая изменчивость в большом диапазоне географической широты (47°‒71° с.ш.) и температуры (1.2‒18.0°С). Показано, что популяции K. longispina из девяти водоемов морфологически отличались хотя бы по одному параметру. Наибольшая длина переднего шипа характерна для особей из арктического озера. Отмечена тенденция снижения размеров тела и шипов с севера на юг и с повышением температуры, но значимые различия отмечены только для крайних точек [11]. Сходные изменения морфологических параметров тела выявлены и для K. bostoniensis.
У K. bostoniensis наибольшие размеры панциря и шипов зарегистрированы в мезотрофных озерах, значительно меньшие – в эвтрофных и минимальные в дистрофных водоемах. Сходные вариации известны для K. cochlearis [16], в олиготрофных озерах длина заднего шипа этого вида больше, чем в эвтрофных. В олиготрофных и холодноводных местах обитания доминируют особи K. cochlearis с динными шипами, а в теплых и эвтрофных озерах преобладают формы с короткими шипами или без шипов [21]. Максимальные размеры панциря K. cochlearis наблюдаются при низкой температуре воды и слабой обеспеченности пищей [10].
Наибольшие размеры Kellicottia bostoniensis также характерны для глубоких и холодных водоемов. Показано [24], что в мелких водоемах размер шипов K. bostoniensis связан в основном с присутствием потребляющих ее хищников (коловраток рода Asplanchna). В глубоководных озерах с температурной стратификацией в дополнение к этому играет роль изменение с глубиной плотности и вязкости воды.
В тропических водоемах Южной Америки K. bostoniensis имеет малые размеры по сравнению с коловратками из водоемов Северной Америки и Западной Европы [3, 7, 12, 20]. Небольшие размеры K. bostoniensis из тропических водоемов исследователи объясняют недавним вселением этого вида и отсутствием избирательного хищника – коловраток рода Asplanchna [7]. Однако, по нашему мнению, это может быть связано и с более высокой температурой воды.
В целом, коловратки из водоемов Западной Европы такие же крупные, как и в нативных биотопах Северной Америки (табл. 2). В европейской части России (ручей из оз. Тонкое, озера Симагино, Малое Яичко, Трестино, Свято, Чарское) обнаружены популяции с крупными особями, сравнимыми по размерам тела с европейскими и североамериканскими. Также найдены популяции и мелкоразмерной K. bostoniensis (пойменные водоемы р. Пра и некоторые озера Вологодской обл.) сходные с южноамериканскими коловратками.
На территории РФ не выявлено четкой тенденции изменения размеров тела K. bostoniensis с запада на восток и с севера на юг (табл. 3), однако популяции коловратки из водоемов и водотоков в разных регионах различались. Наибольшие размеры тела характерны для коловраток, обитающих на северо-западе (Ленинградская, Новгородская и Тверская области) и юго-востоке европейской части России (Нижегородская обл.), наименьшие – на севере (Вологодская обл.) и юге (Рязанская обл.).
Выводы. Коловратка K. bostoniensis обитает в широком диапазоне условий среды. Морфологический анализ популяций из 23 водных объектов показал, что наиболее вариабельный признак – длина заднего шипа, наименее вариабельный – длина панциря. Длина переднего и заднего шипов коррелирует положительно. Зарегистрировано увеличение длины шипов с ростом длины панциря. Размеры коловратки различаются в водоемах разного трофического статуса, с разными глубинами, уровнем pH и цветностью воды. Выявлено увеличение размеров тела в мезотрофных, ацидных и глубоких водных объектах.
Список литературы
Лазарев М.И. Пространственное распределение массовых видов коловраток в пелагиали озера Байкал: Автореф. дис. … на соискание ученой степени канд. биол. наук. Борок, 2007. 24 с.
Эрман Л.А. Цикломорфоз и питание планктонных коловраток // Зоол. журн. 1962. Т. 41. Вып. 7. С. 998−1003.
Arnemo R., Berzins B., Gronberg B., Mellgren I. The Dispersal in Swedish Waters of Kellicottia bostoniensis (Rousselet) (Rotatoria) // Oikos. 1968. V. 19. № 2. P. 351–358.
Balvay G. First Record of the Rotifer Kellicottia bostoniensis (Rousselet, 1908) in France // J. Plankton Res. 1994. V. 16. № 8. P. 1071–1074.
Bayanov N.G. Occurrence and Abundance Level of Kellicottia bostoniensis (Rousselet, 1908) in Lakes of the Nizhny Novgorod region // Rus. J. Biol. Invasions. 2014. V. 5. № 2. P. 111–114.
Beauchamp P. Classe des Rotifers // Traite de Zoologie, Anatomie, Systematique, Biologie. 1965. V. 4. № 3. P. 1225–1379.
Bezerra-Neto J.F., Aguila L.R., Landa G.G., Pinto-Coelho R.M. The exotic rotifer Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in the zooplankton community in a tropical reservoir // Lundiana. 2004. V. 5. № 2. P. 151–153.
Bonett D.G. Confidence interval for a coefficient of quartile variation // Computational Statistics & Data Analysis. 2006. V. 50. № 11. P. 2953–2957.
Derry A.M., Hebert P.D.N., Prepas E.E. Evolution of rotifers in saline and subsaline lakes: A molecular phylogenetic approach // Limnol., Oceanogr. 2003. V. 48. P. 675–685.
Diéguez M., Modenutti B., Queimaliños C. Influence of abiotic and biotic factors on morphological variation of Keratella cochlearis (Gosse) in a small Andean lake // Hydrobiologia. 1998. V. 387/388. P. 289–294.
Edmondson W.T., Litt A.H. Morphological variation in Kellicottia longispina // Hydrobiologia. 1989. V. 186/187. P. 109–117.
Eloranta P. Kellicottia bostoniensis (Rousselet), a Plankton Rotifer Species New to Finland // Ann. Zool. Fenn. 1988. V. 25. P. 249–252.
Ge Y.L., Xi Y.L., Ma J., Xu D.D. rDNA ITS sequences among morphotypes of Keratella cochlearis, Keratella quadrata and Brachionus forficula (Rotifera) // Gen. and Molecular Res. 2012. V. 11. № 1. P. 765–774.
Gilbert J.J. The effect of Daphnia interference on a natural rotifer and ciliate community: Short-term bottle experiments // Limnol., Oceanogr. 1989. V. 34. № 3. P. 606–617.
Green J. Morphological variation of Keratella cochlearis (Gosse) in a backwater of the River Thames // Hydrobiologia. 2005. V. 546. P. 189–196.
Green J. Morphological variation of Keratella cochlearis (Gosse) in Myanmar (Burma) in relation to zooplankton community structure // Hydrobiologia. 2007. V. 593. P. 5–12. https://doi.org/10.1007/s10750-007-9072
Krainev E.Yu., Tselishcheva E.M., Lazareva V.I. American rotifer Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in the Kama Reservoir (Kama River, Russia) // Inland Water Biology. 2018. V. 11. № 1. P. 42–45. doihttps://doi.org/ 10.1134/S199508291801008X
Lazareva V.I., Zhdanova S.M. American rotifer Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in the resrvoirs of the Upper Volga Basin // Inland Water Biology. 2018. V. 7. № 3. P. 259–263. https://doi.org/10.1134/S1995082914030110
Li H.B., Xi Y.L., Cheng X.F., Xiang X.L. Sympatric speciation in rotifers: evidence from molecular phylogenetic relationships and reproductive isolation among Brachionus calyciforus clones // Acta Zool. Sin. 2008. V. 54. P. 256–264.
Lucinda I., Moreno I.H., Melão M.G.G., Matsumura-Tundisi T. Rotifers in freshwater habitats in the Upper Tietê River Basin, São Paulo State, Brazil // Acta Limnol. Bras. 2004. V. 16. № 3. P. 203–224.
Pejler B. Variation in the genus Keratella // Hydrobiologia. 1980. V. 73. P. 207–213.
Schulz H. Biometrische Messungen an Kellicottia bostoniensis (Rousselet) // Mitt. Hamburg. Zool. Mus. und Inst. 1964. V. 61. S. 117–121.
Zhang J.Y., Xi Y.L., Ma Q, Xiang X.L. Taxonomical status of two Brachionus calyciforus morphotypes in Lake Liantang based on ITS sequence // Acta Hydrobiol. Sin. 2010. V. 34. P. 935–942.
Zhdanova S.M., Dobrynin A.E. Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in waterbodies of European Russsia // Inland Water Biology. 2011. V. 4. № 1. P. 39–47. https://doi.org/10.1134/S1995082911010147
Zhdanova S.M., Lazareva V.I., Bayanov N.G. et al. Distribution and ways of dispersion of American rotifer Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in waterbodies of European Russia // Russ. J. Biological Invasions. 2016. V. 7. № 4. P. 308–320.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод