Биология внутренних вод, 2019, № 2-1, стр. 21-32
Педоморфные тенденции в эволюции группы видов Daphnia (Daphnia) longispina s. l. (Crustacea: Cladocera: Daphniidae)
А. Г. Кирдяшева 1, А. А. Котов 2, 3, *
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Некоузский р-н, Ярославская обл., пос. Борок, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Ленинский проспект, д. 33, Россия
3 Казанский федеральный yниверситет
420008 Казань, ул. Кремлевская, д. 18, Россия
* E-mail: alexey-a-kotov@yandex.ru
Поступила в редакцию 18.01.2017
После доработки 22.02.2017
Принята к публикации 10.03.2017
Аннотация
Рассмотрены педоморфные тенденции в эволюции пелагических дафний на примере представителей группы Daphnia longispina s. l. (Crustacea: Cladocera: Daphniidae). Они проявляются в уменьшении общей длины тела животного, длины туловища и относительной длины рострума, относительной длины постабдоминальных выростов, снижении количества зубчиков постабдомена и удлинении хвостовой иглы, плавательных антенн и постабдоминальных щетинок. Педоморфные тенденции у самцов Daphnia cucullata Sars проявляются в схожести их морфологии с морфологией самок, у самцов Daphnia galeata Sars – с неполовозрелыми самцами Daphnia longispina (O.F. Müller). Педоморфная эволюция и адаптация к пелагическому образу жизни могут быть тесно взаимосвязаны, идти параллельно или даже независимо друг от друга, в чем проявляется мозаичность эволюции.
ВВЕДЕНИЕ
Ветвистоусые рачки рода Daphnia O.F. Müller, 1785 (Crustacea: Cladocera: Daphniidae) – модельный объект современной экологии, физиологии и токсикологии [12, 26, 33]. В настоящее время их эволюционную биологию и систематику изучают с применением современных молекулярно-генетических методик [13, 29, 31, 32]. При этом, если в ХХ в. проблемы морфологической эволюции дафний обсуждали весьма широко [2, 17, 35, 37], то в настоящее время интерес к морфологическим исследованиям во многом утрачен, за исключением некоторых избранных “модных” проблем [30, 34]. Обобщенная информация по морфологической эволюции отр. Anomopoda, к которому относится и сем. Daphniidae Straus, 1820, была недавно представлена А. А. Котовым [9], однако проблемы, связанные с морфологической эволюцией в пределах отдельных семейств и родов ветвистоусых ракообразных, требуют внимания специалистов, в частности недостаточное внимание уделяется анализу эволюционных изменений в отдельных семействах и родах при переходе к пелагическому образу жизни.
Вопросы о проникновении прибрежных видов в зоопланктон и о генезисе эузоопланктона активно обсуждаются в гидробиологической литературе, начиная с работ Фореля [15], Везенберг-Лунда [36] и Вольтерека [37]. Развитие представлений о происхождении планктона от крайне наивных теорий конца ХIХ в. до более реалистичных (хотя и не всегда) идей конца 1960-х годов подробно освещено И.А. Киселевым [8]. При этом ветвистоусые ракообразные для большинства из перечисленных авторов были модельной группой в понимании генезиса планктона. Следует отметить, что у многих гидробиологов создалось превратное представление о ветвистоусых ракообразных как преимущественно планктонной группе [9]. На самом деле, планктонный образ жизни присущ незначительной их части. Жизнь подавляющего большинства кладоцер, в той или иной мере, ассоциирована с субстратом [3, 9, 17]. Даже в подроде Daphnia (Daphnia), к которому относятся наиболее типичные обитатели пелагиали крупных водоемов, например D. galeata Sars и D. cucullata Sars, такой образ жизни отмечен у меньшинства видов. В подроде выделены две большие группы видов – D. (D.) pulex и D. (D.) longispina. В пределах последней группы, в состав которой входят наиболее типичные пелагические виды крупных озер, также встречаются виды, явно предпочитающие более мелкие водоемы, т.е. у данной группы имеются виды с разным образом жизни.
Цель работы – проанализировать изменения основных морфологических структур в ряду видов D. longispina (O.F. Müller)–D. galeata–D. cucullata и выявить педоморфные тенденции в эволюции этой группы видов дафний.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для работы послужили представители группы видов D. (D.) longispina из 23 водоемов разного типа, расположенных в европейской части России, а также в западной и южной частях Восточной Сибири. Характеристики водоемов даны в табл. 1. Пробы отбирали планктонной сетью Апштейна и гидробиологическим сачком. Использовали газ с размером ячеи 64 мкм, пробы фиксировали 4%-ным формалином. Измерения проводили по единой схеме (рис. 1). Морфологию D. galeata и D. cucullata изучали в водоемах, где обитала только одна из них и отсутствовали другие виды группы D. longispina s. l. Для выявления педоморфных тенденций в ряду D. longispina–D. galeata–D. cucullata анализировали признаки взрослых и ювенильных особей D. longispina. Сравнивали особей первого и второго возрастов со взрослыми дафниями из той же популяции. Признаки, по которым обнаруживали различия между ювенильными и взрослыми особями D. longispina, использовали для сравнения трех видов Daphnia.
Таблица 1.
Характеристика водных объектов
| Местонахождение | Водный объект | Площадь, км2 | Глубина максимальная (средняя), м | Вид Daphnia |
|---|---|---|---|---|
| Озера | ||||
| Красноярский край, центральная часть Западного Саяна | ||||
| южный склон хребта Кулумыс, высота 1416 м | Ойское | 0.56 | 25 | D. galeata |
| район хребта Ергаки, высота 1631 м | Нижнее Буйбинск (Каровое) | ~0.07 | ~9 (3–5) | D. longispina |
| Тюменская обл., Бердюжский р-н | Труханское | ~0.8 | – | D. galeata |
| Глубокое | ~1 | 3 (2.5) | То же | |
| пос. Бердюжье | Травное | 0.76 | 1.8 (1.4) | » |
| д. Истошино | Травное | 2.15 | – | » |
| Ямало-Ненецкий автономный округ, | ||||
| г. Октябрьск | Ханто | ~2.5 | 6 (1) м в месте отбора проб | » |
| Мурманская обл., Кировский р-н | Большой Вудъявр | 3.24 | 40 | D. galeata |
| Малый Вудъявр | 1.5 | ~10 (~5) | То же | |
| Ярославская обл., Некрасовский р-н пос. Черная заводь |
Чистое | 4.5 | 1.8 (1) | D. cucullata |
| Владимирская обл., Вязниковский р-н | Кщара | 1.32 | 4–11 м в месте отбора проб | D. hyalina |
| Республика Чувашия Алатырский р-н, Гос. природный заповедник “Присурский” | Большое Щучье | ~0.19 | 11 (3–4) | D. cucullata |
| Вурнарский р-н | Кюльхири | 0.15 | 13.7 | То же |
| Водохранилища | ||||
| Тульская обл. Суворовский р-н | Черепетское | 9 | (3–5) | D. cucullata |
| Ярославская обл., Некоузский р-н напротив устья р. Сутка |
Рыбинское | – | 3–3.5 | То же |
| Реки и старицы | ||||
| Тюменская обл. р. Полуй | Старица | – | (1.5–2) | D. longispina |
| Красноселькупский р-н, бассейн р. Таз, р. Варка-Корылька | Старица | – | То же | |
| Ярославская обл., Некоузский р-н | р. Латка, бобровые пруды | Сильно варьирует в течение сезона | 3 | » |
| р. Ильдь | – | 3 м в месте отбора проб | » | |
| Небольшие постоянные и временные водоемы | ||||
| Челябинская обл. ручей Совхозный | Пруд | – | – | D. longispina |
| Pеспублика Чувашия, Цивильский р-н | Пруд Шишнеперский | ~0.3 | (4.2) | D. cucullata |
| г. Москва | Пруд на Ленинских горах | – | – | D. longispina |
| Ярославская обл., Некоузский р-н пос. Борок, стационар “Сунога” |
Пруды | ~0.001–0.002 | 0.5–2 | То же |
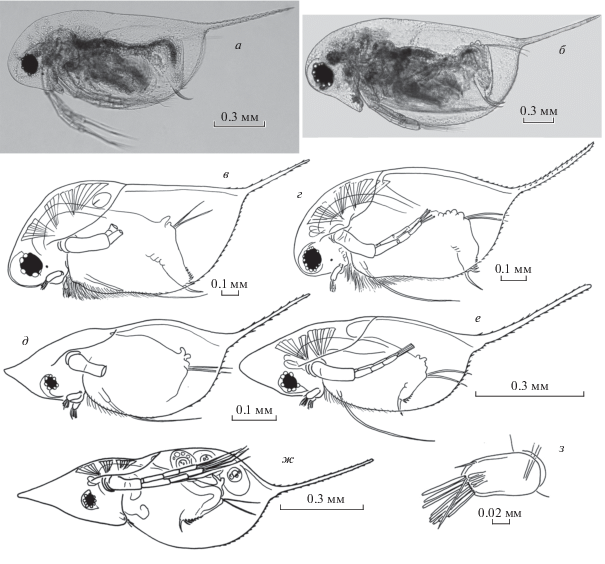
Рис. 1.
Схема измерений дафний. а – параметры тела: А–Б – общая длина, А–В – длина головы, В–Б – длина тела, Б–Г – длина хвостовой иглы, Д–Е – высота головы, Е–Ж – длина рострума, З–И – длина плавательных антенн; б – параметры постабдомена: А–Б – длина постабдомена, Б–В – длина постабдоминальных щетинок, Г–Д – длина первого абдоминального выроста, Е–Ж – длина второго абдоминального выроста, З–И – длина третьего абдоминального выроста.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
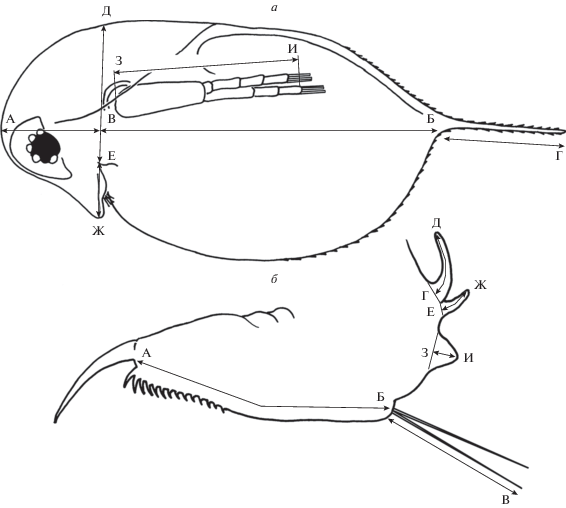
Общая длина тела животного и длина туловища (без хвостовой иглы). В ряду D. longispina–D. galeata–D. cucullata наблюдается тенденция к снижению как максимальных, так и средних значений общей длины (рис. 2а). Несмотря на наличие шлема у D. galeata и D. cucullata, в целом общая длина самок заметно меньше, чем таковая у D. longispina, не имеющей шлема. При этом, если между D. longispina и D. galeata различия по этим признакам относительно невелики (хотя статистически значимы), то D. cucullata сильно отличается от двух других видов как малой общей длиной животного, так и малой длиной тела (рис. 2а, 2б). Средний размер взрослых D. cucullata часто сопоставим с размером новорожденных D. longispina или даже меньше последнего.
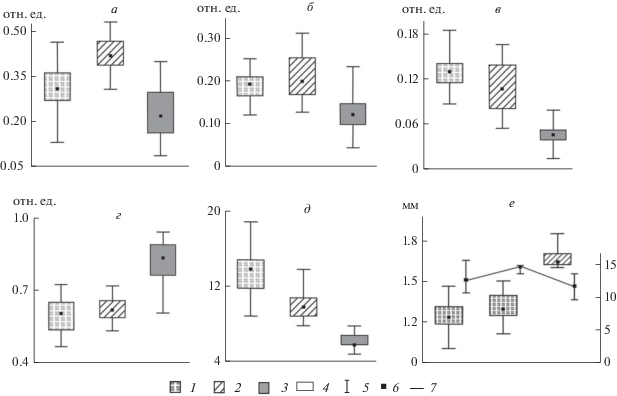
Рис. 2.
Межвидовые различия трех видов Daphnia: а – общая длина; б – длина тела; в – относительная длина хвостовой иглы; г – относительная длина плавательных антенн; д – относительная длина головы D. galeata из популяций со шлемом и D. cucullata; е – относительная длина рострума D. galeata и D. longispinа. 1 – D. longispina, 2 – D. galeata, 3 – D. cucullata, 4 – межквартильный 25–75% интервал, 5 – min–max, 6 – медиана. Все различия статистически значимы при р < 0.05.
Относительная длина хвостовой иглы и плавательных антенн (к длине тела). Относительная длина хвостовой иглы в ряду D. longispina–D. galeata–D. cucullata увеличивается (рис. 2в). При этом различия в длине иглы между D. galeata и D. cucullata меньше, чем между каждым из этих двух видов и D. longispina. Аналогичная картина наблюдается и при сравнении относительной длины плавательных антенн (рис. 2г). Относительная длина хвостовой иглы и плавательных антенн у ювенильных D. longispina больше, чем у взрослых особей.
Относительная длина головы (к длине тела). У ювенильных D. longispina относительная длина головы больше, чем у взрослых особей. Относительная длина головы у D. cucullata, в целом больше, чем у D. galeata – у первого вида шлем развит сильнее. На рис. 2д показано различие в относительной длине головы между D. galeata и D. cucullata из популяций со шлемом.
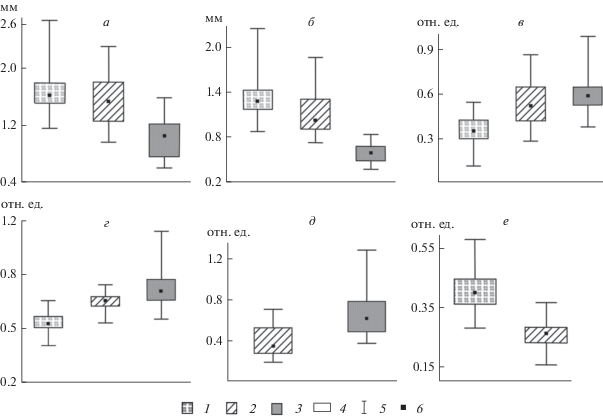
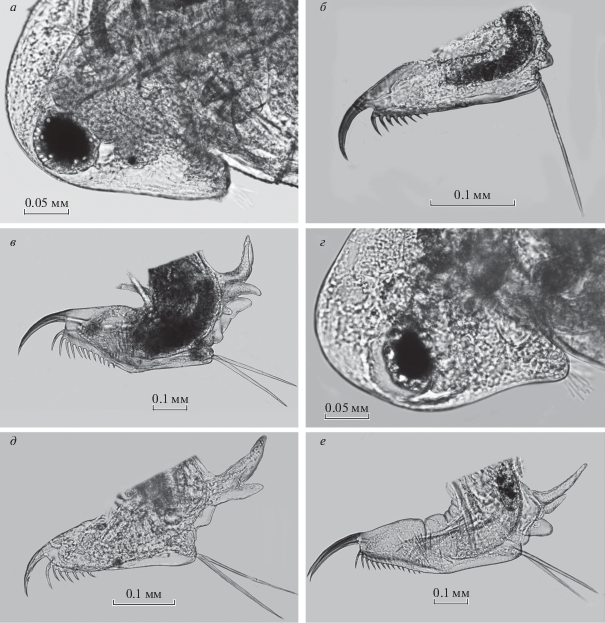
Обнаружены некоторые особенности морфологии шлема, встречающиеся у ювенильных особей D. galeata и взрослых D. cucullata. У молоди D. galeata верхушка шлема часто имеет вид шипика, иногда раздвоенного (рис. 3а–3в). Аналогичное строение шлема отмечено у взрослых D. cucullata (рис. 3г–3ж). У взрослых особей D. galeata шлем такой формы не обнаружен. К сожалению, недостаточное количество материала не позволяет статистически проверить предположение о том, что эта особенность является педоморфным признаком.
Рис. 3.
Ювенильный самец D. galeata из оз. Большой Вудъявр (а–в) и взрослые самки D. cucullata из оз. Щучье (г–ж): a, г, е – вид сбоку, б, в – голова, д, ж – шлем.
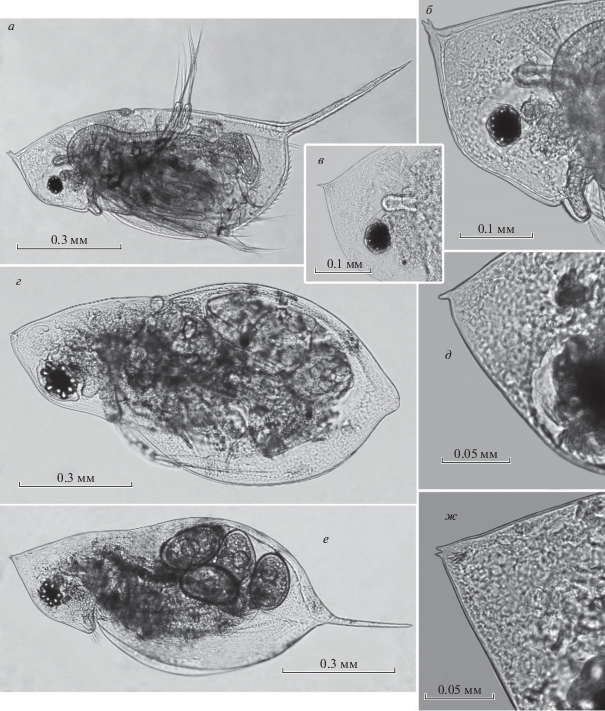
Относительная длина рострума (к высоте головы) и форма нижнего края головы. У ювенильных D. longispina, в отличие от взрослых особей, рострум короткий, тупой, эстетаски отходят почти от кончика рострума (у особей первого возраста). Нижний край головы прямой или слабовогнутый (рис. 4а). Длина рострума у D. galeata в целом меньше, чем у D. longispina (рис. 2е), соответственно эстетаски выступают за кончик рострума в большей степени и, как правило, рострум у D. galeata более широкий и тупой. У D. cucullata рострум совсем короткий и округлый, эстетаски отходят от самого его кончика, нижний край головы вогнут слабо или не вогнут совсем. По этим признакам взрослая D. cucullata сходна с ювенильными особями D. longispina (рис. 4б).
Рис. 4.
Головы и постабдомены Daphnia longispina (а–в), D. cucullata (г, д) и D. galeata (е): а – голова самки первого возраста, б – постабдомен ювенильной самки, в, д, е – постабдомены взрослой самки, г – голова взрослой самки.
Постабдомен. Преанальный угол постабдомена у ювенильных D. longispina не выражен, количество постабдоминальных зубчиков меньше, чем у взрослых особей (рис. 4в). Морфология постабдомена относительно сходна у взрослых D. longispina и D. galeata: преанальный угол постабдомена у обоих видов, как правило, достаточно сильно или в средней степени выражен (рис. 4г, 4д). У взрослых самок D. cucullata угол выражен слабо или полностью отсутствует (рис. 4е). По этому признаку форма постабдомена D. cucullata напоминает таковую ювенильных особей дафний других видов.
У ювенильных особей D. longispina абдоминальные выросты не развиты (рис. 4в), относительная длина постабдоминальных щетинок (длина постабдоминальных щетинок/длина постабдомена) больше, чем у взрослых особей. У D. galeata и D. longispina относительная длина абдоминальных выростов (к длине постабдомена) и относительная длина постабдоминальных щетинок мало отличаются между видами (рис. 5а–5в). У D. cucullata абдоминальные выросты короче, чем у D. longispina и D. galeata (рис. 5а–5г), постабдоминальные щетинки, наоборот, длиннее (рис. 5г). Количество постабдоминальных зубчиков в ряду D. longispina–D. galeata–D. cucullata резко снижается (рис. 5д).
Рис. 5.
Межвидовые различия трех видов Daphnia: а–в – относительная длина абдоминальных выростов (а – первого, б – второго, в – третьего); г – относительная длина постабдоминальных щетинок; д – количество постабдоминальных зубчиков; е – длина тела (по оси ординат слева) и количество постабдоминальных зубчиков (по оси ординат справа) D. longispina из двух популяций и D. galeata из одной популяции. Различия статистически значимы при р < 0.05, кроме различий между D. longispina и D. galeata в длине постабдоминальных щетинок, длине второго и третьего абдоминальных выростов и между двумя популяциями D. longispina в числе зубчиков (р > 0.05). Обозначения 1–6, как на рис. 2; 7 – кривая, количество постабдоминальных зубчиков.
Признаки самцов. Ювенильные самцы D. longispina слабо отличаются по форме тела от ювенильных самок (рис. 6а, 6б). Некоторые признаки, характерные для самок D. longispina, отмечены у самцов D. galeata и D. cucullata (рис. 6г–6е): угол передненижнего края створок слабо выражен, вооружение переднего края створок развито слабее, антеннулы более короткие (рис. 6з), спинной край створок выпуклый. Различия между самцами D. longispina, D. galeata и D. cucullata по морфометрическим признакам аналогичны таковым между самками этих видов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Перечисленные выше признаки характерны для взрослых особей видов, ведущих преимущественно пелагический образ жизни в крупных водоемах (D. galeata, D. cucullata) и ювенильных особей D. longispina, характерной для меньших водоемов. По нашему мнению, выявленные выше отличия между видами частично объясняются педоморфными тенденциями в морфологическом ряду D. longispina–D. galeata–D. cucullata, который одновременно может быть истолкован как эволюционный ряд перехода от обитания в небольших водоемах к жизни в пелагиали крупных озер.
Педоморфоз – одна из форм гетерохроний, т.е. изменений относительных сроков созревания. В настоящее время термин педоморфоз имеет широкое толкование и означает эволюционное изменение онтогенеза, связанное с сохранением во взрослом состоянии признаков любых более ранних стадий индивидуального развития, в том числе и неличиночных [6, 7]. Педоморфоз может осуществляться двумя разными способами: путем неотении и путем прогенеза, обеспечивая “легкую в генетическом отношении эволюционную реакцию на давление со стороны среды, поскольку при этом может быть использована морфогенетическая система, которая уже интегрирована в организм” [4, 11, 18].
Данная проблематика широко обсуждалась применительно к ветвистоусым ракообразным в связи с гипотезой об их неотеническом происхождении от “конхострак” [1, 16, 27]. Мы не будем приводить здесь аргументы сторон “за” и “против” таковой. Отметим, что стоит говорить не о глобальной неотенизации при происхождении кладоцер, а скорее о “постепенном прогенетическом процессе” [16] в их эволюции. Кроме того, в эволюции как ветвистоусых ракообразных в целом, так и дафний, только меньшая часть признаков видоизменяется по некоему гетерохронному сценарию, в то время как бóльшая – эволюционирует по другим сценариям или остается неизменной. В данном случае концепция неотенического происхождения кладоцер представляется менее важной, чем концепция мозаичности эволюции. В связи с этим будем рассматривать лишь педоморфные тенденции в ряду D. longispina–D. galeata–D. cucullata, объясняющие только одну из сторон морфологической эволюции в пределах этого ряда.
В практике филогенетических исследований неотения и прогенез трудно различимы [10]. Однако описанные выше морфологические изменения явно скоррелированы с уменьшением размера животного в ряду D. longispina–D. galeata–D. cucullata. При этом именно прогенез часто представляет собой реакцию на условия среды, в которых высокий уровень размножения и/или малые размеры отдельной особи оказываются наиболее выгодными. В некоторых из таких случаев отбор может идти не на какой-то определенный признак, а на малые размеры тела как таковые, в результате чего зрелый в репродуктивном отношении организм приобретает ювенильные черты или сочетает ювенильные и взрослые признаки [11]. Это характерно для рассматриваемых пелагических видов дафний [20, 21, 28]. В литературе по кладоцерам преимущественно обсуждалось, что уменьшение размеров тела снижает видимость рачков для позвоночных хищников (рыб) [24, 25].
Отметим, что педоморфная эволюция и адаптация к пелагическому образу жизни могут быть тесно взаимосвязаны, идти параллельно или независимо друг от друга, в чем проявляется мозаичность эволюции. Однако второй вариант представляется наиболее естественным. Например, удлинение плавательных антенн и хвостовой иглы повышает способность рачка противостоять погружению [8, 9, 22, 23]. Следовательно, эти признаки можно рассматривать и как адаптацию к пелагическому образу жизни, по-видимому, не связанную напрямую с педоморфозом. Однако, промежуточное положение D. galeata по этим признакам, несмотря на то, что этот вид, как и D. cucullata, пелагический, говорит в пользу педоморфности этих признаков, что не исключает их адаптивного значения.
Сложно судить, является ли в действительности более длинная голова у D. cucullata педоморфным признаком, так как ее длина в данном случае зависит от степени развитости шлема. Однако, несмотря на то, что из выборки при анализе были исключены особи D. galeata без шлема, отмеченная нами разница между D. galeata и D. cucullata по этому признаку существенна. С другой стороны, у D. galeata без шлема относительная длина головы не отличается от таковой у D. longispina. Но при этом у ювенильных особей D. galeata шлем, как правило, более выражен и присутствует чаще чем у взрослых особей. Предположительно, это говорит в пользу педоморфности длинной головы у D. cucullata.
Степень различия между относительными размерами первого абдоминального выроста у D. cucullata и D. longispina невелика. Возможно, это объясняется тем, что он участвует в удержании яиц в выводковой камере дафнии [3], и сохранение его ювенильных размеров у половозрелых самок с яйцами неоправданно с точки зрения репродуктивного успеха вида. В то же время, относительные размеры двух других абдоминальных выростов у D. cucullata значительно меньше, чем у D. longispina и D. galeata, так как функция этих выростов в удержании яиц, по-видимому, несущественна, и их недоразвитость может рассматриваться как педоморфный признак.
Бóльшую длину постабдоминальных щетинок D. cucullata по сравнению с другими видами можно рассматривать как адаптацию к пелагическому образу жизни, не обусловленную педоморфозом напрямую. Напомним, что постабдоминальные щетинки, иногда называемые “плавательными щетинками”, участвуют в повышении плавучести рачков и служат балансирами при быстром плавании [9]. Следовало бы ожидать, что и у пелагической D. galeata щетинки будут длиннее, чем у D. longispina. Но различий между D. longispina и D. galeata по этому признаку не было выявлено, что говорит в пользу педоморфности данного признака у D. cucullata.
Известно, что при увеличении размеров рачка количество зубчиков на постабдомене возрастает [3]. Корреляция количества зубчиков и длины тела прослеживается внутри каждой популяции, однако между популяциями одного вида зачастую отсутствует. В целом, в ряду D. longispina–D. galeata–D. cucullata число зубчиков на постабдомене уменьшается. При сравнении двух популяций D. longispina с популяцией крупноразмерной D. galeata выявлено, что, несмотря на большую, чем у D. longispina, длину тела, количество постабдоминальных зубчиков у D. galeata из этой популяции меньше (рис. 5е). Вероятно, меньшее количество постабдоминальных зубчиков у D. cucullata и D. galeata можно считать педоморфным признаком.
Наиболее явно педоморфные тенденции проявляются в эволюции самцов дафний в этом ряду видов. Известно [3], что у дафний фактически отсутствуют различия в форме тела самок и самцов первого ювенильного возраста. Некоторые признаки, характерные для самок D. galeata и D. cucullata, можно наблюдать у самцов. Особенно сильное сходство между самками и самцами прослеживается у D. cucullata (рис. 6д, 6ж). Самцы D. galeata по внешнему виду похожи на неполовозрелых самцов D. longispina. Биологическая функция самцов обусловливает их короткий срок жизни и ускоренное созревание. Возможно, этим можно объяснить большее, чем у самок, проявление педоморфных тенденций. Ранее соотношение примитивных и развитых признаков в морфологии самцов и самок обсуждалось в работах [2, 5], причем имеющиеся противоречия, по-видимому, связаны с тем, что разные авторы оперировали различными таксонами, в пределах которых эволюция половых отличий шла разными путями [9].
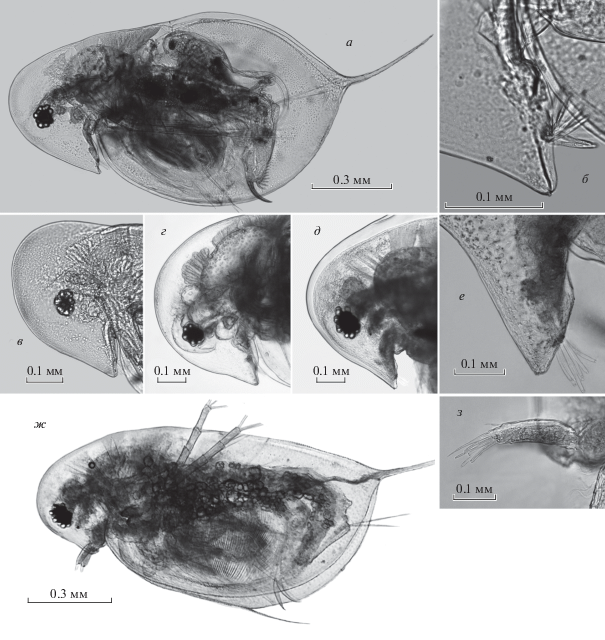
D. hyalina не отличается от D. longispina по морфометрическим показателям, за исключением наличия шлема у особей из некоторых популяций первого вида. Ранее Петрусек с соавт. [29, 31] заключили, что D. hyalina – озерная морфа D. longispina. По сравнению с D. galeata и особенно D. сucullata, шлем у D. hyalina (при его наличии) невысок и не заострен (рис. 7в). Возможно, данное состояние переходное между D. longispina (без шлема) и D. galeata (с хорошо развитым шлемом). В последнее время наличие шлема и удлинение хвостовой иглы у дафний рассматривается многими исследователями как адаптации, обеспечивающие защиту от мелкоразмерных хищников [9, 12, 19]. Однако, округлая форма шлема и его небольшой размер у D. hyalina, скорее всего, предполагает более низкую эффективность по сравнению с формами, несущими большой и заостренный шлем. Более уверенно о педоморфных тенденциях у D. hyalina можно судить на основе анализа морфологических особенностей ее самцов. Взрослые самцы D. hyalina имеют форму тела, сходную с таковой ювенильных самцов D. longispina (рис. 7ж, 7з), при этом строение антеннул как у взрослых самцов D. longispina (рис. 7з).
Рис. 7.
D. hyalina из разных популяций: а–е – взрослые самки (а – вид сбоку, б, е – рострум, в–д – голова); ж–з – взрослый самец (ж – вид сбоку, з – антеннула).
Предположительно педоморфные тенденции ранее были выявлены у одного из таксонов другого подрода D. (Ctenodaphnia) atkinsoni Baird. Так, Флёснер [14] описал новую форму D. triquetra f. semilunaris, отличия которой от типичной формы, по его мнению, педоморфные, причем, как и в нашем случае, педоморфная эволюция данного таксона была сопряжена с адаптацией к пелагическому образу жизни, в целом нехарактерному для представителей подрода D. (Ctenodaphnia) [17].
Выводы. В изменении морфологических признаков в ряду видов дафний из группы D. longispina при переходе от жизни в небольших водоемах к обитанию в пелагиали прослеживаются педоморфные тенденции, проявляющиеся в уменьшении общей длины, длины тела, удлинении хвостовой иглы, плавательных антенн и постабдоминальных щетинок, уменьшении длины постабдоминальных выростов и снижении количества зубчиков постабдомена, а также в уменьшении длины рострума. Наиболее сильно педоморфные тенденции прослеживаются у самцов дафний. Педоморфная эволюция и адаптация к пелагическому образу жизни могут быть тесно взаимосвязаны, двигаться параллельно или независимо друг от друга, в чем проявляется мозаичность эволюции.
Список литературы
Бойкова О.С. К вопросу о происхождении Сladocera (Сrustacea, Branchiopoda): новое осмысление старой гипотезы // Зоол. журн. 2015. Т. 94. № 2. С. 133–149.
Глаголев С.М. Половой диморфизм и морфологическая продвинутость ветвистоусых (Cladocera, Crustacea) // Журн. общ. биол. 1984. Т. 45. № 1. С. 59–65.
Глаголев С.М. Морфология, систематика и географическое распространение ветвистоусых ракообразных рода Daphnia Евразии: Дис. … канд. биол. наук. М.: ИЭМЭЖ АН СССР, 1986. 226 с.
Грант В. Эволюционный процесс. М.: Мир, 1991. 246 с. (Grant V. The Evolutionary Process: A Critical Review of Evolutionary Theory. N.Y.: Columbia Univ. Press, 1985. 499 p.).
Геодакян В.А., Смирнов Н.Н. Половой диморфизм и эволюция низших ракообразных // Проблемы эволюции. Новосибирск: Наука, 1968. Т. 1. С. 30–36.
Иорданский Н.Н. Основы теории эволюции. М.: Просвещение, 1979. 190 с.
Иорданский Н.Н. Эволюция жизни. М.: Академия, 2001. 425 с.
Киселев И. А. Планктон морей и континентальных водоемов. Л.: Наука, 1969. Т. 1. 658 с.
Котов А.А. Морфология и филогения Anomopoda (Crustacea: Cladocera). М.: Товарищество науч. изданий КМК, 2013. 638 с.
Назаров В.И. Учение о макроэволюции: На путях к новому синтезу. М.: Наука, 1991. 288 с.
Рэфф Р., Кофмен T. Эмбрионы, гены и эволюция. М.: Мир, 1986. 404 с. (Raff R., Kaufman T. Embryos, Genes, and Evolution: The Developmental-Genetic Basis of Evolutionary Change. N.Y.: Macmillan Publ. Co., 1983. 402 p.).
Benzie J.A.H. The genus Daphnia (including Daphniopsis) (Anomopoda: Daphniidae) // Guides to the identification of the microinvertebrates of the continental waters of the world 21. Ghent: Kenobi Productions; Leiden Backhuys Publ., 2005. 376 p.
Ebert D. A genome for the environment // Science. 2011. V. 331. P. 539–540.
Flössner D. A pedomorphic form type of Daphnia triquetra Sars, 1903 (Cladocera, Daphniidae) from Mongolia // Hydrobiologia. 1987. V. 145. P. 47–49.
Forel F.A. Le Léman. Monographie Limnologique. Lausanne: Rouge and Co, 1892. V. 1. 543 p. 1895. V. 2. 651 p. 1904. V. 3. 715 p.
Fritsch M., Bininda-Emonds O.R.P., Richter S. Unraveling the origin of Cladocera by identifying heterochrony in the developmental sequences of Branchiopoda // Front. Zool. 2013. V. 10. 35 p.
Fryer G. Functional morphology and the adaptive radiation of the Daphniidae (Branchiopoda: Anomopoda) // Philos. Trans. R. Soc. Lond. B Biol. Sci. 1991. V. 331. P. 1–99.
Gould S.J. Ontogeny and Phylogeny. Cambridge: Cambridge Univ. Press, 1977. 501 p.
Gries T., Jöhnk K., Fields D., Strickler J.R. Size and structure of “footprints” produced by Daphnia impact of animal size and density gradients // J. Plankton Res. 1999. V. 21. P. 509–523.
Hansen P.J., Bjørnsen P.K., Hansen B.W. Zooplankton grazing and growth: scaling within the 2–2000 mm body size range // Limnol. Oceanogr. 1997. V. 42. P. 687–704.
Hansen B., Bjornsen P.K., Hansen P.J. The size ratio between planktonic predators and their prey // Limnol. Oceanogr. 1994. V. 39. № 2. P. 395–403.
Hutchinson G.E. A treatise on Limnology. II. Introduction to lake biology and limnoplankton. N.Y.: John Wiley and Sons, 1967. 1115 p.
Jacobs J. Cyclomorphosis in Daphnia galeata mendote Bire, a case of environmentally controlled allometry // Arch. Hydrobiol. 1961. V. 58. P. 7–71.
Kerfoot W.C., Lynch M. Branchiopod communities: associations with planktivorous fish in space and time // Predation. Direct and indirect impacts on aquatic communities. Hannover; L.: Univ. Press of New England, 1987. P. 367–378.
Kerfoot W.C. Commentary: transparency, body size, and prey conspicuousness // Evolution and ecology of zooplankton communities. Hannover: Univ. Press of New Dartmouth, 1980. P. 609–617.
Lampert W. Daphnia: development of a model organism in ecology and evolution // Excell. Ecol. 2011. V. 21. P. 1–250.
Margalef R. Importancia de la neotenia en la evolución de los crustaceos de agua dulce // Publicaciones del Instituto Biología Aplicada. 1949. V. 6. P. 41–51.
Menden-Deuer S., Kiørboe T. Small bugs with a big impact: linking plankton ecology with ecosystem processes // J. Plankton Res. 2016. V. 38. № 4. P. 1036–1043.
Petrusek A., Hoboek A., Nilssen J.P. et al. A taxonomic reappraisal of the European Daphnia longispina complex (Crustacea, Cladocera, Anomopoda) // Zool. Scr. 2008. V. 37. P. 507–519.
Petrusek A., Tollrian R., Schwenk K. et al. A “crown of thorns” is an inducible defense that protects Daphnia against an ancient predator // Proc. Nat. Acad. of Sci. USA. 2009. V. 106. P. 2248–2252.
Petrusek A., Thielsch A., Schwenk K. Mitochondrial sequence variation suggests extensive cryptic diversity within the Western Palearctic Daphnia longispina complex // Limnol., Oceanogr. 2012. V. 57. № 6. P. 1838–1845.
Reisser C.M.O., Fasel D., Hürlimann E. et al. Transition from environmental to partial genetic sex determination in Daphnia through the evolution of a female-determining incipient W chromosome // Mol. Biol. Evol. 2016. V. 34. P. 575–588. https://doi.org/10.1093/molbev/msw251
Smirnov N.N. Physiology of the Cladocera. L.: Acad. Press, 2014. 352 p.
Tollrian R., Laforsch C. Linking predator kairomones and turbulence: synergistic effects and ultimate reasons for phenotypic plasticity in Daphnia cucullata // Arch. Hydrobiol. 2006. V. 167. № 1–4. P. 135–146.
Wagler E. Branchiopoda, Phyllopoda = Kiemenfüsser // Handbuch der Zoologie. 1927. V. 3. № 1. P. 305–398.
Wesenberg-Lund C. Grundzüge der Biologie und Geographie des Süsswasserplanktons // Int. Rev. gesamt. Hydrobiol. und Hydrograph., Suppl. 1910. V. 1. P. 1–44.
Woltereck R. Variation und Artbildung. Analitische und experimentelle Untersuchungen an pelagischen Daphniden und anderen Cladoceren // Int. Rev. gesamt. Hydrobiol. und Hydrograph. 1920. V. 9. № 1/2. S. 1–151.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод