Биология внутренних вод, 2019, № 2-2, стр. 20-27
Pазвитие Nelumbo komarovii Grossh. (Nelumbonaceae) из семян в культуре
Ю. А. Хроленко 1, *, М. С. Яцунская 1, Т. Ю. Горпенченко 1, Т. А. Безделева 2
1 ФНЦ Биоразнообразия Дальневосточного отделения Российской академии наук
690022 Владивосток, пр. 100-летия Владивостока, д. 159, Россия
2 Ботанический сад-институт Дальневосточного отделения Российской академии наук
690024 Владивосток, ул. Маковского, д. 142, Россия
* E-mail: khrolenko@biosoil.ru
Поступила в редакцию 20.02.2018
После доработки 30.10.2018
Принята к публикации 27.11.2018
Аннотация
Получены сведения о развитии Nelumbo komarovii Grossh. из семян при выращивании в культуре. Выделено пять фаз морфогенеза N. komarovii: фаза семени, первичного (главного) побега, системы “главного побега” и побегов закрепления, куртины, клубневидной структуры. Фазы морфогенеза соотнесены с периодами онтогенеза и возрастными состояниями особей.
ВВЕДЕНИЕ
Обитатели рек, озер и водоемов образуют неустойчивые пресноводные сообщества, к ярким компонентам которых относится лотос Комарова. Nelumbo komarovii Grossh. (N. nuciferum auct. non Gaertn.) (сем. Nelumbonaceae) – травянистое растение, гидрофит. Вид распространен на Дальнем Востоке России в пределах Амурской и Еврейской автономной областей, Хабаровского и Приморского краев. В настоящее время этот реликт водной флоры имеет статус охраняемого растения [10, 11].
Оценка онтогенетического развития растений способствует выбору оптимального пути сохранения и восстановления вида. Кроме того, может служить основой для понимания механизма повреждения особей и организации мероприятий по их защите. Очень важно минимизировать ущерб, наносимый редкому виду неизбежным вмешательством исследователя. Искусственные плантации позволяют решить часть этих проблем [27, 28]. Сведения по развитию N. komarovii приведены в ряде работ, но без выделения возрастных состояний. А.Б. Безделев и Т.А. Безделева [2] определили N. komarovii как “многолетний летнезеленый травянистый толсто-длиннокорневищно-кистекорневой симподиально нарастающий поликарпик с розеточным прямостоячим побегом”. Сведений об онтогенезе видов рода лотос (N. komarovii, N. nucifera Gaertn., N. lutea Willd.) в естественных условиях мало [3, 16, 21, 29, 30, 33]. Более детально описаны некоторые особенности произрастания интродуцированного N. nucifera в условиях Ботанического сада АН УзССР [15]. Проростки и ювенильные особи часто бывает сложно описать. Иногда невозможно их диагностировать из-за большой морфологической схожести надземной сферы ювенильных и сенильных особей у многолетников, экологической специфики видов и т.д. Многие исследователи подсевают в естественные популяции или в питомники изучаемый вид и, уже зная, что это молодые растения данного вида, проводят их описание. Существует подобная практика и с водными растениями [4, 14].
Цель работы – наблюдение и описание прорастания семян и начальных этапов развития N. komarovii.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Семена N. komarovii собирали из природных популяций оз. Лотос (Хасанский район Приморского края), кроме того использовали семена, полученные из г. Биробиджан (Еврейская автономная область). В работе применяли рекомендации по проращиванию семян лотоса, касающиеся температурного режима, уровня воды в лабораторных сосудах и т.д. [9, 16]. В исследовании использовали основные подходы: структурно-морфологический [19, 20] и онтогенетический [8, 17, 25]. При описании морфологии растений применяли терминологию, принятую в современных онтогенетических исследованиях [7]. При описании онтоморфогенеза, вслед за А.П. Хохряковым [26], принимали фазу онтоморфогенеза не только как структуру, но и как процесс (временной промежуток), в ходе которого формируется определенный габитус растения. Растения откапывали, отмывали и проводили мониторинг изменений >30 особей в течение двух полевых сезонов (2016, 2017 гг.). Строение проростков анализировали при помощи стереомикроскопа Stemi 2000C (Zeiss, Германия). Для изучения строения зародыша применяли модифицированную методику обработки материала в просветляющих жидкостях с дальнейшей регистрацией автофлюоресценции на конфокальном микроскопе LSM 510 META (Zeiss, Германия). При этом использовали просветление в метил салицилате (methyl salicylate (Sigma)) и дибутил фталате (dibutyl phthalate (Sigma)) [32]. Изображения получали при возбуждении аргоновым лазером 488 нм (4%) и регистрации изображения широким эмиссионным фильтром 505 LP с помощью объективов с увеличением ×10 и ×40. Для обработки серийных оптических срезов применяли компьютерные программы LSM 510 Release 4.2 и ZEN 2009 Light Edition. В работе использовали оборудование Центра коллективного пользования “Биотехнология и генетическая инженерия” ФНЦ Биоразнообразия ДВО РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В морфогенезе N. komarovii было выделено пять фаз.
I. Фаза семени. Семена лотоса (Nelumbo) представляли собой нераскрывшиеся орешки. Орешек имел овально-яйцевидную форму, серо-коричневого цвета с сизым налетом (рис. 1). Поверхность семени была гладкая и матовая. Размеры семени – 1.6–2.1 см в длину и 0.9–1.1 см в ширину (рис. 1а). Зародыш имел две сросшиеся у основания семядоли, длиной 1.8–2.0 см, два зеленых сложенных листа (первый лист крупнее, чем второй) и верхушечную почку с зачатками трех чешуевидных листьев (рис. 1в, 1г). Зачатки чешуевидных листьев были сформированы на короткой зачаточной оси побега.
Рис. 1.
Скарифицированное семя и строение зародыша Nelumbo komarovii: а – семя-орешек, б – заложение апикальной меристемы придаточных корней (указано стрелками), в – первый лист, г – второй лист и верхушечная почка с зачатками трех чешуевидных (указано стрелкой) листьев.
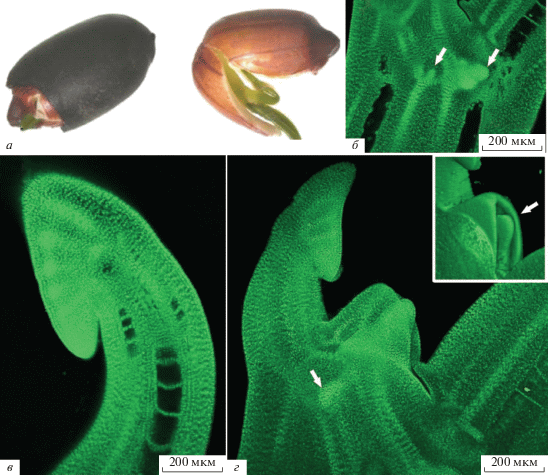
Наиболее полно эмбриологию и формирование зародыша рода Nelumbo на примере N. nucifera исследовали в лаборатории эмбриологии Ботанического института им. В.Л. Комарова [1, 22]. Для семядольного аппарата зародыша Nelumbo была характерна синкотилия [24]. Н.С. Снигиревской [21] было показано, что у N. nucifera “зародышевый корешок закладывается в виде небольшого бугорка, полностью погруженного в ткани семядоли” и в дальнейшем не развивается, как и у N. lutea [29]. В основаниях черешков как первого, так и второго листа N. komarovii формировалась система адвентивных корней (рис. 1б, 1г). В семенах N. komarovii, как и в зрелом семени у N. nucifera (по [5] и [21]), эндосперм и перисперм отсутствовали, запасные вещества содержались только в массивных полушаровидных семядолях.
Плод – погруженный многоорешек [23] – по форме напоминал перевернутый усеченный конус. Один плод содержал от 14 до 44 плодиков- орешков. Семена при хранении вне воды нуждались в скарификации. Всхожесть скарифицированных семян в настоящей работе была 92%.
II. Фаза первичного (главного) побега продолжалась от начала прорастания семени до смены моноподиального типа нарастания побега на симподиальный.
В лабораторных условиях семена, скарифицированные во второй декаде мая, прорастали в воде на 5–6-е сут. Прорастание начиналось с появления первого листа (рис. 2а, 2б). Тип прорастания семян – подземный, гипокотиль не развит, эпикотиль – 0.5–2.5 см в длину. Особенности прорастания семян были связаны с температурой воды. Скорость роста эпикотиля была выше в условиях с более высокой температурой (≥25°С) и, отрастая, эпикотиль и второе междоузлие выносились за пределы семени (рис. 2д, 2е). При более низких температурах (18–20°С) этого не происходило. Вслед за первым настоящим листом появлялся второй, оба листа были на длинных черешках, которые впоследствии покрывались мелкими шипиками (рис. 2в, 2г и рис. 3а). Листовая пластинка была туго свернута от краев к центру. На 7–8-е сут (при ≥18°С) трогался в рост третий лист (рис. 2е). В этот период на первом узле формировалось несколько придаточных корней. На 9–10-е сут первый лист, достигнув поверхности воды, принимал горизонтальное положение и постепенно разворачивался от центра к краям. Плавающие щитовидные листья имели округлую форму, диаметр 5–6 см и сизо-зеленый цвет. C абаксиальной стороны они были покрыты восковым налетом, поэтому совершенно не смачивались водой. Наблюдалось радиальное расположение главных жилок и лучистое жилкование. Край листовой пластинки был волнистый и гладкий. Черешки листьев продолжали расти и после того, как листовые пластинки достигали поверхности воды (длина 16–27 см). На 11–12-е сут на розеточном побеге визуально четко выделились три сидячих чешуевидных листа. Они были тонкие, полупрозрачные, буровато-зеленого цвета, с параллельным жилкованием, плотно охватывающие основание черешка третьего настоящего листа. Первый и второй чешуевидные листья имели вид мелких, сложенных вдоль, вытянутых треугольников, третий лист был меньше первых двух (рис. 2ж). В то же время на втором узле появлялись новые придаточные корни. В течение II фазы формировалось моноцентрическое розеточное моноподиально нарастающее вегетативное растение. Эта фаза – часть прегенеративного периода онтогенеза – продолжалась 12–16 сут. Она включала возрастные состояния проростка и ювенильного растения.
Рис. 2.
Развитие Nelumbo komarovii: а, б – первый лист, в–д – второй лист, е, ж –придаточные корни и чешуевидные листья (1 – эпикотиль, 2 – второе междоузлие, 3 – чешуевидные листья, 4 – ассимилирующие листья, 5 – плагиотропный побег), з, и – укоренение розетки, к – клубневидные структуры. На рис. е, ж, и листья и придаточные корни изображены не полностью.
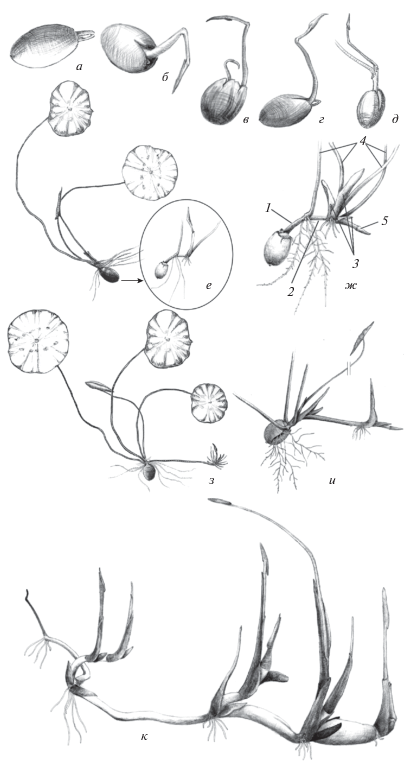
Рис. 3.
Особи Nelumbo komarovii: а – проросток; б – рост оси плагиотропного побега, черешок четвертого листа и побег переплелись между собой, так как отрастали одновременно (стрелками показаны три чешуевидных листа); в, д – полицентрическое растение стрелками указаны 3–4 столона (возраст 3 мес); г – ось с дистальным плагиотропным побегом (указана стрелкой); е – подземная сфера особи; ж, к – листья полицентрических растений; з, и, л – клубневидные структуры растения.

III. Фаза системы “главного побега” и побегов закрепления. Трогались в рост четвертый ассимилирующий лист и почка в пазухе третьего чешуевидного листа (рис. 3б). При развертывании этой почки формировалась система симподиально сменяющих друг друга побегов возрастающих порядков. Побег каждого порядка ветвления включал плагиотропный и косоапогеотропный участки (рис. 2з, 2и). Из плагиотропных члеников последовательных порядков (подиумов) [19] в грунте образовывался симподиальный столон. Причем, самый первый плагиотропный участок симподиального столона начинал отрастать очень быстро, прибавляя в длину по 4 см в сутки (рис. 2ж, рис. 3б). Когда длина плагиотропного участка побега достигала 12–16 см, направление его роста сменялось на косоапогеотропное – формировался косоапогеотропный участок побега n +1-го порядка. На его верхушке развивался розеточный побег, несущий один ассимилирующий лист и 3-4 чешуевидных (рис. 2з, 2и). В пазухе третьего чешуевидного листа закладывалась почка, обеспечивающая дальнейшее симподиальное нарастание столона, причем, длина плагиотропного участка побега n +2-го порядка была чуть меньше, чем побега n +1-го порядка – 7–12 см. Следует отметить, что у близкородственного вида N. nucifera, по данным Ю.М. Мурдахаева [15], розеточный побег содержит пять чешуевидных листьев, а по данным Н.С. Снигиревской [21], – от одного до восьми. Связь с семенем сохранялась, семядоли были сочные, мясистые, их увядание морфологически никак не проявлялось, более того, принудительное удаление их у особей с несколькими листьями приводило к гибели растений. По-видимому, вклад запасных веществ семядолей в питание растений на данной стадии развития существенен. Эта фаза соответствовала имматурному онтогенетическому состоянию и продолжалась 30–40 сут – до наступления кратковременного периода покоя.
IV. Фаза куртины. После переноса растений в пруд (конец июня) и непродолжительного периода покоя (10–15 сут), наблюдалось дальнейшее развитие симподиального столона: число симподиально сменяющих друг друга побегов возрастало до 6–7 (рис. 3в, 3д, 3е). У растений появлялась новая генерация более крупных плавающих листьев до 15–17 см в диаметре (рис. 3ж, 3к). На отдельных особях развивалось до 6–7 ассимилирующих листьев. Плагиотропные участки побегов розового цвета достигали в диаметре 0.5–0.7 см. Старые чешуевидные листья темнели и приобретали иссиня-черный цвет. Как правило, с середины августа дистальный участок начинал расти в глубь донного субстрата (рис. 3г). На глубине 20–30 см формировалось еще несколько участков, которые располагались в почве горизонтально. Во 2-й декаде августа развитие симподиального столона завершалось образованием клубневидной структуры. Она формировалась за счет утолщения и паренхиматизации (диаметр 1.5–1.8 см, длина до 3–5 см; рис. 2к, рис. 3з, 3и, 3л) оси последнего плагиотропного участка столона. Боковая почка, раньше обеспечивающая симподиальное нарастание столона, была способна сформировать дочернюю клубневидную структуру (рис. 3з, 3и).
Таким образом, в эту фазу морфогенеза за счет итеративного ветвления [7] формировалась система симподиально сменяющих друг друга побегов возрастающих порядков, завершающаяся клубневидной структурой. Побеги закрепления укоренялись в грунте за счет многочисленных придаточных корней. Растение подготавливалось к зимнему состоянию покоя. Эта фаза соответствовала молодому виргинильному онтогенетическому состоянию прегенеративного периода и продолжалась 85–90 сут до конца вегетационного сезона. Было сформировано полицентрическое розеточное симподиально нарастающее вегетативное растение.
V. Фаза клубневидной структуры. Все надземные и подземные структуры отмирали, сохранялись лишь зимующие клубневидные структуры.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для водных растений свойственна высокая скорость онтогенеза, это достоверно демонстрируют такие вегетативно подвижные растения, как рдесты, телорез, водокрас и многие другие [18], для лотоса тоже характерно быстрое развитие. Хорошо дифференцированный крупный зародыш обеспечивает быстрое отрастание побега после скарификации, фактически в первые две недели развивается имматурное растение, и за данный период формируется ассимилирующий аппарат. Вероятно, такому развитию способствует и наличие двух зеленых листьев у сформированного зародыша. По мнению Н.С. Снигиревской [21], зеленая окраска листьев зародыша обусловлена не проникновением внутрь семени света через дыхательное отверстие, а наличием первичного хлорофилла. Протохлорофилл попадает в листья зародыша на ранних стадиях его развития в ходе использования веществ эндосперма.
Наглядный пример ускоренного развития N. komarovii – формирование первого плагиотропного участка симподиального столона, который прорывает базальную часть третьего чешуевидного листа, даже сдвигает его с места (рис. 3б). Подобное явление наблюдается каждый раз при формировании очередного плагиотропного участка столона. Это согласуется с наблюдениями Н.С. Снигиревской [21], что “боковые почки корневища, развивающиеся в пазухе подводного листа, прободают его с противоположной стороны, благодаря чему он разрывается на две части”.
Дифференциация фаз морфогенеза у N. komarovii в течение первого года развития легко прослеживается по морфологии листьев: листья моноцентрических и полицентрических растений различаются в диаметре в 2–3 раза. Также границей перехода от одной фазы морфогенеза к другой считается смена типа нарастания побега, у N. komarovii – с моноподиального на симподиальный. Существуют разные точки зрения на тип ветвления для видов рода Nelumbo. Так для близкородственного вида N. nucifera Ю.М. Мурдахаев определил, что “корневище моноподиальное дорзовентрального типа” [15], в то время как Н.С. Снигиревская указала на симподиальный тип ветвления [21]. Наши исследования N. komarovii подтверждают результаты Н.С. Снигиревской.
У растений наблюдается сезонное развитие побегов: весной и большую часть лета нарастают длинные тонкие плагиотропные побеги – столоны, расположенные близко к поверхности грунта, но, начиная со второй половины августа, когда продолжительность светового дня значительно сокращается, побег растет в глубь донного субстрата и уже на глубине формирует клубневидные структуры. Подобные структуры в конце вегетационного сезона образуются также у Sparganium microcarpum (Neum.) Raunk. [13].
Представляют интерес данные, полученные японскими авторами [30, 31], инициировавшими прорастание семян N. nucifera с апреля по ноябрь. Растения, пророщенные в августе и октябре, образовывали утолщенные корневища (rhizome) с 10-го и 5-го узлов соответственно. Однако растения, полученные из весенних и июньских проростков, образовывали длинные шнуровидные корневища с максимальным числом листьев, побегов, узлов при нормальной продолжительности дня независимо от температуры. Серией экспериментов с использованием климатической камеры эти исследователи достоверно показали, что переход N. nucifera к состоянию покоя зависит от продолжительности дня, а не температуры [30, 31].
Летние побеги (столоны), нарастающие в течение фазы III морфогенеза, впоследствии отмирают, перезимовывают только утолщенные покоящиеся клубневидные структуры, сформированные в фазу куртины. Этим объясняется частая гибель популяций N. komarovii при наводнениях в конце июля–начале августа (например, наводнение 2013 г. в Амурской обл. [12]) поскольку растения еще не успели сформировать клубневидные структуры. Особи, оказавшись полностью под водой, не могут нарастить эти структуры, так как их воздушные полости функционально не обеспечивают условия для жизнедеятельности, и растения погибают. В конце вегетационного сезона надводная часть растения также отмирает, но, поскольку клубневидные структуры уже сформированы, гарантируется возобновление популяции на следующий год.
N. komarovii вегетативно подвижное растение и, хотя относится к вегетативным малолетникам, в естественных условиях зацветает на второй, третий год жизни. Близкородственный вид N. nucifera в условиях Ботанического сада АН УзССР зацветал в первый же год интродукции, причем уже пятый щитовидный лист был воздушным [15]. Наступление цветения N. komarovii, в отличие от перехода к состоянию покоя, зависит от температуры воздуха и воды, а сами фазы цветения и плодоношения наиболее продолжительны по времени [6].
Выводы. Наблюдения за ростом и развитием N. komarovii показали, что в течение первого года жизни вид проходит несколько фаз от проростка до молодого виргинильного возрастного состояния. За этот период последовательно сменяются пять фаз морфогенеза: I – фаза семени, II – первичного (главного) побега, III – системы “главного побега” и побегов закрепления, IV – куртины; V – фаза клубневидной структуры. Особи фазы II морфогенеза – моноцентрические растения, фазы III и IV – полицентрические. Особи имеют придаточную корневую систему, сформированную в узлах розеточного побега. Длина придаточных корней 12–15 см. Питание происходит за счет корневой системы и ассимиляции листьев. В течение последовательного прохождения фаз морфогенеза у N. komarovii наблюдается неоднократная смена направления роста плагиотропных побегов. Для этих растений характерно сезонное развитие побегов – весной и летом они формируют тонкие и длинные столоны, а к концу вегетационного сезона образуют клубневидные структуры.
Список литературы
Батыгина Т.Б. Биология развития растений. Симфония жизни. СПб.: Изд-во ДЕАН, 2014. 764 с.
Безделев А.Б., Безделева Т.А. Жизненные формы семенных растений российского Дальнего Востока. Владивосток: Дальнаука, 2006. 296 с.
Бутюков С.А. Лотос Комарова в Приморском крае (распространение и охрана) // Актуальные вопросы охраны природы на Дальнем Востоке. Владивосток: Дальневост. науч. центр АН СССР, 1978. С. 56–59.
Васильева Н.В. Особенности прорастания семян частухи подорожниковой (Alisma plantago-aquatica L.) в лабораторных условиях // Биология внутр. вод. 2001. № 1. С. 46–49.
Грушвицкий И.В. Подземное прорастание и функции семядолей // Бот. журн. 1963. Т. 48. № 6. С. 906–915.
Дулин А.Ф., Цыренова Д.Ю. Исследование фенологии и семенной продуктивности лотоса Комарова Nelumbo komarovii Grossh. в популяции вида вблизи Хабаровска (Дальний Восток, Россия) // Уч. зап. ЗабГУ. 2017. Т. 12. № 1. С. 13–19.
Жмылев П.Ю., Алексеев Ю.Е., Карпухина Е.А., Баландин С.А. Биоморфология растений: иллюстрированный словарь. Уч. пособие. М.: Гриф и Ко, 2002. 240 с.
Жукова Л.А. Популяционная жизнь луговых растений. Йошкар-Ола: Изд-во РИИК Ланар, 1995. 224 с.
Зиновьев А.С., Гуков Г.В. Выращивание лотоса Комарова (Nelumbo komarovii Grossh.) в искусственных условиях // Изв. Иркутск. гос. ун-та. Сер. Биология. Экология. 2011. Т. 4. № 2. С. 32–37.
Красная книга Приморского края: Растения. Редкие и находящиеся под угрозой исчезновения виды растений и грибов. Владивосток: АВК “Апельсин”, 2008. 688 с.
Красная книга Хабаровского края. Редкие и находящиеся под угрозой исчезновения виды растений и животных. Хабаровск: Приамурские ведомости, 2008. 632 с.
Кудрин С.Г. Влияние наводнения 2013 г. на популяции Nelumbo komarovii (Nelumbonaceae) в Архаринском районе Амурской области // Бот. журн. 2015. Т. 100. № 10. С. 1091–1099.
Лапиров А.Г., Беляков Е.А. Морфология вегетативной и генеративной сферы Sparganium microcarpum (Neum.) Raunk. // Ярослав. пед. вестн. 2011. Т. 3. № 1. С. 133–138.
Лебедева О.А., Лапиров А.Г. К биологии Batrachium trichophyllum (Chaix) Bosch: Особенности прорастания семян и начальных этапов развития проростка в лабораторных условиях // Биология внутр. вод. 2000. № 4. С. 14–20.
Мурдахаев Ю.М. Некоторые вопросы биологии и морфологии лотосов, интродуцированных Ботаническим садом АН УзССР // Интродукция и акклиматизация растений. Ташкент: ФАН, 1973. Вып. 10. С. 95–99.
Пшенникова Л.М. Водные растения российского Дальнего Востока. Владивосток: Дальнаука, 2005. 106 с.
Работнов Т.А. Жизненный цикл многолетних травянистых растений в луговых ценозах // Тр. БИН АН СССР. Сер. 3. Геоботаника. М.; Л.: Наука, 1950. 176 с.
Савиных Н.П. Онтогенез и его особенности у водных растений // Гидроботаника: методология, методы: материалы школы по гидроботанике. Рыбинск: ОАО Рыбинский Дом печати, 2003. С. 98–103.
Серебряков И.Г. Экологическая морфология растений. М.: Высш. шк., 1962. 378 с.
Серебрякова Т.И. Об основных “архитектурных моделях” травянистых многолетников и модусах их преобразования // Бюл. МОИП. Отд. биол. 1977. Т. 82. Вып. 5. С. 112–128.
Снигиревская Н.С. Материалы к морфологии и систематике рода Nelumbo Adans. // Флора и систематика высших растений. Сер. 1. Вып. 13. М.; Л.: Наука, 1964. С. 104–172.
Сравнительная эмбриология цветковых растений. 1. Winteraceae – Juglandaceae. Л.: Наука, 1981. С. 116–120.
Тахтаджян А.Л. Происхождение покрытосеменных растений. М.: Сов. наука, 1954. 96 с.
Титова Г.Е. О природе псевдомонокотилии у цветковых растений // Бот. журн. 2000. Т. 85. № 7. С. 76–91.
Уранов А.А. Возрастной спектр фитоценопопуляций как функция времени и энергетических волновых процессов // Науч. докл. высш. шк. Биол. науки. М.: Наука, 1975. № 2. С. 7–34.
Хохряков А.П. Изменение образа жизни растений в онтогенезе // Журн. общ. биол. 1978. Т. 39. № 3. С. 357–372.
Хроленко Ю.А., Бурундукова О.Л., Безделева Т.А. и др. Возрастные этапы в онтогенезе Panax ginseng C.A. Mey в условиях плантации // Изв. РАН. Сер. биол. 2007. № 2. С. 157–162.
Хроленко Ю.А., Журавлев Ю.Н. Возрастная структура природных популяций женьшеня настоящего // Вестн. Дальневост. отд. РАН. 2008. № 4. С. 97–102.
Lyon H.L. Preliminary note on the embryogeny of Nelumbo // Science, New Series. 1901. V. 13. № 325. P. 470.
Masuda J., Urakawa T., Ozaki Y., Okubo H. Short photoperiod induces dormancy in lotus (Nelumbo nucifera) // Ann. Bot. 2006. V. 97. P. 39–45.
Masuda J., Yoshimizu S., Ozaki Y., Okubo H. Rhythmic response of rhizome growth to light-break in lotus (Nelumbo nucifera) // J. Fac. Agr. Kyushu Univ. 2007. V. 52. P. 35–38.
Nakonechnaya O.V., Gorpenchenko T.Yu., Voronkova N.M. et al. Embryo structure, seed traits, and productivity of relict vine Aristolochia contorta (Aristolochiaceae) // Flora. 2013. V. 208. P. 293–297.
Shen-Miller J., Schopf J.W., Harbottle G. et al. Long-living lotus: germination and soil γ-irradiation of centuries-old fruits, and cultivation, growth, and phenotypic abnormalities of offspring // Amer. J. Botan. 2002. V. 89. № 2. P. 236–247.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


