Биология внутренних вод, 2019, № 3, стр. 94-99
Вариабельность содержания меди в культивируемой мидии Мytilus galloprovincialis Lam.
Н. С. Челядина 1, *, Л. Л. Смирнова 2
1 Институт морских биологических исследований им. А.О. Ковалевского
299011 Севастополь, Нахимова, 2, Россия
2 Институт природно-технических систем Российской академии наук
299011 Севастополь, ул. Ленина, 28, Россия
* E-mail: chelydina2007@mail.ru
Поступила в редакцию 26.05.2016
После доработки 17.09.2018
Принята к публикации 05.12.2018
Аннотация
Показаны особенности индивидуального накопления Cu в раковинах и мягких тканях мидии Mytilus galloprovincialis Lam., культивируемой в прибрежной акватории г. Севастополь (Крым, Черное море). Депонированная в раковинах Cu лимитирует линейный рост мидий с размером раковины 30.20 ± 0.07, ограничивает выпуклость раковин моллюсков размером 50.30 ± 0.14 мм, что может влиять на массу мягких тканей и экономические показатели мидийных ферм. Содержание Cu в раковине не увеличивается с возрастом моллюска и ≤8–12 мкг/г золы. В мягких тканях содержание Cu зависит от сезона, размера, пола и стадии зрелости гонад моллюска и в 8–10 раз выше, чем в раковине. Отмечено, что самки M. galloprovincialis накапливают Cu в мягкой ткани в большем количестве, чем самцы. Содержание Cu в тканях самок обеих размерных групп более вариабельно (Cv 53−57%), чем у самцов (25−36%). Полученные результаты могут быть использованы при оценке качества продукции мидийных ферм, изучении полиморфизма, аномалий в развитии мидий и инверсии пола в популяциях культивируемых мидий Mytilus galloprovincialis.
ВВЕДЕНИЕ
Тяжелые металлы, как микроэлементы, необходимы гидробионтам для нормальной физиологической деятельности [16, 19]. Однако, многие из них накапливаются в органах и тканях гидробионтов в избыточном количестве [6], влияют на жизнедеятельность и гаметогенез моллюсков [3, 21, 23]. Возрастающее загрязнение морской среды, в том числе тяжелыми металлами, может вызывать структурные мутации, которые приводят к изменению соотношения полов в популяциях двустворчатых моллюсков [20, 21]. К наиболее токсичным элементам, наряду с Hg и Cd, относится Cu, который на молекулярном уровне может вызывать окислительный стресс [7], нарушать структуру ДНК, блокировать функциональные группы в молекулах белка [2], оказывать мутагенное действие при формировании генеративной ткани моллюсков сем. Mytilidae [20, 21]. При сравнении уровня накопления Cu в мягких тканях у представителей различных родов двустворчатых моллюсков отмечаются значительные флуктуации концентрации этого элемента, что связано с физиологическими особенностями моллюсков и биогеохимическим режимом акватории [8, 9, 16].
При определении содержания Cu в моллюсках обычно исследуют пробы тканей, объединенных от нескольких особей, при этом индивидуальная особенность мидии концентрировать Cu не учитывается. В настоящее время мидийно-устричные фермы – перспективное направление развития марикультуры в прибрежных акваториях крымского побережья Черного моря [5, 12]. Поэтому изучение содержания Cu в мягких тканях и раковинах отдельных моллюсков необходимо для оценки их полиморфизма и качества продукции фермы (выявление аномалий в развитии мидий), выявления факторов, определяющих инверсию пола в популяциях культивируемой мидии Mytilus galloprovincialis Lam. на Крымском побережье [20].
Цель работы – оценить изменчивость индивидуального содержания Cu в мягких тканях и раковинах М. galloprovincialis в зависимости от размера, окраски ее раковины, пола и стадии зрелости гонад.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали двустворчатого моллюска M. galloprovincialis с размером раковины 30.20 ± 0.07 и 50.30 ± 0.14 мм, культивируемого на фермах в прибрежных акваториях г. Севастополь (44°37′13.4″ с.ш., 33°30′13.6″ в.д. и 44°37′14.4″ с.ш., 33°30′40.7″ в.д.).
Моллюсков собирали с веревочных коллекторов на глубине 3–4 м в летний и осенний периоды 2007–2012 гг. В выборках мидий определяли окраску раковины по методике [4], пол и стадии зрелости гонад – под микроскопом Jenaval (×125), при визуальном наблюдении мазков гонад [12]. Для определения формы раковины и аномалий в ее развитии использовали индекс вытянутости (H/L) – отношение высоты створки к ее длине и индекс выпуклости (D/L) – отношение ширины створки к длине. Толщину раковины мидий на единицу ее поверхности рассчитывали по формуле в работе [18].
Створки мидий очищали от обрастания, мидий вскрывали, удаляли мантийную жидкость и отделяли мягкие ткани от раковины. Пробы мягких тканей и раковин от каждой особи взвешивали и высушивали при 100°С, раковины озоляли при 550°С. По разнице массы сухой раковины и ее золы рассчитывали массу периостракума и гипостракума (органическое вещество раковины моллюска). В сухих мягких тканях и золе раковин после растворения проб в азотной кислоте определяли содержание Cu методом атомно-абсорбционной спектроскопии [8] и выражали в мягких тканях в мкг/г сухой ткани, в раковинах – в мкг/г золы (зольность). Рассчитывали содержание Сu в раковине каждой из исследованных мидий в мкг. Всего было проанализировано 1620 особей.
Для статистического анализа материала определяли среднее арифметическое (x), доверительный интервал (Дx), стандартное отклонение (S), размах вариации W (xmin – xmaх). Рассчитывали коэффициенты корреляции (r), детерминации (R2), вариации полученных данных (Cv %). Результаты в табл. 1 представлены как $\bar {x} \pm \Delta x$. Достоверность различий (при p < 0.05) определяли по критерию Стьюдента (t).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Накопление Сu в мягких тканях и раковине M. galloprovincialis происходит в процессе роста и развития моллюска. Индивидуальное содержание Cu в раковинах мелких мидий (30 мм) изменялось в пределах 4–8 мкг/г золы у самок и 4–12 мкг/г золы у самцов. У крупных мидий с размером раковины 50 мм оно сохранялось в пределах 4−9 мкг/г золы и у самцов, и у самок. Содержание Cu у крупных моллюсков было менее вариабельно (Cv < 21.8%), чем у мелких мидий (Cv = 23.0–38.6.8%).
При росте раковины в процессе ее утолщения и увеличения в размерах Cu накапливается в органическом (периостракум и гипостракум) и неорганическом (остракум) слоях. Изменение содержания Cu в зависимости от массы органической и неорганической частей раковины моллюсков, двух размерных групп приведено на рис. 1. Выявлено, что большая часть депонированной Сu связана с неорганической частью раковин мидий (R2 = 0.83).
Рис. 1.
Связь между индивидуальным содержанием Cu (мкг) в раковине и ее зольностью (а) и массой органической части (б).
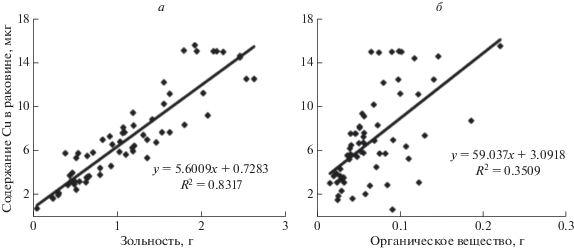
Индивидуальную изменчивость содержания Cu в мягких тканях мидий двух размерных групп оценивали на различных стадиях гаметогенеза (табл. 1).
Таблица 1.
Концентрация Сu в мягких тканях М. galloprovincialis в зависимости от размера раковины, пола и стадии зрелости гонад в разные сезоны года
| Стадии гаметогенеза | Сu, мкг/г сухой ткани | |||
|---|---|---|---|---|
| ♂ | ♀ | ♂ | ♀ | |
| 30 мм (N = 180) | 50 мм (N = 170) | |||
| Лето 2009 г. | ||||
| 2 | $\frac{{95.6 \pm 18.5}}{{(45.6--110.3)}}$ | $\frac{{101.4 \pm 34.4}}{{(16.7--120.6)}}$ | $\frac{{79.2 \pm 24.3}}{{\left( {35.9--94.4} \right)}}$ | $\frac{{81.5 \pm 29.3}}{{(12.8--93.6)}}$ |
| 3 | $\frac{{135.6 \pm 36.2}}{{(49.4--176.3)}}$ | $\frac{{150.3 \pm 38.5}}{{(29.3--160.9)}}$ | $\frac{{88.1 \pm 22.4}}{{(24.3--90.9)}}$ | $\frac{{89.1 \pm 39.5}}{{(15.65--93.2)}}$ |
| 4 | $\frac{{120.9 \pm 34.8}}{{(60.3--174.3)}}$ | $\frac{{155.7 \pm 45.4}}{{(25.5--185.3)}}$ | $\frac{{90.7 \pm 28.6}}{{(47.4--130.3)}}$ | $\frac{{93.7 \pm 31.1}}{{(15.58--99.9)}}$ |
| 5 | $\frac{{131.2 \pm 35.2}}{{(60.1--186.7)}}$ | $\frac{{156.4 \pm 48.1}}{{(29.4--189.1)}}$ | $\frac{{94.4 \pm 32.3}}{{(27.8--112.1)}}$ | $\frac{{95.6 \pm 38.4}}{{(19.6--122.5)}}$ |
| Осень 2010 г. | ||||
| 2 | $\frac{{41.6 \pm 16.2}}{{(35.2--80.4)}}$ | $\frac{{44.9 \pm 18.2}}{{(28.3--98.4)}}$ | $\frac{{20.4 \pm 5.1}}{{(10.2--25.5)}}$ | $\frac{{21.8 \pm 9.6}}{{(2.9--49.0)}}$ |
| 3 | $\frac{{56.3 \pm 17.4}}{{(36.4--81.3)}}$ | $\frac{{60.21 \pm 21.3}}{{(28.4--97.6)}}$ | $\frac{{~23.8 \pm 5.9}}{{(7.8--27.9)}}$ | $\frac{{23.6 \pm 8.6}}{{(4.7--48.5)}}$ |
| 4 | $\frac{{52.4 \pm 17.2}}{{(38.5--89.2)}}$ | $\frac{{62.7 \pm 18.7}}{{(27.3--99.4)}}$ | $\frac{{23.1 \pm 7.2}}{{(11.2--39.8)}}$ | $\frac{{24.9 \pm 9.9}}{{(8.8--39.5)}}$ |
| 5 | $\frac{{60.3 \pm 17.6}}{{(37.3--88.9)}}$ | $\frac{{63.8 \pm 19.1}}{{(29.4--98.3)}}$ | $\frac{{28.9 \pm 8.6}}{{(7.6--39.1)}}$ | $\frac{{25.1 \pm 11.3}}{{\left( {8.7--51.5} \right)}}$ |
Концентрация Cu у особей разных полов и размерных групп увеличивалась от второй к пятой стадии зрелости гонад в летний и осенний сезоны. При сравнении содержания Cu в мягких тканях молоди и взрослых особей на изучаемых стадиях зрелости гонад, отмечено, что мелкие моллюски (30 мм) накапливали Cu в бо́льшем количестве (96.9 ± 18.3 мкг/г сухой ткани), чем крупные (50 мм) (54.6 ± 10.5 мкг/г сухой ткани). Различия между средними значениями достоверны: для уровня значимости p < 0.05 и числа степеней свободы k = 348 , tф = 2.0 > tst = 1.9. У самок обеих размерных групп отмечена тенденция к повышенному концентрированию Cu (78.3 ± 24.3 мкг/г сухой ткани) по сравнению с самцами (71.2 ± 20.5 мкг/г сух. ткани), как в летний, так и осенний периоды года. Различия между средними значениями были недостоверны: для уровня значимости Р < 0.05 и числа степеней свободы k = 348, tф = 0.2 < tst = 1.9.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В водной толще и донных отложениях шельфовой зоны черноморского побережья п-oва Крым и прибрежных акваторий г. Севастополь наблюдается высокое содержание элементов группы тяжелых металлов, связанное с природными факторами и антропогенным загрязнением [1, 11]. Для района расположения ферм характерны хороший водообмен, летние и осенние апвеллинги и сгонно-нагонные явления, способствующие выносу донных загрязнений в толщу воды и массовому развитию кормового фитопланктона – кокколитофорид, мелких диатомовых, гаптофитовых и зеленых микроводорослей, хорошо концентрирующих тяжелые металлы [5].
Содержание Cu в раковинах моллюсков. Вошедший в состав раковины Cu сохраняется в ней длительное время, служит индикатором загрязнения окружающей среды [3] и влияет на морфологическую изменчивость раковины [4]. Показано [14], что в прибрежной акватории г. Севастополь при благоприятных экологических условиях у культивируемых мидий с длиной раковины 30 мм Н/L достигает 0.58–0.63. Нами отмечено, что при увеличении содержания Cu в раковинах мелких моллюсков до 6.8 мкг/г золы и выше наблюдается замедление их линейного роста (Н/L возрастает до 0.62–0.68). Получена тесная корреляция между толщиной раковины и содержанием в ней Cu (r = 0.57–0.83 при р < 0.001) у изучаемых размерных групп.
Для мидий обеих размерных групп была выявлена корреляция между выпуклостью раковины и содержанием в ней Cu – у моллюсков с раковиной 30 мм она была положительная (r = 0.4), с раковиной 50 мм – отрицательная (r = –0.5). Полученная отрицательная корреляция означает, что увеличение содержания Cu в раковине крупных мидий лимитирует ее выпуклость. Такое ограничение выпуклости раковины может влиять на массу мягких тканей культивируемых мидий.
Особенности накопления меди в мягких тканях. Мидии M. galloprovincialis, культивируемые в прибрежных акваториях г. Севастополь, накапливают в мягких тканях Cu в 5–10 раз больше, чем этот вид из Эгейского моря [25], а также виды этого рода из Белого и Балтийского морей, и Crenomytilus grayanus Dunker из Японского моря [9, 16, 22]. Отмечено [6], что высокие концентрации Cu способны накапливать моллюски, адаптированные к повышенному содержанию его соединений в окружающей среде, что характерно для акваторий расположения ферм. Сезонная динамика содержания Cu в мягких тканях мидий, связанная с репродуктивным циклом, анализируется в работах многих авторов, которые отмечают максимальную концентрацию Cu перед нерестом [10, 16]. При изучении содержания этого микроэлемента в индивидуальных особях отмечено высокое накопление Cu в мягких тканях молоди (табл. 1), что связано с более быстрыми энергетическими процессами и фильтрационной активности у мидий с размером раковины 30 мм, чем у крупных моллюсков [17].
Для оценки индивидуальной изменчивости содержания Cu в мягких тканях мидий различного размера, пола и фена рассчитаны Сv (рис. 2). Коэффициенты вариации содержания Cu в мягких тканях самцов и самок у мидий в обеих размерных группах высокие, но более вариабельно содержание Cu у самок. Отмеченную закономерность можно объяснить неравномерным нарастанием массы генеративной ткани самцов и самок и большим количеством питательных веществ белковой природы в яйцеклетках, которые способны связывать Cu [15].
Рис. 2.
Вариабельность содержания Cu (%) в мягких тканях мидий в зависимости от пола, окраски (1 – коричневые, 2 − черные) и размера раковины (а – 30 мм, б – 50 мм).
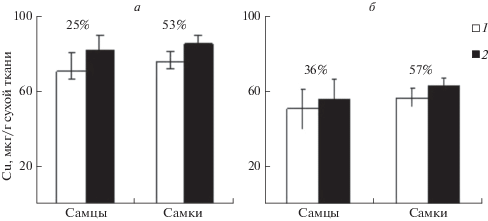
В последние десятилетия в популяциях культивируемых мидий шельфовой зоны Крыма наблюдается сдвиг половой структуры в сторону увеличения количества самцов [13]. Соотношение количества самок и самцов у особей с размером раковины 50 мм достигает 1 : 7 [13]. Переход самок мидии в самцов инициируют различные факторы [20], в том числе и тяжелые металлы [21, 24]. При одинаковых экологических условиях самки культивируемых M. galloprovincialis накапливают Cu в мягкой ткани в большем количестве, чем самцы, что может быть одной из причин инверсии пола направленной на увеличение количества самцов в популяции.
Выводы. Результаты проведенных исследований показали, что содержание Cu в мягких тканях культивируемых Mytilus galloprovincialis зависит от размера, сезона, пола и стадии гаметогенеза. У мидий с размером раковины 30 мм содержание Cu в летний сезон >100 мкг/г сухой ткани, осенью уменьшается до 60−64 мкг/г сухой ткани. У мидий с размером раковины 50 мм содержание Cu в мягких тканях на всех стадиях гаметогенеза в 1.5 раза меньше, чем у моллюсков с размером раковины 30 мм. Концентрация Cu в мягких тканях самцов и самок относится к нестабильным характеристикам, максимум Cv (53–57%) отмечен для самок обеих размерных групп. В раковинах моллюсков исследованных размерных групп содержание Cu ≤ 8–12 мкг/г золы и менее вариабельно у особей с размером раковины 50 мм (Cv < 21.8%). Мидии с черной окраской раковины депонируют Cu в меньшем количестве, чем моллюски с коричневой окраской раковины. Для мидий с размером раковины 50 мм выявлена обратная связь между выпуклостью раковины и содержанием в ней Cu (r = –0.5). Ограничение выпуклости раковины может влиять на массу мягких тканей культивируемых мидий и экономические показатели мидийных ферм.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках госзадания Института морских биологических исследований им. А.О. Ковалевского по теме “Разработка научных принципов воспроизводства в искусственных биотехнологических комплексах водных биоресурсов – возобновляемого природного сырья для получения целевых продуктов” АААА-А18-118021350003-6 и Института природно-технологических систем “Фундаментальные и прикладные исследования закономерностей и механизмов формирования региональных изменений природной среды и климата под влиянием глобальных процессов в системе океан–атмосфера–криосфера и антропогенного воздействия” 0012-2019-0007.
Список литературы
Губанов В.И., Копытов Ю.П., Бобко Н.И. Оценка состояния загрязнения донных осадков тяжелыми металлами в прибрежных районах Крыма (Черное море) // Мор. экол. журн. 2010. № 4. Т. 9. С. 38–47.
Давыдова С.Л., Тагасов В.И. Тяжелые металлы как супертоксиканты XXI века: Уч. пособие. М.: Рос. ун-т дружбы народов, 2002. 140 с.
Дехта В.А., Каталевский Н.Н. Содержание химических элементов в раковинах и изменчивость их формы у мидий Mytilus galloprovincialis прибрежной зоны Черного моря // Геоэкологические исследования и охрана недр. 2000. № 3. С. 26–33.
Жуковская Е.А., Кодолова О.П., Переладов М.П. О временной динамике морфологической изменчивости черноморской мидии Mytilus galloprovincialis Lam. // Изв. РАН. Сер. биол. 2002. № 3. С. 316–328.
Иванов В.Н., Трощенко О.А., Ломакин П.Д. и др. Марикультура мидий на Черном море. Севастополь: НПЦ ЭКОСИ-Гидрофизика, 2007. 314 с.
Кавун В.Я., Шулькин В.М. Изменение микроэлементного состава органов и тканей двустворчатого моллюска Crenomytilus grayanus при акклиматизации в биотопе, хронически загрязненном тяжелыми металлами // Биол. моря. 2005. Т. 31. № 2. С. 123–127.
Кулева Н.В., Сабиров М.А., Филимонов В.Б., Раилкин А.И. Влияние ионов меди на показатели окислительного стресса у беломорской мидии Mytilus edulis // Вестн. С.-Петербург. ун-та. Сер. 3. Биол. 2008. № 4. С. 83–87.
Методика выполнения измерений массовой концентрации Cd, Zn, Cu, Pb, As в пищевых продуктах. Атомно-абсорбционный метод с использованием электро-термической атомизации МВВ 081/12–16-98. Северодонецк: КНПП “Химавтоматика – аналитприбор”, 1998. 64 с.
Подгурская О.В., Кавун В.Я., Лукъянова О.Н. Аккумуляция и распределение тяжелых металлов в органах мидии Грея Crenomytilus grayanus из районов апвеллинга Японского и Охотского морей // Биол. моря. 2004. Т. 30. № 3. С. 219–226.
Поспелова Н.В., Егоров В.Н., Челядина Н.С., Нехорошев М.В. Содержание меди в органах и тканях Mytilus galloprovincialis Lamarck, 1819 и поток ее седиментационного депонирования в донные осадки в хозяйствах черноморской аквакультуры // Мор. биол. журн. 2018. Т. 3. № 4. С. 64–75.
Смирнова Л.Л., Аннинская И.Н. Распределение соединений меди в морской среде и донных осадках портовых акваторий // Экологическая безопасность прибережной и шельфовой зон и комплексное использование ресурсов шельфа. 2003. Вып. 9. С. 106–111.
Холодов В.И., Пиркова А.В., Ладыгина Л.В. Выращивание мидий и устриц в Черном море Воронеж: ООО ИЗДАТ-ПРИНТ, 2017. 508 с.
Челядина Н.С. Фенотипическая и половая структура поселения мидии Mytilus galloprovincialis Lam., культивируемой на внешнем рейде г. Севастополя (Крым, Черное море) // Мор. биол. журн. 2018. Т. 3. № 3. С. 86–93.
Челядина Н.С., Попов М.А. Сравнительный анализ морфометрических характеристик мидии Мytilus galloprovincialis из различных районов обитания (Крым, Черное море) // Вестн. Воронеж. гос. ун-та. Сер. Химия. Биология. Фармация. 2018. № 2. С. 264–269.
Челядина Н.С., Вялова О.Ю., Смирнова Л.Л. Содержание Zn, Cu, Pb, Cd в гонадах культивируемых моллюсков Mytilus galloprovincialis // Мор. экол. журн. 2005. Т. 4. № 3. С. 119–125.
Чернова Е.Н. Изменение концентрации металлов в тканях мидии Мytilus еdulis из Белого моря в ходе репродуктивного цикла // Биол. моря. 2010. Т. 36. № 1. С. 63–69.
Черноморские моллюски: элементы сравнительной и экологической биохимии. Севастополь: НПЦ ЭКОСИ-Гидрофизика, 2014. 323 с.
Яп К.К., Измаил А., Тан С.Г. Зависимость между массой мягких тканей, толщиной раковины и накоплением тяжелых металлов (Cd, Cu, Pb, Zn) у зеленой мидии Perna viridis // Биол. моря. 2003. Т. 29. № 5. С. 358–362.
Ярославцева Л.М., Сергеева Э.П. Влияние ионов меди на ранние стадии развития тихоокеанской мидии Mytilus trossulus // Биол. моря. 2005. Т. 31. № 4. С. 267–273.
Bretona S., Capta Ch., Guerraa D., Stewartb D. Sex determining mechanisms in Bivalves. Preprints 2017. 209.https://doi.org/10.20944/preprints201706.0127.v1
Liu G., Shu M., Chai X. et al. Effect of chronic sublethal exposure of major heavy metals on filtration rate, sex ratio, and gonad development of a Bivalve species // Bull. Environ. Contam. and Toxicol. 2014. V. 92 (I). P. 71–74.
Rainbow P.S., Fialkowski W., Sokolowski A. et al. Geographical and seasonal variation of trace metal bioavailabilities in the Gulf of Gdansk, Baltic Sea using mussels (Mytilus trossulus) and barnacles (Balanus improvisus) as biomonitors // Mar. Biol. 2004. V. 144. P. 271–285.
Raftopoulou E.K., Dimitriadis V.K. Comparative study of the accumulation and detoxification of Cu (essential metal) and Hg (non essential metal) in the digestive gland and gills of mussels Mytilus galloproincialis, using analytical and his to chemical techniques // Chemosphere. 2011. V. 83. P. 1155–1165.
Sokolowski A., Bawazir A.S., Wolowicz M. Trace metals in the brown mussel Perna perna from the coastal waters of yemen (gulf of aden): how concentrations are affected by weight, sex, and seasonal cycle // Arch. Environ. Contam. and Toxicol. 2004. V. 46. № 1. P. 67–80.
Ugur S. Trace metal levels in mussels (Mytilus galloprovincialis L., 1758) from Turkish Aegean Sea coast // Environ. Monitor. Assess. 2006. V. 114. № 1–3. P. 273–286.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


