Биология внутренних вод, 2019, № 3, стр. 21-34
Гетеротрофные жгутиконосцы сфагновых болот, террасных лесных и пойменных водоемов Среднерусской лесостепи
1 Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Некоузский р-н, Ярославская обл., пос. Борок, Россия
2 Лаборатория клеточной и молекулярной протистологии, Зоологический институт Российской академии наук
199034 Санкт-Петербург, Университетская набережная, 1, Россия
* E-mail: kristin892@mail.ru
Поступила в редакцию 13.03.2018
После доработки 02.02.2019
Принята к публикации 06.02.2019
Аннотация
Изучены видовой состав и внешняя морфология гетеротрофных жгутиконосцев из разнотипных водных объектов (сфагновых болот, озер и реки) Среднерусской лесостепи Воронежской области. Обнаружено 67 видов, из них 40 – новые для Воронежской обл. Максимальным видовым богатством характеризуются террасные лесные озера, минимальным – сфагновые болота. Наибольшее сходство фаун гетеротрофных жгутиконосцев отмечено для террасных лесных озер Маклок и Черепашье (64%), пойменного оз. Восьмерка и р. Усманка (58%). Даны морфологические описания и фотографии 15 видов: Codosiga botrytis, Bicosoeca petiolata, Clathromonas eiffelii, Paraphysomonas bandaiensis, Stokesiella acuminata, Actinomonas mirabilis, Actinomonas sp., Tremula vibrans, Protaspa sp., Naegleria gruberi, Distigma proteus, Heteronema polymorphum, Notosolenus rhombicus, Urceolus cyclostomus и Cryptomonas paramecium.
ВВЕДЕНИЕ
В последние десятилетия свободноживущих гетеротрофных жгутиконосцев (ГЖ) активно изучают по всему миру [16, 17, 21, 22, 24, 26, 27, 36, 39 и др.]. Это полифилетическая группа одноклеточных эукариот, у которых хотя бы на одной из стадий жизненного цикла присутствует один или несколько жгутиков [30]. ГЖ распространены повсеместно в водоемах разных типов. Как основные потребители бактерий они способствуют рециркуляции и реминерализации биогенных элементов, участвуют в процессе очищения водоемов от органики [4, 13]. Большинство крупных групп протистов и многоклеточные животные, вероятно, произошли именно от жгутиковых форм. Таким образом, их всестороннее изучение необходимо для понимания филогении эукариот.
Целенаправленное изучение ГЖ в водоемах и водотоках Среднерусской лесостепи на данный момент ограничивается одной статьей [34], которая не может отражать все видовое богатство данного региона.
Цель работы – повторно изучить видовое разнообразие ГЖ в сфагновых болотах, террасных лесных и пойменных озерах, получить первые данные по видовому составу р. Усманка, исследовать морфологию, биологию, жизненные циклы и спектры питания ГЖ, а также особенности распределения видов по биотопам.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве модельного объекта для Среднерусской лесостепи был выбран Усманский бор Воронежской обл. благодаря наличию разнообразных типичных для Среднерусской лесостепи водных объектов. Располагаясь на охраняемой территории, данные водные объекты имеют низкую антропогенную нагрузку, а также являются объектами многолетних наблюдений. Усманский бор – это крупнейший лесной массив, расположенный на западной окраине Окско-Донской равнины, по левому берегу реки Воронеж и ее притоков [14].
На исследуемой территории были изучены четыре типа водоемов с различными гидрохимическими и гидрологическими режимами: сфагновые болота, террасные лесные озера, пойменные озера и река. Сфагновые болота (Клюквенное-1, Клюквенное-2, Клюквенное-3) являются мезотрофными болотами со смешанным типом питания. Лесные озера (Черепашье, Маклок, Чистое) образуются на сходных ландшафтах в пределах одной активной водной системы и имеют сходный гидрохимический состав. Пойменные озера (Восьмерка, Круглое) периодически затопляются в половодье и имеют гидрохимические параметры, сходные с параметрами реки Усманка [8]. Из каждого водного объекта взято по три пробы. В болотах пробы отбирали из нескольких внутриболотных водоемов (мочажины, озерка, кабаньей купалки). Географические координаты, гидрофизические и гидрохимические данные пунктов сбора приведены в табл. 1.
Таблица 1.
Места сбора проб гетеротрофных жгутиконосцев и гидрохимические показатели воды 20 и 22 августа 2017 г.
| Номер | Водный объект | Координаты | pH | T, °C |
|---|---|---|---|---|
| Болота: | ||||
| 1 | Клюквенное-1 | 51°48′56.7″ с.ш., 39°23′37.6″ в.д. |
6.4–7.2 | 17–19 |
| 2 | Клюквенное-2 | 51°48′56.9″ с.ш., 39°23′38.4″ в.д. |
6.5–7.2 | 21–28 |
| 3 | Клюквенное-3 | 51°49′32.7″ с.ш., 39°25′08.8″ в.д. |
6.8–7.3 | 26–29 |
| Озера: | ||||
| 4 | Черепашье | 51°49′12.4″ с.ш., 39°24′38.7″ в.д. |
7.9 | 28 |
| 5 | Маклок | 51°48′31.0″ с.ш., 39°24′50.6″ в.д. |
8.0 | 29 |
| 6 | Чистое | 51°48′36.3″ с.ш., 39°23′51.9″ в.д. |
7.8 | 27 |
| 7 | Восьмерка | 51°48′45.4″ с.ш., 39°22′54.2″ в.д. |
8.0 | 23 |
| 8 | Круглое | 51°48′46.5″ с.ш., 39°22′44.5″ в.д. |
8.6 | 21 |
| 9 | Река Усманка | 51°48′42.7″ с.ш., 39°23′03.3″ в.д. |
8.0 | 23 |
Пробы воды с частью донных осадков отбирали в пластиковые 15-миллилитровые пробирки, не фиксировали и доставляли в лабораторию при температуре 4°С. В камеральных условиях пробы помещали в чашки Петри, обогащали суспензией бактерий Pseudomonas fluorescens Migula (0.15 мл суспензии на 5 мл пробы) и выдерживали в термостате при температуре 22°С в темноте. Пробы просматривали в течениe 10 сут для выявления скрытого видового разнообразия. Для наблюдений использовали световой микроскоп AxioScope A1 (Carl Zeiss, Германия) с фазово-контрастной и DIC установками и с объективами водной иммерсии (общее увеличение ×1120). Запись объектов исследования на видео производили аналоговой видеокамерой AVT HORN MC1009/S. Тотальные препараты подготавливали по общепринятой методике [28] и просматривали в трансмиссионном электронном микроскопе JEM-1011.
Для построения дендрограммы фаунистического сходства водных объектов использовали метод одиночного присоединения на основе расчета индекса фаунистического сходства Брея–Кертиса в программе PAST [19].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Обнаружено 53 вида и 14 форм ГЖ, не определенных до видового уровня. В работе использована современная макросистема эукариот [15], в которой не обозначен ранг макротаксонов (отмечены звездочками). Данные о видовом составе найденных жгутиконосцев в исследованных водных объектах приведены в табл. 2. Ниже даны морфологические описания наиболее редких и представляющих интерес видов, диагнозы которых нами дополнены.
Таблица 2.
Распределение гетеротрофных жгутиконосцев по водным объектам (нумерация представлена в соответствии с табл. 1).
| Таксон | Водные объекты | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| OPISTHOKONTA Cavalier-Smith, 1987 | |||||||||
| **Choanoflagellatea Cavalier-Smith, 1998 | |||||||||
| **Craspedida Cavalier-Smith, 1997 | |||||||||
| Codosiga botrytis (Ehrenberg, 1838) Kent, 1880 | + | – | + | + | – | + | + | – | + |
| Salpingoeca minor Dangeard, 1910 | – | – | – | – | – | – | + | – | – |
| SAR | |||||||||
| *Stramenopiles Patterson, 1989 | |||||||||
| **Bicosoecida Grassé, 1926 | |||||||||
| Bicosoeca lacustris (James-Clark, 1867) Skuja, 1948 | – | – | – | – | – | + | + | – | – |
| B. petiolata (Stein, 1878) Bourrelly, 1951 | – | – | – | – | + | – | + | – | – |
| **Chrysophyceae Pascher, 1914 | |||||||||
| Clathromonas eiffelii (Thomsen in Thomsen et al., 1981) Scoble et Cavalier-Smith, 2014 | – | – | – | + | – | – | – | – | – |
| Spumella sp. | + | + | – | – | – | – | – | + | – |
| Stokesiella acuminata (Stokes, 1885) Lemmermann, 1910 | – | + | – | – | – | + | – | – | – |
| Paraphysomonas bandaiensis Takahashi, 1976 | – | – | – | – | + | – | + | + | + |
| P. uniformis hemiradia Scoble et Cavalier-Smith, 2014 | – | + | – | + | + | + | – | – | – |
| ***Chromulinales Pascher, 1910 | |||||||||
| Anthophysa vegetans (Müller, 1773) Stein, 1878 | – | – | – | + | – | – | – | – | – |
| **Dictyochophyceae Silva, 1980 | |||||||||
| ***Pedinellales Zimmermann et al., 1984 | |||||||||
| Actinomonas mirabilis Kent, 1880 | – | – | – | – | – | + | – | – | – |
| A. sp. | – | – | – | – | – | + | – | – | – |
| Ciliophrys infusionum Cienkowski, 1876 | + | – | – | – | – | – | – | – | – |
| *Alveolata Cavalier-Smith, 1991 | |||||||||
| *Incertae sedis Alveolata | |||||||||
| Colponema vietnamica Tikhonenkov et al., 2014 | – | – | – | – | – | – | – | + | – |
| C. sp. 1 | – | – | – | – | – | + | – | – | – |
| C. sp. 2 | – | – | – | – | – | – | + | – | – |
| C. sp. 3 | – | – | – | – | – | – | + | – | – |
| C. sp. 4 | – | – | – | – | – | – | – | + | – |
| *Rhizaria Cavalier-Smith, 2002 | |||||||||
| **Cercozoa Cavalier-Smith, 1998 | |||||||||
| ***Cercomonadidae Kent, 1880 | |||||||||
| Cercomonas directa Brabender et al., 2012 | – | + | – | – | – | – | – | – | – |
| C. longicauda Dujardin, 1841 | + | – | – | – | – | – | – | – | – |
| C. varians Skuja, 1948 | – | + | + | – | – | – | – | – | – |
| C. sp. | + | – | – | – | – | – | – | + | – |
| Tremula vibrans (Sandon, 1927) Cavalier-Smith in Howe et al., 2011 | – | – | – | + | – | + | + | + | + |
| **Glissomonadida Howe et Cavalier-Smith, 2009 | |||||||||
| Allantion tachyploon Sandon, 1924 | – | – | + | + | – | – | + | + | + |
| Allapsa sp. | – | + | – | – | – | – | – | – | – |
| Sandona sp. | – | + | – | – | – | – | – | – | – |
| ***Imbricatea Cavalier-Smith, 2011 | |||||||||
| ****Spongomonadida Hibberd, 1983 | |||||||||
| Spongomonas uvella Stein, 1878 | + | – | + | + | + | + | – | – | – |
| S. sp. | – | – | – | – | – | + | – | – | – |
| ****Silicofilosea Adl et al., 2005 | |||||||||
| *****Thaumatomonadida Shirkina, 1987 | |||||||||
| ******Thaumatomonadidae Hollande, 1952 | |||||||||
| Thaumatomastix sp. | – | – | – | – | – | – | + | – | – |
| Thaumatomonas seravini Mylnikov et Karpov, 1993 | – | – | + | – | – | – | – | – | – |
| ***Metromonadea Cavalier-Smith, 2007 | |||||||||
| Metromonas simplex (Griessmann, 1913) Larsen et Patterson, 1990 | – | – | + | + | + | – | – | – | – |
| *** Thecofilosea Cavalier-Smith, 2003 | |||||||||
| ****Cryomonadida Cavalier-Smith, 1993 | |||||||||
| Protaspa simplex (Vørs, 1992) Cavalier-Smith in Howe et al., 2011 | + | + | – | + | + | + | + | + | + |
| P. sp. | – | – | – | + | – | – | – | – | – |
| **Incertae sedis Rhizaria | |||||||||
| Helkesimastix faecicola Woodcock et Lapage, 1915 | – | + | – | – | – | – | – | – | + |
| EXCAVATA Cavalier-Smith, 2002 | |||||||||
| *Discoba Simpson in Hampl et al., 2009 | |||||||||
| **Jakobida Cavalier-Smith, 1993 | |||||||||
| ***Histionidae Flavin et Nerad, 1993 | |||||||||
| Histiona aroides Pasher, 1942 | – | – | – | + | + | + | – | – | – |
| **Discicristata Cavalier-Smith, 1998 | |||||||||
| ***Heterolobosea Page et Blanton, 1985 | |||||||||
| ****Tetramitia Cavalier-Smith, 1993 | |||||||||
| Naegleria gruberi (Schardinger, 1899) Lepsi, 1960 | – | – | – | – | – | – | – | + | – |
| ***Euglenozoa Cavalier-Smith, 1981 | |||||||||
| *Euglenida Bütschli, 1884 | |||||||||
| *****Heteronematina Leedale, 1967 | |||||||||
| Anisonema ovale Klebs, 1893 | – | – | – | – | – | – | – | – | + |
| Distigma proteus Ehrenberg, 1838 | – | – | – | – | – | + | – | – | – |
| D. senni Pringsheim, 1942 | – | + | – | – | – | – | – | + | – |
| Entosiphon oblongum Cavalier-Smith et al., 2016 | – | – | – | – | – | – | + | + | – |
| E. sulcatum (Dujardin, 1841) Stein, 1878 | – | – | – | + | + | + | + | + | + |
| Heteronema exaratum Larsen et Patterson, 1990 | – | – | – | – | – | – | – | + | – |
| H. globulifera (Ehrenberg, 1838) Stein, 1878 | – | – | – | + | – | + | – | + | – |
| H. ovale Kahl, 1928 | – | – | – | + | + | – | – | – | + |
| H. polymorphum Deflandre, 1932 | – | – | – | – | – | – | – | – | + |
| H. sp. | – | – | – | – | – | – | – | – | + |
| Jenningsia fusiforme (Larsen, 1987) Lee et al., 1999 | – | – | + | – | + | + | + | – | – |
| Notosolenus apocamptus Stokes, 1884 | + | – | – | + | + | + | – | – | – |
| N. rhombicus Larsen, 1987 sensu Schroeckh et al., 2003 | – | – | – | – | – | – | – | – | + |
| N. similis Skuja, 1939 | – | – | + | – | + | – | – | – | – |
| Pseudoperanema trichophorum (Ehrenberg, 1832) Larsen, 1987 | – | – | – | + | + | – | – | – | + |
| Petalomonas minor Larsen et Patterson, 1990 | – | – | – | – | – | – | + | – | – |
| P. poosilla (Skuja, 1948) Larsen et Patterson, 1990 | – | + | – | – | + | – | + | + | + |
| P. sp. | – | – | – | – | – | + | + | + | + |
| Ploeotia adhaerens Larsen et Patterson, 1990 | – | – | – | – | – | + | – | – | – |
| P. obliqua (Klebs, 1893) Schroeckh et al., 2003 | – | – | – | + | + | + | + | + | + |
| P. plumosa Ekebom et al., 1996 | – | – | – | + | – | – | – | – | – |
| Urceolus cyclostomus (Stein, 1878) Mereschkowsky, 1881 | – | – | – | + | + | – | – | – | – |
| *****Aphagea Cavalier-Smith, 1993 | |||||||||
| Astasia granulata Pringsheim, 1942 | – | + | – | – | – | + | – | – | – |
| ****Kinetoplastea Honigberg, 1963 | |||||||||
| ****Metakinetoplastina Vickerman in Moreira et al., 2004 | |||||||||
| ******Neobodonida Vickerman in Moreira et al., 2004 | |||||||||
| Neobodo designis (Skuja, 1948) Moreira et al., 2004 | + | + | + | + | + | + | + | + | + |
| Rhynchobodo armata Brugerolle, 1985 | – | – | – | + | + | – | + | – | – |
| Rh. simius Patterson et Simpson, 1996 | + | – | – | + | – | – | – | – | + |
| ******Eubodonida Vickerman in Moreira et al., 2004 | |||||||||
| Bodo saltans Ehrenberg, 1838 | + | + | – | – | – | + | + | – | + |
| Incertae sedis EUKARYOTA | |||||||||
| *Cryptophyceae Pascher, 1913 | |||||||||
| **Cryptomonadales Pascher, 1913 | |||||||||
| Cryptomonas paramecium (Ehrenberg, 1832) Hoef-Emden et Melkonian, 2003 | + | + | + | + | – | – | – | – | – |
| *Ancyromonadida Cavalier-Smith, 1998 | |||||||||
| Ancyromonas sigmoides (Kent, 1880) Heiss et al., 2010 | – | – | – | – | + | + | + | – | + |
| *Apusomonadidae Karpov et Mylnikov, 1989 | |||||||||
| Amastigomonas caudata Zhukov, 1975 | – | – | – | – | – | + | – | + | + |
| *Cryptophyceae Pascher, 1913 | |||||||||
| **Goniomonas Stein, 1878 | |||||||||
| Goniomonas truncata (Fresenius, 1858) Stein, 1878 | – | – | – | + | + | + | + | + | + |
| Всего видов | 12 | 14 | 10 | 24 | 20 | 26 | 23 | 20 | 22 |
Codosiga botrytis (Ehrenberg, 1838) Kent, 1880 [bas.: Epistylis botrytis Ehrenberg, 1838] (рис. 1а–1г).
Рис. 1.
Морфология гетеротрофных жгутиконосцев (световой микроскоп): а–г – Codosiga botrytis, д–з – Stokesiella acuminata, и–р – Actinomonas mirabilis.
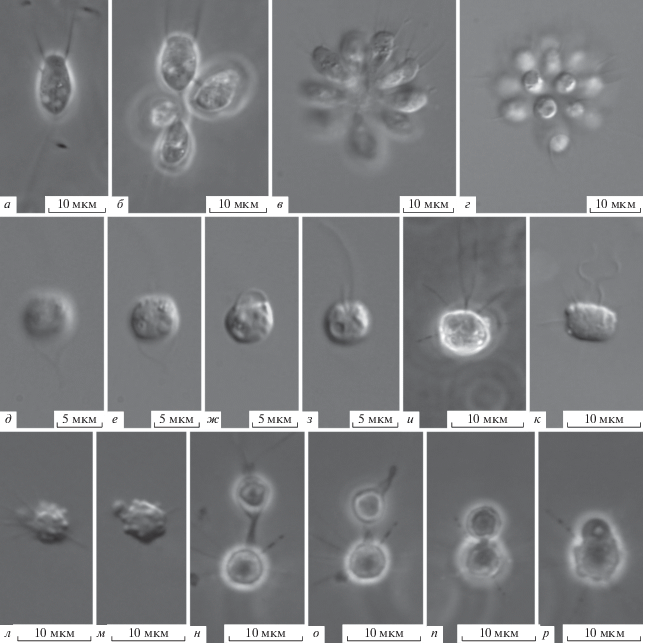
Тело клетки (6.5–10.0) × (4–6) мкм, овальной формы, передний конец прямо срезан, задний – заужен. Неширокий воротничок равен длине тела клетки, жгутик – в 3 раза длиннее. Около переднего конца тела часто наблюдается тонкая пальцевидная псевдоподия, участвующая в захвате пищи (рис. 1а). Ядро располагается медиально, две сократительные вакуоли – в базальной части. Данный организм формирует колонии из 2–20 клеток, соединяющихся небольшим базальным выступом на вершине общего стебелька (рис. 1б–1г). Встречаются также одиночные клетки (рис. 1а). Некоторые клетки в колонии могут быть соединены протоплазматическим мостиком (рис. 1б). В зависимости от онтогенеза, стебелек, жгутик и воротничок могут редуцироваться [2, 5]. После деления клетка мельче и без стебелька, напоминает Monosiga ovata Kent, 1880 [2, 5]. В старых колониях образуются видоизмененные расселительные формы: округлое тело клетки с редуцированным воротничком [5]. Отличие от других представителей рода: C. furcata Kent, 1880 имеет хорошо развиты вторичные (индивидуальные) стебельки [2]; у C. gracilis (Kent, 1880) De Saedeleer, 1927 сильно сужена передняя часть тела у основания воротничка [25].
Распространение: Россия [6, 10, 37], Венгрия [22], Дания [39], Монголия [7], Китай [40], Австралия [27].
Stokesiella acuminata (Stokes, 1885) Lemmermann, 1910 [bas.: Bicosoeca acuminata Stokes, 1888] (рис. 1д–1з).
Тело клетки 4.5–8.0 мкм в диаметре, не уплощено. Два неравных жгутика отходят от переднего конца клетки и направлены вперед. Длинный жгутик в 1.2–2.0 раза длиннее тела, короткий жгутик – меньше в 0.5 раз. Ядро располагается медиально, сократительная вакуоль – латерально. Клетка наполовину погружена в чашевидный домик. Диаметр самой расширенной устьевой части домика равен диаметру тела клетки, базальная часть домика вытянута в небольшую полую ножку, прикрепляющуюся к субстрату. Стенки домика тонкие, прозрачные. От других известных видов рода (S. leptostoma (Stokes, 1888) Lemmermann, 1910; S. longipes (Stokes, 1888) Lemmermann, 1910; S. epipyxis Pascher, 1930) отличается меньшими размерами, округлой формой домика и отсутствием стебелька.
Распространение: Россия [10, 37].
Actinomonas mirabilis Kent, 1880 (рис. 1и–1р).
Тело клетки 5.0–7.5 мкм в диаметре, округлой формы. На поверхности тела иногда видны вздутия пищеварительных вакуолей. Единственный жгутик в 2.0–2.5 раза длиннее тела. Клетка прикрепляется к субстрату при помощи длинного (20–25 мкм) тонкого сократимого стебелька с небольшими утолщениями (узлами) по всей длине. Вокруг жгутика кольцо из 1–2 рядов аксоподий. Также имеются дополнительные одиночные аксоподии, отходящие от всего тела клетки. Аксоподии длиннее тела клетки в ~1.2–1.5 раза. Иногда от тела отходят пальцевидные пищевые псевдоподии, захватывающие и обволакивающие жертву (рис 1л–1р). Жгутиконосец поедает бактерий (рис. 1л–1м) и мелких простейших (рис. 1н–1р). У потревоженных и плавающих клеток дополнительные аксоподии могут пропадать [24]. Исследуемый вид отличается от Pteridomonas danica Patterson et Fenchel, 1985 наличием дополнительных аксоподий, отходящие от всей поверхности тела [24]. Некоторые авторы отмечают более округлую форму тела клетки у A. mirabilis по сравнению с P. danica [24].
Распространение: Россия [6], Фиджи, Гавайи, Бразилия [24], Австралия [26].
Bicosoeca petiolata (Stein, 1878) Bourrelly, 1951 [bas.: Poteriodendron petoilatum Stein, 1878] (рис. 2а–2г).
Рис. 2.
Морфология гетеротрофных жгутиконосцев (ТЕМ): а–г – Bicosoeca petiolata, д–з – Clathromonas eiffelii, и–л – Paraphysomonas bandaiensis.

Клетки формируют древовидные колонии. Дочерние клетки после деления прикрепляются стебельком к внутренней стенке домика материнской клетки. Домик (17–20) × (10–12) мкм, бокаловидной формы со слегка расширенным устьем. Стенки домика состоят из толстых и тонких фибрилл, располагающихся по спирали, почти перпендикулярно продольной оси домика. Стебелек 20–50 мкм в длину, прикрепляется к субстрату посредством небольшого расширения у основания – прикрепительной бляшки. Данный вид легко идентифицируется по форме образуемой колонии [11]. Среди колониальных видов этого рода известен B. socialis (Lauterborn, 1898) Skuja, 1956 с домиком без стебельков и шаровидными колониями.
Распространение: Россия [6, 11].
Clathromonas eiffelii (Thomsen in Thomsen et al., 1981) Scoble et Cavalier-Smith, 2014 [bas.: Paraphysomonas eiffelii Thomsen in Thomsen et al., 1981] (рис. 2д–2з).
Тело клетки 8–11 мкм в диаметре (на тотальных препаратах), покрыто двумя типами соматических сетчатых чешуек: тангентальные пластинчатые и радиальные башневидные. Пластинчатые чешуйки (0.8–1.0) × (0.6–0.8) мкм, овальные. По краю чешуек проходят 1–4 ряда округлых отверстий. Центральная часть чешуек заполнена хаотично расположенными отверстиями и у большинства отделена от внешних рядов уплотненным темным кольцом. Башневидные чешуйки воронковидной формы с расширенным основанием и цилиндрической дистальной частью. Длина чешуйки 1.3–1.8 мкм, основание 0.8–1.1 мкм в диаметре, диаметр цилиндрической части чешуйки 0.1–0.3 мкм. Дистальная верхушка оканчивается двумя острыми зубчиками. Данный вид напоминает C. quadrispina (Thomsen et Kristiansen in Thomsen et al., 1981) Scoble et Cavalier-Smith, 2014, от которого отличается более короткими башневидными чешуйками с более плоским основанием и наличием четырех дистальных зубчиков. Размеры чешуек обнаруженных клеток схожи с первоописанием [36], Прейсиг и Хибберд [32] описывали чешуйки бóльших размеров.
Распространиние: Дания [36], Великобритания [32], Канада [29], Шри-Ланка [18].
Paraphysomonas bandaiensis Takahashi, 1976 (рис. 2и–2л).
Тело клетки 10–14 мкм в диаметре (на тотальных препаратах), покрыто одним типом соматических радиальных чешуек. Основание чешуйки 1.1–1.4 мкм в диаметре, округлое с уплотненными краями. Стержень чешуйки 1.1–1.9 мкм в длину, конически заостряется к дистальному концу. Морфология исследованных чешуек схожа с предыдущими описаниями, однако ранее описывали меньшие размеры чешуек и более округлые дистальные кончики [12, 31].
Распространение: Россия [12], Великобритания [31].
Actinomonas sp. (рис. 3а–3д).
Рис. 3.
Морфология гетеротрофных жгутиконосцев (световой микроскоп): а–д – Actinomonas sp., е–з – Tremula vibrans, и–л – Naegleria gruberi, м–о – Distigma proteus.
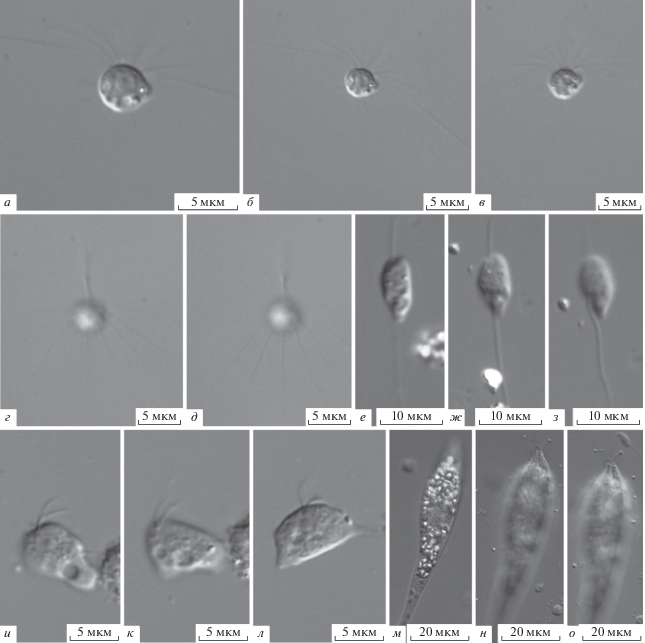
Морфология клеток напоминает A. mirabilis. Размеры тела клетки 3.5–5.5 мкм. Единственный жгутик в 2–2.5 раза длиннее тела. Стебелек в длину ~20 мкм. Вокруг жгутика располагается кольцо из 1 ряда длинных (18–22 мкм) аксоподий, направленных вбок и слегка отгибающихся назад. Также присутствуют дополнительные короткие (обычной длины) боковые и задние аксоподии. Отличается от A. mirabilis рядом очень длинных аксоподий вокруг жгутика.
Tremula vibrans (Sandon, 1927) Cavalier-Smith in Howe et al. 2011 [bas.: Cercobodo vibrans Sandon, 1927] (рис. 3е–3з).
Тело клетки (6.5–8.0) × (4.0–5.5) мкм, овальной формы с округлым передним концом и вытянутым задним. Передний жгутик немного длиннее тела, дистальный кончик слегка отгибается вверх. Задний жгутик в 2 раза длиннее тела, располагается в вентральной бороздке в передней половине тела клетки. При поворотах клетки видна вентральная выемка, из которой выходит жгутик (рис 3ж–3з). Крупное ядро располагается медиально, сократительная вакуоль – в задней части тела. Размеры исследованных клеток меньше описываемых ранее [3]. Вид отличается от T. longifila Howe et Cavalier-Smith in Howe et al., 2011 [21] более короткими и неравными по длине жгутиками и наличием амебоидной стадии в жизненном цикле.
Характерен для почвенных местообитаний [3, 21].
Naegleria gruberi (Schardinger, 1899) Lepsi, 1960 (рис. 3и–3л).
Четыре стадии жизненного цикла: амебоидная (питание), переходная (амебоидная стадия со жгутиками), жгутиковая (передвижение) и стадия цисты [18]. Была обнаружена только переходная стадия. Тело клетки 6–8 мкм в диаметре, уплощено. Крупное ядро в центре клетки у основания жгутиков, одна сократительная вакуоль – в задней части. Два одинаковых (4–6 мкм) жгутика интенсивно асинхронно мерцают. Морфология исследованных клеток соответствует предыдущим описаниям [18], однако размеры меньше. В литературе описано быстрое, почти мгновенное, превращение амебоидной стадии в жгутиковую и обратно, однако у обнаруженных нами клеток была длительная и стабильная переходная стадия. Полученные данные согласуются с наблюдениями А.П. Мыльникова (устное сообщение).
Distigma proteus Ehrenberg, 1838 (рис. 3м–3о).
Тело клетки вытянутой веретеновидной формы, передняя часть расширенная, задняя – узкая, почти цилиндрическая. Длина тела 50–58 мкм, ширина расширенной части – 8–12 мкм. Два жгутика отходят апикально из небольшой выемки. Основной жгутик составляет половину длины тела, дополнительный – 1/4 длины основного жгутика. Парамилоновые зерна многочисленные, мелкие, преобладают в передней части тела. Пелликула тонко спирально заштрихована. Метаболия тела сильно выражена. От D. senni Pringsheim, 1942 [33] отличается большими размерами тела клетки, выраженной метаболией тела, заметной штриховкой пелликулы и более резкими движениями клеток.
Распространение: Украина, Крым [1], Австралия [35].
Protaspa sp. (рис. 4а–4п).
Рис. 4.
Морфология гетеротрофного жгутиконосца Protaspa sp. (световой микроскоп): а-б – сытые клетки с асимметрично расположенной пищеварительной вакуолью; в – формирование пищевой псевдоподии; г-и – процесс поглощения протопласта жертвы и формирования пищеварительной вакуоли; к-п – отторжение части поглощенного протопласта.
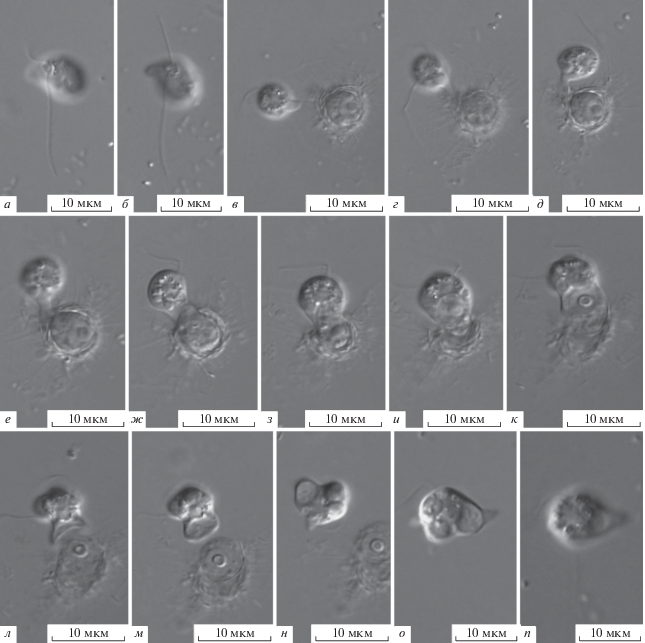
Тело клетки (5.5–7.0) × (6.5–12.0) мкм, не уплощено, вытянуто с боков: одна из сторон тела как правило больше другой. Жгутики выходят из небольшого субапикального углубления на вентральной стороне тела (рис. 4а–4б). Передний жгутик немного больше длины тела, направлен вперед и совершает маховые движения. Задний жгутик в 2.5–3.0 раза длиннее тела, тянется за клеткой. Жгутиконосец является хищником, поедающим мелких эукариот. Голодные клетки значительно меньше сытых, тело овальной формы, напоминает таковое Protaspa simplex. Процесс поглощения жертвы (солнечника) длится ~10 мин (рис. 4в–4н). Пищевая псевдоподия формируется сбоку или от вентральной стороны тела (рис. 4в), медленно проходит через чешуйки к протопласту жертвы и полностью его поглощает (рис. 4г–4з). Через короткое время часть поглощенного протопласта отторгается (рис. 4к–4м). Формируется латеральная пищеварительная вакуоль, одна из сторон тела становится больше другой (рис. 4н–4р).
Heteronema polymorphum Deflandre, 1932 (рис. 5а–5д).
Рис. 5.
Морфология гетеротрофных жгутиконосцев (световой микроскоп): а–д – Heteronema polymorphum, е–з – Notosolenus rhombicus, и–н – Urceolus cyclostomus, о–р – Cryptomonas paramecium.
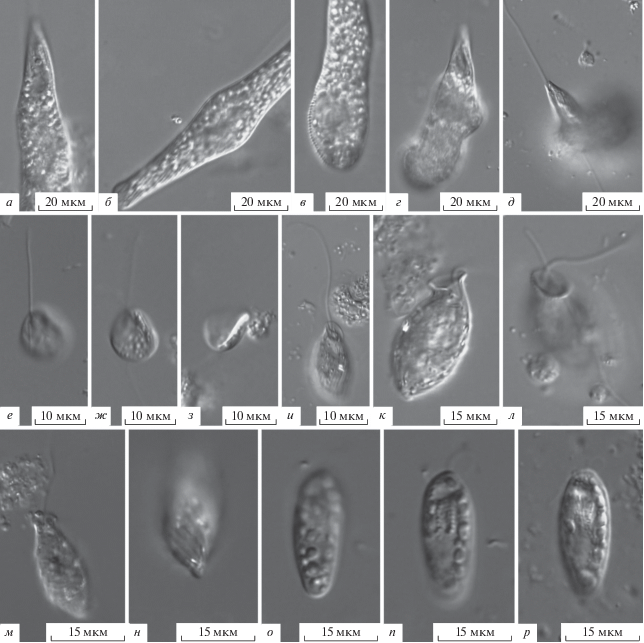
Тело клетки в вытянутом состоянии (85–100) × × (8–20) мкм, овально-цилиндрическое, периодически сильно сокращается. При метаболии в передней части тела может появляться небольшое вздутие, волной проходящее вдоль всего тела. Длина переднего жгутика – 2/3 длины тела, он направлен вперед, дистальная часть вибрирует. Задний жгутик – 1/3 длины переднего жгутика. Штриховка пелликулы хорошо заметна. Размеры и морфология исследованных клеток соответствует предыдущим описаниям [1]. Отличается от H. tauricum Vetrova, 1977 формой тела и длиной жгутиков [1].
Распространение: Крым [1].
Notosolenus rhombicus Larsen, 1987 sensu Schroeckh et al., 2003 (рис. 5е–5з).
Тело клетки (7–12) × (6–10) мкм, уплощено, дорзальная сторона вогнута, края клетки отогнуты вверх (рис. 5з), форма тела ромбовидная. Передний жгутик в 1.5 раза длиннее тела, задний – вполовину короче. Пелликула гладкая, без штриховки и бороздок. Сходен по размеру с N. apocamptus, N. lens Skuja, 1948 и N. similis Skuja, 1939, отличается ромбовидной формой тела и гладкой пелликулой без бороздок.
Распространение: Австралия [35].
Urceolus cyclostomus (Stein, 1878) Mereschkowsky, 1881 [bas.: Phialonema cyclostomum Stein, 1878] (рис. 5и–5н).
Тело клетки (15–22) × (6.5–14) мкм, не уплощено, овальной формы. Передний конец вытянут в небольшую шейку с сильно расширенным устьем, задний конец заужен. Единственный жгутик в 1.5 раза длиннее тела. Пищеварительная органелла слабо развита. Пелликула сильно спирально заштрихована. Жгутиконосец медленно ползает по субстрату, задний конец тела приподнят над субстратом. Исследованные клетки меньше описываемых ранее [1, 27]. Отличается от других представителей рода правильной и более-менее ригидной формой тела, слабо развитой пищеварительной органеллой, хорошо выраженной штриховкой пелликулы.
Распространение: Украина [1], Австралия [27].
Cryptomonas paramecium (Ehrenberg, 1832) Hoef-Emden et Melkonian, 2003 [bas.: Chilomonas paramecium Ehrenberg, 1832] (рис. 5о–5р).
Тело клетки (14–25) × (4.0–7.5) мкм, уплощено, удлиненно-овальной формы со слегка скошенным передним концом. Два одинаковых жгутика немного меньше длины тела. Жгутиковый карман и мембрана клетки окружены рядом экструсом. Ядро и сократительная вакуоль рядом со жгутиковым карманом. Клетки быстро плавают, иногда останавливаются вблизи субстрата и остаются какое-то время без движения. Большинство гетеротрофных видов рода (C. acuta Schiller, 1929, C. bacillaris Javornicky, 1930, C. cryptomonadoides Skuja, 1956, C. insignis Skuja, 1932 и C. oblonga Pascher, 1914) недостаточно изучены и нуждаются в ревизии [20].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследованных водных объектах зарегистрировано 67 видов из 42 родов и 3 макротаксонов (Opisthokonta, SAR и Excavata). Наибольшее количество видов относится к группе SAR (32 вида) и экскаватам (29 видов), четыре вида – к группе неопределенного систематического положения и два – к опистоконтам. Среди SAR преобладают ризарии (16 видов) и страменопилы (11 видов) (табл. 2). Наиболее часто встречались Neobodo designis (в девяти водных объектах), Protaspa simplex (8), Codosiga botrytis, Entosiphon sulcatum, Goniomonas truncata, Ploeotia obliqua (6). Наиболее редкими было 29 видов (в одном водном объекте): Actinomonas mirabilis, A. sp., Allapsa sp., Anisonema ovale, Anthophysa vegetans, Cercomonas directa, C. longicauda, Ciliophrys infusionum, Clathromonas eiffelii, Colponema vietnamica, C. sp. 1, C. sp. 2, C. sp. 3, C. sp. 4, Distigma proteus, Heteronema exaratum, H. polymorphum, H. sp., Naegleria gruberi, Notosolenus rhombicus, Petalomonas minor, Ploeotia adhaerens, P. plumosa, Protaspa sp., Salpingoeca minor, Sandona sp., Spongomonas sp., Thaumatomastix sp. и Thaumatomonas seravini. Более половины из обнаруженных ГЖ (40 видов и форм) – новые для Воронежской обл.
Видовое богатство исследованных водных объектов достаточно высокое (в среднем – 19). Максимальное число видов обнаружено в террасных лесных озерах Чистое (26) и Черепашье (24 вида), минимальное – в сфагновых болотах Клюквенное-1 (12), Клюквенное-2 (10) и Клюквенное-3 (14 видов). Общее видовое богатство остальных водных объектов достигало 20–23 вида. Максимальной уникальностью видового состава (долей видов, встреченных лишь в данном водном объекте от его общего видового богатства) характеризуется оз. Чистое (6 видов, 23%). Всего в озерах обнаружено 56 видов гетеротрофных жгутиконосцев (в среднем по водоему 22.6), из них 26 видов (46.4%) – уникальные (встретились только в озерах). В сфагновых болотах зарегистрировано 27 видов (в среднем 12), из них 8 (29.6%) – уникальные. В р. Усманка найдено 22 вида, из них 4 (18.2%) – уникальные. Высокий уровень видового разнообразия исследованных водных объектов Усманского бора свидетельствует о высокой потенциальной недообследованности данной территории.
Биогеография протистов остается плохо изученной, многие регионы и даже страны не имеют данных о видовом разнообразии ГЖ. В то же время в некоторых регионах (европейской части России, Австралии, Европы и Северной Америки) проводилось значительно бóльшее количество исследований и зафиксировано бóльшее количество видов. Таким образом, космополитизм многих видов ГЖ еще предстоит выяснить.
Анализ фаунистического сходства комплексов гетеротрофных жгутиконосцев исследованных водных объектов показал наличие крупного кластера со сходством ≥50%, в котором объединились все озера и р. Усманка (рис. 6). При этом внутри кластера выделились две подгруппы: 1) озера Маклок и Черепашье (64% сходства), 2) оз. Восьмерка и р. Усманка (58% сходства). Полученные результаты вполне ожидаемы, поскольку озера Маклок и Черепашье – остатки русловой части ранее существовавшего левобережного притока р. Воронеж [14], расположенные близко друг к другу. Пойменное оз. Восьмерка имеет постоянную в течение всего сезона в отличие от другого пойменного оз. Kруглое связь с рекой, что подтверждается сходством не только фаун данных водных объектов, но и физико-химических параметров воды. Все три сфагновых болота показали крайне низкие коэффициенты сходства как между собой, так и с остальными водоемами. Это подтверждает полученные выводы о наибольшей уникальности видового состава гетеротрофных жгутиконосцев в водоемах с экстремальными параметрами среды (заболоченные водоемы с кислой средой) [9].
Рис. 6.
Фаунистическое сходство (%) комплексов ГЖ исследованных водных объектов: 1 – болото Клюквенное-2, 2 – болото Клюквенное-3, 3 – оз. Черепашье, 4 – оз. Маклок, 5 – оз. Чистое, 6 – болото Клюквенное-1, 7 – р. Усманка, 8 – оз. Восьмерка, 9 – оз. Круглое.
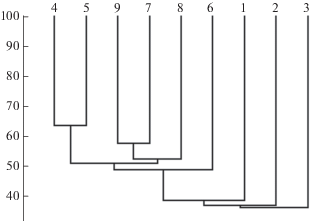
Выводы. В исследованных водных объектах зарегистрировано 67 видов ГЖ, из них 40 – новые для данной территории. Максимальное количество видов обнаружено в террасном лесном оз. Чистое. Низким видовым богатством обладали сфагновые болота, которые к тому же проявили наименьшие коэффициенты сходства как друг с другом, так и с остальными водными объектами. Максимальное сходство фаун гетеротрофных жгутиконосцев показали два террасных лесных озера Маклок и Черепашье (64%), а также пойменное оз. Восьмерка и р. Усманка (58%).
Список литературы
Ветрова З.И. Бесцветные эвгленовые водоросли Украины. Киев: Наук. думка, 1980. 184 с.
Жуков Б.Ф. Атлас пресноводных гетеротрофных жгутиконосцев (биология, экология, систематика). Рыбинск: Ин-т биологии внутр. вод РАН, 1993. 160 с.
Жуков Б.Ф. Определитель бесцветных свободноживущих жгутиконосцев подотряда Bodonina Hollande // Тр. Ин-та биологии внутр. вод АН СССР. 1971. Вып. 21(24). С. 241–284.
Жуков Б.Ф., Мыльников А.П. Фауна зоофлагеллят очистных сооружений // Простейшие активного ила. Л.: Наука, 1983. С. 27–41.
Карпов С.А. Особенности развития культуры Codonosiga botrytis (Erh.) Stein (Choanoflagellida Kent, Protozoa) // Биология внутренних вод: Информ. бюл. Л.: Наука, 1981.
Косолапов Д.Б., Косолапова Н.Г. Гетеротрофные жгутиконосцы и бактерии в планктоне загрязненной нефтью таежной реки // Сиб. экол. журн. 2008. № 1. С. 3–10.
Копылов А.И., Мыльников А.П., Амгаабазар Э. Гетеротрофные флагелляты в реках и озерах Монголии: видовой состав, численность, биомасса и продукция // Биол. внутр. вод. 2006. № 1. С. 57–66.
Животова Е.Н., Коротеева О.А. К изучению гидрохимического режима некоторых водоемов Усманского бора // Гидробиологические исследования водоемов Среднерусской лесостепи. Воронеж, 2002. Т. 1. С. 221–225.
Мазей Ю.А., Тихоненков Д.В., Мыльников А.П. Распределение гетеротрофных жгутиконосцев в малых пресных водоемах Ярославской области // Биол. внутр. вод. 2005. № 4. С. 33–39.
Мыльников А.П., Косолапова Н.Г. Фауна гетеротрофных жгутиконосцев небольшого заболоченного озера // Биол. внутр. вод. 2004. № 4. С. 18–28.
Мыльников А.П., Мыльникова З.М. Внешнее строение пресноводного жгутиконосца Bicosoeca petiolata Bourreliy (Bicosoecida, Protista) // Биол. внутр. вод. 2006. № 4. С. 42–46.
Мыльников А.П., Тихоненков Д.В., Симдянов Т.Г. Фауна и морфология гетеротрофных жгутиконосцев из Воронцовской пещеры (Краснодарский край) // Зоол. журн. 2006. Т. 85. № 10. С. 1164–1175.
Уморин П.П. Взаимоотношение бактерий и жгутиконосцев при разрушении органического вещества // Журн. общ. биологии. 1976. Т. 37. № 6. С. 831–835.
Хлызова Н.Ю., Прокин А.А., Стародубцева Е.А. и др. Материалы к изучению террасных водоемов Усманского и Хреновского боров (I): распространение, происхождение, антропогенная трансформация, типология, цикличность гидрологического режима // Тр. Воронеж. гос. заповед. 2007. Вып. 24. С. 234–289.
Adl S.M., Simpson A.G.B., Lane C.E. et al. The revised classification of eukaryotes // J. Eukar. Microbiol. 2012. V. 59. P. 429–493.
Aydin E.E., Demirsoy A. The systematics of free-living heterotrophic flagellates of Beytepe Pond // Hacettepe J. Biol. and Chem. 2012. Special Issue. P. 337–342.
Dürrschmidt M., Cronberg G. Contribution to the knowledge of tropical chrysophytes: Mallomonadaceae and Paraphysomonadaceae from Sri Lanka. Algological Studies // Archiv für Hydrobiol. 1989. Suppl. vol. P. 15–37.
Fulton C. Cell differentiation in Naegleria gruberi // Ann. Rev. Microbiol. 1977. V. 31. № 1. P. 597–627.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontol. Electron. 2001. V. 4. № 1. 9 p.
Hoef-Emden K., Melkonian M. Revision of the genus Cryptomonas (Cryptophyceae): a combination of molecular phylogeny and morphology provides insights into a long-hidden dimorphism // Protist. 2003. V. 154. № 3–4. P. 371–409.
Howe A.T., Bass D., Scoble J.M. et al. Novel cultured protists identity deep-branching environmental DNA clades of Cercozoa: new genera Tremula, Micrometopion, Minimassisteria, Budifila, Peregrinia // Protist. 2011. V. 162. P. 332–372.
Kiss A.K., Acs E., Kiss K.T., Török J.K. Structure and seasonal dynamics of the protozoan community (heterotrophic flagellates, ciliates, amoeboid protozoa) in the plankton of a large river (River Danube, Hungary) // Eur. J. Protist. 2008. V. 45 № 2. P. 121–138.
Kosolapova N.G., Kosolapov D.B. The diversity and distribution of heterotrophic nannoflagellates in the eutrophic lake Nero // Inland Water Biol. 2009. V. 2. № 1. P. 42–49. https://doi.org/10.1134/S1995082909010076
Larsen J., Patterson D.J. Some flagellates (Protista) from tropical marine sediments // J. Nat. Hist. 1990. V. 24. P. 801–937.
Leadbeater B.S., Morton C. A microscopical study of a marine species of Codosiga James-Clark (Choanoflagellata) with special reference to the ingestion of bacteria // Biol. J. Linn. Soc. 1974. V. 6. № 4. P. 337–347.
Lee W.J. Small free-living heterotrophic flagellates from marine sediments of Gippsland basin, South-Eastern Australia // Acta Protozool. 2015. V. 54. P. 53–76.
Lee W.J., Simpson A.G.B., Patterson D.J. Free-living heterotrophic flagellates from freshwater sites in Tasmania (Australia), a field survey // Acta Protozool. 2005. V. 44. P. 321–350.
Moestrup Ø., Thomsen H.A. Preparations of shadow cast whole mounts // Handbook of Phycological Methods. Cambridge: Cambridge Univ. Press, 1980. P. 385–390.
Nicholls K.H. Eight Chrysophyceae new to North America // Phycologia. 1984. V. 23. № 2. P. 213–221.
Patterson D.J., Larsen J. Biology of free-living heterotrophic flagellates. Oxford: Univ. Press, 1991. 503 p.
Preisig H.R., Hibberd D.J. Ultrastructure and taxonomy of Paraphysomonas (Chrysophyceae) and related genera 1 // Nord. J. Bot. 1982. V. 2. P. 397–420.
Preisig H.R., Hibberd D.J. Ultrastructure and taxonomy of Paraphysomonas (Chrysophyceae) and related genera 2 // Nord. J. Bot. 1982. V. 2. P. 601–638.
Pringsheim E.V. Contributions to our knowledge of saprophytic algae and flagellate. III. Astasia, Distigma, Menoidium and Rhabdomonas // New Phytologist. 1942. V. 41. № 3. P. 171–205. https://doi.org/10.1134/S1995082917020110
Prokina K.I., Mylnikov A.P. Heterotrophic flagellates of Sphagnum bogs and lakes in Usman Pine Forest, Voronezh oblast, Russia // Inland Water Biol. 2017. V. 10. № 2. P. 182–191. https://doi.org/10.1134/S1995082917020110
Schroeckh S., Lee W.J., Patterson D.J. Free-living heterotrophic euglenids from freshwater sites in mainland Australia // Hydrobiologia. 2003. V. 493. P. 131–166.
Thomsen H.A., Zimmermann B., Moestrup Ø., Kristiansen J. Some new freshwater species of Paraphysomonas (Chrysophyceae) // Nordic J. Bot. 1981. V. 1. № 4. P. 559–581.
Tikhonenkov D.V. Species diversity of heterotrophic flagellates in Rdeisky reserve weetlands // Protistology. 2007/2008. V. 5. № 2/3. P. 213–230.
Tikhonenkov D.V., Mylnikov A.P., Gong Y.C. et al. Heterotrophic flagellates from freshwater and soil habitats in subtropical China (Wuhan Area, Hubei Province) // Acta Protozool. 2012. V. 51. P. 63–77.
Vørs N. Heterotrophic amoebae, flagellates and heliozoan from the Tvarminne area, gulf of Finland, in 1988–1990 // Ophelia. 1992. V. 36. № 1. P. 1–109.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


