Биология внутренних вод, 2020, № 3, стр. 260-275
Многолетние изменения состава и обилия зоопланктона водохранилищ р. Камы
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: lazareva_v57@mail.ru
Поступила в редакцию 24.07.2018
После доработки 27.11.2018
Принята к публикации 09.04.2019
Аннотация
В августе 2016 г. исследован пелагический зоопланктон (Cladocera, Copepoda, Rotifera) и меропланктон (велигеры моллюсков рода Dreissena) четырех водохранилищ р. Камы (Камского, Воткинского, Нижнекамского и камской части Куйбышевского). Обнаружено 108 видов, выявлено 14 новых для р. Камы, в том числе пять ракообразных – вселенцев из Каспийского моря. Три из них (Heterocope caspia, Eurytemora caspica и Cercopagis pengoi) продвинулись на север до Камского водохранилища, два (Cornigerius maeoticus и Calanipeda aquaedulcis) достигли верховьев Камского плеса Куйбышевского водохранилища. Установлено, что пять южных видов (Heterocope caspia, Diaphanosoma orghidani, Pompholyx sulcata, Conochiloides coenobasis и Asplanchna henrietta), впервые обнаруженных в р. Каме в 2016 г., локально формируют высокую численность. Летняя биомасса зоопланктона составляет в среднем 1.8 г/м3 в Камском водохранилище, 1.3 г/м3 в Нижнекамском, 1.0 г/м3 в Воткинском и 0.5 г/м3 в Куйбышевском, ее уровень близок к таковому в 2000-х гг. Обсуждаются смены видов, биоинвазии, особенности пространственного распределения и многолетние изменения биомассы зоопланктона.
ВВЕДЕНИЕ
Река Кама – левый, самый крупный и многоводный приток р. Волги, до зарегулирования длина реки была >2000 км, среднемноголетний расход воды в нижнем течении >4000 м3/с (Волга…, 1978). Каскад водохранилищ р. Камы создан в период 1954–1979 гг. (Эдельштейн, 1998). Еще в 1970-х гг. отмечали большое влияние зоопланктона р. Камы на состав и структуру сообщества р. Волги ниже ее слияния с р. Камой (Волга…, 1978).
К настоящему времени наиболее изучен зоопланктон верхних Камского и Воткинского водохранилищ (Алексевнина, Преснова, 2017; Кортунова, 1983; Кортунова, Галанова, 1988; Кузнецова, 2015; Поскрякова, 1977; Преснова, Хулапова, 2015; Селеткова, 2015) существенно менее – Нижнекамского водохранилища и Камского плеса Куйбышевского (Куйбышевское…, 1983, 2008; Поскрякова, 1977). В августе 1975 г. в рамках экспедиции Института биологии внутренних вод им. И.Д. Папанина РАН были обследованы водохранилища р. Камы от ее слияния с р. Волгой до устья р. Вишера, зоопланктон всех четырех водохранилищ описан Н.П. Поскряковой (1977).
Несмотря на большое количество публикаций о зоопланктоне двух верхних камских водохранилищ, до сих пор отсутствует анализ многолетней динамики его состава и структуры. В большинстве работ лишь констатировано состояние сообщества на момент исследования. Вместе с тем в волжских водохранилищах и других водоемах отмечено существенное изменение этих характеристик (биоинвазии, смены доминантов, увеличение доли ветвистоусых и веслоногих ракообразных, продуктивности сообщества), которое вызвано трансформацией экосистем на фоне потепления климата (Лазарева и др., 2018а, 2018б; Фефилова и др., 2014; Adrian et al., 2006; Lazareva, Sokolova, 2015). Установлено быстрое продвижение на север по р. Волге понто-каспийских ракообразных, ряд которых стали массовыми в Куйбышевском водохранилище и водоемах р. Камы (Лазарева и др., 2018а, 2018б; Тимохина, 2000; Lazareva, 2019).
Цель работы – дать анализ динамики состава и структуры пелагического зоопланктона водохранилищ р. Камы за >40 лет с использованием собственных и литературных данных.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Район исследования. Зарегулированный участок р. Камы расположен ниже устья р. Вишера и включает три водохранилища (Камское, Воткинское и Нижнекамское), схема их расположения приведена в работе Беляевой и др. (2018). Обширная устьевая область р. Камы после заполнения на р. Волге Куйбышевского водохранилища сформировала два из восьми его плесов (Камский и Волго-Камский) (Дзюбан, 1960). Трофический статус всех камских водохранилищ в летнюю межень 2016 г. по содержанию хлорофилла а в планктоне определен как эвтрофный, по сумме хлорофилла и феопигментов в донных осадках Камское водохранилище – эвтрофное, Воткинское и Нижнекамское – мезотрофные (Беляева и др., 2018).
Камское (Пермское, Верхнекамское) водохранилище – верхнее в системе р. Камы, заполнено в 1954 г. Его площадь 1915 км2, средняя глубина 6.4 м (максимальная 30 м), коэффициент условного водообмена 4.4 год–1 (Эдельштейн, 1998). Ниже по реке между городами Пермь и Чайковский расположено Воткинское водохранилище, созданное в 1966 г. Его площадь 1120 км2, средняя глубина 8.4 м (максимальная 28 м), коэффициент условного водообмена 5.7 год–1 (Эдельштейн, 1998). В 1979 г. между городами Чайковский и Набережные Челны создано Нижнекамское водохранилище, которое до сих пор не заполнено до проектной отметки и транзитом пропускает сток р. Кама в Куйбышевское водохранилище. Площадь водоема 1000 км2, средняя глубина 8.0 м (максимальная 14 м), коэффициент условного водообмена 6.6 год–1 (Эдельштейн, 1998). Куйбышевское – одно из крупнейших долинных водохранилищ Средней Волги заполнено в 1957 г. Площадь его зеркала 5900 км2, средняя глубина 8.9 м (максимальная >40 м), коэффициент условного водообмена 4.2 год–1 (Эдельштейн, 1998).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Комплексная экспедиция Института биологии внутренних вод РАН в августе 2016 г. фактически повторила маршрут предыдущей (1975 г.). Во второй половине месяца вдоль затопленного русла р. Камы обследовали Волго-Камский и Камский плесы Куйбышевского водохранилища, а также Нижнекамское, Воткинское и Камское водохранилища. Пробы отбирали на 6–8 станциях в пелагиали каждого водоема в области наибольших глубин. Наиболее южная точка отбора располагалась у слияния р. Камы с р. Волгой против пос. Камское устье (55°14.776′ с.ш., 49°16.355′ в.д.) в Волго-Камском плесе Куйбышевского водохранилища, самая северная – в верхней части Камского водохранилища у г. Усолье (59°26.242′ с.ш., 56°41.322′ в.д.).
Ракообразных и коловраток учитывали в тотальных пробах зоопланктона, которые отбирали сетью Джеди с диаметром входного отверстия 12 см и ситом с диагональю ячеи 105 мкм. Сборы фиксировали 4%-ным формалином и просматривали в лаборатории под стереомикроскопом StereoDiscovery-12 (Carl Zeiss, Jena). В пробах определяли численность и биомассу каждого обнаруженного вида, рассчитывали общие значения этих показателей для четырех крупных таксономических групп (Cladocera, Cyclopoida, Calanoida, Rotifera) и всего сообщества. К доминантам относили виды с обилием ≥10% общей численности ракообразных или коловраток.
Концентрацию растворенного кислорода, температуру и электропроводность воды измеряли ручным зондом YSI ProODO (YSI Inc., USA) с оптическим датчиком кислорода.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Гидрофизические условия. Глубина в точках отбора проб на русле р. Камы варьировала от 8 до 23 м, средние ее значения во всех водохранилищах были близки (11–16 м). Прозрачность воды по белому диску составляла 90–170 см. Цветность была низкой 25–45 град Cr–Co, наибольшие значения отмечены в Воткинском водохранилище. Уровень рН воды всех водохранилищ изменялся в пределах 7.8–8.6.
Электропроводность воды р. Камы в августе, отражающая уровень ее минерализации, ступенчато возрастала снизу вверх от Волго-Камского плеса Куйбышевского (275–360 мкS/см)11к верхней части Камского водохранилища (730–860 мкS/см). На отдельных его участках (у городов Березники и Усолье, ниже слияния рек Иньва и Косьва) в придонном слое она достигала 3480–4870 мкS/см. Это связано с выносом в русло р. Камы природных рассолов, широко распространенных вдоль левого берега р. Камы вблизи г. Соликамск, а также с загрязнением вод отходами промышленных предприятий по добыче калийных солей (Печеркин и др., 1980). Минимальные значения (175–250 мкS/см) электропроводности воды регистрировали в Нижнекамском водохранилище выше устья р. Белая и в Воткинском водохранилище от плотины Воткинской ГЭС до устья р. Тулва.
Период работ в августе 2016 г. характеризовался очень высоким (>24°С) прогревом воды, что на 6–6.4°С выше нормы. Норма для августа составляет 18°С в Камском и Воткинском водохранилищах, 19°С в Нижнекамском и камской части Куйбышевского водохранилищ (Многолетние…, 1988). Наибольшую температуру (до 25.5°С) поверхностного слоя наблюдали в Куйбышевском водохранилище. Вследствие такого прогрева был слабо выражен подъем температуры воды вблизи крупных городов (+1°С у г. Чайковский и ниже г. Пермь) и зоны сброса подогретых вод (+0.3°С у Пермской ГРЭС). У дна водоемов на большей части затопленного русла р. Камы температура была на 0.1–1.1°С ниже, чем у поверхности. Максимальную разницу между поверхностной и придонной температурой воды (3–7°С) регистрировали в условиях прямой стратификации на глубоководных (13–24 м) участках вблизи плотин ГЭС в Камском и Воткинском водохранилищах. Минимальные значения температуры воды у дна были 18–24°С.
В трофогенном горизонте (0–3 м) всех обследованных водоемов днем наблюдали перенасыщение (до 165%) воды растворенным кислородом (О2) вследствие массового развития водорослей. Содержание О2 в устьевой области р. Кама (Куйбышевское водохранилище) и выше в Нижнекамском водохранилище превышало 8 мг/л (>80% насыщения) во всем столбе воды. По руслу р. Камы в Воткинском и Камском водохранилищах отмечали значительный дефицит О2 на глубине >8 м. Содержание О2 <1.5 мг/л (<20% насыщения) в слое 1–6 м над дном наблюдали на нижнем участке Воткинского водохранилища от плотины до устья р. Тулва. Тоже регистрировали почти по всему руслу р. Камы в пределах Камского водохранилища, на приплотинном участке которого между городами Пермь и Добрянка слой с аноксией (О2 <1 мг/л) достигал 5–14 м над дном.
Состав и структура зоопланктона. В зоопланктоне водохранилищ р. Кама известно 180 видов, их основа представлена коловратками (48%) и ветвистоусыми ракообразными (33%) (табл. 1). Летом 2016 г. в пелагиали обнаружено 108 видов (Cladocera 33, Copepoda 22 и Rotifera 53), 92 из них отмечены в Куйбышевском водохранилище, 61 – в Нижнекамском, 75 – в Воткинском и 72 – в Камском. Наиболее часто (>80% проб) встречались 7 видов в Куйбышевском водохранилище, 13 – в Нижнекамском, 21 – в Воткинском и 20 – в Камском (табл. 1). Обычными для всех водохранилищ р. Камы были кладоцеры Limnosida frontosa, Diaphanosoma orghidani, Daphnia galeata и Bosmina longirostris, копеподы Mesocyclops leuckarti, Thermocyclops oithonoides, T. crassus и Heterocope caspia, коловратки Polyarthra luminosa, P. major и два подвида Euchlanis dilatata. Кроме того, в более северных Камском и Воткинском водохранилищах часто встречались ракообразные Daphnia cristata, Bosmina crassicornis, B. coregoni, Сyclops vicinus, Eurytemora caspica и коловратки Trichocerca similis, Polyarthra longiremis, Asplanchna priodonta, A. herriсki, Brachionus angularis, Keratella cochlearis, K. quadrata, Kellicottia longispina, Conochilus unicornis и Pompholyx sulcata.
Таблица 1.
Видовой состав зоопланктона водохранилищ р. Камы
| Таксон | Водохранилище | ||||||
|---|---|---|---|---|---|---|---|
| Камское | Воткинское | Нижнекамское | Куйбышевское | ||||
| 1 | 4 | 2 | 4 | 4 | 3 | 4 | |
| РАКООБРАЗНЫЕ – CRUSTACEA | |||||||
| Сем. Sididae | |||||||
| Sida crystallina (O.F. Müller, 1776) | + | + | ++ | + | – | + | – |
| Limnosida frontosa Sars, 1862 | + | +++ | ++ | +++ | +++ | + | ++ |
| Diaphanosoma gr. brachyurum (Lievin, 1848) | ++ | ++ | ++ | ++ | ++ | + | + |
| D.orghidani Negrea, 1982* | – | ++ | – | +++ | +++ | – | +++ |
| D. mongolianum Ueno, 1938* | – | – | – | – | ++ | – | – |
| Latona setifera (O.F. Müller, 1776) | + | – | + | – | – | – | – |
| Сем. Daphniidae | |||||||
| Daphnia (Daphnia) cristata Sars, 1862 | + | +++ | ++ | ++ | + | + | + |
| D. (D.) longiremis Sars, 1862 | – | – | ++ | – | – | – | – |
| D. (D.) galeata Sars, 1864 | ++ | +++ | +++ | +++ | +++ | + | +++ |
| D. (D.) cucullata Sars, 1862 | ++ | ++ | +++ | ++ | ++ | + | ++ |
| Ceriodaphnia quadrangula (O.F. Müller, 1785) | + | – | ++ | + | + | + | + |
| C. cf. dubia Richard, 1894 | + | – | + | – | – | + | – |
| C. pulchella Sars, 1862 | – | + | + | – | – | + | + |
| C. reticulata (Jurine, 1820) | – | – | + | – | – | – | – |
| C. laticaudata P.E. Müller, 1867 | – | – | + | – | – | – | – |
| C. rotunda Sars, 1862 | + | – | – | – | – | – | – |
| Simocephalus vetulus (O.F. Müller, 1776) | + | – | + | – | – | + | – |
| Scapholeberis mucronata (O.F. Müller, 1776) | + | – | + | – | – | – | – |
| Сем. Moinidae | |||||||
| Moina micrura Kurz, 1874 | + | + | – | ++ | ++ | + | ++ |
| M. macrocopa (Straus, 1820) | + | – | – | – | – | + | – |
| Сем. Macrothricidae | |||||||
| Macrothrix laticornis (Jurine, 1820) | + | – | – | – | – | + | – |
| M. hirsuticornis Norman et Brady, 1867 | + | – | + | – | – | – | – |
| Сем. Ilyocryptidae | |||||||
| Ilyocriptus agilis Kurz, 1874 | – | – | – | – | – | + | – |
| I. acutifrons Sars, 1862 | + | – | + | – | – | – | + |
| I. sordidus (Lievin, 1848) | + | – | + | – | – | – | – |
| Сем. Eurycercidae | |||||||
| Eurycercus (s.str) lamellatus (O.F. Müller, 1776) | + | – | + | – | – | – | – |
| Cем. Сhydoridae | |||||||
| Pleuroxus trigonellus (O.F. Müller, 1785) | – | – | + | – | – | – | – |
| P. adunctus (Jurine, 1820) | + | – | ++ | + | – | – | – |
| P. truncatus (O.F. Müller, 1785) | – | – | + | – | – | – | – |
| P. uncinatus Baird, 1850 | + | – | ++ | – | – | – | – |
| Alonella exigua (Lilljeborg, 1901) | – | – | + | – | – | – | – |
| A. excisa (Fischer, 1854) | – | – | + | – | – | – | – |
| Rhynchotalona falcata (Sars, 1862) | + | + | – | – | – | – | + |
| Disparalona rostrata (Koch, 1841) | + | – | ++ | + | – | + | + |
| Chydorus sphaericus (O.F. Müller, 1785) | ++ | +++ | +++ | ++ | + | + | ++ |
| C. gibbus Sars, 1891 | + | + | – | + | – | – | + |
| C. ovalis Kurz, 1874 | + | – | + | – | – | + | – |
| Alona quadrangularis (O.F. Müller, 1785) | + | – | ++ | – | – | + | – |
| A. affinis (Leydig, 1860) | + | – | + | ++ | ++ | – | + |
| A. intermedia (Sars, 1862) | + | – | – | – | – | + | – |
| A. costata Sars, 1862 | – | – | + | – | – | – | – |
| A. guttata Sars, 1862 | – | – | + | – | – | – | – |
| Coronatella rectangula (Sars, 1862) | + | – | + | + | – | + | + |
| Acroperus harpae (Baird, 1834) | + | – | + | – | – | – | + |
| Alonopsis elongatus Sars, 1862 | + | – | – | – | – | – | – |
| Camptocercus rectirostris Sars, 1862 | + | – | + | – | – | – | – |
| Leydigia leydigii (Schoedler, 1863) | + | + | + | + | – | + | + |
| Graptoleberis testudinaria (Fisсher, 1851) | + | – | + | – | – | – | – |
| Monospilus dispar Sars, 1862 | + | – | + | ++ | + | + | + |
| Cем. Вosminidae | |||||||
| Bosmina (s.str) longirostris (O.F. Müller, 1785) | ++ | ++ | +++ | +++ | ++ | + | +++ |
| B. (Eubosmina) cf. coregoni Baird, 1857 | ++ | +++ | ++ | ++ | ++ | + | + |
| B. (E.) cf. kessleri Uljanin, 1864 | + | – | – | – | + | + | + |
| B. (E.) cf. longispina Leydig, 1860 | + | + | +++ | ++ | + | + | + |
| B. (E.) cf. crassicornis (Lilljeborg, 1887) | + | ++ | – | +++ | +++ | + | + |
| Bosminopsis deitersi Richard, 1895 | + | + | – | – | – | + | + |
| Cем. Рolyphemidae | |||||||
| Polyphemus pediculus (Linnaeus, 1761) | + | – | ++ | + | – | + | + |
| Сем. Podonidae | |||||||
| Cornigerius maeoticus (Pengo, 1879)* | – | – | – | – | – | + | + |
| Сем. Сercopagidae | |||||||
| Bythotrephes brevimanus × B. cederströmii | + | ++ | ++ | ++ | + | + | ++ |
| Bythotrephes lilljeborgi (Korovchinsky, 2018)* | – | – | – | – | + | – | – |
| Cercopagis (s.str.) pengoi (Ostroumov, 1891)* | – | ++ | – | + | – | + | + |
| Сем. Leptodoridae | |||||||
| Leptodora kindtii (Focke, 1844) | + | +++ | ++ | ++ | +++ | + | ++ |
| Сeм. Cyclopidae | |||||||
| Halicyclops neglectus Kiefer, 1935* | – | – | – | – | – | – | + |
| Macrocyclops albidus (Jurine, 1820) | + | – | ++ | – | – | + | – |
| Eucyclops serrulatus (Fisсher, 1851) | + | – | + | + | – | – | – |
| E. macruroides (Lilljeborg, 1901) | + | – | – | – | – | – | – |
| E. macrurus (Sars, 1863) | + | – | – | – | – | – | – |
| Paracyclops fimbriatus (Fisсher, 1853) | + | – | + | – | + | + | + |
| Ectocyclops phaleratus (Koch, 1838) | + | – | – | – | – | – | – |
| Сyclops vicinus Uljanin, 1875 | + | +++ | ++ | ++ | ++ | + | + |
| C. kolensis Lilljeborg, 1901 | + | – | – | + | – | + | ++ |
| C. strenuus Fischer, 1851 | + | – | ++ | – | – | – | – |
| C. insignis Claus, 1857* | – | – | – | + | – | – | – |
| Megacyclops viridis (Jurine, 1820) | + | + | ++ | + | – | + | + |
| Acanthocyclops vernalis (Fischer, 1853) | + | – | + | – | – | + | + |
| A. robustus (Sars, 1863) | + | – | – | – | – | – | – |
| A. americanusamericanus (Marsh, 1893) | – | ++ | – | ++ | + | + | +++ |
| A. a. spinosus Monchenko, 1961 | – | – | – | – | + | – | + |
| Diacyclops languidoides (Lilljeborg, 1901)* | – | – | – | – | – | – | + |
| D. bicuspidatus (Claus, 1857) | + | – | + | – | + | + | – |
| D. bisetosus (Rehberg, 1880) | – | – | + | – | – | – | – |
| Metacyclops minutus (Claus, 1863) | + | – | – | – | – | – | – |
| Mesocyclops leuckarti (Claus, 1857) | ++ | +++ | +++ | +++ | +++ | + | +++ |
| Thermocyclops oithonoides (Sars, 1863) | ++ | +++ | +++ | +++ | +++ | + | ++ |
| T. crassus (Fisсher, 1853) | ++ | ++ | ++ | +++ | +++ | + | +++ |
| T. taihokuensis (Harada, 1931)* | – | – | + | – | – | – | – |
| Сем. Diaptomidae | |||||||
| Eudiaptomus gracilis (Sars, 1863) | + | + | ++ | ++ | +++ | + | ++ |
| E. graciloides (Lilljeborg, 1888) | + | ++ | ++ | + | ++ | + | + |
| E. coeruleus (Fischer, 1835) | – | – | – | – | – | + | – |
| E. transylvanicus (Daday, 1890)* | – | + | – | – | – | – | – |
| Сем. Pseudodiaptomidae | |||||||
| Calanipeda aquaedulcis Kritschagin, 1873* | – | – | – | – | – | – | ++ |
| Cем. Temoridae | |||||||
| Heterocope appendiculata Sars, 1863 | + | + | ++ | – | – | + | + |
| H. caspia Sars, 1897* | – | +++ | – | +++ | +++ | + | +++ |
| Eurytemora velox (Lilljeborg, 1853) | + | ++ | +++ | + | – | + | + |
| E. caspica Sukhikh et Alekseev, 2013* | – | ++ | – | +++ | ++ | – | ++ |
| E. affinis (Poppe, 1880) | + | – | – | – | – | + | – |
| E. lacustris (Poppe, 1887) | + | – | + | – | – | + | – |
| КОЛОВРАТКИ – ROTIFERA | |||||||
| Сем. Notommatidae | |||||||
| Сephalodella volvocicola (Zawadowsky, 1916)* | – | – | – | – | – | – | + |
| C. gibba (Ehrenberg, 1832) | + | – | – | – | – | – | – |
| C. crassipes (Lord, 1903)* | – | – | – | – | – | – | + |
| Сем. Trichocercidae | |||||||
| Trichocerca (s.str) cylindrica (Imhof, 1891) | + | ++ | – | + | + | + | ++ |
| T. (s.str.) capucina (Wierz. et Zachar., 1893) | + | ++ | ++ | ++ | – | + | + |
| T. (s.str.) rattus (O.F. Müller, 1776) | + | – | – | – | – | – | + |
| T. (s.str.) stylata (Gosse, 1851) | – | – | – | – | – | + | + |
| T. (s.str.) mucosa (Stokes, 1896)* | – | – | – | – | – | – | + |
| T. (s.str.) pusilla (Lauterborn, 1898) | + | + | – | + | – | + | + |
| T. (s.str.) elongata (Gosse, 1886) | + | – | – | – | – | – | – |
| Т. (s.str.) longiseta (Schrank, 1802) | + | – | – | – | – | – | – |
| T. (Diurella) porcellus (Gosse, 1886) | + | + | ++ | + | + | + | – |
| T. (D.) similis (Wierzejski, 1893) | + | +++ | – | +++ | ++ | + | ++ |
| T. (D.) rousseleti (Voigt, 1902)* | – | + | – | – | – | – | – |
| T. (D.) brachyura (Gosse, 1851) | + | – | – | – | – | – | – |
| T. (D.) weberi (Jennings, 1903) | + | – | + | – | – | – | – |
| T. (D.) tenuior (Gosse, 1886) | + | – | – | – | – | – | – |
| T. (D.) heterodactyla (Tschugunoff, 1921)* | – | + | – | – | – | – | – |
| Сем. Gastropodidae | |||||||
| Ascomorpha ecaudis Perty, 1850* | – | + | – | – | – | – | – |
| A. ovalis (Bergendal, 1892)* | – | ++ | – | – | + | – | – |
| Сем. Synchaetidae | |||||||
| Synchaeta pectinata Ehrenberg, 1832 | + | ++ | – | ++ | ++ | + | ++ |
| S. tremula (O.F. Müller, 1786) | – | + | – | ++ | ++ | + | ++ |
| S. grandis Zacharias, 1893 | – | – | ++ | – | – | – | – |
| Polyarthra vulgaris Carlin, 1943 | ++ | – | – | + | – | – | + |
| P. minor Voigt, 1904 | – | ++ | ++ | ++ | + | – | + |
| P. dolichoptera Idelson, 1925 | + | – | ++ | – | – | + | – |
| P. remata Skorikov, 1896 | + | – | ++ | – | – | + | – |
| P. longiremis Carlin, 1943 | + | ++ | – | +++ | + | – | ++ |
| P. euryptera Wierzejski, 1891* | – | ++ | – | ++ | + | – | + |
| P. luminosa Kutikova, 1962 | + | +++ | – | +++ | +++ | + | ++ |
| P. major Bruckhardt, 1900 | +++ | +++ | +++ | +++ | +++ | + | ++ |
| Bipalpus hudsoni (Imhof, 1891) | + | – | ++ | – | – | + | + |
| Ploesoma truncatum (Levander, 1894) | + | – | – | – | – | – | + |
| Сем. Asplanchnidae | |||||||
| Asplanchna priodonta Gosse, 1850 | + | +++ | ++ | ++ | + | – | + |
| A. henrietta Langhaus, 1906* | – | + | – | ++ | + | – | ++ |
| A. herriсki Guerne, 1888* | – | +++ | – | +++ | ++ | – | – |
| A. sieboldi (Leydig, 1854) | – | + | – | + | + | + | – |
| A. girodi Guerne, 1888 | – | – | – | – | – | + | – |
| A. brightwelli Gosse, 1850* | – | + | – | + | – | – | + |
| Сем. Lecanidae | |||||||
| Lecane (s.str.) luna (O.F. Müller, 1776) | + | ++ | + | – | – | – | – |
| L. (Monostyla) bulla (Gosse, 1886) | + | – | + | – | – | – | – |
| L. (M.) closterocerca (Schmarda, 1859) | – | – | + | – | – | – | – |
| L. (M.) lunaris (Ehrenberg, 1832) | + | – | + | – | – | – | – |
| L. (M.) copeis (Harring et Myers, 1926) | + | – | – | – | – | – | – |
| Сем. Trichotriidae | |||||||
| Trichotria truncata (Whitelegge, 1889) | + | – | ++ | – | – | – | – |
| T. pocillum (O.F. Müller, 1776) | – | – | ++ | – | – | – | – |
| T. similis (Stenroos, 1898) | – | – | ++ | – | – | – | – |
| T. tetractis (Ehrenberg, 1830) | + | – | ++ | – | – | – | – |
| T. curta (Skorikov, 1914) | + | – | – | – | – | – | – |
| Сем. Mytilinidae | |||||||
| Mytilina ventralis (Ehrenberg, 1832) | + | – | – | + | – | – | – |
| Сем. Euchlanidae | |||||||
| Euchlanis dilatatadilatata Ehrenberg, 1832 | + | ++ | +++ | ++ | – | + | ++ |
| E. d.lucksiana (Hauer, 1939) | + | ++ | – | +++ | +++ | – | ++ |
| E. triquetra Ehrenberg, 1838 | + | – | + | – | – | – | – |
| Dipleuchlanis propatula (Gosse, 1886) | – | – | – | – | – | – | + |
| Сем. Brachionidae | |||||||
| Brachionus calyciflorus Pallas, 1776 | + | + | +++ | ++ | – | + | ++ |
| B. angularis Gosse, 1851 | + | ++ | ++ | +++ | ++ | + | ++ |
| B. quadridentatus Hermann, 1783 | + | – | ++ | – | – | + | + |
| B. diversicornis (Daday, 1883) | + | ++ | – | ++ | ++ | + | ++ |
| B. budapestinensis Daday, 1885 | + | + | – | ++ | + | – | + |
| B. variabilis Hempel, 1896 | + | – | – | – | – | – | – |
| B. leydigii Cohn, 1862 | – | – | + | – | – | + | – |
| B. urceus (Linnaeus, 1758) | + | – | + | – | – | + | – |
| B. bennini Lessling, 1924 | + | – | + | – | – | – | + |
| B. nilsoni Ahlstrom, 1940 | + | – | + | – | – | – | – |
| B. rubens Ehrenberg, 1838 | + | – | – | – | – | – | – |
| Platias quadricornis (Ehrenberg, 1838) | – | – | + | – | – | – | – |
| P. polyacanthus (Ehrenberg, 1834)* | – | – | – | – | – | – | + |
| Keratella cochlearis (Gosse, 1851) | ++ | +++ | + | +++ | ++ | + | ++ |
| K. irregularis (Lauterborn, 1898)* | – | – | – | + | ++ | – | – |
| K. quadrata (O.F. Müller, 1786) | + | +++ | +++ | +++ | + | + | ++ |
| K. valga (Ehrenberg, 1834) | + | – | + | – | – | + | – |
| K. testudo (Ehrenberg, 1832) | + | – | – | – | – | – | – |
| K. tropica (Apstein, 1907)* | – | – | – | – | – | – | + |
| Kellicottia longispina (Kellicott, 1879) | ++ | +++ | +++ | +++ | ++ | + | – |
| K. bostoniensis (Rousselet, 1908)* | ++ | – | – | – | – | – | – |
| Сем. Conochilidae | |||||||
| Conochilus hippocrepis (Schrank, 1803) | – | + | – | + | ++ | – | + |
| C. unicornis Rousselet, 1892 | – | ++ | – | +++ | + | + | + |
| Conochiloides coenobasis Skorikov, 1914* | – | + | – | ++ | ++ | – | ++ |
| Сем. Testudinellidae | |||||||
| Testudinella patina (Hermann, 1783) | + | – | + | – | – | – | – |
| T. parva (Ternetz, 1892)* | – | – | – | – | – | – | + |
| Pompholyx sulcata Hudson, 1885* | – | +++ | – | +++ | ++ | – | + |
| P. complanata Gosse, 1851 | + | – | – | – | – | – | – |
| Сем. Filiniidae | |||||||
| Filinia longiseta (Ehrenberg, 1834) | ++ | ++ | ++ | ++ | ++ | – | + |
| F. terminalis (Plate, 1886) | – | – | – | – | – | + | – |
| Сем. Hexarthridae | |||||||
| Hexarthra mira (Hudson, 1871) | + | ++ | – | + | + | – | ++ |
| Сем. Collothecidae | |||||||
| Collotheca pelagica (Rousselet, 1893)* | – | +++ | – | ++ | ++ | – | ++ |
| Всего видов | 121 | 72 | 95 | 75 | 61 | 80 | 92 |
Примечание. 1 – 2002–2013 гг. (Крайнев и др., 2018; Кузнецова, 2015; Селеткова, 2015), 2 – 1979–2014 гг. (Кортунова, Галанова, 1988; Кузнецова, 2015; Преснова, Хулапова, 2015; Сидоровский и др., 2018), 3 – 1990–2002 гг. без указания встречаемости (Тимохина, 2000), 4 – данные автора. “+++” – вид встречается в большинстве проб (>80%), “++” – обычен (30–79% проб), “+” – редок (<30% проб), “–” – не обнаружен. * Зарегистрирован впервые в водохранилищах р. Камы.
Сравнительный анализ новых данных и списков зоопланктона, опубликованных по материалам 1970–2000-х г. (Кортунова, Галанова, 1988; Селеткова, 2015; Тимохина, 2000), показал, что состав видов существенно изменился. В каждом водоеме выявлено от 20 до >30 видов (преимущественно коловраток), которых ранее не регистрировали (табл. 1). Большинство из них (40–65%) обычны для современного зоопланктона волжских водохранилищ (Лазарева, 2007; Лазарева и др., 2018а; Экологические…, 2001), а также других водоемов лесной зоны Европейской России (Боруцкий и др., 1991; Пидгайко, 1984). Остальные новые для р. Камы виды можно разделить на три группы: южные пресноводные формы, которые расширяют свой ареал на север в связи с потеплением климата; понто-каспийские инвазионные ракообразные, расселившиеся в р. Каме по р. Волге из Каспийского моря, и виды-вселенцы, проникшие в бассейн р. Волги с других континентов.
В первую группу входят ракообразные Diaphanosoma orghidani, Acanthocyclops americanus и коловратки Asplanchna henrietta, Brachionus diversicornis, B. budapestinensis, Keratella tropica, Pompholyx sulcata, Conochiloides coenobasis. Эти виды еще в прошлом веке достигли Верхней Волги (Лазарева, 2007; Экологические…, 2001), а теперь обнаружены и в камских водохранилищах (табл. 2). В эту же группу можно отнести первую находку в р. Каме против устья р. Иж (Нижнекамское водохранилище, 56° с.ш.) Diaphanosoma mongolianum (>300 экз./м3) совместно с более многочисленной D. orghidani (2 тыс. экз./м3). Diaphanosoma mongolianum распространена в Палеарктике до 57° с.ш., но чаще встречается в южной ее части (Korovchinsky, 1987). Отметим, что ряд южных видов в камских водохранилищах образуют многочисленные популяции (ракообразные 5‒20, коловратки 10‒125 тыс. экз./м3) и локально входят в состав доминантов зоопланктона (табл. 2).
Таблица 2.
Встречаемость (В, % числа проб) и максимальная численность (Nmax, экз./м3) некоторых вселенцев в водохранилищах р. Камы летом 2016 г.
| Таксон | Водохранилище | |||||||
|---|---|---|---|---|---|---|---|---|
| Куйбышевское* | Нижнекамское | Воткинское | Камское | |||||
| Nmax | В | Nmax | В | Nmax | В | Nmax | В | |
| Crustacea | ||||||||
| Heterocope caspia** | 19‒33 | 100 | 2‒3 | 80 | 11‒19 | 100 | 3‒5 | 90 |
| Acanthocyclops americanus | 3‒6 | 100 | 0.06 | 30 | 1‒2 | 60 | 0.1 | 40 |
| Calanipeda aquaedulcis | 1‒5 | 70 | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ |
| Eurytemora caspica | 0.2‒0.5 | 80 | 0.2 | 70 | 3 | 100 | 0.8 | 75 |
| Diaphanosoma orghidani** | 2‒5 | 100 | 1‒2 | 80 | 1 | 100 | 7‒21 | 60 |
| Cornigerius maeoticus | 0.1‒0.3 | 50 | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ |
| Cercopagis pengoi | 0.02 | 30 | ‒ | ‒ | 0.02 | 15 | 0.05 | 40 |
| Rotifera | ||||||||
| Brachionus diversicornis | 2 | 50 | 0.1 | 30 | 1‒9 | 40 | 0.8 | 40 |
| Brachionus budapestiensis | 0.08 | 15 | 0.07 | 15 | 1 | 40 | 0.8 | 25 |
| Keratella tropica | 0.8 | 50 | ‒ | ‒ | ‒ | ‒ | ‒ | ‒ |
| Pompholyx sulcata** | 0.3 | 15 | 89‒125 | 70 | 1‒5 | 100 | 2‒4 | 90 |
| Conochiloides coenobasis** | 24 | 70 | 17‒22 | 70 | 9‒10 | 70 | 21 | 25 |
| Asplanchna henrietta** | 1 | 70 | 0.08 | 15 | 6‒14 | 60 | 1.6 | 25 |
Ко второй группе относятся каспийские копеподы Heterocope caspia, Eurytemora caspica и средиземноморская Calanipeda aquaedulcis, а также хищные каспийские кладоцеры Cornigerius maeoticus и Cercopagis pengoi. Calanipeda aquaedulcis и Cornigerius maeoticus найдены только в камской части Куйбышевского водохранилища (до 55° с.ш.), Cercopagis pengoi отмечен, кроме того, в верховье Воткинского водохранилища и приплотинном участке Камского (до 58° с.ш.), а Heterocope caspia и Eurytemora caspica заселили все водохранилища р. Камы до 59° с.ш. (табл. 2). Среди них многочисленна копепода Heterocope caspia, которая доминировала в Куйбышевском и локально в Воткинском водохранилищах (Лазарева и др., 2018б; Lazareva, 2019). Остальные виды сравнительно малочисленны (<5 тыс. экз./м3).
В третьей группе один вид – американская коловратка Kellicottia bostoniensis, которая вселилась в бассейн р. Волги из Западной Европы и быстро распространяется в восточном направлении (Zhdanova et al., 2016). К 2012 г. она заселила фактически все Камское водохранилище, но в августе 2016 г. вид в планктоне отсутствовал (Krainev et al., 2018).
Помимо перечисленных выше, зарегистрирована группа (10 видов) новых, но редких форм, которые малочисленны или найдены в единственном экземпляре (табл. 1). Среди них наиболее часто во всех водохранилищах, особенно в Камском, встречалась коловратка Collotheca pelagica. Этот вид обычен также в Верхней и Средней Волге (Лазарева и др., 2018а). Следует отметить первую находку копеподы Eudiaptomus transylvanicus (20 экз./м3) в приплотинном участке Камского водохранилища. Вид широко распространен в водоемах лесной зоны (Боруцкий и др., 1991), но в водохранилищах рек Волги и Камы ранее его не обнаруживали (Волга…, 1978; Лазарева, 2007; Лазарева и др., 2018а). По нашим сборам из Нижнекамского водохранилища описан новый вид рода Bythotrephes – B. lilljeborgi Korovchinsky, 2018 (Korovchinsky, 2018), тогда как другие представители рода, обитающие в реках Кама и Волга, отнесены к гибридам Bythotrephes brevimanus × B. cederströmii (Korovchinsky, 2019). Ранее их указывали как Bythotrephes longimanus (Leydig, 1860).
Наиболее многочисленными представителями зоопланктона каждого водохранилища были 3–6 видов ракообразных и 2–4 вида коловраток. В августе основу (60–90%) численности ракообразных (Ncr) во всех водохранилищах формировали копеподы. Доминировали Mesocyclops leuckarti (в среднем 20–60 тыс. экз./м3 или 40–60% Ncr) и Thermocyclops crassus (7–30 тыс. экз./м3 или 10–20% Ncr). В северных Воткинском и Камском водохранилищах также многочислен T. oithonoides (24–30 тыс. экз./м3 или 17–25% Ncr), а в южном Куйбышевском водохранилище – вселенец Heterocope caspia (8 тыс. экз./м3 или 18% Ncr).
Локально, чаще всего в устье крупных притоков Камы, высокую численность формировали кладоцеры. Так, в устье р. Кондас (Камское водохранилище) 16% Ncr образовывали мелкие (0.3–0.8 мм) Diaphanosoma orghidani (21 тыс. экз./м3) и Chydorus sphaericus (28 тыс. экз./м3), а крупная (до 1.8 мм) Daphnia galeata была особенно обильна (15–26 тыс. экз./м3 или 15–20% Ncr) вблизи устья рек Обва и Иньва в Камском водохранилище, р. Тулва – в Воткинском, рек Сива и Иж – в Нижнекамском.
Среди коловраток высокую численность (10–220 тыс. экз./м3) формировали 11 видов: Brachionus angularis, Pompholyx sulcata, Keratella cochlearis, K. quadrata, Conochilus hippocrepis, Euchlanis dilatata lucksiana, Conochiloides coenobasis, Polyarthra luminosa, P. major, Synchaeta pectinata и Asplanchna henrietta. Их обилие в пелагиали водохранилищ распределено крайне неравномерно (коэффициент вариации 150–430), большинство видов доминировали локально в отдельных участках водоемов. Максимальную (>300 тыс. экз./м3) численность коловраток (Nrot) регистрировали в Камском водохранилище вблизи устья р. Кондас (доминировал Brachionus angularis – 220 тыс. экз./м3 или >70% Nrot) и верхнем речном участке Нижнекамского водохранилища от плотины Воткинской ГЭС до г. Сарапул (табл. 3). В последнем была многочисленна большая группа коловраток, в которой преобладали Pompholyx sulcata (90–125 тыс. экз./м3, 26% Nrot), Keratella cochlearis (100–119 тыс. экз./м3, 26% Nrot), Conochilus hippocrepis (100–113 тыс. экз./м3, 26% Nrot) и Euchlanis dilatata lucksiana (33–39 тыс. экз./м3, 9% Nrot).
Таблица 3.
Численность (N, тыс. экз./м3) и биомасса (В, мг/м3) зоопланктона водохранилищ р. Камы летом 2016 г.
| Таксон | Водохранилище | |||||||
|---|---|---|---|---|---|---|---|---|
| Куйбышевское | Нижнекамское | Воткинское | Камское | |||||
| N | В | N | В | N | В | N | В | |
| Cladocera | $\frac{{6 \pm 2}}{{0.5{\kern 1pt} --{\kern 1pt} 19}}$ | $\frac{{200 \pm 50}}{{14{\kern 1pt} --{\kern 1pt} 20}}$ | $\frac{{13 \pm 5}}{{1{\kern 1pt} --{\kern 1pt} 30}}$ | $\frac{{830 \pm 310}}{{40{\kern 1pt} --{\kern 1pt} 1810}}$ | $\frac{{6 \pm 2}}{{2{\kern 1pt} --{\kern 1pt} 16}}$ | $\frac{{260 \pm 100}}{{10{\kern 1pt} --{\kern 1pt} 640}}$ | $\frac{{24 \pm 9}}{{2{\kern 1pt} --{\kern 1pt} 76}}$ | $\frac{{990 \pm 260}}{{110{\kern 1pt} --{\kern 1pt} 1800}}$ |
| Cyclopoida | $\frac{{32 \pm 8}}{{4{\kern 1pt} --{\kern 1pt} 80}}$ | $\frac{{130 \pm 50}}{{10{\kern 1pt} --{\kern 1pt} 370}}$ | $\frac{{52 \pm 13}}{{10{\kern 1pt} --{\kern 1pt} 99}}$ | $\frac{{375 \pm 130}}{{60{\kern 1pt} --{\kern 1pt} 890}}$ | $\frac{{106 \pm 24}}{{35{\kern 1pt} --{\kern 1pt} 228}}$ | $\frac{{480 \pm 110}}{{85{\kern 1pt} --{\kern 1pt} 875}}$ | $\frac{{114 \pm 23}}{{36{\kern 1pt} --{\kern 1pt} 229}}$ | $\frac{{500 \pm 76}}{{170{\kern 1pt} --{\kern 1pt} 780}}$ |
| Calanoida | $\frac{{9 \pm 4}}{{0.3{\kern 1pt} --{\kern 1pt} 36}}$ | $\frac{{170 \pm 90}}{{2{\kern 1pt} --{\kern 1pt} 870}}$ | $\frac{{1 \pm 0.5}}{{0.1{\kern 1pt} --{\kern 1pt} 3}}$ | $\frac{{40 \pm 20}}{{4{\kern 1pt} --{\kern 1pt} 130}}$ | $\frac{{6 \pm 3}}{{0.3{\kern 1pt} --{\kern 1pt} 20}}$ | $\frac{{70 \pm 28}}{{14{\kern 1pt} --{\kern 1pt} 200}}$ | $\frac{{2 \pm 0.8}}{{ < 0.1{\kern 1pt} --{\kern 1pt} 6}}$ | $\frac{{80 \pm 35}}{{ < 0.1{\kern 1pt} --{\kern 1pt} 310}}$ |
| Rotifera | $\frac{{16 \pm 6}}{{0.5{\kern 1pt} --{\kern 1pt} 73}}$ | $\frac{{25 \pm 10}}{{0.1{\kern 1pt} --{\kern 1pt} 100}}$ | $\frac{{141 \pm 88}}{{0.2{\kern 1pt} --{\kern 1pt} 447}}$ | $\frac{{60 \pm 30}}{{0.1{\kern 1pt} --{\kern 1pt} 200}}$ | $\frac{{56 \pm 14}}{{14{\kern 1pt} --{\kern 1pt} 123}}$ | $\frac{{170 \pm 60}}{{30{\kern 1pt} --{\kern 1pt} 490}}$ | $\frac{{66 \pm 36}}{{6{\kern 1pt} --{\kern 1pt} 313}}$ | $\frac{{240 \pm 160}}{{20{\kern 1pt} --{\kern 1pt} 1320}}$ |
| Весь зоопланктон | $\frac{{63 \pm 7}}{{28{\kern 1pt} --{\kern 1pt} 99}}$ | $\frac{{530 \pm 120}}{{130{\kern 1pt} --{\kern 1pt} 1010}}$ | $\frac{{207 \pm 102}}{{14{\kern 1pt} --{\kern 1pt} 539}}$ | $\frac{{1310 \pm 460}}{{105{\kern 1pt} --{\kern 1pt} 2910}}$ | $\frac{{173 \pm 29}}{{105{\kern 1pt} --{\kern 1pt} 325}}$ | $\frac{{980 \pm 180}}{{410{\kern 1pt} --{\kern 1pt} 1770}}$ | $\frac{{208 \pm 60}}{{87{\kern 1pt} --{\kern 1pt} 619}}$ | $\frac{{1810 \pm 360}}{{720{\kern 1pt} --{\kern 1pt} 3840}}$ |
| Меропланктон (Dreissena veliger) |
$\frac{{21 \pm 5}}{{0{\kern 1pt} --{\kern 1pt} 44}}$ | $\frac{{15 \pm 7}}{{0.2{\kern 1pt} --{\kern 1pt} 71}}$ | $\frac{{13 \pm 9}}{{0.6{\kern 1pt} --{\kern 1pt} 59}}$ | $\frac{{22 \pm 16}}{{0.5{\kern 1pt} --{\kern 1pt} 106}}$ | $\frac{{6 \pm 3}}{{0.6{\kern 1pt} --{\kern 1pt} 26}}$ | $\frac{{12 \pm 5}}{{1{\kern 1pt} --{\kern 1pt} 47}}$ | $\frac{{0.6 \pm 0.3}}{{0{\kern 1pt} --{\kern 1pt} 2}}$ | $\frac{{0.9 \pm 0.3}}{{0{\kern 1pt} --{\kern 1pt} 2.4}}$ |
В верховье Камского водохранилища у г. Березники при численности коловраток 95 тыс. экз./м3 доминировали Conochiloides coenobasis (21 тыс. экз./м3, 22% Nrot) и Brachionus angularis (16 тыс. экз./м3, 17% Nrot), на участке от слияния рек Иньва и Косьва до плотины Камской ГЭС при сравнительно небольшой общей численности группы (6–52 тыс. экз./м3) доминирование было слабо выраженным, преобладали Keratella cochlearis (<25% Nrot) и Polyarthra major (<17% Nrot).
Между устьем рек Нытвы и Тулвы в средней части Воткинского водохранилища при численности коловраток (60–120 тыс. экз./м3) доминировали Polyarthra luminosa (до 18 тыс. экз./м3, в среднем 17% Nrot) и Synchaeta pectinata (до 36 тыс. экз./м3, 11% Nrot), вблизи устья р. Очер наряду с этими видами была сравнительно многочисленна Asplanchna henrietta (14 тыс. экз./м3, 11% Nrot). От разлива у пос. Елово до плотины Воткинской ГЭС количество коловраток достигало 15–60 тыс. экз./м3, преобладали Keratella cochlearis (<20 тыс. экз./м3, 18% Nrot) и K. quadrata (<13 тыс. экз./м3, 9% Nrot), а в приплотинном участке ~80% Nrot формировал Conochilus hippocrepis (13 тыс. экз./м3).
На нижнем участке Нижнекамского водохранилища численность коловраток была очень мала (<10 тыс. экз./м3), только Conochilus hippocrepis в устье р. Белой достигал 5 тыс. экз./м3. Таким же низким было количество коловраток в Камском и Волго-Камском плесах Куйбышевского водохранилища, лишь в устье р. Вятка оно возрастало >70 тыс. экз./м3 (рис. 1а). Здесь доминировали Brachionus angularis (31 тыс. экз./м3, 42% Nrot) и Conochiloides coenobasis (24 тыс. экз./м3, 33% Nrot). На остальной части р. Кама в пределах этого водохранилища наряду с указанными двумя видами небольшое количество (1‒1.5 тыс. экз./м3) образовывали Polyarthra luminosa, P. major, Brachionus calyciflorus и Asplanchna henrietta.
Рис. 1.
Распределение обилия основных групп зоопланктона (а) и его общей биомассы (б) по продольному профилю р. Камы от верховья Камского водохранилища у г. Усолье до слияния с р. Волгой в Куйбышевском водохранилище у с. Атабаево. 1 – Cladocera, 2 – Copepoda, 3 – Rotifera. По оси абсцисс станции: 1–8 в Камском, 9–15 в Воткинском, 16–21 в Нижнекамском и 22–27 в Куйбышевском водохранилищах.
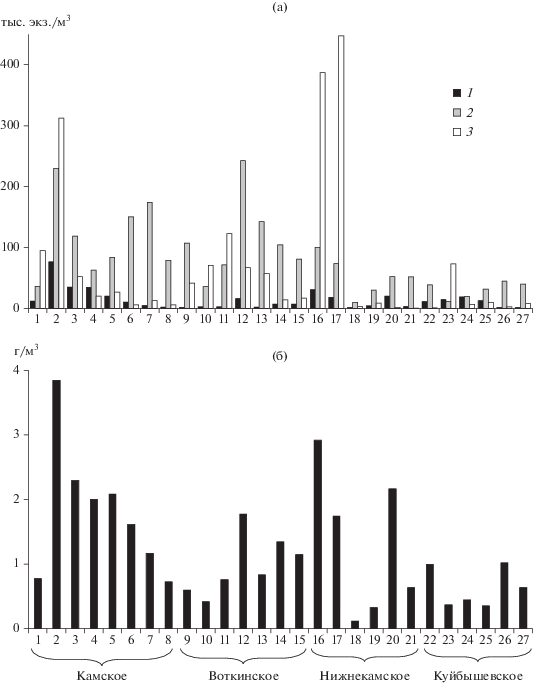
Численность и биомасса. Общая численность зоопланктона в камской части Куйбышевского водохранилища была в среднем в три раза ниже, а количество меропланктона (велигеры моллюска Dreissena) многократно выше, чем в трех других (табл. 3). Повсеместно преобладали коловратки (25‒68% общей численности) и циклопоидные копеподы (25‒61%). Численность сообщества, особенно коловраток и кладоцер, резко (в 2–10 раз) снижалась в средней части Нижне-Камского водохранилища и оставалась низкой до устья р. Камы (рис. 1а). Вклад меропланктона в суммарное количество животного планктона достигал 25% в Куйбышевском водохранилище, в остальных не превышал 6%.
Наибольшую биомассу зоопланктона регистрировали в Камском и Нижнекамском водохранилищах, наименьшую – в Куйбышевском (табл. 3). В Камском водохранилище она превышала 1 г/м3 почти по всему руслу р. Камы и достигала максимума (~4 г/м3) в устье р. Кондас (рис. 1б). В Воткинском водохранилище ее высокие значения (1.1‒1.8 г/м3) отмечены в устье р. Тулва и на участке от г. Воткинск до плотины ГЭС. В Нижнекамском водохранилище наблюдались очень большие вариации биомассы (до 30 раз) с максимумами (1.7‒2.9 г/м3) на верхнем участке от устья р. Сива до г. Сарапул и в устье р. Иж. В Куйбышевском водохранилище биомасса зоопланктона достигала 1 г/м3 только в верховье Камского плеса ниже г. Елабуга.
Основу биомассы повсеместно формировали кладоцеры (27‒63% общей биомассы) и циклопоидные копеподы (25‒49%Вsum), среди которых доминировали Mesocyclops leuckarti (22‒29%) и Daphnia galeata (15‒43%). В Куйбышевском водохранилище вместе с указанными выше видами значительную долю биомассы (32%) формировали Calanoida, преимущественно Heterocope caspia (24%). Вклад этого вселенца в биомассу зоопланктона был также высоким (20%) в Нижне-Камском водохранилище, в северных Воткинском и Камском – только 7–8%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Экспедиция Института биологии внутренних вод РАН летом 2016 г. оказалась первой за 40 лет, в которой единовременно в течение недели обследовали зоопланктон всех водохранилищ р. Камы. Как результат, выявлены новые местообитания многих, преимущественно южных, видов. Обзор расселения понто-каспийских солоновато-водных ракообразных в водохранилищах Волго-Камского каскада приведен в работах В. И. Лазаревой (Лазарева и др., 2018б; Lazareva, 2019). Здесь заметим только, что до 2016 г. в р. Кама выше плотины Нижнекамской ГЭС не находили вселенцев из Каспийского и Азовского морей (Истомина и др., 2016; Кортунова, Галанова, 1988; Куйбышевское…, 1983; Преснова, Хулапова, 2015; Селеткова, 2015; Тимохина, 2000; Popov, 2011). В 2016 г. установлено, что три (Heterocope caspia, Eurytemora caspica и Cercopagis pengoi) из пяти вселенцев этой группы продвинулись по реке на север до Камского водохранилища. Остальные два вида Cornigerius maeoticus и Calanipeda aquaedulcis к 2016 г. проникли вверх по р. Каме только до верховьев Камского плеса Куйбышевского водохранилища.
В 2015–2016 гг. Eurytemora gr. affinis, обитающая в водохранилищах рек Волги и Камы, определена как E. caspica (Лазарева и др., 2018а, 2018б; Lazareva, 2019), что подтверждено молекулярно-генетическими исследованиями (Сухих и др., 2020). E. caspica – новый вид, недавно описанный по материалам из дельты р. Волги и Северного Каспия (Sukhikh, Alekseev, 2013). Типичная Eurytemora affinis (Poppe, 1880) не обнаружена ни в одной пробе.
Среди южных видов, расширяющих ареал к северу, во второй половине 2000-х годов как обычные для рек юго-восточной части Республики Татарстан, в том числе притоков р. Камы указаны два вида коловраток рода Brachionus (B. diversicornis и B. budapestinensis) (Подшивалина, Яковлев, 2012). В той же работе отмечены находки Keratella tropica в р. Каме и ее левобережных притоках южнее г. Набережные Челны. Нами этот вид найден на том же участке реки (Волго-Камский и Камский плесы Куйбышевского водохранилища), тогда как Brachionus diversicornis и B. budapestinensis были обычны во всех водохранилищах р. Камы (табл. 2).
Появились сведения о находках без указания даты восточно-азиатской копеподы Thermocyclops taihokuensis (Harada, 1931) (syn. T. asiaticus) на нижнем участке Воткинского водохранилища и в устьевой области р. Иж в зоне подпора Нижнекамского водохранилища (Сидоровский и др., 2018). В 2016 г. в наших сборах из камских водохранилищ этот вид отсутствовал, но в 2017 г. он обнаружен в р. Волге ниже г. Волгограда (Лазарева и др., 2018б), а в 2018 г. найден в устьевой области р. Сура (Чебоксарское водохранилище) (Жихарев и др., 2019). Велика вероятность, что именно из притоков теплолюбивые виды проникают в водохранилища.
Как и ранее (Кортунова, 1983; Кортунова, Галанова, 1988; Поскрякова, 1977; Преснова, Хулапова, 2015; Селеткова, 2015), в водохранилищах р. Камы в 2016 г. основное количество рачкового планктона формировали обычные для таежной зоны циклопоидные копеподы Mesocylops leuckarti, Thermocyclops oithonoides и T. crassus, а также кладоцера Daphnia galeata, которую в ранних работах идентифицировали как D. longispina (O.F. Müller). В водохранилищах р. Волги, как результат потепления отмечено увеличение обилия циклопоидных копепод родов Mesocylops и Thermocyclops, особенно T. crassus (Лазарева и др., 2018а,б; Lazareva, Sokolova, 2015). Тоже зарегистрировано в водоемах Западной Европы (Adrian et al., 2006). Подобное, возможно, имеет место и в водохранилищах р. Камы, но выявить это нам не удалось, поскольку данные кратковременного обследования в августе 2016 г. трудно сравнивать с результатами более ранних работ, выполненных в другие сроки вегетационного периода. Однако выявлена тенденция к росту доли копепод в биомассе зоопланктона и снижению вклада кладоцер (табл. 4), что особенно заметно в Куйбышевском водохранилище, начиная с 2000-х гг. Это связано в основном с распространением и ростом численности крупной копеподы-вселенца Heterocope caspia.
Таблица 4.
Многолетние изменения структуры и обилия летнего (июль‒август) зоопланктона водохранилищ р. Камы
| Водохранилище | Nsum, тыс. экз./м3 | Вsum, г/м3 | Доля группы, % Вsum | ||
|---|---|---|---|---|---|
| I | II | III | |||
| Камское: | |||||
| 1970-e | 50–300 | 0.9–2.3 | 48 | 49 | 3 |
| 2000-е | 90–100 | 0.4–1.6 | 66 | 24 | 10 |
| 2016 г. | 208 | 1.8 | 55 | 32 | 13 |
| Воткинское: | |||||
| 1970-е | 40 | 1–1.8 | 90 | 8 | 2 |
| 1980-е | 400 | 1.5–4.4 | 47 | 33 | 20 |
| 2000-е | 115–225 | 0.6–2.1 | 80 | 20 | <1 |
| 2016 г. | 170 | 1.0 | 30 | 56 | 17 |
| Нижнекамское: | |||||
| 1970-е | 16 | 0.3 | 70 | 15 | 15 |
| 1980-е | 178–253 | 1.5–2.2 | 22 | 27 | 51 |
| 2006–2011 | 51–87 | 0.5–1.1 | 53 | 37 | 10 |
| 2016 г. | 207 | 1.3 | 63 | 32 | 5 |
| Куйбышевское: | |||||
| 1970-е | 60–96 | 0.4–0.9 | 50 | 20 | 30 |
| 1980-е | 50–260 | 0.9–2.5 | 70 | 25 | 5 |
| 1990-е | 36–160 | 0.7–2.1 | 50 | 30 | 20 |
| 2000-е | 2–75 | 0.02–0.5 | 14 | 77 | 9 |
| 2016 г. | 63 | 0.01–0.07 | 38 | 57 | 5 |
Примечаниe. I – Cladocera, II – Copepoda, III – Rotifera; Nsum – численность зоопланктона, Bsum – биомасса. Источники данных: 1970-е годы (Кортунова, 1983; Поскрякова, 1977), 1980-е годы – (Кортунова, Галанова, 1988; Куйбышевское…, 1983; Махотина, 1985; Тимохина, 2000), 1990-е годы – (Куйбышевское…, 2008), 2000-е годы – (Истомина и др., 2016; Кузнецова, 2015; Куйбышевское…, 2008; Преснова, Хулапова, 2015; Селеткова, 2015; Шакирова и др., 2013), 2016 г. – данные автора.
До середины 2000-х гг. в Камском водохранилище были многочисленны обычные для второй половины лета Bosmina coregoni (Поскрякова, 1977; Селеткова, 2015), а в Воткинском – B. longirostris и Eurytemra velox (Кортунова, Галанова, 1988; Преснова, Хулапова, 2015). В августе 2016 г. все три вида были малочисленны. Однако обнаружена сравнительно высокая численность вселенцев Heterocope caspia и Diaphanosoma orghidani. В Нижнекамском водохранилище в августе следующего 2017 г. как обычные виды ракообразных отмечены Mesocylops leuckarti, Daphnia galeata и Bosmina coregoni (Мельникова и др., 2019), которые были таковыми и в наших сборах.
В 2016 г. зарегистрировано 11 многочисленных видов коловраток, пик развития которых приходится на период май–сентябрь. Однако ранее только пять (Synchaeta pectinata, Polyarthra major, Keratella cochlearis, K. quadrata и Euchlanis dilatata) или <50% из них относили к массовым (Кортунова, 1983; Кортунова, Галанова, 1988), в том числе в работах по материалам недавних лет (2011–2015 гг.) (Кузнецова, 2015; Селеткова, 2015; Истомина и др., 2016). Отчасти это указывает на быструю смену короткоцикловых видов Rotifera в зоопланктоне водохранилищ. Такую смену подтверждает сравнительно высокая (30%) доля новых для р. Камы видов южного происхождения среди доминантов этой группы (Pompholyx sulcata, Conochiloides coenobasis и Asplanchna henrietta). Но важным следует признать и тот факт, что в рыбохозяйственных работах мелких коловраток (Polyarthra, Conochilus, Synchaeta) с малым вкладом в биомассу сообщества часто определяют только до рода.
В 1970-х гг. состав зоопланктона камского участка Куйбышевского водохранилища почти не отличался от такового в его Волжском плесе (Куйбышевское…, 1983). Сейчас в Камском и, особенно, Волго-Камском плесах он далек от наблюдаемого в Волжском и близок к составу сообщества южной части водоема (Лазарева и др., 2018а). Причиной этого стало широкое распространение и высокая численность вселенцев из Каспия, большинство которых еще не проникли в Волжский плес (Лазарева и др., 2018а, 2018б; Lazareva, 2019).
Обилие зоопланктона всех камских водохранилищ характеризуется большими колебаниями год от года (Алексевнина, Преснова, 2017; Истомина и др., 2016; Кортунова, 1983; Кортунова, Галанова, 1988; Куйбышевское…, 2008; Махотина, 1985; Селеткова, 2015). В 2016 г. биомасса сообщества большинства из них была близка к отмеченной в 2000-х гг., а численность приближалась к максимальной для этого периода (табл. 4). В Воткинском и Камском водохранилищах наиболее высокую биомассу регистрировали в 1970–1980-е гг., в камских плесах Куйбышевского – до середины 1990-х. В 1980–1990-х гг. пик биомассы отмечен также в Рыбинском водохранилище (Верхняя Волга) (Lazareva, Sokolova, 2015). Наши данные (табл. 4) по количеству зоопланктона в Нижнекамском водохранилище близки к отмеченным в первые годы существования водоема (Махотина, 1985), тогда как структура сообщества сходна с зарегистрированной во второй половине 2000-х гг. (Шакирова и др., 2013). Существенно ниже обилие сообщества (в среднем 32 тыс. экз./м3 и 0.16 г/м3) наблюдалось в августе 2017 г. (Мельникова и др., 2019), что лишний раз подтверждает его большие колебания год от года.
Выводы. В 2016 г. в пелагиали камских водохранилищ обнаружено 108 видов зоопланктона – от 61 до 92 в каждом из четырех водоемов, преобладали коловратки (50% списка). Выявлено 14 новых для р. Камы видов-вселенцев, представленных тремя группами: южными пресноводными формами (8 видов), расширяющими ареал на север в связи с потеплением климата; понто-каспийскими солоновато-водными ракообразными (5 видов), проникшим в р. Каму по р. Волге, и вселенцами с других континентов (1 вид). Наибольшую численность зоопланктона каждого водохранилища формирует небольшой набор видов: 3–6 – ракообразных и 2–4 – коловраток. Группировки доминантов наиболее разнообразны вблизи устьевых областей крупных притоков р. Камы и в верхних участках всех четырех водохранилищ. Четыре южных вида (Diaphanosoma orghidani, Pompholyx sulcata, Conochiloides coenobasis и Asplanchna henrietta), впервые обнаруженные в р. Каме в 2016 г., а также один вселенец из Каспия (Heterocope caspia) локально формируют высокую численность в зоопланктоне р. Камы, в том числе в северных Камском и Воткинском водохранилищах. Биомасса зоопланктона в августе максимальна (>1 г/м3) в Камском и Нижнекамском водохранилищах, минимальна (0.5 г/м3) – в Куйбышевском. В 2016 г. биомасса зоопланктона Камского, Воткинского и камской части Куйбышевского водохранилищ была близка к таковой в 2000-х гг., а численность сходна с наибольшей для этого периода. В Нижнекамском водохранилище биомасса сообщества была высокой и сходной с отмеченной в 1980-х гг.
Список литературы
Алексевнина М.С., Преснова Е.В. 2017. Структура планкто- и бентоценозов центрального района Воткинского водохранилища и ее изменения в многолетнем аспекте // Современные проблемы водохранилищ и их водосборов: Тр. VI Междунар. науч.-практ. конф. Т. 3. Пермь: Пермский гос. нац. исслед. ун-т. С. 4.
Беляева П.Г., Минеева Н.М., Сигарева Л.Е. и др. 2018. Содержание растительных пигментов в воде и донных отложениях водохранилищ р. Камы // Тр. Ин-та биологии внутр. вод РАН. Вып. 81(84). С. 97.
Боруцкий Е.С., Степанова Л.А., Кос М.С. 1991. Определитель Calanoida пресных вод СССР. Ленинград: Наука.
Волга и ее жизнь. 1978. Ленинград: Наука.
Дзюбан Н.А. 1960. О районировании Куйбышевского водохранилища // Бюл. Ин-та биологии водохранилищ. № 8–9. С. 53.
Жихарев В.С., Гаврилко Д.Е., Шурганова Г.В. 2019. Находка тропического вида Thermocyclops taihokuensis Harada, 1931 (Copepoda: Cyclopoida) в европейской части России // Поволж. экол. журн. № 2. С. 264. https://doi.org/10.35885/1684-7318-2019-2-264-270
Истомина А.М., Беляева П.Г., Истомин С.Г. и др. 2016. Современное состояние планктона бентоса и ихтиофауны Воткинского водохранилища // Современное состояние биоресурсов внутренних водоемов и пути их рационального использования: Матер. докл. Всерос. конф. с междунар. участием, посвященной 85-летию Татарского отделения Гос. науч.-исслед. ин-та озер. и реч. рыб. хоз-ва (Казань, 24–29 октября 2016 г.). Казань: Гос. науч.-исслед. ин-т озерн. и речн. рыб. хоз-ва. С. 430.
Кортунова Т.А. 1983. Зоопланктон Камского водохранилища и его продукция // Комплексные исследования рек и водохранилищ Урала. Пермь: Пермск. гос. ун-т. С. 68.
Кортунова Т.А., Галанова А.А. 1988. Зоопланктон // Биология Воткинского водохранилища. Иркутск: Иркутск. гос. ун-т. С. 50.
Кузнецова Е.М. 2015. Зоопланктон Камского водохранилища в летний период 2013 г. // Фундаментальные и прикладные исследования в биологии и экологии: Матер. рег. студенческой науч. конф. 14–19 апр. 2014 г. Пермь: Пермский гос. нац. исслед. ун-т. С. 57.
Куйбышевское водохранилище. 1983. Ленинград: Наука.
Куйбышевское водохранилище (научно-информационный справочник). 2008. Тольятти: Ин-т экологии волжского бассейна РАН.
Лазарева В.И. 2007. Состав ракообразных и коловраток Рыбинского водохранилища // Экология водных беспозвоночных. Нижний Новгород: Вектор ТиС. С. 127.
Лазарева В.И., Сабитова Р.З., Соколова Е.А. 2018а. Особенности структуры и распределения позднелетнего (август) зоопланктона в водохранилищах Волги // Труды Ин-та биологии внутр. вод РАН. Вып. 82(85). С. 28.
Лазарева В.И., Сабитова Р.З., Быкова С.В. и др. 2018б. Распределение летнего зоопланктона в каскаде водохранилищ Волги и Камы // Тр. Ин-та биологии внутренних вод РАН. Вып. 83(86). С. 62.
Махотина М.К. 1985. Характеристика зоопланктона Нижнекамского водохранилища на первом этапе его формирования. Санкт-Петербург: Гос. науч.-исслед. ин-т озер. и реч. рыб. хоз-ва. Вып. 240. С. 112.
Мельникова А.В., Любина О.С., Гвоздарева М.А. и др. 2019. Оценка качества воды Нижнекамского водохранилища по гидробиологическим показателям // Вода: химия и экология. № 3‒6. С. 67.
Многолетние данные о режиме и ресурсах поверхностных вод суши. Бассейн реки Камы. 1988. Ленинград: Гидрометеоиздат. Т. 1. Вып. 25.
Печеркин И.А., Двинских С.А., Тихонов В.П., Китаев А.Б. 1980. Факторы загрязнения водных масс Камского водохранилища и пути его предотвращения // Биологические ресурсы водоемов Западного Урала. Пермь: Пермск. ун-т. С. 9.
Пидгайко М.Л. 1984. Зоопланктон водоемов Европейской части СССР. Москва: Наука.
Подшивалина В.Н., Яковлев В.А. 2012. Мониторинг состояния малых и средних рек лесостепного Заволжья по зоопланктону // Вода: химия и экология. № 1. С. 56.
Поскрякова Н.П. 1977. Зоопланктон Камы в августе 1975 г. // Биология внутренних вод: Информ. бюл. Ленинград: Наука. № 36. С. 57.
Преснова Е.В., Хулапова А.В. 2015. Структура и распределение зоопланктона в центральном районе Воткинского водохранилища // Вестник Пермского ун-та. Биология. Вып. 4. С. 366.
Селеткова Е.Б. 2015. Зоопланктон Камского водохранилища // Биоценозы рек и водохранилищ Западного Урала. Санкт-Петербург: Гос. науч.-исслед. ин-т озер. и реч. рыб. хоз-ва. С. 136.
Сидоровский С.А., Каргапольцева И.А., Холмогорова Н.В. 2018. Каталог ракообразных (Arthropoda, Crustacea) республики Удмуртия // Амурский зоологический журнал. Т. 10. № 2. С. 101.
Сухих Н.М., Лазарева В.И., Алексеев В.Р. 2020. Копепода Eurytemora caspica Sukhikh et Alekseev, 2013 (Crustacea, Calanoida) в водохранилищах Волги и Камы // Биология внутр. вод. № 2. С. 129.
Тимохина А.Ф. 2000. Зоопланктон как компонент экосистемы Куйбышевского водохранилища. Тольятти: Ин-т экологии волж. бассейна РАН.
Фефилова Е.Б., Батурина М.А., Кононова О.Н. и др. 2014. Многолетние изменения в сообществах гидробионтов в Харбейских озерах // Журн. Сибирского фед. ун-та. Биология. № 7. С. 240.
Шакирова Ф.М., Говоркова Л.К., Анохина О.К. 2013. Современное состояние Нижнекамского водохранилища и возможности рационального освоения его рыбных ресурсов // Известия Самарского научного центра РАН. Т. 15. № 3(1). С. 518.
Эдельштейн К.К. 1998. Водохранилища России: экологические проблемы и пути их решения. Москва: ГЕОС.
Экологические проблемы Верхней Волги. 2001. Ярославль: Ярослав. гос.-техн. ун-т.
Adrian R., Wilhelm S., Gerten D. 2006. Life-history traits of lake plankton species may govern their phenological response to climate warming // Global Change Biology. V. 12. P. 1652. https://doi.org/10.1111/j.1365-2486.2006.01125.x
Korovchinsky N.M. 1987. A study of Diaphanosoma species (Crustacea: Cladocera) of the “mongolianum” group // Int. Rev. gesamt. Hydrobiol., Hydrogr. V. 72. № 6. P. 727.
Korovchinsky N.M. 2018. Further revision of the genus Bythotrephes Leydig (Crustacea: Cladocera: Onychopoda): redescription of B. brevimanus Lilljeborg, reevaluation of B. cederströmii Schödler, and description of a new species of the genus // Zootaxa. V. 4379. № 3. P. 347. https://doi.org/10.11646/zootaxa.4379.3.2
Korovchinsky N.M. 2019. Morphological assessment of the North Eurasian interspecific hybrid forms of the genus Bythotrephes Leydig, 1860 (Crustacea: Cladocera: Cercopagididae) // Zootaxa. V. 4550. № 3. P. 340. https://doi.org/10.11646/zootaxa.4550.3.3
Krainev E.Yu., Tselishcheva E.M., Lazareva V.I. 2018. American rotifer Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in the Kama Reservoir (Kama River, Russia) // Inland Water Biology. V. 11. № 1. P. 42. https://doi.org/10.1134/S199508291801008X
Lazareva V.I. 2019. Spreading of Alien Zooplankton Species of Ponto-Caspian Origin in the Reservoirs of the Volga and Kama Rivers // Russ. J. Biol. Invasions. № 4. P. 328. https://doi.org/10.1134/S2075111719040040
Lazareva V.I., Sokolova E.A. 2015. Metazooplankton of the Plain Reservoir during Climate Warming: Biomass and Production // Inland Water Biology. V. 8. № 3. P. 250. https://doi.org/10.1134/S1995082915030098
Popov A.I. 2011. Alien species of zooplankton in Saratov Reservoir (Russia, Volga River) // Rus. J. Biol. Invasions. V. 2. Issue 2–3. P. 126.
Sukhikh N.M., Alekseev V.R. 2013. Eurytemora caspica sp. nov. from the Caspian Sea – one more new species within the E. affinis complex (Copepoda: Calanoida, Temoridae) // Proceedings of the Zoological Institute RAS. V. 317. № 1. P. 85.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


