Биология внутренних вод, 2020, № 5, стр. 439-449
Сравнительный анализ содержания хлорофилла а в пресноводном и морском водоемах
Л. Е. Сигарева a, *, Т. Г. Коренева b, Н. М. Минеева a, Н. А. Тимофеева a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
b Сахалинский филиал ФГБНУ “Всероссийский научно-исследовательский институт рыбного хозяйства
и океанографии”
Южно-Сахалинск, Россия
* E-mail: sigareva@ibiw.ru
Поступила в редакцию 07.10.2019
После доработки 17.12.2019
Принята к публикации 28.01.2020
Аннотация
Обобщены данные по содержанию хлорофилла в воде и донных отложениях пресноводного Рыбинского водохранилища (Верхняя Волга) и морского залива Анива (Охотское море). Средняя концентрация хлорофилла а в планктоне водохранилища 23.0 ± 1.9 мкг/л, залива – 0.77 ± 0.06 мкг/л, в донных отложениях – 144.2 ± 14.9 и 8.2 ± 0.7 мкг/г сухого осадка соответственно. Выявлены корреляционные связи между концентрациями пигментов в эвфотической зоне, афотическом придонном слое, целом столбе воды и верхнем слое донных отложений, а также связи пигментов с глубиной (в пределах 6–100 м) и прозрачностью (от 1 до 18 м). Показано, что общие связи для двух водоемов аппроксимируются нелинейными уравнениями с коэффициентами детерминации (R2) от 0.37 до 0.93. Характер связей между пигментными показателями сходен для обоих водных объектов.
ВВЕДЕНИЕ
Энергетическая основа существования экосистем – продукция растительных сообществ, в изучении которых широко применяются сведения об универсальном пигменте фотосинтетического аппарата Хл и его производных (Swain, 1985; Adams, Prentki, 1986; Leavitt, 1993; Szymczak-Żyła, Kowalewska, 2009; Сигарева, 2012; Krajewska et al., 2017).
Информация о растительных пигментах может использоваться для оценки состава фитопланктона, первичной продукции, условий окружающей среды, изменений климата, трофии водоема, эвтрофирования и др. (Freiberg et al., 2011; Jimenez et al., 2015; Schuller et al., 2015; Tse et al., 2015; Naeher et al., 2016; Reavie et al., 2017; Cotoviez et al., 2018; Koomklang et al., 2018; Timofeeva et al., 2018b). Рассматривается связь растительных пигментов с другими звеньями трофической цепи, например, с мейофауной, макрозообентосом (Liu et al., 2005; Rasiq et al., 2016; Lampadariou, Eleftheriou, 2018; Timofeeva et al., 2018). Растительные пигменты всесторонне используются в мониторинге состояния водоемов Волжского бассейна (Минеева, 2004; Сигарева, 2012; Сигарева и др., 2016; Структура…, 2018). Интерес к пигментам в морских водах обусловлен необходимостью оценки первичной продукции ОВ в Мировом океане, а также изучения эволюции жизни на Земле (Виноградов, 2004).
В этом плане особый интерес представит анализ распределения пигментов в компонентах морских и пресноводных экосистем, существенно различающихся по абиотическим условиям и видовому составу организмов.
Цель работы – сравнить содержание и характер связей Хл в воде и донных отложениях пресноводного и морского водоемов на примере Рыбинского водохранилища на р. Волге и залива Анива в Охотском море.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
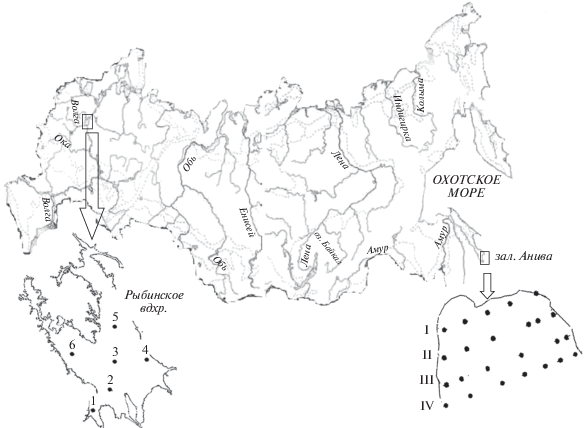
Материалы по Рыбинскому водохранилищу получены в стандартных экспедициях на научно-исследовательском судне “Академик Топчиев”, по заливу Анива – на судне “Дмитрий Песков”. В Рыбинском водохранилище пробы собирали в безледные периоды 2008–2017 гг., в заливе Анива – 2009 и 2013 г. Пробы воды в водохранилище отбирали на шести постоянных станциях (рис. 1) однометровым батометром по всей глубине в основной части фотосинтезирующей зоны (0–2 м), в среднем перемешиваемом (2–6 м) и нижнем (от 6 м до дна) слоях, а также в придонном однометровом слое. Пробы воды в заливе отбирали на 24 станциях четырех разрезов (рис. 1). Использовали батометрическую секцию Rossette, снабженную кассетой из 12 пластиковых батометров Нискина объемом 1.7 л с дистанционным закрытием на заданной глубине (поверхность, 10, 20, 30… м). Пробы донных отложений отбирали из верхнего 2.5-сантиметрового слоя отложений в Рыбинском водохранилище стратометром или коробчатым дночерпателем, в заливе Анива – дночерпателем Ван-Вина.
Рис. 1.
Схема расположения станций в Рыбинском вдхр. и заливе Анива (Охотское море). I, II, III, IV – разрезы в заливе, 1–6 – станции.
Содержание Хл и его производных определяли спектрофотометрическим или флуоресцентным методами (Гольд и др., 1986; Jeffrey, Humphrey, 1975; Lorenzen, 1967). Воздушно-сухую объемную массу донных отложений рассчитывали по влажности грунта (Сигарева, 2012). Тип донных отложений оценивали по гранулометрическому составу и водно-физическим свойствам грунта.
Краткая характеристика исследуемых водных объектов. Рыбинское водохранилище (58°22.378′ с.ш., 38°23.217′ в.д.) – одно из крупнейших в волжском каскаде, служит резервуаром пресной воды для центральных регионов РФ. Площадь 4550 км2, объем 25.4 км3, средняя глубина 5.6 м (Структура…, 2018). Прозрачность воды в водохранилище (средняя за сезон) варьирует в пределах 1–1.7 м. Климат в регионе умеренно-континентальный. Трофический статус водохранилища по показателям развития фитопланктона и концентрации Хл оценивался чаще всего как мезотрофный с признаками эвтрофии. В последнее время для водохранилища характерно эвтрофное состояние (Структура…, 2018).
Первичная продукция фитопланктона водохранилища составила 187–414 г О2/(м2 год). (Пырина и др., 2006). Содержание общего азота в воде ‒ 0.46–1.07 мг/л, общего фосфора ‒ 40–68 мкг/л (Структура…, 2018). Площадь грунтов разного типа была рассчитана по данным 2010 г. и составила: 14% почв; 55% песчаных наносов; 28% илистых отложений торфа и 3% отложений из макрофитов (Структура…, 2018). Содержание ОВ в песчаных отложениях было 0.2–4.6%, в глинистых илах – 7.7%, в торфянистых – 10.3–22.4%, торфе – 40.1%. Скорость осадконакопления – 2.2 мм/год, скорость илонакопления ‒ 5.9 мм/год (Структура…, 2018).
Залив Анива – юго-западная часть Охотского моря, омывает побережье о. Сахалин, находится между мысами Крильон (45°54′ с.ш., 142°05ʹ в.д.) и Анива (46°01ʹ с.ш., 142°25ʹ в.д.). Площадь акватории залива 5809 км2. Наименьшие глубины характерны для северной части залива (10–40 м), наибольшие – для южной центральной (80–110 м). Средняя глубина залива 63 м (Лоция…, 2003). Климат умеренно-муссонный. Среднемноголетние значения температуры воды в заливе колеблются от –1.5°С в марте до 13.0°С в августе. Соленость глубоководной части залива – 30.3–33.0, прибрежной – 22.8–31.9‰. Прозрачность воды изменяется от 2 до 18 м (Leonov, Pishchal’nik, 2005). Алеврито-пелитовые отложения с размерами частиц <0.1 мм занимают 39% площади дна, пески (≤1 мм) – 35%, грубообломочные грунты (<1 мм) – 26%. Доля алеврито-глинистых илов достигает 54% в районе дампинга грунта, в местах с галькой и гравием снижается до 5% (Шевченко и др., 2016).
В заливе Анива первичная продукция фитопланктона в среднем 0.29 ± 0.04 г С/(м2 сут) при диапазоне 0.01–1.53 г С/(м2 сут), в период массового развития диатомовых водорослей в акватории Охотского моря может достигать 3–6 г С /(м2 сут) (Агатова и др., 2016). Нитратный азот – основной лимитирующий фактор развития фитопланктона в заливе (Коренева и др., 2014). Весенний максимум нитратного азота 86.1 мкг/л, минерального фосфора – 33.6 мкг/л, летом эти показатели уменьшаются до 63.8 и 18.9 мкг/л соответственно (Пропп, Гаврина, 2005). Влажность грунтов 7–51%, концентрация ОВ 0.2–2.7% (Koreneva, Sigareva, 2019). Воздушно-сухая объемная масса донных отложений залива характеризуется величинами (0.7–2.3 г/см3), сходными с отмечаемыми в других районах Охотского моря (Здобин, 2014). Средняя скорость осадконакопления в море 0.295 мм/год, на отдельных участках от 0.024 до 0.425 мм/год (Астахов и др., 1988), у берегов Сахалина – 0.08 мм/год (Семаков, 1976).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В Рыбинском водохранилище на постоянных станциях среднегодовая концентрация Хл в эвфотической зоне (0–2 м) изменялась от 5.2 ± 1.7 до 50.5 ± 7.9 мкг/л, в придонном однометровом слое от 2.3 ± 0.8 до 37.8 ± 16.2 мкг/л. Средние концентрации Хл на станциях в 2009–2014 гг. приведены в табл. 1. В заливе Анива (табл. 1) концентрация Хл в фотосинтезирующей области (до глубины трехкратной прозрачности) была 0.36–1.46 мкг/л, в придонной афотической (глубины более трехкратной прозрачности до 100 м) – 0.09–0.96 мкг/л. Средняя концентрация Хл в эвфотической зоне водохранилища достигала 23.0 ± 1.9, залива – 0.77 ± 0.06 мкг/л.
Таблица 1.
Концентрация Хл (мкг/л) в эвфотическом и придонном слоях Рыбинского водохранилища (среднее за 2009–2014 гг.) и залива Анива (2013 г.)
| Номер станции, разрез | Эвфотическая зона | Придонный слой |
|---|---|---|
| Рыбинское водохранилище | ||
| 1 | 24.4 ± 5.5 | 13.1 ± 3.4 |
| 2 | 32.4 ± 6.2 | 21.0 ± 4.4 |
| 3 | 19.8 ± 4.1 | 13.3 ± 2.8 |
| 4 | 18.0 ± 2.1 | 11.6 ± 1.5 |
| 5 | 17.6 ± 2.5 | 10.5 ± 2.0 |
| 6 | 25.8 ± 5.4 | 11.7 ± 1.8 |
| Залив Анива | ||
| I | 0.53 ± 0.12 | 0.36 ± 0.05 |
| II | 0.59 ± 0.06 | 0.21 ± 0.1 |
| III | 1.01 ± 0.14 | 0.49 ± 0.11 |
| IV | 0.91 ± 0.08 | 0.36 ± 0.12 |
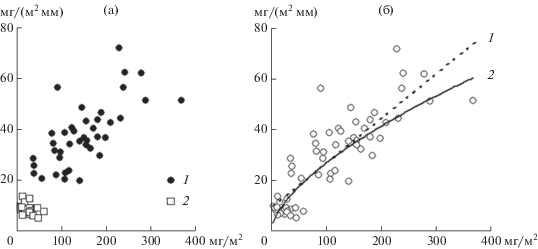
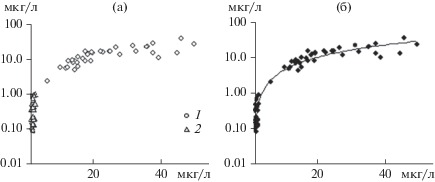
Между концентрациями Хл в слоях водной толщи Рыбинского водохранилища (0–2, 2–6 и 6 м – дно, 0 м – дно) зарегистрированы достаточно тесные корреляционные связи (в 2009–2014 гг. r = 0.5–0.9) (Минеева, 2016). Аналогичные результаты получены при анализе связи концентраций пигмента в эвфотическом и придонном однометровом слоях (Sigareva et al., 2019). Концентрация Хл в придонной воде была меньше, чем в эвфотической зоне – в 1.8 раза в Рыбинском водохранилище и в 2.1 раза в заливе Анива. Зависимость между концентрациями Хл в эвфотической зоне и придонной воде обоих водных объектов представлена универсальной связью при высоком коэффициенте детерминации (рис. 2). Доля Хл придонного полуметрового слоя в водном столбе в Рыбинском водохранилище достигала 3–8% концентрации в целом столбе воды, в заливе Анива – 0.14–4.1%.
Рис. 2.
Зависимость концентрации Хл в придонной воде (ось ординат) от концентрации пигмента в эвфотической зоне (ось абсцисс): а – Рыбинское вдхр. (1) и залив Анива (2); б – оба водоема, R2 = 0.93.
Связь между Хл в водном столбе и его глубиной в исследованных водоемах представлена прямой зависимостью (рис. 3а). Объединение данных в один ряд приводит к изменению связи (между общим содержанием Хл и глубиной в пределах 6–100 м) с прямой положительной на нелинейную отрицательную (рис. 3в).
Рис. 3.
Связь содержания Хл в столбе воды с глубиной (а, в) и в эвфотичесокй зоне с прозрачностью воды (б, г). а – Рыбинское вдхр. (1, R2 = 0.18) и залив Анива (2, R2 = 0.56); б – Рыбинское вдхр. (1, R2 = 0.46) и залив. Анива (2, R2 = = 0.26); в – Рыбинское вдхр. + залив Анива (R2 = 0.37); г – Рыбинское вдхр. + залив Анива (R2 = 0.67).
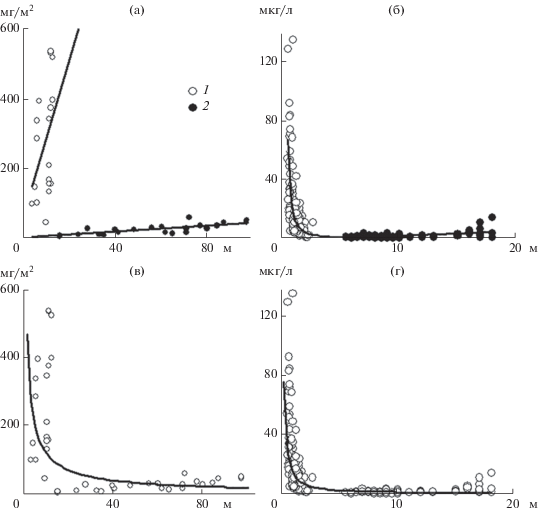
Связь Хл с прозрачностью (показателем световых условий, толщины фотосинтезирующей зоны и количества взвеси), выявленная в Рыбинском водохранилище, обратная и достаточно тесная, в заливе – менее выражена (рис. 3б). Для объединенных данных (рис. 3г) установлена сильная обратная связь Хл с прозрачностью (диапазон 1–18 м) в виде степенного уравнения (R2 = 0.67).
Концентрация Хл с его производными в донных отложениях составила в Рыбинском водохранилище 144.2 ± 14.9 мкг/г сухого грунта, в заливе – 8.2 ± ± 0.7 мкг/г сухого грунта. Связи концентрации осадочных пигментов с влажностью грунтов в Рыбинском водохранилище и заливе Анива аппроксимируются положительными нелинейными зависимостями (рис. 4а), с объемной массой – отрицательными нелинейными (рис. 4в). Для объединенных данных по обоим водоемам характер связей представлен нелинейными зависимостями в пределах всего диапазона рассматриваемых величин: положительной связью пигментов с влажностью (рис. 4б) и отрицательной – с воздушно-сухой объемной массой грунта (рис. 4г).
Рис. 4.
Связи концентрации Хл + феопигменты в донных отложениях с влажностью (а, б), воздушно-сухой объемной массой грунта (в, г) и глубиной водного столба (д, е). Линии регрессии для Рыбинского вдхр. – 1, 4, 7, 9 (R2 соответственно 0.72, 0.75, 0.64, 0.65); для залива Анива – 2, 5, 8, 10 (R2 соответственно 0.52, 0.47, 0.002, 0.15); для обоих водоемов – 3 (R2 = 0.72) и 6 (R2 = 0.68).
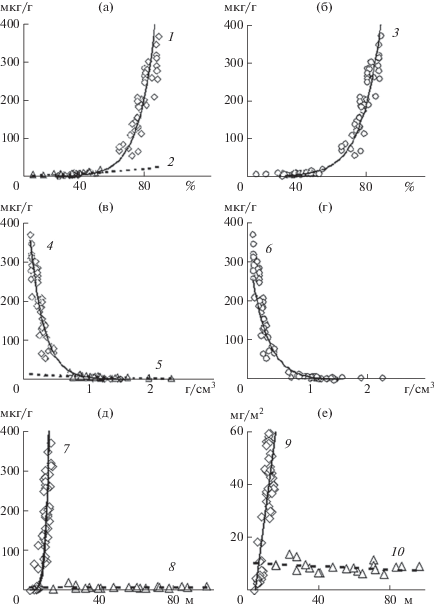
Связь осадочных пигментов с глубиной водной толщи в Рыбинском водохранилище – тесная положительная степенная, в заливе Анива такая связь отсутствует (рис. 4д, 4е). При этом общая для двух объектов зависимость от глубины не прослеживается ни для концентраций пигментов в сухом грунте, ни для их содержания в целом столбе воды.
Содержание феопигментов (производных Хл) меняется в толще воды и донных осадках двух водных объектов сходным образом. При благоприятных условиях для фотосинтеза растительных организмов в водной толще относительное содержание продуктов разрушения Хл значительно ниже, чем в донных отложениях (табл. 2).
Таблица 2.
Содержание феопигментов (% суммы с Хл) в Рыбинском водохранилище и заливе Анива
| Номер станции, разрез | Слои водной толщи* | Донные отложения (0–2.5 см) |
||
|---|---|---|---|---|
| верхний | средний | нижний | ||
| Рыбинское водохранилище | ||||
| 1 | 37.2 ± 3.4 | 37.9 ± 4.4 | 46.2 ± 3.8 | 77.5 ± 3.0 |
| 2 | 28.5 ± 3.2 | 30.7 ± 3.6 | 43.1 ± 4.8 | 68.5 ± 1.8 |
| 3 | 28.8 ± 5.7 | 43.8 ± 6.8 | 46.9 ± 9.5 | 88.2 ± 2.3 |
| 4 | 37.0 ± 4.2 | 47.3 ± 7.6 | – | 91.2 ± 2.9 |
| 5 | 36.2 ± 5.4 | 48.2 ± 7.1 | 58.5 ± 8.2 | 82.8 ± 2.7 |
| 6 | 29.3 ± 4.6 | 39.6 ± 6.6 | 53.2 ± 6.7 | 71.2 ± 1.2 |
| Залив Анива | ||||
| I | 45.9 ± 7.6 | 55.1 ± 16.3 | 61.5 ± 2.8 | 80.8 ± 7.2 |
| II | 58.2 ± 6.5 | 55.3 ± 5.3 | 35.9 ± 10.9 | 88.6 ± 3.1 |
| III | 50.5 ± 5.7 | 59.7 ± 4.2 | 67.5 ± 10.5 | 88.5 ± 2.3 |
| IV | 57.3 ± 2.4 | 69.1 ± 4.3 | 77.3 ± 5.1 | 89.0 ± 3.4 |
Соотношение между концентрациями Хл в воде и донных отложениях в заливе Анива и Рыбинском водохранилище можно представить как линейной, так и степенной зависимостями (рис. 5) с высокими коэффициентами детерминации (0.72 и 0.71 соответственно). Линии, отражающие зависимость бентосного Хл от планктонного, пересекают ось ординат не в нулевой точке, т.е. даже при отсутствии пигмента в водной толще (например, за счет сезонной динамики) в отложениях водоема сохраняется некоторое количество Хл. Среднее соотношение между содержанием Хл в водном столбе (мг/м2) и верхнем слое донных отложений (мг/(м2 мм)) составляет 3.91 ± 0.22 в Рыбинском водохранилище и 3.33 ± 0.47 в заливе Анива. Согласно критерию Стьюдента, различия между этими величинами недостоверны. Если учесть скорости осадконакопления, то исследуемое соотношение будет в Рыбинском водохранилище 0.66, заливе Анива 11.3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты изучения растительных пигментов позволили выявить универсальные закономерности в распределении Хл в морском и пресноводном водоемах, обусловленные сходством процессов формирования первичной продукции ОВ фитопланктона. В Рыбинском водохранилище содержание Хл соответствует величинам мезотрофной и эвтрофной категорий вод (Винберг, 1960). В морском заливе Анива концентрация Хл существенно ниже, чем в Рыбинском водохранилище, но по градации для морских вод (Ведерников, 1975; Antoine et al., 1996; Мордасова, 2014) тоже соответствует мезотрофным и эвтрофным величинам. Широкий диапазон концентраций Хл в исследуемых водоемах обусловлен динамикой фитопланктона и абиотических факторов продуктивности (Пырина и др., 2006; Коренева, Латковская, 2013; Коренева и др., 2014; Структура…, 2018). В многолетнем аспекте содержание Хл в водохранилище варьирует согласно цикличности солнечной активности без определенных трендов и остается типичным для водоема (Пырина и др., 2006).
Суммарное содержание Хл в столбе воды зависит от количества водорослей и увеличивается с глубиной водной толщи. Связь между Хл и глубиной в конкретных водоемах представлена прямой зависимостью (рис. 3а). Наиболее тесная связь (R2 = 0.56 в морском заливе) выявлена для широкого диапазона глубин, различающихся в 10 раз, менее тесная (R2 = 0.18 в водохранилище) – для сравнительно небольших глубин при двукратных различиях.
Характер установленной нами универсальной для водохранилища и морского залива связи между Хл и прозрачностью согласуется с результатами, приведенными в работе (Carlson, 1977) для пределов концентраций Хл 0.04–1183 мкг/л и прозрачности 0.06–64 м в природных водоемах. Обратная связь концентрации Хл с прозрачностью обусловлена уменьшением последней при увеличении плотности клеток фитопланктона и, как следствие, увеличении концентрации Хл. Наиболее резкие изменения отмечены в Рыбинском водохранилище при небольшом диапазоне прозрачности, ограничивающей толщину эвфотической зоны (рис. 3б).
Содержание Хл в донных отложениях водохранилища, как и в водной толще, характеризовалось более высокими величинами, чем в морском заливе. Средняя концентрация осадочного Хл в Рыбинском водохранилище относится к эвтрофной категории, в заливе Анива – олиготрофной (Möller, Scharf, 1986). Выявленные зависимости осадочных пигментов от свойств грунтов обусловлены варьированием значений водно-физических показателей донных отложений, связанных с ОВ растительного происхождения. В целом, характер связей сходен с таковым для других исследованных ранее водоемов – разнотипных озер и водохранилищ Волжского бассейна (Номоконова, 2009, 2011; Сигарева, 2012).
Среди закономерностей пространственного распределения пигментов между компонентами экосистем можно отметить сходство соотношения между потенциально активной и деградированной формами Хл в Охотском море и Рыбинском водохранилище. В других водоемах соотношение Хл и его производных тоже возрастает с глубиной в водном столбе и донных отложениях (Минеева, 2004; Сигарева, 2012; Смольская и др., 2018; Структура…, 2018). Относительное содержание феопигментов зависит не только от благоприятных для фотосинтеза условий, но и от стабилизирующих пигментный фонд факторов, к которым относят аноксию, наличие сероводорода и метана, как, например, во впадине Каспийского моря (Kravchishina et al., 2016) или некоторых пресноводных озерах (Leavitt, 1993).
Содержание растительных пигментов в афотических зонах (и донных отложениях) тесно коррелирует с содержанием пигментов в зоне фотосинтеза. Этот факт согласуется с особенностями распределения и динамики пигмента (водорослей) в воде и донных отложениях водоемов (Состояние…, 2008; Номоконова, 2011; Минеева, 2016; Сигарева и др., 2016; Структура…, 2018)). Расчеты показывают, что общее содержание Хл в водном столбе соответствует их содержанию в слое поверхностных отложений толщиной ~3–4 мм. Такие величины сопоставимы с полученными ранее для ряда озер и водохранилищ волжского каскада другим способом, учитывающим объем всей водной массы и общую площадь водоема (Сигарева, 2012). Соотношение между содержанием Хл (пересчитанного на ОВ) в среднегодовом слое осадконакопления и первичной продукцией невелико (Сигарева, 2012), как и отношение содержания ОВ в донных отложениях к первичной продукции, которое в Охотском море уменьшается с глубиной. В центральном наиболее глубоком районе моря в отложениях содержится 0.15–0.7% ОВ, в менее глубоком районе континентальных склонов – 0.7–1.0%, в отдельных местах – 1–3% (Bosin et al., 2010). Такие данные близки к средней величине для биосферы, составляющей 0.8% ОВ от первичной продукции (Romankevich et al., 2009). Незначительная доля первичной продукции фитопланктона, поступающей на дно, свидетельствует о сбалансированности продукционно-деструкционных процессов в водных экосистемах и, следовательно, об устойчивости биогеохимических круговоротов (Горшков, 1985; Виноградов, 2004; Максимова, 2004).
Различия свойств фонда растительных пигментов в морском и пресноводном водоемах обусловлены широким диапазоном абиотических факторов продуктивности – почти десятикратной разницей средних глубин и прозрачности воды. Основной показатель различий – содержание Хл, которое в пресноводном Рыбинском водохранилище в 30 раз выше, чем в морском заливе Анива (табл. 1). Следствием разного влияния глубины на распределение Хл в компонентах экосистем были более тесные корреляционные связи между глубиной и Хл в планктоне морского залива, чем в водохранилище. Однако, связи между глубиной и содержанием осадочных пигментов лучше выражены в пресноводном водоеме (рис. 4).
Сходство структурно-функциональной организации фонда растительных пигментов в водохранилище и заливе проявилось в универсальных для водоемов закономерностях, характеризующих связи между концентрациями пигмента в компонентах экосистемы. Например, соотношение между концентрациями Хл в нижнем (афотическом) придонном и верхнем (эвфотическом) слоях воды, как правило, меньше 1.0, а общая (для двух водоемов) связь достаточно тесная. Сильная связь между концентрациями пигмента по вертикальному разрезу водоема отражает определяющую роль в экосистеме новообразованного ОВ при фотосинтезе. В эвфотической зоне скорость синтеза Хл превышает скорость его деградации, в афотической зоне Хл, теоретически, не синтезируется, а разрушается. В афотической зоне, включая дно, концентрация пигментов пополняется за счет осевших клеток водорослей, Хл превращается в феопигменты и другие продукты деградации. По вертикальному профилю водоема возрастает процентное содержание феопигментов, о чем свидетельствуют максимальные значения этого показателя в самых нижних горизонтах водной толщи и донных отложениях. Универсальный характер связи между концентрациями пигментов в водной толще и донных отложениях отражает наличие определенного соотношения пигментов (и ОВ) в бентали и пелагиали, несмотря на трансформацию ОВ при седиментации.
Жизнь в морских и пресных водах различается на всех уровнях организации – экосистемном, организменном, клеточном и молекулярном, а специфичность биоты в водоемах разной солености считается фундаментальным свойством жизни (Жирков, 2017). Однако, наряду с различиями, морские и пресноводные экосистемы характеризуются сходными закономерностями функционирования первичного звена и сходными связями между компонентами пигментного фонда. Сравнительный анализ морских и пресноводных водоемов может быть одним из подходов к пониманию структурно-функциональной организации разнотипных водных экосистем.
Выводы. Особенности формирования и распределения фонда растительных пигментов в пресноводном Рыбинском водохранилище и морском заливе Анива (Охотское море) контролируются абиотическими условиями. Концентрации Хл в воде и донных отложениях пресноводного водоема существенно выше по сравнению с морским заливом. Для пресного и морского водоемов выявлено более высокое относительное содержание феопигментов в афотических водных слоях и донных отложениях по сравнению с эвфотической зоной. Универсальные связи (связи между концентрациями растительных пигментов в эвфотическом, афотическом слоях и донных отложениях; содержания Хл в водной толще с глубиной водного столба и прозрачностью; содержания осадочных пигментов с водно-физическими свойствами отложений – влажностью и объемной массой; содержания пигментов в поверхностном слое отложений с концентрацией Хл в водном столбе) отражают сходство пигментных фондов исследованных водных объектов. Содержание Хл в фотосинтезирующем слое влияет на его распределение в компонентах экосистемы. Полученные результаты могут применяться в мониторинге экологического состояния морских и пресноводных объектов.
Список литературы
Агатова А.И., Лапина Н.М., Торгунова Н.И. 2016. Органическое вещество, скорости его трансформации и продуктивность различных районов Охотского моря // Труды ВНИРО. Т. 164. С. 41.
Астахов А.С., Вагина Н.К., Горбаренко С.А. и др. 1988. Скорости голоценового осадконакопления в Охотском море // Тихоокеанская геология. № 4. С. 3.
Ведерников В.И. 1975. Зависимость ассимиляционного числа и концентрации хлорофилла а от продуктивности вод в различных температурных областях Мирового океана // Океанология. Т. 15. № 4. С. 703.
Винберг Г.Г. 1960. Первичная продукция водоемов. Минск: Изд-во АН БССР.
Виноградов М.Е. 2004. Биологическая продуктивность океанических экосистем // Новые идеи в океанологии. Т. 1. Физика. Химия. Биология. Москва: Наука. С. 237.
Гольд В.М., Гаевский Н.А., Шатров И.Ю. и др. 1986. Опыт использования флуоресценции для дифференциальной оценки содержания хлорофилла у планктонных водорослей // Гидробиол. журн. Т. 22. № 3. С. 80.
Горшков В.Г. 1985. Устойчивость биогеохимических круговоротов // Экология. № 2. С. 3.
Жирков И.А. 2017. Биогеография. Общая и частная: суши, моря и континентальных водоемов. Москва: Тов-во науч. изд. КМК.
Здобин Д.Ю. 2014. Состав и свойства илов шельфа Охотского моря // Инженерная геология. № 2. С. 34.
Коренева Т.Г., Латковская Е.М. 2013. Характеристика изменчивости вод залива Анива по содержанию пигментов фитопланктона // Вода: хим.экол. № 10. С. 68.
Коренева Т.Г., Латковская Е.М., Частиков В.Н. 2014. Сезонная динамика гидролого-гидрохимических характеристик и концентрации хлорофилла а в заливе Анива в 2003 г. // Вода: хим. экол. № 4. С. 33.
Лоция Татарского пролива, Амурского лимана и пролива Лаперуза. 2003. Санкт-Петербург: ГУНиОМО РФ.
Максимова М.П. 2004. Сравнительная гидрохимия морей // Новые идеи в океанологии. Т. 1. Физика, химия, биология. Москва: Наука. С. 168.
Минеева Н.М. 2004. Растительные пигменты в воде волжских водохранилищ. Москва: Наука.
Минеева Н.М. 2016. Сезонная и межгодовая динамика хлорофилла в планктоне Рыбинского водохранилища по данным флуоресцентной диагностики // Тр. ин-та биол. внутр. вод РАН. № 76(79). С. 75.
Мордасова Н.В. 2014. Косвенная оценка продуктивности вод по содержанию хлорофилла // Тр. ВНИРО. Т. 152. С. 41.
Номоконова В.И. 2009. Гидрохимический режим и трофическое состояние озер Самарской Луки и сопредельной территории // Изв. Самар. науч. центра РАН. Т. 11. № 1. С. 155.
Номоконова В.И. 2011. Содержание фотосинтетических пигментов в воде и донных отложениях водоемов Самарской Луки // Самарская Лука: пробл. регион. глобал. экол. Т. 20. № 2. С. 54.
Пропп Л.Н., Гаврина Л.Ю. 2005. Сезонные вариации соединений биогенных элементов и продукционных характеристик в водах залива Анива по результатам экспедиционных исследований 2001–2002 гг. // Тр. СахНИРО. Т. 7. С. 111.
Пырина И.Л., Литвинов А.С., Кучай Л.А и др. 2006. Многолетние изменения первичной продукции фитопланктона Рыбинского водохранилища в связи с действием климатических факторов // Состояние и проблемы продукционной гидробиологии. Москва: Товарищество науч. изданий КМК. С. 36.
Семаков Н.Н. 1976. Палеомагнитное изучение отложений южной части Охотского моря // Палеомагнетизм мезозоя и кайнозоя Сибири и Дальнего Востока. Новосибирск: Институт геологии и геофизики СО АН СССР. С. 113.
Сигарева Л.Е. 2012. Хлорофилл в донных отложениях волжских водоемов. Москва: Товарищество науч. изданий КМК.
Сигарева Л.Е., Пырина И.Л., Тимофеева Н.А. 2016. Межгодовая динамика растительных пигментов в воде и донных отложениях Рыбинского водохранилища // Тр. ин-та биол. внутр. вод РАН. № 76(79). С. 119.
Смольская О.С., Жукова А.А., Люля А.С. 2018. Пигментные и физико-химические характеристики донных отложений озер Нарочь и Мястро // Журн. Белорусс. гос. ун-та. Биология. № 2. С. 65.
Состояние экосистемы озера Неро в начале XXI века. 2008. Москва: Наука.
Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века. 2018. Москва: РАН.
Шевченко Г.В., Частиков В.Н., Кириллов К.В., Кусайло О.В. 2016. Экспериментальные исследования течений в заливе Анива в 2003 г. // Фундаментальная и прикладная гидрофизика. Т. 9. № 4. С. 35.
Adams M.S., Prentki R.T. 1986. Sedimentary pigments as an index of the trophic status of Lake Mead // Hydrobiologia. V. 143. № 1. P. 71. https://doi.org/10.1007/BF00026647
Antoine D., Andre J.-M., Morel A. 1996. Oceanic primary production 2. Estimation at global scale from satellite (coastal zone color scanner) chlorophyll // Global Biogeochem. Cycles. V. 10. № 1. P. 57.
Bosin A.A., Zakharkov S.P., Gorbarenko S.A. 2010. The reflection of the present distribution of the primary production in the bottom sediments of the Sea of Okhotsk // Oceanology. V. 50. № 2. P. 175. https://doi.org/10.1134/S0001437010020037
Carlson R.E. 1977. A trophic state index for lakes // Limnol., Oceanogr. V. 22. № 2. P. 361. https://doi.org/10.4319/lo.1977.22.2.0361
Cotovicz L.C., Jr., Knoppers B.A., Brandini N. et al. 2018. Predominance of phytoplankton-derived dissolved and particulate organic carbon in a highly eutrophic tropical coastal embayment (Guanabara Bay, Rio de Janeiro, Brazil) // Biogeochemistry. V. 137. № 1–2. P. 1. https://doi.org/10.1007/s10533-017-0405-y
Jeffrey S.W., Humphrey G.F. 1975. New spectrophotometric equations for determing chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton // Biochem. Physiol. Pflanz. V. 167. № 2. P. 191. https://doi.org/10.1016/S0015-3796(17)30778-3
Jiménez L., Romero-Viana L., Conde-Porcuna J.M., Pérez-Martínez C. 2015. Sedimentary photosynthetic pigments as indicators of climate and watershed perturbations in an alpine lake in southern Spain // Limnetica. V. 34. № 2. P. 439. https://doi.org/10.23818/limn.34.33
Freiberg R., Nõmm M., Tõnno I. et al. 2011. Dynamics of phytoplankton pigments in water and surface sediments of a large shallow lake // Estonian J. Earth Sci. V. 60. № 2. P. 91. https://doi.org/10.3176/earth.2011.2.03
Koomklang J., Yamaguchi H., Ichimi K., Tada K. 2018. A role for a superficial sediment layer in upward nutrient fluxes across the overlying water–sediment interface // J. Oceanogr. V. 74. № 1. P. 13. https://doi.org/10.1007/s10872-017-0434-0
Koreneva T.G., Sigareva L.E. 2019. The distribution of chlorophyll a in the bottom sediments of Aniva Bay (Sea of Okhotsk) // Russ. J. Mar. Biol. № 5. P. 341. https://doi.org/10.1134/S1063074019050067
Krajewska M., Szymczak-Żyla M., Kowalewska G. 2017. Algal pigments in Hornsund (Svalbard) sediments as biomarkers of Arctic productivity and environmental conditions // Polish Polar Research. V. 38. № 4. P. 423. https://doi.org/10.1515/popore-2017-0025
Kravchishina M.D., Lisitzin A.P., Lein A.Y. et al. 2016. First results on determination of chlorophyll a and its derivatives in the system of trapped sedimentary material–fluffy layer–bottom sediment of the Caspian Sea // Dokl. Earth Sci. V. 467. № 1. P. 284. https://doi.org/10.1134/S1028334X16030041
Lampadariou N., Eleftheriou A. 2018. Seasonal dynamics of meiofauna from the oligotrophic continental shelf of Crete (Aegean Sea, eastern Mediterranean) // J. Exp. Mar. Biol. Ecol. V. 502. P. 91. https://doi.org/10.1016/j.jembe.2017.12.014
Leavitt P.R. 1993. A review of factors that regulate carotenoid and chlorophyll deposition and fossil pigment abundance // J. Paleolimnol. № 9. № 2. P. 109. https://doi.org/10.1007/BF00677513
Leonov A.V., Pishchal’nik V.M. 2005. Biotransformation of organogenic substances in the Aniva Bay waters: assessment with the use of mathematical modeling // Water Resour. V. 32. № 5. P. 508. https://doi.org/10.1007/s11268-005-0065-5
Liu X., Zhang Z., Wu Y., Huang Y., Zhang Y. 2005. Distribution of sediment chloroplastic pigments in the Southern Yellow Sea, China // J. Ocean Univ. China. V. 4. № 2. P. 163. https://doi.org/10.1007/s11802-005-0011-9
Lorenzen C.J. 1967. Determination of chlorophyll and phaeo-pigments: spectrophotometric equations // Limnol., Oceanogr. V. 12. № 2. P. 343. https://doi.org/10.4319/lo.1967.12.2.0343
Möller W.A.A., Scharf B.W. 1986. The content of chlorophyll in the sediment of the volcanic maar lakes in the Eifel region (Germany) as an indicator for eutrophication // Hydrobiologia. V. 143. № 1. P. 327. https://doi.org/10.1007/BF00026678
Naeher S., Suga H., Ogawa N.O. et al. 2016. Distributions and compound-specific isotopic signatures of sedimentary chlorins reflect the composition of photoautotrophic communities and their carbon and nitrogen sources in Swiss lakes and the Black Sea // Chem. Geol. V. 443. P. 198. https://doi.org/10.1016/j.chemgeo.2016.04.029
Rasiq K.T., Kurian S., Karapurkar S.G., Naqvi S.W.A. 2016. Sedimentary pigments and nature of organic matter within the oxygen minimum zone (OMZ) of the Eastern Arabian Sea (Indian margin) // Estuarine, Coastal Shelf Sci. V. 176. P. 91. https://doi.org/10.1016/j.ecss.2016.04.013
Reavie E.D., Edlund M.B., Andresen N.A. et al. 2017. Paleolimnology of the Lake of the Woods southern basin: continued water quality degradation despite lower nutrient influx // Lake Reservoir Manage. V. 33. № 4. P. 369. https://doi.org/10.1080/10402381.2017.1312648
Romankevich E.A., Vetrov A.A., Peresypkin V.I. 2009. Organic matter of the World Ocean // Russian Geology and Geophysics. V. 50. № 4. P. 299. https://doi.org/10.1016/j.rgg.2009.03.013
Schüller S.E., Bianchi T.S., Li X. et al. 2015. Historical reconstruction of phytoplankton composition in estuaries of Fiordland, New Zealand: the application of plant pigment biomarkers // Estuaries Coasts. V. 38. № 1. P. 56. https://doi.org/10.1007/s12237-014-9771-z
Sigareva L.Ye., Mineyeva N.M., Timofeyeva N.A. 2019. Chlorophyll a content in the near-bottom layer of water of the Rybinsk Reservoir (the Upper Reaches of the Volga River, Russian Federation) // Gydrobiol. Zh. V. 55. № 1. P. 58. https://doi.org/10.1615/HydrobJ.v55.i1.60
Swain E.B. 1985. Measurement and interpretation of sedimentary pigments // Freshwater Biol. V. 15. № 1. P. 53. https://doi.org/10.1111/j.1365-2427.1985.tb00696.x
Szymczak-Żyła M., Kowalewska G. 2009. Chloropigments a in sediments of the Gulf of Gdansk deposited during the last 4000 years as indicators of eutrophication and climate change // Palaeogeogr., Palaeoclimatol., Palaeoecol. V. 284. № 3–4. P. 283. https://doi.org/10.1016/j.palaeo.2009.10.007
Timofeeva N.A., Perova S.N., Sigareva L.E. 2018a. Distribution of sedimentary pigments and macrozoobenthos in the deepwater part of the Rybinsk Reservoir // Contemporary Problems of Ecology. V. 11. № 6. P. 652. https://doi.org/10.1134/S1995425518060100
Timofeeva N.A., Sigareva L.E., Gusakov V.A., Zakonnov V.V. 2018b. Content of plant pigments in the bottom sediments of the water bodies of Vietnam // Inland Water Biology. V. 11. № 3. P. 278. https://doi.org/10.1134/S1995082918030215
Tse T.J., Doig L.E., Leavitt P.R. et al. 2015. Long-term spatial trends in sedimentary algal pigments in a narrow river-valley reservoir, Lake Diefenbaker, Canada // J. Great Lakes Res. V. 41. Suppl. 2. P. 56. https://doi.org/10.1016/j.jglr.2015.08.002
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод