Биология внутренних вод, 2021, № 2, стр. 142-150
Анализ состояния биологических сообществ континентального водоема с использованием гидрооптических характеристик
Г. В. Винокурова a, *, И. А. Суторихин a, А. А. Коломейцев a, И. М. Фроленков a
a Институт водных и экологических проблем, Сибирское отделение Российской академии наук
Барнаул, Россия
* E-mail: kimg@iwep.ru
Поступила в редакцию 05.12.2018
После доработки 20.11.2019
Принята к публикации 05.03.2020
Аннотация
В марте, августе 2017 г. и феврале 2018 г. исследованы состав, развитие, распределение фитопланктона и гидрооптические характеристики мезотрофного бессточного оз. Красиловское (Алтайский край, Россия). В составе ФП обнаружено 147 таксонов рангом ниже рода. Зимой при высоте снежного покрова 0.13−0.34 м, толщине льда 0.56−0.70 м и температуре воды 0.1−4.5°C численность фитопланктона составила 0.03−1.06 млн кл./л, биомасса 0.2−12.2 г/м3, содержание Хл а 1.8−24.1 мг/м3. Летний фитопланктон характеризовался более высокими показателями развития (0.11−1.74 млн кл./л, 0.6−18.2 г/м3, 27.5−83.4 мг/м3 Хл а). Выявлена связь коэффициентов поглощения света в диапазоне 400−460 и 670−800 нм с содержанием Хл а, в диапазоне 520−580 нм – с общей численностью фитопланктона, что свидетельствует об активном фотосинтезе водорослей не только в летний, но и в подледный период.
ВВЕДЕНИЕ
Экология ФП континентальных водоемов в период открытой воды считается одним из наиболее изученных аспектов функционирования водных экосистем (Wetzel, 2001). Значительно меньше сведений относится к подледному периоду, хотя водоемы северного полушария покрыты льдом 2−8 месяцев в году. Интенсивное развитие водорослей планктона и криофитона под слоем льда и снега выявлено в водоемах умеренных и арктических широт (Wright, 1964; Foy, Gibson, 1982; Терешенкова, 1983; Ермолаев, Науменко, 1992; Науменко, Нечаева, 2000; Phillips, Fawley, 2002; Бондаренко, 2009; Оглы, 2009; Корякина, 2009; Veillette et al., 2010; Кутько, 2012; Dokulil et al., 2014; Баженова, Михайлов, 2015; Лабунская, Бухарицин, 2015; Халиуллина, Яковлев, 2015; Ривьер, 2016). Однако динамика структуры ФП в толще воды в период ледостава остается мало изученной (Vanderploeg et al., 1992; Pasztaleniec, Lenard, 2008; Могильникова и др., 2009; Ташлыкова, 2011; Bertilsson et al., 2013). При исследовании морских арктических и антарктических акваторий широко используют гидрооптические методы. Получаемые in situ в реальном масштабе времени первичные гидрооптические характеристики используют для анализа биооптической структуры водной толщи и состояния биологических сообществ (Шоларь, Ли, 2018). На континентальных водоемах эти методы распространены в меньшей степени, в связи с чем очевидна необходимость их апробации при исследовании функционального состояния пресноводного фитопланктона. В качестве модельного водоема выбрано оз. Красиловское, на берегу которого располагается учебно-научная база Алтайского государственного университета. Поскольку озеро бессточное, вынос или привнесение аллохтонных видов водорослей сведены к минимуму, и состояние ФП полностью зависит от внутриводоемных процессов.
Цель работы – исследование структуры, обилия и функционального состояния ФП оз. Красиловское в периоды летней и зимней межени с использованием альгологических и гидрооптических методов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Наблюдения проводили 14 марта, 2 августа 2017 г. и 20 февраля 2018 г. на станции глубиной 6 м. Пробы отбирали батометром Руттнера от поверхности до дна с интервалом 1 м. Фитопланктон концентрировали прямой фильтрацией через мембранные фильтры Владипор МФАС-ОС-3 с диаметром пор 0.8 мкм и фиксировали 4%-ным формалином. Подсчет клеток водорослей проводили под световым микроскопом (×650) в камере Нажотта объемом 0.01 мл (Руководство…, 1992). В доминирующий комплекс включены виды с численностью и биомассой ≥10% общей численности и/или биомассы. Таксономия водорослей приведена в соответствии с современной международной номенклатурой (Guiry, Guiry, 2018). Для оценки сходства качественного состава водорослей использовали коэффициент Серенсена, для оценки видового разнообразия ‒ индекс Шеннона, рассчитанный по численности (Леонтьев, 2008), экологические и географические характеристики водорослей взяты из работы (Баринова и др., 2006).
Содержание Хл а определяли стандартным спектрофотометрическим методом (SCOR-UNESCO, 1966), температуру воды – прибором ДИТЦ‒10/05 (Зуев и др., 2014), прозрачность – по диску Секки. Коэффициент поглощения света (ε) измеряли на спектрофотометре ПЭ-5400УФ в 1-см кварцевых кюветах в диапазоне длин волн 400–800 нм и рассчитывали по формуле
ελ = (1/L)ln (I0λ/Iλ),
где L – длина кюветы, I0λ и Iλ – интенсивность светового потока, прошедшего соответственно через дистиллированную и природную воду, при длине волны λ.
Оз. Красиловское (53°18′13″ с.ш., 83°36′16″ в.д.) расположено на надпойменной террасе правого берега р. Обь на высоте 220 м над у.м. Площадь водосбора составляет 46.1 км2, площадь водного зеркала 0.8 км2, средняя глубина − 2.7 м, максимальная − 6.5 м (Суторихин и др., 2016). Дно покрыто мощным слоем бурого ила (Малолетко, 2006). Вода озера гидрокарбонатно-кальциевая с минерализацией 31.6−55.4 мг/дм3, рН 7.15−8.72, ПО 6.65–9.16 мг О/дм3. Низкая минерализация поддерживается за счет обильных атмосферных осадков (в среднем 500 мм/год) и значительной доли подземных вод в питании озера (Модина, Сухова, 2007). Содержание фосфора фосфатов (0.01−0.08 мг Р/дм3) в подледный период выше, чем летом. Содержание нитритного, нитратного и аммонийного азота составляет соответственно 0.006–0.062, 0.09–0.12 и 0.18–0.71 мг N/дм3 (Долматова, 2016). Трофический статус озера варьирует от мезотрофного до эвтрофного.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Летом при прямой термической стратификации температура воды в озере снижалась от 24.2°C у поверхности до 13.6°C у дна, а в подледный период при обратной стратификации соответственно увеличивалась от 0.1–0.3 до 4.1–4.5°C (рис. 1). Высота снежного покрова составляла 0.34 м в феврале и 0.13 м в марте, толщина льда – 0.56 м и 0.70 м. При прозрачности воды 1.25 м в августе фотический слой не превышал 3.0‒3.5 м.
Рис. 1.
Вертикальное распределение температуры воды в оз. Красиловское в периоды исследования. По оси ординат – глубина, по оси абсцисс – температура. 1 − февраль, 2 – март, 3 – август.

При ослаблении светового потока толщей воды коэффициент поглощения световых волн увеличивался с глубиной в 3.5–4.1 раза. Свет в синей области спектра поглощался озерной водой более интенсивно, чем в желто-зеленой и красной. Величины ε для различных участков спектра незначительно различались в августе и марте, но существенно увеличивались в феврале (рис. 2, табл. 1).
Рис. 2.
Вертикальное распределение коэффициента поглощения световых волн (ԑ) разной длины в оз. Красиловское в августе (а), феврале (б) и марте (в). По оси ординат – глубина, по оси абсцисс – ԑ.
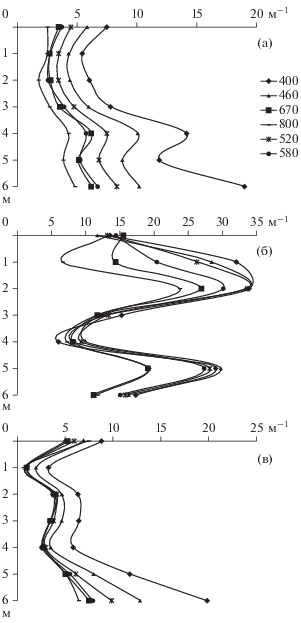
Таблица 1.
Обилие ФП и гидрооптические показатели воды оз. Красиловское в периоды наблюдения (над чертой пределы, под чертой среднее)
| Показатель | Август | Февраль | Март |
|---|---|---|---|
| Численность, тыс. кл./л | $\frac{{65.3 - 738}}{{278}}$ | $\frac{{48.8 - 141}}{{95.3}}$ | $\frac{{26.4 - 1056}}{{328}}$ |
| Биомасса, г/м3 | $\frac{{0.6 - 18.2}}{{5.6}}$ | $\frac{{0.2 - 5.3}}{{1.7}}$ | $\frac{{0.8 - 12.2}}{{3.4}}$ |
| Хл а, мг/м3 | $\frac{{0.6 - 18.2}}{{5.6}}$ | $\frac{{1.8 - 6.8}}{{4.7}}$ | $\frac{{3.1 - 24.1}}{{9.0}}$ |
| Объем клетки, мкм3 | $\frac{{1.8 - 126 \times {{{10}}^{4}}}}{{2261}}$ | $\frac{{0.5 - 33.5 \times {{{10}}^{4}}}}{{1716}}$ | $\frac{{0.5 - 22.1 \times {{{10}}^{4}}}}{{1058}}$ |
| ԑ400‒460, м–1 | $\frac{{4.3 - 19.0}}{{8.7}}$ | $\frac{{6.1 - 33.8}}{{20.7}}$ | $\frac{{2.0 - 19.8}}{{7.5}}$ |
| ԑ520‒580, м–1 | $\frac{{2.5 - 9.4}}{{5.0}}$ | $\frac{{5.5 - 33.4}}{{16.5}}$ | $\frac{{0.9 - 10.9}}{{4.6}}$ |
| ԑ670‒800, м–1 | $\frac{{1.8 - 6.2}}{{3.8}}$ | $\frac{{6.7 - 26.9}}{{14.1}}$ | $\frac{{0.8 - 7.5}}{{4.3}}$ |
В составе фитопланктона оз. Красиловское обнаружено 147 таксонов рангом ниже рода, относящиеся к семи отделам. Ведущую позицию занимают зеленые водоросли Chlorophyta (51.1% общего видового состава), далее следуют Cyanoprocaryota (18.4%), Bacillariophyta (12.8%), Euglenophyta (9.2%), Ochrophyta (3.5%), Cryptophyta (2.8%) и Dinophyta (Miozoa) (2.1%). Наибольшее число видов (более 100) встречено в августе, вдвое меньшее – в феврале и марте (56 и 52). Индекс видового разнообразия соответственно снижался от 3.79 до 3.20 и 2.10 бит/экз. Большинство таксонов с известным географическим распространением ‒ космополиты (46.0% общего состава), 4.1% – бореальные виды, географическая приуроченность остальных видов не выявлена.
В летний период разнообразно представлены зеленые водоросли из родов Scenedesmus (16 видов и разновидностей), Monoraphidium (6), Raphidocelis (3), Staurodesmus (3 вида), многие из которых достигали массового развития (табл. 2). В состав доминирующего комплекса входили также цианопрокариоты Microcystis aeruginosa и неидентифицированные мелкие формы с диаметром клеток 1−3 мкм. Chroomonas coerulea из криптофитовых отмечен в большом количестве на глубине 4 м. В состав доминирующих по биомассе видов входила редко встречающаяся крупноклеточная Euglena hemichromata. Подвижные жгутиковые водоросли (Chlamydomonas, Euglena, Lepocinclis, Trachelomonas, Phacus, Glenodinium, Cryptomonas, Chroomonas) и подвижные нитчатые цианопрокариоты (Spirulina, Chrysosporum, Oscillatoria, Lyngbya) встречаются во всей толще воды от поверхности до дна. Их состав наиболее разнообразен на глубине 2‒5 м (10‒14 видов), а в верхних слоях и у дна число подвижных водорослей примерно в два раза меньше (5‒8 видов).
Таблица 2.
Структура доминирующего комплекса фитопланктона оз. Красиловское в зимний и летний период (в скобках % общей численности/биомассы)
| Глубина, м | Доминирующие виды | |
|---|---|---|
| по численности | по биомассе | |
| Февраль 2018 г. | ||
| 0 | Anabaena sp. (34), Achnanthes sp. (15) | Chlamydomonas sp. (30), Trachelomonas sp. (23) |
| 1 | Microcystis pulverea (H.C. Wood) Forti. (64) | M. pulverea (90) |
| 2 | НИД мелкие цианобактерии (20), Microcystis sp. (14), Gloeocapsa sp. (10), Trachelomonas sp. (10) | M. pulverea (48), Trachelomonas sp. (11) |
| 3 | M. pulverea, Cyanothece aeruginosa (Näg.) Kom. (18), Monoraphidium komarkovae Nygaard (11) | M. pulverea (51), Microcystis aeruginosa (Kütz.) Kütz. (42) |
| 4 | Hyaloraphidium contortum Pascher & Korshikov in Korshikov (15), M. komarkovae (14) | НИД золотистые (22), НИД криптофитовые (15), цисты зеленых (11), Fragilaria sp. (9) |
| 5 | M. aeruginosa, Scenedesmus caudato-aculeolatus var. spinosus (Deduss.) Pankow (15), Dictyosphaerium subsolitarium Van Goor (15), H. contortum (14), M. komarkovae (13) | M. aeruginosa (30), НИД динофитовые (29), Pseudopediastrum boryanum (Turpin) E. Hegewald (10) |
| 6 | M. aeruginosa (39), Chroococcus vacuolatus Skuja (37) | Microcystis sp. (58), M. aeruginosa (12) |
| Март 2017 г. | ||
| 0 | Gomphosphaeria lacustris Chodat (97) | G. lacustris (57), Cyanodictyon reticulatum (Lemmermann) Geitler (40) |
| 1 | G. lacustris (99) | G. lacustris (97) |
| 2 | M. pulverea (47), G. lacustris (46) | M. pulverea (57), G. lacustris (31) |
| 3 | G. lacustris (82), M. pulverea (17) | M. pulverea (92) |
| 4 | G. lacustris (83), M. pulverea (16) | M. pulverea (95) |
| 5 | G. lacustris (59), M. pulverea (40) | M. pulverea (94) |
| 6 | G. lacustris (74), M. pulverea (24) | G. lacustris (56), M. pulverea (41) |
| Август 2017 г. | ||
| 0 | НИД мелкие цианобактерии (17), Scenedesmus caudate-aculeolatus var. spinosus (12), Coelastrum astroideum De Notaris (10) | Euglena hemichromata Skuja (16), M. pulverea (16), Staurastrum saltator Grönblad (10), Pediastrum duplex Meyen (9) |
| 1 | P. duplex (25), Mucidosphaerium pulchellum (H.C. Wood) C. Bock, Proschold & Krienitz (23), C. astroideum (10) | P. duplex (24), НИД динофитовые (22) |
| 2 | M. aeruginosa (11), Chlamydomonas proboscigera var. conferta (Korshikov) Ettl (9), S. saltator (9) | M. aeruginosa (33), S. saltator (9), C. proboscigera var. conferta (8) |
| 3 | P. duplex (11), НИД мелкие цианобактерии (9), M. aeruginosa (8) | M. aeruginosa (89) |
| 4 | Chroomonas coerulea (Geitler) Skuja (16), Enallax costatus (Schmidle) Pascher (8), Desmodesmus magnus (Meyen) Tsarenko (8), Dictyosphaerium granulatum Hindák (8) | M. aeruginosa (47), Euglena hemichromata (33), Chroomonas coerulea (5) |
| 5 | M. aeruginosa (30), D. granulatum (27), Desmodesmus denticulatus (5) | M. aeruginosa (26), D. denticulatus (15), D. granulatum (8) |
| 6 | M. aeruginosa (66), D. granulatum (8) | M. aeruginosa (93) |
Численность водорослей увеличивалась с глубиной, достигая максимальной у дна за счет зеленых, криптофитовых водорослей и цианопрокариот. Высокая биомасса отмечена на глубине 3 и 6 м. Содержание Хл а также увеличивалось с глубиной, но не совпадало с пиками численности и биомассы (табл. 2, рис. 3). Среднеценотический объем клеток составил 2261 мкм3.
Рис. 3.
Вертикальное распределение численности (а), биомассы фитопланктона (б) и содержания Хл а (в) в оз. Красиловское в феврале (1), марте (2) и августе (3). По оси ординат – глубина, по оси абсцисс – показатели обилия.

В зимнем фитопланктоне наиболее разнообразно представлен род Scenedesmus ‒ 9 таксонов в феврале и 7 в марте. В феврале в состав доминирующего комплекса входили цианопрокариоты, зеленые, эвгленовые, диатомовые, золотистые и криптофитовые водоросли (табл. 2). Крупноклеточные Chlamydomonas sp. и Trachelomonas sp. доминировали по биомассе в верхних слоях. В пробах обнаружены пустые створки диатомовых (11 из 16 видов) и пустые клеточные оболочки зеленых водорослей Scenedesmus, Tetraëdron, Pediastrum, количество которых увеличивалось ко дну. Присутствовали также водоросли из разных отделов, которые не удалось идентифицировать до вида. В феврале их численность была максимальной. Часть клеток находилась в стадии покоя в виде цист. Во всей толще воды встречались подвижные жгутиковые водоросли (Chlamydomonas sp., Lepocinclis acus (O.F. Müller) B. Marin & Melkonian, Euglena deses Ehr., Trachelomonas sp., T. volvocina (Ehr.) и нитчатые цианопрокариоты (Spirulina sp., Anabaena sp.). Подвижные криптофитовые и золотистые водоросли отмечены ниже глубины 2 м. В марте во всей толще воды доминировали цианопрокариоты. Жгутиковые Euglena deses, Trachelomonas hispida (Perty) F. Stein, T. conica Playfair встречались подо льдом до глубины 2 м, а подвижные нитчатые Spirulina sp. Oscillatoria sp., Anabaena macrospora Klebahn – на глубине 3‒6 м. У дна отмечены и те, и другие виды.
Зимний фитопланктон озера сформирован более мелкими формами, чем летний, со среднеценотическим объемом клеток 1716 и 1058 мкм3 в феврале и в марте. Показатели развития подледного фитопланктона были ниже, чем летом. Минимальные величины получены в феврале, когда лед покрыт более толстым слоем снега. Численность, биомасса и содержание хлорофилла увеличивались с глубиной, но изменялись не синхронно (рис. 3). При микроскопических исследованиях мартовских проб обнаружено, что окраска хлоропластов зеленых водорослей с глубиной становилась более интенсивной.
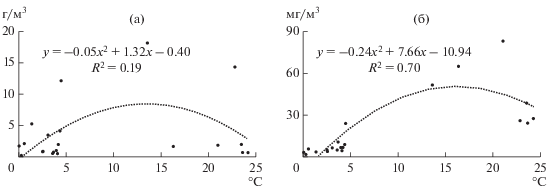
Биомасса водорослей не зависела от температуры воды, но достоверная отрицательная корреляция была выявлена между температурой и содержанием Хл а (рис. 4). С показателями поглощения света в синей (400−460 нм) и красной (670−800 нм) области спектра положительно связана концентрация Хл а, а в желто-зеленой области (520 и 580 нм) – общая численность фитопланктона (рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Состав, структура и обилие ФП, представленного в оз. Красиловское главным образом видами-космополитами, типичны для мелководных мезотрофных и слабо эвтрофных водоемов умеренных широт. Численность, биомасса, содержание Хл а и пределы их варьирования в толще воды максимальны в августе, снижаются в марте и минимальны в феврале, когда лед покрыт толстым слоем снега. Отрицательного действия низкой температуры воды на обилие водорослей не отмечено. Все обнаруженные в подледный период виды вегетировали и летом, но поскольку зимой видовое разнообразие снижалось вдвое, то коэффициент видового сходства зимнего и летнего ФП невысокий – 41.6%. В летнем ФП отмечены как крупные, так и мелкоклеточные виды. В зимнем планктоне размер клеток редко превышал 10 мкм; обильно развивались мелкие (<5 мкм) коккоидные и веретеновидной формы с шипиками и длинными отростками; колонии цианопрокариот имели мощную слизистую оболочку. Все эти особенности позволяют водорослям находиться в толще воды при отсутствии перемешивания (Phillips, Fawley, 2002; Bondarenko et al., 2006; Somogyi et al., 2009). Именно мелкоклеточные формы – пикопланктон достигают высокого обилия подо льдом (Doculil, 2009; Veillette et al., 2010; Bondarenko et al., 2012). Жгутиковые подвижные виды, способные перемещаться к поверхности в более благоприятные по освещенности условия или, не оседая, находиться в толще воды, представлены единичными экземплярами и, в отличие от других озер (Костерина, 2018; Doculil, 2009; Dokulil et al., 2014), распределены в толще воды достаточно равномерно. В подледном фитопланктоне оз. Красиловское встречены подвижные нитчатые цианопрокариоты Aphanizomenon, Lyngbya, Oscillatoria, Spirulina, Anabaena, сведения о которых в цитируемой литературе отсутствуют.
Удержанию в толще воды и выносу клеток к поверхности способствуют не только морфологические особенности и жизненные стратегии водорослей, но также гидрологические и гидрохимические условия (Phillips, Fawley, 2002; Dokulil et al., 2014). Это могут быть восходящие токи воды с меньшей плотностью, которые образуются за счет нагрева воды при окислении илов (Malm et al., 1997; Terzhevik et al., 2009; Bertilsson et al., 2013) или за счет более низкого содержания минеральных веществ по сравнению с подледным слоем (Granin et al., 2000).
Подледный фитопланктон может находиться в различном физиологическом состоянии. При низкой температуре снижается интенсивность метаболизма (Bertilsson et al., 2013) и в морфологии клеток не проявляются видоспецифичные черты. Именно поэтому в оз. Красиловское зимой в большом количестве встречены не идентифицированные водоросли из разных отделов, численность которых максимальна в феврале при большой высоте снежного покрова. Часть клеток находилась в стадии покоя в виде цист.
При низкой освещенности водоросли могут переходить на гетеротрофное или миксотрофное питание (Vanderploeg et al., 1992; Mencfel, Pasztaleniec, 2004; Pasztaleniec, Lenard, 2008; Игошкина, 2014; Dokulil et al., 2014). О такой возможности свидетельствуют высокие значения ПО в воде оз. Красиловское, указывающие на присутствие доступного легко окисляемого органического вещества.
Насыщенная окраска хлоропластов, довольно высокое содержание Хл а и его связь с показателями ослабления света свидетельствуют об активном фотосинтезе водорослей. Известно, что через слой льда и снега проникает до 70% солнечной энергии (Wright, 1964; Vanderploeg et al., 1992; Wetzel, 2001; Pasztaleniec, Lenard, 2008; Dokulil et al., 2014; Brabdao et al., 2017), а прозрачность воды зимой увеличивается из-за осаждения взвешенных веществ (Оглы, 2009; Dokulil et al., 2014). В результате первичная продукция подледного фитопланктона может достигать 0.55–1.90 г C/(м2 · сут) (Foy, Gibson, 1982; Корякина, 2009; Dokulil et al., 2014). Поскольку фотосинтез в синей части спектра идет более интенсивно, чем в красной (Шифрин, 1983; Brabdao et al., 2017), то коэффициенты поглощения света ε400−460 в оз. Красиловское выше, чем ε670−800.
Показатели поглощения света увеличиваются с ростом концентрации Хл а, но теснота связи между ними не велика. Одной из причин может быть присутствие в воде фотосинтезирующих бактерий, микроскопических водных грибов зеленоватого и коричнево-бурого цвета, остатков высших растений. Механизмом приспособления самих водорослей к обитанию в условиях низкой температуры и освещенности служит световая и хроматическая адаптация – увеличение количества дополнительных пигментов, расширяющих спектр поглощаемых волн (Wright, 1964; Brabdao et al., 2017); увеличение общего содержания пигментов и эффективности фотосинтетической единицы (Михеева, 1977; Foy, Gibson, 1982; Dokulil et al., 2014). Вероятно, этим объясняются максимальные показатели поглощения, полученные в феврале при самых низких концентрациях Хл а.
Положительная корреляция между поглощением желто-зеленого света и общей численностью ФП объяснима доминированием в оз. Красиловское цианопрокариот, в клетках которых содержатся фикобилины: фикоэритрин, поглощающий свет в диапазоне 495−565 нм, и фикоцианин (550−615 нм) (Wright, 1964; Doculil, 2009). Эффективность работы этих пигментов также увеличивается при низкой подводной освещенности в феврале.
Выводы. В составе фитопланктона оз. Красиловское в летнюю межень обнаружено более 100 видов водорослей при массовом развитии зеленых, криптофитовых, эвгленовых и цианопрокариот. В период ледостава таксономическое разнообразие вдвое ниже, но специфических зимних видов не выявлено, в массе развивались цианопрокариоты и зеленые водоросли, фитопланктон сформирован более мелкими формами, чем летом. Минимальные показатели развития фитопланктона отмечены в феврале при высоком снежном покрове. Численность, биомасса фитопланктона и содержание хлорофилла во все сезоны увеличивались от поверхности к придонному слою. Насыщенная окраска хлоропластов, высокое содержание Хл а и его закономерная связь с показателями ослабления света в синей и красной областях спектра свидетельствуют о заметной фотосинтетической активности подледного фитопланктона.
Список литературы
Баженова О.П., Михайлов В.В. 2015. Особенности существования Arthrospira fusiformis в озере соленом (г. Омск) в зимний период // Вестник ОГАУ. № 1. С. 36.
Баринова С.С., Медведева Л.А., Анисимова О.В. 2006. Биоразнообразие водорослей-индикаторов окружающей среды. Телль-Авив: Ин-т эволюции ун-та Хайфы. 498 с.
Бондаренко Н.А. 2009. Экология и таксономическое разнообразие планктонных водорослей в озерах горных областей Восточной Сибири: Автореф. дис. … докт. биол. наук. Борок.
Долматова Л.А. 2016. Особенности гидрохимического режима оз. Красиловское (бассейн Верхней Оби) // Вода. Химия и экология. № 7. С. 9.
Ермолаев В.И., Науменко Ю.В. 1992. Фитопланктон озера Убинское в подледный период // Сиб. биол. журн. № 3. С. 29.
Зуев В.В., Кураков С.А., Суторихин И.А. и др. 2014. Автономный многоканальный измерительный комплекс для регистрации метеорологических и гидрофизических параметров // Измерение, контроль, информатизация – 2014: Матер. XV междунар. науч.-техн. конф. Барнаул: Изд-во АлтГТУ. С. 186.
Игошкина И.Ю. 2014. Оценка экологического состояния водоема природного парка “Птичья Гавань” (г. Омск) по показателям развития фитопланктона: Автореф. дис. … канд. биол. наук. Омск.
Корякина Е.А. 2009. Региональная особенность первичной продукции озера Арахлей (Забайкалье): Автореф. дис. … канд. биол. наук. СПб.
Костерина Л.И. Состав и вертикальное распределение фитопланктона в оз. Светлояр в 2010–2011 гг. Электрон. ресурс. Режим доступа http://olimp. bspu.ru/data/olimp/1/41/doc/work_4806_4334_hffpzegv.pdf. Дата обращения 10.10.2018.
Кутько П.И., Стародубова А.А., Зыбина А.Р. и др. 2012. Фитопланктон Салтовского водохранилища (Харьковская область) в зимний период // Biologia. Электрон. ресурс] / Режим доступа http://www.rusnauka.com/27_SSN_2012/Biologia/6_117347.doc.htm
Лабунская Е.Н., Бухарицин П.И. 2015. Особенности распределения фитопланктона в центральных районах Северного Каспия в зимних условиях // Междунар. журн. эксперимент. образования. № 2. Ч. 3. С. 433.
Леонтьев Д.В. 2008. Флористический анализ в микологии. Харьков: Ранок-НТ. 110 с.
Малолетко А.М. 2006. Эоловые процессы как фактор речных перехватов в Верхнем Приобье // География и природопользование Сибири. Барнаул: Изд-во Алт. ун-та. Вып. 8. С. 108.
Михеева Т.М. 1977. О показателях удельной активности и некоторых причинах их определяющих // Гидробиол. журн. № 3. С. 11.
Могильникова Т.А., Полтева А.В., Латковская Е.М. и др. 2009. Микроводоросли и гетеротрофные бактерии льда и подледной воды: условия их развития в прибрежных акваториях острова Сахалин // Морская биология и экология. № 1. С. 129.
Модина Т.Д., Сухова М.Г. 2007. Климат и агроклиматические ресурсы Алтая. Новосибирск: Унив. кн. изд-во. 180 с.
Науменко Ю.В., Нечаева В.С. 2000. Видовой состав зимнего фитопланктона Новосибирского водохранилища // Сиб. экол. журн. № 2. С. 173.
Оглы З.П. 2009. Показатели продуктивности фитопланктона в водоемах Забайкальского края // Известия Самарского научного центра РАН. Т. 11. № 1(3). С. 327.
Ривьер И.К. 2016. Особенности планктоценозов озер в разные экологические периоды (подледный и открытой воды) // Труды ИБВВ РАН. Вып. 74(77). С. 59.
Руководство по гидробиологическому мониторингу пресноводных экосистем. 1992. Санкт-Петербург: Гидрометеоиздат.
Суторихин И.А., Букатый В.И., Харламова Н.Ф. и др. 2016. Климатические условия и гидрооптические характеристики пресноводных озер Алтайского края. Новосибирск: Изд-во СО РАН.
Ташлыкова Н.А. 2011. Фитопланктон озера Арахлей в подледный период // Biol. [Электрон. ресурс] / Режим доступа http://www.rusnauka.com/ 16_ADEN_2011/Biologia/3_88990.doc.htm. Дата обращения 10.10.2018.
Терешенкова Т.В. 1983. Вертикальное распределение фитопланктона в подледный период в малых озерах Ленинградской области // Изв. ГОСНИОРХ. № 132. С. 34.
Халиуллина Л.Ю., Яковлев В.А. 2015. Фитопланктон мелководий в верховьях Куйбышевского водохранилища. Казань: Изд-во Академии наук РТ.
Шифрин К.С. 1983. Введение в оптику океана. Ленинград: Гидрометеоиздат. 278 с.
Шоларь С.А., Ли М.Е. 2018. Оптические контактные методы мониторинга гидросферы и их возможное использование в новых научных направлениях // Системы контроля окружающей среды. № 14(34). С. 17.
Bertilsson S., Burgin A., Carey C. et al. 2013. The under-ice microbiome of seasonally frozen lakes // Limnol., Oceanogr. V. 58. № 6. P. 1998.
Bondarenko N.A., Timoshkin O.A., Ropstorf P. et al. 2006. The under-ice and bottom periods in the life cycle of Aulacoseira baicalensis (K. Meyer) Simonsen, a principal Lake Baikal alga // Hydrobiol. V. 568 (S). P. 107.
Bondarenko N.A., Belykh O.I., Golobokova L.P. et al. 2012. Stratified distribution of nutrients and extremophile biota within freshwater ice covering the surface of Lake Baikal // J. Microbiol. V. 50. № 1. P. 8.
Brabdao L., Brighenti L., Staehr P.A. et al. 2017. Partitioning of the diffuse attenuation coefficient for photosynthetically available irradiance in a deep dendritic tropical lake // Anais da Academia Brasileira de Ciências. V. 89. № 1. P. 469.
Doculil M.T. 2009. An analysis of long-term winter data on phytoplankton and zooplankton in Neusiedler See, a shallow temperate lake, Austria // Aquat. Ecol. V. 553. P. 293.
Dokulil M.T., Herziga A., Somogyib B. et al. 2014. Winter conditions in six European shallow lakes: a comparative synopsis // Eston. J. Ecol. V. 63. № 3. P. 111.
Foy R.H., Gibson C.E. 1982. Photosynthetic characteristics of planktonic blue-green algae: changes in photosynthetic capacity and pigmentation of Oscillatoria redekei Van Goor under high and low light // Brit. Phycol. J. V. 17. P. 183.
Granin N.G., Jewson D.H., Gnatovsky R.Yu. et al. 2000. Turbulent mixing under ice and the growth of diatoms in Lake Baikal // Verh. Internat. Verein. Limnol. V. 27. № 5. P. 2812.
Guiry M.D., Guiry G.M. 2018. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; searched on [Electronic resource]. (Дата обращения 30.10.2018).
Malm J., Terzhevik A., Bengtsson L. et al. 1997. Temperature and salt content regimes in three shallow ice- covered lakes // Nord. Hydrol. V. 28. № 2. P. 129.
Mencfel R., Pasztaleniec A. 2004. Characteristics of the winter phytoplankton in Rogózno Lake // Annales Universitatis Mariae Curie-Sklodowska, Sectio C, Biologia. V. 59. P. 1.
Pasztaleniec A., Lenard T. 2008. Winter phytoplankton communities in different depths of three mesotrophic lakes (Leczna-Wlodava Lakeland, Eastern Poland) // Biol. V. 63. № 3. P. 294.
Phillips K.A., Fawley M.W. 2002. Winter phytoplankton blooms under ice associated with elevated oxygen levels // J. Phycol. V. 38. № 6. P. 1068.
SCOR-UNESCO Working Group 17. 1966. Determination of photosynthetic pigments in sea water // Monographs on Oceanographic Methodology. Montreux: UNESCO. P. 9.
Somogyi B., Felföldi T., Vanyovszki J. et al. 2009. Winter bloom of picoeukaryotes in Hungarian shallow turbid soda pans and the role of light and temperature // Aquat. Ecol. V. 43. № 3. P. 735.
Terzhevik A., Golosov S., Palshin N. et al. 2009. Some features of the thermal and dissolved oxygen structure in boreal, shallow ice-covered Lake Vendyurskoe, Russia // Aquat. Ecol. V. 43. № 3. P. 617.
Vanderploeg H.A., Bolsenga S.J., Fahnenstiel G.L. et al. 1992. Plankton ecology in an ice-covered bay of Lake Michigan: utilization of a winter phytoplankton bloom by reproducing copepods // Hydrobiol. V. 243. P. 175.
Veillette J., Martineau M.-J., Antoniades D. et al. 2010. Effects of loss of perennial lake ice on mixing and phytoplankton dynamics: insights from High Arctic Canada // Annals Glaciol. V. 51. № 56. P. 57.
Wetzel R. 2001. Lymnology. Lake and river ecosystems. San Diego: Acad. Press.
Wright R.T. 1964. Dynamic of a phytoplankton community in an ice-covered lake // Limnol., Oceanogr. V. 9. № 2. P. 163.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод