Биология внутренних вод, 2021, № 4, стр. 353-366
Cтруктура и пространственное распределение инфузорий в планктоне водохранилищ Средней и Нижней Волги
С. В. Быкова *
Самарский федеральный исследовательский центр Российской академии наук, Институт экологии
Волжского бассейна Российской академии наук
Тольятти, Россия
* E-mail: svbykova514@rambler.ru
Поступила в редакцию 18.05.2020
После доработки 10.06.2020
Принята к публикации 22.09.2020
Аннотация
Исследованы видовой состав и распределение свободноживущих инфузорий планктона в русловой части водохранилищ Средней и Нижней Волги в период конца гидрологической весны 2016 г. и в летнюю межень 2017 г. Показана тенденция снижения видового разнообразия инфузорий вниз по каскаду волжских водохранилищ, расширены представления о распространении некоторых редких видов и распределении по Волжскому каскаду основных групп структурообразующих видов из отрядов Tintinnida и Choreotrichida. Численность инфузорий на участке от плотины Рыбинской ГЭС до г. Астрахань варьировала в пределах 20–4785 тыс. экз./м3, биомасса – 0.1–254 мг/м3. Наибольшие видовое разнообразие, обилие и продукция инфузорий зарегистрированы в Горьковском и Чебоксарском водохранилищах, а также на незарегулированном участке Нижней Волги, что обусловлено более высоким уровнем трофности. Обсуждались факторы, определяющие сезонные и межгодовые различия распределения инфузорий в р. Волге.
ВВЕДЕНИЕ
Инфузории – важнейший структурно-функциональный компонент пресноводных экосистем, в том числе крупных рек и водохранилищ. Изучение их разнообразия и экологического значения в экосистеме р. Волги проводится >100 лет. Первые работы относятся к периоду до создания каскада водохранилищ, в них приведены списки видов инфузорий в составе других групп простейших и немногочисленные сведения об их обилии (Волга…, 1978). В последующие годы инфузорий исследовали, в основном, на Верхней Волге (Мордухай-Болтовская, Сорокин, 1965) и в авандельте реки (Косова, 1965). Восполнили пробел в изучении данной группы гидробионтов работы Н.В. Мамаевой и З.М. Мыльниковой, исследовавших видовой состав и количественное развитие инфузорий всех водохранилищ Волжского каскада в разные сезоны 1971–1974 гг. (Волга…, 1978; Мамаева, 1979, 1986) и 1989 г. (Мыльникова, 1990).
После заполнения в 1981–1982 гг. Чебоксарского и Нижнекамского водохранилищ инфузорий подробно исследовали в водоемах Средней и Нижней Волги (Жариков, Ротарь, 1992, 1994; Ротарь, 1995). Функционирование сообществ инфузорий В.В. Жариков рассматривал в рамках “каскадной” концепции, согласно которой “природная экосистема р. Волги расчленена на индивидуальные экосистемы водохранилищ с разной интенсивностью техногенных внутриводоемных процессов” (Жариков, 1998, 2000). Этот подход расходится с принципом континуальности, который применяют для описания функционирования ненарушенных водотоков (Vannote et al., 1980). В качестве главных факторов, влияющих на формирование условий обитания и жизнедеятельность гидробионтов, отмечали режим уровня воды, а также внешний водообмен (годовой приток) и внутренний водообмен (режим сброса воды через плотину), последний определяется параметрами работы ГЭС (Жариков, 2000).
В настоящее время большое внимание уделяют роли инфузорий как компонента “микробной петли” (Копылов и др., 2010; Копылов, Косолапов, 2011; Косолапов и др., 2017). Однако инфузории остаются недостаточно изученной группой планктона. До сих пор справедливо замечание Мамаевой (1979), что эта группа простейших “выпадает из поля зрения гидробиологов”.
Цель работы – оценить современное разнообразие инфузорий планктона, выявить редкие виды и уточнить границы их распространения, а также характер распределения сообщества и вариаций характеристик в каскаде водохранилищ Средней и Нижней Волги.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Инфузорий изучали в комплексных экспедициях, организованных Институтом биологии внутренних вод РАН летом 2016 и 2017 гг. Водохранилища р. Волги обследовали 2–20 июня 2016 г. (конец гидрологической весны–начало лета) и 15–31 августа 2017 г. (летняя межень) от пос. Борок (Ярославская обл.) до г. Астрахань (рис. 1). Кроме того, 12–19 августа 2016 г. исследовали участок р. Волги от пос. Борок до устья р. Камы. Согласно данным (Волга…, 1978), Горьковское, Чебоксарское и Куйбышевское водохранилища относили к Средней Волге, Саратовское и Волгоградское водохранилища с участком реки ниже Волжской ГЭС – к Нижней Волге.
Рис. 1.
Карта-схема расположения станций (○) отбора проб в водохранилищах Средней и Нижней Волги в июне и августе 2016 г. и в августе 2017 г.
Пробы отбирали в русловой части водохранилищ послойно батометром с интервалом 1 м от поверхности до глубины 10 м и с интервалом 2 м с глубины >10 м до дна. Сборы со всех горизонтов объединяли и анализировали как одну пробу, всего просмотрено 194 интегральных проб. Видовую принадлежность инфузорий определяли в живом состоянии, а также с использованием импрегнации азотнокислым серебром и окраски ядер по Фельгену. Количество инфузорий учитывали на временных препаратах, фиксированных сулемой, продукцию рассчитывали “физиологическим” методом (Винберг, 1983; Хлебович, 1983).
Трофические группы выделяли по методике (Pratt, Cairns, 1985), однако, “фототрофов” (миксотрофов) рассматривали как важную экологическую группу независимо от типа их питания (Mitra et al., 2016; Weisse, 2017). Размерную структуру инфузорий анализировали по объему клеток, в соответствии с методикой (Уманская, 2004). Видовое разнообразие оценивали с использованием индексов H, выровненности Пиелу (E), Di в модификации (Шитиков и др., 2003). Последний учитывает совместно три показателя: частоту встречаемости, численность и биомассу. Также оценивали отдельно ν, % и $D_{{\text{f}}}^{{\text{1}}}$ при численности вида >10% общего количества инфузорий. Количество проб, когда вид занимал первое место по вкладу в общую численность инфузорий хотя бы в одной из проб, считали Df в более узком понимании, как изначально предлагал Де Фриз (Баканов, 2005). К доминантам относили виды, численность которых превышала 10% общей, к субдоминантам – виды, вклад которых в общую численность был выше 1%. Частоту встречаемости и доминирования видов оценивали по каскаду водохранилищ в целом.
Коэффициент сходства видового состава Съеренсена рассчитывали по формуле: KS = = 2с/(a + b), где а и b – число видов в каждом из сравниваемых сообществ, с – число общих для них видов.
При построении дендрограммы различий видового состава инфузорий использовали эвклидово расстояние, группировку выполняли методом Варда. Для оценки степени изученности фауны инфузорий строили кумулятивные кривые с использованием непараметрического метода разрежения Колуэлла–Мао (Шитиков и др., 2010). Данные по Хл а и его содержанию в крупных таксонах водорослей взяты из работы Минеевой (Минеева, 2018).
Район исследования. Волжские водохранилища относятся к крупным равнинным водоемам. Наибольшие по площади и объему – Куйбышевское (при нормальном подпорном уровне 6450 км2 и 57.3 км3) и Волгоградское (3120 км2 и 31.4 км3) водохранилища. Самые глубокие – Куйбышевское, Саратовское и Волгоградское водохранилища (максимальная глубина 33–41 м), наиболее проточные Чебоксарское (коэффициент условного водообмена 20 год–1) и Саратовское (18 год–1) (Эдельштейн, 1998). Площадь мелководий максимальна в Чебоксарском водохранилище (до 31% площади акватории) (Корнева, 2015). Боковая приточность снижается в каскаде с севера на юг с 36–54% годового притока в Горьковском и Чебоксарском водохранилищах до 1–2% в Саратовском и Волгоградском (Волга…, 1978; Эдельштейн, 1998; Корнева, 2015). Река Волга от верховьев до дельты протекает через лесную, лесостепную, степную и полупустынную зоны. Географическая зональность бассейна приводит к последовательному изменению абиотических характеристик среды обитания гидробионтов: с севера на юг увеличиваются прозрачность и общая минерализация (в частности, возрастает вклад хлорид-ионов), снижаются цветность и содержание взвешенных веществ (Минеева, 2007; Дебольский и др., 2010; Корнева, 2015; Цельмович, Отюкова, 2018).
Гидрологический и термический режимы 2016 и 2017 гг. сильно различались. Особенность 2016 г. ‒ сильный прогрев воды, ее температура от Рыбинского водохранилища до дельты р. Волги существенно (на 1.4–3.1°С в июне и >3.2°С в августе) превышала норму (Лазарева и др., 2018в). В начале лета 2016 г. средняя температура воды плавно снижалась от 19.3°С в Горьковском водохранилище до 17.6°С в Куйбышевском, ниже к дельте р. Волги она повышалась до 19.9°С. В конце лета 2017 г. температура воды равномерно возрастала с севера на юг от 20.3 до 23.9°С. Особенность 2017 г. в том, что он был одним из самых многоводных, по сравнению с периодом наблюдений 1978–2013 гг. Так, приток воды в р. Волгу в июле и августе 2017 г. достигал 208 и 150% соответственно (Цветков, Цветкова, 2018).
Кислородный режим в июне 2016 г. и августе 2016 и 2017 гг. был в целом благоприятным для гидробионтов во всех водохранилищах (Лазарева и др., 2018в). В период сильного прогрева водной толщи на отдельных станциях Горьковского водохранилища (вблизи г. Чкаловск) и Чебоксарского водохранилища (в устье р. Ветлуги) в придонном горизонте отмечали дефицит растворенного кислорода; на Нижней Волге насыщение кислородом у дна <50% зафиксировано лишь в Волгоградском водохранилище (устьевая область р. Еруслан).
Среднее содержание Хл а в последние годы характеризует Чебоксарское водохранилище как эвтрофное, Горьковское и Куйбышевское – умеренно эвтрофные, Саратовское и Волгоградское – мезотрофные (Минеева, Макарова, 2018), незарегулированный участок р. Волги – как умеренно эвтрофный (Минеева, 2018).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Видовое богатство и разнообразие (рис. 2). В 2016 и 2017 гг. в русловой части водохранилищ Средней и Нижней Волги зарегистрировано >150 видов инфузорий: 129 видов в июне и августе 2016 г. и 115 видов ‒ в августе 2017 г. График зависимости числа выявленных видов от числа проб указывает на высокое потенциальное разнообразие инфузорий – при числе наблюдений >200 кривая не выходит на плато (рис. 2а). Одновременно это свидетельствует о неполно выявленном видовом богатстве сообщества. Однако по результатам двух лет исследований ~70% видов обнаружены после отбора лишь 16–18% всех проб.
Рис. 2.
Видовое разнообразие и сходство видового состава сообществ инфузорий водохранилищ Средней и Нижней Волги в 2016‒2017 гг: a, б ‒ кумулятивные кривые видового богатства в целом и в отдельных водохранилищах соответственно; в ‒ дендрограмма сходства видового состава инфузорий различных водохранилищ в июне 2016; г ‒ кривые доминирования-разнообразия (по оси абсцисс – номер вида в порядке убывания его численности). 1 – Горьковское водохранилище, 2 – Чебоксарское, 3 – Куйбышевское, 4 – Саратовское, 5 – Волгоградское, 6 – незарегулированный участок Нижней Волги, 7 – июнь 2016 г., 8 – август 2017 г.
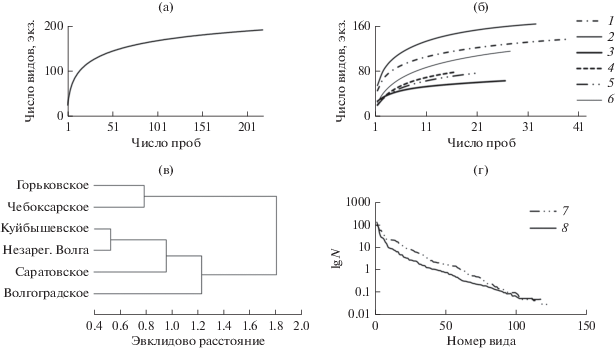
Сходство фауны инфузорий в июне 2016 г. и августе 2017 г. было высоким и достигало 76%. В разные гидрологические периоды наблюдали однотипное изменение уровня сходства фауны водохранилищ вниз по течению р. Волги. Коэффициент сходства Съеренсена на Средней Волге снижался в июне с 52 до 24%, в августе ‒ с 62 до 27%, на Нижней Волге, напротив, он возрастал в июне с 18 до 29%, в августе ‒ с 35 до 39%. По результатам кластерного анализа наиболее близкими по составу видов оказались сообщества инфузорий Горьковского и Чебоксарского водохранилища, сообщество Куйбышевского водохранилища группировалось с таковыми водохранилищ Нижней Волги (рис. 2в).
Наибольшие значения числа видов в общем списке и в пробе, а также таксономического разнообразия наблюдали в сообществе инфузорий Чебоксарского водохранилища, наименьшие – Волгоградского (табл. 1). Существенное влияние на формирование видового богатства инфузорий Чебоксарского водохранилища оказывала фауна р. Оки. В августе 2016 г. на трех русловых станциях в ее нижнем течении зарегистрирован 71 вид, с учетом станций в открытой литорали и зарослях макрофитов – 86 видов. Кумулятивные кривые хорошо демонстрировали различия видового богатства инфузорий планктона разных водохранилищ р. Волги (рис. 2б). Удельные показатели видового богатства и разнообразия инфузорий водохранилищ Средней Волги были наиболее высокими в июне 2016 г. (табл. 1). В августе 2017 г. отмечали более высокий уровень доминирования в сообществе инфузорий, по сравнению с июнем предыдущего года (рис. 2г), что привело к снижению видового разнообразия.
Таблица 1.
Число видов (S) и индекс видового разнообразия Шеннона (H) сообщества инфузорий в водохранилищах Средней и Нижней Волги в 2016–2017 гг.
| Водохранилище | 2016 г. | 2017 г. | ||||
|---|---|---|---|---|---|---|
| июнь | август | август | ||||
| S | H | S | H | S | H | |
| ГВ | 78 (27 ± 12) | 4.41 (3.56 ± 0.64) | 66 (18 ±11) | 4.72 (2.95 ± 1.23) | 46 (16 ± 5) | 3.88 (3.18 ± 0.44) |
| ЧВ | 90 (38 ± 11) | 4.64 (3.95 ± 0.57) | 68 (22 ± 10) | 4.78 (3.69 ± 0.57) | 73 (23 ± 9) | 4.51 (3.62 ± 0.21) |
| КВ | 64 (20 ± 8) | 4.50 (3.32 ± 0.51) | 33 (13 ± 4) | 4.23 (3.18 ± 0.44) | 63 (19 ± 6) | 4.06 (3.28 ± 0.39) |
| СВ | 49 (18 ± 11) | 4.00 (2.96 ± 0.92) | – | – | 57 (19 ± 4) | 4.03 (3.27 ± 0.39) |
| ВВ | 49 (19 ± 5) | 3.94 (3.09 ± 0.22) | – | – | 51 (18 ± 7) | 3.42 (2.97 ± 0.51) |
| нВ | 74 (25 ± 10) | 4.37 (3.45 ± 0.48) | – | – | 82 (21 ± 13) | 3.93 (3.01 ± 0.58) |
| Всего S/H | 116 | 4.99 | 89 | 5.04 | 115 | 4.29 |
Примечание. В скобках – M ± SD; “–” – данные отсутствуют. Здесь и в табл. 2, 3 водохранилища: РВ – Рыбинское, ГВ – Горьковское, ЧВ – Чебоксарское, КВ – Куйбышевское, СВ – Саратовское, ВВ – Волгоградское, нВ – незарегулированный участок р. Волги ниже Волжской ГЭС.
Состав видов и структура сообщества. В 2016 и 2017 гг. выявлен ряд таксонов, ранее не встречавшихся в р. Волге: Urotricha simonsbergeri Foissner, Berger et Schaumburg 1999; Urotricha venatrix Kahl, 1935; Spiretella plancticola Gelei, 1933; Wenrichia (=Disematostoma) colpidioides (Gelei, 1954) Velistoma et Yankovskij, 1980; Nassula citrea Kahl, 1930; Acineta cf. fluviatilis Stokes, 1885; Euplotes cf. woodruffi Gaw, 1939; Trachelocerca sp.; Plagiocampa sp.; Pelagostrobilidium sp. и два неидентифицированных вида рода Strombidium.
Отмечена низкая встречаемость большинства видов инфузорий, что свидетельствует о высокой пространственной гетерогенности их распределения. Только 11 видов (6% общего количества) встречались в >50% проб (табл. 2). Около 25% видов обнаружены в <1% проб, среди них: Aspidisca turrita (Ehrenberg, 1831) Claparède et Lachmann, 1858, Pelagovasicola cinctum (Voigt, 1901) Jankowski, 1980, Trithigmostoma srameki Foissner, 1988, Discophrya sp., Leptopharynx costatus Mermod, 1914, Placus luciae Kahl, 1926, Vorticella chlorellata Stiller, 1940 и др. Единично найдены виды, ранее упоминавшиеся Н.В. Мамаевой (1979): Teuthophrys trisulca Chatton et de Beauchamp, 1923, Paradileptus elephantinus (Svec, 1897) Kahl, 1931, Marituja pelagica Gajewskaja, 1928, последние два вида были массовыми в Куйбышевском и Волгоградском водохранилищах.
Таблица 2.
Особенности видовой структуры инфузорий русловой части водохранилищ Волжского каскада в июне 2016 и августе 2017 гг.
| Вид | Водохранилище | По всему каскаду | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| РВ | ГВ | ЧВ | КВ | СВ | ВВ | нВ | Di | ν | $D_{{\text{f}}}^{1}$ | Df | |
| Rimostrombidium lacustris (Foissner, Skogstad et Pratt, 1988) | + | + | + | + | + | + | + | 8.20 | 89 | 19.0 | 4 |
| Tintinnopsiscylindrata Kof. et Cam., 1892 | + | д | + | д | + | д | д | 4.24 | 90 | 61.0 | 34 |
| Tintinnidium fluviatile (Stein, 1863) | д | д | + | + | + | + | д | 3.20 | 74 | 18.0 | 4 |
| Stokesia vernalis Wenrich, 1929 | 0 | <1 | <1 | + | <1 | + | + | 2.97 | 36 | 7.0 | 5 |
| Rimostrombidium hyalinum (Mirabdullaev, 1985) | + | + | + | д | д | д | + | 2.93 | 92 | 47.0 | 18 |
| Urotricha spp. (U. farcta Clap. et Lachmann, 1859 + U. furcata Schewiakoff, 1892) | д | + | + | + | д | д | + | 1.41 | 84 | 22.0 | 6 |
| Pelagostrombidium mirabile (Penard, 1916) | + | + | <1 | + | + | + | <1 | 1.38 | 56 | 8.0 | 0.6 |
| Limnostrombidium pelagicum (Kahl, 1932) | + | + | + | + | + | + | + | 1.07 | 67 | 8.0 | 3 |
| Halteria grandinella (Müller, 1773) | + | + | + | + | + | + | + | 0.92 | 72 | 8.0 | 1.8 |
| Codonella cratera (Leidy, 1887) | + | + | + | + | <1 | <1 | <1 | 0.79 | 52 | 11.0 | 4 |
| Calyptotricha lanuginosa (Penard, 1922) | 0 | <1 | д | <1 | <1 | <1 | + | 0.55 | 31 | 4.0 | 1.2 |
| Balanion planctonicum (Foissner, Oleksiv et Müller, 1990) | <1 | + | + | + | д | + | <1 | 0.42 | 55 | 9.0 | 3 |
| Askenasia volvox (Eichwald, 1852) | <1 | + | <1 | + | <1 | <1 | <1 | 0.37 | 53 | 0.6 | – |
| Paradileptus conicus Wenrich, 1929 | <1 | <1 | <1 | <1 | 0 | <1 | <1 | 0.34 | 33 | 0.6 | – |
| Urotricha pelagica Kahl, 1935 | 0 | <1 | + | <1 | <1 | <1 | + | 0.33 | 39 | 1.2 | 0.6 |
| Vorticella spp. | + | + | + | <1 | <1 | 0 | <1 | 0.26 | 36 | 5.0 | 1.8 |
| Rimostrombidium humile (Penard, 1922) | + | <1 | + | + | + | <1 | <1 | 0.24 | 44 | 5.0 | 4 |
| Pelagostrobilidium sp. | 0 | 0 | 0 | <1 | + | + | + | 0.19 | 21 | 2.4 | 1.8 |
| Coleps hirtus viridis Ehrenberg, 1831 | 0 | <1 | + | <1 | <1 | <1 | <1 | 0.19 | 38 | 0.6 | – |
| Epistylis procumbens Zacharias, 1897 | 0 | <1 | <1 | <1 | <1 | <1 | <1 | 0.17 | 20 | 0.6 | – |
| Limnostrombidium viride (Stein, 1867) | 0 | <1 | <1 | <1 | <1 | <1 | <1 | 0.16 | 31 | 0.6 | – |
| Cyclotrichium viride Gajewskaja, 1933 | 0 | <1 | 0 | <1 | <1 | <1 | <1 | 0.16 | 16 | 0.6 | – |
| Rhabdoaskenasia minima Krainer et Foissner, 1990 | <1 | <1 | <1 | + | <1 | <1 | <1 | 0.15 | 44 | 1.2 | – |
| Pelagovorticella natans (Faure-Fremiet, 1924) | <1 | <1 | + | <1 | <1 | 0 | <1 | 0.13 | 21 | 0.6 | – |
| Cinetochilum margaritaceum Perty, 1852 | + | <1 | <1 | + | + | + | 0 | 0.12 | 38 | 1.2 | – |
| Histiobalantium bodamicum Krainer et Muller, 1995 | д | + | <1 | <1 | <1 | 0 | 0 | 0.08 | 16 | 1.8 | 1.2 |
| Mesodinium pulex (Claparéde et Lachmann, 1858) | 0 | + | + | <1 | <1 | + | <1 | 0.07 | 22 | 2.4 | 0.6 |
| Actinobolina smalli Holt, Lynn et Corliss 1973 | 0 | <1 | <1 | <1 | <1 | <1 | <1 | 0.07 | 28 | 1.2 | – |
| Pseudohaplocaulus infravacuolatus Foissner et Brozek, 1996 | 0 | + | <1 | + | 0 | 0 | 0 | 0.06 | 6 | 2.4 | 2.4 |
| Tintinnidium fluviatile f. minima Mamaeva, 1979 | 0 | + | + | <1 | 0 | 0 | <1 | 0.05 | 20 | 0.6 | 0.6 |
| Rimostrombidium velox (Faure-Fr., 1924) | 0 | <1 | <1 | <1 | + | 0 | <1 | 0.05 | 21 | 0.6 | 0.6 |
| Sphaerophrya magna Maupas, 1881 | 0 | 0 | <1 | <1 | <1 | 0 | + | 0.02 | 8 | 1.2 | 0.6 |
Виды инфузорий в табл. 2 ранжированы по индексу Di. Первую позицию занял крупный Rimostrombidium lacustris (Foissner, Skogstad et Pratt, 1988), отличавшийся высокой встречаемостью (>80% проб). По численности, как правило, доминировали тинтинниды и мелкие хореотрихи (сем. Strobilidiidae, Rimostrombidium hyalinum), встречаемость которых достигала 70–90%.
Показатели частоты доминирования Df и $D_{{\text{f}}}^{{\text{1}}}$ дополняли характеристику структуры сообщества инфузорий, поскольку учитывали локальные максимумы численности видов. Согласно этим показателям, в число структурообразующих видов вошли Calyptotricha lanuginosa (Penard, 1922), многочисленная в устьевой области рек Ока и Ветлуга, Pseudohaplocaulus infravacuolatus Foissner et Brozek, 1996, обнаруженный ниже устья небольших притоков вблизи городов Ярославль и Кострома и р. Камы, а также Sphaerophrya magna Maupas, 1881, найденная в заливе у г. Астрахань (табл. 2).
Сезонные и пространственные вариации таксономической структуры. Основные таксоны (отряды Tintinnida, Choreotrichida, Prorodontida и подклассы Oligotrichia и Peritrichia) формировали 65–91% общей численности во всех водохранилищах р. Волги в июне 2016 г. и 74–89% ‒ в августе 2017 г. (рис. 3а, 3г). Отряды Tintinnida и Choreotrichida, как правило, дополняли друг друга и часто развивались в противофазе. Численность перитрих (особенно колониальных форм) в июне 2016 г. была в >3 раза выше, чем в августе 2017 г. (рис. 3а, 3г). До 71% биомассы инфузорий в Куйбышевском водохранилище и 19% в Саратовском вносил Epistylis procumbens Zacharias, 1897. Вклад Epicarchesium pectinatum (Zacharias, 1897) на некоторых станциях Чебоксарского водохранилища достигал 9% биомассы. В августе эти виды были единичны.
Рис. 3.
Соотношение численности основных таксономических групп инфузорий в водохранилищах Волжского каскада (а, г) и видов внутри лидирующих таксонов – отр. Tintinnida (б, д) и отр. Choreotrichida (в, е) – в июне 2016 г. (а, б, в) и августе 2017 г. (г, д, е). Здесь и на рис. 4 и 5 обозначения водохранилищ, как в табл. 1.
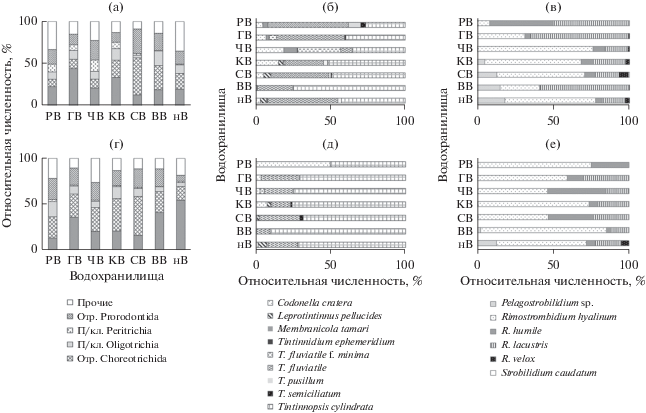
К массовым видам, как и в 1970-е годы, отнесены Tintinnidium fluviatile и Tintinnopsis cylindrata, которые по-разному распределены в каскаде водохранилищ. Вклад первого вида в численность инфузорий уменьшается вниз по течению р. Волги, вклад второго, напротив, увеличивается (рис. 3б, 3д). В Горьковском и Чебоксарском водохранилищах отмечены находки редких Membranicola tamari Foissner et al., 1999, Тintinnidium ephemeridium Hillard, 1968 и Тintinnidium fluviatile f. minima; на участке от устья р. Камы до дельты р. Волги – Leprotintinnus pellucidus.
Среди стробилидиид (отр. Choreotrichida) можно считать фоновым (встречаемость 92%) Rimostrombidium hyalinum (табл. 2, рис. 3в, 3е). Доминирующих в водохранилищах Средней Волги мелких R. humile и R. hyalinum в Нижней Волге заменяет R. lacustris. Во всех старых сводках (Мамаева, 1979; Мыльникова, 1990) как массовый вид указан R. velox (Faure-Fremiet, 1924). Однако в 2016–2017 гг. R. velox встречался редко (21% проб) и лишь в Саратовском водохранилище был в ранге субдоминанта (табл. 2, рис. 3в, 3е). Возможно, ранее как R. velox идентифицировали близкий вид R. lacustris. Область распространения нового для р. Волги рода Pelagostrobilidium начинается от слияния рек Волги и Камы, ниже по течению до г. Астрахани его роль в сообществе увеличивается (рис. 3в и 3е).
Таблица 3.
Численность, биомасса, продукция и суточные Р/В-коэффициенты сообществ инфузорий волжских водохранилищ в 2016 и 2017 гг.
| Водохранилище, трофность | Дата | Численность, тыс. экз./м3 |
Биомасса, мг/м3 |
Продукция, мг/(м3 сут) | P/B-коэффициент |
|---|---|---|---|---|---|
| РВ*, эвтрофное | 06.2016 | 888 | 14.8 | 8.6 | 1.14 |
| 08.2016 | 1208 | 20.6 | 19.3 | 0.88 | |
| 08.2017 | 372 | 7.2 | 5.1 | 0.71 | |
| ГВ, умеренно эвтрофное | 06.2016 | 1505 (43–4785) | 42.4 (0.9–132.4) | 24.0 (0.6–79.5) | 0.56 (0.35–0.83) |
| 08.2016 | 499 (24–1624) | 15.5(0.1–34.4) | 11.5 (0.2–32.2) | 0.85 (0.47–1.30) | |
| 08.2017 | 394 (84–740) | 8.9 (2.4–20.4) | 6.2 (1.5–11.7) | 0.72 (0.57–0.92) | |
| ЧВ, эвтрофное | 06.2016 | 1246 (304–2914) | 3.8 (6.1–55.7) | 17.7 (4.0–38.1) | 0.56 (0.45–0.65) |
| 08.2016 | 778 (52–3344) | 18.4 (1.2–66.1) | 14.4 (1.2–51.4) | 0.87 (0.61–1.06) | |
| 08.2017 | 497 (116–1380) | 12.9 (3.0–37.8) | 8.2 (2.8–23.9) | 0.71 (0.32–0.94) | |
| КВ, умеренно эвтрофное | 06.2016 | 279 (54–790) | 14.1(1.0–86.1) | 6.0 (0.8–26.1) | 0.44 (0.18–0.82) |
| 08.2016** | 198 (64–516) | 6.5 (0.5–26.3) | 5.9 (0.8–22.8) | 1.03 (0.5–1.4) | |
| 08.2017 | 458 (128–1104) | 19.8 (2.2–69.5) | 10.8 (1.8–23.8) | 0.66 (0.28–0.91) | |
| СВ, мезотрофное | 06.2016 | 282 (20–494) | 13.4 (0.1–46.0) | 5.1 (0.1–13.8) | 0.50 (0.26–0.92) |
| 08.2016 | – | – | – | – | |
| 08.2017 | 397 (140–936) | 20.7 (3.9–99.5) | 9.9 (3.0–32.6) | 0.70 (0.33–0.91) | |
| ВВ, мезотрофное | 06.2016 | 469 (98–1402) | 29.6 (1.2–108.3) | 12.4 (0.7–34.2) | 0.47 (0.29–0.60) |
| 08.2016 | – | – | – | – | |
| 08.2017 | 608 (40–2380) | 13.2 (0.8–37.2) | 8.9 (0.6–27.8) | 0.75 (0.39–1.00) | |
| нВ, умеренно эвтрофное | 06.2016 | 427 (74–1680) | 82.2 (7.2–254.8) | 30.9 (2.3–92.3) | 0.37 (0.28–0.58) |
| 08.2016 | – | – | – | – | |
| 08.2017 | 538 (20–1640) | 23.9 (0.6–112.6) | 15.8 (0.5–61.4) | 0.74 (0.54–0.88) | |
| Каскад в целом*** | 06.2016 | 705 ± 909 | 37.1 ± 46.6 | 16.7 ± 19.6 | 0.48 ± 0.14 |
| 08.2017 | 482 ± 407 | 15.7 ± 21.1 | 10.1 ± 10.4 | 0.71 ± 0.15 |
Примечание. Приведены средние, в скобках min–max; “–” – отсутствие данных; P/B-коэффициент – отношение количества продукции за cутки к средней за этот период биомассе. * Одна точка отбора проб. ** Только Волжский плес и часть Волго-Камского плеса Куйбышевского водохранилища от г. Новочебоксарск до п. Камское устье. *** Среднее и его стандартное отклонение.
Обилие и продукция. Численность инфузорий варьировала в начале лета 2016 г. от 20 до 4785 тыс. экз./м3, в конце лета (водохранилища Средней Волги) – от 24 до 3344 тыс. экз./м3, в конце лета 2017 г. – от 20 до 2380 тыс. экз./м3; биомасса изменялась в пределах 0.07–254, 0.1–66.2 и 0.6–112.6 мг/м3 соответственно. Среднее количество инфузорий за счет высокой численности в Горьковском и Чебоксарском водохранилищах было выше в июне 2016 г., по сравнению с августом 2017 г. (табл. 3). Сезонные различия были отчетливо выражены в водохранилищах Средней Волги в 2016 г. Так, в июне средние численность (1106 тыс. экз./м3) и биомасса (30 мг/м3) были вдвое выше, чем в августе (559 тыс. экз./м3 и 14 мг/м3, соответственно). Наибольшую численность инфузорий регистрировали в июне 2016 г. на станциях Волгореченск и Плес (Горьковское водохранилище), в августе – в устье р. Оки (Чебоксарское водохранилище); в августе 2017 г. – в устье р. Еруслан (Волгоградское водохранилище) (рис. 4). Максимальные значения их биомассы отмечены в незарегулированном участке Нижней Волги на станциях Замьяны (2016 г.) и Тулугановка (2017 г.) (рис. 4).
Рис. 4.
Изменение по каскаду волжских водохранилищ численности, биомассы инфузорий и температуры воды (°С) в июне 2016 г. (а) и августе 2017 г. (б). 1 – численность, 2 – биомасса, 3 – температура воды на поверхности, 4 – у дна.
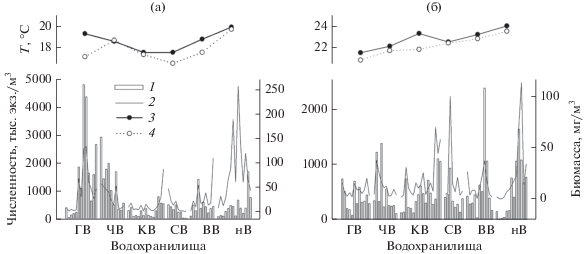
Коэффициент вариации численности в разные периоды достигал 85–129%, биомассы – 126–128%, что указывало на высокую гетерогенность обилия инфузорий по каскаду р. Волги. В июне 2016 г. количество инфузорий было более вариабельно на Средней Волге, в августе 2017 г. – на Нижней Волге. Коэффициент вариации численности в 2017 г. возрастал вниз по течению р. Волги от 53 до 106%, при этом медианы численности изменялись незначительно (в пределах 393–607 тыс. экз./м3).
Подъемы биомассы совпадали с высокой концентрацией Хл а (r = 0.90, р < 0.05) (рис. 5а). Кроме того, важное значение имело доминирование тех или иных крупных таксонов водорослей в структуре Хл а. Так, в Куйбышевском водохранилище, при низкой концентрации данного пигмента и преобладании в его составе Хл а цианобактерий (79% общего (Минеева, 2018)), биомасса инфузорий была минимальна. В незарегулированном участке Нижней Волги (рис. 5a), где основу Хл а составлял таковой диатомовых водорослей (88% (Минеева, 2018)), наблюдался резкий подъем биомассы инфузорий и преобладание в их сообществе альгофагов (например, Zosterodasys sp. и Strombidium sp. 2) с вакуолями, плотно наполненными диатомовыми водорослями. Кривые зависимости биомассы инфузорий от концентрации Хл а диатомовых водорослей (r = 0.91, р < 0.05) и цианобактерий (r = –0.47, р < 0.05) находились в противофазе (рис. 5б).
Рис. 5.
Изменение биомассы инфузорий (мг/м3) и содержания Хл а (мг/л) в водохранилищах Средней и Нижней Волги (а) и связь биомассы инфузорий с содержанием Хл а диатомовых водорослей и цианобактерий (б). 1 – общее содержание Хл а, 2, 4 – Хл а цианобактерий, 3, 5 – Хл а диатомовых водорослей; 6, 7 – линейные регрессии биомассы инфузорий и Хл а цианобактерий и диатомовых водорослей соответственно. Содержание Хл а приведено по: (Минеева, 2018).
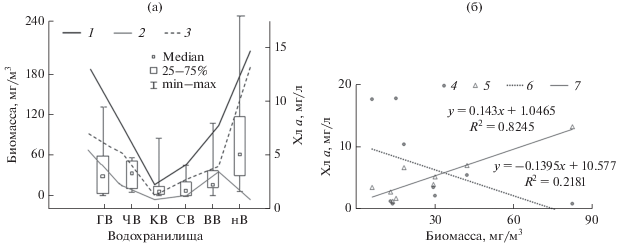
Продукция инфузорий варьировала в широких пределах (табл. 3): 0.1–92.3 мг/(м3 сут) в начале и 0.2–51.4 мг/(м3 сут) в конце лета 2016 г. (водохранилища Средней Волги) и 0.5–61.4 мг/(м3 сут) в конце лета 2017 г. Ее максимум зарегистрирован в незарегулированной части Нижней Волги в оба исследуемых периода, высокие значения (до 79.5 мг/(м3 сут)) отмечены также в Горьковском водохранилище в июне 2016 г. (табл. 3). Продукционные характеристики сообщества инфузорий волжских водохранилищ достоверно коррелировали с их трофическим статусом. Так, отмечена положительная связь с содержанием Хл а продукции инфузорий (r = 0.89, р < 0.05) и суточного P/B-коэффициента (r = 0.78, р < 0.05).
Размерная структура. Различия размерной структуры сообществ инфузорий Средней и Нижней Волги были наиболее выражены в июне 2016 г. (рис. 6а, 6б). В водохранилищах Средней Волги преобладали виды мелких и средних размерных фракций (объемом 3200 и 12 800 мкм3 соответственно), в Нижней Волге – мелких (3200 мкм3) и крупных (102 400 мкм3). Размерные спектры сообществ инфузорий Средней и Нижней Волги в августе 2017 г. были почти одинаковы (рис. 6а, 6б). Значения средней индивидуальной массы особи в сообществе обоих участков р. Волги в 2017 г. были очень близки (0.032 · 103 и 0.037 · 103 мг), а в 2016 г. на Нижней Волге они выше почти в 4 раза (0.120 · · 103 мг), чем на Средней Волге (0.026 · 103 мг). В целом, в июне в сообществах инфузорий доминировали виды объемом от 3200 до 12 800 мкм3 и регистрировался небольшой подъем в области крупноразмерной фракции (размеры этой группы даны чуть выше), обусловленный развитием крупных одиночных и колониальных видов, а в августе преобладали сравнительно мелкие виды объемом 3200 мкм3 (рис. 6а, 6б).
Рис. 6.
Вклад в общую численность различных размерных групп инфузорий (мкм3) на Средней (а), Нижней Волге (б) в июне 2016 г. и августе 2017 г. и в районе впадения р. Оки в р. Волгу в августе 2016 г. (в). 1 – июнь 2016 г., 2 – август 2017 г., 3 – р. Ока, 4 – Горьковское водохранилище, 5 – Чебоксарское водохранилище. Шкала по оси абсцисс логарифмирована.
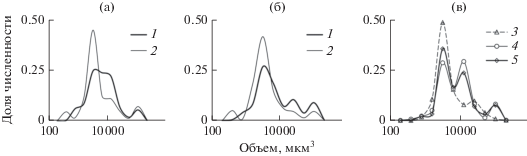
На соотношение численности размерных фракций инфузорий заметно влияло поступление видов из крупных притоков р. Волги. Например, среди инфузорий р. Оки преобладали мелкие виды Calyptotricha lanuginosa. Ниже ее устья структура сообщества Чебоксарского водохранилища также изменялась в сторону увеличения вклада инфузорий мелких размерных фракций (рис. 6в). Трансформация размерной структуры инфузорий вблизи плотин ГЭС носила случайный характер и была более заметна в июне. В верхних бьефах плотин при больших глубинах и низкой скорости течения формировались сравнительно выровненные по размеру сообщества (исключение ‒ плотины Рыбинской и Чебоксарской ГЭС). В нижних бьефах преобладали с высокой степенью доминирования сравнительно мелкие инфузории (плотины ГЭС Жигулевская, Саратовская и Волжская) или, напротив, крупные (плотины Рыбинской, Нижегородской и Чебоксарской ГЭС). В августе при высокой скорости течения и мощном развитии цианобактерий различия в структуре сообществ верхнего и нижнего бьефов плотин ГЭС были слабо выражены.
Трофическая структура. Соотношение трофических групп в сообществе инфузорий в период летней межени (август 2017 г.) фактически было одинаковым по всей р. Волге. В начале лета (июнь 2016 г.) вниз по течению достоверно снижался вклад бактерио-детритофагов (с 29 до 10% численности и с 22 до 6% биомассы) и возрастал вклад альгофагов (с 25 до 48% численности и с 51 до 77% биомассы).
Миксотрофные (симбионтосодержащие) инфузории формировали в водохранилищах р. Волги небольшую часть численности: в среднем 12–28% в начале и 6–11% в конце лета. Однако среди волжских миксотрофов присутствовало много крупных видов (Stokesia vernalis, Pelagodileptus trachelioides (Zacharias, 1894), Disematostoma butschlii Lauterborn, 1894 и др.), поэтому их вклад в биомассу достигал 23–82% в 2016 г. и 16–28% в 2017 г. В августе 2017 г. из-за дождевых паводков увеличился сток воды по р. Волге (Цветков, Цветкова, 2018). Как результат, уменьшились различия между Средней и Нижней Волгой по вкладу миксотрофных инфузорий в общую численность (8 и 7% соответственно) и биомассу (18 и 23% соответственно). В июне 2016 г. вклад миксотрофов в водохранилищах Средней Волги был существенно выше, чем в Нижней Волге – 18 и 9% численности и 46 и 29% биомассы инфузорий соответственно.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По сравнению с данными 1970-х гг. (Мамаева, 1979), состав массовых видов инфузорий р. Волги в основном остался прежним, но изменилась значимость в сообществе некоторых видов. Идентификация и количественный учет пресноводных тинтиннид затруднителен (Foissner, Wilbert, 1979; Dolan, Gallegos, 2001; Dolan et al., 2013; Ganser, Agatha, 2019). Вследствие этого, соотношение численности родов Tintinnidium и Tintinnopsis в наших исследованиях (табл. 2) отличается от такового в работе Н.В. Мамаевой (1979). В планктоне р. Волги зарегистрировано 9 видов тинтиннид. Кроме перечисленных выше, обнаружены Tintinnidium pusillum Entz, 1909 и T. semiciliatum (Sterki, 1879). В 1970–1980-е гг. Codonella craterа была массовым видом в р. Волге (Мамаева, 1979), в 2016 и 2017 гг. она встречалась реже и была менее обильна, хотя в водохранилищах р. Камы этот вид до сих пор входит в состав доминантов (Быкова, 2017, 2019). Кроме того, уменьшилась численность колониальных перитрих и количество зооидов в их колониях.
Не выявлено достоверной корреляции удельных показателей видового богатства и разнообразия с географической широтой. Однако эти показатели, рассчитанные по усредненным данным для каждого водоема (интегральные), уменьшаются вниз по течению р. Волги. Подобная тенденция выявлена и для таксономического разнообразия фитопланктона (Корнева, 2015). Направленные изменения видового богатства и разнообразия с севера на юг, по-видимому, характерны для всей биоты р. Волги (Приймаченко, 1981; Корнева, 2002, 2009; Лазарева и др., 2018a). Однако в Нижней Волге ближе к дельте реки это прослеживается не всегда (Лазарева и др., 2018б; данные автора). В сибирских реках флористическое богатство планктонных водорослей увеличивается от истока к устью (Воробьева, 1995; Корнева, 2015), в европейских реках, напротив, снижается в этом направлении (Приймаченко, 1981; Корнева, 2015). В обоих случаях видовое богатство выше в северной части бассейна рек. Вероятно, это связано с увеличением с юга на север плотности гидрографической сети (Корнева, 2009).
Для небольших организмов, в частности простейших, отмечена малая достоверность корреляции видового разнообразия с широтным градиентом (Hillebrand, Azovsky, 2001; Azovsky et al., 2016). Однако показано (Dolan, Gallegos, 2001; Dolan et al., 2013), что морские тинтинниды демонстрируют пример “стереотипного” широтного градиента разнообразия. Общее число видов инфузорий и индекс разнообразия в водоемах Средней Волги (125 видов, H = 4.92) несколько выше, чем в Нижней Волге (116, 4.46). Таксономическое разнообразие инфузорий Средней Волги тесно связано (r = = 0.86–0.97, p < 0.05) с выносом видов из мелководий и притоков, что наиболее четко проявляется в конце весны – начале лета. Фауна крупных притоков богата видами (р. Окa – 71 вид, H = 4.09, р. Камa – 81 вид, H = 4.89) и существенно пополняет разнообразие инфузорий Средней Волги (Быкова, Жариков, 2019). Выровненность распределения инфузорий отрицательно коррелирует с глубиной (r = –0.91) и минимальна в глубоких водохранилищах Нижней Волги.
За более 45-летний период (с 1972 г.) численность инфузорий во всех водохранилищах р. Волги снизилась в среднем в 2–3 раза, наиболее сильно (в 4.8–6.2 раза) с 1987 г. в Куйбышевском водохранилище. Однако следует учесть тот факт, что Н.В. Мамаева (1979) проводила исследования в маловодную фазу (1963–1977-й гг.) стока р. Волги, наши данные получены для многоводной фазы. Это несколько осложняет сопоставление современных результатов с полученными ранее. В целом, количество инфузорий в волжских водохранилищах, как и полвека назад, ниже, чем в водохранилищах и лиманах р. Днепр (Ковальчук, 1997).
Для волжских водохранилищ ранее указывали на уменьшение численности инфузорий в направлении к плотинам ГЭС (Мамаева, 1979). В 2016 и 2017 гг. не отмечено этой закономерности ни по акватории отдельных водохранилищ, ни по всему каскаду (рис. 4). При этом выявлена большая вариабельность обилия инфузорий в июне на Средней Волге и августе на Нижней Волге. Вероятно, в период окончания половодья это вызвано влиянием на формирование сообщества инфузорий повышенной боковой приточности, которая способствует неравномерному развитию инфузорий, тогда как в конце лета в низовьях р. Волги сказывается влияние прибрежной водной растительности. Численность инфузорий положительно коррелировала с площадью мелководий (r = = 0.89, р < 0.05) и долей бокового притока (r = = 0.83, р < 0.05).
Заметное влияние оказывали также особенности прогрева воды в июне. Из-за аккумуляции в водохранилищах Верхней Волги сравнительно теплых талых вод и сброса вниз по р. Волге холодных зимних, в мае и июне температура воды в нижневолжских водохранилищах ниже, чем в расположенных выше по каскаду (Литвинов, 1999). В июне 2016 г., когда период весеннего половодья уже заканчивался, температура воды в Горьковском и Чебоксарском водохранилищах была на 0.7–1.0°С выше, чем в расположенных ниже по каскаду Куйбышевском и Саратовском водохранилищах, а в Волгоградском водохранилище и на незарегулированном участке Нижней Волги вода уже успела прогреться лучше, по сравнению с ними, на 1.1–1.2°С. В результате, в июне самая низкая температура отмечена в Куйбышевском (17.6°С у поверхности и 17.4°С у дна) и Саратовском водохранилищах (17.6 и 16.6°С), что отразилось на развитии инфузорий (рис. 4).
Влияние температуры воды четко прослеживается в изменении структуры сообщества инфузорий. Так, при более высоком (на 2°С) прогреве водной толщи в августе 2016 г., по сравнению с августом 2017 г., на участке р. Волги от Рыбинской ГЭС до устья р. Камы в трофической структуре сообщества был вдвое выше вклад бактерио-детритофагов (до 44% общей численности) и втрое – вклад гистофагов (до 2.7%). Эти группы инфузорий потребляют разлагающееся органическое вещество и бактериопланктон и активнее развиваются при повышенной температуре. Для всего массива данных (194 пробы) выявлена достоверная положительная корреляция с температурой воды биомассы инфузорий (r = 0.27, р < 0.05) и средней индивидуальной массы (r = 0.33, р < 0.05).
Уровень развития инфузорий зависит также от степени “цветения” воды цианобактериями (Tirjaková et al., 2016). В летнюю межень 2017 г. сравнительно низкое количество инфузорий и узкий диапазон варьирования их обилия, вероятно, определялись массовым развитием цианобактерий, а также повышенным стоком р. Волги. Воздействием тех же факторов можно объяснить особенности структурной организации сообщества в 2017 г. – высокую степень доминирования на уровне видов и крупных таксонов, преобладание мелкой фракции и однородность размерного спектра инфузорий Средней и Нижней Волги, верхних и нижних бьефов плотин ГЭС, сходное соотношение трофических группировок по всей р. Волге и сравнительно низкую долю миксотрофных инфузорий (табл. 3, рис. 3 и 6).
Отмеченные нами подьемы численности инфузорий в Горьковском и Чебоксарском водохранилищах, а также на незарегулированном участке ниже Волжской ГЭС наблюдались и ранее (Мамаева, 1979). Они обусловлены повышенной трофностью этих участков реки (Минеева, Макарова, 2018). Трофический статус является основным фактором, определяющим пространственное распределение и временные вариации количества и размеров тела планктонных инфузорий (Ковальчук, 1997; Velho et al., 2005).
Выводы. В 2016 и 2017 гг. выявлена тенденция снижения видового разнообразия инфузорий вниз по каскаду волжских водохранилищ. Не обнаружено единой закономерности распределения их сообществ по акватории отдельных водохранилищ или в целом по Средней и Нижней Волге. Это не позволило применить к распределению инфузорий в условиях каскада крупных водохранилищ ни гипотезу континуальности, ни гипотезу дискретности. Выявлены различия в распределении общего количества и характеристик структуры сообщества инфузорий в разные сезоны года. В конце гидрологической весны (июнь) они определялись повышенной боковой приточностью и особенностями температурного режима, в период летней межени (август) – необычно высоким притоком вод дождевых паводков и “обычным” массовым развитием цианобактерий, что привело к снижению видового разнообразия и обилия инфузорий.
Список литературы
Баканов А.И. 2005. Количественная оценка доминирования в экологических сообществах // Количественные методы экологии и гидробиологии (Сборник научных трудов, посвященный памяти А.И. Баканова). Тольятти: Самap. науч. центр РАН. С. 37.
Быкова С.В. 2017. Инфузории бассейна Камского водохранилища и его сапробиологическая оценка // Вода: химия и экология. № 8. С. 48.
Быкова С.В. 2019. Свободноживущие инфузории глубоководной части камских водохранилищ // Тр. Инст. биол. внутр. вод РАН. № 85(88). С. 23. https://doi.org/10.24411/0320-3557-2019-10003
Быкова С.В., Жариков В.В. 2019. Биоразнообразие и особенности развития инфузорий планктона в зоне слияния рек Волги и Камы // Учен. зап. Казан. ун-та. Сер. Естеств. науки. Т. 161. Кн. 1. С. 172. https://doi.org/10.26907/2542-064X.2019.1.141-157
Винберг Г.Г. 1983. Температурный коэффициент Вант-Гоффа и уравнение Аррениуса в биологии // Журн. общ. биол. Т. 44. Вып. 1. С. 31.
Волга и ее жизнь. 1978. Ленинград: Наука.
Воробьева С.С. 1995. Фитопланктон водоемов Ангары. Новосибирск: Наука. Сибирская издат. фирма РАН.
Дебольский В.К., Григорьева И.Л., Комиссаров А.Б. и др. 2010. Современная гидрохимическая характеристика реки Волга и ее водохранилищ // Вода: химия и экология. № 11. С. 2.
Жариков В.В. 1998. Концепция природно-техногенного каскадного комплекса экосистем волжских водохранилищ // Экологические проблемы бассейнов крупных рек-2: Тез. докл. Тольятти. С. 15.
Жариков В.В. 2000. Специфика водохранилищ Волги как среды обитания гидробионтов (на примере свободноживущих инфузорий) // Теоретические проблемы экологии и эволюции (Третьи Татищевские чтения). Тольятти: Ин-т биол. Волжского бассейна РАН. С. 64.
Жариков В.В., Ротарь Ю.М. 1992. Состав фауны свободноживущих инфузорий Куйбышевского водохранилища // Биология внутренних вод: Информ. бюл. Санкт-Петербург: Наука. № 92. С. 19.
Жариков В.В., Ротарь Ю.М. 1994. К оценке реакции свободноживущих инфузорий водохранилищ Средней и Нижней Волги на изменения некоторых факторов среды // Биоиндикация: теория, методы, приложения. Тольятти: Ин-т экологии Волжского бассейна РАН. С. 205.
Ковальчук А.А. 1997. Свободноживущие планктонные инфузории Днепровско-Бугского лимана и их роль в продукционно-деструкционных процессах // Гидробиол. журн. Т. 33. № 4. С. 44.
Копылов А.И., Косолапов Д.Б. 2011. Микробная “петля” в планктонных сообществах морских и пресноводных экосистем. Ижевск: КнигоГрад.
Копылов А.И., Лазарева В.И., Пырина И.Л. и др. 2010. Микробная петля в планктонной трофической сети крупного равнинного водохранилища // Усп. совр. биол. Т. 130. № 6. С. 544.
Корнева Л.Г. 2002. Изменение разнообразия флоры и сообществ планктона водохранилищ р. Волги // Динамика разнообразия гидробионтов во внутренних водоемах России.. Ярославль: Изд-во Ярослав. гос. техн. ун-та. С. 24.
Корнева Л.Г. 2009. Формирование фитопланктона водоемов бассейна Волги под влиянием природных и антропогенных факторов: Автореф. дис. … докт. биол. наук. Санкт-Петербург: Институт озероведения РАН. 47 с.
Корнева Л.Г. 2015. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской печатный дом.
Косова А.А. 1965. Питание молоди рыб в култучной зоне и в авандельте Волги // Тр. Астраханского заповедника. № 10. С. 177.
Косолапов Д.Б., Копылов А.И., Косолапова Н.Г., Мыльникова З.М. 2017. Структура и функционирование “микробной петли” северного водохранилища // Биол. внутр. вод. № 1. С. 26–35.
Лазарева В.И., Сабитова Р.З., Быкова С.В. и др. 2018а. Распределение летнего зоопланктона в каскаде водохранилищ Волги и Камы // Тр. Ин-та биологии внутр. вод РАН. № 83(86). С. 62. https://doi.org/10.24411/0320-3557-2018-10030
Лазарева В.И., Сабитова Р.З., Соколова Е.А. 2018б. Особенности структуры и распределения позднелетнего (август) зоопланктона в водохранилищах Волги // Тр. Инcт. биологии внутр. вод РАН. Вып. 82(85). С. 28. https://doi.org/10.24411/0320-3557-2018-1-0011
Лазарева В.И., Степанова И.Э., Цветков А.И. и др. 2018в. Кислородный режим водохранилищ Волги и Камы в период потепления климата: последствия для зоопланктона и зообентоса // Тр. Инcт. биол. внутр. вод РАН. № 81(84). С. 47. https://doi.org/10.24411/0320-3557-2018-10005
Литвинов А.С. 1999. Энерго- и массообмен в водохранилищах Волжского каскада: Дис. … докт. геогр. наук в форме научного доклада. Борок. 63 с.
Мамаева Н.В. 1979. Инфузории бассейна Волги: Экологический очерк. Ленинград: Наука.
Мамаева Н.В. 1986. Инфузории как компонент планктонного сообщества: Автореф. дис. … докт. биол. наук. 34 с.
Минеева Н.М. 2007. Водохранилища как среда обитания гидробионтов // Тр. междунар. научно-практ. конф. “Современные проблемы водохранилищ и их водосборов”. Пермь. С. 254.
Минеева Н.М. 2018. Состав и содержание фотосинтетических пигментов в планктоне водохранилищ Волги (2015–2016 гг.) (Composition and content of photosynthetic pigments in plankton of the Volga River reservoirs (2015–2016)) // Тр. Ин-та биол. внутр. вод РАН. № 81(84). P. 85. https://doi.org/10.24411/0320-3557-2018-10006
Минеева Н.М., Макарова О.С. 2018. Содержание хлорофилла как показатель современного (2015–2016 гг.) трофического состояния водохранилищ Волги. № 3, С. 107–109.
Мордухай-Болтовская Э.Д., Сорокин Ю.И. 1965. Питание парамеций водорослями и бактериями // Тр. Инст. биол. внутр. вод АН СССР. № 8. С. 12.
Мыльникова З.М. 1990. Планктонные инфузории волжских водохранилищ // Биология внутренних вод: Информ. бюл. Ленинград: Наука. № 85. С. 41.
Приймаченко А.Д. 1981. Фитопланктон и первичная продукция Днепра и днепровских водохранилищ. Киев: Наукова думка.
Ротарь Ю.М. 1995. Планктонные инфузории Куйбышевского водохранилища: Дис. … канд. биол. наук. Санкт-Петербург.
Уманская М.В. 2004. Экологические особенности развития бактериопланктона малых эвтрофных озер Самарской Луки: Автореф. дис. … канд. биол. наук. Тольятти: Ин-т биологии волжск. бассейна РАН.
Хлебович Т.В. 1983. Методы изучения состояния кормовой базы рыбохозяйственных водоемов // Сб. тр. Гос.НИИ озер. и реч. рыб. хоз-ва. Вып. 196. С. 57.
Цветков А.И., Цветкова М.В. 2018. Приточность водохранилищ Волжско-Камского каскада в период экстремальной водности 2017 г. // Волга и ее жизнь: Сборник тезисов докладов Всероссийской конференции. Филигрань: Ярославль. С. 141.
Цельмович О.Л., Отюкова Н.Г. 2018. Содержание железа и главных компонентов солевого состава в воде волжских водохранилищ в период открытой воды 2015 года // Тр. Инст. биол. внутр. вод РАН. № 81(84). С. 7.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д. 2003. Количественная гидроэкология: методы системной идентификации. Тольятти: Ин-т экологии волжского бассейна РАН.
Шитиков В.К., Зинченко Т.Д., Абросимова Э.В. 2010. Непараметрические методы сравнительной оценки видового разнообразия речных сообществ макрозообентоса // Журн. общ. биол. Т. 71. № 3. С. 256.
Эдельштейн К.К. 1998. Водохранилища России: экологические проблемы, пути их решения. Москва: Геос.
Azovsky A.I., Tikhonenkov D.V., Mazei Y.A. 2016. An estimation of the global diversity and distribution of the smallest eukaryotes: biogeography of marine benthic heterotrophic flagellates // Protist. V. 167. № 5. P. 411.
Dolan J.R., Gallegos C.L. 2001. Estuarine diversity of tintinnids (planktonic ciliates) // J. Plankton Res. V. 23. № 9. P. 1009.
Dolan J.R., Montagnes D.J., Agatha S. et al. 2013. The biology and ecology of tintinnid ciliates: models for marine plankton. Chichester: Wiley-Blackwell: John Wiley & Sons.
Foissner W., Wilbert N. 1979. Morphologie, Infraciliatur und Ökologie der limnischen Tintinnina: Tintinnidium fluviatile Stein, Tintinnidium pusillum Entz, Tintinnopsis cylindrata Daday und Codonella cratera (Leidy) (Ciliophora, Polyhymenophora) // J. Protozool. V. 26. № 1. P. 90.
Ganser M.H., Agatha S. 2019. Redescription of Antetintinnidium mucicola (Claparède and Lachmann, 1858) nov. gen., nov. comb. (Alveolata, Ciliophora, Tintinnina) // J. Eukaryotic Microbiol. V. 66. № 5. P. 802. https://doi.org/10.1111/jeu.12728
Hillebrand H., Azovsky A.I. 2001. Body size determines the strength of the latitudinal diversity gradient // Ecography. V. 24. № 3. P. 251.
Mitra A., Flynn K.J., Tillmann U. et al. 2016. Defining planktonic protist functional groups on mechanisms for energy and nutrient acquisition: incorporation of diverse mixotrophic strategies // Protist. V. 167. № 2. 106. https://doi.org/10.1016/j.protis.2016.01.003
Pratt J.R., Cairns J.R.J. 1985. Functional Groups in the Protozoa: Roles in Differing Ecosystems 1, 2: protozoan functional groups // J. Protozool. V. 32. № 3. P. 415.
Tirjaková E., Krajčovičová K., Illyová M., Vďačný P. 2016. Interaction of ciliate communities with cyanobacterial water bloom in a shallow, hypertrophic reservoir // Acta Protozool. V. 55. №. 3. P. 173. https://doi.org/10.4467/16890027AP.16.017.5749
Vannote R.L., Minshall G.W., Cummins K.W. et al. 1980. The river continuum concept // Can. J. Fish. Aquat. Sci. V. 37. № 1. P. 130.
Velho L.F.M., Pereira D.G., Pagioro T.A. et al. 2005. Abundance, biomass and size structure of planktonic ciliates in reservoirs with distinct trophic states // Acta Limnol. Bras. V. 17. № 4. P. 361.
Weisse T. 2017. Functional diversity of aquatic ciliates // Eur. J. Protistol. V. 61. P. 331. https://doi.org/10.1016/j.ejop.2017.04.001
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


