Биология внутренних вод, 2021, № 4, стр. 378-391
Особенности сообществ макрозообентоса малых арктических озер Евразии
М. В. Чертопруд a, *, С. В. Крыленко a, А. И. Лукиных a, П. М. Глазов b, О. П. Дубовская c, d, Е. С. Чертопруд a, e
a Биологический факультет Московского государственного университета им. М.В. Ломоносова
Москва, Россия
b Институт географии Российской академии наук
Москва, Россия
c Институт биофизики Федерального исследовательского центра “Красноярский научный центр”
Сибирского отделения Российской академии наук
Красноярск, Россия
d Сибирский федеральный университет
Красноярск, Россия
e Институт экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: lymnaea@yandex.ru
Поступила в редакцию 23.07.2020
После доработки 06.11.2020
Принята к публикации 15.11.2020
Аннотация
На оригинальных данных по трем северным регионам Евразии (подножие плато Путорана, о. Колгуев, о. Западный Шпицберген) рассмотрены таксономическая структура, типология, видовое богатство и суммарное обилие сообществ донных и зарослевых макроскопических беспозвоночных малых озер арктической и субарктической зон. Проведен сравнительный анализ сообществ этих регионов и, с привлечением большого массива литературных данных, обсуждаются особенности высокоарктических островных, низкоарктических, субарктических и бореальных озерных сообществ. Выявлен сложный характер изменения суммарной биомассы бентоса малых озер: снижение ее в субарктической тайге, повышение в гипоарктической тундре и снова снижение в Высокой Арктике.
ВВЕДЕНИЕ
В биологии пресных вод сложились общие представления о сообществах малых озер (Жадин, Герд, 1961; Dodds, Whiles, 2010). Они подразумевают эвтрофные, с высокой плотностью бентоса сообщества илистого дна (доминируют личинки комаров сем. Chironomidae, двустворчатые моллюски и олигохеты сем. Tubificidae) и хорошо развитые зарослевые сообщества погруженных макрофитов (преобладают легочные брюхоногие моллюски, жуки, клопы и стрекозы). Для малых озер характерны высокая трофность и сапробность; летний пик обилия макрофауны и развития высших водных растений сочетается с более или менее катастрофичным зимним замором. Кроме того, этот тип водоемов нередко бывает подвержен гумификации вод. Такие представления в основном сформировались на примере озер и прудов средней полосы (лесной и отчасти степной зон) Евразии, с относительно жарким летом, но длинной морозной зимой.
Описанная выше картина может существенно и неоднозначно трансформироваться в арктическом климате и таежно-тундровом ландшафте. Особенности арктических местообитаний многообразны и частично скоррелированы между собой (Чернов, 1985; Rautio et al., 2011). Более короткое и прохладное лето определяет меньшее летнее прогревание воды. При этом обычные в средней полосе высшие водные растения (кувшинковые, водокрасовые, рясковые и т.п.) замещаются мхами, что приводит к перестройке биотопа фитали, резкому уменьшению питательной ценности детрита и, в целом, трофности водоема. Одновременно элиминируют тепловодные таксоны (например, многие стрекозы и клопы), но появляются более холодноводные группы (в основном хирономиды, некоторые поденки и веснянки) (Vincent et al., 2008). В тайге и тундре, по сравнению с зоной смешанных и лиственных лесов, гораздо меньше поступает в водоемы листового опада, что резко снижает приток биогенных элементов. При этом, значимым источником биогенов в малых озерах Арктики могут становиться, например, фекалии околоводных и мигрирующих птиц (Jensen et al., 2019). Высокая влажность климата северной тайги и тундры приводит к увеличению водности и проточности водоемов и к меньшей минерализации воды озер, по сравнению со средней полосой, а также стимулирует заболачивание берегов (Vincent et al., 2008). По берегам малых водоемов северной тайги и тундры часто развивается мох Sphаgnum, создающий собственный микробиотоп, а также приводящий к подкислению воды и отложению на дне трудноразлагаемого торфянистого детрита. В субарктической таежной зоне в малых озерах нередки мелкие рыбы (в частности, колюшка Gasterosteus aculeatus L., 1758), но большинство арктических тундровых малых озер безрыбно (Rautio et al., 2011; Vincent et al., 2008). В целом в Арктике снижается пресс выедания рыбами за счет обеднения ихтиофауны, а также отсутствия некоторых инвазивных видов, например ротана Perccottus glenii Dybowski, 1877 (Решетников и др., 2003; Vincent et al., 2008).
Вышеперечисленные особенности малых озер северной тайги и тундры позволяют ожидать выявления существенной специфики населяющих их сообществ макрозообентоса. Однако, в настоящее время полноценные обобщения по структуре таких сообществ нам не известны. При этом для реофильных макрозообентосных сообществ Субарктики и Арктики (Ямал и Кольский п-ов) выявлен целый ряд черт, отличающих их от сообществ средней полосы (Palatov, Chertoprud, 2012; Chertoprud, Palatov, 2013).
Необходимо отметить и в средней полосе, и в Арктике наблюдается сильная локальная изменчивость гидрологических и гидрохимических характеристик между водоемами, находящимися даже на небольших расстояниях друг от друга (Хатчинсон, 1969). Нередко на участке в несколько десятков километров можно обнаружить как эвтрофные пруды, полностью зарастающие цветковыми макрофитами, так и дистрофные сфагновые водоемы. В связи с этим, выявление общих тенденций широтной и климатической изменчивости сообществ макрозообентоса возможно только при анализе материалов из широкого спектра водоемов в каждом из сравниваемых регионов.
Цель работы – по оригинальным данным описать сообщества макрозообентоса равнинных малых озер трех модельных высокоширотных регионов (плато Путорана, острова Колгуев и Западный Шпицберген). Дополнительно предпринята попытка выявить специфику и изменчивость сообществ макрозообентоса малых озер субарктической и арктической климатических зон на основe собственных и литературных данных.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика изученных модельных регионов
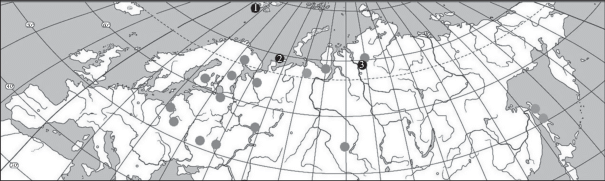
Анализ фауны макрозообентоса малых озер северной тайги и тундры основан на оригинальных данных из трех модельных субарктических и арктических регионов (рис. 1): подножие плато Путорана (равнинная северная тайга), о. Колгуев (равнинная тундра, остров расположен в 80 км от материка) и о. Западный Шпицберген (приледниковая равнинная тундра, остров удален от материка на ~600 км).
Рис. 1.
Карта-схема расположения обследованных регионов в северной части Евразии. Черные кружки с обозначением регионов (1 – архипелаг Шпицберген, 2 – о. Колгуев, 3 – плато Путорана) – оригинальные данные; серые – литературные данные.
Плато Путорана. Регион северной тайги сибирского типа. Сборы проведены в июле–августе 2004 г., собрано 38 количественных проб в 21 водоеме. Озера находятся у подножия плато на 67.4°–68.8° с.ш., и абсолютной высоте от 20 до 290 м, обычно окружены лесом. Большинство озер с глубиной 0.7–3 м и площадью зеркала от 0.1 до 1 га, постоянные, слабопроточные, хорошо прогреваемые к середине лета (до 18–24°С). Дно озер илисто-детритное или торфянистое, часто с береговой осоково-сфагновой сплавиной, иногда встречаются заросли макрофитов. Минерализация воды, как правило, не превышает 50 мг/л, рН варьирует в широких пределах – от 4.2 до 10.0 (в 12 озерах – >7, в 7 озерах – <7).
Остров Колгуев. Территорию острова занимает низкоарктическая тундра. Материалы собраны в июле, августе 2018 г., для большинства водоемов проведено две съемки – в начале и в конце лета. Всего проанализировано 182 пробы из 60 малых озер, расположенных на 69° с.ш. Обследованные озера – мелкие (глубиной ≤1 м), главным образом термокарстового происхождения и окружены равнинной тундрой. Берега обрамлены зарослями кустарниковых ив, дерновиной сабельника Comarum palustre L. и осок Carex spp. Для мелководий характерны заросли гелофита – хвостника Hippuris vulgaris L. Дно преимущественно илистое, часто с большой примесью торфянистого детрита, иногда встречаются участки песчано-детритного и каменистого дна. Летняя температура воды может достигать 18–22°С, но обычно находится в пределах 8–14°С. Минерализация воды, как правило, варьирует в пределах 20–80 мг/л, рН изменяется от 7.0 до 7.9. Некоторые водоемы почти высыхают к концу лета и, вероятно, зимой промерзают до дна.
Остров Западный Шпицберген. Архипелаг Шпицберген лежит в Высокой Арктике (широтная зона арктических пустынь), хотя климат его смягчен влиянием Гольфстрима, и на побережье развита тундровая растительность. Исследования проводили в августе 2014 и 2015 гг., собрано 115 проб по 69 малым озерам в районе поселков Лонгйир, Баренцбург, Пирамида, Нью-Алесунн на 78°–79° с. ш. Большинство озер мелководные, глубиной 0.5–1.5 м, площадью ≤1 га, окружены равнинной тундрой, иногда галечно-валунной приледниковой мореной. Не исключено зимнее промерзание многих водоемов. Дно озер илистое или каменистое, часто на мелководье развиты заросли полуводных мхов, цветковые макрофиты отсутствуют. Летняя дневная температура 7–12°С, минерализация 100–300 мг/л, рН 7.3–9.4. Собранный материал частично проанализирован в ряде публикаций по влиянию на озерную биоту изменения климата в Арктике и мигрирующих птиц (Chertoprud et al., 2017; Walseng et al., 2018; Jensen et al., 2019).
Для анализа широтной изменчивости характеристик сообществ макрозообентоса малых озер был привлечен массив литературных данных, охватывающий водоемы преимущественно российской части севера и средней полосы Палеарктики (рис. 1): Большеземельской тундры (Батурина и др., 2012), п-ова Ямала (Богданов и др., 2005; Степанов, 2017, 2018), плато Путорана (Заделёнов и др., 2017), Кольского п-ова (Moiseenko et al., 2009; Денисов и др., 2015), Карелии (Герд, 1956; Стерлигова и др., 2012; Куликова, Рябинкин, 2015; Кучко и др., 2019), Архангельской обл. (Новосёлов и др., 2017), южной части Финляндии (Meriläinen, Hynynen, 1990; Hynynen, Meriläinen, 2005), Ленинградской обл. (Беляков, Бажора, 2016), Калининградской обл. (Масюткина, 2018), Курской обл. (Silina, Prokin, 2008); Воронежской обл. (Силина, 2001; Синицкий и др., 2002; Хицова и др., 2010), Новосибирской обл. (Визер и др., 2018), Поволжья (Гелашвили и др., 2007; Алексевнина и др., 2011; Ромашкова, 2015), Белоруссии (Ерёмова, Орловская, 1997; Лукашинец, Новик, 2015) и о. Сахалин (Лабай, 2015).
Методика отбора проб и выделения сообществ макрозообентоса
Пробы, как правило, отбирали с помощью полусферического скребка площадью 0.02 м2, общая площадь пробы была 0.1 или 0.2 м2. Обследованы все доступные донные, береговые и зарослевые биотопы на глубинах до 1 м (1–4 биотопа в каждом водоеме). Организмы определены до родов или видов, в зависимости от таксона и стадии развития личинок, главным образом по работам в серии “Определитель пресноводных беспозвоночных России” (Определитель…, 1994–2004). Для каждой пробы определяли численность и биомассу макрозообентоса, а также рассчитывали абсолютный и относительный метаболизм.
В качестве основного показателя обилия таксонов при выделении типов сообществ применялся относительный метаболизм таксонов – их доля в каждой пробе по метаболизму, рассчитываемому на основе численности и биомассы по формуле:
R = Q N 0.25B 0.75,
где N – численность, B – биомасса на единицу площади, Q – коэффициент уровня обмена, специфичный для каждой группы (Алимов, 1979). По нашему мнению, этот показатель наиболее адекватно отражает роль таксона в сообществе, поскольку непосредственно связан с его питанием и дыханием.
Принятая нами схема разделения сообществ на типы основана на геоботаническом методе Брауна–Бланке (Braun–Blanquet, 1964), модифицированном для количественных данных (Chertoprud, 2011). Исходной таблицей данных послужила таблица относительного метаболизма определенных видов. В этом массиве данных были выделены комплексы таксонов со сходным распространением, доминирующие в пробах, и сгруппированы соответствующие пробы. Далее проводили экологическую интерпретацию этих групп: выявляли привязку их к биотопу, факторы, обусловливающие их распространение, и оценивали внутреннюю изменчивость. Если группа проб достаточно устойчива по таксономической структуре, проводили описание типа сообщества: состав и структура доминирования, биотопическая приуроченность, средние показатели сообщества и т.д.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Плато Путорана (Красноярский край, Россия)
Видовое богатство и обилие. В общей сложности были определены 98 видов макрофауны, из них 37 – хирономид, по 9 – прочих двукрылых и ручейников, по 8 – поденок и жуков, 6 – стрекоз, 5 – брюхоногих моллюсков, другие таксоны представлены беднее (табл. 1). Среднее число видов в пробе достигало 9.9. Около трети видового богатства приходилось на северные (циркумарктические) виды, остальные таксоны – аркто-бореальные, распространенные на большей части Палеарктики (в основном по данным, приводимым в определителях). Доля специфичных западно- или восточно-палеарктических видов незначительна.
Таблица 1.
Число видов и средняя доля по метаболизму (в скобках, %) семейств макрозообентоса в изученных районах
| Таксон | Плато Путорана | о. Колгуев | о. Западный Шпицберген |
|---|---|---|---|
| Turbellaria | |||
| Planariidae | 0 | 1(0.9) | 0 |
| Oligochaeta | |||
| Naididae | 2(0.2) | 1(0.4) | 0 |
| Tubificidae | 2(1.0) | 2(0.7) | 0 |
| Lumbriculidae | 1(8.8) | 1(3.9) | 0 |
| Enchytraeidae | 0 | 0 | 2(0.5) |
| Hirudinea | |||
| Erpobdellidae | 1(0.9) | 0 | 0 |
| Haemopidae | 1(0.1) | 0 | 0 |
| Glossiphoniidae | 2(0.8) | 4(2.5) | 0 |
| Gastropoda | |||
| Lymnaeidae | 1(0.1) | 0 | 0 |
| Planorbidae | 2(3.9) | 1(4.7) | 0 |
| Valvatidae | 2(3.4) | 1(0.5) | 0 |
| Bivalvia | |||
| Pisidiidae | 2(5.6) | 5(15.4) | 0 |
| Sphaeriidae | 1(1.6) | 2(14.2) | 0 |
| Malacostraca | |||
| Gammaridae | 1(9.0) | 1(31.4) | 0 |
| Phyllopoda | |||
| Lynceidae | 1(0.2) | 0 | 0 |
| Cyzicidae | 0 | 1(0.3) | 0 |
| Lepiduridae | 0 | 1(0.4) | 1(18.4) |
| Chirocephalidae | 0 | 1(0.5) | 0 |
| Branchynectidae | 1(0.1) | 1(0.9) | 0 |
| Polyartemiidae | 1(0.1) | 1(0.1) | 0 |
| Odonata | |||
| Coenagrionidae | 1(0.1) | 0 | 0 |
| Aeshnidae | 1(0.1) | 0 | 0 |
| Corduliidae | 1(5.0) | 0 | 0 |
| Libellulidae | 3(6.9) | 0 | 0 |
| Ephemeroptera | |||
| Baetidae | 2(2.8) | 1(2.0) | 0 |
| Caenidae | 1(0.6) | 0 | 0 |
| Leptophlebiidae | 1(0.03) | 0 | 0 |
| Plecoptera | |||
| Nemouridae | 0 | 1(0.02) | 0 |
| Heteroptera | |||
| Corixidae | 1(0.05) | 1(0.4) | 0 |
| Coleoptera | |||
| Dytiscidae | 5(0.6) | 11(5.0) | 0 |
| Gyrinidae | 0 | 2(0.01) | 0 |
| Haliplidae | 1(0.2) | 5(0.7) | 0 |
| Helophoridae | 0 | 1(0.06) | 0 |
| Chrysomelidae | 1(0.02) | 0 | 0 |
| Trichoptera | |||
| Polycentropodidae | 1(0.2) | 0 | 0 |
| Hydroptilidae | 0 | 1(0.2) | 0 |
| Apataniidae | 0 | 0 | 1(0.6) |
| Leptoceridae | 3(2.1) | 0 | 0 |
| Limnephilidae | 1(0.4) | 5(0.6) | 0 |
| Molannidae | 2(1.4) | 0 | 0 |
| Phryganeidae | 1(0.6) | 2(0.4) | 0 |
| Megaloptera | |||
| Sialidae | 1(6.3) | 0 | 0 |
| Diptera | |||
| Chironomidae | 34(31.4) | 47(13.0) | 18(80.5) |
| Ceratopogonidae | 4(2.1) | 0 | 0 |
| Chaoboridae | 1(0.3) | 1(0.8) | 0 |
| Limoniidae | 1(0.7) | 1(0.2) | 0 |
| Dolichopodidae | 1(0.6) | 0 | 0 |
| Empididae | 1(0.01) | 0 | 0 |
| Muscidae | 1(1.8) | 0 | 0 |
| Всего видов | 89 | 103 | 22 |
Средняя суммарная численность макрозообентоса в водоемах была 834 экз./м2, биомасса – 2.83 г/м2, метаболизм – 0.98 мл О2/м2.
Структура сообществ. Синэкологический анализ позволил выделить три основных типа сообществ, широко распространенных в изученных озерах, которые образуют многочисленные переходные варианты. Еще несколько проб относились к редким типам сообществ, которые пока не могут быть корректно описаны в связи с недостатком материала.
Сообщество Chironomus gr. plumosus – Sialis sordida (Klingstedt, 1932) – Euglesinae – Procladius gr. choreus. Сообщество класса пелали с преобладанием роющих форм макробентоса, развивается на илисто-детритных грунтах. Доминируют хирономиды, горошинки и вислокрылка Sialis sordida. Из второстепенных групп характерны олигохеты (Lumbriculus sp. и Tubificidae spp.), шаровка Sphaerium corneum (L., 1758), личинки Ceratopogonidae. Описанный видовой комплекс типичен для дна обследованных малых озер. Средняя суммарная численность макрозообентоса была 1189 экз./м2, биомасса – 3.33 г/м2, метаболизм – 1.25 мл О2/м2.
Сообщество Gammarus lacustris Sars, 1863 – Lumbriculus variegatus (Müller, 1774) – Leucorrhinia orientalis Selys, 1887 – Somatochlora sahlbergi Trybom, 1889. Сообщество относится к классу рипали, приурочено к береговым субстратам (краю моховой сплавины и торфянисто-детритному грунту под ним, а также зарослям гелофитов на отмелях). В нем преобладали подвижные лазающие формы: бокоплав Gammarus lacustris, разнокрылые стрекозы и олигохета Lumbriculus variegatus. Второстепенные формы – хирономиды родов Procladius, Psectrocladius, Tanytarsus, поденки Cloeon simile Eaton, 1870, Caenis horaria L., 1758, горошинки, вислокрылка Sialis sordida, катушка Gyraulus acronicus (Ferussac, 1807). В зависимости от характера береговой линии, с увеличением глубины это сообщество более или менее плавно переходит в предыдущее. Суммарная численность в среднем составляла 726 экз./м2, биомасса – 2.83 г/м2, метаболизм – 0.94 мл О2/м2.
Сообщество Gyraulus acronicus (Ferussac, 1807) – Cincinna ambigua (Westerlund, 1878). Фитальное сообщество, характерно для зарослей погруженных макрофитов, относительно изолированных от дна водоема. Этот тип сообществ встречался относительно редко. Преобладали брюхоногие моллюски, второстепенные формы – ручейники Mystacides niger (L., 1758), Limnephilus nigriceps (Zetterstedt, 1840), хирономиды Psectrocladius simulans Johannsen, 1937, бокоплав Gammarus lacustris. Суммарная численность в среднем 1293 экз./м2, биомасса – 3.01 г/м2, метаболизм – 1.19 мл О2/м2.
Остров Колгуев (Ненецкий автономный округ, Россия)
Видовое богатство и обилие. В изученных водоемах выявлено 102 вида макрофауны. Из них 47 видов относятся к сем. Chironomidae (определены не все виды), 19 – жуков (главным образом, сем. Dytiscidae), 8 – ручейников, 7 – двустворчатых моллюсков, 5 – листоногих ракообразных, прочие таксоны представлены беднее (табл. 1). Среднее число видов в пробе 8.4 – чуть ниже, чем в озерах плато Путорана. Около 20 видов имеют циркумполярные арктические или аркто-альпийские ареалы. Именно они обычно доминировали в сообществах. Остальные таксоны имели широкое палеарктическое распространение, и их ареалы можно отнести к аркто-бореальным.
Средняя суммарная численность макрозообентоса в изученных озерах – 1021 экз./м2, биомасса – 20.3 г/м2, метаболизм – 5.3 мл О2/м2.
Структура сообществ. Структура сообществ макрозообентоса о. Колгуев упрощена. Резко выражено доминирование амфиподы Gammarus lacustris и двустворчатых моллюсков Henslowiana nordenskioldi (Clessin in Westerlund, 1876) и Sphaerium westerlundi Clessin in Westerlund, 1873, достигающих 65% среднего суммарного метаболизма. На наиболее разнообразных по числу видов хирономид приходятся суммарно 13% метаболизма и их отдельные виды обычно не входят в состав доминантов сообществ. Выделено четыре типа сообществ макрофауны.
Henslowiana nordenskioldi – Sphaerium westerlundi – Gammarus lacustris – Chironomidae spp. – сообщество илисто-песчаных и илисто-детритных грунтов большинства обследованных водоемов. Преобладают мелкие двустворчатые моллюски (Pisidiidae и Sphaeriidae) и бокоплав Gammarus lacustris. Второстепенные виды – олигохеты Lumbriculus variegatus, Limnodrilus sp., двустворчатый моллюск Parasphaerium rectidens (Starobogatov et Streletzkaja, 1967), а также разнообразные хирономиды. Средняя суммарная численность 1321 экз./м2, биомасса – 26.4 г/м2, метаболизм – 6.1 мл О2/м2.
Gammarus lacustris – сообщество класса рипали, развито на смешанных субстратах (детрит, торф, затопленная осока и т.п.), в том числе в зарослях гелофита хвостника Hippuris vulgaris вдоль береговой кромки большинства водоемов. Как правило, резко доминировал один вид – бокоплав Gammarus lacustris, роль других таксонов невелика. Второстепенные виды – двустворчатые моллюски Henslowiana nordenskioldi и Sphaerium westerlundi, олигохета Lumbriculus variegatus, пиявки Glossiphonia complanata L., 1758 и Helobdella stagnalis (L., 1758), жуки-плавунцы Dytiscus lapponicus Gyllenhal, 1808, Colymbetes dolabratus (Paykull, 1798), Agabus arcticus (Paykull, 1798), поденка Baetis macani Kimmins, 1957, а также ряд хирономид. Суммарная численность в среднем 932 экз./м2, биомасса – 15.4 г/м2, метаболизм – 4.7 мл О2/м2.
Gyraulus stroemi (Westerlund, 1881) – Dytiscus lapponicus – Chironomidae spp. – это редкое сообщество, характерное для фитали, отмечено в зарослях макрофитов на мелководье. Доминировали гастропода – мелкая катушка Gyraulus stroemi, а также жук-плавунец Dytiscus lapponicus. Второстепенные виды – личинки хирономид, горошинка Henslowiana nordenskioldi, поденка Baetis macani, пиявка Glossiphonia complanata, жук-плавунчик Haliplus fulvus (Fabricius, 1801), бокоплав Gammarus lacustris. Суммарная численность в среднем 363 экз./м2, биомасса – 7.2 г/м2, метаболизм – 1.9 мл О2/м2.
Cyclocalyx lapponicus (Clessin in Westerlund, 1873) – Chaoborus crystallinus (De Geer, 1776) – Branchinecta paludosa (Müller, 1788) – Pristicephalus josephinae (Grabe, 1853) – Baetis macani – Chironomidae spp. – сообщество, типичное для временных водоемов, отмечено в начале лета в некоторых мелководных озерах, вероятно, высыхающих к осени. В комплекс доминантов входили специфические двустворчатые моллюски рода Cyclocalyx, коретра Chaoborus, питающаяся планктоном, а также жаброноги и разнообразные хирономиды. Второстепенные виды – плавунцы Dytiscus lapponicus, Agabus arcticus, турбеллярия Bothromesostoma essenii Braun, 1885, олигохета Lumbriculus variegatus, горошинки Henslowiana nordenskioldi и H. waldeni (Kuiper, 1975), клоп-гребляк Arctocorisa carinata (Sahlberg, 1819). В сообществе почти не встречались виды, массовые в большинстве постоянных водоемов острова. Суммарная численность составляла в среднем 589 экз./м2, биомасса – 2.9 г/м2, метаболизм – 1.0 мл О2/м2.
Остров Западный Шпицберген (Норвегия)
Видовое богатство и обилие. Отмечено 22 вида макрофауны: 18 видов хирономид, два вида олигохет сем. Enchytraeidae, ручейник Apatania zonella (Zetterstedt, 1840) и щитень Lepidurus arcticus (Pallas, 1793). Среднее число видов в пробе 3.2. Таким образом, единственный крупный таксон макрофауны, эффективно заселяющий Высокую Арктику даже через протяженные морские пространства – комары сем. Chironomidae. Никаких специфических для острова и архипелага видов не обнаружено. Найденные виды характерны для Северной Палеарктики, часто имеют циркумполярные или аркто-альпийские ареалы.
Суммарная численность макрозообентоса в изученных озерах в среднем 798 экз./м2, биомасса – 1.7 г/м2, метаболизм – 0.74 мл О2/м2.
Структура сообществ. Структура сообществ макрозообентоса на о. Западный Шпицберген резко упрощена, почти во всех биотопах преобладают хирономиды. Щитень Lepidurus arcticus населяет толщу воды, но единично встречается в донных и зарослевых биотопах, создавая существенное увеличение биомассы (~25%) и метаболизма (~18%). При выделении сообществ макробентоса этот вид, встречаемость которого носит случайный характер, не учитывался.
Синэкологический анализ позволил выделить шесть вариантов сообществ, характерных для малых озер. Каждый из них связан с одним доминирующим видом. Ряд типов сообществ замещает друг друга на сходных субстратах в разных водоемах.
Chironomus spp. (Chironomidae: Chironomini) – пелальное сообщество встречается на илистых грунтах водоемов, обычно повышенной трофности. Основной доминант – род Chironomus, второстепенные виды – Cricotopus tibialis (Meigen, 1804) и Psectrocladius barbimanus (Edwards, 1929). Суммарная численность макрозообентоса – 434 экз./м2, биомасса – 0.9 г/м2, метаболизм – 0.46 мл О2/м2.
Procladius crassinervis (Zetterstedt, 1838) (Chironomidae: Tanypodinae) – пелальное сообщество, отмеченное на глинистых илах, иногда на глинистой гальке. Вероятно, этот грунт не дает нужной пищевой базы детритофагам (таким как Chironomus), и здесь поселяется хищная хирономида Procladius crassinervis, питающаяся мейобентосом или трупами зоопланктона. Второстепенные виды – Cricotopus tibialis, Micropsectra radialis Goetghebuer 1939, Psectrocladius barbimanus. Суммарная численность организмов – 217 экз./м2, биомасса – 0.5 г/м2, метаболизм – 0.24 мл О2/м2.
Cricotopus (Chironomidae: Orthocladiinae) – рипальное сообщество, отмеченное на подушках мха вдоль береговой линии и на мелководье, изредка на каменистом грунте. Основные доминанты – Cricotopus tibialis и C. glacialis Edwards, 1922. Суммарная численность организмов – 996 экз./м2, биомасса – 1.0 г/м2, метаболизм – 0.60 мл О2/м2.
Orthocladius (Chironomidae: Orthocladiinae) – рипальное сообщество, по типу занимаемого биотопа сходное с предыдущим. Совместные поселения родов Orthocladius и Cricotopus встречаются редко, обычно они доминируют в разных водоемах. Суммарная численность – 798 экз./м2, биомасса – 1.7 г/м2, метаболизм – 0.82 мл О2/м2.
Psectrocladius barbimanus (Chironomidae: Orthocladiinae) – сообщество, также характерное для вышеописанного биотопа рипали. Основной доминант – Psectrocladius barbimanus, вместе с ним встречаются виды родов Cricotopus, Procladius и Paratanytarsus. Суммарная численность – 727 экз./м2, биомасса – 2.0 г/м2, метаболизм – 0.91 мл О2/м2.
Paratanytarsus austriacus (Kieffer, 1924) (Chironomidae: Tanytarsini) населяет тонкослойный наилок на каменистых грунтах мелководья, переходное между рипальным и пелальным. Основной доминант – Paratanytarsus austriacus, второстепенные виды – Psectrocladius barbimanus, Cricotopus glacialis, Orthocladius spp., Apatania zonella. Одновидовое сообщество встречается часто. Суммарная численность – 1307 экз./м2, биомасса – 0.8 г/м2, метаболизм – 0.55 мл О2/м2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Широтная изменчивость видового богатства. Из рассмотренных на оригинальном материале регионов по этому показателю близки два более южных – плато Путорана (зона северной тайги) и о. Колгуев (зона тундр), хотя первый из них материковый, второй – островной. В каждом из этих регионов видовое богатство достигало ~7–10 видов на пробу, 15–20 видов на водоем и ~100 видов во всей серии изученных водоемов. Близкие показатели (84 вида) приводятся для тундровых озер бассейна р. Яраяха на Южном Ямале (Степанов, 2017), расположенных в тех же широтах. Для отдельных тундровых и северо-таежных озер разные авторы указывают видовое богатство от 20 до 50 видов на водоем (Богданов и др., 2005; Степанов, 2017). Эти показатели невысоки, по сравнению со средней полосой Европы и России, но не сильно отличаются от них. Например, для малых озер Калининградской обл. в среднем отмечено по 15–30 видов макробентоса на водоем (Масюткина, 2018). Причем в малых озерах южной части средней полосы видовое богатство макрозообентоса заметно выше. Так, в оз. Погоново (Воронежская обл.) отмечено 83 вида макробентоса (Силина, 2001).
На высокоарктическом архипелаге Шпицберген разнообразие макробентоса во много раз ниже, чем на о. Колгуев и на плато Путорана. Среднее число видов на пробу лишь три, а во всех изученных 69 озерах – 22 вида. С одной стороны, обедняющий эффект суровых арктических условий кажется очевидным, но его трудно отделить от островного эффекта. Шпицберген – крайне изолированный архипелаг с затрудненным проникновением новых таксонов, к тому же с небольшой и не очень стабильной полосой суши, свободной от ледников. Для материковой Арктики в Канаде также описаны структурно сходные сообщества с преобладанием хирономид и щитня Lepidurus arcticus, хотя и отмечены отдельные виды бокоплавов, моллюсков и олигохет (Rautio et al., 2011). В малых тундровых озерах на мысе Барроу (северная Аляска, 71° с.ш.) зарегистрирован 31 вид хирономид, пять – других видов насекомых (ручейников, жуков и веснянок), две – олигохеты и одна – гастропода (Lougheed et al., 2011). На изолированном арктическом архипелаге Ян Майен в Атлантике (также 71° с.ш.) макрозообентос представлен только хирономидами и олигохетами (Skreslet, Foged, 1970). Таким образом, можно предположить, что островное влияние на фауну Арктики превалирует над широтным. Для корректного решения вопроса о влиянии высоких широт и островной изоляции на состав и разнообразие озерного макробентоса нужны отсутствующие пока данные по субматериковым высокоарктическим регионам, таким как Северная Земля или север Гренландии.
Широтная изменчивость показателей обилия. Суммарная численность макробентоса в трех рассматриваемых модельных регионах схожа и колеблется на уровне ~1000 экз./м2. На этом сходство регионов заканчивается: суммарная биомасса на о. Колгуев (в среднем ~20 г/м2) в несколько раз превышает таковую на плато Путорана и о. Западный Шпицберген (~2–3 г/м2). Аналогично соотношение метаболизма макрозообентоса в трех сравниваемых регионах. Это легко объяснимо с точки зрения таксономической структуры сообществ. На о. Колгуев основу численности составляют относительно крупные бокоплавы Gammarus lacustris (средняя масса тела ~20 мг) и двустворчатые моллюски. В других регионах обильны, главным образом, хирономиды (со средней массой тела ~3 мг). Гораздо менее очевидны трофические предпосылки таких различий. С одной стороны, показано, что сообщества с доминированием личинок насекомых обычно имеют гораздо меньшее обилие, чем сообщества высших ракообразных и моллюсков, то есть менее полно используют локальные трофические ресурсы (Чертопруд, 2014). Этот факт может объяснять меньшее обилие макробентоса на о. Западный Шпицберген, где обитают в основном одни хирономиды. С другой стороны, в водоемах плато Путорана тоже встречается бокоплав Gammarus lacustris, но его численность там низкая, по сравнению с водоемами о. Колгуев. В отдельных, даже крупных озерах плато Путорана бокоплавы могут полностью отсутствовать (Заделёнов и др., 2017). Однa из возможных причин малочисленности бокоплавов (и крупных брюхоногих моллюсков) на плато Путорана – низкие значения pH водной среды в некоторых водоемах. Повышенная кислотность вод озер северной тайги, по сравнению с водоемами тундр и смешанных лесов, отмечена ранее при анализе биопродуктивности водоемов разных природных зон (Китаев, 1984). Дистрофный статус озер региона, в первую очередь, связан со слабой разлагаемостью торфянистого детрита и хвойного опада, а также низкой освещенностью прибрежной зоны в тайге. Дополнительно, массовому развитию гаммаруса на плато Путорана препятствует низкая минерализация воды и недостаток кальция – это известный для гаммарусов лимитирующий фактор (Ялынская, 1970). Впрочем, низкая минерализация и закисление вод не повсеместны на плато Путорана, в его горных районах подстилающие породы обусловливают щелочную среду и большую буферную емкость вод (Blais et al., 1999; Dubovskaya et al., 2010).
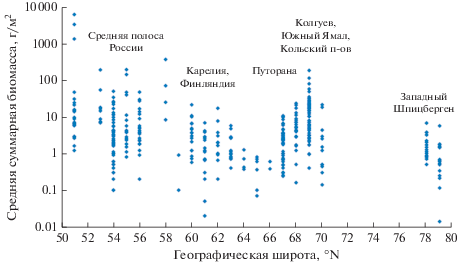
Литературные данные по биомассе бентоса в тундровых озерах разнообразны. Для малых равнинных тундровых озер Южного Ямала (69° с.ш.) известна средняя биомасса макробентоса 3.07 г/м2, при очень большом разбросе – от 0.02 до 11.2 г/м2 (Степанов, 2017). В оз. Большой Харбей Большеземельской тундры (67° с.ш.) средняя биомасса колеблется в разные годы от 3.9 до 7.1 г/м2 (Батурина и др., 2012). Для девяти тундровых озер Южного Ямала (66°–67° с.ш.) приводятся биомассы от 0.4 до 12.7, в среднем 3.5 г/м2 (Богданов и др., 2005). Обычно биомасса макрозообентоса тундровых озер не достигает показателей, отмеченных для о. Колгуев (в среднем ~20 г/м2), хотя на Аляске встречаются озера с близкими (20–22 г/м2) значениями обилия (Northington et al., 2010).
В водоемах северной тайги биомасса в среднем уступает тундровой зоне. В больших озерах плато Путорана (Заделёнов и др., 2017) обилие макрозообентоса не превышает 1.5 г/м2. Наибольшая биомасса макрозообентоса отмечена на мягких грунтах в оз. Собачье (3.8 г/м2). Для озер Северной Карелии (65° с.ш.) известен средний показатель 0.37 г/м2 (Герд, 1956), но в этой работе рассмотрены, главным образом, крупные, явно олиготрофные озера с преобладанием на дне хирономид подсем. Orthocladiinae. В более поздних исследованиях различных озер Северной Карелии (Стерлигова и др., 2012) приведены сходные данные – от 0.22 до 1.25 г/м2. В водоемах южных районов Карелии (Герд, 1956; Кучко и др., 2019) и близких по широте районов Архангельской обл. (Новосёлов и др., 2017) отмечена биомасса макрозообентоса 0.07–17 г/м2 (в большинстве водоемов 1–3 г/м2). В целом, биомасса донных организмов в пределах Карелии возрастает к югу, в сторону средней полосы (Герд, 1956; Стерлигова и др., 2012). В малых озерах южной Финляндии отмечены значения биомассы, близкие к таковым в Карелии. За период 1984–1986 гг. обилие беспозвоночных варьировало от 0.01 до 14.5 г/м2, достигая в среднем лишь 2.22 г/м2 (Meriläinen, Hynynen, 1990; Hynynen, Meriläinen, 2005). Биомасса бентоса в озерах Кольского п-ова составляет 0.3–12 г/м2, поднимаясь до 20–50 г/м2 при антропогенной эвтрофикации (Moiseenko et al., 2009; Денисов и др., 2015).
В озерах средней полосы Палеарктики обилие макробентоса обычно в несколько раз больше, чем в озерах северной тайги, и часто даже превышает показатели, отмеченные нами для о. Колгуев. Большой материал, собранный по озерам севера Ленинградской обл. (60°–61° с.ш.), позволил выявить огромный разброс данных по суммарной биомассе всех обследованных субрегионов – от 0.1–0.3 до 10–30 г/м2 (в 100 раз и более), в зависимости от местных факторов, определяющих трофность водоема (Беляков, Бажора, 2016). Существенные колебания биомассы макробентоса зарегистрированы в малых озерах Восточной Палеарктики – на о. Сахалин (50°–53° с.ш.) (Лабай, 2015) и малых озерах Новосибирской обл. (54°–55° с.ш.) (Визер и др., 2018). В малых озерах Калиниградской обл. (55° с.ш.) биомасса макрозообентоса варьирует от 1–2 до 140–190 г/м2, в среднем 39 г/м2 (Масюткина, 2018). Характерно, что высокие значения обусловлены спорадично распространенными крупными моллюсками Anodonta cygnea L., 1758, Unio pictorum (L., 1758) и Viviparus viviparus (L., 1758). В трех Нарочанских озерах Белоруссии (55° с.ш.) суммарная биомасса бентоса в среднем варьировала от 34 до 58 г/м2, главным образом, за счет крупных моллюсков (Ерёмова, Орловская, 1997). В прудах средней полосы (как правило, эвтрофных) обилие макробентоса еще выше. Например, в разных водоемах в окрестностях г. Пермь (58° с.ш.) биомасса колебалась от 12.6 до 510.3 г/м2 (Алексевнина и др., 2011). Наиболее высокие значения биомассы обеспечивали тоже крупные двустворки – беззубки Anodonta cygnea. Гаммарусы в малых озерах и прудах умеренной зоны распространены не везде, но обилие макробентоса обычно высоко и без них.
В целом, биомасса бентоса возрастает от субарктической северной тайги к югу лесной умеренной зоны. Небольшая часть этого роста (примерно до 2–5 г/м2) обеспечивается обилием личинок насекомых (в основном хирономид), остальное – появлением крупных моллюсков и, в меньшей степени, ракообразных (бокоплавов, водяных осликов, иногда декапод). С другой стороны, по всей умеренной зоне, даже в лесостепи, встречаются олиготрофные и дистрофные озера с низким обилием макробентоса, более характерным для северной тайги. Например, средняя биомасса макробентоса оз. Погоново Воронежской обл. (51° с.ш.) – 1.2 г/м2 (Силина, 2001). Невысока также биомасса в полисапробных и заморных прудах, несмотря на высокую трофность, – по-видимому, из-за отсутствия жаберных моллюсков и высших ракообразных. Например, в городских прудах г. Нижний Новгород (56° с.ш.) биомасса бентоса колеблется от 0.2 до 13.6 г/м2 (Гелашвили и др., 2007).
Обобщенная картина широтной изменчивости суммарной биомассы макробентоса, составленная на основании оригинальных и литературных данных, дана на рис. 2. Несмотря на широкий разброс значений, наблюдается не только общий тренд уменьшения биомассы к полюсу, но и ее закономерные колебания: падение от умеренной зоны к северной тайге (64°–66° с.ш.), дальнейшее повышение к низкоарктической тундре (68°–69° с.ш.) и снова спад к Высокой Арктике. Снижение обилия и разнообразия макробеспозвоночных в малых озерах северной тайги детально описано на примере водоемов Финляндии. Показано, что основная причина обеднения сообществ беспозвоночных южной части Финляндии (и, вероятно, Карелии) – повышенная ацидификация вод (Meriläinen, Hynynen, 1990; Hynynen, 2004; Hynynen, Meriläinen, 2005). Наиболее чувствительны к повышению кислотности воды брюхоногие моллюски семейств Lymnaeidae и Valvatidae, которые в случае уменьшения pH полностью исчезают из водоемов (Meriläinen, Hynynen, 1990). Типичная доминирующая группа в малых дистрофных озерах с кислой реакцией вод – хирономиды подсем. Orthocladiinae (Mousavi, 2002), что характерно и для водоемов Карелии (Герд, 1956). Основными причинами высокой (причем нередко растущей из года в год) ацидификации водоемов европейской северной тайги считаются естественный дистрофный статус многих малых озер, антропогенная нагрузка на экосистемы и глобальные климатические изменения (Hynynen, 2004; Culp et al., 2012; Hayden et al., 2019). В низкоарктической тундре потепление климата и антропогенная деятельность, обеспечивающие приток биогенов в экосистему, напротив, способствуют повышению трофности водоемов и вызывают повышение биомассы макрозообентоса (Moiseenko et al., 2009). Таким образом, в двух соседних природных зонах (северная тайга и низкоарктическая тундра) сходные факторы среды могут создавать разнонаправленные векторы изменения обилия водной фауны.
Рис. 2.
Зависимость средней суммарной биомассы макрозообентоса от географической широты в северной части Палеарктики (по оригинальным и литературным данным). Ось ординат логарифмирована.
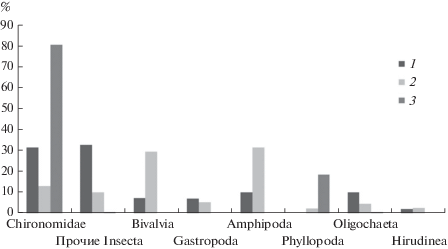
Широтная изменчивость структуры сообществ. Три обследованных модельных региона принципиально различаются по среднему соотношению обилий основных крупных таксонов макробентоса (рис. 3). На плато Путорана преобладают различные насекомые (при большой доле хирономид), на о. Колгуев – бокоплавы и двустворчатые моллюски, а на о. Шпицберген – хирономиды и листоногие ракообразные (щитень). Возможно, высокое обилие бокоплавов на о. Колгуев приводит к выеданию и угнетению других донных личинок насекомых.
Рис. 3.
Средние доли (%) по метаболизму крупных таксонов макрозообентоса в исследованных регионах. 1 – плато Путорана, 2 – о. Колгуев, 3 – о. Западный Шрицберген.
На первый взгляд, повторяющиеся типы сообществ в разных высокоширотных модельных регионах не выявлены. Тем не менее, на уровне макротаксонов зообентоса можно предложить следующую предварительную схему.
Илистые грунты (пелаль). На плато Путорана в пелальных сообществах преобладали хирономиды и мелкие двустворчатые моллюски, на о. Колгуев – мелкие двустворчатые моллюски, на о. Западный Шпицберген – хирономиды. Таким образом, основных таксонов пелали Арктики всего два, но их обилие сильно варьирует между регионами. Состав доминирующих таксонов в озерах других северных регионов сходен, иногда его дополняют олигохеты сем. Tubificidae (Батурина и др., 2012; Беляков, Бажора, 2016). В средней полосе Палеарктики все эти группы сохраняются, но спорадично (в основном в пойменных и проточных озерах, где присутствуют рыбы) появляются крупные двустворчатые моллюски (сем. Unionidae), достигающие огромного обилия и резко доминирующие по биомассе (Ерёмова, Орловская, 1997; Масюткина, 2018 и др.). В Арктике крупные двустворки также иногда встречаются (например, на Кольском п-ове и на Чукотке), но расселяются с лососевыми рыбами и обычно обитают в реках и крупных проточных озерах.
Береговые субстраты (рипаль). На плато Путорана в рипальных сообществах многочисленны бокоплавы и насекомые (личинки и имаго), на о. Колгуев – в основном, бокоплавы (Gammarus), на о. Западный Шпицберген – хирономиды. Доминирование Gammarus также характерно для бентосных сообществ прибрежной зоны тундровых озер провинции Нунавут (Канада) (Namayandeh, Quinlan, 2011), близких по условиям среды к водоемам о. Колгуев. В рипали озер умеренной зоны (большинство авторов называют этот биотоп литораль) обычно наблюдается неустойчивое доминирование различных личинок насекомых (стрекоз, поденок, жуков, клопов, хирономид). При наличии в водоеме бокоплавов (в Палеарктике обычно Gammarus lacustris, иногда Gmelinoides fasciatus (Stebbing, 1899)), других высших ракообразных или крупных брюхоногих моллюсков (например, Viviparus viviparus), они занимают доминирующие позиции на береговых субстратах (Ерёмова, Орловская, 1997; Беляков, Бажора, 2016). Характерно, что именно бокоплавы преобладают в сообществах рипали в большинстве регионов, где условия благоприятны для их развития. В отсутствие бокоплавов структура сообществ рипали может быть крайне изменчива. Так, на высокоширотном архипелаге Шпицберген, где из-за суровости климата пресноводные бокоплавы встречаются очень редко, в рипальных сообществах преобладают разные таксоны хирономид.
Зарослевые субстраты (фиталь). На плато Путорана и о. Колгуев в фитали доминируют брюхоногие моллюски, а на архипелаге Шпицберген – хирономиды. В типичной фитали, даже в Арктике, обычно преобладают гастроподы, и только на о. Шпицберген они не проникли. Согласно литературным данным, по мере продвижения к югу преобладание брюхоногих моллюсков в фитали сохраняется, причем их обилие и разнообразие возрастают за счет семейств Lymnaeidae, Planorbidae, Viviparidae, Bithyniidae и других (Жадин, Герд, 1961).
В целом, низкоарктические озерные сообщества макрозообентоса (из модельных регионов – плато Путорана и о. Колгуев) имеют таксономическую структуру, характерную для большей части Палеарктики, хотя и несколько обедненную. Состав макротаксонов между разными биотопами значительно различается. Обычно можно выделить три основных варианта биотопов, которым соответствуют основные классы сообществ: пелаль, рипаль и фиталь, ранее предложенные нами для реофильных сообществ (Chertoprud, 2011; Чертопруд, 2014). В пелали преобладают двустворчатые моллюски (сем. Pisidiidae и Sphaeriidae), хирономиды и Tubificidae. Для рипали характерно доминирование бокоплавов (обычно Gammarus), обильны пиявки, олигохеты (Lumbriculus), двустворчатые моллюски, стрекозы и жуки. На макрофитах массово представлены брюхоногие моллюски, а также бокоплавы, жуки, клопы и стрекозы. Все эти варианты в общем близки к классам сообществ, ранее выделенных для рек и ручьев, в том числе арктических широт (Chertoprud, Palatov, 2013; Palatov, Chertoprud, 2012).
Высокоарктические островные озерные сообщества (из модельных регионов – архипелаг Шпицберген) имеют уникальную, резко обедненную таксономическую структуру. Во всех биотопах доминируют разные виды одного сем. Chironomidae, другие таксоны очень редки. Также можно выделить специфику сообществ разных биотопов (илов, зарослей мхов, прибрежных камней и береговой сплавины), но она проявляется на уровне разных родов и видов одного семейства, что подробно обсуждалось нами ранее (Chertoprud et al., 2017).
ЗАКЛЮЧЕНИЕ
Общие особенности сообществ макробентоса малых арктических и субарктических озер Палеарктики сводятся к следующим. В них, по климатическим или историческим причинам, отсутствуют или редки многие таксоны макрозообентоса, что несколько снижает общее разнообразие, а за счет полного или частичного отсутствия крупных моллюсков (Unionidae, Viviparidae, Lymnaeidae) снижается и общая биомасса. Однако существуют отдельные группы тундровых водоемов (например, Вашуткины озера Большеземельской тундры), в которых малакофауна разнообразна и многочисленна (Зверева и др., 1964; Bolotov et al., 2014). Кроме того, в арктических и субарктических озерах слабо развиваются или отсутствуют заросли погруженных цветковых макрофитов, поэтому не выражены сообщества фитали и снижено обилие и разнообразие зарослевых таксонов макрофауны (в первую очередь легочных брюхоногих моллюсков, стрекоз, клопов и жуков). В сообществах мягких грунтов в Арктике и Cубарктике возрастает роль сем. Chironomidae и мелких двустворчатых моллюсков (семейств Pisidiidae и Sphaeriidae). В фауне наиболее разнообразны транспалеарктические и голарктические виды, которые встречаются по всей лесной зоне. Доля специфических северных (арктических или аркто-альпийских) видов мала, в отличие от текучих водоемов Арктики, где таких видов довольно много (Palatov, Chertoprud, 2012).
Общее обилие макробентоса и другие структурные особенности сильно варьируют в разных северных регионах, что позволяет раздельно рассмотреть (предварительно) особенности трех арктических подзон: водоемы северной тайги (субарктическая зона). Суммарное обилие макробентоса в озерах этой зоны обычно низко (до 1–3 г/м2). В сообществах доминируют личинки насекомых, (часто наблюдается) сильная дистрофикация водоемов (закисление и смягчение воды, развитие торфянистых субстратов на дне), препятствующая обитанию высших ракообразных и моллюсков; водоемы южной и средней тундры (гипоарктическая зона). Cуммарное обилие макробентоса относительно высоко (в среднем 3–5, на о. Колгуев – ~20 г/м2). Дистрофирующие эффекты менее выражены по сравнению с северной тайгой. Массовые, хотя спорадично распространенные бокоплавы (обычно Gammarus lacustris) резко увеличивают общую биомассу и частично вытесняют личинок насекомых, роль которых в сообществах существенно снижается; водоемы пригляциальной островной тундры (Высокая Арктика). Суммарное обилие макробентоса в водоемах снова снижается до 1–2 г/м2, в первую очередь, из-за полного отсутствия высших ракообразных и моллюсков. Таксономическое разнообразие макробентоса резко падает. Донные сообщества укомплектованы личинками насекомых одного сем. Chironomidae, доля которых по биомассе достигает 80–100%.
Описанные нами тенденции структурных различий сообществ макрозообентоса высоких широт носят предварительный характер. Дальнейшие исследования на большем объеме данных позволят уточнить общие закономерности широтной изменчивости экосистем малых озер. Кроме того, пока мы не рассматривали типологию самих малых озер в каждом регионе, которая вносит в разнообразие озерных сообществ собственный вклад, вероятно, не меньший, чем географическая изменчивость.
Список литературы
Алексевнина М.С., Поздеев И.В., Преснова Е.В., Шипигузова М.В. 2011. Структура донных сообществ пруда на р. Малая Усолка (2007–2008 гг.) // Вестник Пермского ун-та. Вып. 1. С. 21.
Алимов А.Ф. 1979. Интенсивность обмена у водных пойкилотермных животных // Общие основы изучения водных экосистем. Ленинград: Наука. С. 5.
Батурина М.А., Лоскутова О.А., Фефилова Е.Б., Хохлова Л.Г. 2012. Зообентос озера Большой Харбей (Большеземельская тундра): современное состояние и анализ ретроспективных данных // Известия Коми научного центра УрО РАН. Вып. 4. № 12. С. 21.
Беляков В.П., Бажора А.И. 2016. Зообентос озер Ленинградской области и Санкт-Петербурга: влияние природных и антропогенных факторов // Известия Самарского науч. центра РАН. Т. 18. № 2. С. 297.
Богданов В.Д., Богданова Е.Н., Госькова О.А. и др. 2005. Экологическое состояние притоков Нижней Оби (реки Харбей, Лонготьеган, Щучья). Екатеринбург: Изд-во Уральского гос. ун-та.
Визер Л.С., Прусевич Л.С., Сукнев Д.Л. 2018. Перспективы рыбохозяйственного использования малых озер Новосибирской области // Вестник Новосибирского Государственного Аграрного Университета. Биология. Т. 2. № 47. С. 55.
Гелашвили Д.Б., Пухнаревич Д.А., Иудин Д.И. 2007. Структурная организация и фрактальная природа макрозообентоса малых городских водоемов // Поволжский экологический журнал. № 1. С. 3.
Герд С.В. 1956. Опыт биолимнологического районирования озер Карелии // Труды Карельского филиала АН СССР. Вопросы ихтиологии внутренних водоемов. Вып. 5. С. 47.
Денисов Д.Б., Валькова С.А., Терентьев П.М., Черепанов А.А. 2015. Экологические особенности малых ледниковых субарктических озер (Хибинский горный массив, Кольский полуостров) // Труды Карельского научного центра РАН. № 2. С. 40.
Ерёмова Н.Г., Орловская О.А. 1997. Сезонная динамика численности и биомассы макробентоса Нарочанских озер // Биология. С. 26.
Жадин В.И., Герд С.В. 1961. Реки, озера и водохранилища СССР, их фауна и флора. Москва: Учпедгиз.
Заделёнов В.А., Дубовская О.П., Бажина Л.В. и др. 2017. Новые сведения о биоте некоторых озер западной части плато Путорана // Журнал Сибирского федерального университета. Биология. Т. 10. № 1. С. 87.
Зверева О.С., Гецен М.В., Изъюрова В.К. 1964. Система реликтовых озер в Большеземельской тундре // Докл. Акад. наук. Т. 155. № 3. С. 677.
Китаев С.П. 1984. Экологические основы биопродуктивности озер разных природных зон (тундра, тайга, смешанный лес): Автореф. дис. … докт. биол. наук. Ленинград.
Куликова Т.П., Рябинкин А.В. 2015. Зоопланктон и макрозообентос малых водоемов разных типов ландшафтов Южной Карелии // Тр. Карел. Науч. Центра РАН. № 6. С. 47.
Кучко Я.А., Ильмаст Н.В., Кучко Т.Ю. 2019. Гидробиоценозы озера Тулос (юго-западная Карелия) // Самар. науч. вест. Т. 8. № 1. С. 54.
Лабай В.С. 2015. Макрозообентос малых равнинных озер острова Сахалин // Изв. ТИНРО. Т. 183. С. 145.
Лукашинец Л.А., Новик И.В. 2015. Влияние вселения карпа Сyprinus carpio Linnaeus, 1758 на сообщество макрозообентоса озерных экосистем // Докл. НАН Беларуси. Т. 59. № 6. С. 79.
Масюткина Е.А. 2018. Оценка экологического состояния водных объектов Калининградской области на основе структурно-функциональных и индикаторных свойств зообентоса: Дис. … канд. биол. наук. Калининград.
Определитель пресноводных беспозвоночных России и сопредельных территорий, в 6 томах. 1994–2004. Санкт-Петербург: Наука.
Решетников Ю.С., Попова О.А., Соколов Л.И. и др. 2003. Атлас пресноводных рыб России. Т. 2. Москва: Наука.
Ромашкова Ю.А. 2015. Малые озера урбанизированных территорий г. Тольятти: таксономический состав, структура донных сообществ // Самарская Лука: проблемы региональной и глобальной экологии. Т. 24. № 4. С. 32.
Силина А.Е. 2001. Предварительные результаты обследования макрозообентоса озера Погоново как кормовой базы бентосоядных рыб // Вестн. Воронеж. гос. ун-та. Серия химия, биология. № 2. С. 147.
Синицкий А.В., Захаров Е.В., Герасимов Ю.Л. 2002. Зоопланктон и зообентос воронежских прудов // Вестн. Самар. гос. ун-та. Спец. вып. С. 196.
Степанов Л.Н. 2017. Зообентос водоемов и водотоков бассейна реки Яраяха (Южный Ямал, Ямало-Ненецкий автономный округ) // Фауна Урала и Сибири. № 1. С. 116.
Степанов Л.Н. 2018. Зообентос озер мыса Каменный (п-ов Ямал, Ямало-Ненецкий автономный округ) // Фауна Урала и Сибири. № 1. С. 126.
Стерлигова О.П., Китаев С.П., Ильмаст Н.В. 2012. Состояние некоторых водоемов Северной Карелии и их использование для товарного выращивания радужной форели // Тр. Кольского научн. центра РАН. Прикладная экология Севера. Вып. 1. С. 182.
Хатчинсон Д. 1969. Лимнология. Москва: Прогресс.
Хицова Л.Н., Силина А.Е., Мелашенко М.В. 2010. Доминантно-информационная структура донных зооценозов пойменных водоемов в местах обитания бобра в Усманском бору // Вест. Воронеж. гос. ун-та. Серия Химия. Биология. Фармация. № 1. С. 127.
Чернов Ю.И. 1985. Среда и сообщества тундровой зоны // Сообщества Крайнего Севера и человек. Москва: Наука. С. 8.
Чертопруд М.В. 2014. Разнообразие реофильных сообществ макробентоса // Материалы лекций II-й Всероссийской школы-конференции “Экосистемы малых рек: биоразнообразие, экология, охрана” (Борок, 18–22 ноября 2014 г.). Т. 1. Ярославль: Филигрань. С. 112.
Ялынская Н.С. 1970. Содержание кальция у Gammarus balcanicus Schaff. // Гидробиол. журн. Т. 6. № 6. С. 33.
Blais J.M., Duff K.E., Laing T.E., Smol J.P. 1999. Regional Contamination in Lakes from the Noril’sk Region in Siberia, Russia // Water, Air, & Soil Pollution. V. 110. P. 389.
Bolotov I., Bespalaya J., Aksenova O. et al. 2014. Mollusks in the zoobenthos of relict lakes with abnormally high biological production in the Eastern European Subarctic // Inl. Water Biol. V. 7. № 1. P. 61. https://doi.org/10.1134/S1995082914010040
Braun-Blanquet J. 1964. Pflanzensociologie. Wien: Springer.
Chertoprud M. 2011. Diversity and classification of rheophilic communities of macrozoobenthos in middle latitudes of European Russia // Biol. Bull. Rev. V. 1. № 3. P. 165. https://doi.org/10.1134/S2079086411030017
Chertoprud M., Palatov D. 2013. Rheophilic communities of macrobenthos of the Southwestern Kola peninsula // Inl. Water Biol. V. 6. № 4. P. 305. https://doi.org/10.1134/S1995082913040056
Chertoprud M., Palatov D., Dimante-Deimantovica I. 2017. Macrobenthic communities in water bodies and streams of Svalbard, Norway // J. Nat. History. V. 51. № 47. P. 2809. https://doi.org/10.1080/00222933.2017.1395092
Culp J., Lento J., Goedkoop W. et al. 2012. Developing a circumpolar monitoring framework for Arctic freshwater biodiversity // Biodiversity. V. 13. № 3. P. 215. https://doi.org/10.1080/14888386.2012.717526
Dodds W., Whiles M. 2010. Freshwater Ecology. Concepts and Environmental Applications of Limnology. Amsterdam: Elsevier.
Dubovskaya O.P., Kotov A.A., Korovchinsky N.M. et al. 2010. Zooplankton of lakes in the spurs of the Putorana Plateau and adjacent territories (North of Krasnoyarsk Krai) // Contemp. Probl. Ecol. V. 3 P. 401.
Jensen T., Walseng B., Hessen D. et al. 2019. Changes in trophic state and aquatic communities in high Arctic ponds in response to increasing goose populations // Freshwater Biol. P. 1. https://doi.org/10.1111/fwb.13299
Hynynen J. 2004. Anthropogenic changes in Finnish lakes during the past 150 years inferred from benthic invertebrates and their sedimentary remains. Jyveäkylä: University of Jyveäkylä.
Hynynen J., Meriläinen J. 2005. Recovery from acidification in boreal lakes inferred from macroinvertebrates and subfossil chironomids // Hydrobiologia. V. 541. P. 155. https://doi.org/10.1007/s10750-004-5290-42005
Hayden B., Harrod C., Thomas S. et al. 2019. From clear lakes to murky waters – tracing the functional response of high-latitude lake communities to concurrent “greening” and ‘browning’ // Ecology Letters. V. 22. № 5. P. 807. https://doi.org/10.1111/ele.13238
Lougheed V., Butler M., McEwen D., Hobbie J. 2011. Changes in tundra pond limnology: Re-sampling Alaskan ponds after 40 years // Ambio. V. 40. P. 589.
Meriläinen J., Hynynen J. 1990. Benthic invertebrates in relation to Finnish forest lakes //Acidification in Finland. Berlin: Springer. P. 1029.
Moiseenko T., Sharov A., Vandish O. et al. 2009. Long-term modification of Arctic lake ecosystems: Reference condition, degradation under toxic impacts and recovery (case study Imandra Lakes, Russia) // Limnologica. V. 39. P. 1.
Mousavi S. 2002. Boreal chironomid communities and their relations to enviromental factors – the impact of lake depth, size and acidity // Boreal Environ. Res. V. 7. P. 63.
Namayandeh A., Quinlan R. 2011. Benthic macroinvertebrate communities in Arctic lakes and ponds of central Nunavut, Canada // Arctic, Antarctic, and Alpine Research. V. 43. № 3. P. 417.
Novoselov A.P., Studenov I.I., Koz’min A.K. et al. 2017. Species diversity and dynamics of the fish fodder base indicators of the Lacha lake. Part 2. Zoobenthosс // Arctic Environmental Research. V. 17. № 3. P. 233.
Northington R., Keyse M., Beaty S. et al. 2010. Benthic secondary production in eight oligotrophic arctic Alaskan lakes // Journal of the North American Benthological Society. V. 29. № 2. P. 465. https://doi.org/10.1899/09-026.1
Palatov D., Chertoprud M. 2012. The Rheophilic fauna and Invertebrate Communities of the Tundra Zone: A Case Study of the Southern Yamal // Inl. Water Biol. V. 5. № 1. P. 19. https://doi.org/10.1134/S1995082912010117
Rautio M., Dufresne F., Laurion I. et al. 2011. Shallow freshwater ecosystems of the circumpolar Arctic // Ecoscience. V. 18. № 3. P. 204. https://doi.org/10.2980/18-3-3463
Silina A.E., Prokin A.A. 2008. The trophic structure of macrozoobenthos in marsh water bodies of the forest-steppe zone in the Middle Russian Hills // Inland Water Biology. V. 1. № 3. P. 231
Skreslet S., Foged N. 1970. The Ecosystem of the Arctic Lake Nordlaguna, Jan Mayen Island. II. Plankton and Benthos // Astarte. V. 3. P. 53.
Vincent W., Hobbie J., Laybourn-Parry J. 2008. Introduction to the limnology of high-latitude lake and river ecosystems // Polar lakes and rivers – limnology of Arctic and Antarctic aquatic ecosystems. Oxford: Oxford Univ. Press. V. 11. P. 1.
Walseng B., Jensen T., Dimante-Deimantovica I. et al. 2018. Freshwater diversity in Svalbard; providing baseline data for ecosystems in change // Polar Biol. V. 41. № 10. P. 1995. https://doi.org/10.1007/s00300-018-2340-3
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


