Биология внутренних вод, 2021, № 5, стр. 472-480
Особенности распределения зоопланктона в зоне влияния притоков водохранилищ Средней Волги
a Государственный природный заповедник “Присурский”
Чебоксары, Россия
b Чувашский государственный университет им. И.Н. Ульянова
Чебоксары, Россия
* E-mail: verde@mail.ru
Поступила в редакцию 22.12.2020
После доработки 12.01.2021
Принята к публикации 28.01.2021
Аннотация
Проанализировано пространственное размещение сообществ зоопланктона на участке р. Волги (Чебоксарское и Куйбышевское водохранилища), включающем зоны с различным гидрологическим режимом. По продольному профилю реки наблюдается постепенное изменение их состава и видовой структуры. Сообщества литорали различных участков более сходны между собой, чем с сообществами пелагиали. В устьевой зоне притока эффект экотона проявляется в смешении фаун, но не в увеличении видового богатства. Глубина и температура воды определяют основную часть вариаций в составе сообществ.
ВВЕДЕНИЕ
Водохранилища сочетают в себе совокупность условий, характерных для разного типа водоемов, и представляют собой сложную квазиприродную систему. В связи с этим важно изучение закономерностей распределения сообществ в крайне гетерогенной среде водохранилищ и выявление определяющих его факторов. Вопрос о дискретности и континуальности, а также размерах дискретных пятен планктона в водохранилище обсуждался в работе Шургановой и др. (2014). Однако пространственная организация дискретных сообществ в условиях синергетического эффекта от влияния различных факторов требует дополнительного изучения.
Изменения видовой структуры сообществ зоопланктона Чебоксарского водохранилища исследованы с момента его заполнения (Шурганова, Черепенников, 2010). Особенности ее формирования на современном этапе развития представлены в работе (Шурганова и др., 2014). В Волжском плесе Куйбышевского водохранилища изучена трофическая структура зоопланктона на открытом и заросшем макрофитами мелководье (Борисович, Яковлев, 2011). Зоопланктон всего участка р. Волги от нижней части Чебоксарского водохранилища до Волжского плеса Куйбышевского водохранилища исследован Лазаревой и др. (2012, 2018) без детализации распределения в пространстве.
Цель работы – выявить закономерности пространственного размещения (по продольному, поперечному и вертикальному профилям водоемов) сообществ зоопланктона на участках Чебоксарского и Куйбышевского водохранилищ, характеризующихся разной проточностью и находящихся под влиянием их притоков.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Наблюдения проводили на Чебоксарском (август–ноябрь 2011 г.) и Куйбышевском (август 2011 г.) водохранилищах и их притоках (август 2008–2013 гг.) (рис. 1). Пробы отбирали планктобатометром объемом 10 л и сетью Апштейна с размером ячеи 120 мкм, фильтрация 50–100 л воды. Собранный материал фиксировали 4%-ным формалином. Определяли численность и биомассу каждого вида ракообразных и коловраток. В местах отбора проб зоопланктона измеряли температуру воды с помощью термометра, встроенного в планктобатометр, или термооксиметра Кит 5Э.
Рис. 1.
Схема расположения исследованных участков и точек отбора проб. 1 – приплотинная часть Чебоксарского водохранилища; 2 – речной участок Куйбышевского водохранилища; 3 – Волжский плес Куйбышевского водохранилища, точки отбора проб обозначены звездочками (*).

В Чебоксарском водохранилище материал собран в литорали ниже устья р. Парат (Ch1) и на мелководье левого берега р. Волги (1–4 км ниже г. Чебоксары) (Ch2), а также в пелагиали того же участка с поверхности и у дна на глубине 10–12 м (Ch3_1 и Ch3_2). В Куйбышевском водохранилище исследовали два участка. В верхней речной проточной части Волжского плеса с сохранившимся коренным руслом р. Волги пробы отбирали в 10 км ниже Чебоксарской ГЭС (K1_1 и K1_2), 1 км выше устья р. Цивиль (с поверхности и у дна на глубине 5 м) (K2), в районе впадения р. Цивиль (с поверхности и у дна на глубине 3 м) (K3_1 и K3_2), против г. Мариинский Посад (с поверхности) (K4). На участке Волжского плеса от устья р. Свияга до г. Казань обследовали поверхностный слой 0–1 м на 11 станциях в пелагиали (K5, 7, 8, 10, 12–14, 16–19) и на четырех в литорали (K6, 9, 11, 15). Кроме того, материал собирали в устьевых зонах рек Парат (левый приток нижней части Чебоксарского водохранилища) (Ch_P), Илеть (K_I) и Цивиль (K_Z) (соответственно левый и правый притоки Волжского плеса Куйбышевского водохранилища).
Приплотинный участок Чебоксарского водохранилища и Волжский плес ниже устья р. Свияга Куйбышевского водохранилища рассматривали как малопроточные, верхний речной участок Волжского плеса – как проточный (табл. 1). Влияние вод водохранилища на фауну притока изучали на примере р. Цивиль (длина 197 км) от истока до устья. Более подробно материал собирали в нижнем течении реки на трех участках: выше зоны контакта вод реки и водохранилища (условно обозначен как “нижнее течение”), в зоне контакта (смешения) вод, где наблюдаются постоянные противотечения, и в устье.
Таблица 1.
Характеристика исследованных акваторий
| Водохранилище, участок | Коэффициент водообмена, год–1 | Скорость течения, м/с | Прозрачность, м |
Температура, °С (август, 2011) | |
|---|---|---|---|---|---|
| пелагиаль | литораль | ||||
| Чебоксарское вдхр., | 20.90* | – | – | – | – |
| приплотинный | – | 0*** | 0.9 | 22.0 ± 0.02 | 22.5 |
| Куйбышевское вдхр., | 4.11** | 0.02–0.10**** | – | – | – |
| речной | – | 0.65*** | 0.9–1.1 | – | – |
| Волжский плес | – | – | – | 19.4 ± 0.08 | 20.9 ± 0.05 |
В период наблюдений температура воды в Чебоксарском водохранилище была выше, чем в Куйбышевском (табл. 1), превышала таковую в аналогичный период типичного по термике 2008 г., но не достигала значений экстремально жаркого 2010 г. (Лазарева и др., 2012).
Для определения сходства сообществ обследованных участков на основе данных о численности отдельных видов, а также оценки влияния факторов (температуры, глубины, расположения в акватории) на состав фауны планктонных ракообразных применяли методы канонического корреляционного анализа (CCA) с использованием программы Canoco for Windows 4.5 (Ter Braak, 1988). Включенные в анализ данные предварительно нормализовали логарифмированием. Статистическую значимость взаимосвязей оценивали пермутационным тестом Монте-Карло с 4999 перестановками.
Значимость отдельного вида в сообществе (доминирование) оценивали на основе данных о его обилии с использованием функции рангового распределения (Федоров и др., 1977), а также по показателю его встречаемости (Песенко, 1982). Экологические группы организмов по способу передвижения и захвата пищи выделены согласно классификации Чуйкова (1981). При характеристике групп перечислены виды, составляющие основу биомассы (>5% суммарной биомассы).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Состав фауны и встречаемость общих видов. В Чебоксарском водохранилище за исследованный период выявлено 47 видов зоопланктеров: 19 – Rotifera, 22 – Cladocera, 6 – Copepoda; в Куйбышевском – 36 видов: 18 – Rotifera, 12 – Cladocera, 6 – Copepoda. В августе семь видов беспозвоночных отмечены одновременно, но с различной встречаемостью, в составе сообществ зоопланктона всех трех исследованных участков. Коловратки-вертикаторы Keratella cochlearis (Gosse, 1851) преобладают по встречаемости на слабопроточных участках обоих водохранилищ, Euchlanis lucksiana Hauer, 1930 – в Чебоксарском водохранилище. Ракообразные первичные фильтраторы Bosmina longirostris (O.F. Müller, 1776), а также активные хвататели Mesocyclops leuckarti (Claus, 1857) доминируют на слабопроточных участках обоих водохранилищ, Daphnia galeata Sars, 1863 – на проточном участке Куйбышевского водохранилища. Встречаемость в >50% проб на протяжении всего исследованного участка р. Волги отмечена для вертикатора Euchlanis dilatata Ehrenberg, 1832 и вторичного фильтратора Chydorus sphaericus (O.F. Müller, 1776).
Пространственное размещение по продольному профилю. Встречаемость Bosmina longirostris, Keratella cochlearis, Testudinella patina (Herman, 1783) и Trichocerca pusilla (Lauterborn, 1903) была в 2–3 раза выше на малопроточных участках обоих водохранилищ (приплотинного в Чебоксарском, Волжского плеса ниже р. Свияги в Куйбышевском). К речному проточному участку Куйбышевского водохранилища приурочены, т.е. обнаружены только здесь или их встречаемость в 3–12 раз выше, чем на остальных участках, ракообразные Mesocyclops leuckarti, Diacyclops crassicaudis (Sars, 1863), Daphnia galeata, Alona quadrangularis (O.F. Müller, 1776). Коловратки прудового комплекса, индикаторы повышенной сапробности вод Brachionus diversicornis (Daday, 1883), B. angularis Gosse, 1851 (встречаемость обоих в ~50% проб), B. calyciflorus Pallas, 1776, Synchaeta pectinata Ehrenberg, 1832 (встречаемость обоих <10% проб) отмечены только в Волжском плесе Куйбышевского водохранилища.
В пелагиали приплотинного участка Чебоксарского водохранилища в августе по биомассе доминировали плавающие первичные фильтраторы Daphnia galeata у поверхности воды и Limnosida frontosa Sars, 1862 в глубинном слое (43 и 89% биомассы сообщества соответственно), ползающе-плавающие вторичные фильтраторы Chydorus sphaericus (4–30%), плавающе-ползающие вертикаторы Euchlanis lucksiana (5–12%). Ниже по течению на речном участке Куйбышевского водохранилища повсеместно преобладали первичные Daphnia galeata (30–92%) и вторичные Chydorus sphaericus (6–69%) фильтраторы. Ниже устья р. Свияги к ним добавлялись плавающие первичные фильтраторы Bosmina longirostris, B. cf. crassicornis Lilljeborg, 1887 и вертикаторы Keratella cochlearis (9–31, 35–46 и 1–13% соответственно).
Зоопланктон пелагиали приплотинной части Чебоксарского и речного участка Куйбышевского водохранилищ представлен более крупными особями (средняя W 3.36 ± 1.87 и 4.33 ± 1.91 мг × 10–3 соответственно), по сравнению с таковыми в расположенном ниже по течению Волжском плесе (W 0.75 ± 0.13 мг × 10–3). Это объяснялось массовым развитием дафний.
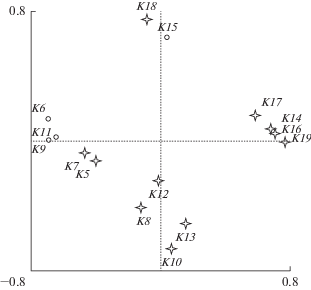
Уникальные виды в августе составляли существенную долю фауны (39–50%) каждого из трех обследованных участков. Однако использованный в работе статистический метод не позволил идентифицировать сообщества этих участков р. Волги как достоверно обособленные. Наблюдались переходные сообщества, в равной степени сходные с таковыми на обоих соседних участках реки. Результат канонического анализа, показан графически на рис. 2, где расстояние между точками определялось степенью сходства сообществ.
Рис. 2.
Ординация сообществ зоопланктона: а – приплотинной части Чебоксарского водохранилища
(○), речного проточного участка Куйбышевского водохранилища ( ) и Волжского плеса Куйбышевского водохранилища (∆), а также притоков водохранилищ
(×); б – то же, без Волжского плеса Куйбышевского водохранилища. Буквенные обозначения
см. в тексте.
) и Волжского плеса Куйбышевского водохранилища (∆), а также притоков водохранилищ
(×); б – то же, без Волжского плеса Куйбышевского водохранилища. Буквенные обозначения
см. в тексте.

Отчетливо выделялись ценозы мелководного прибрежья ниже впадения р. Парат в Чебоксарское водохранилище (Ch1, рис. 2б), а также устьевых областей притоков Чебоксарского (р. Парат, Ch_P) и Куйбышевского (р. Илеть, K_I; р. Цивиль – K_Z) водохранилищ, где наблюдалось смешение речной фауны с таковой водохранилища (рис. 2б). Это свидетельствовало о наличии факторов, способствующих дифференциации сообществ по поперечному профилю р. Волги (см. ниже).
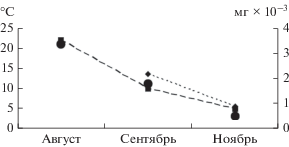
Пространственное размещение по поперечному профилю. В августе пелагиаль приплотинной части Чебоксарского водохранилища населяли несколько более крупные особи зоопланктона (W 3.36 ± 1.87 мг × 10–3), чем в прибрежной части (W 2.58 мг × 10–3). Эта тенденция в распределении зоопланктона наблюдалась не только летом, но и осенью перед ледоставом (W 1.78 ± 0.31 и 0.56 мг × 10–3 соответственно). В прибрежье Чебоксарского водохранилища более обильными по сравнению с пелагиалью были вторичные фильтраторы Chydorus sphaericus, Disparalona rostrata (Koch, 1841), Eurycercus lamellatus (O.F. Muller, 1776) и др. (в сумме 34% биомассы сообщества). В ноябре в литорали преобладали коловратки-вертикаторы (Keratella quadrata (O.F. Muller, 1786), Kellicottia longispina (Kellicott, 1879)), а также первичные (Bosmina longirostris) и вторичные (Acroperus angustatus Sars, 1863) фильтраторы ветвистоусых раков (26, 22 и 5% соответственно). Доля ювенильных особей веслоногих раков в это время достигала 17% биомассы планктона в литорали и >90% в пелагиали.
На речном проточном участке и в Волжском плесе Куйбышевского водохранилища в пелагиали обитали более мелкие особи (W 4.33 ± 1.91 и 0.75 ± 0.13 мг × 10–3 соответственно), чем в прибрежье (W 8.40 и 2.05 ± 1.14 мг × 10–3). В Волжском плесе это обусловлено обилием коловраток (26±4% суммарной биомассы) в пелагиали водохранилища, в литорали они формировали лишь 5±2% биомассы. В литорали речного проточного участка развивались крупные ракообразные фильтраторы Daphnia galeata и Eurytemora velox (Lilljeborg, 1853), предпочитающие менее динамичные гидрологические условия.
В августе зоопланктон литоральной части водохранилищ (точки l, рис. 3, 4) более сходен с сообществом беспозвоночных в глубинном слое пелагиали (точки b, рис. 3, 4), в ноябре – с тем, что развивается в поверхностном (точки s, рис. 3, 4). Сообщества литорали из различных участков более сходны между собой, чем с рядом расположенными пелагическими (рис. 5). Они развиваются при несколько более высоких температурах (20.9 ± 0.5°С), чем в открытой части водохранилища (19.4 ± 0.8°C). При этом влияние температурных условий на состав сообществ недостоверно (p > 0.05).
Рис. 3.
Ординация сообществ зоопланктона (обозначения их расположения см. в тексте) речного проточного участка Куйбышевского водохранилища в августе из литорали (l), поверхностных (s) и придонных (b) слоев воды пелагиали (h – направление изменения глубины).

Рис. 4.
Ординация сообществ зоопланктона приплотинной части Чебоксарского водохранилища в августе (08), сентябре (09) и ноябре (11) из литорали (l), поверхностных (s) и придонных (b) слоев воды пелагиали в пространстве факторов среды (температуры (t) и глубины (h)).

Рис. 5.
Ординация сообществ зоопланктона Волжского плеса Куйбышевского водохранилища в августе
из литорали (⚪) и поверхностных слоев пелагиали ( ). Числовые обозначения – порядковые номера станций по мере удаления от верховья.
). Числовые обозначения – порядковые номера станций по мере удаления от верховья.
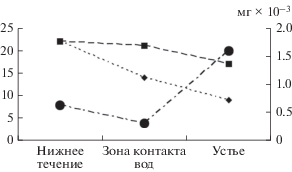
Некоторые аспекты размещения зоопланктона в устьевых зонах притоков. Влияние Куйбышевского водохранилища на гидрологический режим р. Цивиль прослежено на расстоянии 22.5 ± 4 км от устья. Однако характерные для водохранилища таксоны обнаружены выше устья р. Цивиль только на ~4 км – в зоне, где постоянно наблюдали противотечения со стороны водохранилища. Здесь в летний период повышалась прозрачность по диску Секки (до 0.45–0.55 м, в нижнем течении в целом до 0.25–0.45 м). Причем, даже на этом участке отмечена пространственная неоднородность зоопланктона. Это позволило выделить собственно устье и краевую зону смешения речных вод с водами водохранилища (зона контакта вод), выше которой влияние фауны водохранилища не прослежено. В зоне контакта >60% численности и биомассы сообщества представлено коловраткой Brachionus calyciflorus. Для сравнения, в нижнем течении реки ее численность была 3.5–7.0% общей. Этот вид встречался преимущественно в нижнем течении р. Цивиль (67% проб), в среднем течении его встречаемость достигала 13%. Также в нижнем течении реки были сравнительно многочисленны другие представители рода – B. quadridentatus (13–19% численности) и B. bennini Leissling, 1924 (1–17% численности) (Подшивалина, 2013). В зоне контакта вод они не обнаружены.
В устьевом створе р. Цивиль представленность типично речных форм относительно низка (рис. 6). Меняющиеся гидрологические условия, вызванные режимом наполнения и сброса воды из водохранилища, вероятно, не способствуют увеличению численности попадающих сюда речных представителей зоопланктона, поэтому в устье развиваются преимущественно относительно крупные ракообразные (рис. 6), типичные для водохранилища. Среди них ветвистоусые раки Limnosida frontosa, Leptodora kindtii (Focke, 1844), Daphnia cucullata Sars, 1862, D. galeata и веслоногие раки Eurytemora velox, Megacyclops viridis (Jurine, 1820). Таким образом, в устьевой области зарегистрировано смешение фаун притока и водохранилища, однако здесь не наблюдалось увеличение видового богатства зоопланктона (рис. 6), что считается типичным для экотона данного вида (Гидроэкология…, 2015). По-видимому, такая ситуация обусловлена выраженной изменчивостью гидрологических условий (перепад уровня воды на 1–2 м в течение суток, обратный ток воды), что не благоприятствует развитию коловраток и мелких ветвистоусых раков.
Рис. 6.
Общее число видов (--◼--), число типичных для реки (⋅⋅⋅◆⋅⋅⋅) в составе фауны р. Цивиль и средняя индивидуальная масса W (-⋅⚫⋅-) организма в нижнем течении и устье.
Одновременно с распространением видов из водохранилища в его притоки выявлено влияние вод реки на структуру зоопланктона водохранилища, вероятно, за счет изменения условий его обитания. В верхней части речного участка Куйбышевского водохранилища (рис. 3, точка 1) по численности доминировали коловратки рода Euchlanis, по биомассе – ветвистоусый рачок Daphnia galeata. В пелагиали водохранилища напротив устья р. Цивиль (рис. 3, точка 3) основу сообщества представлял Chydorus sphaericus (более половины численности и биомассы). Крупные ракообразные отмечены в устьевой зоне р. Цивиль (рис. 3, точка Z), но в самом водохранилище они были только в литорали выше устья притока (рис. 3, точка l). Характерные для нижнего течения р. Цивиль коловратки рода Brachionus на речном участке Куйбышевского водохранилища не обнаружены. Структура зоопланктона в водохранилище приобретала черты, близкие к исходным (рис. 3, точка 1), в 15 км ниже по течению р. Волги (рис. 3, точка 4). Таким образом, в водохранилище ниже устья притока (рис. 3, точка 3) наблюдалось рассеивание речного сообщества в волжском.
Особенности вертикального размещения сообществ. По результатам канонического анализа состав зоопланктона глубоководной зоны Чебоксарского водохранилища с лимническими условиями различен на разных глубинах (рис. 3, 4) (F = 1.77; р = 0.04). Сообщества поверхностного слоя воды различных участков более сходны между собой, чем с таковыми в придонном горизонте. В отдельной точке зоопланктон поверхностного и глубинного слоя наиболее близок в августе (рис. 4), трофическая структура сообщества не различалась по вертикали. Осенью различия заметнее, при сходном видовом составе они проявляются в особенностях трофической структуры. Так, в сентябре в Чебоксарском водохранилище ветвистоусые раки первичные фильтраторы обильнее в придонном слое (63–71% суммарной биомассы), чем в поверхностном (25–51%). В группе веслоногих раков, осуществляющих активный захват пищи, вертикальное распределение было обратным: 0–5% у дна и 25–42% у поверхности. Также распределялись и копеподы на ювенильных стадиях развития (4–6% у дна и 28–23% у поверхности). Коловратки-вертикаторы в сентябре предпочитали большие глубины (21–30% суммарной биомассы), в поверхностном слое их было существенно меньше (2–4%).
На проточном речном участке Куйбышевского водохранилища достоверная (р < 0.05) зависимость состава зоопланктона от глубины не выявлена. По-видимому, это связано с вертикальной однородностью распределения зоопланктеров, обусловленной проточностью. Возможно, воды крупного притока (р. Цивиль) также способствуют формированию однородной вертикальной структуры сообщества.
Особенности распределения зоопланктона в разные сезоны. В августе в пелагиали приплотинного участка Чебоксарского водохранилища по биомассе доминировали крупные первичные фильтраторы Daphnia galeata (у поверхности 89%) и Limnosida frontosa (в глубинном слое 41%), по численности – вторичный фильтратор Chydorus sphaericus (у поверхности 17–28%) и коловратка-вертикатор Euchlanis lucksiana (24–35%).
В сентябре в доминирующий комплекс видов входили более мелкий первичный фильтратор Bosmina longirostris (29–48% по численности и 25–71% по биомассе), хищные и всеядные хвататели, представленные взрослыми и ювенильными особями Mesocyclops leuckarti (40% по биомассе) и Thermocyclops oithonoides (Sars) (26%), а также ползающе-плавающий вертикатор Brachionus quadridentatus (11–45% численности). Перед ледоставом в составе планктона отмечены в основном циклопы разных ювенильных стадий развития.
Среди факторов среды, изменяющихся в течение сезона, на состав зоопланктона влияла температура воды, по данным канонического анализа она определяла 39% различий состава сообществ. Для Чебоксарского водохранилища это влияние достоверно (F = 1.67, р = 0.002). При снижении температуры воды к осени уменьшалась средняя W особей (рис. 7) и возрастал вклад в сообщество мелких фильтраторов и ювенильных особей Cyclopoida, характеризующихся смешанным питанием. Это отражало ход сезонной сукцессии зоопланктона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В Чебоксарском водохранилище выделяют левобережный речной, правобережный речной, переходный и озерный зоопланктоценозы (Шурганова и др., 2014). Состав зоопланктона исследованной приплотинной части этого водохранилища сходен с описанным “озерным” сообществом (Шурганова и др., 2014). Он характеризуется наличием общих видов с расположенными ниже по течению участками Волжского плеса Куйбышевского водохранилища. По-видимому, между сообществами двух водохранилищ существуют тесные взаимосвязи, не выявлено признаков, позволяющих четко разграничить их друг от друга. Вариации проточности служат одним из определяющих факторов формирования сообществ по продольному профилю исследованного участка р. Волги. Отмечены изменения структуры зоопланктона: в обоих водохранилищах на участках с замедленным течением более разнообразно и обильно представлены плавающие и плавающе-ползающие коловратки-вертикаторы, на относительно более проточных участках – первичные и вторичные фильтраторы ракообразные. Подобное характерно для лотических объектов различного масштаба (Крылов, 2005; Лазарева, 2010; Чертопруд, 2011).
Пограничные (экотонные) сообщества расположены по периметру водохранилищ в устьях притоков и литорали. Они граничат с другими экосистемами, испытывают влияние сочетания разнотипных факторов и отличаются заметным своеобразием. Зоопланктон в устьевых зонах притоков и в литорали обоих водохранилищ характеризуется значительной обособленностью от пелагического, что определяет дифференциацию сообществ по поперечному профилю. В литорали, как и в пелагиали, наблюдается постепенная смена сообществ по продольному профилю р. Волги. Таким образом, в прибрежной и пелагической зонах складываются параллельные континуумы. Это может быть обусловлено характерными для лотических систем дрифтовыми процессами с переносом вещества по продольному профилю (Богатов, 2013).
Сходство между пелагическими и литоральными сообществами меньше, чем между расположенными вдоль русла р. Волги, и определяется скоростью течения. На проточных участках различия сообществ в поперечном профиле выражены в большей степени. Установленная картина распределения сообществ на исследованном участке р. Волги близка к комбинированной концепции организации речных экосистем, основанной на расширенном представлении о речном континууме (Богатов, 2013; Батурина, 2019). В формировании континуума реки участвует все сообщество водотока, при этом взаимодействие между отдельными зонами осуществляется через систему взаимодействия следующих друг за другом локальных сообществ, приуроченных к конкретным разнородным биотопам (Богатов, 2013).
Сложно четко определить границы сообществ водохранилища в устьях притоков. Это переходные зоны между экосистемами рек и водохранилищ, что отмечалось и ранее (Крылов, 2005; Гидроэкология…, 2015). Причем протяженность этих зон определяется гидрологическим режимом и может быть достаточно большой. Индикатором переходной зоны в устье р. Цивиль может служить коловратка-вертикатор Brachionus calyciflorus. Ее численность существенно выше в зоне контакта (смешения) вод по сравнению с соседними сообществами. Подобное может быть проявлением действия r-отбора в условиях нестабильной среды (Охапкин, Юлова, 1993).
Наряду с видами, характерными для исследованного региона, в устьевой части р. Цивиль отмечен обитатель субтропических и тропических широт Keratella tropica (Apstein, 1907) (Кутикова, 1970), а также теплолюбивый Brachionus budapestinensis Daday, 1885. Ветвистоусый рачок Diaphanosoma orghidani Negrea, 1982 отмечен в устьевых областях рек Илеть и Цивиль, а также на участках этих притоков в подпоре Куйбышевского водохранилища. Северная граница распространения этого вида, ранее достаточно редкого, проходит на ~57° с.ш., (Коровчинский, 2004). В настоящее время он обитает по всей р. Волге (Лазарева, 2012; Лазарева и др., 2018). В водохранилищах D. orghidani нами не выявлена, однако она известна для Чебоксарского водохранилища (Лазарева, 2012; Шурганова и др., 2014). На примере Рыбинского водохранилища показано (Лазарева, 2012), что D. orghidani концентрируется в наиболее проточных приустьевых участках малых рек-притоков. Как отмечено ранее (Лазарева, 2008), продвижение южных видов на север обусловлено созданием водохранилищ, причем вселенцы поначалу заселяют устья притоков (Лазарева, 2010).
Влияние самих притоков на фауну водохранилища прослеживается несколько в ином аспекте. Воды притока влияют не на состав, а, преимущественно, на структуру сообщества планктонных беспозвоночных водохранилища. Это воздействие состоит в изменении условий их обитания. В первую очередь изменяются физико-химические условия: скорость течения, солевой состав вод, содержание питательных веществ (Муравейский, 1960). В водохранилищах р. Волги это способствует массовому развитию веслоногих ракообразных, осуществляющих активный захват пищи (до 24 ± 1% биомассы) и вторичных фильтраторов из числа ветвистоусых ракообразных (до 53 ± 11%) при уменьшении доли первичных фильтраторов до 17 ± 12%.
Глубина и температура воды в равной степени определяют основную часть (78%) вариаций состава зоопланктона, каждый из факторов объясняет 39% вариаций. В каждом горизонте вод р. Волги температурные условия и содержание пищевых объектов (фито-, бактериопланктон, детрит) относительно однородны (Корнева, 2015). Это определяет большее сходство структуры сообществ в одном горизонте по сравнению с таковыми в разных вертикальных слоях воды.
Сезонные изменения структуры зоопланктона в позднелетне-осенний период обусловлены завершением жизненных циклов крупных летних теплолюбивых видов и замещением их мелкими видами, менее требовательными к пищевым условиям. Выявленные нами изменения структуры зоопланктона изученного участка р. Волги сходны с теми, что описаны для зоопланктона открытой литорали Куйбышевского водохранилища (Борисович, Яковлев, 2011) и пелагиали Рыбинского водохранилища (Верхняя Волга) (Лазарева, 2010).
Выводы. Результаты анализа распределения зоопланктона по продольному профилю исследованного участка р. Волги, включающего зоны с различным гидрологическим режимом, свидетельствуют о постепенном изменении состава и видовой структуры сообщества, что соответствует расширенной модели континуума как последовательного однонаправленного накопления отличий от верхних участков к расположенным ниже по течению. Сообщества различных участков литорали более сходны между собой, чем с соседними пелагическими. В устьевой зоне малой реки-притока Куйбышевского водохранилища выявлено смешение фаун, но не отмечено типичного для экотона повышенного уровня видового богатства планктонных беспозвоночных. Вероятно, это связано с неблагоприятным для ряда видов гидрологическим режимом. Глубина и температура воды в наибольшей степени влияют на изменение структуры сообществ по вертикали. В конце вегетационного сезона при снижении температуры воды наблюдается уменьшение средней индивидуальной массы W особей зоопланктона.
Список литературы
Батурина Н.С. 2019. Закономерности организации речных экосистем: ретроспектива становления современных концепций (обзор) // Биология внутр. вод. № 1. С. 3. https://doi.org/10.1134/S0320965219010042
Богатов В.В. 1994. Экология речных сообществ Российского Дальнего Востока. Владивосток: Дальнаука.
Богатов В.В. 2013. О закономерностях функционирования речных экосистем в свете базовых научных концепций // Вестник Северо-Восточного центра ДВО РАН. Гидробиология. № 4. С. 90.
Борисович М.Г., Яковлев В.А. 2011. Трофическая структура зоопланктона разнотипных мелководий Волжского и Волжско-Камского плесов Куйбышевского водохранилища // Ученые записки Казанского университета. Сер. Естеств. науки. Т. 153. С. 214.
Гидроэкология устьевых областей притоков равнинного водохранилища. 2015. Ярославль: Филигрань.
Коровчинский Н.М. 2004. Ветвистоусые ракообразные отряда Ctenopoda мировой фауны (морфология, систематика, экология, зоогеография). Москва: Товарищество науч. изданий КМК.
Корнева Л.Г. 2015. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской печатный дом.
Крылов А.В. 2005. Зоопланктон равнинных малых рек. Москва: Наука.
Куйбышевское водохранилище (научно-информационный справочник). 2008. Тольятти: Ин-т экологии Волжск. бассейна РАН.
Кутикова Л.А. 1970. Коловратки фауны СССР. Ленинград: Наука.
Лазарева В.И. 2008. Распространение и особенности натурализации новых и редких видов зоопланктона в водоемах бассейна Верхней Волги в начале XXI века // Биология внутр. вод. № 1. С. 81.
Лазарева В.И. 2010. Структура и динамика зоопланктона Рыбинского водохранилища. Москва: Товарищество науч. изданий КМК.
Лазарева В.И. 2012. Распространение видов рода Diaphanosoma (Crustacea, Cladocera) в водохранилищах рек Волги и Шексны: влияние факторов среды // Биология внутренних вод. № 3. С. 33.
Лазарева В.И., Минеева Н.М., Жданова С.М. 2012. Пространственное распределение планктона в водохранилищах Верхней и Средней Волги в годы с различными термическими условиями // Поволжский экологический журнал. № 4. С. 394.
Лазарева В.И., Сабитова Р.З., Соколова Е.А. 2018. Особенности структуры и распределения позднелетнего (август) зоопланктона в водохранилищах Волги // Тр. Инст. биол. внутр. вод РАН. № 82(85). С. 28.
Литвинов А.С., Законнова А.В. 1986. Водный баланс, водообмен и режим уровня Чебоксарского водохранилища в первые годы заполнения // Водные ресурсы. № 3. С. 69.
Муравейский С.Д. 1960. Животный планктон реки Керженца // Реки и озера. Москва: Гос. изд-во геогр. литературы. С. 308.
Охапкин А.Г., Юлова Г.А. 1993. Анализ динамических взаимодействий водохранилища и эвтрофированного притока по показателям видовой структуры фитопланктона // Экологические проблемы бассейнов крупных рек. Тольятти: Ин-т экологии Волжск. бассейна РАН. С. 112.
Песенко Ю.А. 1982. Принципы и методы количественного анализа в фаунистических исследованиях. Москва: Наука.
Подшивалина В.Н. 2013. Распределение зоопланктона по продольному профилю малой реки в условиях высокой антропогенной нагрузки (на примере р. Цивиль, Среднее Поволжье) // Известия Самарского научного центра РАН. Т. 15. № 1(3). С. 503.
Федоров Е.Д., Кондрин Е.К., Левич А.П. 1977. Ранговое распределение фитопланктона Белого моря // Доклады академии наук СССР. Т. 236. № 1. С. 264.
Чертопруд М.В. 2011. Разнообразие и классификация реофильных сообществ макробентоса средней полосы европейской России // Журн. общей биологии. Т. 72. № 1. С. 51.
Чуйков Ю.С. 1981. Методы экологического анализа состава и структуры сообществ водных животных. Экологическая классификация беспозвоночных, встречающихся в планктоне пресных вод // Экология. № 3. С. 71.
Шурганова Г.В., Черепенников В.В. 2010. Динамика видовой структуры зоопланктоценозов двух волжских водохранилищ в процессе их формирования и развития // Журнал Сибирского федерального университета. Сер. Биология. Т. 3. № 3. С. 267.
Шурганова Г.В., Черепенников В.В., Кудрин И.А., Ильин М.Ю. 2014. Характеристика современного состояния видовой структуры и пространственного размещения сообществ зоопланктона Чебоксарского водохранилища // Поволжский экологический журнал. № 3. С. 417.
Эдельштейн К.К. 1998. Водохранилища России: экологические проблемы и пути их решения. Москва: ГЕОС.
Ter Braak C.J.F. 1988. CANOCO – a FORTRAN program for canonical community ordination. New York: Power Microcomputer.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод