Биология внутренних вод, 2022, № 2, стр. 147-157
Расселение восточно-азиатской копеподы Thermocyclops taihokuensis (Crustacea, Cyclopoida) в бассейне р. Волги
В. И. Лазарева a, *, С. М. Жданова a, Р. З. Сабитова a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл, Россия
* E-mail: lazareva_v57@mail.ru
Поступила в редакцию 19.02.2021
После доработки 17.03.2021
Принята к публикации 26.05.2021
- EDN: TNBBIC
- DOI: 10.31857/S0320965222010065
Аннотация
В 2016–2019 гг. копепода Thermocyclops taihokuensis (Harada, 1931) обнаружена в четырех районах бассейна р. Волги, удаленных друг от друга на расстояние 270–1000 км. Вселенец обитает в Шатском водохранилище (бассейн р. Ока), в озеровидной части Чебоксарского водохранилища (Средняя Волга), в Волжском и Волго-Камском плесах Куйбышевского водохранилища (Средняя Волга) и в речном участке Нижней Волги от с. Черный Яр до г. Астрахань. Численность вселенца варьирует от <1 до >100 тыс. экз./м3. На север Европейской России вид расселился до 56° с.ш. (устье р. Сура), на запад – до 38° в.д. (Шатское водохранилища). В Нижней Волге вселенец является наиболее массовым представителем Cyclopoida и обитает совместно с аборигенным Th. crassus. В Чебоксарском и Куйбышевском водохранилищах он сосуществует с двумя аборигенными видами рода (Th. oithonoides и Th. crassus), при доминировали последних. Конкурентоспособность и успешное расселение вселенца в Европейской России определяется его высокой плодовитостью и длительным периодом размножения.
ВВЕДЕНИЕ
Река Волга представляет часть важнейшего для Европейской России черноморско-каспийско-волжского транзитного пути (инвазионного коридора) расселения водных организмов (Slyn’ko et al., 2002). После формирования каскада водохранилищ река стала основным путем проникновения на север Европейской России понто-каспийских и других южных видов зоопланктона, а также стока c водой вниз по течению реки на юг ряда северных видов (Мордухай-Болтовской, Дзюбан, 1976; Волга…, 1978). В 2010-х гг. появились сведения о быстром распространении в р. Волге другой группы чужеродных видов, происходящих из регионов, удаленных от бассейнов Каспийского и Черного морей. Так, в 2012‒2015 гг. в Иваньковское и Чебоксарское водохранилища вселилась американская коловратка Kellicottia bostoniensis (Rousselet, 1908) (Лазарева, Жданова, 2014; Shurganova et al., 2017). В 2012‒2017 гг. в водоемы Волго-Ахтубинской поймы и р. Волгу ниже г. Волгоград проник восточно-азиатский Thermocyclops taihokuensis (Harada, 1931) (sin. Th. asiatiсus (Kiefer, 1932)) (Нечаев, 2016; Лазарева и др., 2018). В 2018 г. этот вид обнаружен в устьевой области р. Сура (Чебоксарское вдхр.) (Жихарев и др., 2019).
Основной ареал Th. taihokuensis охватывает Центральную и Восточную Азию (Mirabdullayev, Kuzmetov, 1997; Guo, 1999; Mirabdullayev et al., 2003; Monchenko, 2008; Dela Paz et al., 2016). Вид также известен из Казахстана и Узбекистана (Mirabdullayev, Kuzmetov, 1997; Mirabdullayev et al., 2003; Monchenko, 2008; Степаньянц и др., 2015; Калымбетова, 2017). В 2000-х гг. Th. taihokuensis обнаружен в Северо-Восточном и Среднем Каспии (Monchenko, 2008; Шарапова, 2014; Степаньянц и др., 2015). До 2010 г. его не находили севернее Арала (47° с.ш.) и западнее устья р. Урал (52° в.д.) (Monchenko, 2008; Степаньянц и др., 2015).
Цель работы – описать распространение Th. taihokuensis в водохранилищах бассейна р. Волги и незарегулированном участке реки ниже г. Волгоград, а также проанализировать популяционные характеристики Th. taihokuensis в разных биотопах.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В каскаде р. Волги восемь крупных водохранилищ (Иваньковское, Угличское, Рыбинское, Горьковское, Чебоксарское, Куйбышевское, Саратовское и Волгоградское), их трофический статус варьирует от мезотрофного до высоко эвтрофного (Минеева и др., 2020). Выделяют Верхнюю Волгу, нижней границей которой служит плотина Рыбинской ГЭС, Среднюю Волгу с южной границей по Жигулевской ГЭС и Нижнюю Волгу, включающую два водохранилища (Саратовское и Волгоградское) и участок незарегулированной реки ниже Волжской ГЭС (Волга…, 1978). В 2015–2019 гг. ежегодно изучали зоопланктон р. Волги от верховьев Иваньковского вдхр. до г. Астрахань, с 2018 г. дополнительно обследовали устьевые области крупных притоков р. Волги. Пробы отбирали ежегодно в августе на 8–20 станциях каждого водоема, преимущественно в пелагиали. Кроме того, в начале октября 2019 г. изучен зоопланктон Любовского пруда-охладителя Новомосковской ГРЭС на Шатском вдхр. (Тульская обл.). Шатское вдхр. расположено в верховье р. Шат, которая относится к системе р. Ока (бассейн Средней Волги).
На крупных водохранилищах ракообразных учитывали в тотальных пробах зоопланктона, которые отбирали сетью Джеди с диаметром входного отверстия 12 см и ситом с размером ячеи 74 мкм. Облавливали весь столб воды – от дна до поверхности водоема. В прибрежье Шатского вдхр. пробы отбирали мерным ведром с последующей концентрацией планктона через сито с ячеей 74 мкм, фильтровали 100 л воды. Все сборы фиксировали 4%-ным формалином и просматривали в лаборатории под стереомикроскопом “StereoDiscovery-12” (Carl Zeiss, Jena). Таксономическую идентификацию копепод рода Thermocyclops проводили с использованием работ (Рылов, 1948; Монченко, 1974; Guo, 1999; Mirabdullayev et al., 2003; Monchenko, 2008; Dela Paz et al., 2016).
В пробах определяли общую численность и возрастную структуру популяции Th. taihokuensis, размеры половозрелых рачков и плодовитость самок. Численность приведена с учетом копеподитов и науплиусов, количество которых принимали пропорциональным обилию взрослых особей рода Thermocyclops, обнаруженных в пробе. Длину тела рачков измеряли с помощью окулярного микрометра 50/10 мм “Stemi” при увеличении ×25–50. Фотографии выполнены камерой “AxioCam MRс5” (микроскоп “StereoDiscovery V.12”) при увеличении ×60, а также “NikonDS-Fi1” (микроскоп “Nikon Eclipse 80i”) при увеличении ×20–60.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Распространение и среда обитания. Копепода Th. taihokuensis обнаружена в четырех районах бассейна р. Волги, удаленных друг от друга на значительное расстояние (270–1000 км) (рис. 1). Первый и наиболее западный район обитания Th. taihokuensis расположен в юго-восточной части бассейна р. Ока вблизи водораздела рек Волга и Дон (бассейн Средней Волги). Это Шатское вдхр. на р. Шат, в его подпоре находятся устьевые области притоков – рек Любовка, Аселок и Белоколодезь (рис. 1). Площадь водоема 12.5 км2, максимальная глубина 13 м (Григорьева, 2021). В Любовском заливе водохранилища расположен пруд-охладитель Новомосковской ГРЭС, где осенью 2019 г. впервые был обнаружен вселенец.
Рис. 1.
Распространение Thermocyclops taihokuensis в бассейне р. Волги. 1 – Шатское вдхр., 2 – Чебоксарское вдхр., 3 – Куйбышевское вдхр., 4 – р. Волга ниже г. Волгоград.
Второй и самый северный район находится в пределах Чебоксарского вдхр. (Средняя Волга) от устьевой области р. Сура до плотины Чебоксарской ГЭС (110 км). Здесь Th. taihokuensis впервые обнаружен в 2016 г. на семи станциях, удаленных друг от друга на 3–50 км. В последующие годы его регистрировали почти ежегодно, встречаемость варьировала от 40 до 70% проб. В этом районе Th. taihokuensis не обнаружен только в холодном и многоводном 2017 г. Вид расселился в Чебоксарское вдхр., по-видимому, с водой из водоемов, расположенных выше по течению р. Сура. На это указывает стабильная и сравнительно многочисленная (до 20 тыс. экз./м3) популяция вселенца в ее устьевой области (табл. 1). Река Сура – крупный (длина 841 км, бассейн 67.5 км2) правый приток р. Волги, она берет начало у с. Сурские Вершины (Ульяновская обл.) и течет сначала на запад, затем на север. Впадает в р. Волгу у г. Васильсурск. Ниже р. Сура начинается озеровидный участок Чебоксарского вдхр.
Таблица 1.
Характеристика местообитаний и численность Thermocyclops taihokuensis в бассейне р. Волги в августе 2016–2019 гг.
| Станция отбора проб | Координаты, с.ш., в.д. |
Месяц, год находки | N, экз./м3 | Глубина, м | Тводы, °С | С, мкСм/см |
|---|---|---|---|---|---|---|
| Чебоксарское вдхр. | ||||||
| р. Волга у пос. Васильсурск | 56°08.382′, 46°00.494′ |
08.2016 | 70 | 14 | 24 | 450 |
| р. Волга, напротив с. Ильинка | 56°11.190′, 46°50.000′ |
08.2016 | 20 | 16 | 24 | 394 |
| Приплотинный участок | 56°08.600′, 47°26.334′ |
08.2016 | 10 | 25 | 24 | 382 |
| р. Сура, 1 км выше устья | 56°06.725′, 46°00.120′ |
08.2018 | 20 350 | 7 | 23 | 709 |
| р. Сура, 5 км выше устья | 56°06.081′, 46°02.762′ |
08.2018 | 6940 | 6 | 22 | 710 |
| р. Волга у пос. Васильсурск | 56°08.382′, 46°00.494′ |
08.2018 | 100 | 13 | 22 | 356 |
| р. Волга у г. Козьмодемьянск | 56°20.997′, 46°35.654′ |
08.2018 | 370 | 14 | 22 | 364 |
| р. Ветлуга, 2 км выше устья | 56°18.654′, 46°24.777′ |
08.2018 | 100 | 8 | 22 | 361 |
| р. Сура, 1 км выше устья | 56°06.725′, 46°00.120′ |
08.2019 | 2360 | 3 | 20 | 566 |
| р. Сура, 5 км выше устья | 56°06.081′, 46°02.762′ |
08.2019 | 2730 | 5 | 21 | 695 |
| р. Волга у г. Козьмодемьянск | 56°20.997′, 46°35.654′ |
08.2019 | 390 | 9 | 20 | 377 |
| р. Ветлуга, 2 км выше устья | 56°18.654′, 46°24.777′ |
08.2019 | 950 | 8 | 19 | 378 |
| Куйбышевское вдхр. | ||||||
| р. Волга напротив пос. Тенишево | 55°16.028′, 49°16.296′ |
07.2017 | <10 | 3 | – | – |
| р. Свияга, ~3 км выше г. Свияжск | 55°44.571′, 48°39.813′ |
08.2018 | 160 | 6 | 19 | 754 |
| р. Волга напротив устья р. Свияга | 55°47.290′, 48°45.990′ |
08.2018 | 20 | 4 | 21 | 350 |
| р. Волга у с. Верхний Услон | 55°46.459′, 48°59.969′ |
08.2018 | 15 | 14 | 21 | 356 |
| р. Кама напротив с. Атабаево | 55°12.374′, 49°21.690′ |
08.2018 | 10 | 16 | 20 | 340 |
| р. Волга ниже г. Волгоград | ||||||
| р. Волга у с. Черный Яр | 48°06.265′, 46°09.547′ |
08.2017 | 8900 | 7 | 24 | 352 |
| р. Волга у с. Соленое займище | 47°55.129′, 46°09.901′ |
08.2017 | 1760 | 14 | 24 | 350 |
| р. Волга у с. Ветлянка | 47°38.055′, 46°38.806′ |
08.2017 | 2110 | 23 | 24 | 355 |
| Ерик Парашкин* | 47°24.719′, 46°59.080′ |
08.2017 | 6740 | 18 | 24 | 355 |
| р. Волга у с. Сероглазка | 47°00.823′, 47°29.304′ |
08.2017 | 6000 | 7 | 24 | 351 |
| р. Волга у с. Замьяны | 46°49.749′, 47°37.275′ |
08.2017 | 5490 | 10 | 26 | 354 |
| р. Волга напротив с. Верхнелебяжье | 46°44.765′, 47°49.908′ |
08.2017 | 3430 | 14 | 26 | 350 |
| р. Бузан, 3 км выше устья | 46°44.370′, 47°53.668′ |
08.2017 | 1060 | 2 | 24 | 370 |
| р. Волга напротив с. Тулугановка | 46°31.960′, 48°01.394′ |
08.2017 | 4240 | 9 | 24 | 356 |
| р. Волга выше г. Астрахань, глубина 3 м |
46°23.470′, 48°02.274′ |
08.2017 | 2760 | 3 | 24 | – |
| р. Волга ниже г. Астрахань | 46°18.305′, 47°58.519′ |
08.2017 | 4680 | 4 | 24 | – |
| Шатское вдрх. | ||||||
| Любовский пруд-охладитель | 54°06.475′, 38°18.909′ |
10.2019 | 110 000 | 1 | 13 | – |
Третий район расположен в Волжском и Волго-Камском плесах Куйбышевского вдхр. от устья р. Свияга до слияния рек Волги и Камы (90 км). Здесь Th. taihokuensis впервые единично обнаружен в 2017 г. на мелководье левого берега р. Волги вблизи Саралинского участка Волжско-Камского заповедника. В следующем 2018 г. вселенец зарегистрирован на четырех станциях, удаленных друг от друга на 3–90 км. Его встречаемость оставила 45% проб, численность была низкой (табл. 1). Максимальное количество особей (1000 экз./м3) обнаружено в устьевой области р. Свияга. Вероятно, Th. taihokuensis первоначально проник в р. Свияга в 2016–2017 гг. из Чебоксарского вдхр. Позже вид расселился вниз по течению р. Волги до устья р. Кама. Река Свияга – сравнительно большой (длина 375 км, бассейн 16.7 тыс. км2) правый приток р. Волги. Она берет начало у пос. Кузоватово (Ульяновская обл.), впадает в Волжский плес Куйбышевского вдхр. в 37 км выше г. Казань. Река Свияга течет с юга на север параллельно р. Волге, их разделяет узкий водораздел. В бассейне реки ~500 малых озер и водохранилищ общей площадью 11 км2.
Четвертый и наиболее южный район – проточный участок р. Волги (~250 км) между с. Черный Яр и г. Астрахань (Нижняя Волга). Здесь вселенец обнаружен в 2017 г. фактически повсеместно, отмечен на 11 станциях (100% проб). В русло р. Волги Th. taihokuensis проник, по-видимому, из Северо-Восточного Каспия через Волго-Ахтубинскую пойму, в которой его регистрируют с начала 2010-х гг. (Нечаев, 2016). Возможно, вселенец появился в пойме р. Ахтуба и русле р. Волги одновременно, т.е. в начале 2010-х гг. Однако точно установить это не удалось, поскольку до 2017 г. данный участок реки не обследовали.
В изученных водоемах Th. taihokuensis обитал на участках глубиной от 3 до 25 м, при температуре воды в августе 19–26°С, в октябре 13°С (табл. 1). Электропроводность воды варьировала от 350 до 754 мкСм/см, что соответствовало минерализации 230–490 мг/л.
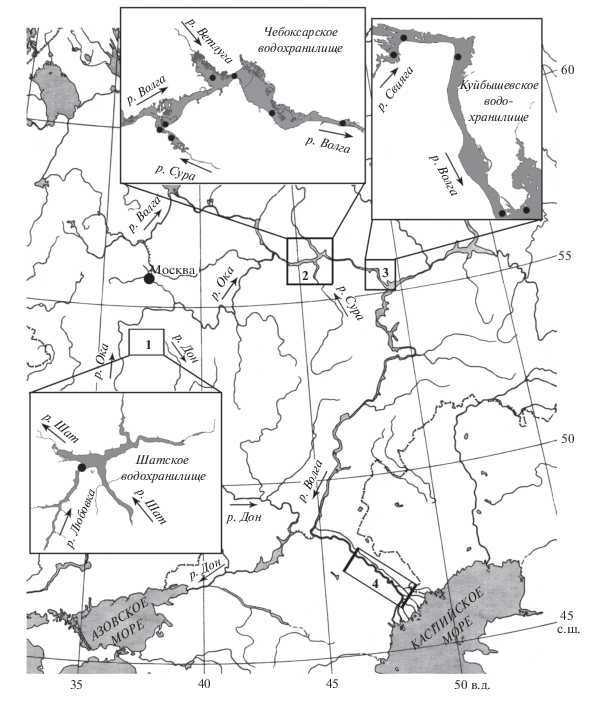
Популяционные характеристики и особенности строения. Общий вид Th. taihokuensis заметно отличается от двух других представителей рода (Th. oithonoides (Sars, 1863) и Th. crassus (Fischer, 1853)), обычных в водоемах бассейна р. Волги. Особи Th. taihokuensis, особенно самки, крупнее и массивнее, благодаря чему хорошо заметны в пробах зоопланктона. Апикальные щетинки фуркальных ветвей самок этого вида широко расставлены (сходно с таковым у рода Cyclops), центральные из них S-образно изогнуты (рис. 2а). Для обоих полов характерно расположение боковой щетинки в последней трети фуркальных ветвей, она заметно сдвинута на их спинную сторону. Яйцевые мешки самок длинные и плотно прижаты к абдомену. Боковые ветви семяприемника самки длинные, их края сильно изогнуты (рис. 2б). Внутренний шип дистального членика эндоподита четвертой пары ног прямой и толстый, вооружен крепкими зубцами, редко и симметрично расположенными на обоих его краях (рис. 2в). Один из отличительных признаков самца – очень длинные и тонкие центральные апикальные щетинки фуркальных ветвей, на концах сильно согнутые на брюшную сторону.
Рис. 2.
Строение тела самки Thermocyclops taihokuensis. а – общий вид яйценосной самки, б – семяприемник, в – дистальные членики четвертой пары ног с апикальными шипами.
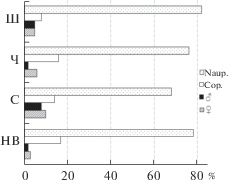
Численность Th. taihokuensis сильно варьировала в разных местообитаниях. Наибольшие ее значения отмечали в Шатском вдхр. (>100 тыс. экз./м3) (табл. 2). При высокой скорости течения на участке Нижней Волги численность вселенца не превышала 10 тыс. экз./м3. Структура популяции с августа до начала октября фактически не различалась, повсеместно преобладали науплиусы (>70%) и копеподиты (до ≤17%) (рис. 3). Количество половозрелых особей было наибольшим в Чебоксарском вдхр. (11 тыс. экз./м3) и устьевой области р. Сура (до 4 тыс. экз./м3) – 10–18% численности популяций.
Таблица 2.
Популяционные характеристики Thermocyclops taihokuensis из разных участков бассейна р. Волги в 2017–2019 гг.
| Показатель | Местонахождение | ||||
|---|---|---|---|---|---|
| НВ (19) | С (37) | Ч (26) | К (16) | Ш (23) | |
| Численность, тыс. экз./м3 | 1–9 | 2–20 | <1 | <1 | 110 |
| Длина тела ♀, мкм | $\frac{{930 \pm 15}}{{840 - 1000}}$ | $\frac{{1060 \pm 10}}{{960 - 1160}}$ | $\frac{{1035 \pm 16}}{{960 - 1160}}$ | $\frac{{1070 \pm 15}}{{1000 - 1160}}$ | $\frac{{950 \pm 10}}{{920 - 1000}}$ |
| Длина тела ♂, мкм | $\frac{{730 \pm 31}}{{640 - 920}}$ | $\frac{{780 \pm 10}}{{720 - 840}}$ | $\frac{{770 \pm 19}}{{720 - 800}}$ | $\frac{{800 \pm 3}}{{790 - 800}}$ | $\frac{{860 \pm 30}}{{720 - 1000}}$ |
| Плодовитость, яиц/♀ | $\frac{{20 \pm 1}}{{16 - 26}}$ | $\frac{{26 \pm 1}}{{10 - 38}}$ | $\frac{{23 \pm 1}}{{20 - 30}}$ | $\frac{{32 \pm 2}}{{26 - 38}}$ | $\frac{{17 \pm 1}}{{12 - 28}}$ |
| Доля ♀ с яйцами, % | 64 | 43 | 70 | 69 | 55 |
| ♀ : ♂ | 1.4 : 1 | 1.3 : 1 | 3 : 1 | 4.3 : 1 | 1 : 1 |
Примечание. Здесь и в табл. 4: НВ – р. Волга ниже г. Волгоград (август), С – устьевая область р. Сура (август), Ч – прочие участки Чебоксарского вдхр. (август), К – Куйбышевское вдхр. (август), Ш – Шатское вдхр. (начало октября). Доля ♀ с яйцами – % общего количества половозрелых самок, ♀ : ♂ – соотношение количества самок и самцов в популяции. В скобках объем выборки. Над чертой – среднее и его ошибка, под чертой – min–max.
Рис. 3.
Структура популяции Thermocyclops taihokuensis (% общей численности) в разных водоемах в августе–октябре 2017–2019 гг. Naup. – науплиусы, Cop. – копеподиты. Водные объекты: НВ – р. Волга ниже г. Волгоград, С – устьевая область р. Сура, Ч – прочие участки Чебоксарского вдхр., Ш – Шатское вдхр.
Длина тела самок и самцов заметно варьировала от водоема к водоему. Наиболее крупные самки (>1.1 мм) отмечены в Чебоксарском и Куйбышевском водохранилищах, самцы (до 1.0 мм) – в Шатском вдхр. (табл. 2). Доля яйценосных самок в большинстве биотопов была очень высокой для второй половины лета (>50% количества взрослых самок). Среди взрослых особей в августе повсеместно преобладали самки, в Шатском вдхр. в октябре соотношение полов приближалось к 1 : 1. Здесь при температуре воды 13°С Th. taihokuensis интенсивно размножался. Индивидуальная плодовитость во всех местообитаниях была высокой, самки вынашивали в двух яйцевых мешках в среднем от 17 до 32 яиц. Максимальная плодовитость (до 38 яиц) зарегистрирована в устьевых областях рек Сура и Свияга. В Чебоксарском вдхр. плодовитость вселенца была на 25–60% выше таковой аборигенных видов рода Thermocyclops. Она сопоставима с отмеченной для Mesocyclops leuckarti (Claus, 1857) (табл. 3). Плодовитость крупного (1.2–1.3 мм) Acanthocyclops americanus (Marshall, 1893) почти вдвое превышала таковую Thermocyclops taihokuensis.
Таблица 3.
Сравнение плодовитости самок вселенца Thermocyclops taihokuensis и аборигенных видов Cyclopoida в Чебоксарском водохранилище
| Плодовитость, яиц/♀ | Thermocyclops | Mеsocyclops leuckarti | Acanthocyclops americanus | ||
|---|---|---|---|---|---|
| taihokuensis | oithonoides | crassus | |||
| Среднее | 25 ± 1 | 16 ± 2 | 20 ± 1 | 22 ±2 | 44 ± 4 |
| Min–max | 10–38 | 6–24 | 12–26 | 12–40 | 16–60 |
Сосуществование вселенца с другими видами копепод. В августе 2016–2019 гг. в водоемах и водотоках бассейна р. Волги Th. taihokuensis обитал совместно с двумя аборигенными видами рода (Th. oithonoides и Th. crassus). Летом наибольший вклад Th. taihokuensis (>90%) в суммарную численность рода Thermocyclops зарегистрирован в Нижней Волге, в остальных местообитаниях он не превышал 15% (табл. 4). В устьевой области р. Сура вселенец формировал максимально 14–15% численности рода и 9–11% количества всех Cyclopoida в августе 2018 г. В Чебоксарском и Куйбышевском водохранилищах аборигенные виды рода всегда были существенно обильнее по сравнению с Th. taihokuensis. Они составляли 85–97% количества всех Thermocyclops и 41–74% Cyclopoida, обычно доминировал Th. oithonoides. В Нижней Волге Th. oithonoides обнаруживали единичными экземплярами, а количество Th. crassus было примерно вдвое ниже такового вселенца.
Таблица 4.
Вклад вселенца в общую численность копепод рода Thermocyclops
| Таксон | Местонахождение | ||||
|---|---|---|---|---|---|
| НВ | С | Ч | К | Ш | |
| Thermocyclops taihokuensis | $\frac{{1 - 9}}{{34 - 100}}$ | $\frac{{2 - 20}}{{3 - 15}}$ | $\frac{{ < 1}}{{1 - 15}}$ | $\frac{{ < 1}}{{3 - 14}}$ | $\frac{{110}}{{100}}$ |
| Th. oithonoides | + | $\frac{{31 - 52}}{{39 - 76}}$ | $\frac{{1 - 2}}{{14 - 42}}$ | $\frac{{1 - 26}}{{50 - 85}}$ | – |
| Th. crassus | $\frac{{1 - 4}}{{6 - 66}}$ | $\frac{{5 - 60}}{{10 - 46}}$ | $\frac{{2 - 7}}{{50 - 96}}$ | $\frac{{1 - 9}}{{16 - 43}}$ | – |
| Род Thermocyclops, тыс. экз./м3 | 1–11 | 48–133 | 3–10 | 1–36 | 110 |
| Все Cyclopoida, тыс. экз./м3 | 1–13 | 74–192 | 32–65 | 14–204 | 114 |
Здесь вселенец образовывал 30–80% всех Cyclopoida. В октябре 2019 г. в Шатском вдхр. Th. taihokuensis формировал 95% количества копепод и 90% всех ракообразных планктона. Другие представители рода Thermocyclops в водоеме отсутствовали. В эти сроки обычные для центра Европейской России Th. oithonoides и Th. crassus переходят к диапаузе (Монченко, 1974).
Помимо представителей рода Thermocyclops вселенец обитал совместно с другими Cyclopoida. Наиболее многочисленными были два пелагических вида Mesocyclops leuckarti и Acanthocyclops americanus, реже и в небольшом количестве (<1 тыс. экз./м3) в водохранилищах отмечали Cyclops vicinus Uljanin, 1875. В р. Волге ниже г. Волгограда обилие Acanthocyclops americanus (<2 тыс. экз./м3) и Mesocyclops leuckarti (<1 тыс. экз./м3) было меньше или сравнимо с таковым вселенца. В устьевой области р. Сура оба вида присутствовали в массе (до 40 тыс. экз./м3), а в озеровидной части Чебоксарского вдхр. они образовывали до 30 тыс. экз./м3 каждый. В Волжском плесе Куйбышевского вдхр. M. leuckarti достигал 90 тыс. экз./м3, Acanthocyclops americanus – 75 тыс. экз./м3. Осенью в Шатском вдхр. с Thermocyclops taihokuensis обнаружен только один немногочисленный (~3 тыс. экз./м3) пелагический представитель Cyclopoida – Mesocyclops leuckarti.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Последнее переописание копеподы Th. taihokuensis сделано Монченко (Monchenko, 2008) из водоемов Туркменистана. Внешне, по вооружению ног четвертой–пятой пары и фуркальных ветвей Th. taihokuensis сходен с Th. oithonoides, дифференциальный диагноз этих двух видов приведен в работе (Рылов, 1948). Следующие важные морфологические признаки Th. taihokuensis, отличающие его от других видов рода, отмечены в работах (Guo, 1999; Dela Paz et al., 2016): сильно изогнутые боковые ветви семяприемника самки, мощный медиальный шип дистального членика эндоподита четвертой пары ног с крепкими редкими зубцами симметрично расположенными на обоих его краях, а также отношение длины дорсальной щетинки фурки к таковой внешней латеральной щетинки >1.5. По нашим наблюдениям, для отличия Th. taihokuensis от аборигенных Th. oithonoides и Th. crassus наиболее важны форма семяприемника, апикальных щетинок фурки, эндоподита четвертой пары ног (рис. 2), а также положение боковой щетинки фуркальных ветвей.
Средняя длина тела половозрелых самок Th. taihokuensis в исследованных водоемах варьировала от 930 мкм в Нижней Волге до 1070 мкм в Куйбышевском вдхр. (в среднем 1010 ± 15 мкм). Это близко к размерам рачков из Казахстана (990 мкм), Монголии (960 мкм), Узбекистана и Китая (940 мкм), пойменных водоемов р. Амур (920 мм) (Рылов, 1948; Mirabdullayev, Kuzmetov, 1997; Guo, 1999). В типовом местообитании на Тайване длина самок варьирует в пределах 800–880 мкм (Mirabdullayev, Kuzmetov, 1997). Особи из бассейна р. Волги несколько крупнее таковых на Тайване и значительно (в 1.5 раза) крупнее рачков из солоноватых водоемов восточного побережья Среднего Каспия (670 ± 6 мкм) (Monchenko, 2008). Наиболее крупные особи вселенца (в среднем >1000 мкм) обнаружены в Чебоксарском и Куйбышевском водохранилищах – самых северных его местообитаниях. Однако такие же крупные (до 1100 мкм) представители Th. taihokuensis отмечены в водоемах Филиппин (Dela Paz et al., 2016). Сведения о плодовитости вселенца немногочисленны. Для водоемов Туркменистана указана очень низкая плодовитость вида (обычно 10–18 яиц на самку) (Monchenko, 2008), в р. Волге она почти вдвое выше (20–32 яйца на самку) (табл. 2).
К 2020 г. в бассейне р. Волги выявлены четыре района обитания вселенца. Самые северные находки вида (56° с.ш., 46° в.д.) расположены в устье р. Сура (Средняя Волга), наиболее западные (54° с.ш., 38° в.д.) – в Шатском вдхр. Первые находки вида в бассейне р. Волги (водоемы Волго-Ахтубинской поймы) зарегистрированы в начале 2010-х гг. (Нечаев, 2016). Вероятно, тогда же этот вид проник в основное русло р. Волги и по Волго-Донскому каналу в р. Дон. В Цимлянском вдхр. Th. taihokuensis отмечен с 2012 г., где он вытеснил из планктона аборигенного Th. crassus (Вехов и др., 2014). К 2018 г. Th. taihokuensis достиг очень высокой численности (>600 тыс. экз./м3) в верхних двух участках водохранилища, также он многочислен в Бреславском и Карповском водохранилищах канала Волга-Дон (Лазарева, Сабитова, 2021). В бассейне р. Волги Th. taihokuensis обитает в пресной воде при содержании солей <500 мг/л. Но вид известен также из солоноватых биотопов (Северный и Средний Каспий, водоемы Казахстана, Узбекистана и Туркменистана) (Шарапова, 2014; Степаньянц и др., 2015; Калымбетова, 2017; Mirabdullayev, Kuzmetov, 1997).
За последние 10 лет Th. taihokuensis расселился к западу и северо-западу от дельты р. Волги на расстояние 500–1200 км. Способы и пути такого быстрого распространения вселенца окончательно не выяснены. Водораздел рек Волги и Дона он, вероятно, преодолел с балластными водами судов, следующих по Волго-Донскому каналу. Об этом свидетельствуют его находки в водохранилищах канала (Лазарева, Сабитова, 2021). Река Сура судоходна только в нижнем течении (80 км) и недоступна для больших грузовых судов, следующих вверх по Волге из г. Астрахань. То же относится к р. Свияга, поэтому вблизи обеих рек нет крупных грузовых портов. Шатское вдхр. вообще не связано с транзитными волжскими судовыми маршрутами. В эти местообитания яйца и науплиусов вселенца занесли, вероятно, мигрирующие водоплавающие птицы.
В основной акватории Чебоксарского вдхр. Th. taihokuensis найден только ниже (<100 км) устья р. Сура, куда он расселился, по-видимому, с течением воды. Установлено, что Th. taihokuensis вселился в Чебоксарское вдхр. еще в 2016 г. (табл. 1), а не в 2018 г., как это указано в работе (Жихарев и др., 2019). На р. Сура вблизи водораздела бассейнов рек Волги и Дон расположено сравнительно небольшое (110 км2) Сурское (Пензенское) вдхр. Логично было бы предположить, что вселенец попал в устье р. Сура из этого водохранилища. Однако до 2015 г. присутствие Th. taihokuensis в планктоне Сурского вдхр. не отмечено (Сенкевич и др., 2016). В последующие 5 лет (до 2020 г.) вселенца также не регистрировали (устное сообщение Т.Г. Стойко). В составе планктона малых рек-притоков р. Сура и озер ее поймы данный вид тоже не обнаружен (Подшивалина, 2015, 2016).
В расположенное ниже по р. Волга Куйбышевское вдхр. Th. taihokuensis проник с течением воды в 2016–2017 гг., по-видимому, первоначально в устье р. Свияга. В эти годы устьевую область данного притока экспедиция Института биологии внутренних вод РАН не обследовала. Наиболее вероятный источник расселения Th. taihokuensis – Чебоксарское вдхр. Показано, что на этом участке р. Волги наблюдается заток планктона из центральной части водохранилища в устья притоков (Подшивалина, 2021). Возможно также вселенец проник в р. Свияга из многочисленных почти не исследованных водоемов в ее бассейне. Позже в многоводном 2017 г. вид расселился вниз по течению р. Волги до устья р. Камы. На этом участке водохранилища вселенца крайне трудно обнаружить из-за его малой численности и массового развития цианобактерий, которые затрудняют просмотр сборов зоопланктона. Виды рода Thermocyclops в Куйбышевском вдхр. населяют преимущественно литораль и устьевые области притоков в его подпоре. Именно в этих биотопах возможны новые находки Th. taihokuensis.
Вселенец обладает мощным продукционным потенциалом, его плодовитость на 25–60% выше по сравнению с аборигенными видами рода. Кроме того, Th. taihokuensis отличается очень длительным периодом размножения. Он активно размножается даже в октябре, в эти сроки аборигенные виды Th. oithonoides и Th. crassus уже переходят к диапаузе (Монченко, 1974). Такая жизненная стратегия способствует аккумуляции большого количества зимующих копеподитов, которые весной обеспечивают быстрый рост численности популяции вселенца.
В период 2008–2015 гг. Th. taihokuensis не регистрировали в Чебоксарском вдхр. и Волжском плесе Куйбышевского вдхр. (Лазарева и др., 2018; Жихарев и др., 2019; Lazareva et al., 2014). Его первая находка в Чебоксарском вдхр. датируется августом 2016 г. (табл. 1). В Куйбышевское вдхр. вид проник в том же 2016 г. или годом позже, его численность в водоеме минимальна по сравнению с другими местообитаниями. В 2015 г. за год до вселения Th. taihokuensis обилие нативных Th. oithonoides и Th. crassus (<1–9 тыс. экз./м3) в водохранилищах Средней Волги было близко к таковому в присутствии вселенца в 2016–2019 гг. или даже меньше (табл. 4). В данном районе р. Волги не было выявлено какого-либо изменения структуры сообщества копепод под влиянием вселенца по причине низкой его численности и недавнего проникновения в водоем.
Копепод разного размера (в основном Calanoida) потребляет массовый пелагический планктофаг – черноморско-каспийская тюлька Clupeonella cultriventris (Nordmann, 1840) (Кияшко, 2004; Кияшко и др., 2007) – которая к 2002 г. заселила все водохранилища р. Волги (Слынько, Кияшко, 2012). Рыбы разного возраста избирательно выедают доступных по размеру и наиболее многочисленных рачков, при этом мелкие Cyclopoida (взрослые особи и копеподиты) обычно составляют рацион сеголетков тюльки (Кияшко и др., 2007). Среди обычных для р. Волги Cyclopoida родов Acanthocyclops, Mesocyclops и Thermocyclops не выявлено предпочтения рыбами какого-либо вида. Учитывая тот факт, что рыбы потребляют наиболее многочисленные виды, можно предположить сдерживание хищниками роста численности популяции Thermocyclops taihokuensis в Нижней Волге. В данном районе вселенец обитает уже около десяти лет (Нечаев, 2016; Лазарева и др., 2018) и является наиболее массовым представителем Cyclopoida (табл. 4). Однако его количество до сих пор невелико (<10 тыс. экз./м3), и он не вытеснил из сообщества аборигенного Th. crassus. Тогда как в Цимлянском вдхр. при очень высокой (до >600 тыс. экз./м3) численности вселенца, Th. crassus почти исчез (Вехов и др., 2014; Лазарева, Сабитова, 2021).
Выводы. В 2016–2019 гг. копепода Th. taihokuensis обнаружена в четырех районах бассейна р. Волги, удаленных друг от друга на расстояние 270–1000 км. Вселенец обитает в речном участке от с. Черный Яр до г. Астрахань (Нижняя Волга), озеровидной части Чебоксарского вдхр., Волжском и Волго-Камском плесах Куйбышевского вдхр. (Средняя Волга) и верховье бассейна р. Оки (Шатское вдхр.). Самое северное (56° с.ш., 46° в.д.) местообитание Th. taihokuensis – устье р. Сура (Средняя Волга), самое западное (38° в.д.) – Шатское вдхр., в котором Th. taihokuensis – единственный многочисленный вид этого рода. В Нижней Волге вселенец обитает совместно с Th. crassus и является наиболее массовым представителем Cyclopoida. В Чебоксарском и Куйбышевском водохранилищах он сосуществует с обоими аборигенными видами Th. oithonoides и Th. crassus при доминировании последних. Высокая плодовитость и длительный период размножения определяют конкурентоспособность и быстрое распространение вселенца в условиях водоемов и водотоков Европейской России.
Список литературы
Вехов Д.А., Науменко А.Н., Горелов В.П. и др. 2014. Современное состояние и использование водных биоресурсов Цимлянского вдхр. (2009–2013 гг.) // Рыбохозяйственные исследования на водных объектах Европейской части России. Санкт-Петербург: ГосНИИ озер. и реч. рыб. хоз-ва. С. 116.
Волга и ее жизнь. 1978. Ленинград: Наука. (The River Volga and its Life. 1979. The Hague: Junk Publishers).
Григорьева И.Л. 2021. Шатское водохранилище // Вода России. Водные ресурсы. 2020. Электронный ресурс. URL. https://water-rf.ru/Водные_объекты/3411/Шатское_водохранилище (обращение январь 2021 г.).
Жихарев В.С., Гаврилко Д.Е., Шурганова Г.В. 2019. Находка тропического вида Thermocyclops taihokuensis (Harada, 1931) (Copepoda: Cyclopoida) в Европейской части России // Поволжский экол. журн. № 2. С. 264.
Калымбетова М.Т. 2017. Современное состояние зоопланктона Шардаринского водохранилища // Вестник сельскохозяйственной науки Казахстана. № 5–6. С. 80.
Кияшко В.И. 2004. Трофоэкологическая характеристика тюльки Clupeonella cultriventris в водохранилищах Средней и Верхней Волги // Вопр. ихтиологии. Т. 44. № 6. С. 811.
Кияшко В.И., Халько Н.А., Лазарева В.И. 2007. О суточном ритме и элективности питания тюльки Clupeonella cultriventris в Рыбинском водохранилище // Вопр. ихтиологии. Т. 47. № 3. С. 389.
Лазарева В.И., Жданова С.М. 2014. Американская коловратка Kellicottia bostoniensis (Rousselet, 1908) (Rotifera: Bracionidae) в водохранилищах бассейна Верхней Волги // Биология внутр. вод. № 3. С. 64. https://doi.org/10.7868/S0320965214030115
Лазарева В.И., Сабитова Р.З., Быкова С.В. и др. 2018. Распределение летнего зоопланктона в каскаде водохранилищ Волги и Камы // Тр. Ин-та биологии внутренних вод им. И.Д. Папанина РАН. Вып. 83(86). С. 62. https://doi.org/10.24411/0320-3557-2018-10030
Лазарева В.И., Сабитова Р.З. 2021. Зоопланктон Цимлянского водохранилища и канала Волга-Дон // Зоол. журн. № 4. С. 603. https://doi.org/10.31857/S0044513421040115
Минеева Н.М., Семадени И.В., Макарова О.С. 2020. Содержание хлорофилла и современное трофическое состояние водохранилищ р. Волги (2017–2018 гг.) // Биология внутр. вод. № 2. С. 205. https://doi.org/10.31857/S0320965220020102
Монченко В.I. 1974. Щелепноротi циклопоподiбнi. Циклопи (Cyclopidae). Киев: Наук. думка.
Мордухай-Болтовской Ф.Д., Дзюбан Н.А. 1976. Изменения в составе и распределении фауны Волги в результате антропогенных воздействий // Биологические продукционные процессы в бассейне Волги. Ленинград: Наука. С. 67.
Нечаев Д.Ю. 2016. Фаунистическое разнообразие планктонных беспозвоночных Волго-Ахтубинской поймы // Матер. Всерос. молодежной гидробиол. конф. “Перспективы и проблемы современной гидробиологии”, пос. Борок, Ин-т биологии внутр. вод им. И.Д. Папанина РАН, 10–13 ноября 2016 г. Ярославль: Филигрань. С. 117.
Подшивалина В.Н. 2015. Фауна зоопланктона фоновых участков малых рек бассейна нижнего течения реки Сура (Среднее Поволжье) // Научные труды государственного природного заповедника “Присурский”. Т. 30. Вып. 1. С. 210.
Подшивалина В.Н. 2016. Фауна планктонных коловраток и ракообразных пойменного озера с карстово-суффозионным провалом (озеро Большое Щучье, пойма нижнего течения реки Сура, Среднее Поволжье) // Научные труды государственного природного заповедника “Присурский”. Т. 31. С. 132.
Подшивалина В.Н. 2021. Особенности распределения зоопланктона в зоне влияния притоков водохранилищ Средней Волги // Биология внутр. вод. № 5. С. 472. 10.31857/S0320965221050156
Рылов В.М. 1948. Фауна СССР. Ракообразные. Cyclopoida пресных вод. Т. 3. Вып. 3. Москва: АН СССР.
Сенкевич В.А., Цыганов А.Н., Стойко Т.Г. 2016. Зоопланктонное сообщество Пензенского водохранилища // Известия высших учебных заведений. Поволжский регион. Естественные науки. Биология. № 1(13). С. 35.
Слынько Ю.В., Кияшко В.И. 2012. Анализ эффективности инвазий пелагических видов рыб в водохранилища Волги // Российский журн. биол. инвазий. № 1. С. 73.
Степаньянц С.Д., Хлебович В.В., Алексеев В.Р. и др. 2015. Определитель рыб и беспозвоночных Каспийского моря. Т. 2. Стрекающие, гребневики, многощетинковые черви, веслоногие ракообразные и мизиды. Санкт-Петербург: Товарищество науч. изданий КМК.
Шарапова Л.И. 2014. Зоопланктон Северо-Восточного Каспия. Приложение 2 // Мониторинг окружающей природной среды Северо-Восточного Каспия при освоении нефтяных месторождений. Алматы: АджипККО. С. 228.
Guo X. 1999. The genus Thermocyclops Kiefer, 1927 (Copepoda: Cyclopidae) in China // Hydrobiologia. V. 403. P. 87.
Dela Paz E.S.P., Holyn’ska M.K., Papa R.D.S. 2016. Mesocyclops and Thermocyclops (Copepoda, Cyclopidae) in the major visayas islands (Central Philippines) // Crustaceana. V. 89. № 6–7. P. 787. https://doi.org/10.1163/15685403-00003547
Lazareva V.I., Mineeva N.M., Zhdanova S.M. 2014. Spatial Distribution of Plankton from the Upper and Middle Volga Reservoirs in Years with Different Thermal Conditions // Biology Bulletin. V. 41. № 10. P. 869. https://doi.org/10.1134/S1062359014100070
Monchenko V.I. 2008. Redescription of the Oriental Thermocyclops taihokuensis (Harada, 1931) (Copepoda: Cyclopoida) from its westernmost population // Zoology in the Middle East. V. 43. № 1. P. 99. https://doi.org/10.1080/09397140.2008.10638274
Mirabdullayev I.M., Kuzmetov A.R. 1997. The Genus Thermocyclops (Crustacea: Copepoda) in Uzbekistan (Central Asia) // International Review of Hydrobiology. V. 82. Iss. 2. P. 201.
Mirabdullayev I.M., Reid J.W., Ueda H. 2003. Copepoda: Cyclopoida genera Mesocyclops and Thermocyclops. Genus Thermocyclops Kiefer, 1927 // Guides to the Identification of the Microinvertebrates of the Continental Waters of the World 20. Leiden: Backhuys Publishers. P. 214.
Shurganova G.V., Gavrilko D.E., Il’in M.Iu. et al. 2017. Distribution of rotifer Kellikottia bostoniensis (Rousselet, 1908) (Rotifera: Brachionidae) in waterbodies and watercourses of Nizhny Novgorod oblast // Russian J. Biological Invasions. V. 8. № 4. P. 393.
Slyn’ko Yu.V., Korneva L.G., Rivier I.K. et al. 2002. Caspian-Volga-Baltic invasion corridor // Alien species in European waters. Dordrecht: Kluwer Publishers. P. 339.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


