Биология внутренних вод, 2022, № 3, стр. 300-309
Особенности структурных и функциональных характеристик диатомовой водоросли Pseudosolenia calcar-avis
Л. В. Стельмах *
Федеральный исследовательский центр “Институт биологии южных морей им. А.О. Ковалевского
Российской академии наук”
Севастополь, Россия
* E-mail: lustelm@mail.ru
Поступила в редакцию 07.06.2021
После доработки 18.11.2021
Принята к публикации 30.11.2021
- EDN: DMFBBB
- DOI: 10.31857/S0320965222030184
Аннотация
Исследованы структурные и функциональные характеристики культуры крупноклеточной диатомовой водоросли Pseudosolenia calcar-avis, выделенной из планктона Черного моря. Выявлены основные причины ее интенсивного развития и доминирования в черноморском фитопланктоне в условиях разного содержания биогенных веществ в воде. При оптимальных условиях среды высокие значения эффективности работы фотосистемы II (0.67–0.69), относительного содержания хлорофилла а (~1% органического углерода), отношения площади поверхности клетки к объему цитоплазмы (~0.80–0.90 мкм–1), а также наличие крупной внутриклеточной вакуоли позволили данному виду расти с высокой скоростью (1.40 сут–1). Перенос клеток P. calcar-avis, имеющих максимальный внутриклеточный пул биогенных веществ, в морскую воду, обедненную по биогенным веществам, вызвал быстрое снижение эффективности работы фотосистемы II, относительного содержания хлорофилла а и удельной скорости роста. За счет внутриклеточного пула питательных веществ исследуемый вид водорослей осуществил 4.5 клеточных деления за 4 сут. После исчерпания внутриклеточных запасов биогенных веществ в культуре в течение последующих 5–7 сут численность клеток почти не изменялась, а жизнеспособность культуры сохранялась. Для полного восстановления функциональной активности и дальнейшего роста этого вида необходим доступ к внешнему источнику биогенных веществ, который будет поддерживать его функционирование на высоком уровне. Обсуждаются возможные механизмы пополнения клеток P. calcar-avis биогенными веществами в условиях их дефицита в море.
ВВЕДЕНИЕ
За последнее столетие в результате изменений климата температура морской воды в глобальном масштабе повысилась на ~1°C (Häder, Gao, 2015), что привело к усилению термического расслоения вод и ослаблению восходящего потока биогенных веществ (Behrenfeld et al., 2006). По мнению ряда исследователей, ослабление турбулентности и потока питательных веществ в поверхностные воды ведет к сокращению доли диатомовых водорослей в первичной продукции и биомассе фитопланктона, а также объема экспорта морской продукции (Boop et al., 2005; Laufkötter et al., 2016). Эта гипотеза основана на представлении, что диатомовые водоросли могут успешно развиваться только в хорошо перемешиваемых водах, при высоких концентрациях нитратов, кремния и фосфатов. Тогда как в стратифицированных водах они уступают место другим группам водорослей, прежде всего, активно перемещающимся в воде динофитовым (Margalef, 1978). Однако другие исследователи считают, что по мере усиления стратификации водной толщи в фитопланктоне будет возрастать роль крупных диатомовых водорослей, которые могут успешно функционировать в обедненных по биогенным веществам водах (Kemp, Villareal, 2018). Последнюю гипотезу подтверждают данные, свидетельствующие об интенсивном развитии крупных видов диатомовых водорослей в олиготрофных водах Мирового океана (Goldman, McGillicuddy, 2003; Pedrosa-Pamies et al., 2016). Среди таких водорослей важнейшее место занимает Pseudosolenia calcar-avis (Schultze) B.G. Sundström, объем клеток которой находится в диапазоне 70–300 тыс. мкм3. В Черном море этот вид развивается наиболее интенсивно в летний и осенний периоды года. Он может создавать основную биомассу фитопланктона не только в прибрежных водах при высоком содержании нитратов и кремния (Финенко и др., 2017), но и в глубоководных районах, где их количество в верхнем перемешанном слое часто падает до аналитического нуля (Stelmakh, Gorbunova, 2019; Yunev et al., 2021). В последнем случае биомасса P. calcar-avis может быть достаточно высокой, достигая 100–150 мг С/м3, что вступает в противоречие с крайне низким содержанием минеральных форм азота в среде и, прежде всего, нитратов (Stelmakh, Gorbunova, 2019). Причины такого явления до настоящего времени окончательно не выяснены. Можно предположить, что данный вид водорослей обладает высокой степенью физиологической пластичности, обусловленной особой структурой клетки, и это позволяет ему успешно конкурировать с другими видами водорослей в водах с разным уровнем питательных веществ. В глубоководной области Черного моря концентрация минеральных форм азота и кремния изменяется от аналитического нуля до 3–6 мкМ, фосфатов – от аналитического нуля до 0.2–0.3 мкМ. Максимальное содержание этих веществ, как правило, наблюдается в зимне-весенний период, минимальное – летом (Mikaelyan et al., 2018).
Цель работы – выявить структурные и функциональные особенности диатомовой водоросли P. calcar-avis, позволяющие ей интенсивно развиваться в условиях разного содержания биогенных веществ в водах Черного моря.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования была диатомовая водоросль Pseudosolenia calcar-avis, впервые выделенная нами из планктона Черного моря в октябре 2019 г. в альгологически чистую культуру (рис. 1а–1г), которая содержалась на питательной среде f/2 (Guillard, Ryther, 1962), естественном рассеянном освещении и температуре 18–20°С, что соответствует температурному оптимуму для черноморских видов диатомовых водорослей (Akimov, Solomonova, 2019).
Рис. 1.
Клетки Pseudosolenia calcar-avis, культивируемые на среде f/2 (а, б) и на морской воде, обедненной по биогенным веществам (в, г). Вид клеток под световым микроскопом (а, в) и люминесцентным (б, г).

Для исследования светозависимого роста клеток P. calcar-avis экспоненциально растущую культуру переносили в 150-миллилитровые колбы, которые экспонировали при восьми различных интенсивностях непрерывного света в диапазоне 8.6–172 мкЭ/(м2 с). Водоросли были адаптированы к каждой интенсивности в течение трех–четырех суток до стабилизации удельной скорости роста. Колбы с водорослями, расположенные на световой решетке, освещали снизу, используя светодиоды. Освещенность измеряли с помощью люксметра Ю-116, коэффициент перехода от освещенности в люксах к интенсивности света – 1000 лк = 17 мкЭ/(м2 с) (Парсонс и др., 1982).
Исследование влияния различного уровня биогенной обеспеченности на структурные и функциональные характеристики P. calcar-avis проводили при насыщающей рост данного вида интенсивности света 68 мкЭ/(м2 с), которую устанавливали экспериментально, и температуре воды 18–20°С. Клетки исследуемой культуры, находившиеся в фазе экспоненциального роста, отбирали пипеткой и переносили в колбы с пастеризованной морской водой без дополнительных добавок биогенных веществ, а также в колбы с биогенными веществами. В первом варианте опытов использовали среду f/2, во втором – f/2 без кремния, в третьем – f/2 без нитратов. В четвертом варианте опытов морская вода была обедненной по биогенным веществам. В ней содержание нитратов, кремния и фосфатов было крайне низким (≤0.05 мкМ).
В ходе экспериментов из колб с культурой микроводорослей ежесуточно отбирали аликвоты для оценки численности клеток, их линейных размеров, концентрации Хл а и продукта его разрушения феофитина а, а также Fv/Fm.
Для определения концентрации пигментов использовали аликвоты объемом 10–15 мл в трех повторностях, профильтрованные через мембранные фильтры GF/C, которые помещали в 90%-ный водный раствор ацетона. Пигменты экстрагировали в течение 12 ч при температуре 8°С. Концентрацию Хл а и феофитина а определяли флуориметрическим методом с использованием лабораторного флуорометра Trilogy Turner Designs (США), калибровку которого осуществляли по чистому Хл а (Protocols…, 1994). Относительная ошибка определений не превышала 10%.
Содержание углерода в клетках P. calcar-avis рассчитывали на основе их объема по уравнению, представленному в работе (Menden-Deuer, Lessard, 2000). Линейные размеры клеток определяли с помощью светового микроскопа ZEISS Primo Star в 20 повторностях при общем увеличении системы ×100. Объем клеток вычисляли по методике (Брянцева и др., 2005), основываясь на принципах геометрического подобия. Удельную поверхность клеток рассчитывали как отношение площади поверхности клетки к полному объему клетки с учетом крупной внутриклеточной вакуоли. Численность клеток учитывали в счетной камере типа Нажотта в трех повторностях. Коэффициент вариации среднего значения был, как правило, в пределах 5–15%.
Для регистрации красной автофлуоресценции Хл а клеток P. calcar-avis в темном поле применяли световой микроскоп Микромед 3ЛЮМ, дополнительно оснащенный флуоресцентным блоком с ртутной лампой мощностью 100 Вт и фотокамерой Toup Cam UCMOS 14000 KPA. Световой диапазон возбуждения флуоресценции в клетках водорослей был 410–490 нм, что обеспечивалось синим светофильтром. Наблюдение красного свечения объекта (в отраженном свете) после прохождения через запирающий светофильтр (515 нм) проводили в области 515–700 нм.
Удельную суточную скорость роста культуры рассчитывали по приросту численности клеток в пробах по уравнению:
где µ – удельная скорость роста водорослей, сут–1, N0 и Nt – исходная численность клеток и их количество через сутки.Оценку Fv/Fm исследуемого вида микроводорослей осуществляли на двухвспышечном флуориметре (Погосян и др., 2009). Измерения проводили после 30 мин адаптации водорослей к темноте, чтобы все реакционные центры фотосистемы II перешли в открытое состояние. Во флуориметре реализован метод измерения начального уровня переменной флуоресценции (F0) под действием коротких зондирующих вспышек и ее максимального уровня (Fm) при помощи насыщающей вспышки. По измеренным показателям рассчитывали переменную флуоресценцию Fv = Fm – F0 и ее удельную величину – Fv/Fm. Относительная погрешность определений показателя Fv/Fm не превышала 5%.
Обработка данных выполнена в программе Excel 2007 для Windows. Рассчитаны среднеарифметические значения исследуемых параметров и стандартное отклонение. Статистическую значимость различий между вариантами определяли по t-критерию Стьюдента. При построении графиков использовали программу Grafer 3.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Зависимость структурных и функциональных параметров P. calcar-avis от интенсивности света. В оптимальных температурных условиях и высоком содержании биогенных веществ в среде по мере увеличения интенсивности света (I) от 8.6 до 51.6 мкЭ/(м2 с) удельная скорость роста (µ) исследуемой культуры линейно возрастала (рис. 2а). В диапазоне световых интенсивностей 51.6–86.0 мкЭ/(м2 с) этот показатель изменялся крайне мало, достигнув максимальных значений (1.38–1.40 сут–1). При дальнейшем усилении света рост клеток P. calcar-avis замедлялся и при интенсивности света 172 мкЭ/(м2 с) был лишь 0.80 сут–1. Полученная нами зависимость скорости роста от интенсивности света представлена в виде экспоненциальной функции, хорошо описываемой уравнением Стила (Steele, 1962):
где µмакс – максимальная удельная скорость роста (сут–1), Iопт – интенсивность света, при которой наблюдается µмакс (мкЭ/(м2 с)). Из уравнения получено, что максимальная скорость роста – 1.40 сут–1 при насыщающей рост интенсивности света (Iопт), равной 68.70 мкЭ/(м2 с).Рис. 2.
Зависимость удельной скорости роста (а), отношения Fv/Fm (б), объема клеток (в) и отношения С/Хл а (г) от интенсивности света в культуре Pseudosolenia calcar-avis. Представленные на графиках значения – среднее арифметическое ± стандартное отклонение.
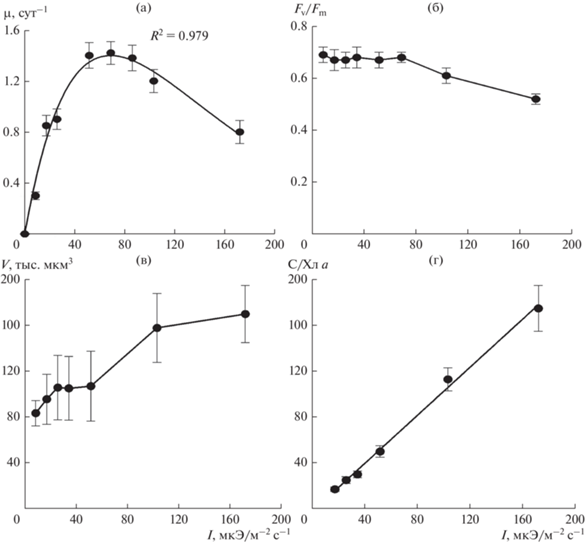
Отношение Fv/Fm при интенсивностях света 8.6–86.0 мкЭ/(м2 с) было почти максимальным – 0.67–0.69. В диапазоне световых интенсивностей 86.0–172 мкЭ/(м2 с) этот показатель снижался до 0.52 (рис. 2б). По мере усиления света средний объем клеток культуры возрастал c 84 до 170 тыс. мкм3 (рис. 2в). При этом удельная поверхность клеток, рассчитанная на единицу их объема, находилась в интервале значений 0.28–0.35 мкм–1. Отношение между органическим углеродом и Хл а (С/Хл а) увеличивалось от 17 до 175, составив при насыщающей рост интенсивности света 105 (рис. 2г). Продукт распада Хл а – феофитин а – в исследуемой культуре отсутствовал.
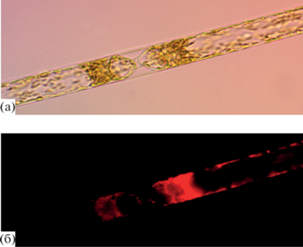
Важным структурным компонентом клеток P. calcar-avis является крупная вакуоль. Ее наличие хорошо видно на примере делящейся клетки, представленной и в светлом поле, и в темном (рис. 3а, 3б). Показано, что даже при оптимальных для роста световых и температурных условиях, а также достаточном количестве биогенных веществ в воде основной объем клетки занимает вакуоль (область в центре каждой из дочерних клеток), которая не флуоресцирует в темном поле микроскопа. Она ограничивает объем цитоплазмы, представленной в виде тонкого слоя, примыкающего к клеточной мембране. Именно в этом слое находится значительная доля хлоропластов, обеспечивающих флуоресценцию Хл а. По нашим приблизительным оценкам, на объем вакуоли приходится ≥70% общего объема клетки. При этом удельная поверхность клетки, рассчитанная только на объем цитоплазмы, будет равна ~0.80–0.90 мкм–1.
Рис. 3.
Вид клеток Pseudosolenia calcar-avis в процессе деления под световым (а) и люминесцентным (б) микроскопами.
Рост P. calcar-avis при различных по биогенным веществам условиях. В культуре P. calcar-avis, находившейся в экспоненциальной фазе роста, а затем перенесенной в свежую питательную среду f/2, при оптимальных для роста световых и температурных условиях наблюдали прирост численности клеток на протяжении всего семисуточного эксперимента (рис. 4а). За этот период численность клеток возросла от 20 до 4170 кл./мл. Самые высокие значения удельной скорости роста (1.10–1.45 сут–1) отмечены в течение первых и вторых суток (рис. 4б). В последующий период по мере увеличения численности клеток удельная скорость роста снижалась и к концу эксперимента была лишь 0.20 сут–1.
Рис. 4.
Изменение численности клеток (а), удельной скорости роста (б), отношения Fv/Fm (в), отношения С/Хл а (г), объема клеток (д) и концентрации Хл а в расчете на клетку (е) в культуре Pseudosolenia calcar-avis. 1 – культивирование на среде f/2, 2 – f/2 без кремния, 3 – f/2 без нитратов, 4 – на морской воде, обедненной по всем биогенным веществам. Значения на графиках – среднее ± стандартное отклонение.
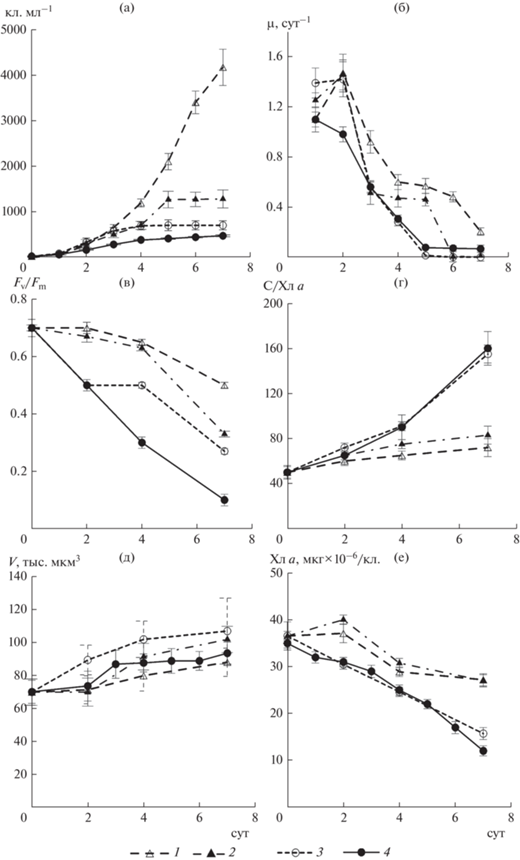
В культуре, помещенной в среду f/2 без кремния, прирост клеток происходил на протяжении первых пяти суток, к концу которых численность водорослей достигла 1280 кл./мл. Удельная скорость роста была максимальной в первые и вторые сутки, а к пятым суткам снизилась в ~3 раза. За пять суток исследуемый вид водорослей осуществил шесть клеточных делений, тогда как в контроле за это же время – 6.7 делений.
Культура P. calcar-avis без нитратов в среде росла с максимальной скоростью (1.40 сут–1) также в течение первых двух суток. Затем к четвертым суткам удельная скорость роста снизилась до 0.30 сут–1, а численность клеток достигла лишь 700 кл./мл. После чего рост водорослей прекратился.
На морской воде прирост данного вида наблюдали в течение четырех суток с постепенным понижением удельной скорости роста от 1.10 до 0.30 сут–1. При этом максимальная численность клеток водорослей была лишь 470 кл./мл. В результате культура, росшая без нитратов в среде, совершила пять клеточных делений, а на морской воде, обедненной по биогенным веществам, – 4.5 деления. Статистически значимые различия (по t-критерию Стьюдента, при р ≤ 0.05) в численности клеток, возраставшей в течение экспериментов, получены между опытами без нитратов и контролем, а также на морской воде без биогенных веществ и контролем. Сходные статистически значимые различия зарегистрированы и для удельной скорости роста.
Снижение удельной скорости роста P. calcar-avis в процессе увеличения численности клеток и в контроле, и в опытах сопровождалось постепенным падением эффективности работы фотосистемы II (рис. 4в), увеличением отношения С/Хл а (рис. 4г) и объема клеток (рис. 4д), а также снижением концентрации Хл а в расчете на клетку (рис. 4е). Однако в культурах, росших на полной среде f/2 или без кремния, эти процессы выражены значительно слабее, чем в культурах, обедненных только по нитратам, либо по нитратам, кремнию и фосфатам. Например, на седьмые сутки эксперимента отношение Fv/Fm снизилось в контроле до 0.50, в культуре, росшей в среде без кремния, – до 0.35, без нитратов – до 0.30, а на морской воде без биогенных веществ – до 0.10. Статистически значимые различия значений Fv/Fm по t-критерию Стьюдента (при р ≤ 0.05) получены между опытами без нитратов и контролем, а также на морской воде без биогенных веществ и контролем. Подобные статистически значимые различия получены и для отношения С/Хл а. За семь суток эксперимента отношение С/Хл а в контроле увеличилось лишь с 50 до 60. Тогда как при культивировании P. calcar-avis без кремния этот показатель вырос до 70, без нитратов – до 150, а без нитратов, кремния и фосфатов – до 155. Это означает, что клетки исследуемого вида водорослей в условиях максимального дефицита всех биогенных веществ характеризовались самым низким содержанием Хл а (рис. 4е), которое было в ~3 раза ниже, чем при оптимальных условиях минерального питания. Результаты микроскопии и в светлом поле, и в темном, где наблюдается красная автофлуоресценция Хл а, подтверждают полученные количественные оценки. Видно, что клеткам водорослей, содержащихся в условиях биогенного насыщения, присуща высокая степень развития пигментной системы. Хлоропласты расположены и в зоне так называемого цитоплазматического мостика, и по всей цитоплазме, расположенной по периферии клетки (рис. 1а, 1б). На морской воде, почти не содержащей биогенных веществ, хлоропласты сконцентрированы, в основном, в зоне цитоплазматического мостика, что может свидетельствовать о сильной деградации пигментной системы (рис. 1в, 1г).
Во всех вариантах опытов минимальные изменения отмечены для объема клеток, который возрастал в течение семи суток лишь на 10–30% (рис. 4д), а удельная поверхность в расчете на единицу объема клетки находилась в диапазоне 0.28–0.30 мкм–1, в расчете на единицу цитоплазмы – ~0.80–0.90 мкм–1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Принято считать, что по мере увеличения объема клеток морских микроводорослей со 100 мкм3 и выше удельная скорость роста снижается (Banse, 1982; Finkel, 2001; Marañón, 2015). У крупноклеточных диатомовых водорослей с объемом ~100 тыс. мкм3 этот показатель достигает 0.20–0.30 сут–1 (Marañón, 2015). Однако по нашим данным, максимальная удельная скорость роста черноморского штамма P. calcar-avis с объемом клеток 100–160 тыс. мкм3 была 1.40 сут–1. Более высокие значения (1.84 сут–1) получены для культуры диатомовой водоросли Rhizosolenia setigera Brightwell, выделенной из вод Токийского залива и имеющей такой же объем клетки, как и у Pseudosolenia calcar-avis (Yoshimatsu et al., 2020). Следовательно, представленные результаты слабо подчиняются установленной ранее зависимости удельной скорости роста морских микроводорослей от объема их клеток. Это противоречие обусловлено, вероятно, структурными и функциональными особенностями некоторых крупных видов диатомовых водорослей, обеспечивающими их интенсивный рост. К таким особенностям у P. calcar-avis следует отнести высокие значения эффективности работы фотосистемы II, близкие к максимальным, выявленным ранее у мелких и средних по размерам видов диатомовых водорослей (Аkimov, Solomonova, 2019). В условиях максимального роста исследованной нами культуры удельное содержание Хл а в расчете на единицу органического углерода достигло почти 1%, что является непременным условием для роста морских микроводорослей с высокой скоростью (Стельмах, 2017).
Наличие крупной внутриклеточной вакуоли у P. calcar-avis, занимающей основной объем клетки, существенно влияет на ее функциональные свойства. Все хлоропласты клетки сосредоточены в узком пристеночном слое цитоплазмы, что повышает эффективность использования световой энергии. Удельная поверхность клеток вида в расчете на небольшой пристеночный объем цитоплазмы сопоставима с таковой для мелких клеток водорослей, у которых клеточная вакуоль небольшая и занимает приблизительно ≤30% объема клетки (Schreiber et al., 2017), что также усиливает эффективность использования световой энергии пигментами P. calcar-avis в процессе фотосинтеза. Небольшой объем цитоплазмы у исследованного нами вида повышает эффективность транспорта биогенных веществ из внешней среды в клетку, а движение цитоплазмы вдоль клеточной мембраны усиливает транспорт биогенных веществ в самой клетке (Raven, 1987). Вероятно поэтому скорость поглощения из воды биогенных веществ, прежде всего азота, у крупноклеточных представителей диатомовых водорослей рода Rhizosolenia в 3 раза выше их удельной скорости роста (Richardson et al., 1996).
При достижении максимальной скорости роста водорослей процесс транспорта биогенных веществ из среды в клетку через ее плазматическую мембрану продолжается. Это позволяет морским планктонным водорослям, в том числе крупным видам диатомовых, накапливать внутри клеток (например, в вакуолях) определенный запас питательных веществ, что следует рассматривать как стратегию выживания водорослей при неблагоприятных по биогенным веществам условиях (Baek et al., 2008). В отсутствии внешних источников минеральных форм азота, кремния и фосфора рост микроводорослей осуществляется за счет внутриклеточного запаса питательных веществ. В процессе их роста из внутриклеточных резервов потребляются в первую очередь так называемые легко усваиваемые питательные вещества – неорганические формы биогенных элементов, затем – трудно утилизируемые органические вещества (аминокислоты, нуклеиновые кислоты, некоторые белки и органические формы фосфора) (Girault et al., 2013; Palabhanvi et al., 2014). После этого вегетативный рост водорослей прекращается. Внутриклеточный пул питательных веществ, вероятно, у разных видов неодинаков. Он позволяет некоторым мелкоклеточным видам диатомовых водорослей осуществить одно клеточное деление (Шоман, 2015), динофитовым – два–три деления (Стельмах, Мансурова, 2021). Тогда как культура Pseudosolenia calcar-avis при полном отсутствии внешних источников биогенных веществ поделилась 4.5 раза за счет их запасов, содержащихся в крупной клеточной вакуоли. При таких условиях значения удельной скорости роста, эффективности работы фотосистемы II и удельного содержания Хл а у исследуемого вида быстро снижались, что следует рассматривать как один из механизмов или способов его выживания и сохранения функциональной активности в течение первых четырех суток без дополнительных внешних источников азота, кремния и фосфора.
После исчерпания внутриклеточных запасов биогенных веществ в культуре в течение последующих 5–7 сут численность клеток не изменялась, а их слабая красная автофлуоресценция и низкие значения эффективности работы фотосистемы II, при которых возможно полное восстановление функционирования водорослей в благоприятных условиях, свидетельствовали о сохранении жизнеспособности культуры. Для дальнейшего роста этого вида необходим доступ к внешнему источнику биогенных веществ, который будет поддерживать его функционирование на высоком уровне.
В условиях дефицита минеральных питательных веществ в стратифицированных водах Черного моря в теплый период года P. calcar-avis может периодически получать минеральные соединения биогенных элементов из глубин за счет периодического ослабления температурного расслоения водной толщи в результате усиления ветровой деятельности и штормов, что обычно наблюдается в осенний период (Yunev et al., 2021).
Возможным дополнительным источником азота для исследуемого нами вида может быть атмосферный азот, способность к фиксации которого показана для цианобактерии Richelia intracellularis Schmidt – эндосимбионта некоторых видов диатомовых водорослей, включая род Rhizosolenia (Anderson et al., 2018). Скорость фиксации атмосферного азота Richelia intracellularis, находящейся в клетках диатомовых водорослей, в 170–420 раз выше, чем у свободноживущих клеток этой цианобактерии. Количество фиксируемого азота во много раз превосходит потребности в нем самой цианобактерии. Основная его часть трансформируется в аммонийный азот и далее используется клетками диатомовых водорослей (Foster et al., 2011). Симбиоз водорослей рода Rhizosolenia и цианобактерии Richelia intracellularis зарегистрирован в субтропических водах Тихого океана (Anderson et al., 2018), в Аравийском (Padmakumar et al., 2010) и Средиземном (Zeev et al., 2008) морях. В Черном море это явление не изучали, однако присутствие R. intracellularis в водах глубоководных районов (Виноградова, Брянцева, 2017) позволяет предположить существование здесь симбиотических отношений между данной цианобактерией и Pseudosolenia calcar-avis.
Пополнение клеток исследуемого нами вида диатомовых водорослей биогенными веществами может осуществляться, вероятно, за счет его вертикальных миграций. Это предположение основано на результатах, подтверждающих, что представители рода Rhizosolenia способны регулировать свою плавучесть и совершать миграции за пределы зоны фотосинтеза, накапливать там биогенные вещества и вновь подниматься вверх (Kemp, Villareal, 2018).
Описанные выше механизмы функционирования P. calcar-avis и отсутствие потребления ее микрозоопланктоном в Черном море обеспечивают виду преобладание в фитопланктоне даже при низких концентрациях биогенных веществ в воде (Stelmakh, Georgieva, 2014).
Выводы. Исследованы особенности структурно-функциональных характеристик крупноклеточной диатомовой водоросли Pseudosolenia calcar-avis, позволяющие ей доминировать в фитопланктоне Черного моря при разном уровне биогенных веществ в воде. Среди структурных особенностей вида следует выделить присутствие крупной внутриклеточной вакуоли, которая способствует движению пристеночного слоя цитоплазмы вдоль периферии клетки, улучшая транспорт биогенных веществ. Наличие тонкого слоя цитоплазмы увеличивает удельную поверхность клетки в расчете на цитоплазму, что усиливает эффективность использования световой энергии пигментами в процессе фотосинтеза. Высокие значения эффективности работы фотосистемы II (0.67–0.69) и относительного содержания Хл а (~1% органического углерода) при оптимальных условиях среды позволили данному виду расти с высокой скоростью (1.40 сут–1). Перенос клеток P. calcar-avis, имеющих максимальный внутриклеточный пул биогенных веществ, в морскую воду, обедненную по биогенным веществам, вызвал снижение эффективности работы фотосистемы II, относительного содержания Х а и удельной скорости роста. За счет внутриклеточного пула питательных веществ исследуемый вид водорослей осуществил 4.5 клеточных деления за 4 сут. После исчерпания внутриклеточных запасов биогенных веществ в культуре в течение последующих 5–7 сут численность клеток почти не изменялась, а их слабая красная автофлуоресценция и низкие значения эффективности работы фотосистемы II, при которых возможно полное восстановление функционирования водорослей в благоприятных условиях, свидетельствовали о сохранении жизнеспособности культуры. Для достижения высокой степени функциональной активности P. calcar-avis необходим внешний источник минеральных форм питательных веществ, который может быть обеспечен предположительно несколькими путями.
Список литературы
Брянцева Ю.В., Лях А.М., Сергеева А.В. 2005. Расчет объемов и площадей поверхности одноклеточных водорослей Черного моря. Севастополь. (Препринт НАН Украины, Институт Биологии Южных морей).
Виноградова О.Н., Брянцева Ю.В. 2017. Таксономическая ревизия Сyanobacteria/Сyanoprokaryota черноморского побережья Украины // Альгология. Т. 27. № 4. С. 436. https://doi.org/10.15407/alg27.04.436
Парсонс Т.Р., Такахаши М., Харгрей В. 1982. Биологическая океанография. Москва: Легк. и пищ. пром-сть. (Parsons T.R., Takahashi M., Hargrave B. 1977. Biological oceanographic processes. Oxford: Pergamon Press).
Погосян С.И., Гальчук С.В., Казимирко Ю.В. и др. 2009. Применение флуориметра “МЕГА-25” для определения количества фитопланктона и оценки состояния его фотосинтетического аппарата // Вода: химия и экология. № 6 (12). С. 34.
Стельмах Л.В. 2017. Закономерности роста фитопланктона и его потребление микрозоопланктоном в Черном море: Автореф. дис. … докт. биол. наук. Севастополь. http://repository.marineresearch.org/handle/299011/2072
Стельмах Л.В., Мансурова И.М. 2021. Физиологический механизм выживания динофитовых водорослей в условиях биогенного лимитирования // Биология внутр. вод. № 2. С. 198.
https://doi.org/10.31857/S0320965221010157
Финенко З.З., Стельмах Л.В., Мансурова И.М. и др. 2017. Сезонная динамика структурных и функциональных показателей фитопланктонного сообщества в Cевастопольской бухте // Системы контроля окружающей среды. Вып. 29. С. 73. https://doi.org/10.33075/2220-5861-2017-3-73-82
Шоман Н.Ю. 2015. Динамика внутриклеточного содержания углерода, азота и хлорофилла a в условиях накопительного роста диатомовой водоросли Phaeodactylum tricornutum (Bohlin, 1897) при разной интенсивности света // Биология моря. Т. 41. № 5. С. 324. http://elibrary.ru/item.asp?id=24862972
Akimov A.I., Solomonova E.S. 2019. Characteristics of growth and fluorescence of certain types of algae during acclimation to different temperatures under culture conditions // Oceanology. V. 59. Iss. 3. P. 316.
https://doi.org/10.1134/S0001437019030019
Anderson E.E., Wilson C., Knap A.H., Villareal T.A. 2018. Summer diatom blooms in the eastern North Pacific gyre investigated with a long-endurance autonomous surface vehicle // PeerJ 6:e5387. https://doi.org/10.7717/peerj.5387
Baek S.H., Shimode S., Han M.-S., Kikuchi T. 2008. Growth of dinoflagellates Ceratium furca and Ceratium fusus in Sagami Bay, Japan: The role of nutrients // Harmful Algae. V. 7. Iss. 6. P. 729. https://doi.org/10.1016/j.hal.2008.02.007
Banse K. 1982. Cell volumes, maximal growth rates of unicellular algae and ciliates, and the role of ciliates in the marine pelagial // Limnol., Oceanogr. V. 27. P. 1059.
Behrenfeld J.M., Worthington K., Sherrell M.R. et al. 2006. Controls on tropical Pacific productivity revealed through nutrient stress diagnostics // Nature. V. 442. Iss. 7106. P. 1025. https://doi.org/10.1038/nature05083
Bopp L., Aumont O., Cadule P. et al. 2005. Response of diatoms distribution to global warming and potential implications: a global model study // Geophys. Res. Lett. V. 32. Iss. 19. L19606. https://doi.org/10.11029/12005GL023653
Finkel Z.V. 2001. Light absorption and size scaling of light-limited metabolism in marine diatoms // Limnol., Oceanogr. V. 46. P. 86. https://doi.org/10.4319/lo.2001.46.1.0086
Foster R.A., Kuypers M., Vagner T. et al. 2011. Nitrogen fixation and transfer in open ocean diatom–cyanobacterial symbioses // The ISME J. V. 5. P. 1484. https://doi.org/10.1038/ismej.2011.26
Girault M., Arakawa H., Hashihama F. 2013. Phosphorus stress of microphytoplankton community in the western subtropical North Pacific // J. Plankton Res. V. 35. Iss. 1. P. 146. https://doi.org/10.1093/plankt/fbs076
Goldman J.C., McGillicuddy D.J. 2003. Effect of large marine diatoms growing at low light on episodic new production // Limnol., Oceanogr. V. 48. Iss. 3. P. 1176. https://doi.org/10.4319/lo.2003.48.3.1176
Guillard R.R.L., Ryther J.H. 1962. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve // Can. J. Microbiol. V. 8. P. 229.
Häder D.-P., Gao K. 2015. Interactions of anthropogenic stress factors on marine phytoplankton // Front. Environ. Sci. V. 3. Article 14. P. 1. https://doi.org/10.3389/fenvs.2015.00014
Kemp A.E.S., Villareal T.A. 2018. The case of the diatoms and the muddled mandalas: Time to recognize diatom adaptations to stratified waters // Progress in Oceanography. V. 167. P. 138. https://doi.org/10.1016/j.pocean.2018.08.002
Laufkötter C., Vogt M., Gruber N. et al. 2016. Projected decreases in future marine export production: the role of the carbon flux through the upper ocean ecosystem // Biogeosciences. V. 13. Iss. 13. P. 4023. https://doi.org/10.5194/bg-13-4023-2016
Marañón E. 2015. Cell size as a key determinant of phytoplankton metabolism and community structure // Annu. Rev. Mar. Sci. V. 7. P. 241. https://doi.org/10.1080/00318884.2020.1812260
Margalef R. 1978. Life-forms of phytoplankton as survival alternatives in an unstable environment // Oceanol. Acta. V. 1. P. 493.
Menden-Deuer S., Lessard E.J. 2000. Carbon to volume relationships for dinoflagellates, diatoms, and other protist plankton // Limnol., Oceanogr. V. 45. Iss. 3. P. 569. https://doi.org/10.4319/lo.2000.45.3.0569
Mikaelyan A.S., Kubryakov A.A., Silkin V.A. et al. 2018. Regional climate and patterns of phytoplankton annual succession in the open waters of the Black Sea // Deep-Sea Res. Pt. I. V. 142. P. 44. https://doi.org/10.1016/j.dsr.2018.08.001
Padmakumar K.B., Menon N.R., Sanjeevan V.N. 2010. Occurrence of endosymbiont Richelia intracellularis (Cyanophyta) within the diatom Rhizosolenia hebetata in Northern Arabian Sea // International J. Biodiversity and Conservation. V. 2. Iss. 4. P. 70. https://doi.org/10.5897/IJBC.9000100
Palabhanvi B., Kumar V., Muthuraj M., Das D. 2014. Preferential utilization of intracellular nutrients supports microalgal growth under nutrient starvation: Multi-nutrient mechanistic model and experimental validation // Bioresour. Technol. V. 173. P. 245. https://doi.org/10.1016/j.biortech.2014.09.095
Pedrosa-Pamies R., Sanchez-Vidal A., Canals M. et al. 2016. Enhanced carbon export to the abyssal depths driven by atmosphere dynamics // Geophys. Res. Lett. V. 43. Iss. 16. P. 8626. https://doi.org/10.1002/2016GL069781
Protocols for the Joint Global Ocean Flux Study (JGOFS) Core Measurements. JGOFS Report Nr. 19, vi+170 pp. Reprint of the IOC Manuals and Guides No. 29. UNESCO 1994. http://hdl.handle.net/11329/220
Raven J.A. 1987. The role of vacuoles // New Phytologist. V. 106. Iss. 3. P. 357.
Richardson T.L., Ciotti A.M., Cullen J.J. 1996. Physiological and optical properties of Rhizosolenia formosa (Bacillariophyceae) in the context of open-ocean vertical migration // J. Phycol. V. 32. P. 741. https://doi.org/10.1111/j.0022-3646.1996.00741.x
Schreiber V., Dersch J., Puzik K. et al. 2017. The Central Vacuole of the Diatom Phaeodactylum tricornutum: Identification of New Vacuolar Membrane Proteins and of a Functional Di-leucine-based Targeting Motif // Protist. V. 168. Iss. 3. P. 271. https://doi.org/10.1016/j.protis.2017.03.001
Steele J.G. 1962. Environmental control of photosynthesis in the sea // Limnol., Oceanogr. V. 1. P. 137.
Stelmakh L.V., Georgieva E.Yu. 2014. Microzooplankton: the trophic role and involvement in the phytoplankton loss and bloom-formation in the Black Sea // Turkish J. Fish. and Aquatic Sci. V. 14. P. 955. https://doi.org/10.4194/1303-2712-v14_4_15
Stelmakh L., Gorbunova T. 2019. Effect of phytoplankton adaptation on the distribution of its biomass and chlorophyll a concentration in the surface layer of the Black Sea // Oceanol. Hydrobiol. Stud. V. 48. Iss. 4. P. 404. https://doi.org/10.2478/ohs-2019-0035
Yoshimatsu T., Yamaguchi H., Limura A. et al. 2020. Effects of temperature, salinity, and light intensity on the growth of the diatom Rhizosolenia setigera in Japan // Phycologia. V. 59. Iss. 6. P. 551. https://doi.org/10.1080/00318884.2020.1812260
Yunev O.A., Carstensen J., Stelmakh L.V. et al. 2021. Reconsideration of the phytoplankton seasonality in the open Black Sea // Limnology and Oceanography Letters. V. 6. P. 51. https://doi.org/10.1002/lol2.10178
Zeev E.B., Yogev T., Man-Aharonovich D. et al. 2008. Seasonal dynamics of the endosymbiotic, nitrogen-fixing cyanobacterium Richelia intracellularis in the eastern Mediterranean Sea // The ISME Journal. V. 2. P. 911.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


