Биология внутренних вод, 2022, № 4, стр. 412-424
Сравнительный анализ паразитофауны остромордой лягушки Rana arvalis в средовых градиентах Урала
А. В. Буракова a, *, В. Л. Вершинин a, b, **, С. Д. Вершинина a
a Институт экологии растений и животных Уральского отделения Российской академии наук
Екатеринбург, Россия
b Уральский федеральный университет, кафедра биоразнообразия и биоэкологии
Екатеринбург, Россия
* E-mail: annabios@list.ru
** E-mail: vol_de_mar@list.ru
Поступила в редакцию 22.06.2021
После доработки 07.12.2021
Принята к публикации 08.12.2021
- EDN: WPVPPV
- DOI: 10.31857/S0320965222040076
Аннотация
Проанализированы паразитоценозы Rana arvalis Nilss., 1842 в градиентах природных и урбанистических ландшафтов Урала. Обнаружено 12 видов гельминтов (типы Platyhelminthes и Nematoda). Показано, что изменение соотношения паразитов разных таксонов обусловлено различиями в биологии групп паразитов и микробиотопическими особенностями местообитаний хозяев. Трансформация паразитоценозов в популяциях R. arvalis урбоценоза Среднего Урала сопровождается обеднением видового состава паразитов и увеличением доли трематод. В период завершения метаморфоза R. arvalis расширяется видовой спектр макропаразитов различной локализации и появляются редкие виды гельминтов, что связано с расширением пищевого спектра амфибий. Таким образом, особенности видового богатства и структуры паразитарных сообществ остромордой лягушки во многом связаны с термо- и влагообеспеченностью и их соотношением в определенных биоценозах.
ВВЕДЕНИЕ
Остромордая лягушка Rana arvalis Nilsson, 1842 – широкоареальный и экологически пластичный вид бесхвостых амфибий (Кузьмин, 1999). В пределах России паразитофауна этого вида описана в Калининградской (Голикова, 1960) и Вологодской (Радченко, Шабунов, 2008) областях. Наиболее полно гельминтофауна R. arvalis изучена на территории Среднего Поволжья (Чихляев и др., 2015; Chikhlyaev, Ruchin, 2021), Башкирии (Юмагулова, 2000; Зарипова и др., 2008; Зарипова и др., 2018), Западной Сибири (Куранова, 1988; Буракова, 2012; Жигилева, Кирина, 2015) и Новосибирской обл. (Золотаренко, Соусь, 1976), на территории Ханты-Мансийский автономный округ-Югра (Ибрагимова, Стариков, 2013; Ибрагимова, Наконечный, 2017) и Республики Бурятия (Щепина и др., 2009; Балданова и др., 2010).
Для Уральского региона имеются сведения по паразитоценозам городских агломераций г. Екатеринбург (Вершинин и др., 2017), Полярного Урала (Вершинин и др., 2018) и Южного Урала и Зауралья (Даниловский, 1997; Буракова, Вершинин, 2016). Поскольку Уральская горная страна имеет значительную протяженность с севера на юг (~2300 км), пересекает несколько ландшафтно-климатических зон и является естественной границей между Европой и Азией (Чикишев, 1966), изучение паразитоценозов R. arvalis на Урале представляется весьма важным.
Цель работы – оценить изменения паразитокомплекса R. arvalis в средовых градиентах Урала.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал собирали в 2010–2019 гг. на территориях горной части и поймы р. Обь Полярного Урала, западного и восточного (городские и природные территории) склонов Среднего Урала, Восточно-Южноуральской провинции Южного Урала и Зауралья (рис. 1).
Рис. 1.
Карта-схема мест сбора материала. 1 – урочище “Красный камень”, 2 – г. Лабытнанги, 3 – Висимский заповедник, 4 – пос. Вогулка, 5 – г. Красноруфимск, 6 – парк “Оленьи ручьи”, 7 – пос. Бугалыш, 8 – г. Краснотурьинск, 9 – пос. Октябрьский, 10 – пос. Сагра, 11 – оз. Песчаное, 12 – г. Екатеринбург (обозначен черным квадратом), 13 – оз. Берданиш, 14 – пос. Метлино, 15 – пос. Байдашево, 16 – пос. Аркаим, 17 – г. Туринск, 18 – пос. Варгаши, 19 – оз. Камышное, 20 – пос. Сунгурово, 21 – оз. Куртан, 22 – пос. Кошелево, 23 – пос. Журавлевка, 24 – оз. Степное.

Поскольку Урал в долготном направлении пересекает восемь физико-географических областей (Чикишев, 1966), климатические различия между его северными и южными территориями очень велики (табл. 1). Геохимическая особенность нерестовых водоемов лесостепной и степной зон Зауралья – высокая естественная минерализация (табл. 2).
Таблица 1.
Климатические особенности физико-географических областей Урала
| Регион | Климат | Годовая сумма осадков, мм | Средняя температура воздуха в июле, °С | Относительная влажность воздуха летом, % | Литературный источник |
|---|---|---|---|---|---|
| Полярный Урал | Арктический, холодный | 650–800 в долинах рек | +10…+12 | 70–80 | Кривцов, Водорезов, 2016 |
| Средний Урал | Умеренно-континентальный | 400–700 | +16…+19 | 60–65 | Чикишев, 1966; Дьяченко, 1997; Кривцов, Водорезов, 2016 |
| Западный склон | Умеренно-континентальный | 600–700 | |||
| Восточный склон | Значительно континентальнее и суше климата западного склона | 400–500 | |||
| Южный Урал | Континентальнее климата Среднего Урала | 300–500 | +18…+20, +22…+40 на крайнем юге |
70–76 | Чикишев, 1966; Мильков, Гвоздецкий, 1976; Дьяченко, 1997 |
| Зауралье | Континентальный | 300–400 | +19…+21 | 30–59 | Кувшинова, 1968; Дьяченко, 1997; Кривцов, Водорезов, 2016 |
Таблица 2.
Средняя минерализация поверхностных вод и среднемесячная температура за период апрель–май
| Регион | Показатель | |
|---|---|---|
| минерализация, мг/дм3 | температура, °C | |
| Средний Урал западный склон |
198.7 ± 102.6 (n = 4) | – |
| восточный склон | 142.1 ± 24.9 (n = 68) | 11.6 ± 0.31 (n = 223) |
| г. Екатеринбург лесопарковая зона | 190.4 ± 18.9 (n = 117) | 11.5 ± 0.21 (n = 504) |
| селитебные территории | 419.6 ± 18.2 (n = 128) | 13.7 ± 0.17 (n = 725) |
| Южный Урал | 216.0 ± 118.6 (n = 3) | – |
| Зауралье | 842.3 ± 118.6 (n = 3) | – |
Изучение паразитоценозов в градиенте урбанизации проводили на примере г. Екатеринбург, расположенного на восточном склоне Среднего Урала (рис. 1). В пределах городской агломерации выделяли селитебную и лесопарковую зоны (Vershinin et al., 2015). В качестве контроля использовали загородные популяция R. arvalis. Наличие средового градиента подтверждено данными гидрохимических анализов нерестовых водоемов, полученными в лаборатории физико-химических анализов Уральского государственного горного университета. Проанализированы различия паразитоценозов животных на 52–53-й стадиях развития и завершивших метаморфоз (54-я стадия) (Дабагян, Слепцова, 1975).
Изучено 2468 экз. остромордой лягушки: с территории Полярного Урала – 30, Среднего Урала – 1833 (из них в пределах городской агломерации – 1378, природных – 455, Южного Урала – 55, Зауралья – 550 экз.
Идентификацию паразитов проводили по стандартной методике (Ивашкин и др., 1971; Рыжиков и др., 1980; Судариков и др., 2002). Зараженность лягушек оценивали по ЭИ (%) и ИО (экз./особь хозяина) (Бреев, 1976). Для оценки значимости различий по ЭИ использован критерий χ2 с поправкой Йетса, по ИО – дисперсионный анализ. Оценка структуры доминирования проводилась с использованием подхода А.А. Кириллова (Кириллов, 2011). Значения экстенсивность инвазии и индекс обилия, значимость различий вычисляли c помощью программного пакета Statistica for Windows 6.0).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У R. arvalis на исследуемых территориях зарегистрировано 12 видов паразитов, относящихся к типам Platyhelminthes (6 видов) и Nematoda (6). Видовой состав, локализация и зараженность паразитами R. arvalis приведены в табл. 3, 4.
Таблица 3.
Видовой состав и показатели инвазированности паразитами Rаnа arvalis в природных экосистемах Урала
| Таксон | Полярный Урал (n = 30) |
Средний Урал (n = 455) |
Южный Урал (n = 55) |
Зауралье (n = 550) |
Локализация паразита |
|---|---|---|---|---|---|
| Тип Platyhelminthes Claus, 1887 | |||||
| Класс Trematoda Rudolphi, 1808 | – | $\frac{{28.35}}{{{{{5.84}}^{d}}}}$ | $\frac{{29.09}}{{1.23}}$ | $\frac{{{{{51.09}}^{{b,c}}}}}{{3.75}}$ | |
| Dolichosaccus rastellus (Olsson, 1876) | – | $\frac{{6.15}}{{0.22}}$ | $\frac{{{{{23.63}}^{b}}}}{{1.05}}$ | $\frac{{{{{40.91}}^{{b,c}}}}}{{{{{2.19}}^{b}}}}$ | Кишечник |
| Opisthioglyphe ranae (Frölich., 1791) | – | – | $\frac{{3.63}}{{0.05}}$ | $\frac{{1.27}}{{0.04}}$ | То же |
| Haplometra cylindracea (Zeder., 1800) | – | $\frac{{5.27}}{{0.14}}$ | $\frac{{5.45}}{{0.05}}$ | $\frac{{{{{18.00}}^{{b,c}}}}}{{{{{0.60}}^{{b,c}}}}}$ | Легкие |
| Echinoparyphium recurvatum (Linstow, 1873), mtc. | – | – | – | $\frac{{2.55}}{{0.33}}$ | Почки |
| Holostephanus volgensis (Sudarikov, 1962), mtc. | – | $\frac{{{{{17.36}}^{{с,d}}}}}{{{{{5.48}}^{d}}}}$ | $\frac{{1.81}}{{0.07}}$ | $\frac{{0.73}}{{0.57}}$ | Полость тела |
| Тип Nematoda Cobb, 1932 | |||||
| Класс Chromadorea Inglis, 1983 | $\frac{{10}}{{0.43}}$ | $\frac{{{{{31.21}}^{a}}}}{{1.35}}$ | $\frac{{{{{34.54}}^{a}}}}{{2.03}}$ | $\frac{{{{{70.55}}^{{a,b,c}}}}}{{{{{7.54}}^{{a,b,c}}}}}$ | – |
| Oswaldocruzia filiformis (Goeze, 1782) | $\frac{{10}}{{0.43}}$ | $\frac{{20.88}}{{0.84}}$ | $\frac{{27.27}}{{1.18}}$ | $\frac{{{{{63.64}}^{{a,b,c}}}}}{{{{{4.26}}^{{a,b,c}}}}}$ | Кишечник |
| Cosmocerca ornata (Dujardin., 1845) | – | $\frac{{{{{14.06}}^{{c,d}}}}}{{{{{0.35}}^{d}}}}$ | $\frac{{1.81}}{{0.01}}$ | $\frac{{0.91}}{{0.05}}$ | То же |
| Neoraillietnema praeputiale (Skrjabin., 1916) | – | $\frac{{2.42}}{{0.05}}$ | – | – | » |
| Aplectana acuminata (Schrank., 1788) | – | $\frac{{0.43}}{{0.01}}$ | – | – | » |
| Cosmocercoides pulcher Wilkie., 1930 | – | – | – | $\frac{{0.55}}{{0.009}}$ | » |
| Rhabdias bufonis (Schrank., 1788) | – | $\frac{{4.40}}{{0.09}}$ | $\frac{{{{{10.90}}^{b}}}}{{0.83}}$ | $\frac{{{{{35.45}}^{{b,c}}}}}{{{{{3.22}}^{{b,c}}}}}$ | Легкие |
| Число видов | 1 | 8 | 7 | 9 | |
Примечание. Здесь и в табл. 4: над чертой – экстенсивность инвазии (ЭИ), %, под чертой – индекс обилия (ИО), экз./особь хозяина, mtc. – метацеркарии; n – количество исследованных лягушек, “–” – отсутствие таксона. Значимые различия: a c Заполярьем; b со Средним Уралом; c с Южным Уралом; d с Зауральем.
Таблица 4.
Видовой состав и показатели инвазированности паразитами Rаna arvalis в природных и урбанизированных ландшафтах Среднего Урала
| Виды | Средний Урал (n = 1833) | ||
|---|---|---|---|
| Западный склон (n = 173) |
Восточный склон (n = 1660) | ||
| урбоценоз (n = 1378) |
природные территории (n = 282) | ||
| Тип Platyhelminthes Claus, 1887 | |||
| Класс Trematoda Rudolphi, 1808 | $\frac{{24.27}}{{0.73}}$ | $\frac{{{{{40.56}}^{a}}}}{{9.81}}$ | $\frac{{{{{30.85}}^{d}}}}{{{{{8.98}}^{d}}}}$ |
| Dolichosaccus rastellus (Olsson, 1876) | $\frac{{{{{13.87}}^{c}}}}{{{{{0.52}}^{c}}}}$ | $\frac{{{{{11.17}}^{a}}}}{{{{{0.70}}^{a}}}}$ | $\frac{{1.42}}{{0.03}}$ |
| Opisthioglyphe ranae (Frölich, 1791) | – | $\frac{{1.59}}{{0.04}}$ | – |
| Haplometra cylindracea (Zeder, 1800) | $\frac{{{{{10.40}}^{c}}}}{{0.21}}$ | $\frac{{3.84}}{{0.22}}$ | $\frac{{2.13}}{{0.10}}$ |
| Echinoparyphium recurvatum (Linstow, 1873), mtc. | – | $\frac{{2.24}}{{0.17}}$ | – |
| Holostephanus volgensis (Sudarikov, 1962), mtc. | – | $\frac{{26.41}}{{8.66}}$ | $\frac{{28.01}}{{8.84}}$ |
| Diplodiscus subclavatus (Goeze, 1782) | – | $\frac{{0.07}}{{0.0007}}$ | – |
| Тип Nematoda Cobb, 1932 | |||
| Класс Chromadorea Inglis, 1983 | $\frac{{{{{53.17}}^{c}}}}{{{{{2.48}}^{c}}}}$ | $\frac{{11.53}}{{0.58}}$ | $\frac{{{{{17.73}}^{b}}}}{{0.65}}$ |
| Oswaldocruzia filiformis (Goeze, 1782) | $\frac{{{{{40.46}}^{c}}}}{{{{{1.76}}^{c}}}}$ | $\frac{{9.57}}{{0.41}}$ | $\frac{{8.87}}{{0.27}}$ |
| Cosmocerca ornata (Dujardin, 1845) | $\frac{{{{{19.65}}^{c}}}}{{0.42}}$ | $\frac{{3.62}}{{0.08}}$ | $\frac{{{{{10.64}}^{b}}}}{{{{{0.30}}^{b}}}}$ |
| Neoraillietnema praeputiale (Skrjabin, 1916) | $\frac{{{{{5.20}}^{c}}}}{{{{{0.13}}^{c}}}}$ | $\frac{{0.29}}{{0.002}}$ | $\frac{{0.35}}{{0.007}}$ |
| Aplectana acuminata (Schrank, 1788) | $\frac{{1.15}}{{0.02}}$ | – | – |
| Rhabdias bufonis (Schrank, 1788) | $\frac{{6.93}}{{0.13}}$ | $\frac{{2.53}}{{0.08}}$ | $\frac{{2.84}}{{0.07}}$ |
| Всего видов | 7 | 10 | 7 |
В зависимости от способа поступления и особенностей цикла развития, гельминтов разделяют на три экологические группы (Чихляев, Файзулин, 2016): 1) автогенные биогельминты – взрослые стадии (мариты) трематод, циркулирующие по трофическим связям (Dolichosaccus rastellus, Opisthioglyphe ranae, Diplodiscus subclavatus, Haplometra cylindracea); 2) аллогенные биогельминты – гельминты, активно (перкутанно) проникающие в организм амфибий из воды (Echinoparyphium recurvatum, Holostephanus volgensis); 3) автогенные геогельминты – половозрелые стадии нематод с прямым циклом развития, пассивно (перорально) заражающие хозяина при случайном контакте с инвазионными личинками на суше (Oswaldocruzia filiformis, Aplectana acuminatа, Neoraillietnema praeputiale, Cosmocercoides pulcher, Rhabdias bufonis) или в воде (Cosmocerca ornata) (Кириллов, Кириллова, 2016; Кириллова, Кириллов, 2021), т.е. не циркулирующих по трофическим связям (рис. 2а).
Рис. 2.
Экологические группы (а) и соотношение видов паразитов (б) у R. arvalis на изучаемых территориях.

Для R. arvalis изученных территорий Полярного Урала отмечена только нематода Oswaldocruzia filiformis. Для Среднего Урала выявлены нематоды Aplectana acuminata и Neoraillietnema praeputiale, не обнаруженные в других регионах. Только для Зауралья отмечена нематода Cosmocercoides pulcher. За исключением Полярного Урала, повсеместно выявлены метацеркарии трематоды Holostephanus volgensis. Сравнительно небольшой объем сборов с территорий Полярного и Южного Урала не позволил провести исчерпывающий анализ структуры паразитоценозов данных регионов (рис. 2б).
ЭИ трематодами выше на территории Зауралья и в популяциях амфибий урбоэкосистем Среднего Урала (табл. 4), по сравнению с природными, однако ИО больше у животных с территории Среднего Урала, чем Зауралья. Зараженность метацеркариями трематоды Holostephanus volgensis значимо выше у амфибий Среднего Урала (табл. 3), преимущественно его восточного склона.
Самая высокая зараженность нематодами отмечена для Зауралья. У животных природных экосистем Среднего Урала, где значительный вклад вносит зараженность амфибий Cosmocerca ornata, ЭИ нематодами значимо выше, чем в урбоценозах (табл. 4).
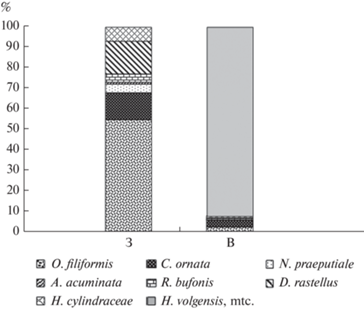
Наряду с наличием общих видов (табл. 2, рис. 3), только на западном склоне отмечена нематода Aplectana acuminata, а на восточном – метацеркарии трематоды Holostephanus volgensis, инвазированность которой максимальна у R. arvalis в урбоценозе Среднего Урала. В среднеуральских популяциях R. arvalis западного склона доминирующий вид – Oswaldocruzia filiformis, субдоминанты – Cosmocerca ornata и Dolichosaccus rastellus. В природных популяциях восточного склона отмечено супердоминирование Holostephanus volgensis. На долю нематод Oswaldocruzia filiformis, Cosmocerca ornata, Rhabdias bufonis и трематоды Haplometra cylindracea приходится 2.8, 3.13, 0.74 и 1.07% соответственно (рис. 3).
Рис. 3.
Соотношение видов паразитов у Rаna arvalis на западном (З) и восточном (В) склонах Среднего Урала.
Для амфибий городской агломерации (селитебная и лесопарковая зоны) и природных территорий отмечено девять общих видов паразитов. Только на городских территориях выявлены трематоды Diplodiscus subclavatus (селитебная зона) и Echinoparyphium recurvatum (табл. 3, рис. 4), в природных популяциях – Aplectana acuminata. Высокая степень доминирования Holostephanus volgensis, mtc. отмечена у амфибий природных территорий (рис. 4, табл. 4). В урбоценозах увеличивается доля и инвазированность животных селитебной зоны трематодой Dolichosaccus rastellus.
Рис. 4.
Соотношение видов паразитов для Rаna arvalis урбанизированных и природных территорий восточного склона Среднего Урала.
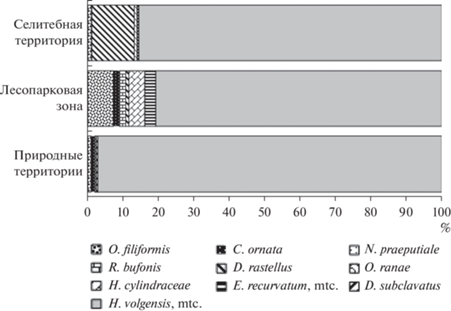
Наибольшее разнообразие нематод отмечено в популяциях R. arvalis природных территорий и лесопарковой зоны. В градиенте урбанизации снижается доля Oswaldocruzia filiformis и Rhabdias bufonis (рис. 4). На западном склоне Среднего Урала доминирует Oswaldocruzia filiformis, однако на восточном склоне доля этого вида низка (рис. 3). Вероятно, по этой причине наблюдается снижение ее в урбоценозах по сравнению с Европейской частью ареала.
Особый интерес представляет изучение паразитоценозов амфибий в период завершения метаморфоза (рис. 5). На природных территориях восточного склона Среднего Урала у особей Rana arvalis на 52–53-ей стадиях развития отмечены два вида трематод – Holostephanus volgensis и Dolichosaccus rastellus. Зараженность метацеркариями Holostephanus volgensis существенно выше, чем в урбоценозе. К завершению метаморфоза амфибии заселяются трематодой Diplodiscus subclavatus и нематодами Oswaldocruzia filiformis, Cosmocerca ornata, Neoraillietnema praeputiale и Rhabdias bufonis, инвазированность которыми низка (табл. 5). По завершению метаморфоза, гельминтоценозы R. arvalis природных экосистем характеризуются бо́льшим разнообразием нематод, чем на предыдущих стадиях.
Рис. 5.
Соотношение видов паразитов у Rаna arvalis на разных стадиях развития из природных популяций Среднего Урала и урбоценоза.

Таблица 5.
Видовой состав и показатели инвазированности паразитами R. arvalis на разных стадиях онтогенеза в градиенте урбанизации
| Виды | Селитебная часть города (n = 642) |
Лесопарковая зона (n = 643) |
Природные экосистемы (n = 242) |
|||
|---|---|---|---|---|---|---|
| 52–53-я стадия (n = 159) |
54-я стадия (n = 483) |
52–53-я стадия (n = 171) |
54-я стадия (n = 472) |
52–53-я стадия (n = 65) |
54-я стадия (n = 177) |
|
| Тип Platyhelminthes Claus, 1887 | ||||||
| Класс Trematoda Rudolphi, 1808 | $\frac{{42.76}}{{7.35}}$ | $\frac{{{{{44.09}}^{{d,е}}}}}{{{{{13.13}}^{{d,е}}}}}$ | $\frac{{{{{50.29}}^{b}}}}{{{{{15.63}}^{b}}}}$ | $\frac{{33.68}}{{6.73}}$ | $\frac{{{{{82.08}}^{{b,c,d}}}}}{{{{{31.17}}^{{b,c,d}}}}}$ | $\frac{{14.44}}{{2.29}}$ |
| Dolichosaccus rastellus (Olsson, 1876) | $\frac{{{{{8.17}}^{d}}}}{{0.22}}$ | $\frac{{{{{24.22}}^{{a,d}}}}}{{{{{1.81}}^{{a,d,е}}}}}$ | $\frac{{1.16}}{{0.02}}$ | $\frac{{3.81}}{{0.11}}$ | $\frac{{1.49}}{{0.04}}$ | $\frac{{1.66}}{{0.02}}$ |
| Opisthioglyphe ranae (Frölich, 1791) | $\frac{{{{{7.54}}^{b}}}}{{{{{0.20}}^{b}}}}$ | $\frac{{2.7}}{{0.05}}$ | – | – | – | – |
| Haplometra cylindracea (Zeder, 1800) | $\frac{{2.51}}{{0.03}}$ | $\frac{{0.62}}{{0.006}}$ | – | $\frac{{2.54}}{{{{{0.31}}^{c}}}}$ | – | – |
| Echinoparyphium recurvatum (Linstow, 1873), mtc. | – | $\frac{{1.24}}{{0.06}}$ | $\frac{{4.09}}{{0.30}}$ | $\frac{{{{{3.81}}^{c}}}}{{{{{0.32}}^{c}}}}$ | – | – |
| Diplodiscus subclavatus (Goeze, 1782) | – | $\frac{{0.20}}{{0.002}}$ | – | – | – | – |
| Holostephanus volgensis (Sudarikov, 1962), mtc. | $\frac{{30.18}}{{6.89}}$ | $\frac{{23.18}}{{{{{11.18}}^{{d,е}}}}}$ | $\frac{{{{{47.95}}^{c}}}}{{{{{15.30}}^{b}}}}$ | $\frac{{26.05}}{{5.97}}$ | $\frac{{{{{82.08}}^{{b,c,d}}}}}{{{{{31.13}}^{{b,c,d}}}}}$ | $\frac{{13.33}}{{2.26}}$ |
| Тип Nematoda Cobb, 1932 | ||||||
| Класс Chromadorea Inglis, 1983 | $\frac{{0.62}}{{0.006}}$ | $\frac{{{{{7.24}}^{а}}}}{{0.18}}$ | – | $\frac{{{{{9.74}}^{c}}}}{{{{{0.40}}^{{c,е}}}}}$ | – | $\frac{{{{{12.77}}^{c}}}}{{0.23}}$ |
| Oswaldocruzia filiformis (Goeze, 1782) | $\frac{{0.62}}{{0.006}}$ | $\frac{{{{{6.83}}^{а}}}}{{0.17}}$ | – | $\frac{{6.56}}{{{{{0.22}}^{{c,е}}}}}$ | – | $\frac{{6.66}}{{0.10}}$ |
| Cosmocerca ornata (Dujardin, 1845) | – | – | – | $\frac{{4.02}}{{0.07}}$ | – | $\frac{{{{{5.55}}^{d}}}}{{0.11}}$ |
| Neoraillietnema praeputiale (Skrjabin, 1916) | – | – | – | – | – | $\frac{{0.55}}{{0.01}}$ |
| Rhabdias bufonis (Schrank, 1788) | – | $\frac{{0.62}}{{0.01}}$ | – | $\frac{{{{{2.54}}^{c}}}}{{0.10}}$ | – | $\frac{{0.55}}{{0.005}}$ |
| Всего видов | 5 | 8 | 3 | 7 | 2 | 6 |
Примечание. Над чертой – ЭИ, в %; под чертой – ИО, экз./особь хозяина. Остальные обозначения, как в табл. 4. Значимые различия внутри каждой зоны: a – c 53-й стадией; b – с 54-й стадией; значимые различия внутри каждой стадии развития: c – с селитебной территорией; d – с лесопарковой зоной; е – с природными экосистемами.
На 52-й, 53-й стадиях развития наиболее богат паразитоценоз R. arvalis селитебной территории, где присутствуют четыре вида трематод и нематода Oswaldocruzia filiformis. К 54-й стадии развития видовое богатство увеличивается до восьми видов гельминтов. На урбанизированной территории у амфибий, завершающих метаморфоз, не найдены кишечные нематоды Cosmocerca ornata и Neoraillietnema praeputiale, сокращается доля Opisthioglyphe ranae. Только на селитебной территории после завершения метаморфоза зарегистрирована трематода Diplodiscus subclavatus. И в урбоценозах, и на природных территориях у амфибий, завершивших метаморфоз, отмечена нематода Rhabdias bufonis (табл. 5, рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Паразитоценозы остромордых лягушек исследуемых территорий характеризуется как общими, так и специфическими чертами. Трематод, отмеченных у R. arvalis Среднего, Южного Урала и Зауралья, у животных Полярного Урала не обнаружено, что может быть связано с ограниченным размером выборки, но, вероятнее, – с экстремальными условиями среды. Известно, что в природных экосистемах передача паразитов регулируется температурными условиями окружающей среды (Marcogliese, 2001; Morley, Lewis, 2013), в ряде регионов с арктическим климатом паразитоценозы отсутствуют или обеднены трематодами (Galaktionov, 2017).
Видовое богатство трематод и ЭИ выше в Зауралье. Возможно, это обусловлено спецификой местообитаний – открытые лесостепные пространства с обилием хорошо прогреваемых озер, широким распространением и высокой численностью промежуточных и дефинитивных хозяев (моллюсков, водных и околоводных птиц с богатыми трофическими связями). Нерестовые водоемы Зауралья высокоминерализованы (табл. 2), по сравнению со Средним и Южным Уралом. Высокая инсоляция (Titi et al., 2014) и минерализация (Vershinin et al., 2015) способствуют нарастанию биомассы водорослей, увеличению численности промежуточных хозяев и обилию продуцируемых ими церкарий.
Отсутствие нематоды Aplectana acuminata (табл. 4) в популяциях R. arvalis Южного Урала, присутствующей на Среднем Урале, вероятно, связано с небольшим объемом выборки, поскольку она известна для данного вида в Башкирии (Юмагулова, 2000).
Более высокая инвазированность нематодами на западном склоне Среднего Урала, по сравнению с восточным, определяется различиями в температурном режиме и количестве осадков, влияющих на реализацию жизненного цикла нематод и трематод. Выявленные нематоды западного и восточного макросклонов Среднего Урала, относятся к геогельминтам, яйца и личинки которых созревают в почве при достаточном увлажнении (Barton, 1998) и соответствующей температуре (Griffin, 1988). Высокий уровень осадков на западном склоне Среднего Урала, вероятно, обусловливает большую зараженность животных нематодами, по сравнению с восточным склоном. С запада на восток значимо уменьшаются ИО и ЭИ Rhabdias bufonis и Oswaldocruzia filiformis и снижается зараженность амфибий кишечной нематодой Cosmocerca ornata.
Особенность восточного склона Среднего Урала – высокая инвазированность остромордой лягушки Holostephanus volgensis, что и определяет значительную зараженность трематодами в популяциях R. arvalis на этой территории. В других регионах Holostephanus volgensis известен у Pelophylax ridibundus (Pallas, 1771) (Индирякова, 2011; Чихляев и др., 2012). Предполагаемым дефинитивным хозяином Holostephanus volgensis вероятно является серая ворона Corvus cornix (L., 1758), в больших количествах присутствующая в антропоценозах Среднего Урала (Ляхов, 2012), в том числе и вблизи нерестовых водоемов R. arvalis. Миграционные пути серой вороны (Рыжановский, 2019) делают занос трематоды Holostephanus volgensis на территорию Среднего Урала весьма вероятным. Максимальная инвазированность R. arvalis метацеркариями Holostephanus volgensis в урбоценозе может быть связана с высокой численностью ее промежуточного хозяина – моллюска Bithinia tentaculata (L., 1758), доминирующего вида в городских водоемах (Филиппенко, 2011; Ромашкова, 2015; Суворова, Шмакова, 2016).
Наличие трематод Opisthioglyphe ranae, Echinoparyphium recurvatum, mtc., Diplodiscus subclavatus и увеличение инвазированности и доли Dolichosaccus rastellus у амфибий селитебной зоны связано с аккумулирующим характером урбанизированных экосистем, увеличением минерализации и повышением температуры нерестовых водоемов, увеличением численности промежуточных хозяев (гастропод, насекомых) и обилием продуцируемых ими церкарий (Vershinin et al., 2015; Вершинин и др., 2017). Промежуточными хозяевами Diplodiscus subclavatus служат моллюски родов Planorbis Müller, 1774 (Рыжиков и др., 1980), а также Anisus Studer, 1820 и Viviparus Montfort, 1810, преобладающие в городских водоемах (Мингазова и др., 2008).
Таким образом, на территории города у R. arvalis растет доля трематод и снижается доля нематод, появляются редко встречающиеся виды паразитов, не отмеченные в природных популяциях, т.е. отмечается тенденция к “поюжнению” по данным показателям. Данный тренд заметен и во временном градиенте при завершении метаморфоза.
Rаnа arvalis городских и природных территорий на 52–53-й стадии развития заселена метацеркарными формами трематод. Ранняя зараженность трематодами и их высокое видовое богатство у амфибий на селитебных территориях связаны с экологическими особенностями нерестовых водоемов. Зараженность метацеркариями Holostephanus volgensis к 54-й стадии развития снижается повсеместно вследствие смертности наиболее инвазированных особей (Вершинин и др., 2017). Высокая доля сеголетков (30.4%), приступающих к питанию до завершения метаморфоза (Вершинин, 1995), в селитебной части города приводит к раннему заселению их почвенными формами нематод. К 54-й стадии R. arvalis природных территорий характеризуется максимальной зараженностью и видовым богатством, сокращающихся с ростом степени урбанизации вследствие глубокой трансформации почв городских территорий.
Выводы. У R. arvalis на исследуемых территориях выявлено 12 видов паразитов, относящихся к типам Platyhelminthes (6) и Nematoda (6). Наблюдаемое в средовых градиентах изменение структуры паразитоценозов популяций R. arvalis обусловлено различиями в биологии групп паразитов и микробиотопическими особенностями местообитаний хозяев. Особенность паразитарных комплексов R. arvalis – высокая инвазированность животных восточного склона Среднего Урала метацеркариями трематоды Holostephanus volgensis. В урбоценозах Среднего Урала у R. arvalis происходит обеднение видового состава паразитов, увеличивается доля трематод, появляются редко встречающиеся виды паразитов. Это обусловлено спецификой городских местообитаний: повышением температуры и изменением химизма нерестовых водоемов. В начальный период наземной жизни R. arvalis у животных, завершающих метаморфическую перестройку, заселение паразитами гостальных биотопов определяется расширением спектра пищевых объектов, связанным с увеличением радиуса пищевой активности и продолжающимся ростом сеголетков. При продвижении с севера на юг показатели зараженности увеличиваются, что обусловлено увеличением теплообеспеченности, ростом биоразнообразия промежуточных и дефинитивных хозяев. В направлении с запада на восток повышаются показатели зараженности трематодами. В отношении нематод наблюдается обратная тенденция, что связано со снижением влагообеспеченности восточного склона – различия в гидротермическом коэффициенте между западным (1.5–1.6) и восточным (1.26) склонами Урала, означающем рост континентальности климата.
Список литературы
Балданова Д.Р., Щепина Н.А., Дугаров Ж.Н. 2010. Паразитофауна бесхвостых амфибий Забайкалья и ее зависимость от экологических условий // Экологические последствия биосферных процессов в экотонной зоне Южной Сибири и Центральной Азии: Труды Международной конференции. Т. 2. Улан-Батор: Бэмби сан. С. 160.
Бреев К.А. 1976. Применение математических методов в паразитологии // Проблемы изучения паразитов и болезней рыб. Ленинград: Наука. С. 109.
Буракова А.В. 2012. Экологический анализ гельминтофауны популяций остромордой лягушки (Rana arvalis Nilsson, 1842) в градиенте урбанизации: Автореф. дис. … канд. биол. наук. Пермь.
Буракова А.В., Вершинин В.Л. 2016. Анализ паразитофауны синтопически обитающих представителей бесхвостых амфибий // Вестн. Санкт-Петербург. ун-та. Сер. 3. Биология. Вып. 3. С. 31. https://doi.org/10.21638/11701/spbu03.2016.306
Вершинин В.Л. 1995. Динамика питания сеголеток бурых лягушек в период завершения метаморфоза // Экология. № 1. С. 68.
Вершинин В.Л., Буракова А.В., Вершинина С.Д. 2017. Сравнительный анализ паразитоценозов амфибий сем. Ranidae (Anura) в градиенте урбанизации // Экология. № 5. С. 385.https://doi.org/10.7868/S0367059717050080
Вершинин В.Л., Вершинина С.Д., Трофимов А.Г., Буракова А.В. 2018. Морфологические аномалии Rana arvalis Nilsson, 1842 урбанизированной территории Заполярья // Экология. № 3. С. 239.https://doi.org/10.7868/S0367059718030101
Голикова М.Н. 1960. Эколого-паразитологическое изучение биоценоза некоторых озер Калининградской области // Паразитология. Т. 39. Вып. 7. С. 984.
Дабагян Н.В., Слепцова Л.А. 1975. Травяная лягушка Rana temporaria L. // Объекты биологии развития. Москва: Наука. С. 442.
Даниловский Г.А. 1997. Характеристика класса земноводных и их паразитофауна на территории Челябинской области // Челябинский государственный педагогический университет. Челябинск. Деп. в ВИНИТИ 19.06.1997, № 2039-B97.
Дьяченко А.П. 1997. Флора листостебельных мхов Урала. Екатеринбург: Урал. Ч. 1.
Жигилева О.Н., Кирина И.Ю. 2015. Зараженность гельминтами остромордой (Rana arvalis Nilsson, 1842) и сибирской (Rana amurensis Boultnger, 1886) лягушек в Западной Сибири // Сиб. экол. журн. Т. 22. № 2. С. 287.
Зарипова Ф.Ф., Байрамгулова Г.Р., Юмагулова Г.Р. и др. 2008. Гельминтофауна амфибий в условиях Башкирского Зауралья // Вестник Оренбургского государственного университета. № 12. С. 86.
Зарипова Ф.Ф., Файзулин А.И., Михайлов Р.А. 2018. К фауне гельминтов бесхвостых земноводных Южного Урала // Известия Самарского научного центра РАН. Т. 20. № 5–4. С. 559.
Золотаренко Г.С., Соусь С.М. 1976. Кормовые связи и эндопаразиты остромордой лягушки (Rana terrestris Andr.) в Северной Кулунде // Охрана и преобразование природы лесостепи Западной Сибири. Новосибирск: Наука. С. 242.
Ибрагимова Д.В., Стариков В.П. 2013. Амфибии в экосистемах города Сургута: проблема оптимизации городской среды. Сургут: Библиография.
Ибрагимова Д.В., Наконечный Н.В. 2017. Сравнительный анализ зараженности гельминтами Rana arvalis Nilss, 1842 Среднего Приобья // Вестник Нижневартовского государственного университета. № 1. С. 49.
Ивашкин В.М., Контримавичус В.М., Назарова Н.С. 1971. Методы сбора и изучения гельминтов наземных позвоночных млекопитающих. Москва: Наука.
Индирякова Т.А. 2011. Сравнительная характеристика гельминтофауны водных экосистем на территории Ульяновской области // Вестник Ульяновской государственной сельскохозяйственной академии. № 1. С. 70.
Кириллов А.А. 2011. Сообщества гельминтов обыкновенного ужа Natrix natrix L. (Reptilia: Colubridae) юга Северного Поволжья // Известия Самарского научного центра РАН. Т. 13. № 1. С. 127.
Кириллов А.А., Кириллова Н.Ю. 2016. Анализ репродуктивной гемипопуляции Cosmocerca ornata (Dujardin, 1845) (Nematoda: Cosmocercidae) в озерных лягушках разного возраста // Биология внутр. вод. № 3. С. 93.https://doi.org/10.7868/S0320965216030074
Кириллова Н.Ю., Кириллов А.А. 2021. Жизненный цикл паразита амфибий нематоды Cosmocerca ornata (Nematoda: Cosmocercidae) // Биология внутр. вод. № 3. С. 286.https://doi.org/10.31857/S0320965221020078
Кривцов В.А., Водорезов А.В. 2016. Физическая география и ландшафты России. Рязань: Гос. ун-т.
Кувшинова К.В. 1968. Климат // Урал и Приуралье: природные условия и естественные ресурсы СССР. Москва: Наука.
Кузьмин С.Л. 1999. Земноводные бывшего СССР. Москва: Товарищество науч. изданий КМК.
Куранова В.Н. 1988. Гельминтофауна бесхвостых амфибий Поймы Оби, ее половозрастная и сезонная динамика // Вопр. экол. беспозвоночных. Томск: Изд-во Томск. ун-та.
Ляхов А.Г. 2012. Врановые птицы Екатеринбурга // Материалы к распространению птиц на Урале, в Приуралье и Западной Сибири // Региональный авифаун. журн. Вып. 17. С. 98.
Мильков Ф.Н., Гвоздецкий Н.А. 1976. Физическая география СССР. Москва: Мысль.
Мингазова Н.М., Деревенская О.Ю., Палагушкина О.В. и др. 2008. Биоразнообразие водных объектов г. Казани // Ученые записки Казанского гос. ун-та. Естественные науки. Т. 150. Кн. 4. С. 252.
Радченко Н.М., Шабунов А.А. 2008. Эколого-гельминтологические исследования амфибий в Вологодской области // Паразитология в XXI веке – проблемы, методы, решения: Матер. IV съезда Паразитол. о-ва при РАН. Санкт-Петербург: Лема. Т. 3. С. 72.
Ромашкова Ю.А. 2015. Малые озера урбанизированных территорий г. Тольятти: таксономический состав, структура донных сообществ // Самарская Лука: проб. регион. и глоб. экол. Т. 24. № 4.
Рыжановский В.Н. 2019. Фенология сезонных явлений и территориальное распределение серой вороны (Corvus cornix) из Нижнего Приобья // Экология. № 1. С. 72. https://doi.org/10.1134/S0367059718060100
Рыжиков К.М., Шарпило В.П., Шевченко Н.Н. 1980. Гельминты амфибий фауны СССР. Москва: Наука.
Суворова А.А., Шмакова Е.В. 2016. О фауне пресноводных брюхоногих моллюсков города Ульяновска // В мире научных открытий: Матер. V Всерос. студ. науч. конф. Ульяновск: УГСХА. Т. 6. Ч. 2. С. 297.
Судариков В.Е., Шигин А.А., Курочкин Ю.В. и др. 2002. Метацеркарии трематод – паразиты пресноводных гидробионтов Центральной России. Т. 1. Москва: Наука.
Филиппенко Д.П. 2011. Видовой состав биотопические группы брюхоногих моллюсков прудовых водоемов Калининграда // Вестник Росс. гос. ун-та им. И. Канта. Вып. 1. С. 55.
Чикишев А.Г. 1966. Физико-географическое районирование Урала // Проблемы физической географии Урала. М.: Изд-во Мос. ун-та. С. 7.
Чихляев И.В., Кириллов А.А., Кириллова Н.Ю. 2012. Трематоды (Trematoda) земноводных (Amphibia) Среднего Поволжья. 1. Отряды Fasciolida, Hemiurida, Paramphistomida и Strigeida // Паразитология. Т. 46. № 3. С. 171.
Чихляев И.В., Ручин А.Б., Файзулин А.И. 2015. Гельминты бесхвостых земноводных (Amphibia, Anura) Мордовского заповедника // Тр. Мордовского гос. природ. заповедника. Вып. 14. С. 376.
Чихляев И.В., Файзулин А.И. 2016. Материалы к гельминтофауне съедобной лягушки Pelophylax esculentus (Linnaeus, 1758) в Волжском бассейне // Вестн. Санкт-Петербург. ун-та. Сер. 3. Биология. Вып. 3. С. 175. https://doi.org/10.21638/11701/spbu03.2016.329
Юмагулова Г.Р. 2000. Гельминты амфибий Южного Урала: Автореф. дис. … канд. биол. наук. Уфа.
Щепина Н.А., Борисова Н.Г., Балданова Д.Р. и др. 2009. Земноводные Бурятии. Улан-Удэ: Изд-во Бурят. науч. центра СО РАН.
Barton D.P. 1998. Dynamics of natural infections of Rhabdias cf. hylae (Nematoda) in Bufo marinus (Amphibia) in Australia // Parasitology. V. 117. P. 505. https://doi.org/10.1017/s0031182098003199
Chikhlyaev I.V., Ruchin A.B. 2021. An overview of the helminths of moor frog Rana arvalis Nilsson, 1842 (Amphibia: Anura) in the Volga basin // Diversity. V. 13. № 2. Atr. 61. P. 1. https://doi.org/10.3390/d13020061
Galaktionov K.V. 2017. Patterns and processes influencing helminth parasites of Arctic coastal communities during climate change // J. Helminthol. V. 91. № 04. P. 387. https://doi.org/10.1017/s0022149x17000232
Griffin C.T. 1988. The effect of constant and changing temperatures on the development of the eggs and larvae Oswaldocruzia filiformis (Nematoda: Trichostrongyloidea) // J. Helminthology. V. 62. № 4. P. 281.
Marcogliese D.J. 2001. Implications of climate change for parasitism of animals in the aquatic environment // Can. J. Zoology. V. 79. №. 8. P. 1331. https://doi.org/10.1139/cjz-79-8-1331
Morley N.J., Lewis J.W. 2013. Thermodynamics of cercarial development and emergence in trematodes // Parasitology. V. 140. P. 1211.
Titi A., Rondelaud D., Mekroud A. et al. 2014. Natural light influences cercarial emergence of Calicophoron daubneyi but not that of Haplometra cylindracea from temperature-challenged Galba truncatula // Parasitol Res. V. 113. № 10. P. 3557. https://doi.org/10.1007/s00436-014-4021-7
Vershinin V.L., Vershinina S.D., Berzin D.L. et al. 2015. Longterm observation of amphibian populations inhabiting urban and forested areas in Yekaterinburg, Russia // Scientific Data [Electronic resource]. P. 1.https://doi.org/10.1038/sdata.2015.18
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


