Биология внутренних вод, 2022, № 5, стр. 586-594
Влияние аналогов кортизола на показатели вторичного гемостаза карпа Cyprinus carpio
Д. И. Березина a, *, Л. Л. Фомина a
a Вологодская государственная молочнохозяйственная академия им. Н.В. Верещагина
Вологда, Россия
* E-mail: vetxwork@gmail.com
Поступила в редакцию 01.09.2021
После доработки 19.01.2022
Принята к публикации 11.02.2022
- EDN: TXONDT
- DOI: 10.31857/S0320965222050047
Аннотация
Получены данные по динамике коагулограммы карпа (Cyprinus carpio L.), а также стресс-маркеров под влиянием синтетических аналогов кортизола короткого и пролонгированного действия в течение 21 сут. Проведен сравнительный анализ изменения этих показателей у экспериментальных групп и у интактных рыб. Выявлено, что свертывающая способность крови за счет некоторых плазменных факторов усилилась в ходе эксперимента у всех животных, участвующих в опыте, хотя кривая этих изменений в группах различалась. Отмечено ускорение активированного частичного тромбопластинового времени (АЧТВ), протромбинового времени и повышение концентрации фибриногена в крови рыб. При этом характер изменений содержания растворимых фибрин-мономерных комплексов, а также антитромбина III, указывает на развитие гипокоагуляционных процессов у рыб отдельных групп. Кортизоловый ответ у обработанных гормонами животных был противоречивый. Высказаны предположения о факторах влияния на динамику показателей, отмеченных не только у экспериментальных, но и у контрольных рыб. Статистический анализ выявил корреляционные связи между кортизолом и отдельными параметрами гемостаза.
ВВЕДЕНИЕ
В природе, а в значительной мере в искусственном рыбоводстве промысловая рыба подвергается различным воздействиям стрессовых условий. Стресс-реакции у рыб вызывают в основном катехоламины и кортизол, которые действуют в течение двух различных, но пересекающихся отрезков времени (Смит, 1986; Schreck, Tort, 2016). Регулируется кортикальный ответ у костистых рыб гипоталамо-гипофизарно-интерренальной осью (Donaldson, 1981). Количественная характеристика этого ответа, в частности кортизолового, у рыб достаточно хорошо изучена. Существует обширная база данных, касающихся влияния различных видов стресса на промысловых и диких рыб, в большинстве из которых экспериментально зафиксировано изменение концентрации эндогенного кортизола и глюкозы в плазме крови. Так, исследовано влияние различных стрессовых стимулов: загрязнителей (Романенко и др., 2010), транспортировки (Dobšíková et al., 2009), плотности посадки (Ruane et al., 2002; Ruane, Komen, 2003; Ramsay et al., 2006), облова (Ruane et al., 2001), голода (White, Fletcher, 1986), гипоксии (Причепа, 2015; Березина, 2017), температуры (Basu et al., 2001) и др. (Barry et al., 1993; Barcellos et al., 1999). Многие из авторов отмечают этот кортикостероид как чувствительный индикатор различных нарушений в окружающей среде, а его содержание в органах и тканях можно применять при проведении биомониторинга условий. В рыбоводной практике имеет место как кратковременное, так и многократное и длительное воздействие какого-либо фактора или нескольких стресс-факторов одновременно. Поэтому изучение физиологического состояния рыбы в таких условиях имеет определенное практическое значение.
Стрессовая реакция у рыб сопровождается изменением функционального состояния защитных систем организма и отражается, в первую очередь, на гематологических и иммунологических показателях. Влияние экзогенного кортизола на физиологию крови рыб исследователи изучали неоднократно, применяя его аналоги – гидрокортизон, дексаметазон-фосфат и др. – (Микряков, 2004; Микряков и др., 2007a, 2007б; Балабанова и др., 2009), кортизол, не уточняя природу его происхождения (Pickering, Pottinger, 1989; Espelid et al., 1996; Vijayan et al., 1997) и синтетические кортикостероиды (Roth, 1972; Houghton, Matthews, 1986) для индуцирования стресса. В основном это работы, направленные на изучение иммуннологической функции крови рыб, в них в той или иной мере отмечали супрессивное влияние таких гормональных обработок.
Важный момент, подчеркивающий практическую составляющую подобных исследований, – факт самопроизвольного образования тромбов, описанный у ханоса Chanos chanos (Forsskål, 1775) полосатого тунца Katsuwonus pelamis L., желтоперого тунца Thunnus albacares (Bonnaterre, 1788) и кефали Mugil cephalus (Smith, 1980). Также нередки случаи неожиданной гибели рыб в аквакультуре через несколько суток после травматических манипуляций, например сортировки. Возможно, это происходит в результате травмы, способной вызвать спонтанный тромбоз. В связи с этим система гемостаза представляет большой интерес.
Система гемостаза – физиологический механизм, который, с одной стороны, предотвращает кровопотерю, образуя сгусток и закупоривая сосуды, с другой, – препятствует образованию нежелательных тромбов. Основные черты этого процесса подробно изучаются у высших животных и человека, но значительно менее исследованы у низших животных. Различают три компонента (звена) системы гемостаза: сосудистый, клеточный и коагуляционный. Сосудистый компонент включает сужение стенки сосудов и активацию следующих компонентов. Клеточный компонент (первичный или тромбоцитарный гемостаз) представлен в основном тромбоцитами и лейкоцитами, однако исследование агрегационной способности ядерных тромбоцитов у низших позвоночных затруднительно. Коагуляционный компонент системы гемостаза (вторичный или плазменно-коагуляционный гемостаз) – комплекс факторов системы свертывания крови. Процесс свертывания происходит в виде многоступенчатых каскадов последовательных реакций плазменных белков (рис. 1). Антигемостатические механизмы поддерживаются за счет тромборезистентности стенки сосудов, комплекса антигемостатических факторов форменных элементов, факторов системы фибринолиза, а также ингибиторов коагуляции (Тюкавин и др., 2021).
Рис. 1.
Схема взаимодействия факторов свертывания при активации гемокоагуляции по: (Тюкавин и др., 2021). Римскими цифрами обозначены факторы свертывания крови. TFPI – ингибитор тканевого фактора.
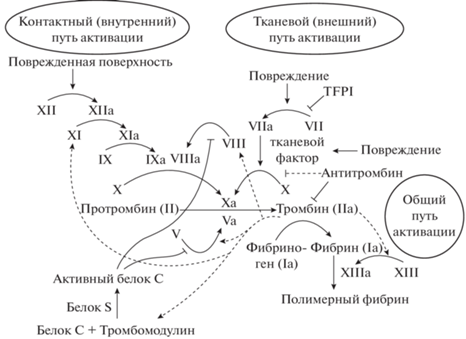
Основным процессом плазменного гемостаза у всех позвоночных является тромбин-катализируемое превращение растворимого в плазме белка фибриногена в нерастворимый фибриновый сгусток. Внешний путь свертывания крови имеет преобладающее значение для рыб (Doolittle, Surgenor, 1962; Tavares-Dias, Oliveira, 2009).
Работы по влиянию экзогенного кортизола и его аналогов на коагуляционные процессы у рыб в доступных литературных источниках отсутствуют, однако, исследование данного вопроса важно для понимания механизма повреждающего действия неблагоприятных факторов, в том числе гормон-индуцируемого стресса на состояние здоровья и свертывающую функцию плазмы крови этих гидробионтов.
Цель работы – оценить воздействие синтетических аналогов кортизола на функционирование плазменно-коагуляционного звена системы гемостаза рыб, а также проследить динамику уровня стресс-маркеров (эндогенного кортизола и глюкозы).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проводили в центре развития аквакультуры “АкваБиоЦентр” Вологодской государственной молочно-хозяйственной академии им. Н. В. Верещагина в весенний период (март–апрель) 2020 г. В эксперименте использовали двухгодовалых чешуйчатых карпов Cyprinus carpio L. массой 800–1000 г (без половой идентификации), выращенных в рыбоводном хозяйстве “Диана” (пос. Кадуй Вологодской обл.). Рыб предварительно разделяли на три группы (по n = 8 в каждой): контрольные рыбы с имитацией острого стресса (1‑я экспериментальная группа), с имитацией хронического стресса (2-я экспериментальная группа).
Для имитации острого стресса использовали парентеральные инъекции дексаметазона (4 мг/мл) (Эллара, Россия) в дозе 0.2 мл или 0.8 мг активного вещества дексаметазон-фосфата на особь (Балабанова и др., 2009), который у млекопитающих метаболизируется в течение 4 ч. В качестве глюкокортикоида, имитирующего хронический стресс, применяли суспензию дипроспана (Schering-Plough Labo N.V., Бельгия) по 0.5 мл на особь, что соответствует 3.5 мг активного вещества бетаметазона, период выведения которого у млекопитающих >10 сут. Использование такой дозировки фармакологического препарата обусловлено эмпирически и не подкреплено данными каких-либо подобных исследований. Обычно в исследованиях применяют масляную эмульсию и внутрибрюшинное введение вещества рыбе, воздействие этого гормона отмечают в течение 24 ч при дозировке 0.1 мг/кг (Swift, 1982). Используемые в работе синтетические гормоны обладали аналогичным кортикостероидам эффектом (Mazeaud et al., 1977; Gamperl et al., 1994). Контрольная группа оставалась интактной (без инъекции).
Рыб содержали в экспериментальной установке, состоящей из трех аквариумов, соединенных между собой системой труб, обеспечивающих непрерывную циркуляцию воды между всеми аквариумами и фильтром. Очистка воды включала механический и биологический компоненты, аэрацию и температурный режимы обеспечивали для каждого аквариума индивидуально. Температура воды была 18–20°C, режим кормления – 1 раз в сутки (за 4 ч до забора крови) кормом для прудовых рыб “Гран-при 2” (Зоомир, Россия). До взятия крови рыб анестезировали, добавляя в воду гвоздичное масло в дозе 0.033 мл/л (Hamackova et al., 2006) и выдерживая в ней 15 мин. Для забора крови проводили пункцию из хвостовой вены у рыб всех трех групп: через 24 ч после прибытия из рыбного хозяйства, спустя 7, 14 и 21 сут после обработки препаратами (Балабанова и др., 2009). При каждом взятии отбирали по 8.0 мл крови.
Для определения показателей плазменно-коагуляционного гемостаза рыб использовали коагулометр “Thrombostat” (Behnk Elektronik, Германия) и медицинские наборы для исследования коагулограммы (табл. 1): “Тромбо-тест”, “Техпластин-тест”, “АПТВ-тест”, “РФМК-тест планшетный вариант”, “Хромотех-Антитромбин” (ООО Технология-Стандарт, Россия) и уровень фибриногена (НПО РЕНАМ, Россия). Все исследования проводились в соответствии с инструкциями к реагентам.
Таблица 1.
Характеристика показателей плазменно-коагуляционного гемостаза
| Показатель | Характеристика |
|---|---|
| АЧТВ, сек | Характеризует первую фазу свертывания крови, является показателем измерения эффективности внутреннего (контактного) пути свертывания крови, активности I, II, V, VIII, IX, X , XI и XII факторов свертывания при добавлении активатора |
| ПТВ, сек | Характеризует 1-ю и 2-ю фазы свертывания крови, показатель измерения эффективности внешнего (тканевого) пути свертывания крови, факторов свертывания I, II, V, VII и X при добавлении тканевого фактора |
| ТВ, сек | Характеризует 3-ю фазу свертывания крови, показатель измерения эффективности общего пути свертывания, отражает скорость превращения фибриногена в фибрин |
| Фибриноген, г/л | Белок, растворенный в плазме крови. Характеризует 3-ю фазу свертывания крови, напрямую обеспечивает образование сгустка |
| РФМК, мг/100 мл | Промежуточные продукты фибринолиза сгустка, показатель измерения эффективности фибринолиза |
| АТ III, % | Белок. Ингибитор коагуляции является показателем оценки активности факторов свертывания крови |
Примечание. Здесь и в табл. 3: АЧТВ – активированное частичное тромбопластиновое время; ПТВ – протромбиновое время; ТВ – тромбиновое время; РФМК – растворимые фибрен-мономерные комплексы; АТ III – антитромбин.
Количественный анализ стресс-маркеров в сыворотке крови проводили по уровню кортизола и содержанию глюкозы. Уровень кортизола определяли методом твердофазного хемилюминесцентного иммуноанализа в лаборатории ООО “Центр лабораторных исследований”; содержание глюкозы – используя медицинские наборы (ООО Ольвекс-Диагностикум, Россия) на полуавтоматическом биохимическом анализаторе “БИАЛАБ-100” (Россия).
Значения полученных результатов в работе представлены в виде средней величины и стандартной ошибки средней (M ± m). Достоверность различий показателей коагулограммы карпов для множественных независимых выборок определяли с помощью критерия Кроскелла–Уоллеса, для парных зависимых выборок использовали критерий Вилкоксона. Результаты исследования со значением вероятности допущения альфа-ошибки ≤5% (р < 0.05), расценивали как статистически значимые. Различие двух показателей считали достоверным, если оно равнялось или превышало свою среднюю ошибку разности в ≥2 раз (Шихова, 2016).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка стресс-реакции. В результате проведенного нами исследования с модуляцией стресса получили данные, представленные в табл. 2.
Таблица 2.
Количественные значения стресс-маркеров у карпов в ходе эксперимента
| t, сут | Группа рыб | Кортизол, нг/мл | Глюкоза, ммоль/л |
|---|---|---|---|
| 0 | (а) Контроль | 376.25 ± 44.04 | 4.56 ± 0.32 |
| (б) 1-я экспериментальная | 346.25 ± 43.16 | 5.20 ± 0.56 | |
| (в) 2-я экспериментальная | 353.68 ± 66.39 | 4.83 ± 0.57 | |
| 7 | (г) Контроль | 366.75 ± 42.82 | 3.90 ± 0.30а |
| (д) 1-я экспериментальная | 242.25 ± 58.49б | 4.89 ± 0.16б | |
| (е) 2-я экспериментальная | 5.25 ± 1.49г, д, в | 8.00 ± 0.42г, д | |
| 14 | (ж) Контроль | 335.33 ± 8.57 | 4.79 ± 0.34г |
| (з) 1-я экспериментальная | 388.25 ± 37.51д | 4.61 ± 0.38б, д | |
| (и) 2-я экспериментальная | 6.00 ± 1.08ж, з, в | 6.76 ± 0.62ж, з, в | |
| 21 | (к) Контроль | 366.00 ± 89.22 | 3.11 ± 0.30а, г, ж |
| (л) 1-я экспериментальная | 264.25 ± 21.21з, д, б | 4.34 ± 0.46д | |
| (м) 2-я экспериментальная | 7.28 ± 1.27л, м, е, в | 6.96 ± 1.00к, в |
Начальные значения стресс-маркеров животных трех исследованных групп различались между собой, хотя статистический анализ не подтвердил достоверность этих различий (табл. 2). Уровень кортизола плазмы у контрольных рыб, не получавших инъекцию гормонов, недостоверно плавно снижался к 14-м суткам и восстанавливался к 21-м суткам эксперимента, за все время его разброс был 335–376 нг/мл. У рыб, стрессированных дексаметазоном, содержание эндогенного кортизола достоверно изменялось скачкообразно и разнонаправленно. Его уровень за все время эксперимента варьировал в пределах 242–388 нг/мл. В группе рыб, подвергнувшихся инъекции гормона пролонгированного действия (бетаметазона), произошло полное достоверное ингибирование выработки эндогенного кортизола к 7-м суткам эксперимента с 353 до 5 нг/мл (на 98.5% изначального), не восстановившееся к концу опыта.
Динамика глюкозы сыворотки крови карпов отличалась от предсказываемой общеизвестной кортизол-зависимой картины, возникающей из-за стимуляции глюконеогенеза и гликогенолиза. Изменения содержания глюкозы у контрольной группы карпов имели скачкоообразный характер, в итоге приводящий к достоверному снижению от исходного уровня (на 31.8%), у группы с имитацией острого стресса, напротив, это понижение достоверно сглаженное (на 16.5%). Содержание глюкозы в крови хронически стрессированных карпов претерпевало резкий достоверный подъем (на 65.6%) и оставалось выше по сравнению с контролем на 44.1%, относительно исходного, до конца эксперимента.
Оценка коагулограммы. Результаты исследования показали, что в начале эксперимента параметры коагулограммы тестируемых различных групп животных различались между собой (табл. 3), хотя статистический анализ не подтвердил достоверность этих различий (кроме растворимых фибрин-мономерных комплексов).
Таблица 3.
Динамика параметров коагулограммы карпов в ходе эксперимента
| t, сут | Группа рыб | ТВ, сек | ПТВ, сек | АЧТВ, сек | Фибриноген, г/л | РФМК, мг/100 мл |
АТ III, % |
|---|---|---|---|---|---|---|---|
| 0 | (а) Контроль | >800 | >800 | 27.05 ± 1.06 | 0.86 ± 0.03 | 29.00 ± 0.41 | 95.54 ± 1.99 |
| (б) 1-я экспериментальная | >800 | >800 | 20.85 ± 2.63 | 0.69 ± 0.20 | 28.00 ± 0.71 | 101.38 ± 4.63 | |
| (в) 2-я экспериментальная | >800.00 | 626.93 ± 108.12 | 25.35 ± 4.93 | 0.60 ± 0.17 | 30.00 ± 0.71б | 90.57 ± 13.52 | |
| 7 | (г) Контроль | 144.9 ± 20.4а | 160.75 ± 16.45а | 8.90 ± 0.23а | 0.77 ± 0.05а | 28.50 ± 0.29 | 65.17 ± 3.91а |
| (д) 1-я экспериментальная | 128.75 ± 19.98б | 157.18 ± 18.5б | 8.13 ± 0.38б | 0.97 ± 0.01б | 29.00 ± 0.58 | 78.21 ± 2.91г, б | |
| (е) 2-я экспериментальная | 184.58 ± 39.30в | 257.10 ± 69.11д, в | 10.30 ± 0.53д, в | 1.06 ± 0.01г, в | 27.75 ± 1.31в | 76.69 ± 9.08 | |
| 14 | (ж) Контроль | 177.20 ± 27.99а | 175.10 ± 19.76а | 7.28 ± 0.24а, г | 0.85 ± 0.05г | 24.25 ± 2.25а, г | 47.66 ± 12.55а, г |
| (з) 1-я экспериментальная | 217.65 ± 35.54б, д | 139.03 ± 13.39ж, б | 6.95 ± 0.30б, д | 0.98 ± 0.02б | 23.25 ± 1.49д | 87.80 ± 2.75ж, б, д | |
| (и) 2-я экспериментальная | 107.63 ± 16.92з, ж, в, е | 129.60 ± 7.39в, е | 7.33 ± 0.13в, е | 1.17 ± 0.03ж, з, в, е | 28.00 ± 0.00з, в | 85.01 ± 4.99ж | |
| 21 | (к) Контроль | 119.70 ± 25.50а, г, ж | 110.90 ± 14.81а, г, ж | 7.98 ± 0.35а, г, ж | 0.97 ± 0.05а, г, ж | 25.50 ± 1.26а, г | 75.64 ± 10.41а |
| (л) 1-я экспериментальная | 132.23 ± 30.92б, з | 137.90 ± 26.45б | 7.58 ± 0.33б | 0.99 ± 0.02б | 24.25 ± 1.18б, д | 95.15 ± 2.83б, д | |
| (м) 2-я экспериментальная | 130.33 ± 14.39в | 134.88 ± 10.24в, е | 8.28 ± 0.52в, е, и | 1.22 ± 0.03к, л, в, е | 28.00 ± 0.00к, л, в | 107.04 ± 3.67к, е, ж, и |
Активированное частичное тромбопластиновое время у всех групп карпов изменялось синхронно и однонаправленно в сторону достоверного сокращения на 63.6–70.5% по сравнению с исходным значением.
Следует отметить сильное достоверное снижение протромбинового времени к последним суткам воздействия гормониндуцированного стресса у всех групп карпов на 78.5–86.1% по сравнению с исходным, у рыб с имитированием острого стресса оно было более резким.
Количество фибриногена в плазме крови в ходе эксперимента у карпов всех групп достоверно увеличилось (на 12.8% в контроле, 43.5% у рыб первой экспериментальной группы и в 2 раза второй группы). Кривая изменений у первой и второй экспериментальных групп рыб, обработанных гормонами, имеет схожую форму, в отличие от таковой контрольной группы. Следует отметить, что под влиянием бетаметазона повышение этого белка происходило наиболее явно.
Анализ тромбинового времени за исследованный период показал, что у всех групп карпов оно, подобно протромбиновому времени, достоверно и почти синхронно сократилось к концу эксперимента на 83.5–85.0%, относительно исходного.
Уровень антитромбина III на седьмые сутки опыта достоверно снижался: у карпов контрольной группы – более резко (на 31.8%), первой экспериментальной – более плавно (на 22.9%), второй экспериментальной – на 15.3%. Содержание антитромбина III у карпов второй экспериментальной группы в итоге превысило таковое исходного уровня на 18.2%, у других групп, наоборот, снизилось (у контрольных рыб на 20.8%, первой группы – на 6.1%). Зарегистрировано общее превышение антитромбина в плазме рыб у экспериментальных групп, по сравнению с контрольными животными в течение всех суток эксперимента.
Одинаковые достоверные колебания уровня растворимых фибринмономерных комплексов с тенденцией к их снижению относительно исходного наблюдали у рыб из всех участвующих в опыте групп: растворимые фибринмономерные комплексы контрольной и первой экспериментальной групп снизились более заметно (12.1–13.1%) по сравнению со второй экспериментальной группой (6.7%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выявленные различия между показателями в группах до начала эксперимента могут быть обусловлены меж- и внутривидовыми различиями устойчивости к стрессу (например, хэндлинг-стрессу), связанному с забором проб крови (Иванов, 2021), либо некачественно подобранными группами по методу пар-аналогов (из-за различий в возрасте, половой принадлежности, массе рыб).
Тотальное снижение уровня плазменного кортизола у рыб с имитацией хронического стресса может быть связано с медленным всасыванием бетаметазона из места введения и блокированием выработки эндогенных гормонов. Контроль уровня эндогенного кортизола при моделировании стрессовых реакций разными способами подробно рассмотрен в работе Gamperl et al. (1994). По мнению Gamperl и других авторов (Pickering et al., 1987; Pickering, Pottinger, 1989; Jerez-Cepa et al., 2019), дексаметазон и бетаметазон подавляют выработку эндогенного кортизола путем ингибирования адренокортикотропного гормона (АКТГ) при воздействии на гипоталамус и гипофиз от 80 до 100%, как это происходит и у млекопитающих. В связи с этим количественный анализ кортизола в рамках данного исследования нельзя считать достаточным и пригодным для качественной и количественной оценки физиологической реакции этих гидробионтов на стресс, хотя и представляется актуальным для изучения гипоталамо-гипофизарно-интерренального ответа на введение синтетических аналогов кортикостероидов.
Изменение уровня глюкозы у всех групп рыб могло быть вызвано влиянием катехоламинов, погрешностью режима кормления и прочими факторами.
Внутренние, внешние и общие пути свертывания крови рыб достаточно подробно были описаны ранее (Doolittle Surgenor, 1962; Lewis, 1996; Jagadeeswaran et al., 2007; Tavares-Dias, Oliveira, 2009; Фомина и др., 2015; Березина и др., 2017), включая и генетические, и экспериментальные аспекты вопроса. Исследование стресса, связанного с выработкой эндогенных гормонов, у млекопитающих – мышей (Toukh et al., 2014), кроликов (Khatun et al., 1999), человека (Palmblad et al., 1977) – показывает, что под влиянием стресс-факторов происходит усиление коагуляционной активности крови. Некоторые данные (Иванов, 2021) свидетельствуют, что стресс-факторы повышают скорость свертывания крови и у рыб, поскольку реакция адаптации к стрессу у рыб включает в себя механизм защиты организма от кровотечения. Также предполагается, что полученные межвидовые различия в свертывании крови у рыб вполне могут оказаться результатом различий устойчивости этих рыб к стрессам, поскольку вылов рыбы с целью исследования уже стресс-фактор. Согласно исследованиям (Tavares-Dias, Oliveira, 2009), отмечена активация первичного и вторичного звеньев гемостаза у стрессированных рыб, включая сокращение времени свертывания, увеличение числа тромбоцитов, снижение уровня фибриногена, быстрое сокращение времени рекальцификации плазмы, протромбинового времени и АЧТВ. Основываясь на результатах собственных исследований по воздействию острой и хронической гипоксии, отмечено гиперкоагуляционное влияние такого стресса на плазменно-коагуляционное звено гемостаза карпов (Пересторонина и др., 2019).
Гиперкоагуляционный эффект, выявленный нами в настоящем исследовании, также отмечен в экспериментах по воздействию стресса на функциональное состояние гемостаза мышей (Полиданов, 2020). В этой работе авторы отмечают стимулированное стрессом повышение концентрации фибриногена в крови, которое оказалось справедливо и для рыб, и совпадает с результатами наших прошлых исследований (Березина, Фомина, 2018). Принимая во внимание результаты анализа данных интактных рыб, описанные изменения могут быть связаны с краткосрочным стрессом, вызванным хэндлингом (даже у анестезированных рыб), достаточно сильным, чтобы вызвать гиперкоагуляцию, хотя при оценке стресс-маркеров нельзя наблюдать какой-либо стресс в контроле. Более качественную картину влияния хэндлинг-стресса может дать почасовое исследование стресс-маркеров у рыб.
Схожие для всех групп результаты могут быть обусловлены и слабым действием данной дозы синтетических аналогов кортизола, достаточной, чтобы вызвать иммуносупрессию (Балабанова и др., 2009), но недостаточной для специфического воздействия на плазменно-коагуляционное звено системы гемостаза. Настоящие предположения требуют уточнения и дальнейшего продолжения исследований в этом направлении. Необходимо учитывать, что изучение коагулограммы без применения хэндлинг-стресса, сопровождающего венепункцию, достаточно затруднительно и требует поиск более сильных анестетиков, установку системы беспрерывной кислородной циркуляции или других методик.
Известно, что растворимые фибрен-мономерные комплексы служат маркерами тромбинемии при диссеминированном внутрисосудистом свертывании у человека (Момот, Мамаев, 2008), и по сравнению с ним и большинством млекопитающих их концентрация у рыб достаточно высока (Фомина и др., 2015). Если гемокоагуляция рыб в процессе настоящего эксперимента ускорялась, можно предположить, что этот показатель должен увеличиваться, что противоречит выше приведенным данным. Однако количественная характеристика растворимых фибрен-мономерных комплексов в крови рыб и их роль в физиологии гидробионтов пока не описана в литературе, соответственно, какие-либо выводы по этому вопросу также делать преждевременно.
Несмотря на ранее приведенные данные об отсутствии у гидробионтов антитромбина (Jordan, 1983), в ходе настоящего исследования удалось зафиксировать и проанализировать антитромбиноподобный фактор с помощью классического теста, применяемого в медицине. Избыток антитромбина III, выявленный к концу эксперимента у второй группы карпов, свидетельствует о сниженной свертываемости плазмы крови и, вместе со снижением растворимых фибрен-мономерных комплексов грозит высоким риском геморрагических осложнений. Начальное снижение концентрации антитромбина III у всех групп могло быть вызвано забором крови, либо повышенной потребностью в компенсаторных процессах гемостаза, связанных с гиперкоагуляцией.
Следует помнить, что на данный момент не разработаны стандартизированные методики и реактивы для исследования параметров коагулограммы пойкилотермных животных и что результаты зависят и от использованного вида тромбина, и от тканевого фактора и даже лабораторной посуды. В связи с этим требуются дальнейшие исследования по разработке единых методик и оценок в данной области.
Выводы. У обработанных синтетическими гормонами рыб уровень эндогенного кортизола имел нестабильную динамику (у острострессированных рыб) и снизился по сравнению с контролем у хронически стрессированных. Все группы карпов прореагировали на введение аналогов кортизола сильной активацией плазменных гемостатических механизмов. Вместе с тем при индукции хронического стресса у рыб к концу опыта также отмечены признаки гипокоагуляционного статуса.
Список литературы
Балабанова Л.В., Микряков Д.В., Микряков В.Р. 2009. Реакция лейкоцитов карпа Cyprinus carpio на гормониндуцируемый стресс // Биология внутр. вод. № 1. С. 91.
Березина Д.И. 2017. Динамика уровня кортизола при стрессе у рыб // Молекулярные исследования агропромышленных и лесных комплексов – регионам: Матер. II междунар. молод. науч.-практ. конф. Вологда-Молочное, 27 апреля 2017 г. Вологда: Вологодская государственная молочно-хозяйственная академия им. Н.В. Верещагина. С. 12.
Березина Д.И., Вайцель А.Э., Фомина Л.Л. 2017. Сравнительно-физиологические аспекты системы гемостаза рыб // Эволюц. и экол. аспекты изуч. живой мат.: Матер. I Всерос. науч. конф., Череповец, 8–9 февраля 2017 г. Череповец: Череповец. гос. ун-т. С. 38.
Березина Д.И., Фомина Л.Л. 2018. Динамика уровня фибриногена в крови рыб под влиянием стресса // Мол.-хоз. вестник. № 3(31). С. 8.
Иванов А.А. 2021. Физиология рыб: Уч. пособие. Санкт-Петербург: Лань.
Микряков Д.В. 2004. Влияние некоторых кортикостероидных гормонов на структуру и функцию иммунной системы рыб: Автореф. дис. … канд. биол. наук: 03.00.10, 14.00.36 / Ин-т проблем экол. и эволюц. им. А.Н. Северцова РАН. Москва.
Микряков Д.В., Микряков В.Р., Силкина Н.И. 2007a. Изменение морфофизиологических показателей иммунокомпетентных органов карпа Cyprinus carpio под влиянием гормона стресса // Вопр. ихтиологии. Т. 47. № 3. С. 418.
Микряков Д.В., Силкина Н.И., Микряков В.Р. 2007б. Влияние гормона стресса кортизона на окислительные процессы в иммунокомпетентных органах карпа Cypirinus carpio L. // Биология внутр. вод. № 3. С. 84.
Момот А.П., Мамаев А.Н. 2008. Современные аспекты патогенеза, диагностики и терапии ДВС-синдрома // Клинич. онкогем. Фунд. иссл. и клинич. практ. Т. 1. № 1. С. 63.
Пересторонина Е.А., Березина Д.И., Фомина Л.Л. 2019. Влияние кортизола на коагуляционные и иммунологические показатели крови рыб // Мол. иссл. агропром. и лесн. компл. – регионам: Матер. IV междунар. молодеж. науч.-практ. конф., Вологда-Молочное, 25 апр. 2019 г. Вологда: Вологод. гос. мол-хоз. акад. Т. 3. Ч. 2. С. 84.
Полиданов М.А., Скороход А.А., Бабиченко Н.Е. 2020. Реактивность и стресс: гемостатическая реактивность организма при стрессе. Исследование влияние стресса на гемокоагуляцию // Modern Science. № 3–1. С. 308.
Причепа М.В. 2015. Вміст кортизолу в тканинах йоржа та судака за різних умов зимівлі // Наукові записки Терноп. націонал. пед. унів. Сер. Біологія. С. 547.
Романенко В.Д., Потрохов А.С., Зиньковский О.Г. 2010. Гормональный механизм энергообеспечения адаптации рыб к воздействию минерального азота // Гидробиол. журн. Т. 46. № 6. С. 58.
Смит Л.С. 1986. Введение в физиологию рыб. Москва: Агропромиздат. 168 с. (Smith L.S. 1982. Introduction to fish physiology. TFH. 352 p.).
Тюкавин А.И. Черешнев В.А. Яковлев В.Н., Гайворонский И.В. 2021. Физиология с основами анатомии: учебник. Москва: ИНФРА-М. 574 с.
Фомина Л.Л., Вайцель А.Э., Березина Д.И. 2015. Функциональное состояние системы гемостаза рыб // Мол.-хоз. вестник. № 2(18). С. 41.
Фомина Л.Л., Кулакова Т.С., Березина Д.И. 2017. Определение активности плазменно-коагуляционного звена системы гемостаза рыб клоттинговыми методами с использованием коагулометра // Актуальные вопр. вет. биологии. Т. 35. № 3. С. 54.
Шихова О.А. 2016. Математическая биостатистика: Учеб. пособие. ФГБОУ ВО Вологодская государственная молочно-хозяйственная академия им. Н.В. Верещагина.
Barcellos L.J.G., Nicolaiewsky S., De Souza S.M.G. et al. 1999. Plasmatic levels of cortisol in the response to acute stress in Nile tilapia, Oreochromis niloticus (L.), previously exposed to chronic stress // Aquacul. Res. V. 30. № 6. P. 437.
Barry T.P., Lapp A.F., Kayes T.B. et al. 1993.Validation of a microtitre plate ELISA for measuring cortisol in fish and comparison of stress responses of rainbow trout (Oncorhynchus mykiss) and lake trout (Salvelinus namaycush) // Aquaculture. V. 117. № 3–4. P. 351.
Basu N., Nakano T., Grau E.G. et al. 2001. The effects of cortisol on heat shock protein 70 levels in two fish species // General and comparative endocrinology. V. 124. № 1. P. 97.
Dobšíková R., Svobodová Z., Bláhová J. et al. 2009. The effect of transport on biochemical and haematological indices of common carp (Cyprinus carpio L.) // Czech. J. Anim. Sci. V. 54. № 11. P. 510.
Donaldson E.M. 1981. The pituitary-interrenal axis as an indicator of stress in fish // Stress and fish. P. 11.
Doolittle R.F., Surgenor D.M. 1962. Blood coagulation in fish // Am. J. Physiology-Legacy Content. V. 203. №. 5. P. 964.
Espelid S., Løkken G.B., Steiro K. et al. 1996. Effects of cortisol and stress on the immune system in Atlantic Salmon (Salmo salar L.) // Fish & Shellfish Immunol. V. 6. № 2. P. 95.
Gamperl A.K., Vijayan M.M., Boutilier R.G. 1994. Experimental control of stress hormone levels in fishes: techniques and applications // Rev. Fish Biol. Fisheries. V. 4. № 2. P. 215.
Hamackova J., Kouril J., Kozak P. et al. 2006. Clove oil as an anaesthetic for different freshwater fish species // Bulg. J. Agricult. Science. V. 12. № 2. P. 185–194.
Houghton G., Matthews R.A. 1986. Immunosuppression of carp (Cyprinus carpio L.) to ichthyophthiriasis using the corticosteroid triamcinolone acetonide // Vet. Immunol. Immunopathol. V. 12. № 1–4. P. 413.
Jagadeeswaran P., Kulkarni V., Carrillo M. et al. 2007. Zebrafish: from hematology to hydrology // J. Thrombosis Haemostasis. V. 5. C. 300.
Jerez-Cepa I., Gorissen M., Mancera J.M. et al. 2019. What can we learn from glucocorticoid administration in fish? Effects of cortisol and dexamethasone on intermediary metabolism of gilthead seabream (Sparus aurata L.) // Comparative Biochem. Physiol. Part A: Molecular & Integrative Physiology. V. 231. P. 1–10.
Jordan R.E. 1983. Antithrombin in vertebrate species: conservation of the heparin-dependent anticoagulant mechanism // Arch. Biochem. Bioph. V. 227. № 2. P. 587–595.
Khatun S., Kanayama N., Belayet H.M. et al. 1999. Induction of hypercoagulability condition by chronic localized cold stress in rabbits // Thrombosis and Haemostasis. V. 81. № 03. P. 449.
Lewis J.H. 1996. Comparative hemostasis in vertebrates. Springer Science & Business Media. 426 p.
Mazeaud M.M., Mazeaud F., Donaldson E.M. 1977. Primary and secondary effects of stress in fish: some new data with a general review // Transactions Am. Fisheries Soc. V. 106. № 3. P. 201–212.
Palmblad J., Blombäck M., Egberg N. et al. 1977. Experimentally induced stress in man: effects on blood coagulation and fibrinolysis // J. Psychosom. Res. V. 21. № 1. P. 87.
Pickering A.D., Pottinger T.G. 1989. Stress responses and disease resistance in salmonid fish: effects of chronic elevation of plasma cortisol // Fish Physiol. Biochem. V. 7. № 1–6. P. 253.
Pickering A.D., Pottinger T.G., Sumpter J.P. 1987. On the use of dexamethasone to block the pituitary-interrenal axis in the brown trout, Salmo trutta L. // General Comparative Endocrinol. V. 65. № 3. P. 346.
Ramsay J.M., Feist G.W., Varga Z.M. et al. 2006. Whole-body cortisol is an indicator of crowding stress in adult zebrafish, Danio rerio // Aquaculture. V. 258. № 1–4. P. 565.
Roth R.R. 1972. Some factors contributing to the development of fungus infection in freshwater fish // J. Wildlife Diseases. V. 8. № 1. P. 24.
Ruane N.M., Huisman E.A., Komen J. 2001. Plasma cortisol and metabolite level profiles in two isogenic strains of common carp during confinement // J. Fish Biol. V. 59. № 1. P. 1.
Ruane N.M., Komen H. 2003. Measuring cortisol in the water as an indicator of stress caused by increased loading density in common carp (Cyprinus carpio) // Aquaculture. V. 218. № 1. P. 685.
Ruane N.M., Carballo E.C., Komen J. 2002. Increased stocking density influences the acute physiological stress response of common carp Cyprinus carpio (L.) // Aquacult. Res. V. 33. № 10. P. 777.
Schreck C.B., Tort L., Farrell A., Brauner C. 2016. The concept of stress in fish // Fish Physiol. USA. Academic Press. V. 35. P. 1.
Smith A.C. 1980. Formation of lethal blood clots in fishes // J. Fish Biol. V. 16. № 1. P. 1–4.
Swift D. J. 1982. Changes in selected blood component values of rainbow trout, Salmo gairdneri Richardson, following the blocking of the cortisol stress response with betamethasone and subsequent exposure to phenol or hypoxia // J. Fish Biology. V. 21. №. 3. P. 269–277.
Tavares-Dias M., Oliveira S.R. 2009. A review of the blood coagulation system of fish // Revista Brasileira de Biociências. № 2. P. 205.
Toukh M., Gordon S.P., Othman M. 2014. Construction noise induces hypercoagulability and elevated plasma corticosteroids in rats // Clinical and Applied Thrombosis/hemostasis. V. 20. № 7. P. 710.
Vijayan M.M., Pereira C., Grau E.G. et al. 1997. Metabolic responses associated with confinement stress in tilapia: the role of cortisol // Comp. Biochem. Physiol. Part C: Pharmacology, Toxicology and Endocrinology. V. 116. № 1. P. 89.
White A., Fletcher T.C. 1986. Serum cortisol, glucose and lipids in plaice (Pleuronectes platessa L.) exposed to starvation and aquarium stress // Comparative Biochemistry and Physiology. Part A: Comp. Physiol. V. 84. № 4. P. 649.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


