Биология внутренних вод, 2022, № 6, стр. 734-748
Видовое разнообразие, пути расселения и экология пресноводных моллюсков о. Колгуев (Баренцево море, Россия)
Ю. В. Беспалая a, *, О. В. Травина a, А. А. Томилова a, И. С. Хребтова a, О. В. Аксенова a, А. С. Аксенов a, b, М. В. Винарский c, А. В. Кондаков a, И. О. Нехаев c, Д. М. Палатов d, В. М. Спицын a, А. Р. Шевченко a, И. Н. Болотов a
a Федеральный исследовательский центр комплексного изучения Арктики им. Н.П. Лаверова
Уральского отделения Российской академии наук
Архангельск, Россия
b Северный (Арктический) федеральный университет им. М.В. Ломоносова
Архангельск, Россия
c Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
d Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
* E-mail: jbespalaja@yandex.ru
Поступила в редакцию 31.05.2022
После доработки 23.06.2022
Принята к публикации 27.06.2022
- EDN: SEUHRO
- DOI: 10.31857/S032096522206002X
Аннотация
Установлено, что малакофауна о. Колгуев (восточная часть Баренцева моря) представлена 20–22 видами пресноводных моллюсков, из них 13 выявлены впервые. Основу малакофауны острова составляют широко распространенные палеарктические и голарктические виды. Для изучения взаимосвязей между экологическими факторами и плотностью моллюсков использован канонический анализ соответствий (CCA). Согласно полученным данным, совокупное влияние типа субстрата, обилия водорослей и химического состава воды играет ведущую роль в распределении моллюсков в изученных водоемах и водотоках. Анализ последовательностей генов 16S рРНК образцов двустворчатых моллюсков сем. Sphaeriidae показал, что изученные особи с о. Колгуев, архипелага Новая Земля, о. Вайгач, п-ва Ямал, Гыданского п-ва, Европы, Сибири, Дальнего Востока, Китая и Северной Америки имеют идентичные гаплотипы, либо отличаются одной или двумя нуклеотидными заменами. Полученные молекулярные данные указывают, что фауна моллюсков о. Колгуев – результат недавней миграции после отступления льдов. Вселение пресноводных моллюсков на остров могло произойти как посредством естественного расселения по водным системам, так и с помощью водоплавающих птиц.
ВВЕДЕНИЕ
Несмотря на многолетнюю историю исследований пресноводной фауны арктических островов восточной части Баренцева моря (Holtedahl, 1928; Вехов, 1997, 2000a, 2000б; Bespalaya et al., 2015, 2017; Coulson et al., 2014), пресноводные моллюски ряда из них остаются почти неизученными. Например, сведения о пресноводных моллюсках о. Колгуев ограничены единственной работой E.A. Смита (Smith, 1896). По сути, это краткая заметка, основанная на изучении сборов малакофауны, выполненных британским полярным исследователем и натуралистом полковником Генри Уэмисс Фейлденом (H.W. Feilden) в ходе экспедиции на остров в 1895 г. По-видимому, эти сборы были достаточно фрагментарны, так как в результате их обработки Смит привел для фауны острова всего три таксона пресноводных моллюсков – Limnaea ovata var. kolguevensis Smith, 1896, L. palustris var. terebra (Westerlund, 1885) и Planorbis borealis Lovén in Westerlund, 1875 (рис. 1). Никаких данных об экологии и численности указанных форм в работе не представлено. В недавней работе М.В. Чертопруда с соавт. (2021) приведены результаты обследования сообществ макрозообентоса водоемов о. Колгуев, в ходе которого было обнаружено 9 видов моллюсков (к сожалению, их полный список в работе не приведен).
Рис. 1.
Раковины пресноводных моллюсков, собранных на о. Колгуев Г.В. Фейлденом в 1895 г., из музея естественной истории Гетеборга (Швеция) и Британского музея естественной истории (Великобритания): а – Limnaea palustris var. terebra; б, в – L. ovata var. kolguevensis; г – Planorbis borealis; д – раковина Ampullaceana sp. с о. Вайгач (RMBH). а, б, г – фото И.О. Нехаева, в – М.В. Винарского, д – О.В. Аксеновой. Масштаб – 5 мм.

Получение полноценной таксономической и экологической информации о моллюсках о. Колгуев представляет не только фундаментальный, но и практический интерес. Пресноводные моллюски играют важную роль в функционировании пресноводных экосистем, участвуя в энергетическом обмене и круговороте питательных веществ (Sousa et al., 2008). Кроме того, они служат пищевым ресурсом для видов, находящихся на более высоких трофических уровнях (Sousa et al., 2011). Оценка видового разнообразия моллюсков о. Колгуев позволит получить полноценную таксономическую информацию и даст представление о численности этой таксономической группы, а данные об их экологии – лучше понять структуру и особенности функционирования пресноводных экосистем островов Баренцева моря.
Изучение путей расселения арктической фауны, базирующееся на применении молекулярных данных, – одно из наиболее актуальных направлений современной биогеографии (Bernatchez, Wilson, 1998; Weider, Hobæk, 2000; Bolotov et al., 2017; Bespalaya et al., 2021а). Генетический подход позволяет датировать расхождение между видами и между популяциями внутри вида, а также детально реконструировать пути их расселения в Арктике (Coulson et al., 2014). Таким путем, например, была реконструирована история вселения ряда видов насекомых и рыб на о. Колгуев и его источники (Bolotov et al., 2015; Артамонова и др., 2020). Однако малакологические исследования островов территории Российской Арктики до настоящего времени не получили широкого развития, за исключением нескольких работ (Лешко и др., 2008; Bespalaya et al., 2015, 2017, 2021b, 2021d, Nekhaev, 2021; Vinarskii et al., 2015, 2021; Чертопруд и др., 2021).
Цель работы – изучить видовое разнообразие и биогеографические связи пресноводных моллюсков, населяющих водоемы о. Колгуев, и определить роль факторов окружающей среды в распространении изученных видов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на о. Колгуев в июле 2017 г. и в августе 2018 г. (рис. 2). Остров Колгуев расположен в восточной части Баренцева моря. Восточный берег острова омывается Печорским морем. Площадь острова 3500 км2. Центральная холмистая часть о. Колгуев приподнята над уровнем моря на 170 м. В южной части острова расположена заболоченная низменность с большим числом озер и густой сетью рек (Гидрогеология СССР, 1976). Остров расположен в тундровой зоне. Его ландшафты представляют собой переходную зону от гипоарктических тундр к типичным (Болотов, 2011). Геологическое строение острова представлено современными верхне- и среднечетвертичными песчано-глинистыми и дочетвертичными отложениями (Гидрогеология СССР, 1976). Мощность толщ многолетнемерзлых пород прослеживается до глубины 100–150 м. Климат на острове субарктический. Средняя температура воздуха в августе +7.5°C, в феврале –12.6°C (Корейша, 2000).
Рис. 2.
Карта и виды района исследования о. Колгуев с обозначением пунктов отбора проб: а – расположение озер отбора образцов (1–12); б – р. Губистая; в – озеро 1; г – вид на оз. Кривое.

В результате полевых работ было обследовано 13 озер и 2 водотока. Всего взято 70 количественных бентосных проб на 14 гидробиологических станциях, объем собранного материала представлен 1929 экз. моллюсков (табл. 1). Пробы отбирали по стандартным методикам (Жадин, 1960; Методика…, 1975; Определитель…, 2016). В каждом водоеме/водотоке выделяли (в зависимости от размера) от одной до трех станций, на каждой станции проводили отбор гидробиологических проб в пяти повторностях. Для отбора проб применяли гидробиологический сачок (размеры 0.28 × 0.5 м, размер ячеи сетки 200 мкм). Пробы промывали с использованием гидробиологического сита (размер ячеек 0.50 мм) (Методика…, 1975). Моллюсков фиксировали 96%-ным спиртом.
Таблица 1.
Видовое разнообразие, средняя плотность (M ± SE) и количество собранных экземпляров моллюсков в водных объектах о. Колгуев
| Вид | Ареал | оз. 1 | оз. 2 | оз. 3 | оз. 4 | оз. 5 | оз. Кривое | р. Губистая | Ручей |
|---|---|---|---|---|---|---|---|---|---|
| Sphaerium nitidum (Clessin in Westerlund, 1876) | Г | 16.1 ± 1.8 (9) | 124.0 ± 7.3 (293) | 21.4 ± 3.7 (5) | 0 | 0 | 50.0 ± 13.5 (21) | – | – |
| Euglesa sp. | ПА | – | – | – | – | 14.3 (2) | 7.1 (1) | – | – |
| E. casertana (Poli, 1791) | К | 1664.3 (233) | – | 21.4 (3) | 0 | 21.4 (3) | 88.8 ± 9.2 (87) | 42.9 (6) | – |
| E. nitida (Jenyns, 1832) | Г | 571.4 ± 285.7 (160) | 35.7 (5) | – | – | – | – | – | – |
| E. obtusalis (Lamarck, 1818) | ПА | – | – | – | 71.4 ± 32.2 (30) | 7.1 (2) | 0 | – | – |
| E. henslowana (Leach in Sheppard, 1823) | ПА | – | – | 100 (14) | 78.6 ± 35.7 (22) | 0 | 21.4 (3) | – | – |
| E. lilljeborgii (Clessin in Esmark & Hoyer, 1886) | Г | – | 28.6 ± 8.4 (20) | 7.1 (2) | 33.3 ± 16.6 (14) | 50 ± 6.79 (21) | 14.3 ± 5.1 (4) | – | – |
| E. subtruncata (Malm, 1855) | Г | – | – | 42.9 ± 35.7 (12) | 0 | 0 | 57.1 ± 2.5 (16) | 64.3 ± 2.4 (18) | |
| E. globularis (Clessin in Westerlund, 1873) | Г | 208.3 ± 69.4 (175) | 21.4 ± 7.7 (12) | 50 (7) | 21.4 ± 9.03 (15) | 31.0 ± 2.3(13) | 7.1 (1) | – | – |
| E. milium (Held, 1836) | ПА | 7.1 (1) | – | 0 | 10.7 ± 2.92 (3) | – | – | – | – |
| Valvata piscinalis (O.F. Müller, 1774) | ЕС | – | – | 311.9 ± 14.38 (262) | – | – | 215.5 ± 19.6 (181) | 25.5 ± 2.72 (25) | 11.9 ± 0.82 (5) |
| Galba truncatula (O.F. Müller, 1774) | Г | – | – | – | – | – | – | 21.4 ± 4.12 (9) | – |
| Gyraulus stelmachoetius (Bourguigant, 1860) | ЕЗС | – | 21.4 (3) | – | 0 | – | 121.4 (17) | 0 | 7.1 (1) |
| G. acronicus (Férussac, 1807) | ЕС | – | 33.7 ± 4.5 (33) | 7.1 (1) | 10.7 ± 2.9 (3) | – | 16.7 ± 6.23 (7) | 54.1 ± 7.93 (53) | 66.1 ± 4.7 (74) |
| G. borealis (Lovén in Westerlund, 1875) | ПА | – | 7.1 (1) | – | – | – | – | 57 (8) | 7.1 (1) |
| G. stroemi (Westerlund, 1873) | ПА | – | 7.1 (2) | – | 32.1 ± 1.7 (9) | – | – | 7.1 (1) | – |
В месте отбора каждой пробы измеряли глубину с точностью до 0.1 м, определяли характер грунта и растительности. Тип грунтов классифицировали на основе подхода, описанного в предыдущих работах (Bespalaya, 2015; Bespalaya et al., 2019): камни (2–75 мм), песок (0.2–2 мм), ил (0.005–0.2 мм) и глина (<0.005 мм).
На каждой станции отбирали пробы воды для гидрохимического анализа. До возвращения в лабораторию их хранили в 0.5-литровых пластмассовых бутылках (Bespalaya et al., 2019, 2021c). Образцы воды проанализировали на содержание макроионов (S${\text{O}}_{4}^{{2 - }}$, Mg2+, K+, Cl–, Na+, Ca2+) в Центре коллективного пользования научным оборудованием “Арктика” Северного (Арктического) Федерального университета (г. Архангельск).
В безымянных озерах бассейна р. Песчанка (озера 7–12) было взято семь качественных проб (рис. 2), содержавших 33 экз. моллюсков. Идентифицированные в них виды включены в фаунистический список моллюсков о. Колгуев, но эти данные не были использованы в количественном анализе.
Определение видовой принадлежности моллюсков базировалось на применении конхологических, анатомических и молекулярных данных (для сем. Sphaeriidae), определителей и монографий (Корнюшин, 1996; Korniushin, 2001; Glöer, Meier-Brook, 2003; Круглов, 2005; Определитель…, 2016). Плотность моллюсков (N, экз./м2) определяли по количественным пробам. Все собранные материалы хранятся в Российском музее центров биологического разнообразия Федерального исследовательского центра комплексного изучения Арктики Уральского отделения РАН (г. Архангельск) (далее RMBH). Номенклатура видов, процитированных из литературных источников, приведена в авторской редакции.
Видовое богатство моллюсков определяли расчетным методом разрежения с последующим построением и анализом графиков (Smith, van Belle, 1984). Достоверность различий гидрохимических параметров между различными группами озер оценивали с помощью теста Маннa–Уитни (U-test).
Влияние факторов среды на распределение станций отбора проб оценивали методом главных компонент (PCA). Количественные значения абиотических факторов предварительно преобразовали как lg(x + 1) с использованием программы PAST (Hammer et al., 2001). Связь численности моллюсков с факторами окружающей среды оценивали с помощью канонического анализа соответствий (CCA), который проводили в программе CANOCO ver. 4.56 (Ter Braak, Šmilauer, 2002). Исходные данные преобразовали в программе CANOCO (ý́ = lg(y × 10 + 1)) (Ter Braak, Šmilauer, 2002). В анализе использовали межвидовые расстояния с масштабированием Хилла, с удалением “хвоста” редких видов. Значимость канонических осей оценивали методом Монте-Карло.
Выделение общей клеточной ДНК из тканей моллюсков семейства Sphaeriidae, осуществляли методом фенол-хлороформной экстракции (Sambrook et al., 1989).
Из полученных образцов ДНК амплифицировали участок митохондриальной ДНК, содержащий фрагмент гена 16S рРНК (16S) с применением праймеров 16Sar и 16Sbr, описанных в работе (Palumbi, 1996). Раствор для синтеза фрагмента состоял из 100 ng ДНК, 2.5 µL Taq-буфера (20 mM MgCl2), 2.5µL раствора всех dNTP (2 mM), по 1 µL обоих праймеров (10 pM), 1 ед. Taq-ДНК-полимеразы и доводили деионизированной водой (dd (Н2O) до объема 25µL. Во всех случаях программа амплификации включала в себя этап первоначальной денатурации ДНК – 5 мин, +95°С; 28–30 циклов синтеза фрагмента ДНК: +95°С – 50 с, +(48–50)°С – 50 с, +72°С – 1 мин, а также этап окончательной элонгации цепи: +72°С, 5 мин. Амплифицированные фрагменты очищали переосаждением с использованием ацетата аммония и этилового спирта.
Секвенирование образцов проводили в Межинститутском центре коллективного пользования “Геном” Института молекулярной биологии имени В.А. Энгельгардта РАН при помощи набора реактивов ABI PRISM® BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3730 (Applied Biosystems). Полученные результаты последовательностей ДНК в прямом и обратном направлениях расшифровывали и анализировали с использованием программы BioEdit 7.0.9 (Hall, 1999).
Полученные последовательности 16S рРНК выравнивали c помощью алгоритма MUSCLE (Edgar, 2004) интегрированного в программу MEGAX (Kumar et al., 2018). Для филогеографического анализа выровненные последовательности 16S были обрезаны для Euglesa casertana до длины 438 п.н., E. nitida – до 502 п.н., E. subrtruncata – до 439 п.н., E. obtusalis – до 437 п.н., E. milium – до 496 п.н., E. lilljeborgii – до 460 п.н., E. henslowana – до 460 п.н., E. globularis – до 407 п.н., Sphaerium rhomboideum – до 471 п.н., S. nitidum – до 471 п.н., S. occidentale – до 471 п.н., в соответствии с длиной самых коротких сиквенсов в каждом массиве. Филогеографический анализ выполняли с помощью программного обеспечения Network v. 4.6.1.3 (Bandelt et al., 1999) методом построения медианных сетей (Median Joining, MJ). Всего проанализировано 377 последовательностей, из них 144 были взяты дополнительно из NCBI GenBank (Доп. мат. табл. S1 ).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В водных объектах о. Колгуев выявлено 16 видов пресноводных моллюсков из пяти родов и четырех семейств: Lymnaeidae (1 род, 1 вид), Planorbidae (1 род, 4 вида), Sphaeriidae (2 рода, 10 видов), Valvatidae (1 род, 1 вид) (табл. 1, рис. 3).
Рис. 3.
Пресноводные моллюски о. Колгуев: а – Galba truncatula; б – Valvata piscinalis; в – Gyraulus acronicus; г – Gyraulus borealis; д – G. stroemi; е – Sphaerium nitidum; ж – Euglesa casertana; з – E. globularis; и – E. henslowana; к – E. lilljeborgii; л – E. milium; м – E. nitida; н – E. obtusalis; о – E. subtruncata; п – Euglesa sp. (слева – с п-ова Гыдан, справа – с о. Колгуев). Фото О.В. Аксеновой. Масштаб: 1 мм.

Наиболее многочисленными были виды Valvata piscinalis – 24%, E. casertana – 17.2%, Sphaerium nitidum – 17.1% и Euglesa globularis – 11.6% (доля общей проанализированной выборки моллюсков равной 1962 экз.).
Анализ распределения моллюсков по типу ареалов показал, что основа малакофауны о. Колгуев представлена палеарктическими и голарктическими видами (табл. 1).
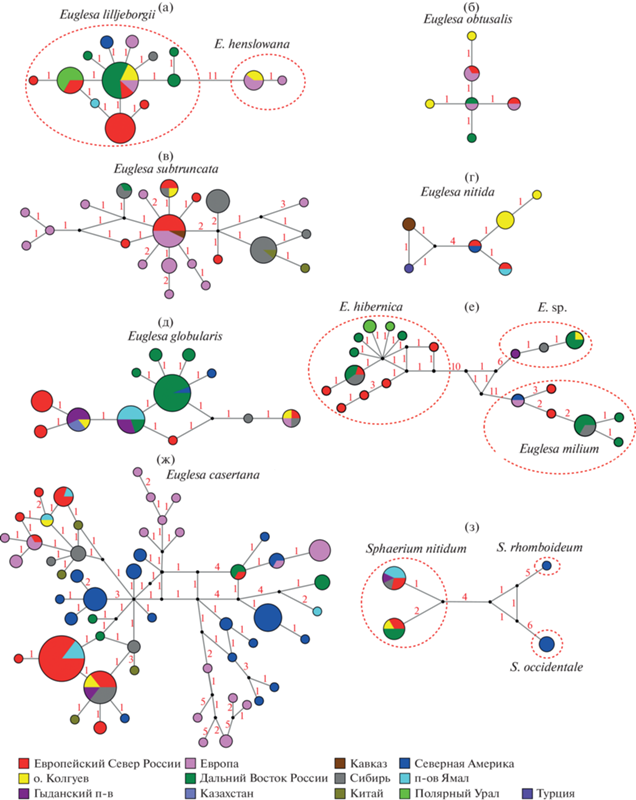
В результате молекулярно-генетического анализа получено 233 новых последовательности гена мтДНК 16S, среди них 22 из особей Sphaerium nitidum, Euglesa globularis, E. casertana, E. obtusalis, E. lilljeborgii, E. henslowana, E. subtruncata, E. nitida и Euglesa sp., собранных в озерах и реках о. Колгуев (Доп. мат. табл. S1). Полученные последовательности 16S рРНК включают гаплотипы, которые близки к гаплотипам образцов из водоемов и водотоков архипелага Новая Земля, о. Вайгач, п-ова Ямал, Гыданского п-ова, Европы, Сибири, Дальнего Востока России, Китая, Казахстана и Америки (рис. 4).
Рис. 4.
Медианная сеть гаплотипов, построенная на основе последовательностей гена 16S рРНК для двустворчатых моллюсков сем. Sphaeriidae: а – Euglesa lilljeborgii, E. henslowana; б – E. obtusalis; в – E. subtruncata; г – E. nitida; д – E. globularis; е – Euglesa sp., E. hibernica, E. milium; ж – E. casertana; з – Sphaerium nitidum, S. rhomboideum, S. occidentale. Размер круга пропорционален количеству идентичных последовательностей. Черные точки на линиях – гипотетически существующие гаплотипы. Цифры на линиях – число нуклеотидных замен между гаплотипами.
В целом, изученные водоемы острова характеризуются слабой минерализацией с преобладанием катионов кальция, либо натрия (табл. 2). Наиболее высокие концентрации макроионов, преимущественно кальция и сульфат-ионов, превышающие в 2–5 раз сумму основных катионов и анионов рассматриваемых озер о. Колгуев, зафиксированы на станциях р. Губистая и Ручей. Преобладают песчаные и илисто-песчаные грунты с крупным детритом и растительными остатками. Результаты анализа методом главных компонент (PCA) показали, что различия между станциями, главным образом, обусловлены характером субстрата и значениями гидрохимических параметров (табл. 3, рис. 5). Проекция первой оси положительно коррелировала с характером субстрата (каменистый грунт) и концентрацией макро-ионов, отрицательно – с глубиной, типом грунта (заилено-песчаный) и наличием остатков растительности. Вдоль второй оси различие станций, в основном, связано с глубиной, концентрацией CI− с положительной стороны оси и содержанием K+, расположенным на другой части оси (рис. 5).
Таблица 2.
Содержание основных ионов (мг/л) в изученных водоемах и водотоках о. Колгуев
| Водный объект | Ca2+ | Na+ | Mg2+ | K+ | Cl– | S${\text{O}}_{4}^{{2 - }}$ |
|---|---|---|---|---|---|---|
| оз. 1, ст. 1 | 25.60 ± 3.21 | 10.80 ± 1.62 | 4.70 ± 0.47 | 0.07 ± 0.02 | 12.26 ± 1.23 | 6.31 ± 0.63 |
| ст. 2 | 25.69 ± 2.57 | 10.96 ± 1.64 | 4.73 ± 0.47 | 0.14 ± 0.03 | 12.44 ± 1.24 | 6.36 ± 0.64 |
| ст. 3 | 25.69 ± 3.41 | 10.99 ± 1.65 | 4.71 ± 0.47 | 0.15 ± 0.03 | 12.40 ± 1.24 | 6.50 ± 0.65 |
| оз. 2, cт. 1 | 8.59 ± 0.86 | 8.69 ± 1.30 | 3.15 ± 0.31 | 0.71 ± 0.14 | 6.42 ± 0.64 | 3.63 ± 0.36 |
| ст. 2 | 9.12 ± 0.91 | 8.65 ± 1.30 | 3.28 ± 0.33 | 0.78 ± 0.16 | 6.28 ± 0.63 | 3.89 ± 0.39 |
| ст. 3 | 8.70 ± 0.87 | 9.01 ± 1.35 | 3.26 ± 0.33 | 0.65 ± 0.13 | 6.26 ± 0.63 | 3.54 ± 0.35 |
| оз. 3 | 11.22 ± 1.12 | 10.46 ± 1.57 | 4.41 ± 0.44 | 1.13 ± 0.17 | 10.78 ± 1.08 | 6.82 ± 0.68 |
| оз. Кривое, ст. 1 | 7.79 ± 0.78 | 7.93 ± 1.19 | 3.30 ± 0.33 | 1.09 ± 0.16 | 8.95 ± 0.89 | 4.16 ± 0.42 |
| ст. 2 | 7.17 ± 0.72 | 7.90 ± 1.25 | 3.48 ± 0.35 | 0.79 ± 0.16 | 6.56 ± 0.66 | 2.96 ± 0.30 |
| р. Губистая | 38.31 ± 3.83 | 16.69 ± 2.50 | 12.70 ± 1.37 | 1.94 ± 0.29 | 11.42 ± 1.14 | 33.19 ± 3.32 |
| Ручей | 66.67 ± 6.67 | 15.15 ± 2.27 | 14.31 ± 1.43 | 1.70 ± 0.25 | 11.81 ± 1.18 | 17.78 ± 1.78 |
| оз. 4 | 8.18 ± 0.82 | 16.67 ± 2.50 | 4.19 ± 0.42 | 0.64 ± 0.13 | 12.92 ± 1.29 | 1.98 ± 0.25 |
| оз. 5 | 3.54 ± 0.35 | 7.65 ± 1.15 | 1.84 ± 0.18 | 0.82 ± 0.16 | 8.09 ± 0.81 | 3.33 ± 0.33 |
Таблица 3.
Результаты анализа главных компонент (PCA) вариации факторов окружающей среды для первых трех PCA-осей
| Фактор среды | Ось 1 | Ось 2 | Ось 3 |
|---|---|---|---|
| silty-sand | –0.5 | 0.17 | –0.6 |
| gr | 0.9 | –0.2 | –0.25 |
| sand | 0.3 | 0.2 | –0.11 |
| algae | 0.07 | –0.4 | 0.6 |
| PV | –0.9 | 0.08 | 0.4 |
| depth | –0.76 | 0.5 | –0.18 |
| K+ | 0.46 | –0.8 | –0.15 |
| Na+ | 0.8 | 0.3 | 0.36 |
| Mg2+ | 0.9 | 0.13 | –0.07 |
| Са2+ | 0.9 | 0.3 | –0.09 |
| Cl− | 0.6 | 0.57 | 0.34 |
| S${\text{O}}_{4}^{{2 - }}$ | 0.9 | 0.02 | –0.18 |
Рис. 5.
Распределение станций отбора проб в зависимости от факторов среды на основе анализа главных компонент (PCA). Коды переменных среды приведены в табл. 3.

Станции р. Губистая и Ручей образуют обособленную группу (рис. 5). Эти водотоки характеризуются более высокой концентрацией Mg2+, Са2+ и S${\text{O}}_{4}^{{2 - }}$, по сравнению с озерами (U-тест Манна–Уитни: р < 0.05).
Рис. 6.
Ординационная диаграмма канонического анализа связей обилия моллюсков (а) и станций отбора проб (б) с экологическими переменными в озерах о. Колгуев. moss – мох. Остальные обозначения факторов, как на рис. 5.
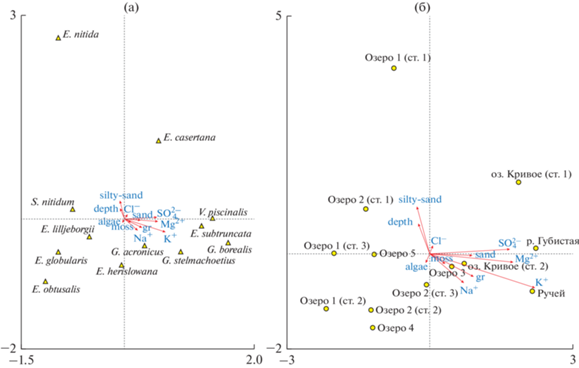
Результаты канонического анализа соответствий (ССА) (рис. 6) показывают, что из 14 факторов окружающей среды 11 оказывают существенное влияние на распространение и обилие моллюсков. Вероятно, большое количество значимых на приблизительно равных уровнях факторов объясняется небольшим числом включенных в анализ станций. Последнее обстоятельство не позволяет полностью исключить влияние случайных сочетаний значений отдельных факторов, а также оценить изолированное влияние каждого из них. Анализ сфокусирован на межвидовых дистанциях с масштабированием Хилла. Собственные значения (лямбда) равны 0.433, 0.379, 0.314 и 0.185 для первой (горизонтальной), второй (вертикальной), третьей и четвертой осей соответственно. Первые две оси объясняют 49.1% дисперсии, а все канонические оси в совокупности объясняют 79.3% дисперсии. Значимость осей определяли на основе теста Монте-Карло (первая ось F = 0.355, Р = 0.03; все оси F = 3.400, Р = = 0.006). Вдоль проекции первой оси различие распределения видов и станций отбора проб, главным образом, обусловлено концентрацией макро-ионов (S${\text{O}}_{4}^{{2 - }}$, Mg2+, K+) и характером грунта (каменистые и песчаные грунты). Проекция второй оси слабо коррелировала с характером субстрата (заилено-песчаный грунт).
Наиболее обособленным положением характеризуются станции Ручей и р. Губистая. В этих местообитаниях брюхоногие моллюски Gyraulus acronicus, G. borealis, G. stelmachoetius, Valvata piscinalis приурочены к участкам с каменистыми либо песчаными грунтами.
Местообитания с высокой концентрацией Na+ и наличием нитчатых водорослей и мха являются оптимальной средой обитания для Euglesa lilljeborgii, E. henslowana, E. obtusalis, E. globularis. Заилено-песчаные грунты населены Sphaerium nitidum, Euglesa nitida и E. casertana.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Таксономическое разнообразие и плотность поселения. Согласно литературным данным, на о. Колгуев обитает только три вида брюхоногих моллюсков (Smith, 1896). В работе Чертопруд с соавт. (2021) выявлено 7 видов двустворчатых и 2 вида брюхоногих моллюсков. В нашем исследовании в водоемах острова были найдены 16 видов моллюсков, из них 13 видов зарегистрированы впервые (табл. 1, рис. 3). Виды, обнаруженные в конце XIX в. Г.У. Фейлденом и определенные Е.А. Смитом (Smith, 1896) как Limnaea ovata var. kolguevensis и Limnaea palustris var. terebra (рис. 1) не были зафиксированы в ходе настоящей работы. Таксономический статус ряда видов, указанных в статье М.В. Чертопруда с соавт. (2021), например, Parasphaerium rectidens, также нуждается в уточнении. Таким образом, с учетом литературных данных на о. Колгуев может обитать ~20–22 вида пресноводных моллюсков. В то же время не все авторы признают видовую самостоятельность таксонов Gyraulus borealis и G. stelmachoetius (например, Meier-Brook, 1983; Glöer, 2019; Nekhaev, 2021). Следует отметить, что система рода Gyraulus остается спорной и до сих пор не ревизована на основе современного интегративного подхода. Остается неясным таксономический статус приведенного Смитом вариетета Limnaea ovata var. kolguevensis, по которому отсутствуют и анатомические, и молекулярные данные. Можно лишь предположить, что первый вид идентичен виду Peregriana dolgini, широко распространенному в Сибири и известному из бассейна р. Печора (Vinarskii et al., 2015; Аксенова и др., 2018). Также нельзя исключить его принадлежность к широко распространенному в северной Евразии виду Ampullaceana lagotis (Schrank, 1803). Таким образом, представленный здесь видовой список пресноводных моллюсков о. Колгуев, можно считать предварительным и должен быть уточнен в ходе дальнейших исследований.
Таксономическая структура и видовое богатство фауны моллюсков водоемов и водотоков о. Колгуев существенно отличаются от водоемов о. Вайгач и архипелага Новая Земля и сопоставимы с таковыми в озерах о. Большой Соловецкий, расположенных в таежной зоне (рис. 7, рис. 8). Впервые для арктических островов установлено обитание представителей сем. Valvatidae. До настоящего времени считалось, что моллюски этого семейства здесь отсутствуют (Vinarskii et al., 2021).
Рис. 7.
Таксономическая структура малакофауны арктических водоемов и водотоков: а – Соловецкие о-ва (Белое море), б – о. Колгуев, в – о. Вайгач.

Рис. 8.
Кривые видового богатства (rarefaction model) фауны моллюсков о. Колгуев, Соловецких островов (Белое море), о. Вайгач и архипелага Новая Земля. Кривые (Соловецкие острова, о. Вайгач) усечены на уровне N = 3000 экз. для повышения наглядности рисунка.

Максимальной численностью и плотностью отличались виды Euglesa casertana, E. globularis, Sphaerium nitidum и Valvata piscinalis (табл. 1). Доминирующее положение видов Euglesa casertana и E. globularis отмечено также в водоемах о. Вайгач (Bespalaya, 2015; Bespalaya et al., 2019), п-ова Ямал (Долгин, 2001; Bespalaya et al., 2018), Гыданского п-ва (Bespalaya et al., 2021c). Двустворчатый моллюск Sphaerium nitidum относится к холодноводным арктическим видам и распространен в высоких широтах Голарктики (Korniushin, 2001).
Относительно высокое видовое разнообразие моллюсков на о. Колгуев, в сравнении с о. Вайгач и Новая Земля, вероятно, связано с действием палеогеографических (см. ниже), географических (близкое расположение к материку) и климатических факторов. Так, несмотря на то, что остров расположен в пределах 68°–70° с.ш., климат здесь более мягкий, чем на других островах Арктики (Корейша, 2000).
Формирование фауны. Вопросы истории фауны арктических островов в плейстоцене являются предметом дискуссий (Coulson et al., 2014; Bolotov et al., 2017). Одни авторы считают, что фауна некоторых арктических островов – результат недавней колонизации (Brochmann et al., 2003; Coulson et al., 2014; Vinarskii et al., 2015; Bolotov et al., 2017; Bespalaya et al., 2017), другие предполагают, что некоторые организмы пережили последнее оледенение в рефугиумах (Provan, Bennett, 2008; Samchyshyna et al., 2008). Например, в ходе недавних исследований установлено, что архипелаг Новая Земля в плейстоцене служил рефугиумом для некоторых видов позвоночных и беспозвоночных животных (Potapov et al., 2018; Makhrov et al., 2019, Spitsyn et al., 2021a, 2021b). Существование рефугиума в юго-восточной части Баренцева моря также возможно и поддерживается некоторыми реконструкциями, предполагающими наличие здесь свободного от ледника пространства в течение всего последнего оледенения (Gataullin et al., 2001). Отметим, что в популяциях морских моллюсков на литорали о. Колгуев обнаружены уникальные гаплотипы с “островным” характером распределения (Strelkov et al., 2007). Вероятно, обе точки зрения не взаимоисключающиe и обе могли быть реализованы.
В целом, обнаруженные на о. Колгуев моллюски – широко распространенные в Палеарктике и Голарктике виды, адаптированные к обитанию в условиях высоких широт. Эндемичные виды в малакофауне о. Колгуев не были выявлены. Изучение типовых экземпляров Limnaea ovata var. kolguevensis, показало, что этот таксон – младший синоним вида Ampullaceana lagotis, либо Peregriana dolgini.
Анализ медианных сетей последовательностей 16S рРНК двустворчатых моллюсков семейства Sphaeriidae (Sphaerium nitidum, Euglesa globularis, E. casertana, E. obtusalis E. lilljeborgii, E. henslowana, E. subtruncata, E. nitida, Euglesa sp.) показал, что особи с о. Колгуев имеют идентичные гаплотипы либо отличаются одной или двумя нуклеотидными заменами от особей из водоемов Северной Европы (о. Вайгач, архипелаг Новая Земля), Сибири (п-ва Ямал, Гыданского п-ова), Дальнего Востока России, Китая и Северной Америки (рис. 4).
В ходе исследований водоемов о. Колгуев был обнаружен двустворчатый моллюск Euglesa sp., проявляющий генетическое сходство с образцами из Сибири (бассейны рек Яна, Лена и Гыда) (рис. 4e). Выявленные последовательности 16S рРНК Euglesa sp. не имеют аналогов в Генбанке и наиболее близки к E. milium и E. hibernica (=E. parvula (Clessin in Westerlund, 1873)) (рис. 4e). Предположительно, двустворчатый моллюск Euglesa sp. – сибирский эндемик, таксономический статус которого нуждается в уточнении. По морфологическим признакам, Euglesa sp. можно отнести к виду Euglesa lindholmi (Starobogatov et Streletzkaja, 1967) подрода Hiberneuglesa Starobogatov in Dolgin, 1983. Этот вид обнаружен в бассейне рек Индигирка и Колыма (Vinarskii, Kantor, 2016) и известен только по типовым конхологическим материалам, его анатомия до настоящего времени остается не изученной (Корнюшин, 1996). Для окончательного решения вопроса необходимо молекулярное изучение топотипов Euglesa lindholmi.
Полученные молекулярные данные согласуются с гипотезой, о формировании фауны беспозвоночных о. Колгуев в результате относительно недавней миграции с материка после отступления льдов. Расселение пресноводных моллюсков на о. Колгуев могло произойти посредством естественного расселения по водным системам. Геологические данные свидетельствуют о том, что о. Колгуев соединялся с материком, и его водоемы были частью обширной пресноводной системы, куда входили также водоемы современного бассейна р. Печора (Bolotov et al., 2015; Артамонова и др., 2020). Не исключено также, что моллюски могли попасть на остров путем их пассивного переноса водоплавающими птицами. Известно, что о. Колгуев – важнейшее место гнездования гусей в Западной Палеарктике (Ануфриев, 2016). Подобный сценарий был предложен для объяснения находки пресноводных легочных моллюсков на о. Врангеля (Vinarskii et al., 2015).
Экологическое распределение. Полученные результаты согласуются с общими представлениями о первоочередной связи распределения пресноводных моллюсков с факторами среды, характеризующими тип водоема или крупного местообитания (Березкина, Старобогатов, 1988; Чертопруд, Удалов, 1996; Dillon, 2000). Согласно полученным данным, важную роль в распределении моллюсков в изученных водоемах и водотоках играют тип субстрата, наличие нитчатых водорослей и концентрация макроионов (рис. 6). Результаты настоящего исследования согласуются с данными, полученными ранее при изучении пресноводных моллюсков о. Вайгач, п-ова Ямал и Гыданского п-ова (Bespalaya et al., 2019; 2021c).
Ограниченный объем материала из водоемов о. Колгуев не позволяет достоверно оценить изолированное влияние отдельных факторов на распределение моллюсков. Однако по аналогии с предшествующими исследованиями можно предположить наличие такого влияния, как и взаимной связи между факторами. В частности, обнаруженная связь распределения моллюсков с субстратом, была неоднократно показана ранее (Clampitt, 1973; Березкина, Старобогатов, 1988; Dillon, 2000; Horsák, Hájek, 2003; Нехаев, 2006; 2011). При этом сам по себе субстрат часто оказывается связан с другими характеристиками, например гидрохимическими параметрами воды, течением и прибойностью местообитания. Водная растительность, в частности водоросли, могут, с одной стороны, выступать в роли субстрата для поселения, с другой – служить пищевым объектом для брюхоногих моллюсков (Цихон-Луканина и др., 1987; Нехаев, 2011). С обилием водорослей связывают увеличение содержания кальция и других питательных веществ в воде (Horsák et al., 2011; Lewin, 2014). Кальций необходим для роста раковин моллюсков и ряда других физиологических процессов, что может обусловливать увеличение численности моллюсков в местообитаниях с его высоким содержанием (Horsák, Hájek, 2003, Horsák et al., 2011). Водные мхи – также один из важных факторов окружающей среды, влияющих на распределение и численность донной фауны (Bespalaya et al., 2021c, 2021d).
Выводы. Получены новые данные, значительно расширяющие имеющиеся сведения о разнообразии, экологии и биогеографических связях пресноводных моллюсков, обитающих в озерах и реках о. Колгуев. Выявлено 16 видов пресноводных моллюсков, принадлежащих к пяти родам и четырем семействам (Lymnaeidae, Planorbidae, Sphaeriidae, Valvatidae), из которых 13 видов были обнаружены впервые на этом острове. В малакофауне о. Колгуев представлены широко распространенные палеарктические и голарктические виды. Установлено, что тип местообитания, обусловленный характером субстрата, обилием водорослей и химическим составом воды, играет важную роль в распределении моллюсков в изученных водоемах и водотоках. Полученные молекулярные данные свидетельствуют о том, что фауна пресноводных моллюсков о. Колгуев – результат недавней миграции после отступления льдов.
Список литературы
Аксенова О.В., Кондаков А.В., Беспалая Ю.В. и др. 2018. Первое молекулярно-генетическое подтверждение обитания сибирского вида брюхоногого моллюска Radix dolgini (Gundrizer et Starobogatov, 1979) в европейской части Российской Арктики // Арктические исследования: от экстенсивного освоения к комплексному развитию: материалы I международной молодежной научно-практической конференции (26–28 апреля 2018). Архангельск: САФУ. Т. 2. С. 235.
Ануфриев В.В. 2016. Ресурсы охотничьих животных островов Колгуев и Вайгач // Рус. орнитол. журн. Т. 25. № 1259. С. 860.
Артамонова В.С., Махров А.А., Попов И.Ю., Спицын В.М. 2020. Европейская корюшка Osmerus eperlanus (Linnaeus, 1758) на острове Колгуев (Баренцево море) и причины, ограничивающие распространение этого вида в Арктике // Сиб. экол. журн. Т. 27. № 2. С. 160.
Березкина Г.В., Старобогатов Я.И. 1988. Экология размножения и кладки яиц пресноводных легочных моллюсков // Тр. Зоол. ин-та АН СССР. Т. 174. С. 1.
Беспалая Ю.В., Аксенова О.В., Болотов И.Н. и др. 2017. Фауна пресноводных моллюсков прибрежных низменностей Печорского моря (Большеземельская тундра, Ненецкий автономный округ) // Фауна Урала и Сибири. № 1. С. 25.
Болотов И.Н. 2011. Фауна и экология булавоусых чешуекрылых (Lepidoptera, Rhopalocera) полуострова Канин и острова Колгуев // Зоол. журн. Т. 90. № 11. С. 1365.
Вехов Н.В. 1997. Фауна и распространение ракообразных в пресных и солоноватых водах островов восточной части Баренцева моря // Зоол. журн. Т. 76. № 6. С. 657.
Вехов Н.В. 2000a. Ракообразные малых водоемов островов восточной части Баренцева моря и пролива Карские ворота // Биология внутр. вод. № 2. С. 42.
Вехов Н.В. 2000б. Ракообразные водоемов полярных пустынь архипелага Новая Земля // Вест. зоологии. Т. 34. № 3. С. 17.
Гидрогеология СССР. 1976. Вып. 1. Основные закономерности распространения подземных вод на территории СССР. М.: Недра.
Долгин В.Н. 2001. Пресноводные моллюски Субарктики и Арктики Сибири: Дис. … докт. биол. наук. Томск: Томский гос. ун-т.
Жадин В.И. 1960. Методы гидробиологического исследования. М.: Высшая школа. 150 с.
Корейша М.М. 2000. Остров Колгуев // J. Geocryology. V. 1. P. 69.
Корнюшин А.В. 1996. Двустворчатые моллюски надсемейства Pisidioidea Палеарктики. Фауна, систематика, филогения. Киев: Наукова думка.
Круглов Н.Д. 2005. Моллюски семейства прудовиков Европы и Северной Азии. Смоленск: Смол. гос. пед. ун-т.
Лешко Ю.В., Фефилова Е.Б., Батурина М.А., Хохлова Л.Г. 2008. Водные беспозвоночные островов Вайгач и Долгий // Разнообразие и пространственно-экологическая организация животного населения Европейского северо-востока. Сыктывкар: Коми НЦ УрО РАН. С. 102.
Методика изучения биогеоценозов внутренних водоемов. 1975. Москва: Наука.
Нехаев И.О. 2006. Особенности распределения пресноводных моллюсков семейства Planorbidae (Gastropoda, Pulmonata), обитающих в прибрежной части водоемов северо-запада Кольского полуострова // Вест. Мурм. гос. тех. ун-та. Т. 9. № 5. С. 793.
Нехаев И.О. 2011. Особенности географического распространения подродов и жизненных форм Lymnaeidae (Gastropoda, Pulmonata) в восточной Европе // Изв. РАН. Сер. биол. № 4. С. 477.
Определитель зоопланктона и зообентоса пресных вод Европейской России. 2016. Mосква; Санкт-Петербург: Тов-во науч. изданий КМК. Т. 2.
Цихон-Луканина Е.А. 1987. Трофология водных моллюсков. Москва: Наука.
Чертопруд М.В., Удалов А.А. 1996. Экологические группировки пресноводных Gastropoda центра Европейской России: влияние типа водоема и субстрата // Зоол. журн. Т. 75. С. 664.
Чертопруд М.В., Крыленко С.В., Лукиных А.И. и др. 2021. Особенности сообществ макрозообентоса малых Арктических озер Евразии // Биология внутр. вод. № 4. С. 378.
https://doi.org/10.31857/S0320965221030050
Bandelt H.J., Forster P., Röhl A. 1999. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. V. 16. № 1. P. 37.
Bernatchez L., Wilson C.C. 1998. Comparative phylogeography of Nearctic and Palearctic fishes // Mol. Ecology. V. 7. № 4. P. 431.
Bespalaya Y. 2015. Molluscan fauna of an Arctic lake is dominated by a cosmopolitan Pisidium species // J. Molluscan Studies. V. 81. P. 294. https://doi.org/10.1093/mollus/eyu081
Bespalaya Y., Bolotov I., Aksenova O. et al. 2015. Occurrence of a Sphaerium species (Bivalvia: Sphaeriidae) of Nearctic origin in European Arctic Russia (Vaigach Island) indicates an ancient exchange between freshwater faunas across the Arctic // Polar Biol. V 38. P. 1545. https://doi.org/10.1007/s00300-015-1656-5
Bespalaya Y.V., Bolotov I.N., Aksenova O.V. et al. 2017. Two Pisidium species inhabit freshwater lakes of Novaya Zemlya Archipelago: the first molecular evidence // Polar Biol. V. 40. P. 2119. https://doi.org/10.1007/s00300-017-2119-y
Bespalaya Y.V., Aksenova O.V., Zubriy N.A. 2018. Molluskan fauna in the lower reaches of the Syoyakha (Yamal Peninsula) // Arctic Environ. Res. V. 18. P. 76. https://doi.org/10.3897/issn2541-8416.2018.18.2.76
Bespalaya Y., Joyner-Matos J., Bolotov I. et al. 2019. Reproductive ecology of Pisidium casertanum (Poli, 1791) (Bivalvia: Sphaeriidae) in Arctic lakes // J. Molluscan Studies. V. 85. № 1. P. 11. https://doi.org/10.1093/mollus/eyy050
Bespalaya Y., Bulakhova N., Gofarov M. et al. 2021a. Occurrence of the mollusc species Euglesa globularis (Clessin in Westerlund, 1873) in North-East Asia (Magadan, Russia) with data on dispersal mechanism and vectors // Limnologica – Ecology and Management Inland Waters. V. 85. https://doi.org/10.1016/j.limno.2020.125832
Bespalaya Yu., Przhiboro A., Aksenova O. et al. 2021b. Preliminary study of the benthic fauna in lakes of the Novaya Zemlya Archipelago and Vaigach Island (the Russian Arctic) // Polar Biol. V. 44. № 3. P. 539. https://doi.org/10.1007/s00300-021-02817-4
Bespalaya Y.V., Aksenova O.V., Sokolova S.E. et al. 2021c. Biodiversity and distributions of freshwater mollusks in relation to chemical and physical factors in the thermokarst lakes of the Gydan Peninsula, Russia // Hydrobiologia. V. 848. P. 3031. https://doi.org/10.1007/s10750-020-04227-9
Bespalaya Y.V., Aksenova O.V., Bolotov I.N. et al. 2021d. Freshwater Mollusks in Lakes of the Solovetsky Islands (White Sea) // Lake Water: Properties and Uses (Case Studies of Hydrochemistry and Hydrobiology of Lakes in Northwest Russia). Chapter 10. N. Y.: Nova Sci. Publishers. P. 249.
Bódis E., Nosek J., Oertel N. et al. 2011. Spatial distribution of bivalves in relation to environmental conditions (middle Danube catchment, Hungary) // Community Ecology. V. 12. P. 210.
Bolotov I.N., Tatarinov A.G., Filippov B.Y. et al. 2015. The distribution and biology of Pararctia subnebulosa (Dyar, 1899) (Lepidoptera: Erebidae: Arctiinae), the largest tiger moth species in the High Arctic // Polar Biol. V. 38. P. 905.
Bolotov I.N., Aksenova O.V., Bespalaya J.V. et al. 2017. Origin of a divergent mtDNA lineage of a freshwater snail species, Radix balthica, in Iceland: cryptic glacial refugia or a postglacial founder event? // Hydrobiologia. V. 787. P. 73. https://doi.org/10.1007/s10750-016-2946-9
Brochmann C., Gabrielsen T.M., Nordal I. et al. 2003. Glacial survival or tabula rasa? The history of the North Atlantic biota revisited // Taxon. V. 52. P. 417.
Clampitt P.T. 1973. Substratum as a factor in the distribution of pulmonate snails in Douglas Lake, Michigan // Malacologia. V. 12(2). P. 379.
Coulson S.J., Convey P., Aakra K. et al. 2014. The terrestrial and freshwater invertebrate biodiversity of the archipelagoes of the Barents Sea; Svalbard, Franz Josef Land and Novaya Zemlya // Soil Biol. Biochem. V. 68. P. 440.
Dillon R.T. 2000. The ecology of freshwater molluscs. Cambridge: Cambridge University Press.
Edgar R.C. 2004. MUSCLE: multiple sequence alignment with high accuracy and high throughput // Nucleic Acids Res. V. 32(5). P. 1792.
Gataullin V., Mangerud J., Svendsen J.I. 2001.The extent of the Late Weichselian ice sheet in the southeastern Barents Sea // Global and Planetary Change V. 31. P. 453.
Glöer P. 2019. The freshwater gastropods of the West-Palaearctis. Volume 1. Fresh- and brackish waters except spring and subterranean snails. Identification key, anatomy, ecology, distribution. Hetlingen: Published by the author.
Glöer P., Meier-Brook C. 2003. Süsswassermollusken. Ein Bestimmungschlüssel für die Bundesrepublik Deutschland. 13 Auflage. Deutscher Jugendbund für Naturbeobachtun, Hamburg.
Hall T.A. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/ NT // Nucleic Acids Symposium Series V. 41. P. 95.
Hammer O., Harper D.A.T., Ryan P.D. 2001. PAST: paleontological statistics software package for education and data analysis // Palaeontologia Electronica. V. 4. P. 9.
Holtedahl O. 1928. Report of the scientific results of the Norwegian expedition to Novaya Zemlya. Oslo: A.W. Broggers Bogtrykkeri.
Horsák M., Hájek M. 2003. Composition and species richness of mollusc communities in relation to vegetation and water chemistry in the Western Carpathian spring fens: the poor-rich gradient // J. Molluscan Studies. V. 69. P. 349.
Horsák M., Hájek M., Hájková P. et al. 2011. Mollusc communities in Bulgarian fens: predictive power of the environment, vegetation, and spatial structure in an isolated habitat // Naturwissenschaften. V. 98. P. 671. https://doi.org/10.1007/s00114-011-0816-x
Korniushin A.V. 2001. Taxonomic revision of the genus Sphaerium sensu lato (Bivalvia Sphaeriidae) in the Palaearctic Region, with some notes on the North American species // Archiv für Molluskenkunde. V. 129. P. 77.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. 2018. MEGA X: molecular evolutionary genetics analysis across computing platforms // Molecular Biology and Evolution. V. 35(6). P. 1547.
Lewin I. 2014. Mollusc communities of lowland rivers and oxbow lakes in agricultural areas with anthropogenically elevated nutrient concentration // Folia Malacolog. V. 22. № 2. P. 87.
Makhrov A.A., Bolotov I.N. 2006. Нет в тексте Dispersal routes and species identification of freshwater animals in northern Europe: a review of molecular evidence // Russian J. Genetics. V. 42. P. 1101.
Meier-Brook C. 1983. Taxonomic studies on Gyraulus (Gastropoda: Planorbidae) // Malacologia. V. 24. P. 1.
Makhrov A.A., Bolotov I.N., Spitsyn V.M. et al. 2019. Resident and Anadromous Forms of Arctic Charr (Salvelinus alpinus) from North-East Europe: An Example of High Ecological Variability without Speciation // Doklady Biochemistry and Biophysics. V. 485. P. 119.
Nekhaev I.O. 2021. Freshwater gastropods of the western part of the Kola Peninsula and northern Karelia (northern Europe) // Ruthenica, Russ Malacolog. J. V. 31. 4. P. 147. https://doi.org/10.35885/ruthenica.2021.31(4).1
Palumbi S.R. 1996. Nucleic acids II: the polymerase chain reaction // Molecular systematics. Sunderland: Sinauer Associates. P. 205.
Potapov G.S., Kondakov A.V., Spitsyn V.M. et al. 2018. An integrative taxonomic approach confirms the valid status of Bombus glacialis, an endemic bumblebee species of the High Arctic // Polar Biol. V. 41. P. 629. https://doi.org/10.1007/s00300-017-2224-y
Provan J., Bennett K.D. 2008. Phylogeographic insights into cryptic glacial refugia // Trends in Ecology & Evolution. V. 23. P. 564. https://doi.org/10.1016/j.tree.2008.06.010
Sambrook J., Fritsch E.F., Maniatis T. 1989. Molecular Cloning: A Laboratory Manual. P. 10.51–10.67. Cold Spring Harbor: Cold Spring Harbor Laboratory Press.
Samchyshyna L., Hansson L.A., Christoffersen K. 2008. Patterns in the distribution of Arctic freshwater zooplankton related to glaciation history // Polar Biol. V. 31. P. 1427. https://doi.org/10.1007/s00300-008-0482-4
Smith E.A. 1896. On some fresh-water shells from the Island of Kolguev // Proceedings of the Malacological Society of London. V. 2. P. 104.
Smith E.P., Van Belle G. 1984. Nonparametric estimation of species richness // Biometrics. V. 40. P. 119.
Sousa R., Morais P., Antunes C., Guilhermino L. 2008. Factors affecting Pisidium amnicum (Müller, 1774; Bivalvia: Sphaeriidae) distribution in the River Minho Estuary: consequences for its conservation // Estuaries and Coasts. V. 31. P. 1198.
Sousa R., Ilarri M., Souza A.T. et al. 2011. Rapid decline of the greater European pea clam at the periphery of its distribution // Int. J. Limnology. V. 47. P. 211.
Spitsyn V.M., Bolotov I.N., Kondakov A.V. et al. 2021a. A new Norwegian Lemming subspecies from Novaya Zemlya, Arctic Russia // Ecologica Montenegrina. V. 40. P. 93. https://doi.org/10.37828/em.2021.40.8
Spitsyn V.M., Kondakov A.V., Froufe E. et al. 2021b. Complete mitochondrial genome of an Arctic Collared Lemming subspecies endemic to the Novaya Zemlya Archipelago, Russia // Ecologica Montenegrina. V. 40. P. 133. https://doi.org/10.37828/em.2021.40.12
Strelkov P., Nikula R., Väinölä R. 2007. Macoma balthica in the White and Barents Seas: properties of a widespread marine hybrid swarm (Mollusca: Bivalvia) // Molecular Ecology. V. 16. P. 4110–4127. https://doi.org/10.1111/j.1365-294x.2007.03463.x
Ter Braak C.J.F., Šmilauer P. 2002. CANOCO reference manual and CanoDraw for Windows user’s guide: software for canonical community ordination (v. 4.5). USA: Microcomputer Power.
Vinarskii M.V., Palatov D.M., Novichkova A.A. 2015. The first freshwater molluscs from Wrangel Island, Arctic Russia // Polar Res. V. 34. № 23889.
Vinarskii M.V., Bolotov I.N. Aksenova O.V. et al. 2021. Freshwater mollusks of the circumpolar Arctic: a review on their taxonomy, diversity and biogeography // Hydrobiologia. V. 848. P. 2891. https://doi.org/10.1007/s10750-020-04270-6
Vinarskii M.V., Kantor Yu.I. 2016. Analytical catalogue of fresh and brackish water molluscs of Russia and adjacent countries. Moscow: Severtsov Institute of Ecology and Evolution of RAS.
Weider L.J., Hobæk A. 2000. Phylogeography and arctic biodiversity: a review // Annales Zoologici Fennici. V. 37. P. 217.
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Перечень отсеквенированных образцов моллюсков и дополнительных последовательностей 16S рРНК, полученных из Генбанка (NCBI), использованных для построения медианной сети гаплотипов, с указанием регистрационного номера, кода образца, информации о местности и источнике данных
Инструменты
Биология внутренних вод


