Биология внутренних вод, 2022, № 6, стр. 749-758
Сообщества макрозообентоса малых тундровых озер северо-востока Европейской части России
О. А. Лоскутова a, *, М. А. Батурина a
a Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: loskutova@ib.komisc.ru
Поступила в редакцию 05.05.2022
После доработки 31.05.2022
Принята к публикации 15.06.2022
- EDN: WBKXNJ
- DOI: 10.31857/S0320965222060134
Аннотация
Донные сообщества ряда крупных озерных экосистем европейских тундр России относительно хорошо изучены, однако информации о зообентосе малых мелководных озер этой зоны все еще недостаточно. В работе представлены оригинальные сведения о таксономической структуре, видовом составе и количественному развитию сообществ макрозообентоса 26 малых озер Малоземельской и Большеземельской тундр (июль 2000–2014 гг.). По количественным показателям обилия водоемы схожи с другими малыми водоемами этих широт. Варьирование биомассы в широких пределах определяется в озерах разными доминирующими таксонами. Выявлен разнообразный видовой состав макрозообентоса. Наиболее богаты по составу видов олигохеты, моллюски и хирономиды, что в целом соответствует тренду, характерному для других водоемов арктических тундр.
ВВЕДЕНИЕ
Малые мелководные озера относятся к числу наиболее важных пресноводных экосистем мира (Oertli et al., 2005), поскольку характеризуются как резервуары биоразнообразия для поддержания на региональном уровне богатой и уникальной фауны (Williams et al., 2004; Labat et al., 2022). В сравнении с крупными озерными системами они в большей степени подвержены изменению климата и воздействию различных антропогенных факторов. Снижение разнообразия мелководных озер приводит к крупномасштабным потерям среды обитания для многих видов (Labat et al., 2022). Этот факт мотивирует развитие исследований, направленных на понимание фундаментальных закономерностей функционирования водных сообществ малых водоемов от локального до регионального масштаба (Oertli et al., 2010).
На территории европейской тундровой зоны России расположено огромное количество озер, большая часть которых относится к категории средних (0.5–1.5 км в диаметре) и малых (0.1–0.2 км) (Кравцова, 2009). Только в восточной части Большеземельской тундры насчитывается >6000 озер (Голдина, 1972). Такое обилие водоемов обусловлено сочетанием ряда физико-географических условий: мелко расчлененный рельеф с большим количеством впадин, неглубокое залегание водопроницаемых пород, обилие осадков, малое испарение, многолетняя мерзлота и заболоченные низменности (Румянцев, Драбкова, 2005), и различный генезис этих озер: ледниковые, пойменные, термокарстовые. В свою очередь, большое разнообразие морфометрических и гидрологических условий обусловливает широкий диапазон вариабельности их лимнических характеристик (Румянцев, Драбкова, 2005).
Донные беспозвоночные – важное структурное звено и значительный компонент вторичной продукции в водных экосистемах. Они участвуют в передаче энергии на верхние трофические уровни (Stoffels и др., 2005), будучи весомым источником пищи для рыб в разные периоды онтогенеза (Diehl, Kornijow, 1998; Kalff, 2001). Несмотря на возрастающий интерес исследователей к изучению малых водоемов (Куликова, Рябинкин, 2015; Заделенов и др., 2017; Shikhova et al., 2021; Epele et al., 2022), сведения о структуре, фауне и количественном развитии сообществ беспозвоночных в тундровых озерах, особенно малых, скудны и фрагментарны. В опубликованной недавно работе (Чертопруд и др., 2021) о сообществах макрозообентоса малых арктических озер Евразии отсутствуют сведения о донном населении подобных водоемов Малоземельской и Большеземельской тундр, на долю которых приходится большой сегмент арктических территорий. Это стало причиной для обобщения наших данных о сообществах макрозообентоса малых водоемов Печорской низменности.
Цель работы – дать характеристику таксономического состава и количественных показателей макрозообентоса малых тундровых водоемов европейского северо-востока России; сравнить эти характеристики между группами озер бассейнов разных рек; выявить особенности, отличающие фауну малых водоемов от других тундровых озер.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
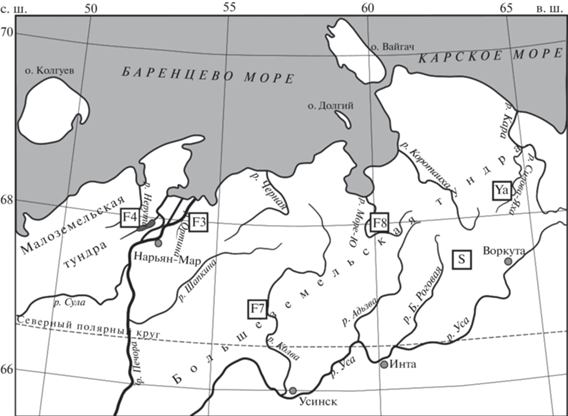
Район исследований (рис. 1, табл. 1) принадлежит к Малоземельской (бассейн р. Нерута) и Большеземельской тундрам (остальные озера), охватывает узкий широтный градиент между 67° и 68° с.ш. и значительную протяженность с запада на восток (54°–64° в.д.). Высота расположения озер над уровнем моря варьирует от трех (в бассейне р. Нерута) до 179 м (в бассейне р. Ярей-Ю). Озера Большеземельской тундры находятся в пределах зоны сплошной толщи мерзлых пород, Малоземельской тундры – в зоне островного распространения мерзлоты (Кравцова, 2009).
Таблица 1.
Характеристика исследованных тундровых водоемов
| Тип водоема | Дата отбора проб | Координаты, с.ш., в.д. | T, °C воды |
Площадь водного зеркала, км2 |
Глубина отбора проб | Тип грунта | Макрофиты |
|---|---|---|---|---|---|---|---|
| min–max | min–max | min–max | |||||
| Малоземельская тундра | |||||||
| F4 – Бассейн р. Нерута (n = 5) | |||||||
| Т | 09.07–12.07.2000 | 68°00.04′–68°00.53′; 52°23.74′–52°24.88′ |
14.5 17.5 |
0.014 2.0 |
1.3 6.0 |
Ил, песок |
Узкая кайма |
| Большеземельская тундра | |||||||
| F3 – Бассейн р. Ортина (n = 9) | |||||||
| П | 02.07–03.07.2000 | 67°55.09′–67°56.05′; 54°02.41′–54°02.60′ |
10.0 14.0 |
0.018 0.09 |
1.5 2.3 |
Ил, песок |
Хорошо развиты/ узкая кайма |
| Т | 04.07–05.07.2000 | 67°56.16′–67°57.17′; 53°56.37′–54°03.90′ |
10.5 15.7 |
0.015 0.84 |
1.0 1.5 |
Песок, ил, торф |
Узкая кайма/ хорошо развиты |
| F7 – Бассейн р. Колва (n = 2) | |||||||
| Т | 02.07.2001 | 67°07.86′, 56°41.82′ | 9.0 | 0.18 | 0.7 | Торф | Узкая кайма |
| П | 01.07.2001 | 67°08.75′, 56°41.28′ | 11.0 | 0.029 | 2.5 | Ил | Узкая кайма |
| F8 – Бассейн р. Море-Ю (n = 4) | |||||||
| Т | 08.07–10.07.2001 | 67°52.97′–67°53.80′; 59°40.16′–59°43.72′ |
8.6 10.4 |
0.05 0.80 |
1.0 6.0 |
Песок, валуны, Ил |
Узкая кайма/ хорошо развиты/ слабо развиты |
| S – Бассейн р. Б. Роговая, окрестности оз. Сяттей-Ты (n = 3) | |||||||
| Т | 09.07–11.07.2014 | 67°33.77′–67°34.36′; 62°41.17′–62°42.75′ |
10.4 11.9 |
0.026 0.15 |
3.2 7.4 |
Песок, валуны, ил, галька | Узкая кайма |
| Ya – Бассейн р. Ярей-Ю (n = 3) | |||||||
| Т | 22.07–27.07.2012 | 68°01.50′–68°10.54′; 64°29.16′–65°11.09′ |
18.4 20.7 |
0.04 0.28 |
2.5 3.5 |
Валуны, песок, ил |
Узкая кайма |
Полевые исследования зообентоса 26 малых водоемов проводились в разные временные периоды. В июле 2000–2001 гг. – на водосборах четырех рек: р. Ортина (F3), р. Нерута (F4), р. Колва (F7) и р. Море-Ю (F8) в рамках проекта ЕС SPICE (СПАЙС). В июле 2012 г. изучены озера (оз. № 3, Тройное и Круглое) в бассейне р. Ярей-Ю (Ya) – притоке второго порядка р. Кара; в июле 2014 г. – озера в районе оз. Сяттей-Ты, бассейн р. Б. Роговая (S).
На мягких грунтах макрозообентос собирали облегченным дночерпателем Петерсена (1/40 м2), на твердых грунтах – гидробиологическим скребком (длина лезвия 30 см, размер ячеи капронового сита 0.16 мм). После промывки пробы фиксировали 4%-ным формалином и далее обрабатывали стандартными методами (Методика …, 1975). Отбирали от трех до пяти проб в каждом озере, всего обработано 69 проб зообентоса. Одновременно со сбором гидробиологических проб измеряли температуру воды (ртутным термометром или портативным анализатором), описывали морфоэдафические характеристики биотопов.
Для характеристик структурных показателей развития макрозообентоса высчитывали численность и биомассу, частоту встречаемости таксономической группы (семейства/рода/вида) в пробе, озере или группе озер. Таксон считали редким, если встречали в ≤5% проб. Для оценки сходства и различий макрозообентоса изученных водоемов выполнен кластерный анализ методом Варда (Ward`s method), в качестве меры различия между кластерами использовали Eвклидово расстояние. Дендрограммы строили по численности и биомассе таксономических групп. Для попарного сравнения выборок численности и биомассы макрозообентоса применяли непараметрический статистический U-критерий Манна–Уитни (для независимых выборок). Для сравнения видовых составов групп, описанных для всех или большинства групп озер, использовали коэффициент общности Чекановского–Серенсена IS (Шитиков и др., 2005). Для выявления зависимости количественных показателей макрозообентоса от химических параметров воды использовали работу (Даувальтер, Холопцева, 2008), где приведены данные о гидрохимии озер бассейнов рек Ортина, Нерута, Колва, Море-Ю. Вычисляли коэффициент ранговой корреляции Спирмена (r). Зависимость считали достоверной при р <0.05. Для статистической обработки и визуализации данных использовали программные пакеты Excel и Statistica 6.0 для Windows (StatSoft).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Все исследованные водоемы по происхождению делятся на термокарстовые и пойменные. Первая группа озер характеризуется простой береговой линией, преимущественно округлой формой, низкими торфяными берегами, часто заболоченными, небольшой площадью водного зеркала, незначительной глубиной, невысокими температурами воды летом (табл. 1).
Стратификация отсутствует, зимой озера обычно промерзают до дна. Большая часть исследованных озер сточные (в бассейне Море-Ю – бессточные), по берегам окружены зарослями невысоких кустарниковых ив. Донные грунты разнообразны: в литорали песчаные или валунные, часто заиленные, в профундали – илистые. Прибрежья зарастают осокой, арктофилой и рдестами, на поверхности воды некоторых водоемов плавают подушки отмершего мха и водорослей, иногда встречается сплавина.
Пойменные озера (бассейн р. Ортина и озеро в бассейне р. Колва) расположены в понижениях рельефа между холмами. Характеризуются сложной формой с небольшими заливами, заболоченными пологими берегами, отсутствием литорали, относительно большими глубинами. Озера имеют постоянный либо временный сток в реку. Донные грунты однообразны, представлены илами. Макрофиты (осоки, вахта, сабельник, ежеголовник, рдесты) хорошо развиты.
Количественное развитие макрозообентоса. Средняя численность зообентоса термокарстовых озер колебалась в пределах 0.8–5.6 тыс. экз./м2; биомасса была низкой и, как правило, в большинстве озер не превышала 5.0 г/м2 (табл. 2). Исключением были озера в бассейне р. Ярей-Ю, где высокая биомасса определялась присутствием в пробах многочисленных представителей моллюсков, гаммарусов и щитней. В большинстве исследованных озер высокой численности достигали олигохеты и хирономиды (табл. 2), в некоторых озерах (бассейн рек Ортина и Б. Роговая (оз. Сяттей-Ты)) отмечали значительную численность моллюсков. По биомассе доминировали разные группы беспозвоночных, чаще других преобладали олигохеты, моллюски, пиявки, хирономиды, реже – амфиподы и листоногие раки; на твердых грунтах была большая доля личинок вислокрылок, ручейников, либо жуков.
Таблица 2.
Количественное развитие макрозообентоса и доминирующие группы термокарстовых озер разных речных бассейнов
| Бассейн реки | Средняя численность | Средняя биомасса | ||
|---|---|---|---|---|
| тыс. экз./м2 | доминирующая группа, % min–max в озере | г/м2 | доминирующая группа, % min–max в озере | |
| Ортина | 1.4 ± 0.2 | Oligochaeta 2.8–33.9 Mollusca 4.4–75.0 Chironomidae 4.9–85.3 |
3.2 ± 1.1 | Hirudinea 0.0–30.1 Mollusca 2.6–47.3 Conchostraca 4.9–50.1 Chironomidae 0.7–19.3 |
| Нерута | 5.5 ± 3.4 | Oligochaeta 0.9–22.0 Mollusca 0.0–65.0 Chironomidae 19.1–93.8 |
3.6 ± 2.0 | Oligochaeta 0.0–17.9 Mollusca 0.0–53.1 Chironomidae 7.0–39.5 |
| Колва | 3.6 ± 2.5 | Oligochaeta 8.3–44.9 Chironomidae 55.1–78.0 |
5.0 ± 3.1 | Oligochaeta 2.5–72.6 Chironomidae 27.4–69.2 |
| Б. Роговая | 0.8 ± 0.3 | Oligochaeta 26.8–47.9 Mollusca 8.9–30.1 Chironomidae 17.8–38.9 |
2.8 ± 0.5 | Oligochaeta 3.6–20.7 Mollusca 1.2–51.3 Amphipoda 0.0–50.2 |
| Ярей-Ю | 7.1 ± 0.5 | Oligochaeta 13.9–50.0 Chironomidae 43.7–60.4 |
13.6 ± 3.5 | Oligochaeta 1.7–32.9 Mollusca 15.0–34.6 Notostraca 0.0–31.1 Amphipoda 0.3–64.3 |
Примечание. Число исследованных озер см. табл. 1.
Зообентос пойменных озер по количественным характеристикам достоверно (p ≤ 0.05) не отличался от зообентоса термокарстовых водоемов: численность колебалась в пределах 3.1–5.5 тыс. экз./м2, биомасса – 3.0–8.0 г/м2. По численности здесь тоже доминировали хирономиды (31.8–67.3%), по биомассе – пиявки (41.5%), моллюски (25.1–45.2%) и хирономиды (25.9–76.4%).
Для большинства исследованных озер (водосборы рек Нерута, Ортина, Колва, Море-Ю) не была выявлена достоверная зависимость между химическими параметрами и количественными показателями макрозообентоса в целом, как и для большей части таксонов. Исключением были только моллюски и пиявки, для численности и биомассы которых зафиксирована умеренная отрицательная корреляция с N${\text{H}}_{4}^{ + },$ Nобщ, P${\text{O}}_{4}^{{3 - }},$ Poбщ, ХПК: r (–0.43…–0.50; р < 0.009–0.02 – для первой группы озер и r –0.43…–0.51; р < 0.006–0.02 для второй).
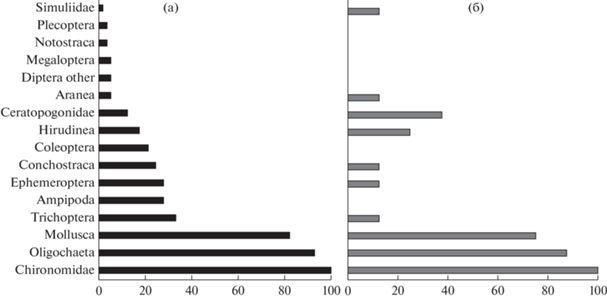
Встречаемость и состав фауны таксономических групп. В составе зообентоса озер обнаружено 16 таксономических групп макрозообентоса (от семи до 11 групп в отдельном озере): 16 в термокарстовых и 10 в пойменных озерах. Во всех группах озер присутствовали хирономиды (рис. 2), на втором месте по встречаемости были олигохеты и моллюски. К редким группам в термокарстовых озерах относились пиявки, щитни, пауки, веснянки, вислокрылки и мошки, часть из которых не отмечена в пойменных. Наиболее разнообразными по составу групп были прибрежные зоны водоемов – от семи до 11 групп макрозообентоса (чаще восемь). В центральной зоне большинства озер встречалось три–пять групп, при этом в 71% проб, отобранных в центре озер на илистых грунтах, отмечены только олигохеты, моллюски и хирономиды, редко – амфиподы и цератопогониды.
Рис. 2.
Ранжирование по частоте встречаемости (%) таксономических групп макрозообентоса в термокарстовых (а) и пойменных (б) озерах.
Наборы данных о составе фауны, лежащие в основе анализа, представленного в статье, хранятся в системах GBIF (Baturina, Loskutova, 2022) и Mendeley Data11.
В фауне изученных водоемов отмечено 36 таксонов олигохет, из них 31 определен до видового статуса. Наиболее разнообразно по числу видов подсемейство Naidinae – 16 видов, на втором месте по разнообразию – подсемейство Tubificinae: девять видов и две формы, не определенные до видового статуса. Остальные семейства представлены одним–двумя видами. В большинстве озерных систем встречались Tubifex tubifex (Müller), Spirosperma ferox Eisen, Uncinais uncinata (Oersted), Lumbriculus variegatus (Müller) и представители сем. Enchytraeidae. На долю редких видов приходилось 27.8% фауны. Наибольшим числом видов олигохет характеризовалась группа термокарстовых озер (34), в пойменных отмечено только 13 видов. Фауна олигохет этих двух групп водоемов демонстрировала низкое сходство (IS 29%). В структуре общего бентоса изученных водоемов доля олигохет была значительна и достигала до 38% общей численности и 25.9% общей биомассы макрофауны. В большинстве озер до 80% численности малощетинковых червей приходилось на представителей подсемейства Naidinae и Tubificinae. В водоемах р. Ортина по численности преобладали виды подсемейства Naidinae (44.6%), р. Нерута – сем. Enchytraeidae (57.9%), р. Колва – подсемейства Tubificinae (69.8%). Структура доминирующих комплексов олигохет в изученных группах озер весьма сходна. Наиболее разнообразный состав доминантов отмечали в водоемах бассейнов рек Ортина и Нерута, превалировали представители подсемейства Naidinae.
В озерах близ оз. М. Сяттей-Ты на илистом грунте зарегистрировано три вида пиявок из широко распространенных эврибионтных родов Glossiphonia и Theromyzon и представители рода Erpobdella (Baturina et al., 2020). В одном из термокарстовых озер бассейна р. Ортина в биомассе доминировал вид Haemopis sanguisuga (L.). В некоторых пойменных озерах пиявки Erpobdella octoculata (L.), Glossiphonia complanata (L.)) на заиленном песчаном грунте показывали высокую встречаемость в пробах (рис. 2) и достигали >50% общей биомассы зообентоса.
В исследованных озерах двустворчатых моллюсков (Bivalvia) представляли 11 видов из семи родов: Sphaerium, Pisidium, Euglesa, Pseudeupera, Amesoda, Cingulipisidium, Henslowiana. Из брюхоногих моллюсков (Gastropoda) присутствоавал лишь один вид Cincinna frigida (Westerlund).
Амфиподы чаще встречались в небольших заросших водной растительностью водоемах. В малых озерах возле оз. Сяттей-Ты обнаружена реликтовая амфипода Pallasea quadrispinosa Sars, а также Gammarus lacustris Sars. Особенность тундровых водоемов в бассейнах рек Ортина и Нерута – обитание в некоторых из них конхострак Cyzicus tetracerus (Krynicki) и Lynceus brachyurus Müller. В бассейне р. Ортина в небольших постоянных тундровых водоемах отмечено массовое развитие бранхиоподы Polyartemia forcipata Fischer. Одно из озер бассейна р. Ортина (F3-3) отличалось наличием щитней Lepidurus arcticus (Pallas) и гаммарусов Gammarus lacustris. В большом количестве щитни этого вида встречены также в озерах бассейна р. Ярей-Ю.
Разнообразие амфибиотических насекомых в исследованных озерах было невелико: отмечены представители шести отрядов1. Распространение их в разных группах озер сильно варьировало. Так, личинок поденок отмечали только в озерах бассейнов рек Нерута, Ортина и Колва. На заиленных с растительным детритом грунтах прибрежья озер поденки были представлены преимущественно одним видом Baetis macani Kimmins. Веснянки встречались только в бассейне р. Колва и близ оз. Сеттяй-Ты и были представлены двумя родами – Nemoura и Capnia. Среди ручейников наиболее многочисленным был род Asynarchus, редко в озерах встречались личинки родов Mollanodes, Molanna, Oecetis, Limnephilus и Mistacides. Личинки и имаго жуков относились к семи родам: Agabus, Ditiscus, Haliplus, Gyrinus, Hydroporus, Stictotarsus, Ilibius. Озера бассейна р. Ортина характеризовались наибольшей видовой насыщенностью этого отряда. Двукрылые, преимущественно личинки хирономид, преобладали среди насекомых по встречаемости и количественным характеристикам. В малых озерах дельты р. Печора (Kuzmina, 2001) и прилегающих тундр обнаружено 69 таксонов личинок и куколок хирономид из шести подсемейств. Большинство видов (55%) относились к подсемейству Chironominae. Наиболее распространены во всех изученных озерах виды родов Procladius, Cladopelma, Chironomus. В зарослях макрофитов в прибрежье озер обнаружены виды, относящиеся к родам Psectrocladius (четыре вида), Orthocladius (три вида), а также Parakiefferiella coronata (Edwards). Из других двукрылых встречены также мокрецы (Ceratopogonidae) и реже мошки (Simuliidae).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Среди особенностей водоемов Субарктики отмечают снижение разнообразия таксонов макрозообентоса за счет исчезновения ряда групп насекомых и отсутствия крупных моллюсков (Чертопруд и др., 2021). Также из-за слабого развития фитали водоемов наблюдается сокращение числа ряда прибрежно-водных таксонов бентоса. Исследованные водоемы относятся к зоне гипоарктических тундр. В них отмечено от 10 до 16 таксономических групп макрозообентоса в зависимости от генезиса озер, наиболее разнообразен состав термокарстовых водоемов, благодаря развитию в них различных биотопов. Все водоемы сходны по составу доминирующих групп: моллюсков, хирономид, олигохет. О роли олигохет как модельной группы для оценки биоразнообразия тундровых водоемов упоминалось ранее (Baturina, Fefilova, 2021). Видовой состав олигохет исследованных пойменных водоемов отличается своеобразием: сходство его с таковым других тундровых озер – оз. Б. Харбей и его придаточных водоемов, малых водоемов близ оз. Б. Харбей (Baturina et al., 2020), малых водоемов дельты р. Печора (Baturina, Fefilova, 2021) – сравнительно низкое (IS 25–29%). При этом фауна термокарстовых озер имела умеренное сходство с фауной перечисленных водоемов (IS 42–45%).
По данным В.А. Даувальтера и Е.В. Хлопцевой (2008), термокарстовым тундровым водоемам присущи более высокие концентрации N${\text{H}}_{4}^{ + }$, Nобщ, P${\text{O}}_{4}^{{3 + }}$, Pобщ, по сравнению с пойменными. Выявленная достоверная отрицательная корреляция биогенов с численностью и биомассой моллюсков и пиявок может быть причиной максимального развития этих таксонов в пойменных водоемах.
Фаунистической особенностью считается обитание в малых тундровых озерах близ оз. Сяттей-Ты (бассейн р. Б. Роговая) реликтовой амфиподы Pallasea quadrispinosa Sars. При этом, в исследованных озерах не регистрировали совместных находок этого вида с Gammarus lacustris. Ранее (Батурина и др., 2014) установлено обитание в крупном оз. Б. Харбей палласового рачка и отсутствие гаммаруса, однако в небольших придаточных водоемах этого озера встречены только гаммарусы. В Вашуткиных озерах палласов рачок не отмечен (Зверева и др., 1966). Во многих озерах амфиподы вообще не были обнаружены. Отсутствие бокоплавов в ряде тундровых озер было отмечено и на плато Путорана (Заделенов и др., 2017) в отличие мелких тундровых водоемов Северной Якутии, где они преобладают во всех группах озер ранним летом (Бурнашева, Потапова, 2019), что соответствует их экологическим характеристикам как стенотермных холодолюбивых организмов, распространенных в высокоширотных озерах. Среди других ракообразных следует отметить присутствие в отдельных озерах щитней, бранхиопод и конхострак. Все эти гидробионты хорошо приспособлены к суровым маргинальным условиям (Kerfoot, Lynch, 1987) и распространены в северных водоемах (Christoffersen, 2001). В наших водоемах значительной численности конхостраки достигали в чистых безрыбных озерах, которые характерны для изучаемой территории (Пономарев и др., 2001; Rautio et al., 2011).
Увеличение роли хирономидных насекомых в арктических тундрах указывалось ранее как тенденция формирования донных сообществ этой зоны (Wetzel, 2001; Биоресурсы…, 2004). Состав родов, выявленных для исследованной территории, соответствовал родам, указываемым как характерные для арктических водоемов (Walker, Mathewes, 1989). Способность этих насекомых жить в подледных условиях в бескислородной среде (Hershey, Lamberti, 2001) способствует развитию хирономид в арктических озерах (Hilsenhoff, 2001). Присутствие других групп амфибиотических насекомых в составе бентоса озер было спорадическим. Оно могло быть связано как вытеснением их из береговой зоны другими таксонами, например, гаммарусом (Чертопруд и др., 2021), либо отсутствием зон макрофитов в озерах. Низкое видовое богатство EPT таксонов на фоне преобладания олигохет и хирономид характерно для водоемов циркумполярной зоны (Lento et al., 2021). Ряд таксонов, например, личинки стрекоз вовсе не был обнаружен. Ранее отсутствие этой группы отмечали для донных сообществ в системе Вашуткиных и Харбейских озер (Зверева и др., 1966; Батурина и др., 2014), озерах приморской тундры (Лоскутова, Фефилова, 1996).
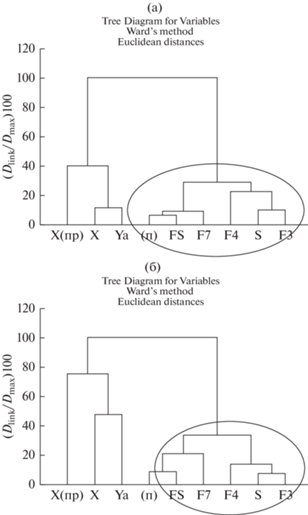
Суммарное обилие макробентоса в озерах гипоарктической зоны указывается как высокое относительно таежной зоны и зоны Высокой Арктики (Чертопруд и др., 2021). По численности исследованные малые озера достоверно (p < 0.05) отличались от крупного тундрового водоема (оз. Б. Харбей) как за счет меньшего числа групп в большинстве малых озер, так и за счет более высокой численности сходных доминирующих таксонов в водоеме с большей площадью и глубиной (Батурина и др., 2014). Для биомассы такой тенденции не выявлено. По составу и значимости групп в численности и биомассе бентоса большая часть малых водоемов объединилась в отдельный кластер (рис. 3). Однако по численности к Харбейским озерам присоединились озера бассейна р. Ярей-Ю (рис. 3а), по биомассе – озера бассейна р. Море-Ю (рис. 3б). Это объясняется высокими показателями численности и биомассы бентоса в этих группах озер и наибольшими среди всех исследованных водоемов долями доминирующих групп: олигохет, моллюсков и хирономид, а также включением в число доминантов амфипод. Биомасса макрозообентоса, в целом, была сравнима с тундровыми озерами этой зоны других регионов (Степанов, 2017; Бурнашева, Потапова, 2019; Чертопруд и др., 2021). Близкие значения биомассы даны для малых водоемов приморских районов Большеземельской тундры (Лоскутова, Фефилова, 1996; Лоскутова, Кононова, 2015) и придаточных водоемов системы Харбейских озер (Батурина и др., 2014).
Рис. 3.
Дендрограммы сходства состава таксономических групп макрозообентоса по численности (а) и биомассе (б) в исследованных озерах (обозначения, как в табл. 1), оз. Б. Харбей (Х) и придаточных озерах Б. Харбея (Х(пр)).
Выводы. Обилие макрозообентоса исследованных малых тундровых озер преимущественно невысокое. Средняя численность беспозвоночных колебалась в широких пределах и отличалась от таковой крупных озер. Основу численности представляли хирономиды, олигохеты и моллюски. Биомасса макрозообентоса была низкой и соответствовала таковой других озер гипоарктической зоны при доминировании олигохет, моллюсков и хирономид. В ряде озер этот показатель превышал верхний предел варьирования за счет преобладания в бентосе иных групп – гаммарусов и щитней со значительной численностью, например, в озерах бассейна р. Ярей-Ю.
Общие черты фауны, выявленные ранее для малых арктических и субарктических озер Палеарктики, – отсутствие крупных двустворчатых моллюсков, клопов, стрекоз и низкое разнообразие таксонов группы EPT – характерны и для исследованных в работе малых озер Большеземельской и Малоземельской тундр. По ряду групп отмечено своеобразие фауны в пойменных озерах. В бедных растительностью и рыбой водоемах в ряде случаев обитал реликтовый вид амфипод Pallasea quadrispinosa, не встреченный в озерах с преобладанием других амфипод. Выявленные особенности малых озер Печорской низменности соответствуют общим тенденциям различий макрозообентоса озер высоких широт. Полученные сведения дают возможность более детального обсуждения закономерностей структуры и фаунистического разнообразия озерных сообществ высоких широт с точки зрения их типологии и генезиса.
Список литературы
Батурина М.А., Лоскутова О.А., Щанов В.М. 2014. Структура и распределение зообентоса озер Харбейской системы // Журн. Сиб. фед. ун-та. Сер. Биология. Т. 7. № 4. С. 332.
Батурина М.А. Фефилова Е.Б. Оценка уровня биоразнообразия пресноводных экосистем дельты р. Печоры по структурным показателям донных таксоценозов Cladocera, Copepoda и Oligoсhaeta // Биология внутр. вод. № 6. С.597 https://doi.org/10.31857/S0320965221060036
Биоресурсы водных экосистем Полярного Урала. 2004. Екатеринбург: УрО РАН.
Бурнашева А.Р., Потапова Н.К. 2019. Сообщества макрозообентоса тундровых водоемов в низовьях р. Индигирка (Северная Якутия) // Acta Biologica Sibirica. 5(2). С. 40. https://doi.org/10.14258/abs.v5.i2.5931
Голдина Л.П. 1972. География озер Большеземельской тундры. Ленинград: Наука.
Даувальтер В.А., Хлопцева Е.В. 2008. Гидрологические и гидрохимические особенности озер Большеземельской тундры // Вестник МГТУ. Т. 11. № 3. С. 407.
Заделенов В.А., Дубовская О.П., Бажина Л.В. и др. 2017. Новые сведения о биоте некоторых озер западной части плато Путорана // Журн. Сибир. фед. ун-та. Биология. Т. 10 (1). С. 26. https://doi.org/10.17516/1997-1389-0010
Зверева О.С. 1966. Бентос и общие вопросы гидробиологии Вашуткиных озер // Гидробиологическое изучение и рыбохозяйственное освоение озер Крайнего Севера СССР. М.: Наука. С. 112.
Кравцова В.И. 2009. Распространение термокарстовых озер в России в пределах зоны современной мерзлоты // Вестн. Мос. ун-та. Сер. 5. География. № 3. С. 33.
Куликова Т.П., Рябинкин А.В. 2015. Зоопланктон и макрозообентос малых водоемов разных типов ландшафтов Южной Карелии // Тр. Карельск. науч. центра РАН. № 6. С. 47.
Лоскутова О.А., Кононова О.Н. 2015. Гидробиологическая характеристика тундровой реки восточно-европейского арктического региона // Изв. Коми научного центра УрО РАН. Вып. 4(24). Сыктывкар. С. 38.
Лоскутова О.А., Фефилова Е.Б. 1996. Гидробиологическая характеристика озер северной части Большеземельской тундры / Некоторые подходы к организации экологического мониторинга в районах разведки, добычи и транспортировки нефти и газа. Сыктывкар // Тр. Коми научного центра УрО Российской АН. № 147. С. 125.
Методика изучения биогеоценозов внутренних водоемов. 1975. Москва: Наука.
Пономарев В.И., Патова Е.Б., Стенина А.С. и др. 2001. Биоразнообразие в водоемах среднего течения р. Нерута (бассейн Колоколковой губы Баренцева моря): Тез. докл. междунар. конф. “Биоразнообразие Европейского Севера”. Петрозаводск: Карельский научный центр РАН. С. 139.
Румянцев В.А., Драбкова В.Г. 2005. Экологические проблемы озер Крайнего Севера, причины и решения // Экологическое состояние континентальных водоемов северных территорий. Санкт-Петербург: Наука. С. 28.
Степанов Л.Н. 2017 Зообентос водоемов и водотоков бассейна реки Яраяха (Южный Ямал, Ямало-Ненецкий автономный округ) // Фауна Урала и Сибири. № 1. С. 116.
Чертопруд М.В., Крыленко С.В., Лукиных А.И. и др. 2021. Особенности сообществ макрозообентоса малых арктических озер Евразии // Биология внутр. вод. № 4. С. 378. https://doi.org/10.31857/S0320965221030050
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д. 2005. Количественная гидроэкология: методы, критерии, решения. Кн. 1. Москва: Наука.
Baturina M.A., Kaygorodova I.A., Loskutova O.A. 2020. New data on species diversity of Annelida (Oligochaeta, Hirudinea) in the Kharbey lakes system, Bolshezemelskaya tundra (Russia) // ZooKeys. Iss. 910. P. 43. https://doi.org/10.3897/zookeys.910.48486
Baturina M., Loskutova O. 2022. The fauna of Oligochaeta (Annelidae) in the shallow tundra lakes (North-east of the European part of Russia). Version 1.1. Institute of Biology of Komi Scientific Centre of the Ural Branch of the Russian Academy of Sciences. Sampling event dataset. https://doi.org/ accessed via GBIF.org on 2022-03-29https://doi.org/10.15468/wyjxb6
Christoffersen K.S. 2001. Predation on Daphnia pulex by Lepidurus arcticus // Hydrobiologia. V. 442. P. 223. https://doi.org/10.1023/A:1017584928657
Diehl S., Kornijow R. 1998. Influence of submerged macrophytes in trophic interactions among fish and macroinvertebrates // The structuring role of submerged macrophytes in lakes. Ecological Studies 131. Springer. 24.
Epele L.B., Grech M.G., Williams-Subiza E.A. et al. 2022. Perils of life on the edge: climatic threats on global diversity patterns of wetland macroinvertebrates // Science of the Total Environment. V. 820. P. 153052. https://doi.org/10.1016/j.scitotenv.2022.153052
Hershey A.E., Lamberti G.A. 2001. Aquatic insect ecology // Ecology and classification of North American freshwater invertebrates. San Diego, CA: Acad. Press.
Hilsenhoff W.L. 2001. Diversity and classification of insects and collembolan // Ecology and classification of North American freshwater invertebrates. 2 ed. San Diego: Acad. Press.
Kalff J. 2001. Limnology: inland water ecosystems. New York: Prentice-Hall.
Kerfoot W.C., Lynch M. 1987. Branchiopod communities: associations with planktivorous fish. Predation // Direct and Indirect Impacts on Aquatic Communities. Hanover: University Press of New England.
Kuzmina Ya. 2001. Distribution, phenologya and habitat characteristics of Chironomidae (Diptera) of the northeastern part of European Russia // Norw. J. Entomol. V. 48. P. 199.
Labat F., Piscart Ch., Thièbaut G. 2022. Invertebrates in small shallow lakes and ponds: a new sampling method to study the influence of environmental factors on their communities // Aquat. Ecol. https://doi.org/10.1007/s10452-021-09939-1
Lento J., Culp J., Levenstein B. et al. 2021. Temperature and spatial connectivity drive patterns in freshwater macroinvertebrate diversity across the Arctic // Freshwater Biol. V. 67. P. 159. https://doi.org/10.1111/fwb.13805
Oertli B., Biggs J., Cereghino R. et al. 2005. Conservation and monitoring of pond biodiversity: introduction // Aquatic Conserv. Mar. Freshwater Ecosyst. V. 15. P. 535. https://doi.org/10.1002/aqc.752
Oertli B., Céréghino R., Biggs J. et al. 2010. Pond Conservation in Europe // Developments in Hydrobiology. V. 210. C 394. Berlin: Springer. https://doi.org/10.1007/s10750-007-9225-8
Rautio M., Dufresne F., Laurion I. et al. 2011. Shallow freshwater ecosystems of the circumpolar Arctic // Ecoscience. V. 18. № 3. P. 204. https://doi.org/10.2980/18-3-3463
Shikhova T.G., Scopin E.A., Bolshakov R.G. 2021. Zooindication of water bodies within petroleum industrial territories of the Bolshezemelskaya tundra // Transactions of Papanin Institute for Biology of Inland Waters RAS. № 95. P. 83. https://doi.org/10.47021/0320-3557-2021-83-92
Stoffels R.J., Clarke K.R., Closs G.P. 2005. Spatial scale and benthic community organization in the littoral zones of large oligotrophic lakes: potential for cross-scale interactions // Freshwater Biol. V. 50. P. 1131.
Walker I.R., Mathewes R.W. 1989. Chironomid (Diptera) remains in surficial lake sediments from the CanadianCordillera: analysis of the fauna across an altitutional gradient // J. Paleolimnology. V. 2. P. 61.
Wetzel R.G. 2001. Limnology: lake and river ecosystems. 3 ed. Elsevier Science (US). San Diego, CA: Acad. Press.
Williams P., Whitfield M., Biggs J. et al. 2004. Comparative biodiversity of rivers, streams, ditches and ponds in an agricultural landscape in Southern England // Biol. Cons. V. 115. P. 329. https://doi.org/10.1016/S0006-3207(03)00153-8
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод