Биология внутренних вод, 2022, № 6, стр. 775-792
Выживаемость и смертность в поселениях морских двустворчатых моллюсков в условиях ненарушенной среды залива (Белое море)
А. В. Герасимова a, *, Н. В. Максимович a, Н. А. Филиппова a
a Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: agerasimova64@mail.ru
Поступила в редакцию 16.05.2022
После доработки 01.06.2022
Принята к публикации 15.06.2022
- EDN: LATFRS
- DOI: 10.31857/S0320965222060067
Аннотация
Работа посвящена изучению пространственно-временной изменчивости смертности в 19 поселениях 9 видов двустворчатых моллюсков (Bivalvia), широко распространенных в литоральной и сублиторальной зонах Керетского архипелага (Кандалакшский залив, Белое море). Многолетние наблюдения за динамикой размерно-возрастного состава поселений (1989–2014 гг.) позволили построить таблицы выживания, дающие возможность анализа повозрастного распределения смертности в поселениях Bivalvia, и соответственно ее причин на разных этапах жизненного цикла. В нескольких случаях удалось проследить за судьбой отдельных генераций на протяжении всего их жизненного цикла и построить когортные таблицы выживания, что беспрецедентно для свободноживущих неприкрепленных морских донных беспозвоночных. Для большинства изучаемых объектов впервые получены характеристики смертности, зарегистрированы значительные колебания в уровне элиминации особей разного возраста, определены их основные причины. Выявлено, что средняя (независимо от возраста) годовая скорость элиминации особей весьма чувствительна к окружающей среде и может служить интегральной оценкой условий существования моллюсков. Для отдельных представителей беломорских Bivalvia этот показатель варьировал в 1.5–2 раза в разных поселениях одного и того же вида. В поселениях беломорских моллюсков показатели смертности особей разного возраста различались, как правило, в десятки раз (от 0.04 до 0.92 год–1). Основное влияние на выживаемость особей оказывали степень защищенности вида, внутривидовые отношения и старение.
ВВЕДЕНИЕ
Динамика численности поселений морских Bivalvia формируется как отражение в основном двух процессов: пополнения (молодью и мигрантами) и смертности. Межгодовые флуктуации в уровне пополнения поселений многих видов двустворчатых моллюсков широко известны (Petersen, 1978; Садыхова, 1982; Commito, 1982; Murawski et al., 1982; Brousseau, Baglivo, 1984; Луканин и др., 1986, 1990; Steingrimsson, Thorarinsdottir, 1995; Honkoop et al., 1998; Flach, 2003; Beukema, Dekker, 2005; Powell, Mann, 2005) и определены, как правило, не столько численностью появившейся в местообитаниях молоди, сколько ее выживаемостью в течение первого года (Beukema et al., 1998, 2001; Hunt et al., 2003; Strasser et al., 2003; Bowen, Hunt, 2009; Gerasimova, Maximovich, 2013; Gerasimova et al., 2021). Соответственно определяющее значение в динамике численности поселений моллюсков приобретают эффекты выживания молоди зимой и снижения численности особей в последующих возрастных группах. Однако, если процессы выживания молоди в течение первого года жизни в поселениях многих видов Bivalvia достаточно активно исследовали (Bachelet, 1986; Elmgren et al., 1986; Armonies, Hellwig-Armonies, 1992; Beukema, 1993; Armonies, 1996; Hunt, Scheibling, 1997; Бурковский и др., 1998; Beukema et al., 1998, 2001; Strasser, Günther, 2001; Hiddink et al., 2002; Strasser, 2002; Flach, 2003; Hunt et al., 2003; Philippart et al., 2003; Strasser et al., 2003; Beukema, Dekker, 2005, 2007; Bowen, Hunt, 2009; Green et al., 2009, 2013; Beukema, Dekker, 2014; Clements et al., 2016; Clements, Hunt, 2017; Beal et al., 2018), то особенности элиминации особей других возрастов для многих представителей данной группы остаются слабоизученными или неизвестными.
Следует отметить, что в большинстве работ по изучению закономерностей элиминации особей в поселениях двустворчатых моллюсков обычно оценивают среднегодовой уровень смертности в возрастных группах как параметр экспоненциальной модели (Petersen, 1978; Brey et al., 1990; NEFSC, 1995; Kilada et al., 2007; Begum et al., 2010). При этом, как правило, не проверяют, насколько представление о смертности как константе на протяжении жизненного цикла животных соответствует реальной ситуации (а в основе модели лежит предположение о стационарности биосистемы).
Наиболее удобной формой представления данных о выживаемости особей разного возраста служат таблицы выживания, построение которых напрямую связано с оценкой межгодовых изменений возрастной структуры поселений. Слабая изученность процессов выживаемости и смертности в поселениях большинства видов морских двустворчатых моллюсков в значительной степени обусловлена проблемами определения точного возраста Bivalvia и, следовательно, параметров возрастной структуры поселений в каждый момент наблюдения. К настоящему времени таблицы выживания построены только для нескольких представителей морского бентоса: усоногих раков Chathamulus stellatus (Poli, 1791), Balanus glandula Darwin, 1854 (Connell, 1961, 1970), брюхоногих моллюсков Nucella lapillus (L., 1758) (Frank, 1969), Conus pennaceus Born, 1778 (Perron, 1983), двустворчатых моллюсков Tapes phillipinarum (A. Adams & Reeve, 1850) (Yap, 1977), Gemma gemma (Totten, 1834) (Weinberg, 1985), Mya arenaria L., 1758 (Gerasimova et al., 2021) и немногих других.
С начала 80-х гг. прошлого века студенты и сотрудники кафедры ихтиологии и гидробиологии биологического факультета Санкт-Петербургского государственного университета проводят долговременные наблюдения за динамикой размерно-возрастной структуры поселений нескольких массовых видов Bivalvia на Белом море (Герасимова, Максимович, 2009; Gerasimova, Maximovich, 2013). В результате удалось собрать информацию для построения таблиц выживания, дающих возможность анализа повозрастного распределения смертности в поселениях, и соответственно ее причин на разных этапах жизненного цикла животных.
Цель данного сообщения – анализ пространственно-временной изменчивости показателей смертности в беломорских поселениях двустворчатых моллюсков.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
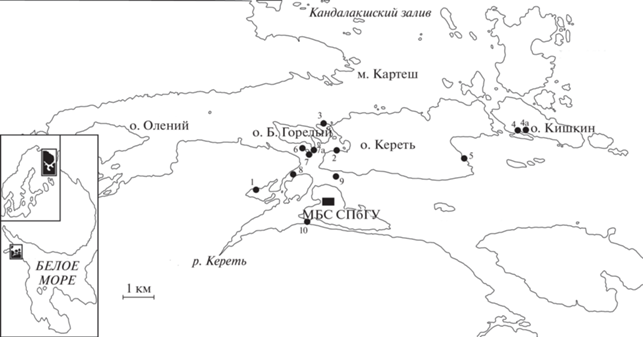
Район исследования и сбор материала. Материал собирали на базе Морской биологической станции Петербургского университета (МБС СПбГУ), расположенной в устье губы Чупа Кандалакшского залива (Белое море). Объекты исследования – 19 поселений 9 видов Bivalvia, располагающихся на 10 участках от средней литорали до глубины 40 м (табл. 1, рис. 1).
Таблица 1.
Основные объекты наблюдения
| Вид | Число участков | Число поселений | Глубина, м | Период наблюдений, годы |
|---|---|---|---|---|
| Mya arenaria L., 1758 | 4 | 7 | Средняя литораль–нижняя литораль | 1989–2014 |
| Macoma balthica (L., 1758) | 2 | 5 | Средняя литораль–верхняя сублитораль (0.5 м) | 1979–2012 |
| Mytilus edulis L., 1758 | 1 | 1 | Нижняя литораль | 1989–1992 |
| Arctica islandica (L., 1767) | 1 | 1 | 5–15 | 1984–2003 |
| Macoma calcarea (Gmelin, 1791) | 1 | 1 | 10–18 | 1989–2012 |
| Serripes groenlandicus (Mohr, 1786) | 1 | 1 | 4–6 | 1989–2005 |
| Musculus niger (J.E. Gray, 1824) | 1 | 1 | 6–10 | 1989–1993 |
| Yoldia hyperborea (Gould, 1841) | 1 | 1 | 38–40 | 1989–1996 |
| Portlandia arctica (Gray, 1824) | 1 | 1 | 15–18 | 1989–1993 |
Рис. 1.
Карта-схема района исследований. ⚫ – участки многолетних наблюдений (1‒10, 4а, 7а). МБС СПбГУ – Морская биологическая станция Санкт- Петербургского гос. ун-та.
Выбранные участки многолетних наблюдений представляли типичные местообитания для анализируемых видов в условиях Белого моря. Наблюдения проводили с интервалом в 1–5 лет в конце июня–июле. На литоральных участках (1–6) сбор материал собирали отдельно в средней, нижней литорали и верхней сублиторали (до глубины 0.5 м) при использовании серии выборочных площадок размером 0.01–1 м2. Объем отдельных выборок колебался от пяти до 30 повторностей. На сублиторальных участках (7–12) моллюсков собирали с помощью драги. Оценку площади, охваченной сборами драгой, проводили с учетом уловов массовых видов дночерпателями Петерсена и Ван-Вина (площадь захвата 0.025 м2) и зубчатым водолазным дночерпателем (площадь захвата 0.05 м2). На каждом участке единовременно дражные и дночерпательные пробы взяты не менее, чем в двух и трех повторностях соответственно.
Моллюсков собирали вместе с другими представителями макробентоса. Показатели донной биоты (видовой состав, численность и биомасса таксонов) использовали для характеристики биотического окружения анализируемых видов Bivalvia в отдельных местообитаниях в период наблюдений.
Из абиотических свойств местообитаний моллюсков в основном изучали характеристики донных отложений (гранулометрический состав грунта и содержание в нем органических веществ) (табл. 2). Гранулометрический состав грунта определяли по стандартной методике (Петелин, 1967) – разделение частиц грунта на 8 фракций (>10, 10…≥5, 5…≥3, 3…≥1, 1…≥0.5, 0.5…≥0.25, 0.25…≥0.1, ≤0.1 мм) путем просеивании осадков через систему сит с ячейками 10, 5, 3, 1, 0.5, 0.25, 0.1 мм. На ст. 4а специального анализа гранулометрического состава донных отложений не проводили. По визуальной оценке – преобладали фракции мелкого песка и ила.
Таблица 2.
Гранулометрический состав грунта и содержание органических веществ в грунте исследованных участков
| Стан-ция | Глубина, м | Содержание органических веществ, % | Гранулометрический состав грунта, % | |||||
|---|---|---|---|---|---|---|---|---|
| галечники, >10 мм | гравий, 10…≥1 мм |
псаммиты грубые, 1…≥0.5 мм |
псаммиты средние, 0.5…≥мм |
псаммиты мелкие, 0.25…≥0.1 мм |
алевриты
и пелиты, <0.1 мм |
|||
| 1 | СГЛ | 1.8 ± 0.1 | 9.9 ± 0.9 | 19.5 ± 1.1 | 8.3 ± 0.7 | 9.0 ± 2.3 | 25.3 ± 1.9 | 27.9 ± 0.9 |
| НГЛ | 6.4 ± 0.6 | 17.4 ± 1.5 | 11.2 ± 0.9 | 13.0 ± 0.5 | 23.9 ± 0.9 | 28.2 ± 3.1 | ||
| 2 | НГЛ | – | 0.41 ± 0.05 | 0.8 ± 0.07 | 0.87 ± 0.05 | 3.6 ± 0.8 | 61.5 ± 1.8 | 32.9 ± 2.1 |
| 3 | СГЛ | 1.1 ± 0.1 | 5.8 ± 0.4 | 7.1 ± 0.8 | 9.5 ± 1.6 | 39.2 ± 3.1 | 38.4 ± 1.1 | |
| 4 | СГЛ | 0.99 ± 0.04 | 3.1 ± 0.5 | 12.6 ± 1.1 | 32.5 ± 4.1 | 40.0 ± 2.4 | 11.9 ± 0.8 | |
| 5 | НГЛ | – | 0.1 ± 0.1 | 0.10 ± 0.08 | 0.33 ± 0.04 | 9.9 ± 1.1 | 89.6 ± 1.4 | – |
| 7 | 5–15 | 5.0 ± 0.9 | 15.6 ± 6.4 | 30.9 ± 7.5 | 8.6 ± 1.3 | 8.3 ± 2.1 | 25.3 ± 3.5 | 11.3 ± 1.6 |
| 7а | 4–6 | 4.9 ± 0.7 | – | 12.0 ± 1.0 | 18.0 ± 5.0 | 24.0 ± 1.0 | 46.0 ± 3.0 | |
| 8 | 10–18 | – | 1.3 ± 1.3 | 6.6 ± 2.9 | 9.2 ± 2.9 | 12.9 ± 1.6 | 23.2 ± 2.6 | 46.9 ± 5.4 |
| 9 | 38–40 | – | – | 4.4 ± 1.3 | 13.1 ± 2.3 | 17.8 ± 1.2 | 24.3 ± 1.5 | 40.3 ± 3.6 |
| 10 | 15–18 | – | 1.0 ± 1.0 | 3.5 ± 2.2 | 8.9 ± 2.3 | 12.6 ± 3.8 | 74.0 ± 7.9 | |
Климатические и гидрологические условия (температура воздуха и воды, соленость воды) в изучаемой акватории в период наблюдений даны по материалам из доступных интернет-источников http://www.meteolab.ru/database/?station=22217 и по результатам круглогодичных гидрологических наблюдений, проводимых с 1957 г. сотрудниками Беломорской биологической станции Зоологического института РАН (“Многолетний мониторинг гидрологии и зоопланктона в Белом море: Картеш Д1”) (Бабков, Прыгункова, 1974; Бабков, 1982; Berger et al., 2003). Были использованы итоги сезонных наблюдений за температурой и соленостью воды на разных глубинах (от 0 до 65 м) в устье губы Чупа почти в течение последних 30 лет (1980–2014 гг.).
Судя по многочисленным описаниям осушной зоны и верхней сублиторали (до глубины 40–50 м) Белого моря (Кузнецов, 1960; Бабков, Голиков, 1984; Голиков и др., 1985; Белое…, 1995 и др.), все выбранные участки представляли обычные для акватории Кандалакшского залива биотопы, а развитые на них донные сообщества (Герасимова, 2021) вполне соответствовали биосистемам, описанным для подобных биотопов в литературе. За время наблюдений (1980–2014 гг.) существенных изменений основных климатических и гидрологических характеристик (температуры воздуха и воды, солености воды) в районе исследований не отмечено (Герасимова, 2021). Обнаруженные межгодовые смещения в структуре донных сообществ, в некоторых местообитаниях весьма значительные, в основном, были обусловлены изменениями численности и биомассы доминирующих на участках видов, в состав которых часто входили анализируемые представители Bivalvia.
Построение таблиц выживания. В каждый момент наблюдения определяли размерно-возрастной состав поселений анализируемых видов Bivalvia. Моллюсков в пробах измеряли с точностью до 0.1 мм и определяли их возраст по подсчету колец нарастания. Дополнительно для двух видов Arctica islandica и Macoma calcarea предприняты попытки определения возраста по внутренним меткам роста – спилам раковины (Герасимова и др., 2017a; Лисицына, Герасимова, 2019). Численность особей разного возраста в отдельные даты наблюдения определяли, как правило, прямым подсчетом, в редких случаях – путем наложения на размерную ось размерно-частотного распределения средних размеров особей разного возраста, принимая за границы возрастных групп середины интервалов между средними. По итогам наблюдений за динамикой возрастной структуры в изучаемых поселениях Bivalvia были построены таблицы выживания.
Существует два вида таблиц выживания – динамические и статические. В первом случае для построения таблицы выживания необходимы подробные наблюдения на протяжении всего жизненного цикла отдельной генерации (модельно рассматриваемой как когорта). Составить такие таблицы можно лишь, когда имеется реальная возможность проследить за индивидуальной судьбой всех членов особей достаточно большой выборки из определенной генерации. Для долгоживущих и подвижных организмов получить данные для построения динамической таблицы крайне трудно. В отношении водных организмов, динамические таблицы выживания составлены, в основном, для прикрепленных организмов, например усоногих раков Balanus glandula (Connell, 1970), что потребовало регулярных обследований на протяжении 10 лет. Гораздо чаще составляют статические таблицы выживания на основании краткосрочных наблюдений за смертностью во всех возрастных группах. Эти таблицы широко применяют в различных демографических исследованиях (Yusuf et al., 2014). Построение статических таблиц выживания сопряжено с рядом условий: возраст-зависимые смертность и скорость воспроизводства популяций должны быть неизменными, т.е. популяция стационарна (Begon et al., 1996; Yusuf et al., 2014). В основном, в настоящей работе построены статические таблицы выживания. Однако в поселениях Mya arenaria удалось проследить за судьбой отдельных генераций на протяжении почти всего их жизненного цикла (или значительной части последнего) и построить когортные таблицы выживания (Gerasimova et al., 2015, 2021). Это оказалось возможным благодаря тому, что в условиях Белого моря песчаные ракушки Mya arenaria оказались способны к формированию на протяжении многих лет почти моновозрастных поселений (Gerasimova et al., 2021).
Как правило, для построения таблиц выживания Bivalvia использовали только надежные, с точки зрения авторов, данные по динамике численности в генерациях. Методика расчетов основных демографических параметров при построении таблиц выживания описана в работах (Гиляров, 1990; Begon et al., 1996).
Параметры, использованные в таблицах выживания, приведены ниже:
| Параметр | Описание |
|---|---|
| Дата | Год наблюдения |
| x | Возраст моллюсков |
| Nx | Число особей, доживших до возраста x |
| lx | Доля особей, доживших до возраста x, lx = Nx/N0 , где N0 – число особей “нулевого” возраста, за N0 принимали начальную численность моллюсков рассматриваемой генерации |
| dx | Доля особей, погибших в течение возрастного интервала от x до x + 1 dx= lx– lx+1 |
| qx | Удельная смертность моллюсков разного возраста, (qx= dx/lx). |
По данным о выживаемости особей (lx) в возрастных группах в нескольких поселениях анализируемых видов Bivalvia были построены кривые выживания. Для аппроксимации эмпирических данных о выживаемости особей разного возраста в популяциях бентосных животных наиболее часто применяют экспоненциальную модель, в которой константа М модельно рассматривается как годовой уровень смертности (Allen, 1971; Brey, 1999):
Nt = N0e(–Mt),
где N0 – начальная численность, М – коэффициент смертности (год–1), t – возраст, Nt – численность в возрасте t.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Методические аспекты проведенных исследований. В большинстве анализируемых поселений Bivalvia анализ выживаемости особей разного возраста не охватывал весь жизненный цикл исследуемых видов. Как правило, эти процессы изучены для животных не младше одного года и не старше 4–5 лет (табл. 3). Максимальный возраст моллюсков лишь в нескольких местообитаниях был менее cеми лет (табл. 3). Однако, были оценены реальные возможности по определению точного возраста особей в старших возрастных группах (Герасимова, 2021). Исключения составили лишь поселения песчаных ракушек Mya arenaria, для которых удалось проследить за динамикой численности отдельных генераций, в нескольких случаях почти на протяжении всего их жизненного цикла, и соответственно построить когортные таблицы выживания (табл. 3) (Gerasimova et al., 2021). Характеристики выживаемости молоди в течение первого года жизни не были включены в анализ выживаемости в поселениях Bivalvia, поскольку обычно сборы материала происходили до массового пополнения поселений.
Таблица 3.
Объекты исследования и характеристика полученных результатов
| Вид | Учас-ток | Глубина | Период наблюдений, годы | Смертность в возрастных группах, год–1 | tmax, лет | |||
|---|---|---|---|---|---|---|---|---|
| возрастной диапазон, лет | M | Δqx | qx | |||||
| Mya arenaria | 1 | Средняя литораль | 1989–2014 | 1–23 | 0.31 ± 0.02 | 0.01–0.72 | 0.21 ± 0.07 | 23 |
| Нижняя литораль | 1989–2014 | 1–25 | 0.33 ± 0.02 | 0.05–0.68 | 0.22 ± 0.04 | 25 | ||
| 2 | Средняя литораль | 1989–1997 | 1–8 | 0.48 ± 0.08 | 0.03–0.86 | 0.36 ± 0.13 | 8 | |
| Нижняя литораль | 1989–1997 | 1–8 | 1.18 ± 0.31 | 0.04–0.92 | 0.38 ± 0.16 | 8 | ||
| 3 | Средняя литораль | 2000–2006 | 1–6 | 0.70 ± 0.11 | 0.01–0.68 | 0.38 ± 0.10 | 7 | |
| 4 | Средняя литораль | 2000–2006 | 1–6 | 0.37 ± 0.05 | 0.06–0.74 | 0.26 ± 0.10 | 7 | |
| 4а | Средняя литораль | 2000–2004 | 1–4 | 1.07 ± 0.20 | 0.25–0.75 | 0.51 ± 0.11 | 5 | |
| Macoma balthica | 2 | Средняя литораль | 1979–2000 | 1–4 | – | 0.03–0.82 | 0.24 ± 0.07 | 7 |
| Нижняя литораль | 1979–2000 | 1–4 | – | 0.13–0.56 | 0.33 ± 0.04 | 7 | ||
| 5 | Средняя литораль | 1989–2012 | 1–4 | 0.64 ± 0.14 | 0.07–0.72 | 0.43 ± 0.05 | 7 | |
| Нижняя литораль | 1989–2012 | 1–4 | 0.52 ± 0.09 | 0.08–0.88 | 0.35 ± 0.06 | 8 | ||
| Верхняя сублитораль (≤0.5 м) | 1996–2012 | 1–4 | 0.54 ± 0.05 | 0.22–0.64 | 0.40 ± 0.03 | 7 | ||
| Mytilus edulis | 6 | Нижняя литораль | 1989–1992 | 3–7 | – | 0.03–0.71 | 0.28 ± 0.07 | 10–11 |
| Arctica islandica | 7 | 10–15 м | 1984–2003 | 15–33 | 0.07 ± 0.01 | 0.02–0.41 | 0.09 ± 0.03 | 48 |
| Macoma calcarea | 8 | 10–18 м | 1989–2012 | 1–5 | 0.33 ± 0.07 | 0.04–0.70 | 0.35 ± 0.06 | 9 |
| Musculus niger | 7 | 6–10 м | 1989–1993 | 3–9 | – | – | 0.22 ± 0.02 | 11 |
| Serripes groenlandicus | 7а | 4–6 м | 1989–2005 | 1–4 | 0.66 ± 0.06 | 0.13–0.85 | 0.48 ± 0.06 | 12 |
| Yoldia hyperborea | 9 | 38–40 м | 1989–1996 | 2–5 | – | 0.11–0.38 | 0.26 ± 0.03 | 11 |
| Portlandia arctica | 10 | 15–18 м | 1989–1993 | 1–5 | – | 0.23–0.62 | 0.53 ± 0.04 | 8 |
Примечание. M – коэффициент смертности как параметр экспоненциальной модели ± ошибка, Δqx – размах колебаний значений смертности, qx – средняя смертность в возрастных группах ± ошибка, tmax – наибольший отмеченный возраст; “–” – отсутствие данных. Номера участков как на рис. 1.
Для трех видов (Musculus niger, Mytilus edulis и Yoldia hyperborea) не удалось получить надежную информацию о выживаемости особей в возрасте 1–2 года, а для Arctica islandica – даже в течение первых 14 лет (табл. 3), что связано с особенностями структуры поселений этих видов в период наблюдений. Закономерности выживания A. islandica в изучаемом беломорском поселении исследованы на примере анализа динамики численности генерации 1969 г. как наиболее массовой в течение большей части наблюдений (Герасимова и др., 2017a). Надежность учета обилия особей других поколений из-за их малочисленности в целом была не высока. Скорость элиминации генерации 1969 г. изучена в период 1984–2003 гг., т.е. когда моллюски были в возрасте 15–34 лет. В поселении Mytilus edulis численность особей в возрасте 1–2-х лет в рассматриваемый период (1989–1992 гг.) ни разу не была сопоставима с величинами обилия последующих генераций (Gerasimova, Maximovich, 2013). Для беломорских мидий известно, что количественные показатели моллюсков ранних возрастов (возраст один–два года) в литоральных поселениях часто зависят от их перераспределения в пределах биотопов. Спат (только что осевшая молодь) мидий преимущественно оседает в верхней сублиторали на нитчатые водоросли (Луканин, Ошурков, 1981; Луканин и др., 1986), откуда постепенно (в нашем случае, вероятно, по достижению возраста 1–2 года) мигрирует в литоральные местообитания. Изучение процессов выживаемости и смертности в поселении Musculus niger (уч. 7) оказалось осложнено прежде всего относительно низким обилием в течение всех лет наблюдения всего поселения (в среднем ~35 экз./м2) и особей в отдельных возрастных группах (обычно <10 экз./м2). В результате предпринята попытка оценить среднегодовую скорость элиминации M. niger за 4–5 лет у представителей разных генераций по материалам выборок 1989 и 1992–1993 гг., начальный возраст моллюсков был 3–6 лет. Из-за частых перерывов в исследованиях и значительных межгодовых колебаниях объемов пополнения (Gerasimova, Maximovich, 2013) также не удалось получить надежные оценки годовой убыли численности Yoldia hyperborea в возрасте одного года в анализируемом местообитании. Получены данные о выживаемости и смертности особей только в возрасте 2–5 лет (табл. 3).
Средняя годовая смертность в беломорских поселениях двустворчатых моллюсков. Средние показатели смертности в поселениях изученных видов Bivalvia варьировали в широких пределах – от 9 до 53% в год (qx, табл. 3). Наименьшая смертность (в среднем 9% в год) была характерна для Arctica islandica, самой долгоживущей из рассмотренных двустворчатых моллюсков. Относительно высоким уровнем элиминации (~50% в год) отличались Portlandia arctica и Serripes groenlandicus (табл. 3).
При анализе процессов выживания в разных поселениях одного и того же вида (Mya arenaria, Macoma balthica) оказалось, что среднегодовая смертность могла варьировать в 1.5–2 раза (табл. 3). Так, относительно высокий уровень годовой элиминации (~40% в год) отмечен в поселениях M. balthica на песчаном пляже (уч. 5), на заиленном биотопе (уч. 2) смертность вида была существенно ниже – ~20–30% в год.
Выживаемость Mya arenaria определена в результате анализа динамики численности в разных местообитаниях двух генераций – 1988 г. (ст. 1, 2) и 1999 г. (уч. 3, 4а). Снижение численности генерации 1988 г. на ст. 1 (продолжительность жизненного цикла поколения 23–25 лет) в среднем соответствовало 20% годовой смертности (табл. 3). Когда эта генерация полностью прекратила свое существование за 9 лет (в условиях более заиленного уч. 2 (табл. 3)), среднегодовая смертность моллюсков достигла ~40%. Не обнаружено достоверных различий этого показателя в разных горизонтах одного и того же участка. Динамика генерации 1999 г. изучена только на протяжении пяти (уч. 4а) и семи лет (уч. 3, 4) (табл. 3). В течение рассматриваемого периода снижение численности генерации в заиленном биотопе (уч. 3) в среднем соответствовало смертности ~40% в год, на преимущественно песчаном участке (уч. 4) – 26% в год, на участке c преобладанием в грунте фракций мелкого песка и ила) – (уч. 4а) ~50% в год (табл. 3). Доля генераций 1988 и 1999 гг. по достижению песчаными ракушками семилетнего возраста составила на уч. 2, 3 лишь 3–5% их количества в возрасте одного года. Напротив, аналогичные характеристики этих же поколений на преимущественно песчаных биотопах (уч. 1, 4) в семилетнем возрасте достигали 11–20%. Наиболее вогнутые кривые выживания характеризовали динамику численности изучаемых поколений на уч. 2, 3 – с повышенным содержанием мелкозернистых фракций (алевритов и пелитов) (рис. 2). Значимых различий параметров модели в разных поселениях уч. 2, 3, 4а не обнаружено (табл. 4). Коэффициент смертности (параметр объединенной экспоненциальной модели) в таких местообитаниях достигал в среднем 0.76 ± 0.08 год–1. На уч. 1, 4 (в преимущественно песчаных биотопах) данный показатель при объединении данных составил 0.34 ± 0.02 год–1. Значимых различий в параметрах индивидуальных кривых выживания (для отдельных поселений этих участков) также не выявлено (табл. 4).
Рис. 2.
Выживаемость Mya arenaria генераций 1988 и 1999 гг. на уч. 1–4, 4а. lx – доля особей, выживших на данной стадии жизненного цикла. Обозначение поселений: горизонт литорали _ номер станции. СГЛ – средний горизонт литорали, НГЛ – нижний горизонт литорали.

Таблица 4.
Статистический анализ параметров кривых выживания (lx= l0eMx) Mya arenaria генераций 1988 и 1999 гг. на участках 1–4, 4а
| Поселение | l0 | M | ||
|---|---|---|---|---|
| E | 95%-ный ДИ | E | 95%-ный ДИ | |
| СГЛ_1 | 0.05 | 1.00–1.20 | 0.02 | 0.26–0.36 |
| НГЛ_1 | 0.04 | 0.83–0.98 | 0.02 | 0.29–0.38 |
| СГЛ_2 | 0.08 | 0.73–1.12 | 0.08 | 0.30–0.67 |
| НГЛ_2 | 0.11 | 0.72–1.24 | 0.31 | 0.42–1.93 |
| СГЛ_3 | 0.08 | 0.77–1.16 | 0.11 | 0.42–0.97 |
| СГЛ_4 | 0.07 | 0.84–1.20 | 0.05 | 0.25–0.48 |
| СГЛ_4а | 0.08 | 0.73–1.24 | 0.20 | 0.44–1.70 |
Изменения уровня элиминации с возрастом моллюсков. В основном, характеристики среднегодовой смертности в изученных поселениях Bivalvia слабо отражали закономерности снижения численности моллюсков в отдельных генерациях с возрастом. Лишь в четырех из девятнадцати анализируемых поселений скорость элиминации почти не различалась у разновозрастных особей: поселения Macoma balthica в верхней сублиторали песчаного биотопа (уч. 5), Serripes groenlandicus (рис. 3а), Portlandia arctica и Musculus niger. Как уже отмечали, для M. niger удалось оценить лишь среднегодовую смертность за 4–5 лет у особей разных генераций (начальный возраст моллюсков 3–6 лет). В поселениях остальных трех видов процессы выживаемости исследованы только в первые 4–5 лет жизни при ее максимальной продолжительности 7–12 лет (табл. 3). В большинстве же изучаемых поселений двустворчатых моллюсков отмечены порядковые различия уровня смертности в разных возрастных группах – по максимуму от 0.04 до 0.92 год–1 (табл. 3).
Рис. 3.
Варьирование смертности (qx, год–1) у особей разного возраста в поселениях Serripes groenlandicus (а), Macoma calcarea (б), Mytilus edulis (в).
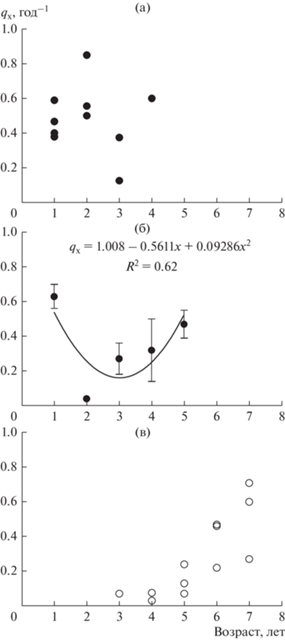
В основном (в десяти из пятнадцати поселений Bivalvia), относительно высоким уровнем элиминации (~50–80% в год) характеризовались особи в возрасте 1 года. Дальнейшие изменения смертности с возрастом носили либо U-образный характер (шесть поселений) – когда смертность относительно велика в младших возрастных группах, понижается в средних и снова возрастает c увеличением возраста моллюсков (рис. 3б), либо (как правило, при отсутствии данных об элиминации особей на поздних этапах онтогенеза) наблюдали увеличение выживаемости особей в последующих возрастных группах (четыре поселения) (рис. 4), либо были колебательные изменения смертности моллюсков с возрастом (три поселения). Для Yoldia hyperborea уровень элиминации годовиков не удалось оценить, наибольшей смертностью отличались особи в возрасте 2–3 лет (~40% в год), с увеличением возраста особей выживаемость росла.
Рис. 4.
Варьирование смертности (qx, год–1) у особей разного возраста в поселениях Macoma balthica на среднем (а) и нижнем (б) горизонтах литорали уч. 5, rs – ранговый коэффициент корреляции Спирмена.

В поселении Mytilus edulis на каменистой литорали (уч. 6) процессы выживаемости изучены лишь в возрасте 3–7 лет (максимальная продолжительность жизни вида на этом местообитании 10–11 лет) (табл. 3). Наибольшей скоростью элиминации отличались моллюски старше пятилетнего возраста (~50% в год), а в возрасте трех лет она была относительно низкой – в среднем ~9% в год (рис. 3в).
Только в литоральных поселениях Mya arenaria была возможность изучить процессы выживаемости на протяжении почти всего жизненного цикла моллюсков, причем у представителей разных поколений (Gerasimova et al., 2021). При относительно непродолжительных наблюденияхза динамикой генераций (в течение ≤7–9 лет) отмечено некое подобие U-образных изменений уровня смертности песчаных ракушек с возрастом (по крайней мере, для большей части рассматриваемых периодов) (рис. 5б, 5в).
Рис. 5.
Варьирование смертности (qx, год–1) у особей разного возраста в поселениях Mya arenaria (генераци (5) и 1988 и 1999 гг.): а – уч. 1, б – уч. 2, в – уч. 3, 4, 4а. Обозначение поселений: горизонт литорали номер станции.

Однако на уч. 1, где наблюдения за динамикой генерации 1988 г. были наиболее длительны (25 лет) и охватили весь ее жизненный цикл, изменения смертности носили скорее колебательный характер, когда периоды низкого уровня смертности песчаных ракушек сменялись относительно резкими повышениями степени элиминации (см. рис. 5а).
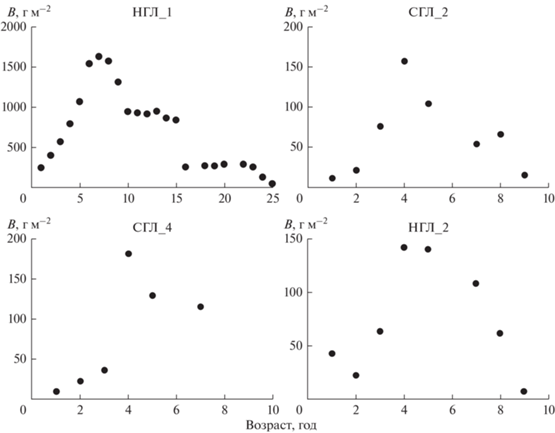
Как правило, повышенной смертностью отличались особи в возрасте 1 г., однако прослеживалась явная зависимость скорости элиминации этой группы от величины обилия генерации. В результате, различия численности особей в разных горизонтах литорали одного и того же участка к 2-летнему возрасту существенного сглаживались. Повышенная смертность также отмечалась в середине–конце периода активного линейного роста особей (в основном, в возрасте 4–8 лет) (рис. 5а) суммарная биомасса песчаных ракушек к этому моменту обычно достигала максимальной величины, далее этот показатель снижался (рис. 6) и в конце жизненного цикла – для наиболее долгоживущей генерации 1988 г. повышение уровня элиминации на поздних этапах онтогенеза отмечали дважды – в возрасте 15 и 23–24 лет (см. рис. 5а), <1% особей их числа в 1989 г. смогли преодолеть пятнадцатилетний возрастной рубеж.
Рис. 6.
Динамика биомассы (B) Mya arenaria генераций 1988 и 1999 гг. на уч. 1, 2 и 4 (по: Gerasimova et al., 2021). Обозначение поселений: горизонт литорали номер станции.
Колебательный режим скорости элиминации в течение жизненного цикла (или его значительной части) оказался свойственен и самым долгоживущим из рассмотренных видов – Arctica islandica. Скорость элиминации особей генерации 1969 г. варьировала на протяжении 1984–2003 гг. почти в 20 раз – от 0.02 до 0.41 год–1 (табл. 3). В динамике генерации в возрасте от 15 до 33 лет прослеживались два периода относительно стабильной численности, разделенных кратковременным (в 1–2 года) промежутком повышенной смертности особей (рис. 7). Соответственно и уровень смертности менялся скачкообразно: периоды низкого уровня смертности (0.02 и 0.13 год–1 в 1984–1995 и 1998–2003 гг. соответственно) сменялись относительно резким повышением степени элиминации – до 0.4 год–1 в 1995–1997 гг.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Смертность как интегральная оценка условий существования. Важным элементом проведенных исследований стала динамика всех анализируемых поселений Bivalvia, являясь примером естественных изменений. В Белом море изучаемые виды двустворчатых моллюсков не относятся к объектам промысла. Их поселения можно считать не подверженными воздействию любительского лова. За время наблюдений не отмечено никаких экстремальных событий в жизни обитателей литорали и сублиторали Кандалакшского залива Белого моря. Существенных изменений основных климатических и гидрологических характеристик в районе исследований за период работ 1980–2014 гг. не выявлено (Герасимова, 2021).
Средняя (независимо от возраста) смертность в поселениях изученных видов Bivalvia варьировала достаточно широко – от 9 до 53% в год. Однако этот показатель характеризовал элиминацию моллюсков, как правило, на разных этапах жизненного цикла видов – в основном, для первых 4–5 лет жизни, но было и много исключений. Соответственно большого смысла в сравнительном анализе среднегодовой смертности в разных поселениях моллюсков, по-видимому, нет. Тем не менее, отдельные закономерности динамики численности поселений Bivalvia можно выявить и из данных характеристик. Наименьшей смертностью (в среднем 9% в год) среди изученных видов отличались наиболее долгоживущие маллюски Arctica islandica. Столь низкий уровень элиминации представителей генерации 1969 г. в возрасте 15–33 лет вполне отражал слабые в среднем вариации плотности поселения в анализируемом местообитании с 1984 по 2003 гг. (Герасимова и др., 2017a). По отношению ко всему жизненному циклу A. islandica, указанный уровень смертности, очевидно, несколько занижен, поскольку с одной стороны не было информации о темпе элиминации особей вида на ранних этапах онтогенеза (например, в первые 14 лет жизни), а с другой – в анализ включены моллюски, уже вышедшие из-под возможного пресса хищников. Известно, что от хищников (беспозвоночных и рыб), в основном, страдали молодые особи данного вида (Schafer, 1972; Brey et al., 1990). Для Белого моря годовая смертность A. islandica (как константа экспоненциальной модели) оценена в 16% в год (Begum et al., 2010), в пределах ареала распространения вида находилась в диапазоне 1–17% в год (Kilada et al., 2007; Begum et al., 2010).
Относительно высокий уровень годовой элиминации (40–50% в год) в поселениях Macoma balthica на песчаном пляже (уч. 5) и Portlandia arctica, для которых отмечены проявления стационарности структуры на протяжении многих лет наблюдений, объясняет довольно резкие падения численности поселений при отсутствии нового очередного успешного пополнения (Gerasimova, Maximovich, 2013; Герасимова и др., 2017b). Для сравнения – в поселении Macoma balthica в средней литорали илисто-песчаного пляжа (уч. 2) смертность в среднем в 2 раза ниже (~20% в год). Даже при перерывах успешного пополнения в несколько лет плотность этого поселения могла поддерживаться на относительно высоком уровне, а продолжительность эффекта доминирования отдельных генераций достигала четырех лет (Герасимова и др., 2017b).
Среди изученных поселений Mya arenaria самая высокая средняя смертность (40–50%) и наиболее вогнутые кривые выживания характеризовали динамику численности генераций на участках с повышенным содержанием мелкозернистых фракций. В таких местообитаниях доминирующие генерации почти прекращали свое существование за 5–9 лет. В преимущественно песчаных биотопах убыль численности генерации в среднем соответствовала годовой смертности <30%, а продолжительность жизни вида могла достигать 23–25 лет. Отрицательная корреляция темпа линейного роста песчаных ракушек и степени заиленности грунта описана в работе (Appeldoorn, 1983). По-видимому, характер выживаемости особей M. arenaria в условиях разных биотопов демонстрирует похожие закономерности.
Таким образом, средняя (для всех возрастных групп) скорость элиминации особей в поселениях Bivalvia может быть весьма показательна при изучении группового отклика поселений на условия окружающей среды. Аналогичное (в относительном плане) поведение в разных поселениях Bivalvia демонстрировал и коэффициент смертности, представляющий параметр кривой выживания. Как правило, этот показатель оценить проще: достаточно описать динамику численности особей в нескольких последовательных возрастных группах.
Причины возраст-зависимых колебаний смертности в поселениях Bivalvia. Возрастная изменчивость темпов элиминации двустворчатых моллюсков не однократно отмечалась ранее в литературе (Green, 1973; Freeman, Dickie, 1979; Ankar, 1980; Commito, 1982; Josefson, 1982; Brousseau, Baglivo, 1988; Brey et al., 1990; McGrorty et al., 1990). Для водных беспозвоночных и рыб известна U-образная зависимость смертности от возраста (или размера) животных: смертность велика в младших возрастных группах, понижается в средних и снова увеличивается в старших возрастах (Алимов, 1989). В большинстве рассмотренных в настоящей работе случаев наиболее низкой выживаемостью отличались моллюски в возрасте 1‒2 лет. Однако лишь в трети анализируемых поселений Bivalvia смертность с возрастом менялась U-образно. Примерно столько же случаев приходилось на ситуации, когда после относительно высокого уровня элиминации особей в младших возрастных группах наблюдали увеличение выживаемости моллюсков с возрастом. Такие результаты вполне объяснимы. Поскольку процессы выживаемости изучены в основном для особей не старше 4‒5 лет, соответственно скорость элиминации моллюсков на поздних этапах онтогенеза осталась неизвестной.
Только в литоральных поселениях M. arenaria оказалось возможным изучить выживаемость на протяжении почти всего жизненного цикла моллюсков (Gerasimova et al., 2021). В разных местообитаниях песчаных ракушек анализировали динамику численности двух генераций – 1988 и 1999 гг. Соответственно, появилась уникальная возможность построения когортных таблиц выживания для представителей разных поколений. Исследование осуществлено в большей мере благодаря специфике динамики изучаемых поселений M. arenaria – развития поселений на протяжении многих лет как динамики одной генерации при практически полном при почти полном отсутствии следов ежегодного пополнения. Из-за отсутствия пополнения поселений песчаных ракушек в течение длительных периодов (до 12 лет в одном из изученных поселений) особей обеих генераций в каждом местообитании было сравнительно легко отделить от представителей других поколений по внешней морфологии раковины на протяжении всего периода анализа динамики генераций (по максимуму – в течение 25 лет).
Оказалось, что сравнительно высоким темпом элиминации отличались представители песчаных ракушек не только на ранних этапах онтогенеза. В случае непродолжительных наблюдений (5–9 лет) за динамикой генераций отмечено некое подобие U-образных изменений уровня смертности песчаных ракушек с возрастом. Однако на одном участке (уч. 1), где наблюдения за динамикой генерации носили наиболее долговременный характер (25 лет), изменения уровня смертности были скорее колебательного характера, – периоды низкого уровня смертности песчаных ракушек сменялись периодами относительно резкого его повышения.
Известно, что высокая смертность особей на ранних стадиях развития (в нашем случае в возрасте одного года), отмеченная в большинстве анализируемых поселений M. arenaria, а также в поселениях других видов, вполне типична для морских беспозвоночных (Hunt, Scheibling, 1997). Причины повышенной смертности на ранних этапах онтогенеза в популяциях гидробионтов разнообразны и могут включать нарушения в развитии, физиологический стресс, физическое воздействие окружающей среды, хищничество, конкуренцию, паразитизм (Hunt, Scheibling, 1997). У песчаных ракушек повышенная смертность в первые годы жизни, по-видимому, связана с их слабой защищенностью и напряженными внутривидовыми отношениями в плотных скоплениях молодых моллюсков. В этот период особи M. arenaria обитают в приповерхностном слое грунта, т.е. в условиях динамичной среды. Значительная часть молоди может погибать в силу нежизнеспособности и в результате воздействия хищников. Так, в губе Чупа Белого моря в личиночном пуле двустворчатого моллюска Mytilus edulis у большого числа особей обнаружены визуально различимые нарушения в развитии (Кулаковский, Флячинская, 1993). Многие исследователи считают хищничество одной из главных причин высокого уровня смертности Mya arenaria на ранних этапах жизненного цикла (Beal et al., 2001; Strasser, Günther, 2001; Beal, Kraus, 2002; Strasser, 2002; Flach, 2003; Strasser et al., 2003; Beukema, Dekker, 2005; Beal, 2006a; Bowen, Hunt, 2009). Есть данные, что и в поселениях Mytilus edulis, Macoma balthica, Arctica islandica от хищничества страдают в основном молодые особи (Schafer, 1972; Dare, 1976; Holland et al., 1980; Bachelet, 1986; Elmgren et al., 1986; Brey et al., 1990; Beukema et al., 1998, 2001; Strasser, Günther, 2001; Hiddink et al., 2002; Strasser, 2002; Philippart et al., 2003; Strasser et al., 2003; Beukema, Dekker, 2005, 2014). Благодаря хищничеству брюхоногого моллюска Euspira herоs (Say, 1822), выживаемость Mey у атлантического побережья Северной Америки в течение первых пяти лет жизни не превышала 3.5% (Commito, 1982). В изученных беломорских местообитаниях песчаных ракушек ни креветки, ни другие хищники (крабы, хищные брюхоногие моллюски, морские звезды, камбалы) или отсутствовали, или были крайне малочисленны (Gerasimova et al., 2015, 2021). Однако нельзя полностью исключить влияние хищников на выживание молодых песчаных ракушек. Известно, что в Белом море потенциальными хищниками для молодых особей Mya arenaria, закапывающихся в грунт не глубже 5–8 см, служат некоторые виды птиц (чайки Larus argentatus Pontoppidan, 1763, L. canus L., 1758), кулики Haematopus ostralegus (L., 1758), Arenaria interpres (L., 1758), серый журавль Grus grus (L., 1758), гага Somateria mollissima (Linnaeus, 1758), рыбы (треска Gadus morpha L., 1758, камбала Pleuronectus flesus (L., 1758), маслюк Pholis gunellus (L., 1758), бельдюга Zoarces viviparus (L., 1758) и морская звезда Asterias rubens L., 1758) (Шкляревич, Щербакова, 2004). Тем не менее, двухлетние песчаные ракушки, которые должны бы подвергаться влиянию хищников из-за их небольшого размера и жизни в поверхностном слое грунта, отличались сравнительно низкой смертностью (0.01–0.24 год–1) в большинстве анализируемых местообитаний. Кроме того, не является аргументом в пользу влияния хищников на молодых особей Mya arenaria наличие огромного количества их пустых неповрежденных раковин (в том числе и мелких – размером <20 мм) в толще донных отложений участков на протяжении всего периода исследований (визуальные наблюдения авторов). Таким образом, маловероятно, что хищничество играло важную роль в регуляции смертности песчаных ракушек в этих местообитаниях.
Если влияние хищничества слабое или отсутствует, основную роль в регуляции смертности годовиков песчаных ракушек (как и остальных видов) могли играть другие биотические факторы, например, внутривидовые отношения. Были выявлены различия в степени элиминации годовиков M. arenaria (от 0.2 до 80% за год) в условиях разной плотности поселений песчаных ракушек в отдельных вертикальных горизонтах одного и того же участка. В результате разница в численности двухлетних особей на разных горизонтах литорали существенно сглаживалась. Аналогичных примеров возможного влияния внутривидовой конкуренции на выживание молоди Bivalvia в литературе немного. Так, в популяции Mytilus edulis у берегов Англии (Девон) степень элиминации молоди сильно варьировала между годами в зависимости от объема пополнения (McGrorty et al., 1990; McGrorty, Goss-Custard, 1993). При этом с увеличением возраста моллюсков выживаемость росла. По мнению (McGrorty et al., 1990), основная причина высокой смертности мидий на ранних этапах онтогенеза в основном связана с хищничеством крабов Сarcinus maenas (Linnaeus, 1758), однако исследователи не дали объяснений плотность-зависимому воздействию крабов на молодь моллюсков. Выживание молоди авторы связывают с возможностью находить убежища между биссусными нитями взрослых особей. Логично предположить, что плотность-зависимая смертность молоди – это отражение ограниченного количества подобных убежищ, что позволяет трактовать такую плотность-зависимую смертность как результат внутривидовой конкуренции за пространство. Экспериментальные исследования, предпринятые у берегов Северной Америки, показали статистически значимое увеличение смертности моллюсков в плотных скоплениях песчаных ракушек (Beal et al., 2001; Beal, 2006b). Однако, по мнению исследователей, маловероятно, что снижение их выживаемости в плотных поселениях обусловлено голоданием (внутривидовой конкуренцией). Обнаружено очень незначительное количество неповрежденных раковин моллюсков (Beal et al., 2001).
Негативное воздействие на выживание молодых особей Mya arenaria могут оказывать и суровые зимние условия (например, истирающее действие льда) (Kühl, 1951; Strasser et al., 2001; Bowen, Hunt, 2009). Процессы формирования спата M. arenaria и его выживание к следующему сезону в Белом море специально изучали в трех местообитаниях в 2003–2010 гг. (Gerasimova et al., 2021). Обнаружено, что спат предыдущего года либо полностью отсутствовал, либо выживали единичные особи.
Последующее увеличение выживаемости моллюсков с возрастом, отмеченное в поселениях M. arenaria и в скоплениях других анализируемых видов можно представить как следствие усиления сбалансированности количества доступного корма и пищевых потребностей моллюсков, а также меньшей уязвимости особей по мере увеличения размеров. Увеличение выживаемости M. arenaria с возрастом многие исследователи часто связывали с большей защищенностью вида по мере роста особей – прежде всего, с увеличением глубины закапывания (Свешников, 1963; Brousseau, 1978; Commito, 1982; Brousseau, Baglivo, 1988). Беломорские песчаные ракушки в возрасте 4–6 лет (средние размеры ~20–40 мм) закапываются на глубину 5–10 см. Североатлантические песчаные ракушки подвержены атакам хищных брюхоногих моллюсков Euspira heros только до размеров 30 мм (Commito, 1982).
В анализируемых поселениях Mya arenaria относительно высокая выживаемость моллюсков, как правило, совпадала по времени с периодом активного роста животных (ежегодные приросты раковины 4–5 мм), что могло привезти к усилению конкуренции особей за пищу при увеличении их размеров, и как результат – происходило увеличение уровня смертности в конце периода активного линейного роста песчаных ракушек. К концу периода активного роста суммарная биомасса в поселениях песчаных ракушек часто достигала максимальной (зарегистрированной за время наблюдений) величины, после чего она снижалась.
Для наиболее долгоживущей генерации песчаных ракушек (уч. 1) очередной этап стабилизации численности отмечен в возрасте 10–15 лет, по-видимому, как результат установившегося окончательного баланса между экологической емкостью среды и массой моллюсков. Средняя скорость роста M. arenaria в этот период <2 мм в год, моллюски способны закопаться на глубину 30–40 см и, таким образом, малодоступны для хищников. Последующее достаточно резкое возрастание уровня смертности в возрасте 15 лет, возможно, обусловлено достижением большинством представителей генерации средней продолжительности жизни. Не более 1% особей (относительно их численности в 1989 г.) оказались способны перейти 15-летний возрастной рубеж. В результате сформировалась группа долгожителей, отличавшаяся низкой численностью и низким темпом роста (<1 мм в год), которая в почти неизменном составе достигла, вероятно, близкой к максимальной продолжительности жизни M. arenaria в Белом море – 23–25 лет.
В результате анализа динамики численности отдельных генераций песчаных ракушек можно выделить несколько обстоятельств, определяющих выживаемость M. arenaria на протяжении жизненного цикла: степень защищенности особей (во многом определена глубиной закапывания моллюсков), внутривидовые отношения и старение. Однако выявленные закономерности возможно справедливы не только для песчаных ракушек. Так, колебание скорости элиминации в течение онтогенеза оказалось свойственно и самым долгоживущим из рассмотренных видов – Arctica islandica. Не было возможности оценить выживаемость моллюсков до 14-летнего возраста, однако в динамике генерации 1969 г. в возрасте от 15 до 33 лет прослеживаются два периода относительно стабильной численности, разделенных кратковременным (в 1–2 года) промежутком повышенной смертности особей. Относительно резкая элиминация А. islandica к 35-летнему возрасту (к 2005 г.) позволяет предположить, что средняя продолжительность жизни большинства особей генерации 1969 г. была ~35 лет. По-видимому, отдельные представители этого поколения жили дольше, поскольку их находили летом 2017 г.
Таким образом, анализ снижения численности особей в возрастных группах в беломорских поселениях Bivalvia показал, что смертность не может рассматриваться как постоянная величина на протяжении жизненного цикла моллюсков. В течение этого периода возможные причины повышения уровня смертности могут быть следующие: 1) обитание в поверхностном слое грунта на начальных этапах жизненного цикла (нестабильная среда, высокая смертность нежизнеспособных особей, влияние хищников); 2) напряженные внутривидовые отношения в плотных скоплениях молоди; 3) усиление внутривидовой конкуренции вследствие быстрого роста моллюсков; 4) старение (достижение средней и максимальной продолжительности жизни).
Выводы. Выявлена значительная пространственно-временная гетерогенность показателей элиминации в поселениях беломорских двустворчатых моллюсков. Средняя (независимо от возраста) годовая скорость элиминации особей оказалась весьма чувствительна к окружающей среде и могла бы служить интегральной оценкой условий существования моллюсков. Для отдельных представителей беломорских Bivalvia этот показатель варьировал в 1.5–2 раза в разных поселениях одного и того же вида и, как следствие, в разных местообитаниях продолжительность доминирования одного поколения существенно различалась (в ≥2 раза). В качестве сравнительной оценки средней скорости элиминации вполне может быть использован параметр экспоненциальной модели, описывающий снижение численности моллюсков с возрастом. Показано, что скорость элиминации не является постоянной величиной на протяжении жизненного цикла моллюсков В поселениях беломорских моллюсков скорость элиминации особей разного возраста варьировала, как правило, в десятки раз. Основное влияние на выживаемость животных оказывали степень их защищенности, внутривидовые отношения и старение.
Список литературы
Алимов А.Ф. 1989. Введение в продукционную гидробиологию. Ленинград: Гидрометеоиздат.
Бабков А.И. 1982. Краткая гидрологическая характеристика губы Чупа Белого моря // Экологические исследования перспективных объектов марикультуры фауны Белого моря. Ленинград: Изд-во Зоол. ин-та АН СССР. С. 3.
Бабков А.И., Голиков А.Н. 1984. Гидробиокомплексы Белого моря. Ленинград: Изд-во Зоол. ин-та РАН.
Бабков А.И., Прыгункова Р.В. 1974. Аномалии сезонного развития зоопланктона и гидрологических условий в губе Чупа Белого моря // Гидробиология и биогеография шельфов холодных и умеренных вод Мирового океана. Ленинград: Наука. С. 99.
Белое море. Биологические ресурсы и проблемы их рационального использования. 1995. Сер.: Исследование фауны морей. Вып. 42(50). Санкт-Петербург: Зоол. ин-т РАН. Ч. I.
Бурковский И.В., Столяров А.П., Удалов А.А. 1998. Личинки как фактор формирования сообщества илисто-песчаной литорали Белого моря // Зоол. журн. Т. 77. № 11. С. 1229.
Герасимова А.В. 2021. Пространственно-временная организация поселений морских двустворчатых моллюсков (на примере Белого моря): Дис. … докт. биол. наук. Санкт-Петербург. 572 с.
Герасимова А.В., Максимович, Н.В. 2009. О закономерностях организации поселений массовых видов двустворчатых моллюсков Белого моря // Вестник Санкт-Петербург. гос. ун-та. Сер. 3. Вып. 3. С. 82.
Герасимова А.В., Григорьева А.С., Максимович Н.В. 2017a. Механизмы организации поселений Arctica islandica (Linnaeus, 1767) в Белом море: многолетняя ротация или мнимая стационарность // Матер. XX науч. семинара “Чтения памяти К.М. Дерюгина”, 01.12.2017. Санкт-Петербург. С. 35.
Герасимова А.В., Филиппова Н.А., Максимович Н.В. 2017b. Стабильность и изменчивость популяционных характеристик Macoma balthica L. в Белом море // XIII Всерос. конф. с междунар. участием “Изучение, рациональное использование и охрана природных ресурсов Белого моря”. Сборник материалов. Санкт-Петербург, 17–20 октября 2017 г. Санкт-Петербург. С. 36.
Гиляров А.М. 1990. Популяционная экология: Учеб. пособие. Москва: Изд-во МГУ.
Голиков А.Н., Скарлато О.А., Гальцова В.В., Меншуткина Т.В. 1985. Экосистемы губы Чупа Белого моря и их сезонная динамика // Биоценозы губы Чупа Белого моря и их сезонная динамика. Ленинград: Наука. С. 5.
Кузнецов В.В. 1960. Белое море и биологические особенности его флоры и фауны. Москва: Изд-во АН СССР.
Кулаковский Э.Е., Флячинская Л.П. 1993. Особенности личиночного развития беломорских мидий (Mytilus edulis L.). Формирование элементов регуляторных систем // Тр. Зоол. ин-та РАН. Т. 253. Санкт-Петербург. С. 61.
Лисицына К.Н., Герасимова А.В. 2019. Сколько лет живут Macoma calcarea (Gmelin) в Белом море: определение возраста по внешней морфологии и спилам раковины // Биология – Наука ХХI века: 23-я Междунар. Пущинская шк.-конф. молодых ученых: Сб. тезисов. г. Пущино, 15–19 апреля 2019 г. Пущино. С. 53.
Луканин В.В., Ошурков В.В. 1981. Структура литоральных поселений мидий в Кандалакшском заливе Белого моря // Биология моря. № 5. С. 33.
Луканин В.В., Наумов А.Д., Федяков В.В. 1986. Динамика размерной структуры поселений беломорских мидий (Mytilus edulis L.) // Экологические исследования донных организмов Белого моря. Ленинград: Зоол. ин-т АН СССР. С. 50.
Луканин В.В., Наумов А.Д., Федяков В.В. 1990. Поселения мидий: постоянное непостоянство // Природа. № 11. С. 56.
Петелин В.П. 1967. Гранулометрический анализ морских донных осадков. Москва: Наука.
Садыхова И.А. 1982. Изменение численности и размерного состава популяции Mya arenaria L. в Белом море // Повышение продуктивности и рациональное использование биологических ресурсов Белого моря: Матер. 1 координационного совещ. (май 1982 г.) Ленинград: Б.-и. Ленинград. С. 73.
Свешников В.А. 1963. Биоценотические связи и условия существования некоторых кормовых беспозвоночных инфауны литорали Кандалакшского залив Белого моря // Тр. Кандалакшского заповед. Вып. 4. С. 114.
Шкляревич Г.А., Щербакова И.Б. 2004. Многолетние изменения поселений Mya arenaria на литорали Кандалакшского залива Белого моря // Проблемы изучения, рационального использования и охраны ресурсов Белого моря: Матер. IX междунар. конф. Петрозаводск, Карелия, 11–14 октября 2004. Петрозаводск. С. 327.
Allen K.R. 1971. Relation between production and biomass // Can. J. Fish and Aquat. Sci. V. 28. P. 1537.
Ankar S. 1980. Growth and production of Macoma balthica (L.) in a northern baltic soft bottom // Ophelia. Suppl. 1. P. 31.
Appeldoorn R.S. 1983. Variation in the growth rate of Mya arenaria and its relationship to the environment as analyzed through principal component analysis and the w parameter of von Bertalanffy equation // Fish. Bull. V. 81. № 1. P. 75.
Armonies W. 1996. Changes in distribution patterns of 0-group bivalves in the Wadden Sea: Byssus-drifting releases juveniles from the constraints of hydrography // J. Sea Res. V. 35. № 4. P. 323.
Armonies W., Hellwig-Armonies M. 1992. Passive settlement of Macoma balthica spat on tidal flats of the Wadden Sea and subsequent migration of juveniles // Neth. J. Sea Res. V. 29. № 4. P. 371.
Bachelet G. 1986. Recruitment and year-to-year variability in a population of Macoma balthica (L.) // Hydrobiologia. V. 142. № 1. P. 233.
Beal B.F. 2006a. Biotic and abiotic factors influencing growth and survival of wild and cultured individuals of the softshell clam (Mya arenaria L.) in eastern Maine // J. Shellfish Res. V. 25. № 2. P. 461.
Beal B.F. 2006b. Relative importance of predation and intraspecific competition in regulating growth and survival of juveniles of the soft-shell clam, Mya arenaria L., at several spatial scales // J. Exp.Marine Biol. Ecol. V. 336. № 1. P. 1.
Beal B.F., Kraus G.M. 2002. Interactive effects of initial size, stocking density, and type of predator deterrent netting on survival and growth of cultured juveniles of the soft-shell clam, Mya arenaria L., in eastern Maine // Aquaculture. V. 208. № 1–2. P. 81. https://doi.org/10.1016/S0044-8486(01)00900-0
Beal B.F., Coffin C.R., Randall S.F. et al. 2018. Spatial Variability in Recruitment of an Infaunal Bivalve: Experimental Effects of Predator Exclusion on the Softshell Clam (Mya arenaria L.) along Three Tidal Estuaries in Southern Maine, USA // J. Shellfish Res. V. 37. № 1. P. 1.
Beal B.F., Parker M.R., Vencile K.W. 2001. Seasonal effects of intraspecific density and predator exclusion along a shore-level gradient on survival and growth of juveniles of the soft-shell clam, Mya arenaria L., in Maine, USA // J. Exp. Marine Biol. Ecol. V. 264. № 2. P. 133. https://doi.org/10.1016/S0022-0981(01)00320-3
Begon M., Harper J.L., Townsend C.R. 1996. Ecology: Individuals, Populations, and Communities. Oxford: Blackwell Science.
Begum S., Basova L., Heilmayer O. et al. 2010. Growth and Energy Budget Models of the Bivalve Arctica islandica at Six Different Sites in the Northeast Atlantic Realm // J. Shellfish Res. V. 29. № 1. P. 107. https://doi.org/10.2983/035.029.0103
Berger V.J., Naumov A.D., Usov N.V. et al. 2003. 36-Years Time-Series (1963–1998) of Zooplankton, Temperature and Salinity in the White Sea: Saint Petersburg: Silver Spring.
Beukema J.J. 1993. Successive changes in distribution patterns as an adaptive strategy in the bivalve Macoma balthica (L.) in the Wadden sea // Helgoland Mar. Res. V. 47. № 3. P. 287.
Beukema J.J., Dekker R. 2005. Decline of recruitment success in cockles and other bivalves in the Wadden Sea: possible role of climate change, predation on postlarvae and fisheries // Mar. Ecol. Progress Series. V. 287. P. 149. https://doi.org/10.3354/meps287149
Beukema J.J., Dekker R. 2007. Variability in annual recruitment success as a determinant of long-term and large-scale variation in annual production of intertidal Wadden Sea mussels (Mytilus edulis) // Helgoland Mar. Res. V. 61. № 2. P. 71. https://doi.org/10.1007/s10152-006-0054-3
Beukema J.J., Dekker R. 2014. Variability in predator abundance links winter temperatures and bivalve recruitment: correlative evidence from long-term data in a tidal flat // Mar. Ecol. Progress Series. V. 513. P. 1. https://doi.org/10.3354/meps10978
Beukema J.J., Honkoop P., Dekker R. 1998. Recruitment in Macoma balthica after mild and cold winters and its possible control by egg production and shrimp predation // Hydrobiologia. V. 375. P. 23. https://doi.org/10.1023/A:1017025526098
Beukema J.J., Dekker R., Essink K., Michaelis H. 2001. Synchronized reproductive success in the main bivalve species in the Wadden Sea: causes and consequences // Mar. Ecol. Progress Series. V. 211. P. 143. https://doi.org/10.3354/meps211143
Bowen J., Hunt H. 2009. Settlement and Recruitment Patterns of the Soft-Shell Clam, Mya arenaria, on the Northern Shore of the Bay of Fundy, Canada // Estuaries and Coasts. V. 32. № 4. P. 758. https://doi.org/10.1007/s12237-009-9151-2
Brey T. 1999. Growth Performance and Mortality in Aquatic Macrobenthic Invertebrates // Advances in Marine Biology: Academic Press. P. 153.
Brey T., Arntz W.E., Pauly D., Rumohr H. 1990. Arctica (Cyprina) islandica in Kiel Bay (Western Baltic): growth, production and ecological significance // J. Exp. Mar. Biol. Ecol. V. 136. № 3. P. 217. https://doi.org/10.1016/0022-0981(90)90162-6
Brousseau D.J. 1978. Population dynamics of the soft-shell clam Mya arenaria // Mar. Biol. V. 50. № 1. P. 63.
Brousseau D.J., Baglivo J.A. 1984. Sensitivity of the population growth rate to changes in single life history parameters: its application to Mya arenaria (Mollusca: Pelecypoda) // Fishery Bulletin. V. 82. № 3. P. 537.
Brousseau D.J., Baglivo J.A. 1988. Life tables for two field populations of soft-shall clam, Mya arenaria, (Mollusca: Pelecypoda) from Long Island Sound // Fishery Bulletin. V. 86. P. 567.
Clements J.C., Hunt H.L. 2017. Effects of CO2-driven sediment acidification on infaunal marine bivalves: A synthesis // Mar. Pollut. Bull. V. 117. № 1–2. P. 6. https://doi.org/10.1016/j.marpolbul.2017.01.053
Clements J.C., Woodard K.D., Hunt H.L. 2016. Porewater acidification alters the burrowing behavior and post-settlement dispersal of juvenile soft-shell clams (Mya arenaria) // Journal of Experimental Marine Biology and Ecology. V. 477. P. 103. https://doi.org/10.1016/j.jembe.2016.01.013
Commito J.A. 1982. Effects of Lunatia heros predation on the population dynamics of Mya arenaria and Macoma balthica in Maine, USA // Mar. Biol. V. 69. № 2. P. 187.
Connell J.H. 1961. The influence of interspecific competition and other factors on the distribution of the barnacle Chthamalus stellatus // Ecology. V. 42. № 4. P. 710.
Connell J.H. 1970. A predator-prey system in the marine intertidal region. I. Balanus glandula and several predatory species of Thais // Ecol. Monographs. V. 40. № 1. P. 49.
Dare P.J. 1976. Settlement, growth and production of the mussel, Mytilus edulis L., in Morecambe Bay, England. London: Her Majesty’s Stationery Office. (Fishery Investigations. Ministry of Agriculture. Fish. Food. Ser. II. V. 28).
Elmgren R., Ankar S., Marteleur B., Ejdung G. 1986. Adult Interference with Postlarvae in Soft Sediments: The Pontoporeia-Macoma Example // Ecology. V. 67. № 4. P. 828.
Flach E.C. 2003. The separate and combined effects of epibenthic predation and presence of macro-infauna on the recruitment success of bivalves in shallow soft-bottom areas on the Swedish west coast // J. Sea Res. V. 49. № 1. P. 59. https://doi.org/10.1016/S1385-1101(02)00199-5
Frank P.W. 1969. Growth rates and longevity of some gastropod mollusks on the coral reef at Heron Island // Oecologia. V. 2. № 2. P. 232.
Freeman K.R., Dickie L.M. 1979. Growth and mortality of the blue mussel Mytilus edulis in relation to environmental indexing // J. Fish Res. Board Canada. V. 36. № 10. P. 1238.
Gerasimova A., Maximovich N. 2013. Age-size structure of common bivalve mollusc populations in the White Sea: the causes of instability // Hydrobiologia. V. 706. № 1. P. 119. https://doi.org/10.1007/s10750-012-1415-3
Gerasimova A., Maximovich N., Filippova N. 2015. Cohort life tables for a population of the soft-shell clam, Mya arenaria L., in the White Sea // Helgoland Mar. Res. V. 69. № 2. P. 141. https://doi.org/10.1007/s10152-014-0423-2
Gerasimova A.V., Maximovic N.V., Filippov N.A. et al. 2021. Bivalve Mya arenaria L. as a model object in demecology: dynamics of bed structure, mortality and growth in the Kandalaksha Bay of the White Sea // Hydrobiologia. V. 848. № 19. P. 4511. https://doi.org/10.1007/s10750-021-04658-y
Green R.H. 1973. Growth and mortality in an arctic intertidal population of Macoma balthica (Pelecypoda, Tellinidae) // J. Fish Res. Board Canada. V. 30. P. 1345.
Green M.A., Waldbusser G.G., Reilly S.L. et al. 2009. Death by dissolution: Sediment saturation state as a mortality factor for juvenile bivalves // Limnol., Oceanogr. V. 54. № 4. P. 1037. https://doi.org/10.4319/lo.2009.54.4.1037
Green M.A., Waldbusser G.G., Hubazc L. et al. 2013. Carbonate Mineral Saturation State as the Recruitment Cue for Settling Bivalves in Marine Muds // Estuaries and Coasts. V. 36. № 1. P. 18. https://doi.org/10.1007/s12237-012-9549-0
Hiddink J.G., Hofstede R.T., Wollf W.J. 2002. Predation of intertidal infauna on juveniles of the bivalve Macoma balthica // J. Sea Res. V. 47. № 2. P. 141. https://doi.org/10.1016/S1385-1101(02)00107-7
Holland A.F., Mountford N.K., Hiegel M.H. et al. 1980. Influence of predation on infaunal abundance in Upper Chesapeake Bay, USA // Mar. Biol. V. 57. № 3. P. 221.
Honkoop P.J.C., van der Meer J., Beukema J.J., Kwast D. 1998. Does temperature-influenced egg production predict the recruitment in the bivalve Macoma balthica? // Mar. Ecol. Progress Series. V. 164. P. 229. https://doi.org/10.3354/meps164229
Hunt H.L., Scheibling R.E. 1997. Role of early post-settlement mortality in recruitment of benthic marine invertebrates // Mar. Ecol. Progress Series. V. 155. P. 269. https://doi.org/10.3354/meps155269
Hunt H., Archie McLean D., Mullineaux L. 2003. Post-settlement alteration of spatial patterns of soft shell clam (Mya arenaria) recruits // Estuaries and Coasts. V. 26. № 1. P. 72. https://doi.org/10.1007/BF02691695
Josefson A.B. 1982. Regulation of population size, growth, and production of a deposit-feeding bivalve: A long-term field study of three deep-water populations off the swedish west coast // J. Exp. Mar. Biol. Ecol. V. 59. № 2–3. P. 125. https://doi.org/10.1016/0022-0981(82)90111-3
Kilada R.W., Campana S.E., Roddick D. 2007. Validated age, growth, and mortality estimates of the ocean quahog (Arctica islandica) in the western Atlantic // ICES Journal of Marine Science. V. 64. № 1. P. 31. https://doi.org/10.1093/icesjms/fsl001
Kühl H. 1951. Uber die siedlungsweise von Mya arenaria // Verhandlungen der Deutschen Zoologischen Gesellschaft. Bd 25. S. 358.
McGrorty S., Clarke R.T., Reading C.J., Goss-Custard J.D. 1990. Population dynamics of the mussel Mytilus edulis: density changes and regulation of the population in the Exe estuary, Devon // Marine Ecology Progress Series. V. 67. P. 157.
McGrorty S., Goss-Custard J.D. 1993. Population Dynamics of the Mussel Mytilus edulis along Environmental Gradients: Spatial Variations in Density-Dependent Mortalities // J. Animal Ecol. V. 62. № 3. P. 415.
Murawski S.A., Ropes J.W., Serchuk F.M. 1982. Growth of the ocean quahog, Arctica islandica, in the Middle Atlantic Bight // Fishery Bulletin. V. 80. P. 21.
NEFSC. 1995. Report of the 19th Northeast Regional Stock Assessment Workshop (19th SAW): Stock Assessment Review Committee (SARC) consensus summary of assessments. Woods Hole, MA: NOAA/National Marine Fisheries Service. (Northeast Fish Sci Cent Ref Doc. 95-08).
Perron F.E. 1983. Growth, Fecundity, and Mortality of Conus pennaceus in Hawaii // Ecology. V. 64. № 1. P. 53.
Petersen G.H. 1978. Life cycles and population dynamics of marine benthic bivalves from the Disko Bugt area of West Greenland // Ophelia. V. 17. № 1. P. 95.
Philippart C.J.M., Aken H.M.V., Beukema J.J. et al. 2003. Climate-related changes in recruitment of the bivalve Macoma balthica // Limnol., Oceanogr. V. 48. № 6. P. 2171. https://doi.org/10.4319/lo.2003.48.6.2171
Powell E.N., Mann R. 2005. Evidence of recent recruitment in the ocean quahog Arctica islandica in the Mid-Atlantic Bight // J. Shellfish Res. V. 24. P. 517.
Schafer W. 1972. Ecology and Palaeoecology of marine environments. Chicago: University of Chicago Press.
Steingrimsson S.A., Thorarinsdottir G.G. 1995. Age structure, growth and size at sexual maturity in ocean quahog, Arctica islandica L. (Mollusca Bivalvia), off NW-Iceland // ICES Document.
Strasser M. 2002. Reduced epibenthic predation on intertidal bivalves after a severe winter in the European Wadden Sea // Mar. Ecol. Progress Series. V. 241. P. 113. https://doi.org/10.3354/meps241113
Strasser M., Dekker R., Essink K. et al. 2003. How predictable is high bivalve recruitment in the Wadden Sea after a severe winter? // J. Sea Res. V. 49. № 1. P. 47. https://doi.org/10.1016/S1385-1101(02)00198-3
Strasser M., Günther C.-P. 2001. Larval supply of predator and prey: temporal mismatch between crabs and bivalves after a severe winter in the Wadden Sea // J. Sea Res. V. 46. № 1. P. 57. https://doi.org/10.1016/S1385-1101(01)00063-6
Strasser M., Reinwald T., Reise K. 2001. Differential effects of the severe winter of 1995/96 on the intertidal bivalves Mytilus edulis, Cerastoderma edule and Mya arenaria in the Northern Wadden Sea // Helgoland Mar. Res. V. 55. № 3. P. 190. https://doi.org/10.1007/s101520100079
Weinberg J.R. 1985. Factors regulating population dynamics of the marine bivalve Gemma gemma: intraspecific competition and salinity // Mar. Biol. V. 86. № 2. P. 173.
Yap W.G. 1977. Population Biology of the Japanese Little-neck Clam, Tapes philippinarum, in Kaneohe Bay, Oahu, Hawaiian Islands // Pacific Science. V. 31. № 3. P. 223.
Yusuf F., Martins J.M., Swanson D. 2014. Life Tables // Methods of Demographic Analysis: Springer Netherlands. P. 143.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод