Биология внутренних вод, 2022, № 6, стр. 766-774
Сезонные изменения пространственной структуры зообентоса в оз. Южный Волос (Беларусь)
И. И. Лапука *
Научно-практический центр Национальной академии наук Беларуси по биоресурсам
Минск, Беларусь
* E-mail: ilya.lapua@yandex.ru
Поступила в редакцию 31.05.2022
После доработки 06.06.2022
Принята к публикации 25.06.2022
- EDN: NNCVAC
- DOI: 10.31857/S0320965222060110
Аннотация
Изучена пространственная структура зообентоса в оз. Южный Волос в разные сезоны года. Установлены особенности сезонного распределения общей численности и биомассы макрозообентоса, его основных таксономических групп и отдельных видов и влияние на них ключевых экологических факторов (кислорода и температуры). Зарегистрировано два пика количественных показателей зообентоса: первый – в границах подводной растительности, где максимальные значения в общем зообентосе определяла дрейссена, а в “мягком” бентосе, в зависимости от сезона года, – разные виды хирономид и водяные ослики; второй обусловлен развитием реликтового рачка монопарея родственная.
ВВЕДЕНИЕ
Изучение пространственной неоднородности макрозообентоса, ее масштабы, характерные особенности, способы формирования и методы анализа – важнейшая, но до сих пор еще недостаточно разработанная область экологии (Смуров, Полищук, 1983; Greig-Smith, 1983; Гиляров, 1990). В то же время исследования в установлении пространственной структуры макрозообентоса относятся к актуальным, поскольку макрозообентос зарекомендовал себя как эффективная группа индикаторов в мониторинге качества воды и экологической целостности экосистемы (Covich et al., 1999; Vanni, 2002; Saxena, 2014) – они чувствительны к изменениям среды обитания, проявляют слабую миграцию и способны отражать долгосрочные изменения в экосистемах (Chen et al., 2009; Zhang et al., 2011, 2015; Ekingen, Kazanci, 2021).
Цель работы – выявить особенности пространственного распределения зообентоса в оз. Южный Волос в разные сезоны года и оценить влияние основных факторов среды (температуры и кислорода).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для работы послужили пробы зообентоса, отобранные один раз в ноябре, декабре, марте и июле 2019–2021 г. в оз. Южный Волос на станциях разной глубины (1, 6, 8, 10, 12, 15, 20, 40 м) (рис. 1). Пробы отбирали дночерпателем системы Боруцкого с площадью захвата 0.0225 м2 (не менее трех дночерпателей на станции). Одновременно, на каждом метре глубины, измеряли температуру и концентрацию кислорода термооксиметром Hanna HI 9143. Прозрачность определяли по диску Секки.
Рис. 1.
Карта-схема отбора проб зообентоса в оз. Южный Волос. Стрелками обозначено движение воды, впадающие ручьи, протоки и т.д.

Учет и измерение животных проводили под бинокулярным микроскопом МБС-10 при увеличении ×56. Детали морфологии уточняли с помощью микроскопа Jenaval при увеличении до ×250. Для определения животных использовали работы (Черновский, 1949; Винберг и др., 1977; Wallace et al., 1990; Edington, Hildrew, 1995; Андреева и др., 1999; Timm, 2015; Цалолихин и др., 2016).
Для оценки состояния сообществ макрозообентоса использовали: численность (N), биомассу (B), частоту встречаемости (Р), количество видов (S) и индексы видового разнообразия Шеннона–Уивера, индекс Симпсона, рассчитанные по численности с помощью программы BioDiversity Pro. Дисперсионный анализ (ANOVA) использовали для определения достоверности влияния основных экологических факторов (кислорода и температуры) и изменений сезонов года на абсолютные величины изученных показателей, а также тест Колмогорова–Смирнова для оценки нормальности распределения данных.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Озеро Южный Волос имеет высокую (7.5–10 м) прозрачность воды. Летом температура колебалась от 5.1°С у дна, до 21.4°С у поверхности. Эпилимнион занимал верхний 5-метровый слой, металимнион заканчивался на глубине 16 м. В зимний и весенний периоды года была отмечены температуры 2.6–3.6 и 2.6–2.8°С соответственно. Осенью (в ноябре) толща воды была разделена на две почти равные части: от поверхности до глубины 17 м температура была 7.7°С, с глубины 19 м и до дна – 5.9–5.3°С (рис. 2a), что указывает на еще не завершенный процесс осеннего перемешивания.
Содержание кислорода в июле изменялось от 7.7 мг/л у поверхности до 1.9 мг/л у дна (рис. 2б). В зоне металимнионна шло увеличение концентрации кислорода до 12.4 мг/л. Зону оксиклина наблюдали до глубины 21 м, далее шло постепенное снижение концентрации кислорода до дна. В ноябре толща воды была разделена на две части: до глубины 17 м содержание кислорода колебалось от 9.2 до 9.8 мг/л, ниже глубины 18 м кислород отсутствовал. По-видимому, это связано с затянувшейся осенью и неполным перемешиванием толщи воды. В декабре наблюдали полное насыщение воды кислородом (14.5 мг/л).
В марте в зоне эпилимниона содержание кислорода постепенно уменьшалось от поверхности (12.4 мг/л) до глубины 5 м (10.5 мг/л). По всей зоне металимниона шло постепенное увеличение содержания растворенного кислорода до 11.3 мг/л. На глубине 16–19 м концентрация растворенного кислорода резко снижалась, и наступала гомооксигения в гиполимнионе с достаточно высоким содержанием кислорода (9.2 мг/л).
За время наблюдений в оз. Южный Волос выявлено 72 таксона видового и надвидового рангов донных макробеспозвоночных (представителей олигохет, мокрецов и слепней не определяли). По видовому богатству лидировали личинки хирономид (32 таксона) и моллюски (9). Остальные таксономические группы встречались в относительно небольших количествах видов.
Наибольшее количество таксонов зарегистрировано в ноябре (56), наименьшее – в июле (25). Самое высокое таксономическое обилие (45) отмечено ст. 6 м, отличавшейся обильным развитием подводной растительности.
Расчет индекса Шеннона–Уивера, характеризующий разнообразие и выравненность в структуре сообщества, и индекс Симпсона, оценивающий степень выраженности доминирования определенных видов в структуре сообщества (Пузнецките, Марушкина, 2005; Шитиков и др., 2011), показал, что и в среднем за год, и по сезонам идет уменьшение доминирования определенных видов и увеличение выравненности от литорали до глубин подводной растительности (6–8 м), где зафиксировано во все сезоны года максимальное количество таксонов, при продвижении к максимальным глубинам увеличивается доминирование и уменьшается выровненность таксономического разнообразия (рис. 3а). Пространственно-временное распределение разнообразия зообентоса во все сезоны повторяло среднегодовую динамику распределения (рис. 3б).
Рис. 3.
Пространственное (а, б) и пространственно-временные (в, г) изменения разнообразия зообентоса в оз. Южный Волос: а, в – индекс Шеннона, б, г – индекс Симпсона.
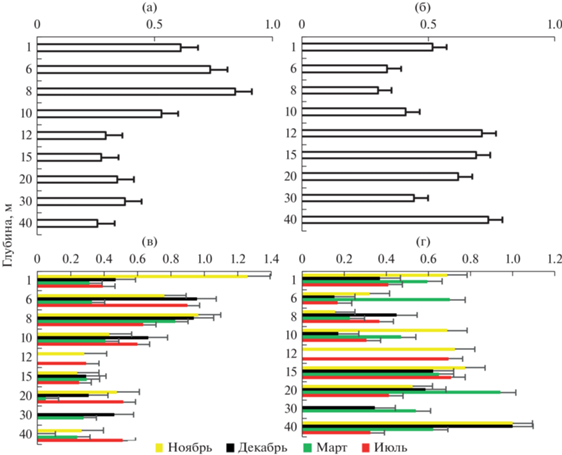
Во все сезоны отмечены наибольшая выровненность разнообразия по численности в зоне подводной растительности и увеличение доминирования по численности некоторых таксонов с увеличением глубины. Выравненность нарушалась доминированием с 10 до 20 м, по численности преобладала Monoporeia affinis Lindström, 1885, на максимальных глубинах – Oligochaeta gen. spp. и представители сем. Chironomidae. Установлено достоверное влияние сезонов года на индекс Шеннона (F = 3.01, p = 0.05).
В пространственном распределении численности зообентоса в оз. Южный Волос наблюдали ее волнообразное изменение с увеличением на двух горизонтах – 6–8 и 12–15 м. Причем, эти два пика численности были характерны и для общего зообентоса, и для “мягкого” зообентоса (рис. 4).
Рис. 4.
Пространственное распределение численности (экз./м2) зообентоса в оз. Южный Волос: а – общий зообентос, б – “мягкий” зообентос.
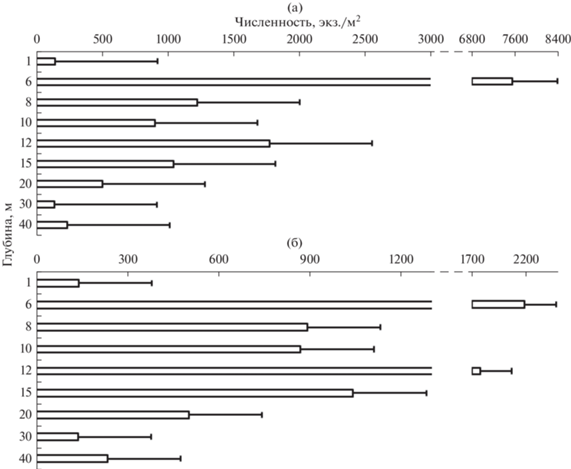
Высокая численность зообентоса на глубине 6 м обусловлена развитием дрейссены на подводной растительности, как единственного субстрата для прикрепления в озере. Максимальная численность “мягкого” бентоса зависела от развития некоторых видов хирономид (Chironomus f.l. plumosus (Meigen, 1830), Endochironomus impar (Walker, 1856), Dicrotendipes nervosus (Staeger, 1839), Polypedilum nubeculosum (Meigen, 1804), Tanytarsus gr. gregarius (Kieffer, 1909), Procladius sp.) и обильного развития Asellus aquaticus (L., 1758). Последующее увеличение численности на глубинах 12–15 м было вызвано развитием Monoporeia affinis. В пространственно-временном распределении численности зообентоса наблюдали те же тенденции, что и в распределении общей средней численности зообентоса (рис. 5). Во все сезоны было два пика численности зообентоса, до 6–8 м она возрастала до максимальных значений. Максимальная численность в зоне подводной растительности (6–8 м) зависела от доминирования различных таксонов: в ноябре – от Dreissena polymorpha (Pallas, 1771) (8459 экз./м2), Asellus aquaticus (2178 экз./м2), Polypedilum nubeculosum (356 экз./м2), в декабре – Dreissena polymorpha (47 экз./м2), Asellus aquaticus (22 экз./м2), в марте – Dreissena polymorpha (12 415 экз./м2), Endochironomus impar (341 экз./м2), в июле – Dreissena polymorpha (207 экз./м2), Tanytarsus gr. gregarius (104 экз./м2). Далее шло постепенное снижение численности и дальнейший ее подъем на глубине 12–15 м за счет увеличения численности Monoporeia affinis, которая колебалась от 5 (в декабре) до 2133 экз./м2 (в ноябре).
Рис. 5.
Пространственно-временное распределение численности (экз./м2) зообентоса в оз. Южный Волос: а – общий зообентос, б – “мягкий” зообентос.
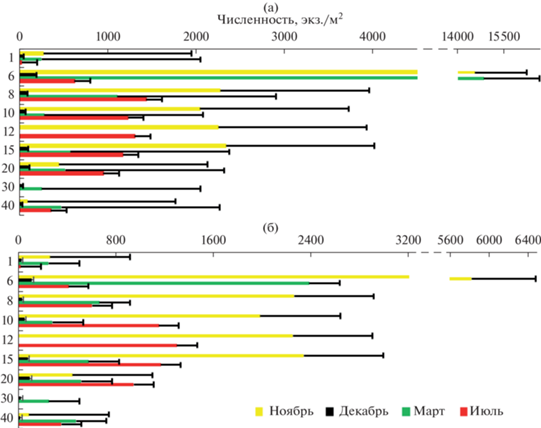
Установлено статистически значимое влияние на пространственно-временное распределение численности зообентоса температуры воды – на класс Diptera (F = 8.1; p = 0.05) и класс Malacostraca (F = 3.01; p = 0.05) и влияние концентрации растворенного кислорода на те же классы: (F = 15.3; p = 0.05) и (F = 15.05; p = 0.05), соответственно.
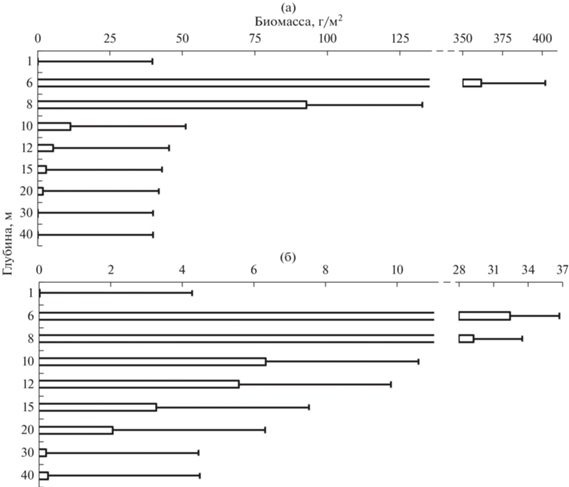
Пространственное распределение биомассы имело небольшие отличия от такового численности зообентоса (рис. 6). Максимум общей биомассы зарегистрирован на глубине 6 м из-за преобладания на этой глубине дрейссены, а в “мягком зообентосе” – Asellus aquaticus, кроме июля, когда доминировали представители Oligochaeta gen. spp. Ниже глубины 6 м шло постепенное снижение биомассы с минимумом на максимальных глубинах.
Рис. 6.
Пространственное распределение биомассы зообентоса в оз. Южный Волос: а – общий зообентос, б – “мягкий” зообентос.
Пространственно-временное распределение биомассы во все сезоны имело сходные черты – увеличение биомассы от литорали до глубины подводной растительности, с резким дальнейшим уменьшением на максимальных глубинах (рис. 7).
Рис. 7.
Пространственно-временное распределение биомассы зообентоса в оз. Южный Волос: а – общий зообентос, б – “мягкий” зообентос.
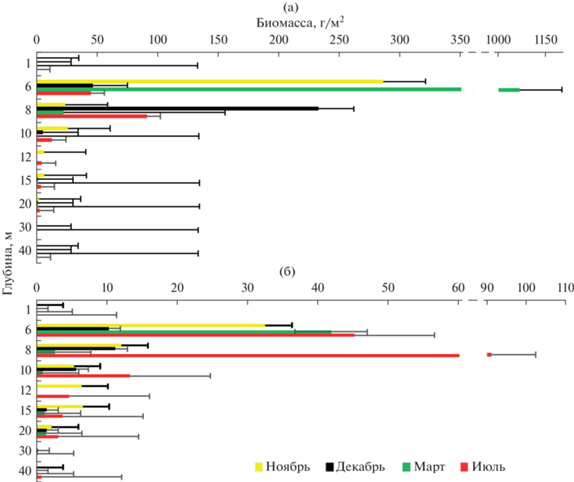
Во все месяцы исследования максимальная биомасса зообентоса была в зоне подводной растительности (6–8 м) и зависела от обилия моллюсков (от 84.7 г/м2 в июле до 1026.8 г/м2 в декабре). В “мягком” зообентосе, в декабре и марте, в зоне подводной растительности доминировали представители Oligochaeta gen. spp. 220.75 и 1030.4 г/м2 соответственно, в ноябре – представители класса Malacostraca (355.12 г/м2), в июле – Oligochaeta gen. spp. и Malacostraca с почти равными массами (3.05 и 3.03 г/м2 соответственно). После глубин подводной растительности во все сезоны наибольшей биомассой обладают представители класса Malacostraca, в частности за счет численного доминирования Monoporeia affinis, на которую приходится основная доля биомассы зообентоса.
Установлено влияние температуры на пространственное распределение биомассы представителей Diptera (F = 16.56; p = 0.05), прочих насекомых (F = 14.7; p = 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Различия в видовом составе и численности макрозообентоса часто связаны с морфометрическими показателями водоема: глубиной и формой (Olenin et al., 1997; Laine, 2003; Coleman et al., 2007; Алимов, 2008, 2012), а также с типом донных отложений (Chapman et al., 1997; Reynoldson et al., 1995). Кроме того, макрофиты создают пространственную гетерогенность, как защиту от хищников (Gong et al., 2000; Clemente et al., 2019). Для оз. Южный Волос максимальные значения разнообразия, численности и биомасссы характерны для глубин, которые являются верхней границей термоклина, и где располагается верхняя граница металимнионного максимума. Помимо температуры и кислорода, на максимальные значения влияло и произрастание макрофитов на глубинах 6–8 м. Наибольшее таксономическое разнообразие отмечено в ноябре, наименьшее – в июле, что соответствует жизненным циклам большинства насекомых. Из-за вылета насекомых и создание последующих генераций, в зависимости от сезонов года, происходит смещение выровненности разнообразия, на которую и влияет изменение сезонов года.
Известно, что биологическое разнообразие в сообществах водных животных также зависит от факторов внешней среды: температуры, содержания кислорода, количества взвешенных веществ, гидрохимических характеристик, глубины, рН и др., соответственно и структура сообществ макрозообентоса под воздействием этих факторов должна меняться во времени и пространстве. В оз. Южный Волос пространственная структура зообентоса относительно стабильна. Во все сезоны на глубине произрастания макрофитов, независимо от сезона года, всегда доминирует дрейссена. В “мягком” зообентосе различные доминантные виды сем. Chironomidae в зависимости от месяца исследования меняются: в ноябре – Polypedilum nubeculosum, декабре – Chironomus f. l. plumosus, марте – Endochironomus impar, июле – Tanytarsus gr. gregarius. Такое изменение структуры по сезонам связано с влияние основных экологических факторов (температуры и кислорода) на численность хирономид. Однако, выявленное влияние экологических факторов на пространственное распределение представителей класса Malacostraca, в основном, связано с предпочтением реликтового ракообразного Monoporeia affinis, располагаться в оз. Южный Волос на глубинах от 12 до 30 м в зависимости от температурного и кислородного режимов (Сущеня и др., 1986).
Выводы. Таксономическая структура оз. Южный Волос включает в себя 72 таксонa видового и надвидового рангов. В зависимости от сезона года ядром таксономической структуры являются представители сем. Chironomidae (в ноябре – Polypedilum nubeculosum, декабрe – Chironomus f.l. plumosus, мартe – Endochironomus impar; июлe – Tanytarsus gr. gregarius). Наиболее высокие показатели видового разнообразия зарегистрированы в зоне подводной растительности. Пространственное распределение численности и биомассы имели схожий характер – их увеличение от литоральной зоны до верхней границы термоклина и металимнионного скачка концентрации кислорода, где произрастают макрофиты. Однако, численность повторно увеличивалась, в зависимости от сезона года, благодаря развитию Monoporeia affinis. Изменения в пространственной структуре зообентоса вызваны влиянием основных экологических факторов (кислорода и температуры) на некоторые группы зообентоса.
Список литературы
Алимов А.Ф. 2008. Связь биологического разнообразия в континентальных водоемах с их морфометрией и минерализацией вод // Биология внутр. вод. № 1. С. 3.
Алимов А.Ф. 2012. Морфометрия водоемов и биологическое разнообразие // Динамика биологического разнообразия и биоресурсов континентальных водоемов. Санкт-Петербург: Наука. С. 16.
Андреева Р.В., Бродская Н.К., Глухова В.М. и др. 1999. Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 4. Санкт-Петербург: Наука.
Винберг Г.Г., Чибисова О.И., Гаевская Н.С. и др. 1977. Определитель пресноводных беспозвоночных Европейской части СССР: Планктон и бентос. Ленинград: Гидрометеоиздат.
Гиляров А.М., 1990. Популяционная экология. Москва: Изд-во МГУ.
Пузнецките К.С., Марушкина Е.В. 2005. Применение индексов альфа-разнообразия зоопланктонных сообществ для оценки трофического статуса водоемов (на примере некоторых озер чебаркульской группы) // Вестник Челябинского гос. ун-та. Т. 12. № 1. С. 22.
Смуров А.В., Полищук Л.В. 1989. Количественные методы оценки основных популяционных показателей: статистический и динамический аспекты. Москва: Изд-во МГУ.
Сущеня Л.М., Семенченко В.П., Вежновец В.В. 1986. Биология и продукция ледниковых реликтовых ракообразных. Минск: Наука и техника.
Цалолихин С.Я., Пржиборо А.А., Кияшко П.В. и др. 2016. Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 2. Москва: Товарищество науч. изданий КМК.
Черновский А.А. 1949. Определитель личинок комаров семейства Tendipedidae // Определители по фауне СССР. Ленинград: Зоол. ин-т АН СССР.
Шитиков В.К., Зинченко Т.Д., Розенберг Г.С. 2011. Макроэкология речных сообществ: концепции, методы, модели. Тольятти: Кассандра.
Chapman P.M., Anderson B., Carr S. et al. 1997. General guidelines for using the sediment quality triad // Mar. Poll. Bull. V. 34. P. 368.
Chen K.N., Bao C.H., Zhou W.P. 2009. Ecological restoration in eutrophic Lake Wuli: A large enclosure experiment // Ecological Engineering. V. 35. P. 1646. https://doi.org/. ecoleng.2008.10.009https://doi.org/10.1016/j
Clemente J.M., Boll T., Teixeira-de Mello F., Iglesias C. et al. 2019. Role of plant architecture on littoral macroinvertebrates in temperate and subtropical shallow lakes: a comparative manipulative field experiment // Limnetica. V. 38(2). P. 759.
Coleman N., Cuff W., Moverley J. et al. 2007. Depth, sediment type, biogeography and high species richness in shallow water benthos // Mar. Freshwater Res. V. 58. P. 293.
Covich A.P., Palmer M.A., Crowl T.A. 1999. The role of benthic invertebrate species in freshwater ecosystems: Zoobenthic species influence energy flows and nutrient cycling // BioScience. V. 49. P. 119. https://doi.org/10.2307/1313537
Edington J.M., Hildrew A.G. 1995. A Revised Key to the Caseless Caddis Larvae of the British Isles with Notes on Their Ecology. Ambleside, Cumbria. Freshwater Biological Association Scientific Publications. № 53.
Ekingen P., Kazanci N. 2021. Environmental factors affecting distribution of caddisfly (trichoptera) larvae in mountain streams of northeastern Turkey // Inland Water Biol. V.14. № 5. P. 581–589. https://doi.org/10.1134/S1995082921050047
Gong Z., Xie P., Wang S. 2000. Macrozoobenthos in 2 shallow, mesotrophic Chinese lakes with contrasting sources of primary production // J. North Am. Benthol. Soc. V. 19. P. 709.
Greig-Smith P. 1983. Quantitative plant ecology. Oxford: Blackwell.
Laine A.O. 2003. Distribution of soft-bottom macrofauna in the deep open Baltic Sea in relation to environmental variability // Estuarine, Coastal and Shelf Science. V. 57. P. 87.
Olenin S. 1997. Benthic zonation of the Eastern Gotland Basin. Netherlands // J. Aquat. Ecol. V. 30. № 4. P. 265.
Reynoldson T.B., Bailey R.C., Day K.E., Norris R.H. 1995. Biological guidelines for freshwater sediment based on BEnthic Assessment of SedimenT (BEAST) using a multivariate approach for predicting biological state // Austr. J. Ecol. V. 20. P. 198.
Saxena S. 2014. The Role of Benthic Invertebrate Species in Freshwater Ecosystem Zoobenthic species influence energy flows and nutrient cycling in Shahpura Lake, Bhopal (M.P.) // Int. J. Adv. Res. V. 8. P. 686.
Timm H. 2015. Eesti sisevete suurselgrootute määraja. Identification guide to freshwater macroinvertebrates of Estonia. Tartu: KUMA Kirjastus.
Vanni M.J. 2002. Nutrient cycling by animals in freshwater ecosystems // Annual Review of Ecology and Systematics. V. 33. P. 341. https://doi.org/10.1146/annurev.ecolsys.33.010802.150519
Wallace I.D., Wallace B., Philipson G.N. 1990. A key to the case-bearing caddis larvae of Britain and Ireland. Ambleside, Cumbria. Freshwater Biological Association Scientific Publication № 51. P. 237.
Zhang M., Cai Q., Tang T. et al. 2011. Macrobenthos community structure and its spatial distribution in Erhai watershed lakes // Chinese J. Ecol. V. 30. № 8. P. 1696.
Zhang Z.X., Chen X., Xu C.Y. et al. 2015. Examining the influence of river lake interaction on the drought and water resources in the Poyang Lake basin // J. Hydrol. V. 522. P. 510. https://doi.org/10.1016/j.jhydrol.2015.01.008
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



