Биология внутренних вод, 2022, № 6, стр. 759-765
Пространственные аспекты организации сообществ макробеспозвоночных горных водотоков Алтая
Л. В. Яныгина *
Институт водных и экологических проблем, Сибирское отделение Российской академии наук
Барнаул, Россия
* E-mail: zoo@iwep.ru
Поступила в редакцию 03.05.2022
После доработки 16.06.2022
Принята к публикации 27.06.2022
- EDN: FFBLUR
- DOI: 10.31857/S0320965222060225
Аннотация
Исследованы структурные характеристики донных сообществ разнотипных водотоков Алтайских гор. Значимый фактор пространственного распределения макробеспозвоночных на локальном уровне – тип донных отложений, на региональном – высота участка водотока над уровнем моря. Выявлено, что численность и биомасса донных сообществ снижались в высокогорной части бассейна Верхней Оби. Альфа-, бета- и гамма-компоненты видового разнообразия макробеспозвоночных имели разнонаправленные тенденции изменений в градиенте факторов, связанных с увеличением высоты над уровнем моря. Для более полного понимания закономерностей формирования донных сообществ горных водотоков рекомендовано совместно анализировать альфа- бета- и гамма- компоненты разнообразия.
ВВЕДЕНИЕ
Речные экосистемы относятся к числу наиболее динамичных природных систем. Существенные изменения рек в пространстве и времени могут быть обусловлены как природными (в первую очередь климатическими), так и антропогенными факторами. Повсеместное увеличение антропогенной нагрузки на водотоки и их водосборные бассейны, гидроморфологические нарушения речных бассейнов угрожают целостности речных экосистем и ставят задачу разработки новых подходов к их оценке. Современные подходы к оценке экологического состояния рек основываются преимущественно на концепции референтных условий (RCA), согласно которой “здоровье” экосистемы определяется степенью отклонения ее характеристик от естественного ненарушенного состояния. Однако использование этих подходов невозможно без понимания закономерностей пространственных и временных изменений ненарушенных экосистем, динамика которых управляется преимущественно природными факторами. В этой связи, особое внимание в экологии рек уделяется исследованию пространственных закономерностей изменений биоразнообразия, что связано с их особой ролью в поддержании устойчивого функционирования экосистем. Характер выявленных взаимосвязей между биоразнообразием и окружающей средой зависит от ряда факторов: географического региона, группы организмов, пространственного масштаба и длины градиента изменения окружающей среды. Соответственно, для понимания закономерностей изменения разнообразия необходимы исследования, проведенные в различных регионах с охватом широких градиентов экологических условий (Alahuhta et al., 2018).
Вслед за Уиттекером (Whittaker, 1960), разнообразие принято подразделять на альфа- (разнообразие внутри сообществ), бета- (разнообразие между сообществами) и гамма- (региональное разнообразие). Традиционно основное внимание в гидробиологических работах уделяется оценке альфа-разнообразия и его показателей – среднее число видов в пробе, индексы видового разнообразия (например, Шеннона) и выравненности. Альфа разнообразие показывает значимость локальных биотических и абиотических факторов, бета-разнообразие отражает реакцию видов на неоднородность окружающей среды (Shoemaker et al., 2020; Keke et al., 2021). В последние годы измерение бета-разнообразия получило особый интерес, что обусловлено возможностью с его помощью оценивать связь между альфа- и гамма-разнообразием, достигая лучшего понимания процессов, лежащих в основе пространственной изменчивости состава сообщества (Heino, Grönroos, 2017; Hill et al., 2019; Rocha et al., 2019). Использование различных подходов к оценке бета-разнообразия позволяет не только определять взаимосвязь между местным (альфа-разнообразием) и региональным (гамма-) разнообразием, но и дает возможность оценивать степень дифференциации биологических сообществ, по сути, измеряя количество различных сообществ в регионе (Tuomisto, 2010). Высказано предположение, что бета-разнообразие может лучше, чем альфа-разнообразие, указывать на изменения в сообществах в ответ на антропогенную трансформацию экосистем, что позволяет рассматривать его в качестве перспективного показателя в системах экологического мониторинга водных объектов (Hillebrand et al., 2018). Однако, несмотря на определенные усилия, приложенные для понимания экологических и эволюционных процессов формирования разнообразия сообществ в водотоках, общие механизмы, лежащие в их основе, недоизучены. Неполными остаются и представления о роли в этих процессах широких пространственных и экологических градиентов.
Сообщества макробеспозвоночных – одни из наиболее удобных и показательных модельных объектов для выяснения закономерностей изменения биоразнообразия в речной системе, благодаря широкому распространению, приуроченности к обитанию на определенном участке, высокому разнообразию таксономических групп и широкому диапазону предпочитаемых факторов среды.
Цель работы – анализ тенденций изменения показателей альфа-, бета- и гамма- разнообразия сообществ макробеспозвоночных в горных водотоках бассейна Верхней Оби.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал собирали в период летне-осенней межени 2007–2010 г. в водотоках бассейна Верхней Оби, принадлежащих к бассейнам рек Бия, Катунь и Чарыш. Всего обследовано 52 участка рек, расположенных на высоте 150–2500 м над у.м. (рис. 1). Пробы отбирали в постоянных водотоках длиной от 5 до 635 км (15 водотоков длиной <30 км, 18 – 30–100 км и 19 рек длиной >100 км). В целом, для исследованного района характерно понижение температуры воды с увеличением высоты местности, у большинства рек температура воды увеличивается от истока к устью. Среднемесячная температура июля в нижнем течении малых высокогорных рек – 2–6°С, в средних и крупных реках ≤10°С (Ресурсы…, 1966). Со снижением средней высоты водосбора температура воды повышается и достигает в реках верхнего яруса среднегорий 10.0–15.0°С, в нижнем ярусе среднегорья и в низкогорье – 16.0–20.0°С (Ресурсы…, 1966).
Макробеспозвоночных собирали стандартными гидробиологическими методами (Руководство…, 1992). На каменистых субстратах грунт (преимущественно валуны и гальку) отбирали гидробиологическим сачком (с последующим определением площади камней по их проекциям на плоскость), на мягких грунтах (песок) – дночерпателем Гр-91 с площадью захвата 0.007 м2. На каждом участке отобрано по три–пять проб зообентоса. Одновременно со сбором макробеспозвоночных в местах отбора проб измеряли температуру воды, прозрачность и глубину. Пробы промывали через капроновый газ с размером ячеи 350 мкм, выбирали животных и фиксировали их 70%-ным этиловым спиртом. Затем определяли таксономическую принадлежность животных, считали их и взвешивали на торсионных весах ВТ–500. Идентификацию особей проводили до низшего определяемого таксона (НОТ), условно названным “видом”. Исключением были малощетинковые черви и нематоды, которых более детально не определяли. Подробно методы отбора проб даны ранее (Яныгина, 2014).
Для оценки бета-разнообразия рассчитывали попарные индексы сходства Жаккара и индекс бета-разнообразия Уиттекера (Jaccard, 1912; Whittaker, 1960). Индекс Уиттекера вычисляли для каждой высотной зоны как отношение общего числа видов, обнаруженных в этой зоне, к среднему числу видов. Из-за разноразмерности использованных выборок индекс нормировали по числу проб (путем деления на n–1 в соответствии с рекомендациями (Harrison et al., 1992).
Статистический анализ данных проводили с использованием программы “PAST”. Все показатели представляли в виде средних значений со стандартными ошибками. При формировании выборок для анализа высотных градиентов распределения макробеспозвоночных использовали только результаты обработки проб, отобранных на каменистых субстратах. Все обследованные участки рек были разбиты на три группы: низкогорные (20 водотоков на высоте <400 м над уровнем моря), среднегорные (23 водотока на высоте 400 м –1500 м над у.м.) и высокогорные (9 водотоков на высоте >1500 м над у.м.). Для проверки статистической значимости межгрупповых различий структуры сообществ макробеспозвоночных рек различных высотных зон применяли дискриминантный анализ. В качестве переменных-дискрипторов использовали данные по относительной численности отдельных видов макробеспозвоночных в водотоках. Результаты анализа представлены в виде диаграммы рассеяния канонических значений в пространстве двух главных канонических осей. При сравнении трех выборок (различных показателей между низко-, средне- и высокогорными водотоками) использовали непараметрический метод Краскела–Уоллиса (Kruskal, Wallis, 1952), при попарных сравнениях – Манна–Уитни (Mann– Whitney, 1947). Нулевую гипотезу об отсутствии различий между выборками отвергали при p >0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
За период исследований в водотоках бассейна Верхней Оби собрано 13 538 экз. макробеспозвоночных, принадлежащих к 191 виду. Наибольшее число видов относилось к двукрылым насекомым (77 вида, из которых 58 – хирономиды), поденкам (36 видов), ручейникам (36 видов) и веснянкам (21 вид). Наибольшей частотой встречаемости характеризовались Hydropsyche nevae (Kolenati) (33.9% проб), Glossosoma altaicum (Martynov) (35.7%), Pagastia orientalis Chernovskij (33.9%) и Antocha vitripennis (Meigen) (32.1%).
Значимый фактор пространственного распределения макробеспозвоночных исследованных водотоков – характер донных отложений. Численность (критерий Краскела–Уолиса, Н = 7.24, р = 0.027) и биомасса (Н = 9.59, р = 0.08) донных сообществ снижалась с уменьшением размера частиц субстрата. Максимальные значения численности и биомассы макробеспозвоночных отмечены на валунно-галечниковых субстратах, минимальные – на песчаных (рис. 2а).
Рис. 2.
Сравнительная характеристика донных сообществ горных водотоков Алтая на разных грунтах (а) и расположенных в разных высотных зонах (б). 1 – валунно-галечный, 2 – галечный, 3 – песчаный; 4 – низкогорные, 5 – среднегорные, 6 – высокогорные. N – численность, тыс. экз./м2; B – биомасса, г/м2; S – среднее число видов в пробе; H – индекс видового разнообразия Шеннона, бит/экз.
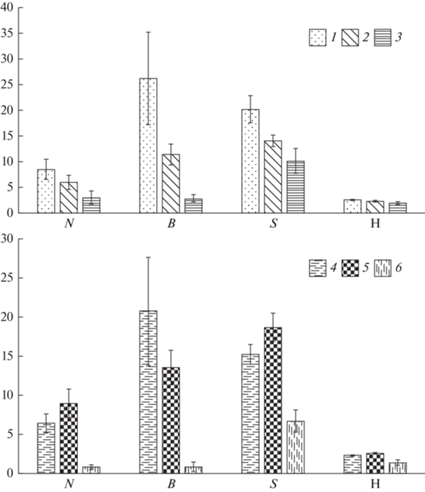
Обилие зообентоса в реках разного размера существенно не различалось. Более значимым фактором пространственной неоднородности распределения зообентоса было высотное положение водотока. При этом численность и биомасса зообентоса в низко- и среднегорных водотоках существенно варьировали и значимо не различались (Манни–Уитни тест, U = 179, р = 0.32 для численности и U = 217, р = 0.98 для биомассы). В высокогорных водотоках отмечены более бедные донные сообщества (рис. 2б).
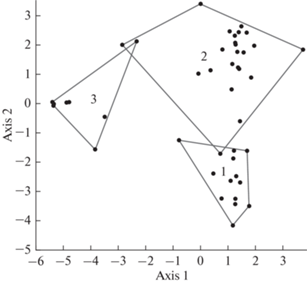
Высотное положение водотока оказывало влияние не только на обилие зообентоса, но и на его таксономическую структуру. Дискриминантный анализ структуры сообществ по относительной численности видов показал, что реки, расположенные в разных высотных зонах, формируют хорошо различающиеся группы (рис. 3). Наибольший вклад в дискриминацию вносили различия в относительной численности Eukiefferiella gr. devonica, Antocha vitripennis, Rhyacophila gr. sibirica, Tvetenia gr. discoloripes, Glossosoma altaicum.
Рис. 3.
Дискриминантный анализ таксономической структуры донных сообществ водотоков Алтая, расположенных в разных высотных зонах. 1 – низкогорные (<400 м над у.м.), 2 – среднегорные (400–1500 м), 3 – высокогорные (>1500 м).
Общее видовое богатство макробеспозвоночных в каждой высотной зоне (гамма-разнообразие) увеличивалось от низкогорной зоны к среднегорной и затем снова снижалось до минимальных значений в высокогорной зоне: в низкогорных реках выявлено 116 видов макробеспозвоночных, в среднегорных – 141 вид, в высокогорной – 71 вид.
Альфа-разнообразие бентосных сообществ. Видовое богатство макробеспозвоночных существенно варьировало в исследованных реках. Максимальное видовое богатство отмечено в среднегорных реках Чемал (в среднем 22 ± 2.7 видов в пробе) и Бирюля (24 ± 6.0), минимальное – в истоках и малых притоках высокогорных рек Чульча и Чаганузун (по 2‒3 вида в пробе). Как и в случае обилия, ведущими факторами пространственной вариабельности видового богатства макробеспозвоночных были тип донных отложений и высота водотока над у.м. Среднее число видов в пробе снижалось при уменьшении размера субстрата и достигало минимальных значений на песках (рис. 2а). Видовое богатство зообентоса между низко- и среднегорными водотоками почти не различалось, но существенно снижалось в высокогорных реках (U = 20, р = 0.0002 по сравнению с низкогорными и U = 18.5, р = 0.0004 по сравнению со среднегорными). Распространенный показатель альфа-разнообразия – индекс Шеннона – существенно не различался в зависимости от типа грунта, размера реки и высотной зоны.
Бета-разнообразие бентосных сообществ. Расчеты попарных мер сходства (индекс Жаккара) на основе данных по наличию видов показали существенные различия таксономического состава донных сообществ в отдельных реках. Значения индексов Жаккара, как правило, не превышали 0.5 (в среднем 0.10). В отличие от общего видового богатства макробеспозвоночных в каждой высотной зоне (гамма-разнообразия) значения индекса бета-разнообразия Уиттекера в низкогорных и среднегорных водотоках почти не различались (0.62 и 0.55 соответственно) и были значительно ниже показателей высокогорья (1.03).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ таксономического разнообразия сообществ макробеспозвоночных горных водотоков Алтая показал, что один из наиболее значимых факторов распределения макробеспозвоночных – высотная зона, в которой расположен водоток. При этом различные компоненты биоразнообразия (альфа-, бета- и гамма-) по-разному изменяются в градиенте факторов, связанных с изменением высоты. Изменение общего видового богатства (гамма-разнообразия) с увеличением высоты имеет вид “горбообразной” кривой, увеличиваясь от низкогорной зоны к среднегорной и затем снижаясь в высокогорной. Такой характер изменения общего видового богатства с высотой характерен не только для водных (например, Henriques-Oliveira, Nessimian, 2010), но и наземных сообществ. Увеличение общего видового богатства с высотой отмечено в Альпах для сосудистых растений, бабочек, жуков, пауков и дождевых червей (Fontana et al., 2020), травянистой растительности в Непале (Bhatta et al., 2018), на Кавказе (Егоров, 2015) и в Китае (Wang et al., 2003). Показано, что включение в анализ более широких (близких к полным) диапазонов высоты обычно приводит к горбообразным кривым изменения общего видового богатства с высотой, однако при сокращении диапазона чаще отмечают тенденцию к монотонному увеличению или уменьшению разнообразия с высотой, что связано с рассмотрением только части кривой (Nogués-Bravo et al., 2008). Поскольку донные сообщества рек Алтая обследовали в широком диапазоне высоты над у.м. (150–2500 м н.у.м.), это позволило выявить близкие к полным градиентам изменения видового разнообразия с высотой.
Альфа-разнообразие донных сообществ (оцениваемое по среднему числу видов в пробе) статистически значимо не различалось между низкогорными и среднегорными водотоками Алтая и уменьшалось в высокогорных реках. Снижение среднего числа видов макробеспозвоночных в высокогорных реках Алтая, по-видимому, отражает общебиологическую тенденцию снижения видового богатства с увеличением суровости условий обитания. Такая тенденция характерна не только для высокогорных, но и для северных территорий и, по-видимому, связана с тем, что лишь немногие виды обладают способностью выживать в столь суровых условиях (Blaen et al., 2013). В целом, широтные и высотные градиенты обычно рассматривают как аналогичные с точки зрения изменения экологических условий и связанных с ними тенденций изменений сообществ (Bozinovic et al., 2011; Dos Santos et al., 2018). Соответственно, исследования динамики биоразнообразия вдоль высотных градиентов имеют особое значение для познания общебиологических тенденций изменения биоразнообразия (Dos Santos et al., 2018). В качестве основного абиотического фактора, определяющего уменьшение видового богатства макробеспозвоночных в высокогорных и северных территориях, обычно рассматривают снижение температуры (Blaen et al., 2014; Madsen et al., 2015; Чертопруд и др., 2020; Brittain et al., 2020; Chertoprud et al., 2020). Высотный градиент альфа-разнообразия отмечен при исследованиях макробеспозвоночных горных водотоков Европы, Северной и Южной Америки (Jacobsen, 2003; De Mendoza, Catalan, 2010; Rendoll Cárcamo et al., 2019; García-Ríos et al., 2020). Еще один фактор, определяющий локальное таксономическое разнообразие, – характер донных отложений. Увеличение сложности биотопа с увеличением размера частиц субстрата, как правило, приводит к увеличению разнообразия сообществ, что также отмечено в нашем исследовании.
Бета-разнообразие, дифференцирующее сообщества макробеспозвоночных Алтая, напротив, увеличивалось в высокогорной зоне. Его расчеты – один из способов анализа степени гетерогенности биотопов на данной территории, они позволяют оценивать скорость изменения таксономического состава сообществ вдоль пространственных и экологических градиентов (Миркин и др., 1989). Индекс бета-разнообразия Уиттекера отражает “скорость оборота” сообществ и показывает количество различных сообществ в анализируемом регионе. Известно, что индекс Уиттикера растет с увеличением экологических и пространственных расстояний (Rocha et al., 2019). Зависимость бета-разнообразия от экологических расстояний подтверждает роль фильтрации окружающей среды в формировании сообществ и позволяет рассматривать индексы бета-разнообразия в качестве перспективных для оценки экологического состояния водотоков и степени антропогенной трансформации рек (Rocha et al., 2019).
Существенное увеличение индекса Уиттикера в высокогорной зоне по сравнению с нижерасположенными может быть связано с более резкой сменой условий обитания макробеспозвоночных в отдельных водотоках высокогорий Алтая даже при незначительных пространственных расстояниях между ними. Кроме того, высокие хребты в высокогорной зоне могут препятствовать расселению амфибиотических насекомых, на которых приходится основная часть видового разнообразия донных сообществ этих водотоков, тем самым способствуя увеличению дифференциации сообществ.
Выводы. Выявлено, что высота оказывает существенное влияние на таксономическое разнообразие макробеспозвоночных Алтая. При этом, альфа-, бета- и гамма-компоненты биоразнообразия по-разному изменялись в градиенте факторов, связанных с изменением высоты над у.м. Локальное и региональное разнообразие (альфа- и гамма-компоненты биоразнообразия) донных сообществ снижались в высокогорных водотоках, отражая усиление суровости климата и, соответственно, степени неблагоприятности условий обитаний для большинства таксонов. Бета-разнообразие, напротив, увеличивалось в высокогорной зоне, показывая увеличение гетерогенности среды обитания. Для более полного понимания закономерностей формирования биоразнообразия сообществ необходимо совместное рассмотрение альфа- бета- и гамма- компонентов.
Список литературы
Егоров А.В. 2015. Структура видового разнообразия растительных сообществ Тебердинского заповедника: Дис… канд. биол. наук. Москва. Мос. гос. ун-т им. М.В. Ломоносова.
Миркин Б.М. 1989. Словарь понятий и терминов современной фитоценологии. Москва: Наука.
Ресурсы поверхностных вод СССР: Гидрологическая изученность. 1966. Т. 15. Алтай и Западная Сибирь. Вып. 1. Горный Алтай и Верхний Иртыш. Ленинград: Гидрометеоиздат.
Руководство по гидробиологическому мониторингу пресноводных экосистем. 1992. СбП: Гидрометеоиздат.
Чертопруд М.В., Палатов Д.М., Чертопруд Е.С. 2020. Реофильные сообщества макрозообентоса Западного Тянь-Шаня // Биология внутр. вод. № 3. С. 276. https://doi.org/10.31857/S0320965220020035
Яныгина Л.В. 2014. Зообентос бассейна Верхней и Средней Оби: воздействие природных и антропогенных факторов: Дис… докт. биол. наук. Барнаул. Институт водных и экологических проблем СО РАН
Alahuhta J., Eros T., Kärnä O. et al. 2018. Understanding environmental change through the lens of trait-based, functional and phylogenetic biodiversity in freshwater ecosystems // Environ. Rev. V. 27. № 2. P. 263. https://doi.org/10.1139/er-2018-0071
Bhatta K.P., Grytnes J.A., Vetaas O.R. 2018. Scale sensitivity of the relationship between alpha and gamma diversity along an alpine elevation gradient in central Nepal // J. Biogeogr. V. 45. № 4. P. 804. https://doi.org/10.1111/jbi.13188
Blaen P.J., Brown L.E., Hannah D.M., Milner A.M. 2014. Environmental drivers of macroinvertebrate communities in high Arctic rivers (Svalbard) // Freshwater Biol. V. 59. P. 378. https://doi.org/10.1111/fwb.12271
Bozinovic F., Calosi P., Spicer J.I. 2011. Physiological correlates of geographic range in animals // Ann. Rev. Ecol. Evol. Syst. V. 42. P. 155. https://doi.org https://doi.org/10.1146/annurev-ecolsys-102710-145055.
Brittain J.E., Heino J., Friberg N. et al. 2020. Ecological correlates of riverine diatom and macroinvertebrate alpha and beta diversity across Arctic Fennoscandia // Freshwater Biol. P. 1. https://doi.org/10.1111/fwb.13616
De Mendoza G., Catalan J. 2010. Lake macroinvertebrates and the altitudinal environmental gradient in the Pyrenees // Hydrobiologia. V. 648. P. 51. https://doi.org/10.1007/s10750-010-0261-4
Dos Santos D.A, Molineri C., Nieto C. et al. 2018. Cold/warm stenothermic freshwater macroinvertebrates along altitudinal and latitudinal gradients in Western South America: a modern approach to an old hypothesis with updated data // J. Biogeogr. V. 45. № 7. P. 1. https://doi.org/10.1111/jbi.13234
Fontana V., Guariento E., Hilpold A. et al. 2020. Species richness and beta diversity patterns of multiple taxa along an elevational gradient in pastured grasslands in the European Alps // Sci. Rep. V. 10. № 12516. https://doi.org/10.1038/s41598-020-69569-9
García-Ríos R., Peláez O., Moi D. 2020. Effects of an altitudinal gradient on benthic macroinvertebrate assemblages in two hydrological periods in a Neotropical Andean river // Ecologia Austral. V. 30. № 1. P. 33. https://doi.org/10.25260/EA.20.30.1.0.995
Harrison S., Ross S.J., Lawton J.H. 1992. Beta Diversity on Geographic Gradients in Britain // J. Anim. Ecol. 61. № 1. P. 151. https://doi.org/10.2307/5518
Heino J., Grönroos M. 2017. Exploring species and site contributions to beta diversity in stream insect assemblages // Oecologia. V. 183. P. 151. https://doi.org/10.1007/s00442-016-3754-7
Henriques-Oliveira A.L., Nessimian, J.L. 2010. Aquatic macroinvertebrate diversity and composition in streams along an altitudinal gradient in Southeastern Brazil // Biota Neotrop. V. 10. № 3. P. 115. https://doi.org/10.1590/s1676-06032010000300012
Hill M.J., Heino J., White J.C. et al. 2019. Environmental factors are primary determinants of different facets of pond macroinvertebrate alpha and beta diversity in a human-modified landscape // Biol. Conserv. V. 237. P. 348. https://doi.org/10.1016/j.biocon.2019.07.015
Hillebrand H., Blasius B., Borer E.T. et al. 2018. Biodiversity change is uncoupled from species richness trends: Consequences for conservation and monitoring // J. Appl. Ecol. V. 55. № 1. P. 169. https://doi.org/10.1111/1365-2664.12959
Jaccard P. 1912. The Distribution of the Flora in the Alpine Zone // New Phytol. V. 11. P. 37. https://doi.org/10.1111/j.1469-8137.1912.tb05611.x
Jacobsen D. 2003. Altitudinal changes in diversity of macroinvertebrates from small streams in the Ecuadorian Andes // Arch. Hydrobiol. V. 158. № 2. P. 145. https://doi.org/10.1127/0003-9136/2003/0158-0145
Keke U.N., Arimoro F.O., Ayanwale A.V. et al. 2021. Weak relationships among macroinvertebrates beta diversity (β), river status, and environmental correlates in a tropical biodiversity hotspot // Ecol. Indic. V. 129. № 107868. https://doi.org/10.1016/j.ecolind.2021.107868
Kruskal W.H., Wallis W.A. 1952. Use of Ranks in One-Criterion Variance Analysis // J. Am. Stat. Assoc. V. 47. № 260. P. 583. https://doi.org/10.1080/01621459.1952.10483441
Madsen P.B., Morabowen A., Andino P. et al. 2015. Altitudinal distribution limits of aquatic macroinvertebrates: an experimental test in a tropical alpine stream // Ecol. Entomol. V. 40. № 5. P. 629. https://doi.org/https://doi.org/10.1111/een.12232
Mann H.B., Whitney D.R. 1947. On a test of whether one of two random variables is stochastically larger than the other // Ann. Math. Stat. № 18. P. 50.
Nogués-Bravo D., Araújo M.B., Romdal T., Rahbek C. 2008. Scale effects and human impact on the elevational species richness gradients // Nature. V. 453. P. 216. https://doi.org/10.1038/nature06812
Rendoll Cárcamo J., Contador T., Gañan M. et al. 2019. Altitudinal gradients in Magellanic sub-Antarctic lagoons: the effect of elevation on freshwater macroinvertebrate diversity and distribution // PeerJ. https://doi.org/10.7717/peerj.7128
Rocha M.P., Bini L.M., Grönroos M. et al. 2019. Correlates of different facets and components of beta diversity in stream organism // Oecologia. V. 191. P. 919. https://doi.org/10.1007/s00442-019-04535-5
Shoemaker L.G., Sullivan L.L., Donohue I. et al. 2020. Integrating the underlying structure of stochasticity into community ecology // Ecology. V. 101. № 2. e02922. https://doi.org/10.1002/ecy.v101.210.1002/ecy.2922
Tuomisto H. 2010. A diversity of beta diversities: straightening up a concept gone awry. Part 1. Defining beta diversity as a function of alpha and gamma diversity // Ecography. V. 33. № 1. P. 2. https://doi.org/10.1111/j.1600-0587.2009.05880.x
Wang G., Zhou G., Yang L., Li Z. 2003. Distribution, species diversity and life-form spectra of plant communities along an altitudinal gradient in the northern slopes of Qilianshan Mountains, Gansu, China // Plant Ecol. V. 165. № 2. P. 169. https://doi.org/10.1023/a:1022236115186 10.1023/A:1022236115186
Whittaker R.H. 1960. Vegetation of the Siskiyou Mountains, Oregon and California // Ecol. Monogr. V. 30. № 3. P. 279. https://doi.org/10.2307/1943563
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод