Биология внутренних вод, 2023, № 1, стр. 20-27
Микобиота отмерших фрагментов тростника, погруженных в воду, (Ярославская обл., Россия)
Л. В. Воронин a, Н. И. Копытина b, *
a Ярославский государственный педагогический университет им. К.Д. Ушинского
Ярославль, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл, Россия
* E-mail: kopytina_n@mail.ru
Поступила в редакцию 07.12.2021
После доработки 09.05.2022
Принята к публикации 03.06.2022
- EDN: KTQNJP
- DOI: 10.31857/S0320965223010199
Аннотация
Микобиоту отмерших, погруженных в воду частей тростника Phragmites australis (листьев, стеблей, листовых влагалищ), исследовали в озерах Плещеево, Мостецкое, озеро в Заволжском р-не г. Ярославль и р. Которосль (Ярославская обл.). Царство Fungi представлено 53 видами из 33 родов, 25 семейств, 12 порядков, семи классов из отделов: Mucoromycota (4) и Ascomycota (48). В царстве Chromista (грибоподобные организмы) выявлено 8 видов, из трех родов, двух семейств, двух порядков, одного класса, отдела Oomycota. Впервые на тростнике обнаружено 23 вида микромицетов. Преобладали представители порядков Pleosporales (16 видов), Helotiales (11), Saprolegniales (7), Hypocreales (5). Число видов грибов на фрагментах растений в разных водных объектах изменялось от 16 до 39. Статистически значимые различия видовой структуры микокомплексов на отмершем тростнике выявлены между озером в Заволжском районе г. Ярославль и р. Которосль (R = 0.646, уровень значимости 0.1%).
ВВЕДЕНИЕ
Тростник обыкновенный Phragmites australis (Cav.) Trin. ex Steud – один из наиболее распространенных на планете гелофитов (воздушно-водных растений), почти космополит, обычен на болотах, берегах озер и рек, способствует зарастанию водоемов (Голуб и др., 2015), образует заросли на морских берегах и песчаных дюнах. Молекулярные методы, примененные для исследования микобиоты P. australis, выявили большое разнообразие грибов (Wirsel et al., 2001, 2002; Neubert et al., 2006). Исследованы сукцессии комплексов грибов на живых и отмерших стоящих растениях, преимущественно в воздушной среде (Van Ryckegem, Verbeken, 2005a, 2005б, 2005в; Woudenberg et al., 2017; DeVries et al., 2020). Некоторые грибы способны развиваться в воздушной и в водной среде (Taligoola et al., 1972; Angelini et al., 2012; Abdel-Aziz, 2016). Работ, в которых отражен состав грибов на отмерших частях растения, погруженных в воду, немного (Luo et al., 2004; Al-Saadoon, Al-Dossary, 2014; Abdel-Aziz, 2016; Черняковская, Воронин, 2017). Список видов грибов и грибоподобных организмов, известных на тростнике в пресных и солоноватых водных объектах представлен для Fungi 562 видами, Chromista – 37 (Voronin et al., 2021). В пресноводных экосистемах небольшую часть продукции тростника потребляют травоядные животные, большая часть разлагающейся биомассы растений вовлечена в детритную пищевую цепь (Sangiorgio et al., 2007).
Цель работы – выявить видовое разнообразие грибов и сравнить структуру микокомплексов на погруженных в воду отмерших фрагментах тростника в различных водных объектах Ярославской обл.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Микобиоту на отмерших погруженных в воду частях тростника (листьях, стеблях, листовых влагалищах) исследовали в сентябре 2019–августе 2020 гг. в четырех водных объектах Ярославской обл., по одной точке отбора проб. Озеро Плещеево (56°45′ с.ш., 38°47′ в.д.), чистые заросли тростника шириной ~20 м. Озеро Мостецкое находится в Ярославском р-не, на границе с Заволжским районом г. Ярославль (57°38′ с.ш., 39°58′ в.д.), заросли тростника шириной 15 м. Озеро в Заволжском районе г. Ярославль (57°38′ с.ш., 39°57′ в.д.), с большой степенью зарастания (тростник + + хвощ приречный (Equisetum fluviatile L.) + водокрас лягушачий (Hydrocharis morsus-ranae L.). Река Которосль в центре г. Ярославль (57°61′ с.ш., 39°88′ в.д.), небольшие заросли 20 × 5 м тростника с рогозом широколистным (Typha latifolia L.). В озере Заволжского района г. Ярославль отбирали в основном листья. Всего обработано 45 проб.
Материал собирали в новые полиэтиленовые пакеты, промывали в проточной воде и культивировали в чашках Петри в воде, взятой из исследуемого водоема и на питательной среде Чапека. Грибы идентифицировали по “морфолого-культуральным признакам”, используя работы (Ellis, 1971, 1976; Милько, 1979; Sutton, 1980 и др.). Валидные названия и систематическая принадлежность видов соответствуют электронной международной базе данных Index Fungorum (http:// www.indexfungorum.org/names/Names.asp).
Полученные данные обрабатывали с применением пакета статистических программ PRIMER® 5.2.8 (Clarke et al., 2014). Систематическая характеристика комплексов грибов дана с использованием двух таксономических индексов, учитывающих расположение видов по возрастающим рангам от вида к царству и иллюстрирующих общность или различие высших таксономических рангов (функция TAXDTEST). Индекс средней таксономической отличительности (или таксономического своеобразия) Δ+ (Average Taxonomic Distinctness index, AvTD) показывает пропорции в соотношении числа таксонов на предыдущем и последующем высоком уровне по длине условного таксономического дерева. Индекс вариабельности Λ+ (Variation in Taxonomic Distinctness index, VarTD) отражает горизонтальную выравненность видового состава – количество низших таксонов в ветвях высших иерархических уровней (Clarke et al., 2014). По коэффициенту Брэя–Кертиса вычислено сходство комплексов грибов по видовому составу (Simila-rity). Проведена оценка статистической достоверности различий видовой структуры между микокомплексами на тростнике в местах обитания и по сезонам года (R-статистика, ANOSIM).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В период исследования на фрагментах отмершего тростника, погруженного в воду, из царства Fungi идентифицировано 52 вида из тридцати трех родов, двадцати пяти семейств, двенадцати отрядов, семи классов из двух отделов: Mucoromycota (четыре вида) и Ascomycota (48); из царства Chromista – восемь видов, из трех родов, двух семейств, двух отрядов, одного класса, одного отдела (Oomycota) и стерильный мицелий (табл. 1). Преобладали представители порядков Pleosporales (16 видов), Helotiales (11), Saprolegniales (семь) и Hypocreales (пять) (65.0% общего списка). В исследованных местах обитаниях обнаружено лишь несколько истинно водных организмов (Lemonniera filiformis, представители рода Saprolegnia), такая закономерность прослеживается в мезо-эвтрофных водных объектах (Воронин, 2010). Вторая группа – сапротрофные микромицеты, которые развиваются в наземных условиях, но адаптированы к водной среде (Dactylaria, Fusarium, Phoma и др.). В результате исследований на тростнике впервые обнаружено 23 вида грибов, в оз. Плещеево – 6, оз. Мостецкое – 6, в озере Заволжского района – 16, р. Которосль – 7; на листьях – 18, стеблях – 10, в листовых влагалищах – один (табл. 1).
Таблица 1.
Видовой состав микромицетов, выделенный на части растения в исследуемых водных объектах Ярославской обл.
| Вид и его характеристика | Водный объект | Местонахождения вида (номер литературного источника) |
|||
|---|---|---|---|---|---|
| П | М | З | К | ||
| Fungi, Ascomycota | |||||
| Acremonium charticola (Lindau) W. Gams | л | – | – | – | Ярославская обл. (4) |
| Alternaria alternata (Fr.) Keissl. *, +, ‰ | с, л | с, л | л | л | Великобритания (8, 17), Ирак (6, 13), Китай (15), Нидерланды (18, 19), Польша (12), Эстония (1) |
| Al. tenuissima (Kunze) Wiltshire *, +, ‰ | л | – | л | – | Ирак (13), Польша (12) |
| Amorphotheca resinae Parbery | в, с | – | – | – | Эстония (1), Ярославская обл. (4) |
| Aspergillus flavus Link *, + | – | л | – | – | Ирак (13), Ярославская обл. (4) |
| As. versicolor (Vuill.) Tirab. | – | – | л | – | Ярославская обл. (Данные авторов) |
| Aureobasidium melanogenum (Herm.-Nijh.) Zalar, Gostinčar & Gunde-Cim. *,+ | – | – | л | – | Германия (14), Ирак (6, 13), Ярославская обл. (4) |
| A. pullulans (de Bary & Löwenthal) G. Arnaud *, + | – | – | л | – | Ирак (6, 13), Германия (14), Ярославская обл. (4) |
| A. pullulans var. pullulans (de Bary & Löwenthal) G. Arnaud | с | – | – | – | Ярославская обл. (Данные авторов) |
| Boeremia exigua Aveskamp, Gruyter & Verkley ‰ | – | – | – | с | Египет (5) |
| Cladosporium herbarum Link *, + | в, с | с, л | л | – | Германия (22), Польша (11, 12), Ярославская область (4) |
| C. cladosporioides (Fresen.) G.A. de Vries *, + | – | – | л | – | Германия (22, 23), Европейская часть России (3), Ирак (13), Италия (7), Польша (11, 12), Эстония (1) |
| C. sphaerospermum Penz. * | в, с | с, л, в | л | – | Ирак (6), Эстония (1) |
| Coniothyrium obiones Jaap | – | с | л | – | Ярославская обл. (Данные авторов) |
| Dactylaria asymmetrica Pasqual. | – | – | – | с | То же |
| D. longidentata Cazau, Aramb. & Cabello | – | с | л | – | Китай (10) |
| D. parvispora (Preuss) de Hoog & Arx | – | – | – | л | То же |
| Dactylaria sp. | – | – | л | – | Ярославская обл. (Данные авторов) |
| Didymella glomerata (Corda) Qian Chen & L. Cai | – | л | л | – | Германия (22) |
| D. pomorum (Thüm.) Qian Chen & L. Cai | – | с, л | л | с | Ярославская обл. (Данные авторов) |
| Fusarium poae (Peck) Wollenw. *, + | с, л | – | л | – | Польша (11, 12), Эстония (1), Ярославская обл. (4) |
| F. sporotrichioides Sherb. *, + | с | – | л | – | Эстония (1), Польша (12), Ярославская обл. (4) |
| Hymenoscyphus albidus (Gillet) W. Phillips | – | – | л | – | Ярославская обл. (Данные авторов) |
| H. splendens Abdullah, Descals & J. Webster | – | с | л | – | То же |
| Juxtiphoma eupyrena Valenz.-Lopez, Crous, Stchigel, Guarro & Cano | – | – | л | – | » |
| Kalmusia amphiloga (Petr.) O.E. Erikss. *, + | – | – | л | – | Великобритания (8), Польша (11) |
| Lemonniera filiformis R.H. Petersen ≈ | – | – | л | – | Ярославская обл. (Данные авторов) |
| Leptosphaeria sp. | – | с | – | – | То же |
| Mirandina flagelliformis Matsush. | – | – | л | – | » |
| M. taiwanensis Matsush. | – | – | – | с, л | » |
| Neobulgaria koningiana Unter. & Réblová | л | с | л | – | » |
| Neohelicosporium griseum (Berk. & M.A. Curtis) Y.Z. Lu & K.D. Hyde | – | – | – | с | Ярославская обл. (Данные авторов) |
| Ochrocladosporium elatum (Harz) Crous & U. Braun | л | – | – | – | Эстония (1), Ярославская обл. (4) |
| Penicillium sp. | л | – | л | – | Ярославская обл. (4) |
| Phaeosphaeria graminis (Fuckel) L. Holm | – | с | л | – | Беларусь (2), Европейская часть России (2) |
| P. lycopodina (Mont.) Hedjar. | – | – | л | – | Ярославская обл. (Данные авторов) |
| Phialophora sp. | – | л | л | – | То же |
| Phoma herbarum Westend. * ,+ | с | с | л | с | Великобритания (8), Польша (11) |
| P. laundoniae Boerema & Gruyter | – | – | – | с | Ярославская обл. (Данные авторов) |
| Phomatospora dinemasporium J. Webster ‰ | – | л | – | – | Бельгия (21), Китай (15), Нидерланды (18, 20), Эстония (1) |
| Septonema sp. | с | – | – | с | Ярославская обл. (Данные авторов) |
| Stagonospora elegans (Berk.) Sacc. & Traverso | – | с | л | – | Беларусь (2), Бельгия (21), Великобритания (16, 17), Европейская часть России (2), Польша (12), |
| Stagonospora sp. | – | – | – | л | Ярославская обл. (Данные авторов) |
| Sydowia polyspora (Bref. & Tavel) E. Müll. | – | – | л | – | То же |
| Tapesia fusca (Pers.) Fuckel | – | – | л | – | » |
| Trichoderma viride Pers. | л | – | л | л | Эстония (1) |
| Trichoderma sp. | л | – | – | – | Ярославская обл. (4) |
| Tricladium sp. | – | – | л | – | Ярославская обл. (Данные авторов) |
| Mucoromycota | |||||
| Mortierella alpina Peyronel | л, в | – | л | – | Ярославская обл. (Данные авторов) |
| M. lignicola (G.W. Martin) W. Gams & R. Moreau | л, в | – | – | с | Ярославская обл. (4) |
| Mucor hiemalis Wehmer | – | – | л | – | Польша (12), Ярославская обл. (4) |
| Rhizopus stolonifer (Ehrenb.) Vuill. * ,+ | л | – | – | – | Ирак (13), Польша (12), Ярославская обл. (4) |
| Chromista, Oomycota | |||||
| Achlya debaryana Humphrey | с | – | – | с | Ярославская обл. (Данные авторов) |
| A. dubia Coker | – | – | л | – | То же |
| Pythium torulosum Coker & P. Patt. | с | – | – | с | США (9) |
| Saprolegnia eccentrica (Coker) R.L. Seym. ≈ | с, л | л | – | – | Ярославская обл. (Данные авторов) |
| S. ferax (Gruith.) Kütz. ≈ | с | с, л | л | л | То же |
| S. hypogyna (Pringsh.) Pringsh. ≈ | – | – | л | – | » |
| Saprolegnia sp. ≈ | с, л, в | – | л | – | » |
| S. unispora (Coker & Couch) R.L. Seym. ≈ | с | с, л | л, в | – | » |
| Стерильный мицелий | с, л, в | с, л, в | л, в | с, л, в | » |
| Всего видов | 25 | 19 | 39 | 16 | |
Примечание. П – оз. Плещеево; М – оз. Мостецкое; З – озеро в Заволжском районе г. Ярославля; К – р. Которосль. Части растения: л – лист; с – стебель; в – влагалище листа. Характеристика вида ≈ – облигатно водный вид микромицета; “*” – вид на живом растении в воздушной среде; “+” – на отмершем растении, погруженном в воду; “‰” – на отмершем растении, погруженном в солоноватую воду. “–” – отсутствие вида. Выделены п/ж шрифтом виды грибов, впервые указанные на тростнике. Литературные источники: 1 – Воронин, 2010; 2 – Попов и др., 2012; 3 – Тобиас и др., 2016; 4 – Черняковская, Воронин, 2017; 5 – Abdel-Aziz, 2008; 6 – Al-Saadoon, Al-Dossary, 2014; 7 – Angelini et al., 2012; 8 – Apinis et al., 1972; 9 – Crocker et al., 2015; 10 – Luo et al., 2004; 11 – Mazurkiewicz-Zapałowicz et al., 2006; 12 – Mazurkiewicz-Zapałowicz, 2010; 13 – Muhsin, Abgui-Kadir, 1995; 14 – Neubert et al., 2006; 15 – Poon, Hyde, 1998; 16 – Sutton, 1980; 17 – Taligoola et al., 1972; 18 – Van Ryckegem, 2005; 19 – Van Ryckegem, Verbeken, 2005а; 20 – Van Ryckegem, Verbeken, 2005б; 21 – Van Ryckegem, Verbeken, 2005в, 22 – Wirsel et al., 2001; 23 – Wirsel et al., 2002.
Водные объекты. Количество видов на тростнике изменялось от 16 (р. Которосль) до 39 (озеро в Заволжском р-не г. Ярославль), на всех полигонах присутствовали Alternaria alternata, Phoma herbarum, Saprolegnia ferax. Сходство видового состава грибов на тростнике в водных объектах изменялось от 21.1 (озеро в Заволжском р-не г. Ярославль и р. Которосль, пять общих видов и стерильный мицелий) до 53.3% (оз. Мостецкое и озеро в Заволжском р-не г. Ярославль, 14 общих видов и стерильный мицелий). Между озером в Заволжском районе г. Ярославль и р. Которосль рассчитано статистически значимое различие видового состава (R = 0.646, уровень значимости 0.1%).
Анализ структуры комплексов грибов проведен с помощью графиков индексов таксономического разнообразия на основе списка видов из указанных водных объектов (рис. 1а, 1б). Символы, соответствующие значениям индекса Δ+ для микокомплексов р. Которосль, оз. Мостецкое и озера в Заволжском р-не расположены на или рядом с пунктирной линией, которая проходит по центру 95%-ной вероятностной воронки. Следовательно, структура микокомплексов на тростнике в этих озерах в большей степени соответствует вертикальному распределению таксонов по одинаковым высоким систематическим рангам. В составе комплексов грибов отмечены ведущие порядки: Pleosporales – 6, 8 и 11 видов, Helotiales – 2, 3 и 8, Saprolegniales – 2, 3 и 5 соответственно, суммарно составляя от 38.2 до 73.7% списка грибов. Символ значения индекса микокомплекса оз. Плещеево находится выше среднего ожидаемого уровня, что указывает на присутствие грибов из других систематических ветвей. В оз. Плещеево выделен Rhizopus stolonifer (порядок Mucorales, отдел Mucoromycota), а также Acremonium charticola (сем. Incertae sedis, порядок Hypocreales), остальные представители этого порядка относятся к семействам Nectriaceae, Hypocreaceae и обнаружены во всех водоемах. Значения индекса Δ+ колебались незначительно (рис. 1а), как и таксономические пропорции микокомплексов вид/род – от 1.3 (оз. Мостецкое и р. Которосль) до 1.8 (оз. Плещеево), род/семейство – от 1.2 (озера Плещеево, Мостецкое) до 1.3 (оз. в Заволжском районе, р. Которосль).
Рис. 1.
Значения индекса таксономического своеобразия Δ+ (a) и индекса вариабельности Λ+ (б) микокомплексов отмершего тростника в водоемах Ярославской обл., на основе списка видов грибов из обследованных водных объектов. 1 – оз. Плещеево, 2 – оз. Мостецкое, 3 – озеро в Заволжском районе г. Ярославль, 4 – р. Которосль. Здесь и на рис. 2 пунктирная линия проходит по центру 95%-ной вероятностной воронки, прямыми линями ограничена вероятностная воронка, ⚫ — значения индексов Δ+ и Λ+.
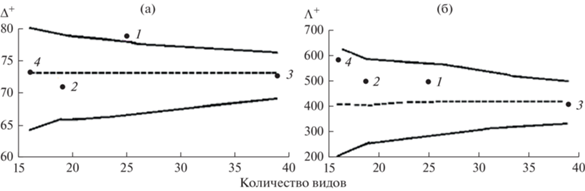
Все символы индекса Λ+ микокомплексов полигонов находятся в пределах вероятностной воронки. В микокомплексах озер Плещеево, Мостецкое и р. Которосль значения индексов выше среднего, но входят в пределы доверительной воронки, в этих местах обитания не выявлены грибы из порядков Dothideales, Eurotiales и Mucorales, но они группируются в общие ветви на последующих высоких рангах. Следовательно, объединение низших таксонов в более высокие ранги для исследуемых водных объектов сходны, а объекты характеризуются подобными условиями обитания.
В озерах на тростнике обнаружено 58 видов грибов, в р. Которосль – 16. Сходство видового состава грибов озер и реки соответствовало 27.0% (8 общих видов и стерильный мицелий).
Части растения. На листьях выявлено 56 видов из трех отделов и двух царств, на стеблях – 27 видов из 2 отделов 2 царств. В листовых влагалищах – 6 видов из 3 отделов, 2 царств. Сходство таксономического состава микромицетов на частях тростника изменялось от 17.0 (лист и листовое влагалище, пять общих видов и стерильный мицелий) до 50.0% (лист и стебель, 20 общих вида и стерильный мицелий).
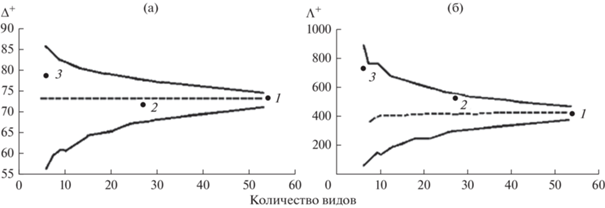
Символы, соответствующие значениям индексов Δ+ и Λ+ (рис. 2а, 2б) для микокомплексов листьев, стеблей и влагалищ расположены в пределах вероятностных воронок. Следовательно, несмотря на то, что химический состав листьев и стеблей по концентрации элементов K, Ca, Mn, Fe и др. различается в >2 раза (Likar et al., 2018), их разлагают виды грибов, относящиеся к одинаковым высшим таксономическим группам.
Рис. 2.
Значения таксономических индексов Δ+ (a) и Λ+ (б) микокомплексов частей отмершего тростника, погруженных в воду, в водоемах Ярославской обл., на основе списка видов грибов из обследованных водных объектов. 1 – листья, 2 – стебли, 3 – листовые влагалища.
Сезоны. В водных объектах количество видов микромицетов по сезонам изменялось от шести (зима) до 54 (осень). Осенью отмечено максимальное число видов, что обусловлено терригенными стоками. В осенний период во всех водоемах обнаружены Saprolegnia ferax и Cladosporium sphaerospermum (исключение р. Которосль); весной – C. herbarum, Coniothyrium obiones; летом – Cladosporium herbarum, Alternaria alternata, зимой – стерильный мицелий. Зимой во время ледостава отбор материала не проводили. Круглогодично на тростнике доминировал стерильный мицелий. Сходство видового состава изменялось от 13.3 (зима и осень, два общих вида и стерильный мицелий) до 43.2% (весна и лето, четыре общих вида и стерильный мицелий). Статистически достоверные различия в видовом составе микокомплексов выявлены между зимним и осенним сезонами (R = 0.620).
На стеблях минимальное число видов грибов отмечено весной (пять), максимальное летом (11). Сходство видового состава комплексов стеблей изменялся от 14.3 (осень и весна, общий стерильный мицелий) до 47.6% (лето и зима, три вида и стерильный мицелий). На листьях число видов грибов по сезонам изменялось от двух (зима) до 43 (осень), сходство видового состава – от 9.8 (зима и осень, два общих вида) до 47.6% (весна и лето, три общих вида и стерильный мицелий).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В отличие от других растений-макрофитов и погруженного листового опада деревьев и кустарников, колонизация грибами погруженных в воду частей тростника происходит медленно (Воронин, 2010). В пресноводных местах обитания на тростнике зарегистрирован 461 вид микромицетов (Fungi 435 + Chromista 26) (Voronin et al., 2021), из них на отмерших погруженных в воду растениях – 152 (150 + 2) (“сборный” список грибов, составлен по литературным данным (Luo et al., 2004; Al-Saadoon, Al-Dossary, 2014; Abdel-Aziz, 2016; Черняковская, Воронин, 2017)). В “сборном” списке на листьях известно 44 вида, на листовых влагалищах – 33, на стеблях – 120. Сходство таксономического состава грибов на частях растений изменялось от 31.7 (стебель и лист) до 41.6% (лист и листовое влагалище).
В нашем исследовании обнаружены 25 видов грибов, которые встречаются на живых и отмерших растениях в водных объектах разных стран (табл. 1). На отмершем, погруженном в воду, тростнике преобладают представители отделов Pleosporales, Hypocreales, Helotiales и Capnodiales, в “сборном” списке на их долю приходится 52.6 видового состава, в водных объектах Ярославской обл. – 58.3%. Сходство микокомплексов Ярославской области и “сборного” списка – 16.9%. Выявлены различия таксономической структуры комплексов грибов. Мы впервые на тростнике обнаружили пять видов грибоподобных организмов из рода Saprolegnia (царство Chromista), но не выявили представителей порядка Microascales (царство Fungi), а в “сборном” списке присутствуют 14 видов этого порядка.
Грибы родов Saprolegnia, Achlya, Pythium – паразиты рыб, амфибий и их икры, зоо- и фитопланктона (Обухова и др., 2017; Дзюба и др., 2020; Воронин, Жданова, 2021). Заболевания рыб также вызывают широко распространенные оппортунистические микромицеты из родов Alternaria, Aspergillus, Cladosporium, Fusarium, Penicillium, Phoma, Rhuzopus (Ghorbani-Choboghlo et al., 2014; Обухова и др., 2017). Виды Dactylaria питаются нематодами, которые попадают в их ловчие сети (Dharmendra, 2017; Devi, 2018).
Выводы. На мертвых погружeнных в воду растениях идентифицировано 61 вид микромицетов из 36 родов, 27 семейств, 14 порядков, 8 классов, 3 отделов, 2 царств, из них 23 вида впервые указаны на тростнике. На листьях выявлено 57 видов, на стеблях – 27, в листовых влагалищах – 6. Между видовой структурой микокомплексов озера в Заволжском районе г. Ярославль и р. Которосль рассчитано статистически значимое различие (R = 0.646). Систематическая характеристика комплексов грибов с использованием графиков таксономических индексов показала, что в микокомплексах водных объектов объединение низших таксонов грибов в высокие ранги сходны, следовательно, объекты характеризуются похожими условиями обитания. Использование графиков таксономических индексов позволило выявить, что в деструкции разных частей растения принимают участие организмы, относящиеся к одинаковым таксономическим группам высокого ранга. В составе микокомплексов водных объектов выявлены грибы, паразитирующие на гидробионтах (Saprolegnia, Achlya, Pythium, Alternaria, Aspergillus, Cladosporium, Fusarium, Penicillium, Phoma, Rhuzopus).
Список литературы
Воронин Л.В. 2010. Микобиота малых озер тундровой и лесной зон. Ярославль: Изд-во ЯГПУ.
Воронин Л.В., Жданова С.М. 2021. Поражение микопаразитами ветвистоусого рачка Daphnia cucullata (Crustacea, Cladocera, Daphniidae) в оз. Плещеево (Ярославская обл., Россия) // Биология внутр. вод. № 6. С. 655.https://doi.org/10.31857/S032096522106019X
Голуб В.Б., Бондарева В.В., Сорокин А.Н., Николайчук Л.Ф. 2015. Сообщества с доминированием тростника (Phragmites australis agg.) в долине Нижней Волги // Растительность России. № 26. С. 26. https://doi.org/10.31111/vegrus/2015.26.26
Дзюба Е.В., Кондратов И.Г., Майкова О.О. и др. 2020. Водные плесени порядка Saprolegniales (Oomycota) в ассоциации с байкальскими видами рыб и губок // Изв. РАН. Сер. биол. № 5. С. 526. https://doi.org/10.31857/S0002332920040050
Милько А.А. 1979. Систематика рода Saprolegnia // Микол. и фитопатол Т. 13. Вып. 4. С. 288.
Обухова О.В., Ларцева Л.В., Васильева Л.М. 2017. Особенности сапролегниоза икры судака (Sander lucioperca) в дельте р. Волги // Вестник АГТУ. Сер. Рыб. хоз-во. № 2. С. 70. https://doi.org/10.24143/2073-5529-2017-2-70-79
Попов Е.С., Коваленко А.Е., Гапиенко О.С. и др. 2012. Микобиота Белорусско-Валдайского поозерья. Моcква; Санкт-Петербург: Тов-во науч. изд. КМК.
Тобиас А.В., Балашова Н.Б., Киселев Г.А. 2016. Материалы к изучению микромицетов заказника “Лебяжий” (Ломоносовский район Ленинградской области) // Вестник СПбГУ. Сер. 3. Вып. 4. С. 37. https://doi.org/10.21638/11701/spbu03.2016.403
Черняковская Т.Ф., Воронин Л.В. 2017. Изучение таксономического состава грибов на разлагающихся в озере Плещеево листьях тростника обыкновенного // Экология и рациональное природопользование: Матер. Всерос. науч.-техн. конф. Ярославль: Ярослав. гос. ун-т им. П.Г. Демидова. С. 164.
Abdel-Aziz F.A. 2008. Diversity of aquatic fungi on Phragmites australis at Lake Manzala, Egypt // Sydowia. V. 60(1). P. 1.
Abdel-Aziz F.A. 2016. Freshwater fungi from the river Nile, Egypt // Mycosphere. V. 7(5). P. 741.
Al-Saadoon A.H., Al-Dossary N. 2014. Fungi from submerged plant debris in aquatic habitats in Iraq // Int. J. Biodiversity and Conservation. V. 6(6). P. 468. https://doi.org/10.5897/IJBC2013.0657
Angelini P., Rubini A., Gigante D. et al. 2012. The endophytic fungal communities associated with the leaves and roots of the common reed (Phragmites australis) in lake Trasimeno (Perugia, Italy) in declining and healthy stands // Fungal Ecol. V. 5(6). P. 683.
Apinis A.E., Chesters C.G.C., Taligoola T.K. 1972. Colonization of Phragmites australis by Fungi // Nova Hedwigia. Bd 23. Hf. 1. P. 113.
Clarke K.R., Gorley R.N., Somerfield P.J., Warwickb R.M. 2014. Change in marine communities: An approach to statistical analysis and interpretation. Plymouth: PRIMER-E.
Crocker E.V., Karp M.A., Nelson E.B. 2015. Virulence of Oomycete pathogens from Phragmites australis-invaded and noninvaded soils to seedlings of wetland plant species // Ecology and Evolution. V. 5(11). P. 2127. https://doi.org/10.1002/ece3.1468
Devi G. 2018. Utilization of Nematode Destroying Fungi for Management of Plant-Parasitic Nematodes – A Review // Biosci. Biotechnol. Res. Asia. V. 15(2). P. 377. https://doi.org/10.13005/bbra/2642
DeVries A.E., Kowalski K.P., Bickford W.A. 2020. Growth and behavior of north american microbes on Phragmites australis leaves // Microorganisms. V. 8. 690.
Dharmendra K. 2017. Genomic insights into the adaptation to parasitism in nematode – trapping fungi and transcriptomics during infection of Caenorhabditis briggsae and plant-parasitic nematodes // Indian Phytopath. V. 70 (1). P. 32. https://doi.org/10.24838/ip.2017.v70.i1.48986
Ellis M.B. 1971. Dematiaceous Hyphomycetes. Commonwealth Mycological Institute, Kew, Surrey, England.
Ellis M.B. 1976. More dematiaceous Hyphomycetes. Commonwealth Mycological Institute, Kew, Museum Surrey, England.
Ghorbani-Choboghlo H., Khosravi A.R., Sharifzadeh A. et al. 2014. Gastrointestinal microflora of captured stellate sturgeon (Acipenser stellatus Pallas, 1771) from Southeast Caspian Sea, Iran // Iranian J. Fish. Sci. V. 13(2). P. 319.
Index Fungorum 2021 – Index Fungorum [Internet]. Royal Botanic Gardens Kew. Available from http://www.indexfungorum.org/names/Names.asp (Accessed on November 01–30, 2021).
Likar M., Dolinar N., Vogel-Mikuš K. et al. 2018. Elemental composition and fungal colonisation of decomposing Phragmites australis (Cav.) Trin. ex Steud. litter at different water regimes // Acta Biologica Slovenica. V. 61. V. 61(2). P. 71.
Luo J., Yin J., Cai L. et al. 2004. Freshwater fungi in Lake Dianchi, a heavily polluted lake in Yunnan, China // Fungal Diversity. V. 16. P. 93. https://hdl.handle.net/10722/223486
Mazurkiewicz-Zapałowicz K., Wrobel M., Silicki A., Wolska M. 2006. Studies on phytopathogenic and saprotrophic fungi in rush associations of Lake Glinno (NW Poland) // Acta Mycologica. V. 41(1). P. 125. https://doi.org/10.5586/am.2006.016
Mazurkiewicz-Zapałowicz K. 2010. Microscopic fungi of Phragmites australis in the littoral of two Lakes in Drawa National Park (NW Poland) // Polish Botanical Journal. V. 55(2). P. 381. http://bomax.botany.pl/cgi-bin/pubs/data/article_pdf?id=2246
Muhsin T., Abgui-Kadir M. 1995. Ecology of fungi associated with Phragmites australis in Iraq // Abhath al-Yarmouk. V. 4(1-a). P. 31.
Neubert K., Mendgen K., Brinkmann H., Wirsel S.G.R. 2006. Only a Few Fungal Species Dominate Highly Diverse Mycofloras Associated with the Common Reed // Applied and Environmental Microbiology. V. 72(2). P. 1118. https://doi.org/10.1128/AEM.72.2.1118-1128.2006
Poon M.O.K., Hyde K.D. 1998. Biodiversity of intertidal estuarine fungi on Phragnates at Mai Po marshes, Hong Kong // Botanica Marina. V. 41. P. 141. https://doi.org/10.1515/botm.1998.41.1-6.141
Sangiorgio F., Basset A., Pinna M. et al. 2007. Ecosystem processes: litter breakdown patterns in Mediterranean and Black Sea transitional waters // Transit. Waters Bull. V. 3. P. 51.https://doi.org/10.1285/i1825229Xv1n3p51
Sutton B.C. 1980. The Coelomycetes. Fungi Imperfecti with pycnidia, acervuli and stromats // CMI. Surrey. Kew.
Taligoola T.K., Apinis A.E., Chester C.G.C. 1972. Microfungi colonizing collapsed aerial parts of Phragmites communis Trin. in water // Nova Hedwigia. V. 23. P. 465.
Van Ryckegem G. 2005. Fungi on common reed (Phragmites australis): fungal diversity, community structure and decomposition processes. Ghent: Ghent University.
Van Ryckegem G., Verbeken A. 2005a. Fungal ecology and succession on Phragmites australis in a brackish tidal marsh. I. Leaf sheaths // Fungal Diversity. V. 19. P. 157.
Van Ryckegem G., Verbeken A. 2005б. Fungal ecology and succession on Phragmites australis in a brackish tidal marsh. II. Stems // Fungal Diversity. V. 20. P. 209.
Van Ryckegem G., Verbeken A. 2005в. Fungal diversity and community structure on Phragmites australis (Poaceae) along a salinity gradient in the Scheldt-estuary (Belgium). Nova Hedwigia. V. 80(1–2). P. 173.
Voronin L.V., Kopytina N.I., Bocharova E.A. 2021. Checklist of fungi and fungi-like organisms on common reed Phragmites australis // Asian Journal of Mycology. V. 4(2). P. 67. https://doi.org/10.5943/ajom/4/2/7
Wirsel S.G.R., Leibinger W., Ernst M., Mendgen K. 2001. Genetic diversity of fungi closely associated with common reed // New Phytologist. V. 149. P. 589.
Wirsel S.G.R., Runge-Froböse C., Ahren D.G. et al. 2002. Four or more species of Cladosporium sympatrically colonize Phragmites australis // Fungal Genet. Biol. V. 35(2). P. 99. https://doi.org/10.1006/fgbi.2001.1314
Woudenberg J.H.C., Hanse B., van Leeuwen G.C.M. et al. 2017. Stemphylium revisited // Studies in Mycology. V. 87. P. 77. https://doi.org/10.1016/j.simyco.2017.06.001
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


