Ботанический журнал, 2021, T. 106, № 11, стр. 1072-1084
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ФОТОСИНТЕТИЧЕСКОГО АППАРАТА ПОДРОСТА PINUS SYLVESTRIS (PINACEAE) В ПОДЗОНЕ СРЕДНЕЙ ТАЙГИ ЕВРОПЕЙСКОГО СЕВЕРО-ВОСТОКА
С. Н. Плюснина 1, *, В. В. Тужилкина 1, **
1 Институт биологии Коми научного центра Уральского отделения РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: pljusnina@ib.komisc.ru
** E-mail: tuzhilkina@ib.komisc.ru
Поступила в редакцию 30.08.2020
После доработки 17.08.2021
Принята к публикации 24.08.2021
Аннотация
Представлены результаты комплексных структурно-физиологических исследований фотосинтетического аппарата сосны обыкновенной (Pinus sylvestris L.) у подроста, произрастающего на вырубке после сплошнолесосечной рубки хвойного фитоценоза в подзоне средней тайги европейского Северо-Востока. Выявлены закономерности изменения ультраструктуры клеток мезофилла, содержания и соотношения пигментов в однолетней хвое в течение вегетационного периода. Максимальное число органелл на срезе клеток мезофилла отмечено в третьей декаде мая. В середине периода вегетации хлоропласты характеризовались наибольшим числом гран и тилакоидов в них. Подготовка однолетней хвои к зимнему периоду сопровождалась снижением крахмала и суммарного числа тилакоидов гран в хлоропластах ассимиляционной паренхимы, смещением пластид вглубь цитоплазмы и накоплением в ней липидных глобул. Показано, что изменения пигментного комплекса P. sylvestris соответствуют ультраструктурным перестройкам хлоропластов в течение вегетации. Установлена тесная корреляция между развитием тилакоидной системы и содержанием хлорофиллов (r = 0.99). Наибольшее количество хлорофиллов, как и максимальное развитие системы фотосинтетических мембран в пластидах хвои, отмечалось в июле.
Pinus sylvestris L. (Pinaceae) – вид, который имеет обширный ареал на Евроазиатском материке и является одним из лесообразующих на европейском Северо-Востоке (Lesa, 1999). На таежных территориях Европейского Севера России повышение эффективности естественного лесовозобновления и реализации лесными экосистемами способности к самовозобновлению после рубок – задачи, которые стоят на первом месте среди проблем воспроизводства лесных ресурсов (Tsvetkov, 2010). Для познания биопродукционного процесса при возобновлении сосны необходимы морфофизиологические исследования хвои – основного ассимилирующего органа. При этом важное значение имеет характер взаимосвязи между структурными и физиологическими показателями клеток мезофилла на протяжении всего периода вегетации – периода роста и накопления биомассы. В течение года посредством биохимического и генетического регулирования изменяются концентрация и активность функциональных веществ (ферментов, пигментов и т.д.) в клетках (Bӓck et al., 2013; Wisniewski, 2018), результат этих процессов отражается в особенностях их структуры.
За последние полвека немало исследований было посвящено сезонным изменениям в структуре ассимиляционного аппарата как сеянцев хвойных растений (Walles, Hudak, 1975; Kivimäenpää et all., 2014), так и деревьев разного возраста (Soikkeli, 1980; Koteyeva, 2002; Zagirova, 2003a; Kivimäenpää, Sutinen, 2007; Ovsyannikov, Koteyeva, 2020), а также их пигментного фонда (Tuzhilkina, 2012; Sofronova et al., 2016). В комплексных работах рассматриваются структурные и функциональные изменения в фотоассимилирующей паренхиме (Ladanova, Tuzhilkina, 1992; Zagirova, 1999, 2001, 2003b; Wyka et al., 2016; Bender, 2019; Bag et al., 2020). Как показывают выше приведенные работы, на начальном этапе периода вегетации в перезимовавшей хвое еще наблюдаются изменения, связанные с переходом растения из зимнего состояния в летнее, а на конечном этапе – с подготовкой растения к периоду с низкими температурами. Молодые, активно растущие деревья отличаются от стареющих (зрелых) особей по структурным показателям хвои (Apple et al., 2002), а, следовательно, могут иметь особенности при прохождении этих этапов. В литературе имеются публикации по изучению физиологических процессов у подроста древесных растений, произрастающих под пологом лиственных и хвойных лесов (Katrushenko, 1967; Malkina et al., 1970; Zav’yalova, 1976; Zarubina, Konovalov, 2018). На сплошных вырубках (в условиях высокой инсоляции) этот вопрос рассматривается в единичных исследованиях (Leina, 1967; Wyka et al., 2016). Структурно-функциональная характеристика фотосинтетического аппарата подроста сосны необходима для выявления механизмов, ответственных за его успешное возобновление на вырубках в условиях сурового климата и при его изменении на Севере.
Цель данной работы – дать структурно-функциональную характеристику фотосинтетического аппарата подроста сосны обыкновенной (Pinus sylvestris L.), возобновившейся после проведения сплошной рубки древостоя.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили в течение вегетации 2018 г. (29 мая, 18 июля, 11 октября) в подзоне средней тайги Республики Коми. Климат в районе исследований умеренно-континентальный, безморозный период по среднемноголетним данным длится 180–190 дней, из них 140–150 дней характеризуются средней суточной температурой воздуха выше 5°С (период вегетации), переход температуры воздуха через 5°С весной отмечается в первой декаде мая, осенью – после 21 сентября (Atlas, 1997). В год исследований весна была затяжная, а лето – позднее, с жаркой погодой в третьей декаде июня и июле, умеренно-теплой в августе. Поздние весенние заморозки были отмечены 2 июня (–0.5°С), ранние осенние – 21 сентября (–0.5°С).
Объектами были 10–12-летние деревья Pinus sylvestris L. высотой 110–130 см, произрастающие на 10-летней вырубке сосняка черничного влажного после сплошнолесосечной рубки древостоя (61°35' с.ш., 51°02' в.д.) (Osipov, 2019). Для изучения морфологических параметров хвои в июле 2018 г. также срезали побеги с 75–95-летних деревьев P. sylvestris, произрастающих в сосняке черничном влажном (62°16' с.ш., 50°41' в.д.) на территории Ляльского лесобиологического стационара. Для исследований ультраструктуры клеток мезофилла отбирали образцы однолетней хвои с пяти, а для изучения динамики пигментов – с десяти растущих на вырубке деревьев сосны в течение вегетации. Такая биологическая повторность считается достаточной для достоверной характеристики биохимического состава хвои (Helmisaari, 1992). Побеги срезали с середины кроны с южной стороны дерева. Для электронно-микроскопических исследований фрагменты из средней трети хвои фиксировали в течение 4.5 ч в 2.5%-ном глутаральдегиде, приготовленном на фосфатном буфере с рН 7.4. Постфиксацию проводили в 1%-ном водном растворе OsO4 в течение 4 ч. После дегидратации в сериях растворов этилового спирта и ацетона образцы заключали в смолу Эпон-812 (FLUKA). Ультратонкие срезы были получены на ультрамикротоме PowerTome PC (Boeckeler Instruments, США). Наблюдения и съемку проводили на трансмиссионном электронном микроскопе Tesla BS 500 (Tesla, Чехословакия). Временные препараты продольных и поперечных срезов хвои для анатомических исследований просматривали под микроскопом Axiovert 200 M (Carl Zeiss, Германия). Фотосъемку объектов выполняли цифровой камерой AxioCam ERc 5s (Carl Zeiss, Германия), морфометрические измерения – при помощи программы ZEN 2011 (Carl Zeiss, Германия).
Количественный анализ фотосинтетических пигментов проводили спектрофотометрически на приборе UV-1800 (Shimadzu, Япония) в ацетоновой вытяжке по оптической плотности при длинах волн 662 и 644 нм (хлорофиллы) и 470 нм (каротиноиды) с поправками в максимумах поглощения (Maslova et al., 1986). Содержание хлорофилла в светособирающем комплексе (ССК) оценивали по соотношению хлорофиллов а и b (Lichtethaler, 1987).
Измерения СО2-газообмена хвои проводили на интактных побегах сосны в июле. Фотосинтетическую способность оценивали по поглощению СО2, измеренной инфракрасным (ИК) газоанализатором Li COR-6400 (Li COR, США) при максимальной интенсивности радиации 1800 мкмоль/м2 с ФАР, температуре 20°С и влажности 70%. Темновое дыхание измеряли по выделению СО2 ИК-газоанализатором в темноте при 20°С, влажности воздуха 70%, естественной концентрации СО2 в воздухе. Объект экспонировали в контролируемой камере 6400–22L (Li COR, США) до установления постоянной скорости СО2-газообмена. Продолжительность экспозиции объекта составляла 10–15 мин. При расчете интенсивности газообмена на единицу площади хвои использовали метод, предложенный Ю.Л. Цельникер (Tselniker, 1982).
Статистическую обработку полученных данных проводили на персональном компьютере с использованием программ “Excel” и “Statistica”. Значимость отличий исследуемых показателей проверяли с помощью критерия Стьюдента. В таблицах даны среднеарифметические значения и их стандартные ошибки. Для структурных параметров клеток и органелл n ≥ 25, для физиолого-биохимических n = 3–6.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфология и анатомия хвои. В год исследований длина однолетней хвои молодых сосен, произрастающих на вырубке сосняка черничного влажного, в среднем составляла 42.2 ± 1.9 мм, а площадь поперечного сечения – 0.85 ± 0.01 мм2. В литературе имеются сведения (Apple et al., 2002), что морфологические и анатомические признаки хвои молодых деревьев могут отличаться от старовозрастных. Так показано, что в условиях гор (368–500 м над у.м.) хвоя 450-летних деревьев Pseudotsuga menziesii (Mirb.) Franco была несколько короче, но с большей площадью поперечного сечения, чем хвоя с молодых 10–40-летних деревьев, посаженных на месте рубок. В хвое с возрастом дерева увеличивался парциальный объем нефотосинтетических (центральный цилиндр, эпидерма+гиподерма, астросклереиды) и уменьшался парциальный объем ассимилирующих тканей (мезофилл) и объем смоляных ходов (Apple et al., 2002). Согласно нашим данным в год исследований длина однолетней хвои сосны на вырубке на 15% (p <0.05) уступала по своей длине хвое с 75–95-летних деревьев, произрастающих в сосняке черничном влажном. Площадь поперечного сечения хвои и доля фотосинтезирующих клеток на срезе не отличались от зрелых деревьев в древостое. В листовом аппарате молодых деревьев закладывается 3–8 смоляных ходов со средним диаметром 74 ± 3 мкм, а у 75–95-летних деревьев – 8–14 со средним диаметром 60 ± 2 мкм. Смоляные ходы, окруженные клетками обкладки, в хвое зрелых деревьев занимали на 30% больше объема, чем у молодых.
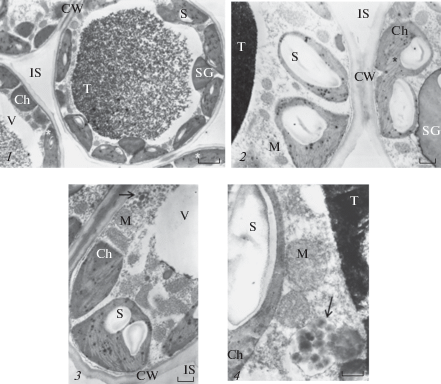
В поперечном сечении хвоя P. sylvestris – полукруг или полуовал (рис. 1, 1). В однолетней хвое 10–12-летних деревьев парциальный объем эпидермы и гиподермы в сумме составляет около 16%, мезофилла и эндодермы – чуть более 50%, смоляных ходов с клетками обкладки – 7.6%, центрального цилиндра (в том числе два проводящих пучка, межпучковая склеренхима и трансфузионная ткань) – 24%. На поперечном срезе мезофилл складчатый, межклетники слабо выражены (рис. 1, 2). На продольном срезе клетки между гиподермой и эндодермой расположены “цепочками” (рис. 1, 3, 4), межклеточное пространство занимает в ассимилирующей паренхиме около 20%.
Рис. 1.
Однолетняя хвоя подроста Pinus sylvestris на поперечном (1, 2) и продольном (3 – май; 4 – июль) срезах. En – эндодерма, Ep – эпидерма, Hp – гиподерма, IS – межклетник, Ms – мезофилл, N – ядро, Ph – флоэма, RC – смоляной ход, Sc – склеренхима, St – устьице, T – танин, Xl – ксилема, * – хлоропласт с крахмалом. Масштабные линейки, мкм: 1 – 100; 2 – 50; 3 – 20; 4 – 20.
Fig. 1. One-year-old needles of young Pinus sylvestris on transverse (1, 2) and longitudinal (3 – May; 4 – July) sections. En – endoderm, Ep – epidermis, Hp – hypodermis, IS – intercellular space, Ms – mesophyll, N – nucleus, Ph – phloem, RC – resin canal, Sc – sclerenchyma, St – stoma, T – tannin, Xl – xylem, * – chloroplast with starch. Scale bars, μm: 1 – 100; 2 – 50; 3 – 20; 4 – 20.

Ультраструктура клеток мезофилла. Тонкая структура клеток мезофилла однолетней хвои в третьей декаде мая свидетельствовала о ее высокой функциональной активности. В эти сроки было отмечено максимальное за весь период наблюдения число органелл на продольных срезах клеток мезофилла (табл. 1). Хлоропласты располагались преимущественно вдоль клеточной стенки (рис. 1, 3, рис. 2, 1). Содержание крахмала в хлоропластах было максимальным за весь период наблюдений (табл. 1), поэтому большинство пластид было неправильной формы (рис. 2, 2). В хлоропластах также просматривались крупные и мелкие пластоглобулы средней электронной плотности (рис. 2, 3). Система фотосинтетических мембран была хорошо развита, однако еще встречались сдвоенные тилакоиды (16% от общего количества гран), наличие которых в сформированной хвое характерно, в том числе, для зимней организации ассимиляционного аппарата (Ladanova, Tuzhilkina, 1992; Koteyeva, 2002; Zagirova, 2003a). Профили митохондрий в этот период были от округлых до сильно вытянутых, заполнены кристами. На срезах ассимилирующих клеток было отмечено до 6 профилей аппарата Гольджи. В цитоплазме клеток мезофилла хвойных встречаются липидные глобулы, число и размер которых варьируют, в том числе, в зависимости от сезона (Ladanova, Tuzhilkina, 1992; Koteyeva, 2002; Zagirova, 2003a; Kivimäenpää et al., 2014). В начале периода вегетации в клетках мезофилла подроста сосны липидсодержащие включения выявлялись не в каждой клетке (табл. 1): электронно-плотные липидные глобулы небольших размеров до 0.7 мкм2 – очень редко, вдоль клеточной стенки; менее электронно-плотные запасающие глобулы со средней площадью 10.7 ± 1.3 мкм2 – чаще, в толще цитоплазмы. Как центральные, так и мелкие вакуоли были заполнены осмиофильным материалом (рис. 1, 3, рис. 2, 1), в мезофилле хвойных определяемым как танинсодержащее вещество (Atlas, 1972; Soikkeli, 1980; Kivimäenpää et all., 2014). В целом, площадь сечения хлоропласта без крахмала, количественные характеристики тилакоидной системы и число пластоглобул в них были близки к показателям, приведенным для пластид мезофилла хвои первого года жизни генеративных деревьев сосны в зимний период (Zagirova, 1999). Отличия заключались в большем, по сравнению с зимним периодом, числе хлоропластов и наличии в них крупных зерен крахмала. То есть после зимнего покоя в однолетней хвое молодых деревьев сначала увеличивается число пластид, а потом начинает нарастать система фотосинтетических мембран.
Таблица 1.
Характеристика органелл в клетках мезофилла на продольном срезе однолетней хвои подроста Pinus sylvestris в течение периода вегетации Table 1. Characteristics of organelles in mesophyll cells on longitudinal section of one-year-old needle of young Pinus sylvestris during vegetation season
| Параметры Characteristics |
29 мая May 29 |
18 июля July 18 |
11 октября October 11 |
|---|---|---|---|
| Площадь сечения клетки, мкм2 Sectional area of cell, μm2 |
630.8 ± 21.2 | 679.2 ± 35.9 | 689.3 ± 16.1 |
| Число хлоропластов на срез клетки Number of chloroplasts per cell section |
21.7 ± 1.3ab | 15.3 ± 0.7aс | 9.2 ± 0.8bс |
| $\frac{{{\text{Доля хлоропластов с крахмалом, \% }}}}{{{\text{Парциальный объем крахмала в хлоропласте, \% }}}}$6$\frac{{{\text{Share of chloroplasts with starch, \% }}}}{{{\text{Partial volume of grain starch in the chloroplast, \% }}}}$ | $\frac{{69.2 \pm {{{2.1}}^{{\text{a}}}}}}{{58.0 \pm {{{0.7}}^{{\text{a}}}}}}$ | $\frac{{53.7 \pm {{{3.3}}^{{{\text{ac}}}}}}}{{21.9 \pm {{{1.5}}^{{{\text{bc}}}}}}}$ | $\frac{{22.9 \pm {{{3.7}}^{{{\text{bc}}}}}}}{{12.9 \pm {{{0.8}}^{{{\text{bc}}}}}}}$ |
| Число митохондрий на срез клетки Number of mitochondria per cell section |
36.4 ± 2.6b | 22.8 ± 1.5aс | 12.8 ± 0.8bс |
| $\frac{{{\text{Площадь сечения митохондрий, мк}}{{{\text{м}}}^{{\text{2}}}}}}{{{\text{Короткая ось митохондрий, мкм}}}}$6$\frac{{{\text{Sectional area of mitochondria, }}\mu {{{\text{m}}}^{{\text{2}}}}}}{{{\text{Short axis of mitochondria, }}\mu {\text{m}}}}$ | $\frac{{0.47 \pm 0.02}}{{0.66 \pm 0.02}}$ | $\frac{{0.40 \pm 0.03}}{{0.59 \pm 0.03}}$ | $\frac{{0.50 \pm 0.04}}{{0.69 \pm 0.03}}$ |
| $\frac{{{\text{Число запасающих глобул на срез клетки}}}}{{{\text{Площадь сечения запасающей глобулы min}}...{\text{max, мк}}{{{\text{м}}}^{{\text{2}}}}}}$6$\frac{{{\text{Number of stored globules per cell section}}}}{{{\text{Area of stored globule section min}}...{\text{max, }}\mu {{{\text{m}}}^{{\text{2}}}}}}$ | $\frac{{1.8 \pm 0.2}}{{1.2...31.4}}$ | $\frac{{1.0 \pm 0.2}}{{1.2...88.7}}$ | $\frac{{ < 1}}{{5.0...24.3}}$ |
| $\frac{{{\text{Число липидных глобул на срез клетки}}}}{{{\text{Площадь сечения липидной глобулы, мк}}{{{\text{м}}}^{{\text{2}}}}}}$6$\frac{{{\text{Number of lipid globules per cell section}}}}{{{\text{Area of lipid globule section, }}\mu {{{\text{m}}}^{{\text{2}}}}}}$ | $\frac{{ < 1}}{{0.41 \pm 0.05}}$ | –* | $\frac{{44.4 \pm 4.3}}{{0.47 \pm 0.05}}$ |
| Толщина клеточной оболочки, мкм Cell wall thickness, μm |
0.44 ± 0.02b | 0.46 ± 0.01 | 0.50 ± 0.02b |
Примечание: В таблицах 1–3 различия статистически значимы при p < 0.05 между вариантами: a – 29 мая и 18 июля; b – 29 мая и 11 октября; c – 18 июля и 11 октября.
Note: In Tables 1–3, the differences are significant at p < 0.05: a – May 29 and July 18; b – May 29 and October 11; c – July 18 and October 11.
Рис. 2.
Клетки мезофилла на продольном срезе однолетней хвои подроста Pinus sylvestris в мае. Ch – хлоропласт, CW – клеточная оболочка, IS – межклетник, M – митохондрия, S – крахмал, T – танин, V – вакуоль. Масштабные линейки, мкм: 1 – 1.0; 2 – 2.0; 3 – 0.5.
Fig. 2. Mesophyll cells on the longitudinal section of one-year-old needle of young Pinus sylvestris in May. Ch – chloroplast, CW – cell wall, IS – intercellular space, M – mitochondrion, S – starch, T – tannin, V – vacuole. Scale bars, μm: 1 – 1.0; 2 – 2.0; 3 – 0.5.

Таблица 2.
Характеристика хлоропластов в клетках мезофилла на продольном срезе однолетней хвои подроста Pinus sylvestris в течение периода вегетации Table 2. Characteristics of chloroplasts in mesophyll cells on longitudinal section of one-year-old needle of young Pinus sylvestris needle during vegetation season
| Параметры Characteristics |
29 мая May 29 |
18 июля July 18 |
11 октября October 11 |
|---|---|---|---|
| Площадь сечения хлоропласта без крахмала, мкм2 Sectional area of the chloroplast without starch, μm2 |
5.9 ± 0.4b | 5.0 ± 0.4 | 4.7 ± 0.2b |
| Длинная ось/короткая ось Long axis/short axis |
3.5 ± 0.3b | 3.6 ± 0.3 | 5.2 ± 0.5b |
| Площадь сечения хлоропласта с крахмалом, мкм2 Sectional area of the chloroplast with starch, μm2 |
13.3 ± 0.4ab | 6.5 ± 0.3ac | 4.6 ± 0.3bc |
| Число гран на срез хлоропласта Number of grains per chloroplast section |
29.1 ± 2.1a | 34.9 ± 1.3ac | 28.5 ± 2.9с |
| Число тилакоидов в гране Number of thylakoids per grain |
3.5 ± 0.1a | 5.7 ± 0.3ac | 3.5 ± 0.1с |
| Число пластоглобул на срез хлоропласта Number of plastoglobules per chloroplast section |
27.0 ± 1.7 | 27.6 ± 1.6 | 31.9 ± 1.9 |
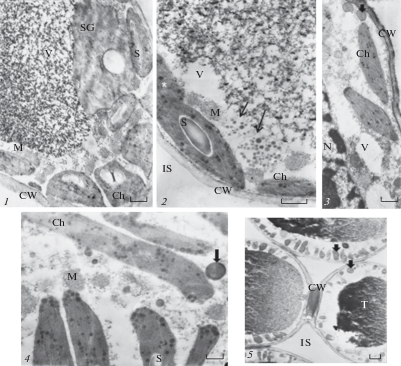
Во второй декаде июля в клетках мезофилла однолетней хвои содержалось среднее число органелл за период наблюдений. Содержание крахмала в пластидах снижалось (табл. 1). Встречались сдвоенные по длинной оси хлоропласты (рис. 3, 1, 2). Комплекс фотосинтетических мембран продолжал развиваться, в этот срок суммарное число гранальных тилакоидов на единицу площади сечения хлоропласта без крахмала (насыщенность хлоропласта фотосинтетическими мембранами) было максимальным и составляло 39.8 против 18.7 весной и 20.0 осенью. Пластоглобулы были преимущественно крупные, в том же количестве, что и весной (табл. 1). Снижалось число и среднее значение площади сечения митохондрий в клетках (табл. 1). В центральных вакуолях по-прежнему накапливались танинсодержащие включения, но в меньшем количестве (рис. 1, 4, рис. 3, 1). Также в цитоплазме встречались (до 6 на срез клетки) небольшие (1.1 ± 0.4 мкм2) вакуоли с электронно-плотными глобулами внутри (рис. 3, 3, 4). Липидсодержащие запасающие глобулы со средней электронной плотностью часто сливались по несколько в одну очень крупную (табл. 1), а мелкие электронно-плотные практически не встречались. Аппарат Гольджи на срезах клеток мезофилла отмечался реже, чем весной. В этот период число пластид на срезе клетки и суммарное число тилакоидов в хлоропласте были не ниже, чем в августе в клетках мезофилла хвои 80‒100-летних деревьев сосны (Zagirova, 2001).
Рис. 3.
Клетки мезофилла на продольном срезе однолетней хвои подроста Pinus sylvestris в июле. Ch – хлоропласт, CW – клеточная оболочка, IS – межклетник, M – митохондрия, S – крахмал, SG – запасающая глобула, T – танин, V – вакуоль, * – сдвоенные хлоропласты. Стрелки указывают на вакуоли с электронно-плотными глобулами. Масштабные линейки, мкм: 1 – 2.0; 2 – 1.0; 3 – 1.0; 4 – 0.4.
Fig. 3. Mesophyll cells on the longitudinal section of one-year-old needle of young Pinus sylvestris in July. Ch – chloroplast, CW – cell wall, IS – intercellular space, M – mitochondrion, S – starch, SG – storage globule, T – tannin, V – vacuole, * – doubled chloroplasts. Arrows indicate vacuoles with electron-dense globules. Scale bars, μm: 1 – 2.0; 2 – 1.0; 3 – 1.0; 4 – 0.4.
Одним из важнейших эндогенных факторов, влияющих на структурно-функциональные параметры однолетней хвои, является рост побегов текущего года (Zagirova, 2003). Выявлено, что начало роста P. sylvestris весной обусловлено суммой среднесуточных температур выше +5°C, а прекращение роста – совместным действием фотопериода и температуры (Andersson Gull et al., 2018). На 2.5-летних саженцах P. sylvestris было показано (Lippu, 1998), что накопленные в конце предыдущего периода вегетации фотоассимиляты использовались во время роста молодых побегов лишь незначительно. Проведенные на 20-летних деревьях сосны эксперименты показали (Ericsson, 1978), что во время роста в побеги текущего года поступают ассимиляты, синтезируемые одно- и двухлетней хвоей. Отмечается (Malkina, 1984), что их потребление в растущей хвое сохраняется, пока она не достигнет 50% от окончательных размеров. Экспортировать продукты фотосинтеза хвоя сосны текущего года начинает в середине июля (Ericsson, 1978), когда скорость фотосинтеза в ней сопоставима с таковой у хвои старшего возраста. Это происходит примерно через 4 недели после того, как впервые в молодой хвое измеряется положительный нетто-фотосинтез. Чем лучше питание и водный режим, тем быстрее это происходит (Ericsson, 1978). Активный отток ассимилятов в растущие органы из однолетней хвои и, соответственно, повышенная потребность в функциональных единицах в клетках-донорах не могут не отразиться на их структуре. Согласно нашим наблюдениям 29 мая вегетативные побеги текущего года еще находились на стадии внутрипочечного роста. Именно в этот период в однолетней хвое наблюдалось максимальное количество органелл в клетке и крахмала в хлоропластах. Повышенной численностью пластид компенсировалась не до конца перестроившаяся после зимнего периода система фотосинтетических мембран. 18 июля хвоя на побегах текущего года уже достигла 70% от конечной длины и 100% по площади сечения. В этот период, число митохондрий и хлоропластов было еще достаточно высоко, а насыщенность последних фотосинтетическими мембранами максимально (табл. 2) в изученные нами сроки. По мере роста молодой хвои снижалось содержание крахмала в хлоропластах. На 80–100-летних деревьях пихты Abies sibirica Ledeb. было показано (Zagirova, 2003a), что ростовые процессы молодых побегов не отражались на динамике гранальной структуры хлоропластов и их числа в мезофилле хвои старшего возраста, однако вызывали снижение содержания крахмала в них.
В середине октября были отмечены изменения в структуре клетки, свидетельствующие об активной подготовке молодых деревьев к сезону с отрицательными температурами. Число пластид в клетках мезофилла статистически значимо (p < 0.001) сокращалось в сравнении с началом и серединой вегетационного периода (табл. 1). Уменьшение (p < 0.001) числа хлоропластов в однолетней хвое подроста с приближением осени было подтверждено и на поперечных срезах хвои. Так, 29 мая их число на срезе клетки мезофилла в среднем составляло 31.1 ± 0.9, 18 июля – 25.2 ± ± 1.0, 11 октября – 15.6 ± 0.9 при средней площади сечения клеток 2744 ± 74.3 мкм2, 2536 ± 173.9 мкм2, 2425 ± 94.6 мкм2 соответственно. В хвое с разных деревьев изменения проходили несинхронно (рис. 4). В ассимилирующих клетках можно было наблюдать разные стадии изменения структуры при подготовке к периоду с отрицательными температурами. Встречалось несколько групп структурных признаков клеток и промежуточные между ними варианты. К первой группе относилась структура мезофилла, схожая с июльской: достаточное количество крахмала и хорошо развитая гранальная система (до 4-х тилакоидов в гране) в хлоропластах, расположенных вдоль клеточной стенки (рис. 4, 1). В таких клетках еще встречались сдвоенные пластиды и характерные для июля вакуоли с электронно-плотными глобулами внутри (рис. 4, 2), а электронно-плотные липидные глобулы в цитоплазме выявлялись редко. Ко второй группе относились клетки с хлоропластами обычной формы, чаще без крахмала, с пластоглобулами и большим количеством гран по 2–3 тилакоида. В клетках появлялись небольшие липидные глобулы (рис. 4, 3). К третьей группе относились клетки, в которых пластиды зачастую располагались почти перпендикулярно относительно клеточной оболочки, т.е. было отмечено начало их сезонного перемещения. У некоторых хлоропластов соотношение длинной и короткой осей достигало 14 (рис. 4, 4). Еще встречались мелкие зерна крахмала в отдельных хлоропластах, однако около 80% пластид не содержали крахмала совсем. В цитоплазме отмечено накопление большого количества мелких липидных глобул (рис. 4 , 5; табл. 1). В таблицах приведены средние значения для описываемого срока, и в целом они демонстрируют, что система фотосинтетических мембран при переходе к периоду физиологического покоя отчасти деградирует, число гран уменьшается на 20% по сравнению с летним периодом, а 24% из оставшихся содержат по 2 тилакоида. Сокращение числа хлоропластов сопровождается накоплением в цитоплазме ассимиляционной паренхимы значительного (до 100 на срез клетки) числа небольших липидных глобул, преимущественно вдоль клеточных стенок. Несинхронные изменения, наблюдаемые в ультраструктуре клеток мезофилла, помимо индивидуальной изменчивости, вероятнее всего связаны с разными микроклиматическими условиями места произрастания отдельных деревьев, сложившихся в фитоценозе после рубки древостоя.
Рис. 4.
Клетки мезофилла на продольном срезе однолетней хвои подроста Pinus sylvestris в октябре. Ch – хлоропласт, CW – клеточная оболочка, IS – межклетник, M – митохондрия, N – ядро, S – крахмал, SG –запасающая глобула, T – танин, V – вакуоль, * – сдвоенные хлоропласты. Тонкие стрелки указывают на вакуоли с электронно-плотными глобулами, толстые стрелки – на липидные глобулы. Масштабные линейки, мкм: 1 – 1.0; 2 – 1.0; 3 – 1.0; 4 – 0.5; 5 – 2.0.
Fig. 4. Mesophyll cells on the longitudinal section of one-year-old needle of young Pinus sylvestris in October. Ch – chloroplast, CW – cell wall, IS – intercellular space, M – mitochondrion, N – nucleus, S – starch, SG – storage globule, T – tannin, V – vacuole, * – doubled chloroplasts. Thin arrows indicate vacuoles with electron-dense globules and thick arrows show lipid globules. Scale bars, μm: 1 – 1.0; 2 – 1.0; 3 – 1.0; 4 – 0.5; 5 – 2.0.
Согласно (Ladanova, Tuzhilkina, 1992) подготовка к зиме в клетках мезофилла хвои текущего года Picea obovata Ledeb. начинается еще в период активной вегетации (конец июля–август). Как и у подроста сосны, это связано с постепенным снижением в хлоропластах числа гран и тилакоидов в гране, уменьшением объемов крахмала в хлоропластах. В сентябре в хвое ели крахмал практически исчезает, пластиды сильно вытянуты, начинается их перемещение к центральной части клетки (Ladanova, Tuzhilkina, 1992). Перемещение хлоропластов из летнего положения, когда они распределены вдоль клеточной стенки, в зимнее, когда они локализованы в одной из частей клетки, связывают не только с формированием морозоустойчивости, но и с фотозащитной реакцией, и наблюдают в период холодовой акклиматизации хвойных в умеренном поясе (Ovsyannikov, Koteyeva, 2020). Согласно (Koteyeva, 2002) в клетках мезофилла P. sylvestris в условиях Ленинградской области (зона умеренного климата, переходного от океанического к континентальному) структурные перестройки начинаются в октябре и сопровождаются группированием хлоропластов и других органелл в складках, образованных выростами клеточной оболочки. Также есть мнение, что сезонное перемещение хлоропластов (агглютинация) в клетках мезофилла происходит от клеточной периферии к ядерной оболочке и связано с коллапсом эндоплазматической сети при снижении экспорта фотосинтатов и прекращении фотосинтеза зимой, а концентрирование пластид вокруг ядра – универсальное следствие отсутствия фотосинтеза, независимое от таксономической специфики объекта (Gamaley, 2015).
Увеличение парциального объема осмиофильных глобул в цитоплазме мезофилла ели отмечено (Ladanova, Tuzhilkina, 1992) уже во второй декаде августа, и оно продолжается до ноября месяца. Увеличение накопления липидов в цитоплазме клеток мезофилла показано также для хвои текущего года трехлетних сеянцев ели в процессе их адаптации к холоду (Kivimäenpää et all., 2014) и зрелых деревьев сосны (Soikkeli, 1980) и пихты (Zagirova, 2003a). Таким образом, накопление липидсодержащих глобул в конце периода вегетации (август–ноябрь) и присутствие их в зимний период – общее явление для хвои разных пород деревьев на разных этапах развития в условиях таежной зоны. Оно отмечено как минимум для хвои первого и второго года жизни. В мае липидные глобулы в однолетней хвое подроста сосны, как было показано выше (табл. 1), встречались крайне редко. Исчезновение липидных глобул с началом активного роста молодых побегов отмечено в перезимовавшей хвое пихты (Zagirova, 2003a). Автор предполагает, что сезонная динамика числа и размеров липидных глобул может быть связана с изменением дыхательных путей в клетках мезофилла хвои.
Пигменты, фотосинтез, дыхание. Исследования пигментной системы у подроста Pinus sylvestris на вырубке показали, что общий фонд фотосинтетических пигментов изменяется в течение вегетации. Однако в отличие от 90-летней сосны, произрастающей в черничных фитоценозах, у 10‑летнего подроста на вырубке сезонный ритм накопления хлорофилла несколько иной и характерен для взрослых деревьев заболоченных сосновых сообществ (Tuzhilkina, 2012). Весной при переувлажнении почвы в условиях вырубки сосняка черничного влажного хвоя содержала наименьшее количество зеленых пигментов (табл. 3). В летний период при наиболее благоприятной влажности почвы в хвое накапливалось наибольшее количество пигментов, которое сопровождалось развитием тилакоидной системы хлоропластов. Максимальное количество хлорофиллов в хвое ели и сосны в середине периода вегетации отмечалось ранее для взрослых деревьев как нами (Ladanova, Tuzhilkina, 1992; Tuzhilkina, 2012), так и другими исследователями (Ottander et al, 1995; Sofronova et al., 2016). Поздней осенью с наступлением холодной и дождливой погоды и перестройкой пластидного аппарата концентрация хлорофилла в хвое у подроста сосны снижалась на 14% по сравнению с летом. Уменьшение фонда пигментов обусловлено как неблагоприятными погодными условиями, так и, очевидно, уменьшением прочности связи пигментов с белковым комплексом в хлоропластах, которое ранее наблюдалось нами в хвое 90-летних деревьев, произрастающих в сосновых фитоценозах (Tuzhilkina, 1985). Величина соотношения хлорофиллов a и b снизилась с 4.1 до 2.8, что обусловлено торможением биосинтеза хлорофилла а, связанного с двумя фотосистемами. Доля хлорофиллов, локализованных в светособирающем комплексе фотосистем, составляла менее 50% от общего фонда зеленых пигментов, увеличиваясь к осени до 58%. Для однолетней хвои подроста прослеживается устойчивая положительная связь количества зеленых пигментов в течение вегетации с изменениями суммарного числа фотосинтетических мембран в гранах на срез хлоропласта (r = 0.99). Содержание желтых пигментов также подвержено колебаниям в сезонном цикле. В отличие от хлорофиллов, летом отмечается наименьшее их количество. Весной и осенью содержание каротиноидов выше на 22%. Величина соотношения хлорофиллов к каротиноидам в эти периоды в 1.5 раза ниже по сравнению с летом, что свидетельствует об увеличении в пигментном аппарате сосны относительного содержания желтых пигментов, играющих протекторную роль ассимиляционного аппарата от фотодинамического разрушения в условиях низких температур и избыточной инсоляции (Ottander et al, 1995; Yatsko et al., 2009).
Таблица 3.
Динамика содержания пигментов в однолетней хвое подроста Pinus sylvestris Table 3. Dynamics of the pigment content in the one-year-old needles of young Pinus sylvestris
| Параметры Characteristics |
29 мая May 29 |
18 июля July 18 |
11 октября October 11 |
|---|---|---|---|
| Хлорофилл а + b, мг/г сухой массы Chlorophyll a + b, mg/g dry weight |
1.58 ± 0.05a | 1.80 ± 0.01ac | 1.55 ± 0.06с |
| Хлорофилл а/хлорофилл b Chlorophyll a/chlorophyll b |
4.1 ± 0.3 | 3.6 ± 0.1 | 2.8 ± 0.1 |
| Доля хлорофилла в ССК, % Share of chlorophyll in LHC,% |
44 | 48 | 58 |
| Каротиноиды, мг/г сухой массы Carotenoids, mg/g dry weight |
0.48 ± 0.02a | 0.38 ± 0.01ac | 0.49 ± 0.01c |
| Хлорофиллы/каротиноиды Chlorophylls/carotenoids |
3.3 ± 0.01 | 4.7 ± 0.03 | 3.2 ± 0.10 |
Одной из важнейших характеристик фотосинтетического аппарата являются ассимиляционные числа (АЧ). Расчет АЧ показал, что фотосинтетическая активность единицы хлорофилла однолетней хвои у подроста сосны на вырубке составляет 5.40 мг СО2/мг хлорофилла в час, что почти вдвое выше работоспособности хлорофилла, полученной нами для 90-летней сосны в древостое.
Измерения углекислотного газообмена P. sylvestris показали, что летом хвоя способна поглощать СО2 с высокой интенсивностью до 5.73 ± ± 0.50 мкмоль СО2/м2 с. Дыхательная способность ее при 20°С составляет 0.37 ± 0.01 мкмоль СО2/м2 с. Ассимиляционный аппарат сосны в оптимальных для роста условиях характеризуется низким соотношением фотосинтеза и дыхания, которое составило лишь 7.0% от максимальной скорости поглощения СО2, что свидетельствует о незначительных энергетических затратах, необходимых для роста хвои.
Таким образом, установлено, что фотосинтетический аппарат P. sylvestris, возобновившейся после рубки древостоя, имеет развитый пластидный аппарат и структуры, обеспечивающие активный газообмен. Хвоя характеризуется содержанием достаточного фонда пигментов (хлорофиллов 1.55–1.80, каротиноидов – 0.38–0.49 мг/г сухой массы) в течение вегетации, что дает возможность древесному растению поглощать СО2 с весны до осени. Адаптация пигментной системы к факторам среды в этот период сопровождается изменениями соотношений ее компонентов. Величина ассимиляционного числа у подроста сосны указывает на высокую фотосинтетическую активность единицы хлорофилла. Установлена положительная корреляция между количеством зеленых пигментов и числом фотосинтетических мембран на срез хлоропласта (r = 0.99), которые имеют хорошо выраженную сезонную динамику: нарастание с весны до середины лета и уменьшение к концу вегетации. Адаптация хвои к низким температурам сопровождается снижением содержания крахмала в пластидах, смещением пластид от клеточной стенки вглубь цитоплазмы, в которой накапливается значительное количество липидных глобул. В целом, в ультраструктуре однолетней хвои на протяжении периода вегетации отмечены характерные для хвойных бореальной зоны изменения. Особенностью однолетней хвои молодого, активно растущего дерева P. sylvestris на вырубке является значительное увеличение числа пластид в период роста побегов текущего года, являющихся мощными акцепторами питательных веществ.
Список литературы
Andersson Gull B., Persson T., Fedorkov A., Mullin T.J. 2018. Longitudinal differences in Scots pine shoot elongation. – Silva Fennica. 52 (5). 12 p. https://doi.org/10.14214/sf.10040
Apple M., Tiekotter K., Snow M., Young Ja., Soeldner A., Phillips D., Tingey D., Bond B.J. 2002. Needle anatomy changes with increasing tree age in Douglas-fir. – Tree Physiology. 22: 129–136.
[Atlas] Атлас по климату и гидрологии Республики Коми. 1997. Москва. 116 с.
[Atlas] Атлас ультраструктуры растительных клеток. 1972. Петрозаводск. 296 с.
Bag P., Chukhutsina V., Zhang Z., Paul S., Ivanov A.G., Shutova T., Croce R., Holzwarth A.R., Jansson S. 2020. Direct energy transfer from photosystem II to photosystem I confers winter sustainability in Scots Pine. – Nature Communications. 11: 6388. www.nature.com/naturecommunicationshttps://doi.org/10.1038/s41467-020-20137-9
Bäck J., Nikinmaa E., Kulmala L., Simojoki A., Kalliokoski T., Hari P. et al. 2013. Processes in Living Structures. – In: Physical and Physiological Forest Ecology Springer, Dordrecht. P. 43–223. https://doi.org/10.1007/978-94-007-5603-8
[Bender] Бендер О.Г. 2019. Структурные и функциональные особенности хвои кедра сибирского и кедрового стланика в условиях юга западной Сибири. – Проблемы ботаники Южной Сибири и Монголии. 18: 467–471. https://doi.org/10.14258/pbssm.2019097
Ericsson A. 1978. Seasonal changes in translocation of C14 from different age-classes of needles on 20-year-old Scots Pine Trees (Pinus sylvestris). – Plant Physiol. 43: 351–358.
[Gamaley] Гамалей Ю.В. 2015. Агглютинация пластид мезофилла и облитерация ситовидных трубок флоэмы – общее следствие сезонных пауз экспорта фотосинтантов. – Цитология. 57 (6): 415–421.
Helmisaari H.S. 1992. Spatial and age-related variation in nutrient concentration of Pinus sylvestris needles. – Silva Fennica. 26 (3): 145–153.
[Katrushenko] Катрушенко И.В. 1967. Фотосинтез подроста ели во вторичных сообществах южной тайги. – В кн.: Световой режим, фотосинтез и продуктивность леса. М. С. 237–241.
Kivimäenpää M., Riikonen J., Sutinen S., Holopainen T. 2014. Cell structural changes in the mesophyll of Norway spruce needles by elevated ozone and elevated temperature in open-field exposure during cold acclimation. – Tree Physiology. 34 (4): 389–403. https://doi.org/10.1093/treephys/tpu023
Kivimäenpää M., Sutinen S. 2007. Microscopic structure of Scots pine (Pinus sylvestris (L.)) needles during ageing and autumnal senescence. – Trees. 21: 645–659. https://doi.org/10.1007/s00468-007-0157-8
[Koteyeva] Котеева Н.К. 2002. Особенности сезонной ритмики ультраструктуры клеток апикальной меристемы побега и мезофилла хвои Pinus sylvestris (Pinaceae). – Бот. журн. 87 (11): 50–60.
[Ladanova, Tuzhilkina] Ладанова Н.В., Тужилкина В.В. 1992. Структурная организация и фотосинтетическая активность хвои ели сибирской. Сыктывкар. 100 с.
[Leina] Леина Г.Д. 1967. Фотосинтез елового подроста под пологом и на вырубках ельника черничника свежего в связи с давностью рубки. – В кн.: Световой режим, фотосинтез и продуктивность леса. М. С. 232–236.
[Lesa] Леса Республики Коми. 1999. М. 332 с.
Lichtethaler N.K. 1987. Chlorophylls and carotenoids-pigments of photosynthetic biomembranes. – Methods in Enzymology. 148: 350–382.
Lippu J. 1998. Redistribution of 14C-labelled reserve carbon in Pinus sylvestris seedlings during shoot elongation. – Silva Fennica. 32 (1): 3–10.
[Malkina] Малкина И.С. 1984. Газообмен и образование ассимилятов в разновозрастной хвое сосны обыкновенной. – Лесоведение. 6: 29–33.
[Malkina, Tselniker, Yakshcina] Малкина И.С., Цельникер Ю.Л., Якшина А.М. 1970. Фотосинтез и дыхание подроста. М. 184 с.
[Maslova, Popova, Popova] Маслова Т.Г., Попова И.А., Попова О.Ф. 1986. Критическая оценка спектрофотометрического метода количественного определения пигментов. – Физиология растений. 39 (6): 615–619.
[Osipov] Осипов А.Ф. 2019. Эмиссия СО2 с поверхности отдельных технологических элементов вырубок среднетаежных сосняков черничных. – В кн.: Сохранение лесных экосистем: материалы II Междунар. науч.-практ. конф. Киров. С. 138–141.
Ottander C., Campbell D., Őquist G. 1995. Seasonal changes in photosystem II organisation and pigment composition in Pinus sylvestris. – Planta. 197 (1): 176–183.
Ovsyannikov A.Yu., Koteyeva N.K. 2020. Seasonal movement of chloroplasts in mesophyll cells of two Picea species. – Protoplasma. 257: 183–195. https://doi.org/10.1007/s00709-019-01427-6
Sofronova V.E., Dymova O.V., Golovko T.K., Chepalov V. A., Petrov K.A. 2016. Adaptive Changes in Pigment Complex of Pinus sylvestris Needles upon Cold Acclimation. – Russian Journal of Plant Physiology. 63 (4): 433–442. https://doi.org/10.1134/S1021443716040142
Soikkeli S. 1980. Ultrustructure of the Mesophyll in Scots Pine and Norway Spruce: Seasonal Variation and Molarity of the Fixative Buffer. – Protoplasma. 103: 241–252.
[Tuzhilkina] Тужилкина В.В. 2012. Пигментный комплекс хвои сосны в лесах европейского Северо-Востока. – Лесоведение. 4: 16–23.
[Tuzhilkina] Тужилкина В.В. 1985. Состояние хлорофилл-белково-липоидного комплекса хвои сосны обыкновенной и ели сибирской. – В кн.: Комплексные биогеоценологические исследования хвойных лесов европейского Северо-Востока. (Труды АН СССР. Коми филиал. 44). Сыктывкар. С. 26–34.
[Tselniker] Цельникер Ю.Л. 1982. Упрощенный метод определения поверхности хвои сосны и ели. – Лесоведение. 4: 85–88.
[Tsvetkov] Цветков В.Ф. 2010. Потенциал лесовозобновления на вырубках европейского Севера России. – Лесоведение. 3: 3–14.
Walles B., Hudak J. 1975. A comparative study of chloroplast morphogenesis in seedlings of some conifers (Larix decidua, Pinus sylvestris and Picea abies). – Studia Forestalia Suecica. 127. 22 p.
Wisniewski M., Nassuth A., Arora R. 2018. Cold Hardiness in Trees: A Mini-Review. – Frontiers in Plant Science. 9: 1–9. https://doi.org/10.3389/fpls.2018.01394
Wyka T.P., Zytkowiak R., Oleksyn J. 2016. Seasonal dynamics of nitrogen level and gas exchange in different cohorts of Scots pine needles: a conflict between nitrogen mobilization and photosynthesis? – European Journal of Forest Research. 135: 483–493. https://doi.org/10.1007/s10342-016-0947-x
[Yatsko et al.] Яцко Я.Н., Дымова О.В., Головко Т.К. 2009. Пигментный комплекс зимне- и вечнозеленых растений в подзоне средней тайги европейского Северо-Востока. – Бот. журн. 94 (12): 1812–1820.
[Zav’yalova] Завьялова Н.С. 1976. Функциональная характеристика фотосинтетического аппарата подроста сосны, ели, пихты и кедра в сосняке травяном в подзоне южной тайги Зауралья. – В кн.: Эколого-физиологические исследования хвойных древесных видов на Урале. Свердловск. С. 3–13.
[Zagirova] Загирова С.В. 1999. Структура ассимиляционного аппарата и CO2-газообмен у хвойных. Екатеринбург. 108 с.
Zagirova S.V. 2001. Structure and CO2 Exchange in the Needles of Pinus sylvestris and Abies sibirica. – Russian Journal of Plant Physiology. 48 (1): 23–28.
[Zagirova] Загирова С.В. 2003a. Рост побегов и динамика структуры клеток мезофилла в двухлетней хвое Abies sibirica Ledeb. – Физиология растений. 50 (1): 43–47.
Zagirova S.V. 2003b. CO2 Exchange and Mesophyll Structure in Second-Year Needles of Abies sibirica Ledeb. – Russian Journal of Plant Physiology. 50 (1): 41–43.
[Zarubina, Konovalov] Зарубина Л.В., Коновалов В.Н. 2018. Динамика накопления пластидных пигментов у подроста ели при онтогенезе березняка черничного. – Лесной журнал. 3: 54–64. https://doi.org/10.17238/issn0536-1036.2018.3.54
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


