Ботанический журнал, 2021, T. 106, № 11, стр. 1085-1100
ВЛИЯНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ НА МЕТАБОЛОМ PINUS SYLVESTRIS (PINACEAE)
К. В. Сазанова 1, 2, *, Н. В. Алексеева-Попова 1, И. В. Дроздова 1, А. И. Беляева 1, И. Б. Калимова 1, Н. И. Павлова 1, А. Л. Шаварда 1, 3
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
3 Научный парк Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: Ksazanova@binran.ru
Поступила в редакцию 31.08.2020
После доработки 03.08.2021
Принята к публикации 24.08.2021
Аннотация
В экспериментальных условиях, с применением метода газовой хроматографии-масс-спектрометрии изучено влияние Cu, Ni и Cd на метаболом Pinus sylvestris. Установлено, что изменения в структуре метаболитной сети растений обнаруживаются на 6-е сутки после воздействия металлов, что на 3–6 дней раньше проявления визуальных симптомов токсичности. При этом контрольная группа растений проявляет отличия на уровне метаболома раньше, а специфическое влияние отдельных металлов на метаболом растений заметно только на 9-е сутки. Оба фактора (природа металла и его концентрация) вносят равнозначный вклад в кластеризацию метаболомов растений. Ответные же реакции растений на действие металлов, проявляющиеся в изменении концентраций отдельных метаболитов, существенно отличаются в зависимости от вносимой концентрации металлов (1 или 5 мМ) и от природы металлов: особенности влияния Cd и Cu проявляются в основном сходным образом, а действие Ni часто отличается. Визуализированные динамические изменения метаболитной матрицы растений обусловлены в основном не набором определенных соединений, а являются проявлением изменения ее корреляционной структуры.
Загрязнение тяжелыми металлами представляет собой значительную угрозу для экосистем. В отличие от органических загрязнителей, эти полютанты не являются биоразлагаемыми и способны перемещаться по пищевой цепи через биоаккумуляцию (Singh et al., 2011). Активное поступление тяжелых металлов в окружающую среду определяет многократное увеличение стрессовых нагрузок на все компоненты экосистем, что может вести к изменению ее структуры в целом (11Kurilenko et al., 2004). Тяжелые металлы являются естественными компонентами земной коры. Накопление значительных концентраций некоторых металлов в окружающей среде – воздухе, почве и растениях – может быть результатом естественных процессов, а также следствием деятельности человека. Антропогенными источниками для эмиссии металлов являются объекты добычи ископаемого топлива, сжигания отходов, переработки руды в цветные металлы, транспорт (Pacyna, Pacyna, 2001; Sawidis et al., 2011). Проблема загрязнения тяжелыми металлами особенно актуальна в городской среде (Al-Khlaifat, Al-Khashman, 2007; Sawidis et al., 2011; Chen et al., 2016; Zhao et al., 2016). Изучение механизмов устойчивости растений к токсическому действию тяжелых металлов необходимо для разработки эффективных методов оценки возрастающего антропогенного загрязнения окружающей среды и разработки мер по его снижению.
Cd, Cu и Ni относятся к приоритетным загрязнителям окружающей среды. Кадмий не является необходимым элементом для роста растений, но он легко усваивается корнями и переносится в побеги. Поэтому его присутствие в окружающей среде даже в минимальных количествах представляет серьезную угрозу для растений (Xie et al., 2014). Медь и никель, в отличие от кадмия, необходимы для нормального роста и развития растений. Однако, когда концентрация этих металлов в окружающей среде очень высока, они становятся токсичными (Valko et al. 2006; Bhalerao et al., 2015; Hassan et al., 2019).
Поглощение и накопление избыточных концентраций тяжелых металлов растениями вызывает различные морфологические, физиологические и биохимические реакции, которые проявляются в торможении роста, нарушении фотосинтеза, дыхания, водного обмена и минерального питания растений (Nazar et al., 2012; 22Titov et al., 2014; Bhalerao et al., 2015). Некоторые ионы металлов вызывают окислительный стресс через образование активных форм кислорода (АФК), которые нарушают метаболизм клеток и приводят к множественным токсическим эффектам, таким как перекисное окисление липидов, расщепление белков или повреждение ДНК (Pongrac et al., 2009; Kandziora-Ciupa et al., 2016). Таким образом, токсическое действие металлов проявляется в нарушении многочисленных метаболических процессов в растении.
В зависимости от таксономической и экологической принадлежности, растения проявляют одну из двух стратегий устойчивости к тяжелым металлам, а именно предотвращения или ограничения поглощения металлов клетками растений или внутриклеточной детоксикации металлов (Titov et al., 2014). Обнаружено, что у растений имеются внутриклеточные системы, которые контролируют АФК с использованием неферментативных антиоксидантов, таких как глутатион, пролин, аскорбиновая кислота, каротиноиды и небелковые соединения, богатые группами S‑H, а также ферментативные антиоксидантные системы (Pongrac et al. 2009; Kandziora-Ciupa, et al., 2016). Низкомолекулярные соединения играют важную роль при адаптации растений к тяжелым металлам. Ряд метаболитов, таких как органические кислоты, аминокислоты, сахара и полиолы могут функционировать в качестве антиоксидантов, осмо-протекторов, молекул сигнальной трансдукции, а также являться побочными продуктами биохимических изменений, происходящих при стрессе (Rizhsky et al., 2004; Shulaev et al., 2008; Xie et al., 2014).
В последнее время мощным инструментом для исследования особенностей метаболических процессов у растений является метаболомный профайлинг (Guy et al., 2008; Fiehn, 2002; Kaplan et al., 2004). В отличие от целевого анализа конкретных соединений результаты метаболомного профайлинга позволяют не только получать данные о концентрационных изменениях большого числа малых органических молекул, но также и исследовать эмерджентное поведение такой сложнейшей биологической системы как метаболитная сеть растения при стрессовом воздействии.
Сосна обыкновенная (Pinus sylvestris L.) является одной из основных лесообразующих хвойных пород на Европейском Севере России, она весьма чувствительна к атмосферному загрязнению и другим антропогенным факторам. В многочисленных исследованиях показано, что эта древесная порода широко используется для целей биоиндикации загрязнения среды тяжелыми металлами (33Yarmishko 1997; 44Ivanov et al., 2013; Kandziora-Ciupa et al., 2016; Václavík et al., 2016). Сосновые иголки с толстым эпикутикулярным восковым слоем интересны для биомониторинга загрязнения воздуха из-за возможности как пассивного, так и активного поглощения тканями из атмосферы (Kandziora-Ciupa, et al., 2016).
Цель данного исследования состояла в выявлении общих закономерностей изменения метаболитного профиля Pinus sylvestris, а также концентрационных изменений отдельных метаболитов под действием меди, никеля и кадмия.
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание растений и воздействие тяжелыми металлами
Для проведения эксперимента использовали семена P. sylvestris сбора 2011 г., предоставленные Выборгским лесхозом Ленинградской области. Проращивание семян проводили в вегетационных сосудах, содержащих 1 кг песка, который поливали через сутки дистиллированной водой, а после появления всходов – разбавленным 1:2 питательным раствором Арнона. В каждый сосуд высевали по 50 семян, после появления всходов оставляли по 20 растений на сосуд. Растения выращивали в контролируемых условиях со световым периодом 16 ч при температуре 21°С в течение месяца. Затем, в контрольный вариант продолжали вносить питательную смесь в той же концентрации, а в опытных вариантах к ней добавляли сернокислые соли металлов (CuSO4 ⋅ 5H2O, NiSO4 ⋅ 7H2O и CdSO4 ⋅ 8H2O). Использовали подобранные в предварительной серии опытов (Drozdova et al., 2014) действующие концентрации этих тяжелых металлов: 1 мМ и 5 мМ. Расчет был выполнен именно на концентрацию металлов, а не их солей. Оценку темпов накопления биомассы надземной части сеянцев проводили гравиметрическим методом. Для определения абсолютно сухой биомассы ее высушивали до постоянного веса. Пробы для анализа метаболитного профиля P. sylvestris и содержания в растениях Cu, Ni и Cd отбирали в процессе роста на 3-й, 6-й и 9-й день после внесения металлов до появления визуальных признаков токсичности.
Подготовка проб
Пробоподготовку осуществляли в соответствии с общепринятыми современными методиками (Kim, Verpoorte, 2010). Растения фиксировали в жидком азоте, экстрагировали метанолом и центрифугировали при 4000 g в течение 10 минут. Полученный экстракт выпаривали при 40°С на роторном испарителе IKA, сухой остаток растворяли в пиридине. Далее с использованием N, O-бис-(триметилсилил) трифторацетамида (BSTFA) (Supelco, США) получали TМС (триметилcилил)-производные. Cилилирование выполняли в течение 15 мин при 100°С.
Растительный материал для анализа содержания тяжелых металлов фиксировали при 105°C, затем выдерживали в сушильном шкафу при 70°С до достижения постоянного веса. Сухие образцы (2 г) озоляли в муфельной печи при 450° C в течение 12 ч. Золу растворяли в 6 мл смеси кислот: 1.5 М HCl и 3.71 М HNO3, затем разбавляли деионизированной водой до 25 мл.
Анализ проб
Анализ содержания метаболитов в растениях P. sylvestris проводили методом газовой хромато-масс-спектрометрии (ГХ-МС) на приборе Маэстро (Интерлаб, Россия) с масс-селективным детектором 5975С, колонка HP-5MS, 30м × × 0.25мм × 0.25 мкм, Agilent (US). Хроматографирование проводили при линейном программировании температуры от 70°C до 320°C, 6°C/мин в режиме постоянства потока газа-носителя через колонку (1 мл/мин). Газ-носитель – гелий. Сканирование масс-спектров проводилось в диапазоне 50–800 m/z с частотой 2 скана/сек. Хроматограммы образцов регистрировали по полному ионному току. Сбор данных осуществляли с помощью программного обеспечения Agilent ChemStation.
Концентрации Cu, Ni и Cd определяли на атомно-абсорбционном спектрофотометре Квант-АФА, “Кортек”, Россия.
Обработка данных
Обработку и интерпретацию масс-спектрометрической информации проводили с использованием программы AMDIS (http://www.amdis.net), базы данных NIST 2011 и базы данных масс-спектрометрической информации, созданной в Ботаническом институте им. В.Л. Комарова РАН. Определение индексов удерживания (RI) проводили с методом калибровки по стандартным предельным углеводородам. Полуколичественную (semiquantitation) интерпретацию метаболитного профиля осуществляли по площадям пиков полного ионного тока методом внутреннего стандарта с помощью программы UniChrom (www.unichrom.com). В качестве внутреннего стандарта использовался трикозан, добавляемый в пробу на стадии растворения ее в пиридине. Следует особо отметить, что данные о количественном содержании отдельных соединений являются не более чем оценочной характеристикой содержания метаболитов в экстрактах растений, но могут использоваться для построения метаболитной матрицы, которая и является формальным результатом профайлингового анализа и используется для статистического моделирования изучаемого явления. Статистическая обработка результатов была выполнена методами мультивариантной статистики с использованием программ Microsoft Excel и MetaboAnalist.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Визуальные симптомы токсичности появились на 10–12 день. Они проявлялись в уменьшении прироста, усыхании, хлорозах и некрозах хвои, укорочении главного и боковых корней. Ранее нами были показаны особенности влияния Ni, Cu и Cd в концентрациях 1 и 5 мМ на ростовые и морфологические признаки растений Pinus sylvestris (55Drozdova et al., 2014). В этих опытах было установлено, что под действием Cd рост стебля и хвои замедлялся на 20% по сравнению с контролем при концентрации металла 1 мМ и на 30% – при концентрации 5 мМ. Медь в низкой концентрации практически не влияла на рост стебля, а в высокой концентрации замедляла его рост на 30–35%. Токсическое влияние Cu в обеих концентрациях в большей степени затрагивало накопление биомассы хвои, которая была на 35–40% меньше, чем в контроле. Никель в низкой концентрации не влиял на прирост стебля и хвои, а в высокой концентрации замедлял прирост стебля на 5–10% и на 20% снижал биомассу хвои. Настоящее исследование в целом подтвердило полученные ранее данные. На 9-е сутки эксперимента наиболее выраженным – на 30% по сравнению с контролем было снижение сухой биомассы надземной части сеянцев Pinus sylvestris при действии Cd в концентрации 5 мМ. Никель в концентрации 1 мМ не вызывал сколько-нибудь значимого снижения биомассы сеянцев, с увеличением концентрации до 5 мМ наблюдалось ее снижение на 25%. Воздействие Cu в концентрациях 1 и 5 мМ приводило к снижению аккумуляции биомассы сеянцев от 20 до 23% от контроля.
Метаболомный профайлинг растений позволил идентифицировать соединения следующих классов: карбоновые кислоты алифатического ряда, в том числе кислоты цикла Кребса, аминокислоты, сахарокислоты, жирные кислоты; сахароспирты, моно- и дисахара, циклические кислоты (шикимовая кислота, хинная кислота, кумаровая кислота, феруловая кислота), флавоноиды (катехины, изорамнетин), терпены (в том числе абиетиновая кислота и фитол), стеролы. Некоторые соединения не были идентифицированы, но учитывались при построении статистических моделей. Результаты метаболомного профайлинга представлены в виде тепловой карты на рис. 1.
Рис. 1.
Тепловая карта метаболитов, обнаруженных в экстрактах растений Pinus sylvestris под действием металлов (Ni – неидентифицированные метаболиты, Rt – время удерживания; F – furanose, P – pyranose).
Fig. 1. Heat map of metabolites found in extracts of Pinus sylvestris plants under the influence of metals (Ni – unidentified metabolites, Rt – retention time; F – furanose, P – pyranose).

На рисунке видно, что добавление металлов в питательный раствор влияет на концентрационные изменения множества метаболитов. Кроме того, метаболомный профиль растения претерпевает динамические изменения в процессе роста растений. Сочетание этих изменений приводит к изменению структуры метаболитной сети в целом.
Состояние метаболитной сети растений было смоделировано с использованием метода главных компонент (МГК) в виде точек в фазовом пространстве, которое построено в координатах, выражающих число молекул каждого структурного типа, обнаруженных в данный момент времени в пробе. Согласно результатам МГК-анализа, различия в структуре метаболитной сети контрольных растений и растений, выращенных в присутствии металлов, выражающиеся в кластеризации метаболомов опытных образцов, заметны только на 6-е сутки после воздействия. На 3-и сутки различия не проявляются (рис. 1, 2). На 9-е сутки заметно четкое расхождение в пространстве главных компонент метаболомов растений, выращенных в присутствии того или иного металла, т.е. проявляется специфическое действие металлов. Таким образом, различия между метаболомом контрольных и опытных растений проявляются раньше, чем между растениями, выращенными в присутствии разных металлов. При этом скорость формирования ответной реакции на уровне метаболома не имеет прямой зависимости от концентрации вносимых Cu, Ni и Cd.
Рис. 2.
PCA анализ растений Pinus sylvestris после внесения тяжелых металлов Cu, Ni и Cd в концентрации 1 мМ: а – 3‑и сутки, полученная модель объясняет 42.8% общей дисперсии (PC1 – 26.5%; PC2 – 16.3%); б – 6-е сутки, полученная модель объясняет 42% общей дисперсии (PC1 – 23.1%; PC2 – 18.9%); в – 9-е сутки, полученная модель объясняет 45.3% общей дисперсии (PC1 – 31.3%; PC2 – 14%).
Fig. 2. PCA analysis of Pinus sylvestris plants after the addition of heavy metals Cu, Ni and Cd at a concentration of 1 mM: а – 3rd day, the resulting model explains 42.8% of the total variance (PC1 – 26.5%; PC2 – 16.3%); б – 6th day, the resulting model explains 42% of the total variance (PC1 – 23.1%; PC2 – 18.9%); в – 9th day, the resulting model explains 45.3% of the total variance (PC1 – 31.3%; PC2 – 14%).

Рис. 2.
Окончание.

Рис. 3.
PCA анализ растений Pinus sylvestris после внесения тяжелых металлов Cu, Ni и Cd в концентрации 5 мМ: а – 3‑и сутки, полученная модель объясняет 42.7% общей дисперсии (PC1 – 25.5%; PC2 – 17.2%); б – 6-е сутки, полученная модель объясняет 42.1% общей дисперсии (PC1 – 28.6%; PC2 – 16.5%); в – 9-е сутки, полученная модель объясняет 46.5% общей дисперсии (PC1 – 25.6%; PC2 – 20.9%).
Fig. 3. PCA analysis of Pinus sylvestris plants after the addition of heavy metals Cu, Ni and Cd at a concentration of 5 mM: а – 3rd day, the resulting model explains 42.7% of the total variance (PC1 – 25.5%; PC2 – 17.2%); б – 6th day, the resulting model explains 42.1% of the total variance (PC1 – 28.6%; PC2 – 16.5%); в – 9th day, the resulting model explains 46.5% of the total variance (PC1 – 25.6%; PC2 – 20.9%).

Рис. 3.
Окончание.

Как видно на рис. 1, концентрации многих соединений сильно варьируют даже в пределах одной экспериментальной группы. Такие различия являются проявлением индивидуальных особенностей метаболомного профиля отдельных растений. Эти различия, безусловно, вносят вклад в структуру метаболитной сети растений. Таким образом, визуализированные динамические изменения метаболитной матрицы растений обусловлены в основном не набором определенных соединений, а, скорее всего, являются проявлением изменения ее корреляционной структуры. Тем не менее статистический анализ позволяет выявить нагрузки переменных, т.е. коэффициенты значимости для отдельных метаболитов. Для главных компонент (ГК) 1 и 2 на 6‑е сутки роста при обеих концентрациях металлов коэффициенты значимости были наибольшими для шикимовой, хинной и глицериновой кислот. При концентрации металлов 5 мМ, а также при более длительном воздействии металлов большую значимость приобретали жирные кислоты и сукцинат (табл. 1). Под действием металлов в концентрации 5 мМ на 9-е сутки изменения метаболома были также связаны с некоторыми аминокислотами (пролин и серин) и многоатомными спиртами (мио-инозитол и ононитол), фитолом и катехином.
Таблица 1.
Наиболее значимые для построения статистической модели метаболомных различий соединения Table 1. The most significant compounds for constructing a statistical model of metabolomic differences
| Cутки/day | Концентрация металлов/ Concentration of metals | Соединения/Compounds |
|---|---|---|
| 6 | 1 mМ | Шикимовая кислота, хинная кислота, эритроновая кислота, глицериновая кислота, галактоза/Shikimic acid, quinic acid, erythronic acid, glyceric acid, galactose |
| 5 mМ | Шикимовая кислота, хинная кислота, янтарная кислота, глицериновая кислота, арабитол, катехин, линолевая, линоленовая кислоты/Shikimic acid, quinic acid, succinic acid, glyceric acid, arabitol, catechin, linolic acid, linoleic acid | |
| 9 | 1 mМ | Шикимовая кислота, хинная кислота, янтарная кислота, глицериновая кислота, эритроновая кислота, ситостерол, жирные кислоты (линолевая, линоленовая, пальмитиновая)/Shikimic acid, quinic acid, succinic acid, glyceric acid, erythronic acid, sitosterol, fatty acids (linolic acid, linoleic acid, palmitic acid) |
| 5 mМ | Янтарная кислота, глюкоза, серин, пролин, ононитол, катехин, мио-инозитол, фитол, линоленовая кислота/Succinic acid, glucose, serine, proline, ononitol, catechin, myo-inositol, phytol, linoleic acid |
При количественном анализе конкретных соединений также заметно, что особенности влияния Cd и Cu на накопление метаболитов часто сходны, а действие Ni проявляется иначе. Влияние Cu и Cd связано практически с одинаковым набором метаболитов, а именно в первую очередь с хинной и шикимовой кислотами, янтарной кислотой и жирными кислотами. Влияние же Ni в большей степени затрагивает метаболизм аминокислот (пролина и серина), углеводов (глюкоза, галактоза) и в меньшей степени хинной и шикимовой кислот.
Как было отмечено выше, концентрации многих метаболитов часто сильно различаются между образцами даже в пределах одной экспериментальной группы. Однако для некоторых соединений различия средних значений концентраций между опытными группами достоверно на уровне значимости 95% (р = 0.05). К таким соединениям относятся хинная, шикимовая, янтарная кислоты и аминокислота пролина, концентрационные изменения которых под действием металлов обсуждаются ниже.
На рисунках 4 и 5 показаны изменения концентраций хинной и шикимовой кислот под действием металлов. На 3-и сутки появляется тенденция к увеличению концентраций в тканях растений этих кислот относительно контроля под действием 1 мМ Cd и Cu и тенденция к уменьшению содержания этих кислот при концентрации металлов 5 мМ. Значимые различия проявляются, начиная с 6-х суток после внесения металлов.
Рис. 4.
Изменение содержания шикимовой кислоты в растениях Pinus sylvestris под действием металлов: а – 1 мМ; б – 5 мМ.
Fig. 4. Change in the shikimic acid content in Pinus sylvestris plants under the influence of metals: а – 1 mM; б – 5 mM.
Key: концентрация, мкг/г сухой биомассы – concentration, μg/g dry biomass; контроль – control; 3-и сутки – 3th day; 6-е сутки – 6th day; 9-е сутки – 9th day.

Рис. 5.
Изменение содержания хинной кислоты в растениях Pinus sylvestris под действием металлов: а – 1 мМ; б – 5 мМ.
Fig. 5. Change in the quinic acid content in Pinus sylvestris plants under the influence of metals: а – 1 mM; б – 5 mM.
Key: концентрация, мкг/г сухой биомассы – concentration, μg/g dry biomass; контроль – control; 3-и сутки – 3th day; 6-е сутки – 6th day; 9-е сутки – 9th day.

Действие Ni на метаболом сосны в низкой концентрации (1 мM), в отличие от действия Cd и Cu, практически не связано с увеличением концентрации хинной и шикимовой кислот, а в высокой концентрации Ni стимулирует накопление этих кислот на 3-и сутки, но далее их содержание снижается.
Шикимовая и хинная кислота является промежуточными продуктами шикиматного пути, участвующего в биосинтезе фенольных соединений. По литературным данным, повышенное количество фенольных соединений в тканях растений наблюдали при воздействии различных стрессовых факторов. Это можно рассматривать как общую реакцию адаптации растений к стрессовым условиям и как стратегию запасания углеродных скелетов, в периоды, когда рост растений ограничен. Как именно стресс-индуцированный биосинтез фенольных соединений обуславливает адаптацию к стрессу является дискуссионным вопросом. Предполагается, что количество фенольных соединений возрастает в том случае, если фотосинтез ингибирован в меньшей степени, чем рост (Caretto et al., 2015).
Содержание янтарной кислоты колебалось в зависимости от времени воздействия, вида металла и его концентрации (рис. 6). Под действием Cd и Cu в обеих концентрациях содержание сукцината возрастало относительно контроля. Под действием Cu эти различия проявлялись на 6-е сутки, а под действием Cd – на 9-е сутки после внесения металла. Ni не оказывал достоверно значимого влияния на накопление в растениях сукцината.
Рис. 6.
Изменение содержания янтарной кислоты в растениях Pinus sylvestris под действием металлов: а – 1 мМ; б – 5 мМ.
Fig. 6. Change in the succinic acid content in Pinus sylvestris plantsunder the influence of metals: а – 1 mM; б – 5 mM.
Key: концентрация, мкг/г сухой биомассы – concentration, μg/g dry biomass; контроль – control; 3-и сутки – 3th day; 6-е сутки – 6th day; 9-е сутки – 9th day.
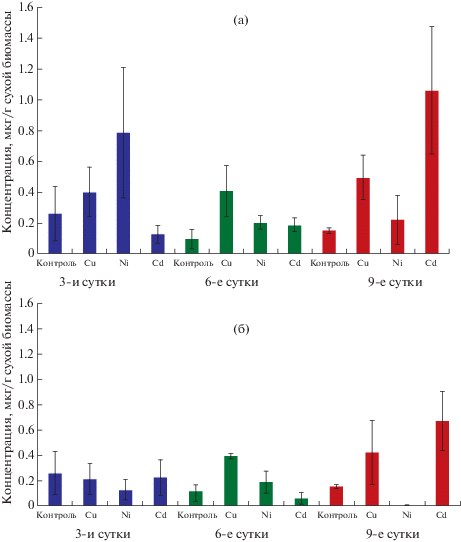
Повышенное накопление низкомолекулярных органических кислот под действием тяжелых металлов является широко распространенным явлением, характерным для растений (Xie et al., 2014; Osmolovskaya et al., 2018). Способность кислот, таких как цитрат, малат, оксалат, малонат, аконитат и тартарат образовывать прочные связи с ионами тяжелых металлов приводит к их детоксикации (Anjum et al., 2015). В листьях амаранта Amarantus cruentus и A. caudatus наблюдается индуцируемое кадмием повышение содержания малата, цитрата и оксалата. Содержание сукцината возрастет только у A. cruentus, и, напротив, снижается у A. caudatus (66Osmolovskaya et al., 2019). Результаты нашего эксперимента свидетельствуют об изменении содержания только кислот в свободной форме и не позволяют сделать выводы о роли кислот в детоксикации металлов. Тем не менее, наблюдаемые изменения концентрации сукцината под действием меди и кадмия указывают на специфическое влияние этих металлов на углеродный метаболизм P. sylvestris.
Начиная с 6-х суток под действием металлов в растениях происходило накопление аминокислоты пролин. Cd и Cu способствовали увеличению содержания пролина в концентрации 5 мМ, а Ni – в концентрации 1 мМ (рис. 7). Повышение уровня пролина в ответ на воздействие тяжелых металлов описано для многих видов растений (Balestrasse et al., 2005; Sharma, Dietz, 2006; Sun et al., 2007; Abdel-Latif, 2008), в том числе для Pinus sylvestris (Kandziora-Ciupa et al., 2016). У растений пролин составляет <5% от общего пула свободных аминокислот при нормальных условиях и 80% от общего пула аминокислот при стрессе (Kumar et al., 2010). Пролин играет важную роль в защите клеток от повреждения, вызванного АФК (Kartashov et al., 2008; Ivanov et al., 2013). Было высказано предположение, что эта аминокислота действует как акцептор радикалов или участвует в хелатировании ионов металлов (Andrade et al. 2009).
Рис. 7.
Изменение содержания пролина в растениях Pinus sylvestris под действием металлов: а – 1 мМ; б – 5 мМ.
Fig. 7. Change in the proline content in Pinus sylvestris plants under the influence of metals: а – 1 mM; б – 5 mM. Key:концентрация, мкг/г сухой биомассы – concentration, μg/g dry biomass; контроль – control; 3-и сутки – 3th day; 6-е сутки – 6th day; 9-е сутки – 9th day.

При анализе закономерностей концентрационных изменений других соединений (рис. 1) на уровне тенденций наши данные позволили выявить уменьшение содержания свободных жирных кислот (пальмитиновой, линолевой, линоленовой, стеариновой) при действии всех металлов в обеих концентрациях. Влияние тяжелых металлов затрагивает метаболизм липидов и жирных кислот (Morsy et al., 2012). Детальный же анализ изменения метаболизма липидов и жирных кислот требует специальных методологических подходов.
Под действием металлов существенно менялось содержание полиолов. Арабитол присутствовал только в контрольных образцах и в некоторых растениях, выращенных при действии Cd в концентрации 5 мМ. Содержание ононитола и мио-инозитола возрастало под действием всех металлов, но только на 9-е сутки воздействия. Увеличение содержание мио-инозитола под действием металлов описано на примере некоторых растений (Osmolovskaya et al., 2019) и, по-видимому, связано с общим нарушением углеродного обмена у растений.
Для многих других соединений, в том числе неидентифицированных, не прослеживалось четких закономерностей концентрационных изменений под действием тяжелых металлов.
Изменения в метаболизме растений непосредственно связаны с поступлением и накоплением металлов в растениях (табл. 2). При концентрации металлов 5 мМ динамика их накопления была различна. Наиболее резкое увеличение концентрации Cd и Cu в вегетативной части растений наблюдается на 6-й день после внесения металлов: количество Cu возрастает более чем в 5 раз, а Cd в 20 раз по сравнению с 3-ми сутками. На 9-е сутки концентрация Cu и Cd возрастает лишь в 1.5–2.5 раза по сравнению с 6-ми сутками. Ni, напротив, накапливался более интенсивно на 9-е сутки, по сравнению с 6-ми. К 9-му дню эксперимента в наименьшей концентрации накапливается Cu, а в наибольшей Cd.
Таблица 2.
Содержание тяжелых металлов в сеянцах Pinus sylvestris, мг/кг сухой массы Table 2. Content of heavy metals in Pinus sylvestris seedlings, mg/kg dry weight
| Вариант опыта/ Experiment variant | День экспозиции / Exposition day | ||
|---|---|---|---|
| 3 | 6 | 9 | |
| Ni | |||
| Контроль/control | 1.95 ± 0.08 | 3.31 ± 0.16 | 3.41 ± 0.19 |
| Ni 1 mМ | 18.5 ± 0.51 | 72.2 ± 1.8 | 96.5 ± 2.89 |
| Ni 5 mМ | 190 ± 5.72 | 558 ± 13.9 | 3168 ± 110 |
| Cu | |||
| Контроль/control | 5.26 ± 0.05 | 4.90 ± 0.09 | 5.25 ± 1.10 |
| Cu 1 mМ | 6.26 ± 0.25 | 12.9 ± 0.51 | 25.5 ± 0.52 |
| Cu 5 mМ | 170 ± 0.52 | 1058 ± 31.1 | 1879 ± 56.3 |
| Cd | |||
| Контроль/control | <0.05 | <0.05 | <0.05 |
| Cd 1 mМ | 4.32 ± 0.04 | 30.2 ± 0.60 | 60.5 ± 12.2 |
| Cd 5 mМ | 80.4 ± 16.1 | 1827 ± 54.8 | 3911 ± 83.4 |
При внесении металлов в концентрации 1 мМ их поступление в ткани растения происходит более равномерно и в значительно меньших количествах. При данной концентрации наиболее интенсивно в вегетативную часть растения поступает Ni, а наименее интенсивно Cu.
Полученные результаты показывают, что ГХ-МС анализ с последующей обработкой метаболитной матрицы методами мультивариантной статистики позволяет выявить значительную часть метаболомных изменений, происходящих под действием тяжелых металлов. Визуализированные динамические изменения метаболома растений обусловлены в основном не изменениями метаболизма отдельных веществ, а являются проявлением изменения корреляционной структуры метаболитной сети. Формирование ответных реакций на уровне метаболома заметно на 6‑е сутки после воздействия металлов, как в высокой, так и в низкой концентрации и, по-видимому, не имеет прямой зависимости с количеством поступивших в растение металлов. Визуальные же симптомы токсичности появились на 10–12 день. Таким образом, метаболомный анализ позволяет зафиксировать биохимические изменения, возникающие на 4–6 дней раньше, чем визуальные симптомы токсичности. При этом контрольная группа растений обособляется раньше, а специфическое влияние отдельных металлов на метаболом растений заметно только на 9-е сутки. Первичные изменения метаболома под действием металлов являются скорее общими реакциями на стрессовое воздействие, а далее имеют место адаптивные изменения метаболизма в ответ на конкретные стрессовые факторы.
По-видимому, действие металлов затрагивает сходные пути метаболизма, что проявляется в общих закономерностях изменения концентраций определенных метаболитов. Тем не менее, следует отметить некоторую специфичность метаболомного ответа у растений в условиях токсического влияния отдельных тяжелых металлов. Влияние Cu и Cd проявлялось сходным образом на изменение концентраций хинной кислоты, шикимовой кислоты, янтарной кислоты и пролина, а влияние Ni заметно отличалось. Динамика поступления Ni в ткани растений также имела особенности: при высокой концентрации Ni медленнее поступает в ткани растения, чем Cu и Cd. Содержание Cu и Cd уже на 6-е сутки достигает значительных величин, что оказывает токсическое действие. Ni при дозе 5 мМ достигает таких концентраций только на 9-е сутки.
Сравнительный анализ дозозависимой специфичности влияния металлов показал, что, оба фактора (природа металла и его концентрация) вносят равнозначный вклад в кластеризацию метаболомов растений. Ответные же реакции растений на действие металлов, проявляющиеся в изменении концентраций отдельных метаболитов, существенно отличаются в зависимости от вносимой концентрации металлов (1 или 5 мМ). Выявленные различия могут являться косвенным свидетельством того, что при концентрации 1 мМ происходят адаптационные процессы, а при более высокой концентрации металлов – 5 мМ в растениях проявляются уже токсические реакции.
Список литературы отсутствует.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


