Ботанический журнал, 2021, T. 106, № 4, стр. 363-381
СТРОЕНИЕ ГИНЕЦЕЯ И СЕМЯЗАЧАТКА У SEDUM KAMTSCHATICUM И SEDUM PALMERI (CRASSULACEAE)
Г. М. Анисимова 1, *, И. И. Шамров 1, 2, **
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, Наб. р. Мойки, 48, Россия
* E-mail: galina0353@mail.ru
** E-mail: ivan.shamrov@gmail.com
Поступила в редакцию 08.10.2020
После доработки 05.11.2020
Принята к публикации 10.11.2020
Аннотация
Впервые изучено развитие и строение гинецея, семязачатка, мегаспорогенез и формирование зародышевого мешка у Sedum kamtschaticum и S. palmeri (Crassulaceae). Полимерно-апокарпный гинецей обычно состоит из 5 плодолистиков. В основании завязи формируется 5-гнездный синкарпный фрагмент: синасцидатная и закрытая симпликатная зоны. На большем протяжении гинецея сохраняются признаки апокарпии (пликатная и апликатная зоны). Отмечены отклонения в строении гинецея и цветка в целом: 4-членные у S. palmeri и 6-членные у S. kamtschaticum.
Инициации семязачатка предшествуют периклинальные деления в субэпидерме плаценты. Семязачаток крассинуцеллятный, битегмальный, фуникулярный, мезохалазальный, с гипостазой. Археспорий обычно 1-клеточный, тетрада мегаспор линейная, зародышевый мешок развивается по Polygonum-типу.
Полученные данные согласуются с молекулярно-генетическими исследованиями, согласно которым изученные виды относятся к разным кладам рода Sedum. В пользу этого свидетельствуют различия в строении слоев стенки микроспорангия (эпидермы, эндотеция и тапетума) (Anisimova, 2020). Среди признаков строения гинецея и семязачатка необходимо отметить следующие черты различия: у S. kamtschaticum – наряду с 5-членными обнаружены 6-членные цветки, отложение танинов происходит в клетках как наружной, так и внутренней эпидермы плодолистиков, число семязачатков в рядах на плаценте составляет 3–5, семязачатки геми-кампилотропные, с 6–7-слойным нуцеллярным колпачком клювовидного типа; у S. palmeri – наряду с 5-членными выявлены 4-членные цветки, отложение танинов происходит только в клетках наружной эпидермы плодолистиков, число семязачатков в рядах на плаценте составляет 10–12, семязачатки гипертропные, с 2–3-слойным нуцеллярным колпачком клювовидного типа.
В эмбриологических сводках характеристика сем. Crassulaceae базируется преимущественно на сведениях по представителям таких родов, как Sedum, Rhodiola, Sempervivum и др. Одним из наиболее крупных родов этого семейства является род Sedum L. По оценкам разных исследователей количество видов, входящих в этот род, не однозначно и составляет от 100 до 600 (список литературы см. Anisimova, 2020).
Сравнительно-эмбриологические и морфолого-анатомические исследования позволяют оценить значимость ряда признаков при решении некоторых спорных вопросов систематики и филогении. Однако эмбриологически многие виды сем. Crassulaceae изучены еще недостаточно (Nikiticheva, 1985; Kamelina, 2009). Ранее детально были рассмотрены морфогенез андроцея, микроспорогенез, развитие и строение стенки пыльника и пыльцевого зерна у Kalanchoe nyikae Engl. (Anisimova, 2016), а также у Sedum kamtschaticum Fisch. и S. palmeri S. Watson (Anisimova, 2020). Подробно также было исследовано развитие и строение гинецея, семязачатка, мегаспорогенез и формирование зародышевого мешка у Kalanchoe laxiflora Baker и K. tubiflora (Harv.) Raym.-Hamet (Anisimova, Shamrov, 2018).
Как уже было отмечено, эмбриологическая характеристика сем. Crassulaceae основана преимущественно на сведениях по представителям некоторых родов, одним из которых является Sedum. Молекулярные данные убедительно продемонстрировали полифилетическую природу этого рода с распределением видов между четырьмя основными кладами филогенетического древа толстянковых (Goncharova, Goncharov, 2009; Mort et al., 2010; Nikulin, Goncharov, 2017). Также молекулярно-генетический анализ показал место рода Sedum в верхушечной кладе древа толстянковых, классифицируемой как подсемейство Sempervivoideae (Thiede, Eggli, 2007). Большинство видов Sedum относятся к трибе Sedeae и расположены между кластером Leucosedum и кладой Acre (в последнюю помещен S. palmeri) (Nikulin, 2017). S. kamtschaticum (=Phedicus kamtschaticus (Fisch.) t’Hart) был отнесен к другой кладе Telephium (Ham, 1995). Как было показано при изучении пыльника, различия между этими видами касаются, главным образом, временных характеристик специализации клеток стенки микроспорангия (строения эпидермы, эндотеция и тапетума) (Anisimova, 2020). При анализе развития и строения семязачатка информация о динамике его структур часто оказывается неполной – обычно указывается тип археспория, число слоев париетальной ткани, типы мегаспорогенеза и развития зародышевого мешка (Rombach, 1911; Mauritzon, 1930, 1933; Schnarf, 1931; Subramanyam, 1962, 1970; Nikiticheva, 1985; Kamelina, 2009).
Все вышесказанное стало причиной проведения детального изучения морфогенеза гинецея и семязачатка у двух представителей рода Sedum – S. kamtschaticum и S. palmeri. Родиной S. kamtscha-ticum является Дальний Восток. В естественных условиях вид распространен в Приморском крае, на Камчатке, Сахалине, а также в Японии, Корее и Восточном Китае. S. palmeri, родиной которого является, Мексика, растет в горах Сьерра-Мадре на высоте около 800 м над ур. м.
МАТЕРИАЛ И МЕТОДИКА
Для исследования были выбраны два вида Sedum из сем. Crassulaceae – S. kamtschaticum Fisch. (= Phedicus kamtschaticus (Fisch.) t’Hart) (очиток камчатский) и S. palmeri S. Watson (очиток Пальмера).
Материалом для изучения послужили растения коллекции Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН. Изученные виды различаются условиями произрастания. S. kamtschaticum произрастает в открытом грунте, а S. palmeri – в условиях оранжереи. Бутоны и цветки на разных стадиях развития фиксировали в смеси FAA (70° этиловый спирт, 40% формалин, ледяная уксусная кислота в пропорции 100 : 7 : 7). Затем проводили инфильтрацию парафином. Срезы толщиной 10–12 мкм окрашивали фуксин-сернистой кислотой по Фельгену (ядра клеток) с подкраской гематоксилином по Эрлиху (цитоплазма) и алциановым синим (клеточные стенки), сафранином по Картису, генцианвиолетом по Ньютону с подкраской оранжем “G” в гвоздичном масле, крахмал определяли с помощью спиртового раствора йода и йодистого калия (Pausheva, 1974).
РЕЗУЛЬТАТЫ
Гинецей, завязь, плацентация. Цветок у изученных видов Sedum, как правило, 5-мерный, обоеполый, актиноморфный, с двойным околоцветником. Андроцей из 10 тычинок (2 круга). Полимерно-апокарпный гинецей состоит из 5 плодолистиков, завязь верхняя. Гинецей хорошо дифференцирован на удлиненно-овальную завязь, длинные стилодии, завершающиеся рыльцами, покрытыми папилловидными клетками. В основании гинецея формируются 5 чешуевидных нектарников. На самых ранних стадиях гинецей срастается в основании с окружающими органами цветка.
В основании завязи формируется 5-гнездный синкарпный фрагмент: синасцидатная (стерильная) и закрытая симпликатная зоны (рис. 1, 2, 3; 2, 1, 2; 3, 1; 4, 1–3). На большем протяжении гинецея сохраняются признаки апокарпии (пликатная и апликатная области) (рис. 1, 4–6; 2, 3, 4; 3, 2–4; 4, 4–6). Гинецею изученных видов присуща центрально-осевая иннервация. Из стелы цветоножки ответвляются пучки в околоцветник, тычинки и гинецей (рис. 1, 1). Васкулярное снабжение гинецея обеспечивается двумя группами пучков: периферическими (дорсальными) и центральными (вентральными). Вентральные проводящие пучки оканчиваются в верхней части, а дорсальные проходят по всей длине гинецея, включая стилодии.
Рис. 1.
Строение гинецея Sedum kamtschaticum во время формирования примордиев семязачатков на плаценте (поперечные срезы).
1 – цветоложе, комплекс проводящих пучков, отходящих в элементы цветка; 2–5 – завязь: 2 – синасцидиатная стерильная зона; 3 – симпликатная зона, смыкание боковых поверхностей смежных плодолистиков в центре, а также апикальных частей синкарпных сутур и образование щели в центре; 4, 5 – пликатная зона, плодолистики разобщены (4, 5) и лишь гетерокарпеллятные вентральные края частично смыкаются (4), семязачатки перестают формироваться вследствие стерилизации плацент (5); 6 – переход завязи каждого плодолистика в стилодий (апликатная зона). Масштабные линейки, мкм: 1, 3–5 – 100, 2, 6 – 50.
Fig. 1. Gynoecium structure during ovular primordia formation on placenta in Sedum kamtschaticum (cross sections).
1 – receptacle with a complex of vascular bundles extending into different elements of the flower; 2–5 – ovary: 2 – synascidiate sterile zone; 3 – symplicate zone, joining of lateral surfaces of adjacent carpels, apical parts of syncarpous sutures and glottis formation in the centre; 4, 5 – plicate zone, carpels break up (4, 5) and only heterocarpellary ventral borders are partly joined (4), ovules stop forming due to sterilization of the placenta (5); 6 – passage of ovary of each carpel into stylodium (aplicate zone). Scale bars, µm: 1, 3–5 – 100, 2, 6 – 50.
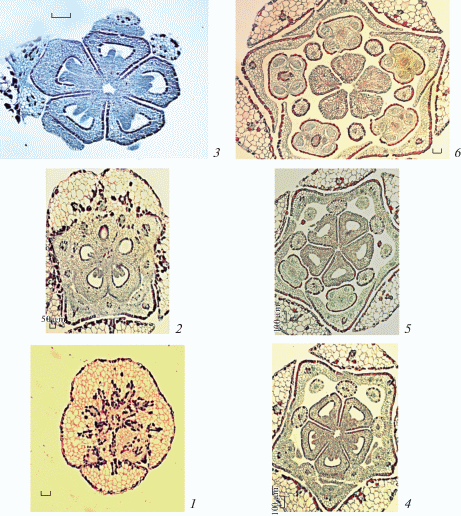
Рис. 2.
Строение гинецея Sedum palmeri во время формирования примордиев семязачатков на плаценте (поперечные срезы).
1 – синасцидиатная зона; 2 – симпликатная зона, смыкание боковых поверхностей смежных плодолистиков в центре, а также апикальных частей синкарпных сутур и образование щели в центре; 3 – пликатная зона, плодолистики разобщены, семязачатки перестают формироваться вследствие стерилизации плацент; 4 – переход завязи каждого плодолистика в стилодий (апликатная зона). Масштабные линейки, мкм: 1, 2 – 100, 3, 4 – 20.
Fig. 2. Gynoecium structure during ovular primordia formation on placenta in Sedum palmeri (cross sections).
1 – synascidiate zone; 2 – symplicate zone, joining of lateral surfaces of adjacent carpels, apical parts of syncarpous sutures and glottis formation in the centre; 3 – plicate zone, carpels break up, ovules stop forming due to sterilization of the placenta; 4 – passage of ovary of each carpel into stylodium (aplicate zone). Scale bars, µm: 1, 2 – 100, 3, 4 – 20.
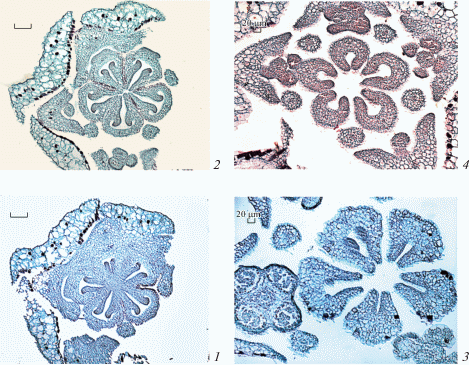
Рис. 3.
Строение гинецея Sedum kamtschaticum во время формирования семязачатков на стадии мегаспорогенеза (поперечные срезы).
1 – синасцидиатная зона; 2, 3 – пликатная зона, плодолистики разобщены: фертильная (2) и стерильная в дистальной области завязи (3); 4 – переход завязи каждого плодолистика в стилодий (апликатная зона). Масштабные линейки, мкм: 100.
Fig. 3. Gynoecium structure during ovule formation at megasporogenesis stage in Sedum kamtschaticum (cross sections).
1 – synascidiate zone; 2, 3 – plicate zone, carpels break up: fertile (2) and sterile in the distal region of the ovary (3); 4 – passage of ovary of each carpel into stylodium (aplicate zone). Scale bars, µm: 100.
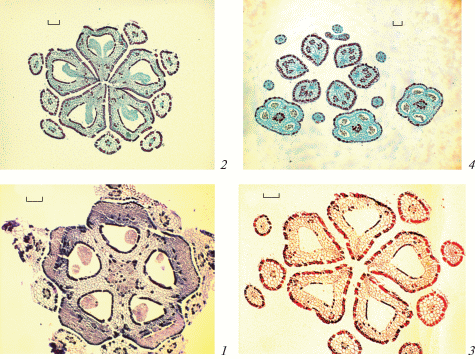
Рис. 4.
Строение гинецея Sedum palmeri во время формирования семязачатков на стадии мегаспорогенеза (поперечные срезы).
1, 2 – синасцидиатная зона; 3 – симпликатная зона, смыкание боковых поверхностей смежных плодолистиков в центре, а также апикальных частей синкарпных сутур и образование щели в центре; 4, 5 – пликатная зона, плодолистики разобщены: фертильная (4) и стерильная в дистальной области завязи (5); 6 – рыльца (апликатная зона). Масштабные линейки, мкм: 1–4, 6 – 100, 5 – 50.
Fig. 4. Gynoecium structure during ovule formation at megasporogenesis stage in Sedum palmeri (cross sections).
1, 2 – synascidiate zone; 3 – symplicate zone, joining of lateral surfaces of adjacent carpels, apical parts of syncarpous sutures and glottis formation in the centre; 4, 5 – plicate zone, carpels break up: fertile (4) and sterile in the distal region of the ovary (5); 6 – stigmata (aplicate zone). Scale bars, µm: 1–4, 6 – 100, 5 – 50.
Клетки наружной эпидермы каждого плодолистика, начиная с заложения семязачатков на плаценте, постепенно заполняются танинами (рис. 1, 2–6; 2, 1–4; 3, 1–4; 4, 1–6). У S. kamtschaticum отложение танинов происходит и в клетках внутренней эпидермы, за исключением плацент с семязачатками и вентральных краев каждого плодолистика (рис. 1, 2–4; 6, 1–4). В стерильной синасцидиатной области гинецея этого вида танины аккумулируются во всех клетках внутренней эпидермы, выстилающих гнезда завязи (рис. 1, 2; 3, 1).
Плацентация сутуральная. В основании гинецея она представлена центральной синплацентой, которая маркирует короткую синасцидиатную зону. В симпликатной зоне плацентация становится центрально-угловой. На большем протяжении завязи выявляется простая угловая плацентация. Семязачатки располагаются в виде 2 рядов на плацентах с вентральной стороны каждого плодолистика. Число семязачатков в рядах составляет 3–5 у S. kamtschaticum и 10–12 у S. palmeri (рис. 6, 4, 8).
У обоих видов отмечены отклонения в строении гинецея и цветка в целом: 6-членные у S. kamtschaticum и 4-членные у S. palmeri. В 6-членных цветках 6-членным был не только гинецей (полимерно-апокарпный из 6 плодолистиков), но андроцей, состоящий из 12 тычинок, расположенных в 2 кругах (рис. 5, 1–3), при этом наблюдались случаи объединения двух смежных плодолистиков в верхней части завязи (рис. 5, 2, 3). В 4-членных цветках 4-членными были не только гинецей, но и андроцей (рис. 5, 5). В отдельных случаях гинецей был 4-членным, но андроцей и околоцветник оставались 5-членными (рис. 5, 4). Иногда при 5-членных андроцее и околоцветнике в гинецее формировались 4 фертильных и один короткий стерильный плодолистики (рис. 5, 6).
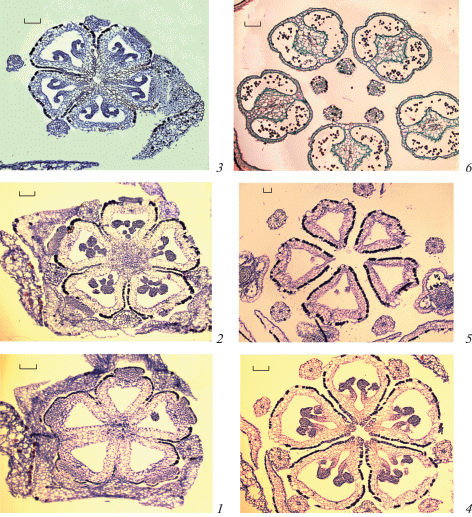
Рис. 5.
Отклонения в строении гинецея у Sedum kamtschaticum (1–3) и S. palmeri (4–6) (поперечные срезы).
1 – 6-гнездная завязь (синасцидиатная зона); 2, 3 – 6 свободных плодолистов (верхняя часть завязей), 2 смежных плодолистика объединяются в один; 4 – 4-мерный гинецей из свободных плодолистиков (верхняя часть завязей – пликатная зона), венчик и андроцей (2 круга) – 5-мерные; 5 – 4-мерный гинецей из свободных плодолистиков (средняя часть завязей – пликатная зона), андроцей тоже 4-мерный; 6 – 4-гнездная завязь (синасцидиатная зона), виден дополнительный стерильный короткий плодолистик. Масштабные линейки, мкм: 100.
Fig. 5. Aberrations in the gynoecium structure in Sedum kamtschaticum (1–3) and S. palmeri (4–6) (cross sections).
1 – 6-loculate ovary (synascidiate zone); 2, 3 – 6 free carpels (upper portions of the ovaries), two adjacent carpels combined into one; 4 – 4-merous gynoecium consisting of free carpels (upper portions of the ovaries – plicate zone), corolla and androecium (two circles) are 5-merous; 5 – 4-merous gynoecium consisting of free carpels (middle portions of the ovaries – plicate zone), androecium is also 4-merous; 6 – 4-loculate ovary (synascidiate zone), additional sterile short carpel is visible. Scale bars, µm: 100.
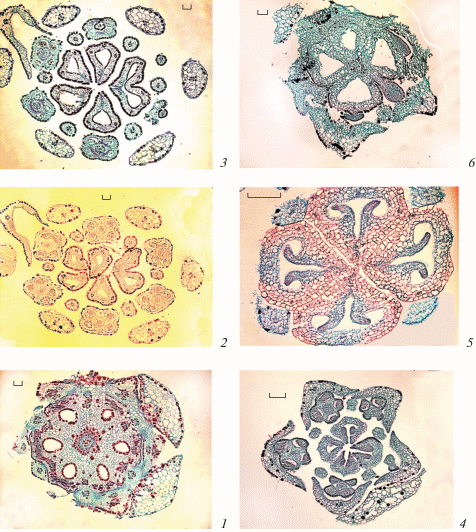
Рис. 6.
Строение семязачатка у Sedum kamtschaticum (1–4) и S. palmeri (5–8) (1–3, 5–7 – поперечные и 4, 8 – продольные срезы).
1 – первые стадии формирования интегументов, в нуцеллусе мегаспороцит и 2 париетальные клетки; 2 – многослойный нуцеллярный колпачок; 3 – антирафальная область семязачатка на уровне антипод зародышевого мешка, видны нуцеллус и оба интегумента; 4 – положение семязачатков в завязи перед опылением; 5, 6 – заложение семязачатка в плаценте (стрелка); 7 – примордий семязачатка, видны осевой ряд клеток и периклинальные деления в субэпидермальном слое; 8 – положение семязачатков в завязи перед опылением. a – антиподы, acr – осевой ряд клеток, ec – эпидермальные клетки, ii – внутренний интегумент, n – нуцеллус, nc – нуцеллярный колпачок, nlc – клетки латеральной зоны нуцеллуса, oi – наружный интегумент, ov – семязачаток. Масштабные линейки, мкм: 1 – 20, 2, 3, 5–7 – 10, 4 – 100, 8 – 50.
Fig. 6. Ovule structure in Sedum kamtschaticum (1–4) and S. palmeri (5–8) (1–3, 5–7 – cross sections and 4, 8 – longitudinal sections).
1 – first stages of integument formation, in the nucellus there are megasporocyte and two parietal cells; 2 – many-layered nucellar cap; 3 – antiraphal region of the ovule on the level of antipodes of embryo sac, nucellus and both integuments are visible; 4 – position of ovules in the ovary before pollination; 5, 6 – the laying of the ovule in the placenta (arrow); 7 – ovular primordium, axial row of cells and periclinal divisions in the subepidermal layer are seen; 8 – position of ovules in the ovary before pollination. a – antipodes, acr – axial cell row, ii – inner integument, n – nucellus, nc – nucellar cap, nlc – cells of nucellus lateral zone, oi – outer integument, ov – ovule. Scale bars, µm: 1 – 20, 2, 3, 5–7 – 10, 4 – 100, 8 – 50.
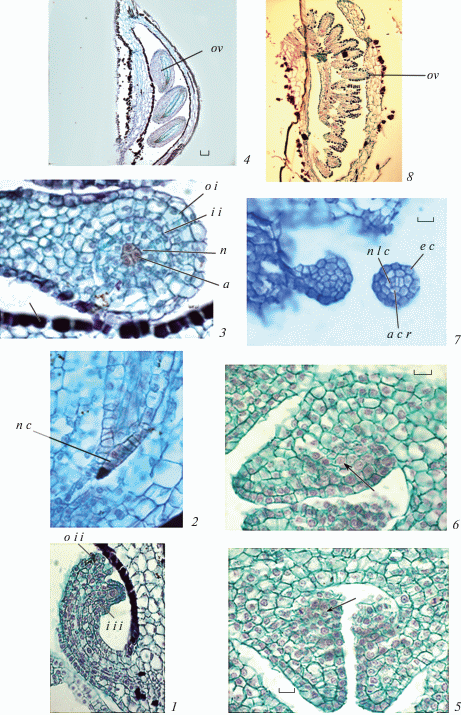
Примордий семязачатка. У видов сем. Сrassulaceae первые стадии возникновения семязачатков на плаценте ранее были изучены у Kalanchoe laxiflora и K. tubiflora (Anisimova, Shamrov, 2018). Проведенное исследование свидетельствует о том, что у изученных видов Sedum также в месте инициации семязачатка в субэпидермальном слое дифференцируются три крупные клетки, которые, как и нижележащие клетки третьего слоя плаценты, делятся периклинально (рис. 6, 5, 6). Как правило, только верхняя производная центральной субэпидермальной поделившейся клетки становится археспориальной клеткой (рис. 7, 1), а нижняя производная этой клетки (инициаль базальной области нуцеллуса) вместе с дериватами, возникшими в результате делений клеток третьего слоя плаценты, образуют центральный осевой ряд (рис. 6, 7; 7, 1). Формируется примордий семязачатка (рис. 7, 2; 8, 1). Уже с самых ранних стадий развития можно диагностировать строение нуцеллуса – именно под археспорием (в дальнейшем мегаспороцитом и зародышевым мешком) формируется базальная область нуцеллуса. Латеральные клетки, возникающие в субэпидермальном слое плаценты, становятся инициалями латеральной области нуцеллуса. Инициали делятся периклинально, образуя второй слой, который смещается непосредственно под археспориальную клетку и, таким образом, в примордии семязачатка возникают продольные ряды клеток (центральный и латеральные) разного происхождения (рис. 6, 7; 7, 2, 3; 8, 1–4).
Рис. 7.
Формирование примордия семязачатка у Sedum kamtschaticum.
1 – семязачаток, возникающий на плаценте: выделение археспориальной клетки; 2, 3 – развивающийся примордий семязачатка, выделение осевого ряда клеток, инициалей латеральной и базальной областей нуцеллуса, гипостазы и внутреннего интегумента. aс – археспориальная клетка, acr – осевой ряд клеток, hi – инициали гипостазы, iii – инициали внутреннего интегумента. Масштабные линейки, мкм: 10.
Fig. 7. Ovular primordium formation in Sedum kamtschaticum.
1 – ovule arising on placenta, singling out archesporial cell; 2, 3 – developing ovular primordium; singling out axial cell row, initials of lateral and basal regions of nucellus, hypostase and inner integument. aс – archesporial cell, acr – axial cell rows, hi – hypostase initials, iii – inner integument initials. Scale bars, µm: 10.
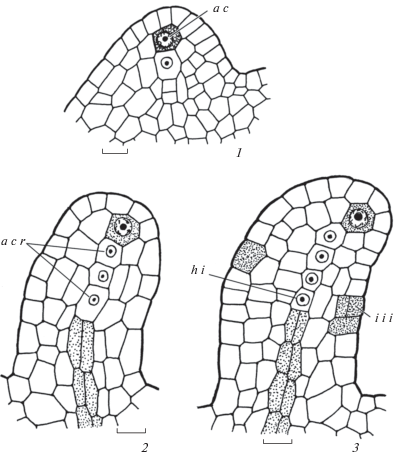
Согласно гипотезе цито-гистологической зональности (Shamrov, 2008), в сформированном примордии семязачатка изученных видов можно выделить следующие зоны: периферическую (эпидермальный слой), апикальную (дифференцирующиеся археспориальная клетка, а затем спорогенная и париетальные клетки в субэпидермальном слое примордия), латеральную (клетки субэпидермального слоя вокруг археспориальной клетки и поделившиеся инициали латеральной области нуцеллуса с образованием наружных продольных рядов под этой клеткой) и базальную (центральный продольный ряд клеток под археспориальной клеткой) (рис. 7, 2, 3; 8, 1–4; 9, 1). В ряде случаев в субэпидермальном слое примордия семязачатка S. kamtschaticum наблюдалось формирование двух археспориальных клеток, отличающихся от окружающих клеток крупными размерами и плотной цитоплазмой. После периклинальных делений над каждой формирующейся спорогенной клеткой располагалась париетальная клетка, хотя центральный осевой тяж был единым для обеих спорогенных клеток (рис. 9, 2).
Дифференциация переходной зоны примордия семязачатка (рис. 8, 5; 9, 1, 2) происходит в центробежном направлении на уровне базальной зоны нуцеллуса. Клетки этой зоны имеют двойственное происхождение: одна часть (центральная) образована производными базальной зоны, а другая – производными латеральной зоны. Переходная зона представлена одним слоем таблитчатых клеток, которые в формирующемся примордии семязачатка как бы разделяют его на две части. На уровне переходной зоны (в дальнейшем формируется гипостаза) одновременно с ее дифференциацией или чуть позже возникают интегументы, выше уровня – нуцеллус, а ниже уровня – халаза и фуникулус (рис. 8, 5; 9, 1, 2).
Рис. 8.
Формирование примордия семязачатка у Sedum palmeri.
1, 2 – развивающийся примордий семязачатка, выделение археспориальной клетки и осевого ряда клеток; 3–5 – развивающийся примордий семязачатка, выделение спорогенной клетки (мегаспороцита), париетальных клеток, инициалей латеральной и базальной областей нуцеллуса, гипостазы, наружного и внутреннего интегументов. aс – археспориальная клетка, acr – осевой ряд клеток, hi – инициали гипостазы, iii – инициали внутреннего интегумента, oii – инициали наружного интегумента, pc – париетальная клетка, sc – спорогенная клетка, vb – проводящий пучок. Масштабные линейки, мкм: 10.
Fig. 8. Ovular primordium formation in Sedum palmeri.
1, 2 – developing ovular primordium, singling out archesporial cell and axial cell row; 3–5 – developing ovular primordium, singling out sporogenous cell (megasporocyte), parietal cells, initials of lateral and basal regions of nucellus, hypostase, outer and inner integuments. aс – archesporial cell, acr – axial cell rows, hi – hypostase initials, iii – inner integument initials, oii – outer integument initials, pc – parietal cell, sc – sporogenous cell, vb – vascular bundle. Scale bars, µm: 10.
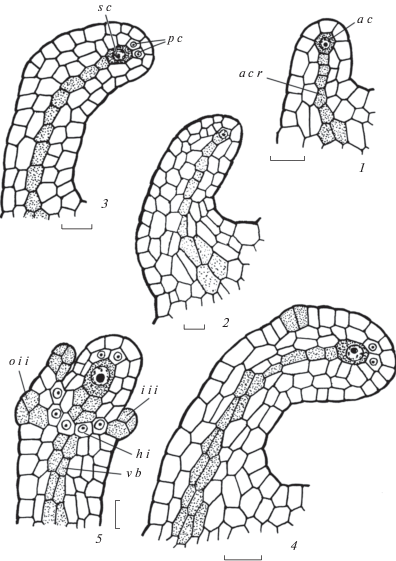
Рис. 9.
Дифференциации структур семязачатка у Sedum kamtschaticum.
Формирование интегументов за счет эпидермальных терминальных инициалей и слоя клеток гипостазы (1, 2), начало поворота семязачатка (1–3), возникновение 2 спорогенных клеток (2), 2-слойной париетальной ткани, 3-слойного наружного интегумента (3) и 2-слойного постамента (4). dc – диада клеток, h – гипостаза, hi – инициали гипостазы, ii – внутренний интегумент, iii – инициали внутреннего интегумента, ms – мегаспороцит, nc – нуцеллярный колпачок, oi – наружный интегумент, oii – инициали наружного интегумента, pc – париетальная клетка, sc – спорогенная клетка, vb – проводящий пучок. Масштабные линейки, мкм: 10.
Fig. 9. Differentiation of ovule structures in Sedum kamtschaticum.
Formation of integuments due to epidermal terminal initials and hypostase layer cells (1, 2), ovule bend beginning (1–3), arising of 2 sporogenous cells (3), 2-layered parietal tissue, 3-layered outer integument (3) and 2-layered postament (4). dc – dyad of cells, h – hypostase, hi – hypostase initials, ii – inner integument, iii – inner integument initials, ms – megasporocyte, nc – nucellar cap, oi – outer integument, oii – outer integument initials, pc – parietal cell, c – sporogenous cell, vb – vascular bundle. Scale bars, µm: 10.
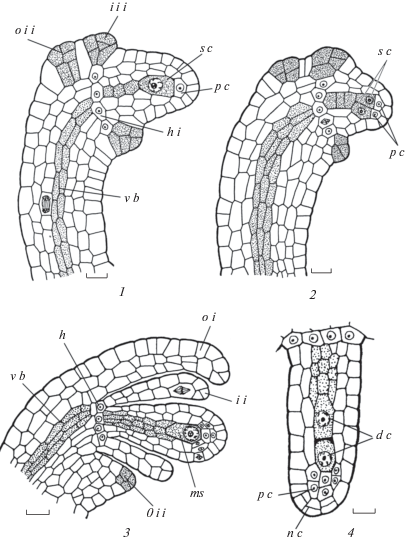
Семязачаток. Строение нуцеллуса у видов сем. Crassulaceae описывается в литературе в самых общих чертах. Чаще всего указывают, что в нем можно выделить эпидермальный и субэпидермальные слои или апикальную и базальную части, разрушающиеся в разное время.
Наше исследование показало, что в ходе развития клетки всех слоев нуцеллуса сильно вытягиваются. Эпидермальные клетки постепенно уплощаются. Несколько клеток верхушки эпидермы нуцеллуса делятся периклинально или наклонно, образуя нуцеллярный колпачок в виде клюва, выходящего в полость эндостома. Нуцеллярный колпачок представлен 2–3 слоями у S. palmeri и 6–7 слоями у S. kamtschaticum. Перед оплодотворением его клетки функционируют как передаточные и характеризуются массивными первичными полисахаридными стенками, которые образуют выросты внутрь протопластов, увеличивая поверхность плазмалеммы и играя важную роль в апопластном транспорте веществ. Эти клетки продуцируют наружу вещества полисахаридной природы и функционируют как нуцеллярный обтуратор (рис. 6, 2; 9, 4; 11, 1–4).
В нуцеллусе топографически представлены апикальная область, или париетальная ткань, которая из однослойной в ходе развития становится 2–3-слойной у обоих видов (рис. 8, 4, 5; 9, 1–4; 10, 1–4; 11, 1–4; 12, 1–4) с двумя-тремя клетками в каждом слое. В латеральной области нуцеллуса сначала имеется один инициальный слой. Как уже было отмечено, эти инициали делятся периклинально, образуя внутрь второй слой, который смещается непосредственно под археспориальную клетку в форме латеральных продольных рядов клеток. Таким образом, в нуцеллусе возникают продольные ряды клеток (центральный и наружный и внутренний латеральные) разного происхождения. Обычно клетки центрального ряда трансформируются в постамент. Однако у изученных видов клетки верхней части наружного латерального ряда, примыкающие к зародышевому мешку, разрушаются. Поэтому под зародышевым мешком формируются не один, а два слоя (центральный и внутренний латеральный) удлиненных густоплазменных клеток, которые следует рассматривать как 2-слойный постамент (рис. 7, 2, 3; 8, 2–5; 9, 1–4; 10, 1, 2; 11, 1–4; 12, 1–4). На основании генезиса и строения (один инициальный слой, латеральная область 2-слойная) развитие нуцеллуса у изученных видов относится к типовой вариации крассинуцеллятного типа (согласно классификации, предложенной Shamrov, 2008).
Семязачаток у изученных видов Sedum битегмальный, с зигзагообразным микропиле (особенно у S. kamtschaticum), образованным обоими интегументами (рис. 11, 4; 12, 3). Интегументы формируются из эпидермальных инициалей в соответствии с вариацией II дермального типа (Shamrov, 2008). Первым возникает внутренний интегумент. Заложение интегументов происходит в виде кольцевых валиков. Этому предшествуют интенсивные антиклинальные деления эпидермальных клеток с дорсальной стороны на уровне переходной зоны примордия семязачатка. Образующиеся клетки вытянуты в радиальном направлении, при этом их размеры увеличиваются. В области инициации интегументов выделяется двухслойная меристематическая зона (рис. 7, 3; 8, 4). Ее густоплазменные клетки делятся сначала наклонно или периклинально (рис. 6, 1; 7, 2; 8, 5; 9, 1, 2), при этом верхушку формирующегося интегумента всегда занимает группа терминальных инициалей. Последние делятся только наклонно в бифациальном ритме, отделяя вниз клетки, остающиеся в составе то одного, то другого слоя интегумента (рис. 8, 5; 9, 1–3; 10, 1–4; 12, 1–4). Интегументы преимущественно двухслойные (рис. 9, 3; 10, 1–3; 12, 1–4). Иногда они становятся 3-слойными в микропилярной (рис. 9, 3; 10, 4; 12, 4) или в халазальной (рис. 10, 4; 6, 1) частях за счет периклинальных делений клеток внутренней эпидермы. В некоторых случаях наблюдается слияние внутреннего и наружного интегументов с дорсальной стороны, в результате чего образуется синтетическая структура из 3–4 слоев (рис. 10, 3). При этом в латеральной области нуцеллуса происходит образование дополнительных слоев.
Рис. 10.
Формирование структур семязачатка во время мегаспорогенеза у Sedum palmeri.
Семязачаток на стадии мегаспороцита (1, 2), диады клеток (3) и тетрады мегаспор (4), поворот семязачатка превышает 180° и он из анатропного становится гипертропным. dc – диада клеток, h – гипостаза, ii – внутренний интегумент, ms – мегаспороцит, oi – наружный интегумент, oii – инициали наружного интегумента, pc – париетальная клетка, tc – танинсодержащие клетки, tmp – тетрада мегаспор, vb – проводящий пучок. Масштабные линейки, мкм: 10.
Fig. 10. Formation of ovular structures during megasporogenesis in Sedum palmeri.
Ovule at the megasporocyte stage (1, 2), dyad of cells (3) and tetrad of megaspores (4), ovule bending exceeds 180°, and it turns from anatropous to hypertropous ovule. dc – dyad of cells, h – hypostase, ii – inner integument, ms – megasporocyte, oi – outer integument, oii – outer integument initials, pc – parietal cell, tc – tannin containing cells, tmp – tetrad of megaspores, vb – vascular bundle. Scale bars, µm: 10.
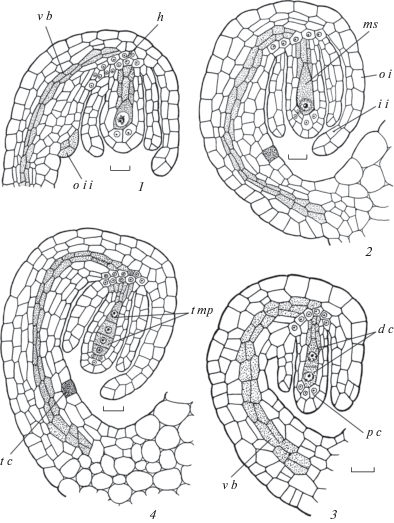
Рис. 11.
Формирование структур семязачатка во время развития зародышевого мешка у Sedum kamtschaticum.
Семязачаток на стадиях 2-ядерного (1, 1a), 4-ядерного (2), сформированного (3) и зрелого (4, 4a) зародышевого мешка; формируется 6–7-слойный нуцеллярный колпачок; семязачаток из анатропного становится геми-кампилотропным. ec – яйцеклетка, es – зародышевый мешок, h – гипостаза, ii – внутренний интегумент, m – микропиле, n – нуцеллус, nc – нуцеллярный колпачок, oi – наружный интегумент, pc – париетальная клетка, s – синергида, vb – проводящий пучок. Масштабные линейки, мкм: 1–4 – 10; 1a, 4a – 50.
Fig. 11. Formation of ovular structures during embryo sac development in Sedum kamtschaticum.
Ovule at the 2-nuclear (1, 1a), 4-nuclear (2), formed (3) and mature (4, 4a) embryo sac stages; 6–7-layered nucellar cap is formed; ovule from anatropous becomes hemi-campylotropous. ec – egg cell, es – embryo sac, h – hypostase, ii – inner integument, m – micropyle, n – nucellus, nc – nucellar cap, oi – outer integument, pc – parietal cell, s – synergid, vb – vascular bundle. Scale bars, µm: 1–4 – 10; 1a, 4a – 50.
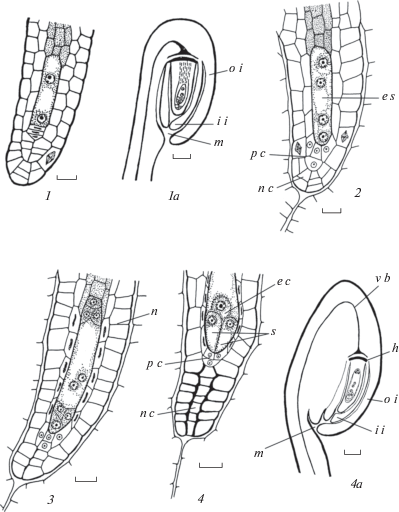
Рис. 12.
Формирование структур семязачатка во время развития зародышевого мешкау Sedum palmeri.
Семязачаток на стадиях 2-ядерного (1), 4-ядерного (2), сформированного (3) и зрелого (4) зародышевого мешка; формируется 2–3-слойный нуцеллярный колпачок. a – антиподы, ec – яйцеклетка, es – зародышевый мешок, h – гипостаза, ii – внутренний интегумент, m – микропиле, n – нуцеллус, nc – нуцеллярный колпачок, oi – наружный интегумент, pc – париетальная клетка, pvb – плацентарный проводящий пучок, s – синергида, vb – проводящий пучок. Масштабные линейки, мкм: 1–3 – 10, 4 – 20.
Fig. 12. Formation of ovular structures during embryo sac development in Sedum palmeri.
Ovule at the 2-nuclear (1), 4-nuclear (2), formed (3) and mature (4) embryo sac stages; 2–3-layered nucellar cap is formed. a – antipodes, ec – egg cell, es – embryo sac, h – hypostase, ii – inner integument, m – micropyle, n – nucellus, nc – nucellar cap, oi – outer integument, pc – parietal cell, pvb – placentary vascular bundle, s – synergid, vb – vascular bundle. Scale bars, µm: 1–3 – 10, 4 – 20.
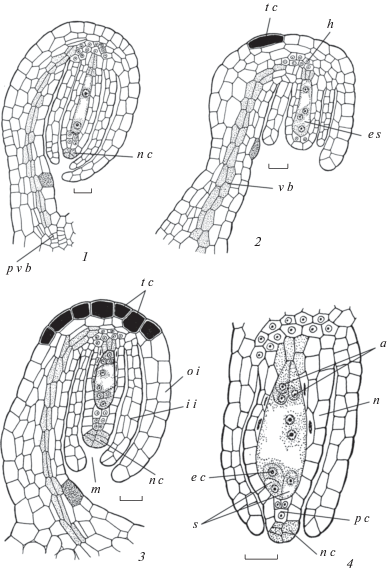
Семязачаток фуникулярный (фуникулус особенно длинный у S. palmeri – рис. 10, 1–4; 12, 1–3). Для него характерно рафе, возникающее в ходе конгенитального срастания фуникулуса и наружного интегумента с дорсальной стороны, при этом интегумент в области микропиле оказывается свободным, образуя вырост (рис. 9, 3; 10, 1). В основании внутреннего интегумента формируется 1-слойная гипостаза, которая в ходе развития становится 2-слойной (рис. 8, 5; 9, 1–3; 10, 1–4; 11, 1а, 4а; 12, 1–4).
Халаза составляет относительно небольшую часть семязачатка и может быть определена как мезохалаза (Shamrov, 2008). Проводящий пучок из фуникулуса входит в халазу в виде воронки и оканчивается вблизи гипостазы. В проводящем пучке семязачатка формируются только тяжи (2–3) прокамбиальных клеток (рис. 10, 1–4; 11, 1а, 4а; 12, 1–3).
В некоторых клетках наружной эпидермы наружного интегумента, халазы и фуникулуса происходит отложение танинов (рис. 10, 4; 12, 2, 3).
Семязачатки у обоих видов начинают формироваться как анатропные. Но уже во время мегаспорогенеза у S. palmeri за счет очень длинного фуникулуса поворот семязачатка относительно плаценты превышает 180°, что позволяет определить его морфологический тип как гипертропный (Savchenko, 1973). Он сохраняет прямую продольную ось, но микропиле обращено не к плаценте, а к фуникулусу (рис. 10, 1–4; 12, 1–3). У S. kam-tschaticum микропиле семязачатка тоже обращено в сторону фуникулуса, но при этом происходит искривление морфологической оси, и он становится геми-кампилотропным, согласно представлениям И.И. Шамрова (Shamrov, 2018) (рис. 11, 1а, 4а).
Археспорий, как правило, одноклеточный. Наблюдались случаи образования двух археспориальных, а затем и спорогенных (рис. 9, 2) клеток. Преобразование в мегаспороцит происходит с отделением париетальной клетки (рис. 8, 3–5; 9, 1–3; 10, 1, 2). Мегаспороцит, имеющий удлиненно-округлую форму, вступает в мейоз (рис. 9, 1; 10, 1, 2) и образования перегородок (сначала диада клеток) формируется линейная тетрада мегаспор (рис. 9, 4; 10, 3, 4). Зародышевый мешок развивается из халазальной (самой крупной в тетраде) мегаспоры по Polygonum-типу (рис. 11, 1–4). Перед оплодотворением он состоит из яйцеклетки и двух синергид (нитчатый аппарат выражен слабо), центральной клетки с двумя полярными ядрами и трех антипод, расположенных в форме треугольника (рис. 6, 3; 11, 4; 12, 4).
ОБСУЖДЕНИЕ
При изучении гинецея у представителей сем. Crassulaceae обычно указывают, что он является полимерно-апокарпным и состоит из 3–5 плодолистиков с верхней завязью. Плод часто образован многолистовкой. Имеются сведения, что у некоторых таксонов гинецей геми-синкарпный (Aizopsis, Rhodiola, Pseudosedum, Sedum acre) или полностью апокарпный (Hylotelephium). Некоторые представители Rhodiola имеют полунижнюю завязь (Goncharova, 2006). Однако подробных исследований по строению гинецея в разных зонах и в ходе развития крайне мало и имеются лишь фрагментарные сведения.
Ранее нами было показано, что у Kalanchoe laxiflora Baker и K. tubiflora (Harv.) Raym.-Hamet гинецей из 4 плодолистиков не является типично апокарпным. В его нижней части формируется синкарпный фрагмент: протяженная синасцидатная 4-гнездная (стерильная в проксимальной и фертильная в дистальной областях) и короткая закрытая симпликатная зоны, при этом в последней произошло полное срастание плодолистиков (Anisimova, Shamrov, 2018). Подобное строение гинецея характерно для Sedum kamtschaticum и S. palmeri (настоящее исследование). По сравнению с Kalanchoe, у видов Sedum типичный гинецей представлен 5 плодолистиками. Тем не менее, его строение в нижней части оказалось сходным при 5-гнездной завязи. Однако у Sedum синасцидиатная зона полностью стерильная, а семязачатки, которые можно видеть на поперечных срезах, относятся к симпликатной зоне. Таким образом, большая часть полимерно-апокарпного гинецея представлена пликатными и апликатными зонами в каждом плодолистике. На основе особенностей строения нижней части завязи подобный полимерно-апокарпный гинецей был описан в рамках синасцидиатной вариации. Он характерен не только для Crassulaceae, но Apocynaceae, Butomaceae, Hydrocharitaceae, Paeoniaceae, некоторых Ranunculaceae и др. (Shamrov, 2020).
У обоих видов Sedum отмечены отклонения в строении гинецея и цветка в целом: 4-членные у S. palmeri, как у видов Kalanchoe, и 6-членные у S. kamtschaticum. В 6-членных цветках 6-членным был не только гинецей, но андроцей, при этом наблюдалось объединение двух смежных плодолистиков в верхней части завязи. В 4-членных цветках 4-членными были не только гинецей, но и андроцей. В отдельных случаях при 4-членном гинецее андроцей и околоцветник оставались 5‑членными. Иногда при 5-членных андроцее и околоцветнике в гинецее формировались 4 фертильных и один короткий стерильный плодолистики.
Данные по генезису и строению примордия семязачатка у видов сем. Crassulaceae были приведены ранее только для Kalanchoe laxiflora и K. tubiflora (Anisimova, Shamrov, 2018). Результаты настоящего исследования по видам Sedum подтвердили эти сведения. Инициация семязачатка начинается с периклинальных делений клеток в субэпидермальном слое плаценты. В возникающем примордии хорошо выражена цито-гистологическая зональность (согласно представлениям Shamrov, 2008). Дифференциацию структур семязачатка запускает процесс формирования переходной зоны (в дальнейшем на ее базе возникает гипостаза). Одновременно с этим происходит выделение интегументов, выше уровня которых идентифицируется нуцеллус, а ниже – халаза и фуникулус.
У большинства изученных видов сем. Crassulaceae семязачаток анатропный, крассинуцеллятный и битегмальный. Сначала формируется внутренний, а затем наружный интегументы. Оба интегумента 2-слойные (Schnarf, 1931; Subramanyam, 1970; Mandric, Golyshkin, 1973) либо 2‒3-слойные (Bragina, 2001). У Kalanchoe laxiflora и K. tubiflora внутренний интегумент преимущественно 2-слойный и лишь в основании – 3-слойный у K. laxiflora. Наружный интегумент у обоих видов является 3-слойным (Anisimova, Shamrov, 2018). У Sedum kamtschaticum и S. palmeri (настоящее исследование) интегументы преимущественно двухслойные. Иногда они становятся 3-слойными в микропилярной или халазальной частях за счет периклинальных делений клеток внутренней эпидермы. В некоторых случаях наблюдается слияние интегументов с дорсальной стороны, в результате чего образуется синтетическая структура из 3–4 слоев.
В сем. Crassulaceae выделяют типы нуцеллуса в зависимости от числа париетальных клеток, характера их деления (поперечно или продольно относительно мегаспороцита) и наличия числа слоев в латеральной области (Mauritzon, 1930, 1933). Обычно клетки париетальной ткани начинают разрушаться во время развития зародышевого мешка. В ее строении выявлены различия. У Rhodiola rosea L. (= Sedum roseum (L.) Scop.), S. maximum (L.) Suter, S. hispanicum L. Sempervivum hirtum L., S. thomayeri Correvon париетальная ткань 1-слойная, представлена 1–3 клетками (Mandric, Golyshkin, 1973; Nikiticheva, 1985). Она может состоять из 2 слоев, в каждом из которых 2 у Kalanchoe tubiflora (Anisimova, Shamrov, 2018) или 3 у K. faustii Font Quer (Nikiticheva, 1985) клетки. У Kalanchoe crenata (Andrews) Haw. (Rombach, 1911) и K. laxiflora (Anisimova, Shamrov, 2018) париетальная ткань расположена в 4 слоя по 2 клетки в каждом. 4-слойная ткань обнаружена у видов Sempervivum, правда, без указания числа клеток в слоях (Jakobsson-Stiasny, 1913). У Kalanchoe pinnata и K. daigremontiana (Bragina, 2001) париетальная ткань образует осевой ряд над мегаспороцитом, состоящий из 3–4 этажей, при этом в каждом этаже имеется только по одной клетке. У Sedum kamtschaticum и S. palmeri париетальная ткань является 2–3-слойной с двумя-тремя клетками в каждом слое (настоящее исследование).
У ряда видов формируется нуцеллярный колпачок в виде клюва, состоящий из 2, как, например, у Kalanchoe faustii (Nikiticheva, 1985), Sedum hispanicum (Brzezicka Kozieradzka-Kiszkurno, 2018) или из 2–3 слоев у K. laxiflora и K. tubiflora (Anisimova, Shamrov, 2018). Его клетки либо клетки эпидермы нуцеллуса в микропилярной части имеют сильно утолщенные наружные и радиальные стенки, при этом ряд авторов (Subramanyam, 1967; Nikiticheva, 1985; Bragina, 2001) считают, что нуцеллярный колпачок преобразуется в дальнейшем в эпистазу. Детальное исследование, проведенное нами, показало, что нуцеллярный колпачок представлен 2–3 слоями у Sedum palmeri и 6–7 слоями у S. kamtschaticum. Перед оплодотворением его клетки приобретают признаки передаточных клеток и характеризуются массивными первичными полисахаридными стенками, которые образуют выросты внутрь протопластов, увеличивая поверхность плазмалеммы и играя важную роль в апопластном транспорте веществ. Эти клетки продуцируют наружу вещества полисахаридной природы и функционируют как нуцеллярный обтуратор. Эта особенность строения нуцеллярного колпачка коррелирует с морфологическим типом семязачатка (подробнее ниже).
В нуцеллусе обычно не описывают процессы дифференциации тканей. У Kalanchoe crenata под зародышевым мешком отмечены 3–5 тяжей удлиненных клеток и формирование 2-слойной латеральной области на уровне антипод (Rombach, 1911). Проведенное нами исследование показало, что в нуцеллусе дифференцируется 3-слойный постамент и 2-слойный подиум у K. laxiflora и K. tubiflora (Anisimova, Shamrov, 2018), а у Sedum palmeri и S. kamtschaticum только 2-слойный постамент (настоящее исследование).
Наличие гипостазы в основании внутреннего интегумента отмечалось только в одном исследовании (Bragina, 2001). По мнению этого автора, гипостаза 1-слойная. У изученных нами видов она сначала 1-слойная, а затем в ходе развития становится 2-слойной. Гипостаза представлена таблитчатыми тонкостенными клетками с плотной цитоплазмой.
Для Sedum palmeri и S. kamtschaticum характерны некоторые специфические черты в развитии и строении семязачатков, что особенно проявилось в становлении их морфологических типов. Выше уже было отмечено, что у большинства видов сем. Crassulaceae описаны анатропные семязачатки. У обоих изученных нами видов они тоже начинают развиваться как анатропные с прямой продольной морфологической осью. Формально семязачаток у S. palmeri остается и далее анатропным. Однако, в связи с особенностями оплодотворения некоторые его структуры приобрели специфические черты, не свойственные анатропным семязачаткам. У этого вида уже во время мегаспорогенеза за счет очень длинного фуникулуса поворот семязачатка относительно плаценты превышает 180°, что характерно для цирцинотропных (закрученных) семязачатков, одним типом из которых является гипертропный (он сохраняет прямую продольную ось как в анатропном семязачатке, но микропиле обращено не к плаценте, а к фуникулусу). У S. kamtschaticum микропиле семязачатка тоже обращено в сторону фуникулуса, но при этом происходит искривление морфологической оси, и он становится геми-кампилотропным. Возникновение гипертропного и геми-кампилотропного семязачатков коррелирует с образованием у этих видов нуцеллярного клюва, особенно длинного у S. kamtschaticum, функционирующего в качестве обтуратора. У изученных видов не формируются другие типы обтуратора (фуникулярные, плацентарные, париетальные). К этому следует добавить, что у S. kamtschaticum почти все клетки внутренней эпидермы стенки плодолистиков заполнены танинами.
Что касается собственно эмбриональных структур, то их развитие происходит довольно сходно. Археспорий часто 1-клеточный или 1–2-клеточный, хотя у Crassula nemorosa (Eckl. et Zeyh.) Endl., Sedum sempervivoides Fisch. ex M. Bieb. и S. chrysanthum (Boiss. et Heldr. ex Boiss.) Raym.-Hamet обнаружено от 2 до 4–5 археспориальных клеток (Mauritzon, 1930, 1933; Subramanyam, 1967). Мегаспорогенез завершается образованием преимущественно линейной тетрады. Отмечены также изобилатеральная и Т-образная тетрады (Subramanyam, 1970). Зародышевый мешок развивается из халазальной мегаспоры преимущественно по Polygonum-типу. У Sedum fabaria W.D.J. Koch (= Sedum telephium L.) и S. populifolium Pall. var. notarjanni обнаружен Аllium-тип развития (Subramanyam, 1967; Wojciechowicz, Samardakiewicz, 1998). Строение элементов зародышевого мешка типичное, хотя у S. sempervivoides синергиды образуют гаустории. Обычно небольшие антиподы становятся крупными у S. fabaria и развивают также гаустории. Иногда они делятся, формируя зародышеподобные структуры (Subramanyam, 1967; Wojciechowicz, Samardakiewicz, 1998). У Sedum ternatum в клетках зародышевого мешка, особенно в синергидах и яйцеклетке, накапливается крахмал (Subramanyam, 1963). У Sedum hispanicum выявлено наличие белков, липидов и нерастворимых полисахаридов в различных клетках женского гаметофита (Brzezicka, Kozieradzka-Kiszkurno, 2018).
Филогенетическая структура Sedum и близких ему таксонов остается слабо изученной. Проведен анализ филогенетической структуры триб Aeonieae, Semperviveae и Sedaeae, в состав которых входят виды Sedum, на основании сравнения 102 последовательностей гена matK хлоропластной ДНК. Полученные данные подтвердили результаты предыдущих исследований, основанных на других маркерах (Nikulin, Goncharov, 2017). Большинство видов Sedum относятся к трибе Sedeae, находясь между кластером Leucosedum и кладой Acre (в последнюю помещен S. palmeri) (Nikulin, 2017). S. kamtschaticum (=Phedicus kamtschaticus (Fisch.) t’Hart) был отнесен к другой кладе Telephium (Ham, 1995). Ранее при изучении пыльника было показано, что различия между этими видами касаются, главным образом, временных характеристик специализации клеток стенки микроспорангия (строения эпидермы, эндотеция и тапетума). Весь протопласт эпидермальных клеток у S. kamtschaticum заполнен танинами, у S. palmeri танины выявляются в виде отдельных глобул. У S. kamtschaticum специализация клеток эндотеция становится заметной после стадии тетрад микроспор, тогда как у S. palmeri – лишь в период созревания пыльцевых зерен. Несмотря на то, что тапетум у обоих видов клеточный секреторный, особенности его реорганизации в постмейотический период различаются: у S. kam-tschaticum происходит реорганизация в амебоидный, а у S. palmeri тапетум развивается без реорганизации (Anisimova, 2020). Среди признаков строения гинецея и семязачатка следует отметить следующие черты различия: у S. kamtschaticum – наряду с 5-членными обнаружены 6-членные цветки, отложение танинов происходит в клетках как наружной, так и внутренней эпидермы плодолистиков, число семязачатков в рядах на плаценте составляет 3–5, семязачатки геми-кампилотропные, с 6–7-слойным нуцеллярным колпачком в виде клюва; у S. palmeri – наряду с 5‑членными выявлены 4-членные цветки, отложение танинов происходит только в клетках наружной эпидермы плодолистиков, число семязачатков в рядах на плаценте составляет 10–12, семязачатки гипертропные, с 2–3-слойным нуцеллярным колпачком в виде клюва.
Список литературы
[Anisimova] Анисимова Г.М. 2016. Строение пыльника, микроспорогенез и пыльцевое зерно у Kalanchoe nyikae (Crassulaceae). – Бот. журн. 101 (12): 1378–1389.
[Anisimova] Анисимова Г.М. 2020. Развитие и строение пыльника Sedum kamtschaticum и Sedum palmeri (Crassulaceae). – Бот. журн. 105 (11): 1093–1110. https://doi.org/10.31857/S0006813620090021
[Anisimova, Shamrov] Анисимова Г.М., Шамров И.И. 2018. Морфогенез гинецея и семязачатка у Kalanchoe laxiflora и K. tubiflora (Crassulaceae). – Бот. журн. 103 (6): 675–694. https://doi.org/10.1134/S0006813618060017
[Bragina] Брагина Е.А. 2001. Репродуктивная биология живородящих растений (Bryophyllym pinnatum (Lam.) Oken, B. daigremontianum (Hamet et Per.) Berger и Hammarbya paludosa (L.) Ktze.): Дис. … канд. биол. наук. СПб. 359 с.
Brzezicka E., Kozieradzka-Kiszkurno M. 2018. Ultrastructural and cytochemical aspects of female gametophyte development in Sedum hispanicum L. (Crassulaceae). – Protoplasma. 255: 247–261. https://doi.org/10.1007/s00709-017-1155-3
[Goncharova] Гончарова С.Б. 2006. Очитковые (Sedoideae, Crassulaceae) флоры Российского Дальнего Востока. Владивосток. 222 с.
[Goncharova, Goncharov] Гончарова С.Б., Гончаров А.А. 2009. Молекулярная филогения и систематика цветковых растений семейства Толстянковых (Crassulaceae DC.) – Молекулярная биология. 43 (5): 856–865.
Ham R.C.H.J. van. 1995. Phylogenetic relationships in the Crassulaceae inferred from chloroplast DNA variation. – In: Evolution and systematics of the Crassulaceae. Leiden. P. 16–29.
Jacobson-Stiasny E. 1913. Die specially Embryologie der Gattung Sempervivum im Vergleich zu den Befunden bei den anderen Rosales. – Denkscr. Akad. Wiss. Wien. 89: 797–815.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
[Mandric, Golyshkin] Мандрик В.Ю., Голышкин Л.В. 1973. Эмбриологическое исследование семейства Crassulaceae. – Бот. журн. 58 (2): 263–272.
Mauritzon J. 1930. Beitrag zur Embryologie der Crassulaceen. – Bot. Notiser. S. 233–250.
Mauritzon J. 1933. Studies über die Embryologie der Familien Crassulaceae und Saxifragaceae. – Dis. Lund. 152 S.
Mort M.E., O’Leary T.R., Carillo-Reyes P., Nowell T., Archibald J.K., Randle C.P. 2010. Phylogeny and evolution of Crassulaceae: past, present, and future. – Biodiversity and Ecology. 3: 69–86.
[Nikiticheva] Никитичева З.И. 1985. Семейство Crassulaceae. – В кн.: Сравнительная эмбриология цветковых растений. Brunneliaceae-Tremandraceae. Л. С. 29–34.
[Nikulin] Никулин В.Ю. 2017. Филогенетические отношения в роде Sedum L. (Crassulaceae J. St.-Hil.) и близких ему родах на основании сравнения нуклеотидных последовательностей ядерной и хлоропластной ДНК: Дис. … канд. биол. наук Владивосток. 114 с.
[Nikulin, Goncharov] Никулин В.Ю., Гончаров A.A. 2017. Молекулярно-филогенетическая характеристика Sedum (Crassulaceae) и близких ему родов на основании сравнения нуклеотидных последовательностей гена matK хлоропластной ДНК и его региона рибосомной ДНК. – Бот. журн. 102 (3): 309–328.
[Pausheva] Паушева З.П. 1974. Практикум по цитологии растений. М. 288 с.
Rombach S. 1911. Die Entwicklung der Samenknospen bei den Crassulaceen. – Rec. Trav. Bot. Néer. 8: 182–200.
[Savchenko] Савченко М.И. 1973. Морфология семяпочки покрытосеменных растений. Л. 190 с.
Schnarf K. 1931. Vergleichende Embryologie der Angiospermen. Berlin. 354 S.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 356 с.
[Shamrov] Шамров. 2018. Особенности морфогенеза, разнообразие и возможные преобразования семязачатков цветковых растений. – Бот. журн. 103 (2): 163–186. https://doi.org/10.1134/S0006813618020011
Shamrov I.I. 2020. Structure and development of coenocarpous gynoecium in angiosperms. – Wulfenia. 27: 145–182.
Subramanyam K. 1962. Embryology in relation to syste-matic botany with particular reference to the Crassulaceae. – Plant Embryology. A Symposium. SCIR. New Delhi. P. 94–112.
Subramanyam K. 1963. Embryology of Sedum ternatum Michx. – J. Indian Bot. Soc. 42A: 252–275.
Subramanyam K. 1967. Some aspects of the embryology of Sedum chrysanthemum (Boissier) Raymond-Hamlet with a discussion on its systematic. – Phytomorphology. 17 (1–4): 240–247.
Subramanyam K. 1970. Crassulaceae. – Bull. Indian Nat. Sci. Soc. 41: 84–89.
Thiede J., Eggli U. 2007. Crassulaceae DC. – In: The families and genera of vascular plants. Berlin. P. 83–118.
Wojciechowicz M.K., Samardakiewicz M. 1998. The deve-lopment of female gametophyte and antipodal embryo formation in Sedum fabaria. – Biologia Plantarum. 40 (2): 193–202.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


