Ботанический журнал, 2022, T. 107, № 11, стр. 1039-1054
ОСОБЕННОСТИ ГЕТЕРОФИЛЛИИ ACER SERRULATUM (ACERACEAE)
С. М. Бебия 1, *, Е. Ф. Джакония 1, И. Ю. Титов 1, И. С. Антонова 2, **, М. С. Телевинова 2, М. В. Кременецкая 2
1 Ботанический институт Академии наук Абхазии
384900 Сухум, ул. Гулиа, 22, Абхазия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: bebia_sergei@mail.ru
** E-mail: ulmaceae@mail.ru
Поступила в редакцию 20.04.22
После доработки 19.09.2022
Принята к публикации 20.09.2022
- EDN: PPFJZR
- DOI: 10.31857/S0006813622110035
Аннотация
Освещены результаты исследования индивидуального развития особей вида Acer serrulatum Hayata. Проведенные многолетние фенологические и эколого-морфологические наблюдения показали, что растения сохранили ритмику и экологические особенности, присущие виду в естественных условиях местообитаний. Охарактеризовано развитие формы листовой пластинки от проростка до зрелой стадии, и основное внимание уделено гетерофиллии этого вида. Рассматривается два вида гетерофиллии: предгенеративного и генеративного периодов. У A. serrulatum гетерофиллия отсутствует у молодых и быстро растущих деревьев 10–12-летнего возраста. На их побегах (и ростовых, и коротких) листья строго пятилопастные. Гетерофиллия у взрослого растения A. serrulatum проявляется в листовой серии ростовых побегов. Изменения от пятилопастной до трехлопастной пластинки объясняется как эффект недоразвития листа в средней части многолистного ростового побега, образующего на следующий год множество боковых и большую листовую поверхность плагиотропной ветви дерева. Рассмотрено явление гетерофиллии и для других 36 видов рода Acer секции Palmata Pax. Общее количество видов с изменяющейся в онтогенезе листовой пластинкой на прегенеративном этапе составляет 90% от числа листопадных видов секции. При этом виды, имеющие гетерофиллию во взрослом генеративном состоянии, составляют 35% от листопадных видов секции. Наиболее часто встречаются виды с 9 лопастями листовой пластинки. Обсуждаются возможные эволюционные тенденции в пределах таксона, приспособительные возможности вегетативного тела древесного растения.
Изучение индивидуального развития особей позволяет уточнить характеристику приспособительных возможностей вида и необходимо для понимания эволюционных тенденций (преобразований) в пределах таксона. У некоторых видов кленов прохождение отдельных стадий онтогенеза маркируется определенной формой листовой пластинки. Фенологические, морфологические и анатомические методы исследования побегов позволяют выявить особенности, сформированные в естественных условиях, и оценить приспособительные возможности растения.
Acer serrulatum Hayata относится к секции Palmata Pax. По литературным данным секция объединяет около 40 видов (De Jong, 1976; Xu et al., 2008; Eom et al., 2011). На систематическое положение вида существуют разные точки зрения (De Jong, 1976; Beaulieu et al., 2003; Eom et al., 2011). F. Pax в монографическом описании рода Acer (1886) включает A. serrulatum в состав A. oliverianum. Другие авторы (Beaulieu et al., 2003) в обзоре рода клен также приводят только A. oliverianum Pax. Причем, в пределах вида они выделяют три комбинации: A. oliverianum f. longistaminum Hayata, A. oliverianum var. microcarpum Hayata, A. oli-verianum var. nakaharae Hayata, и отдельно комбинацию A. serrulatum Hayata в качестве синонима. Во флорах Тайваня и Китая A. serrulatum приведен как самостоятельный эндемичный вид, произрастающий в составе дубово-лавровых лесов (Huang et Editorial..., 1993; Xu et al. (eds.), 2008). Название A. serrulatum Hayata считается приоритетным по IPNI (2019) и POWO (2019).
В настоящее время A. serrulatum Hayata рассматривается в качестве эндема острова Тайвань. Растения вида обладают высокой семенной продуктивностью и всхожестью семян, крупными размерами деревьев. Это характеризует вид как прогрессивный реликт, обладающий ограниченным ареалом, в силу того что он, вероятно, еще не успел расселиться.
Местообитания A. serrulatum сосредоточены на высотах от 1000 до 2000 м над ур. м., где 187 дней в году отмечаются дожди, вследствие чего влажность почвы и воздуха постоянно высокая (Wu, 1959; Huang et Editorial..., 1993; Bebiya et al., 2000). Это лесные массивы, расположенные в субтропическом климате, характеризующиеся стабильностью температурного режима и постоянным присутствием туманов и облачности, спускающейся с гор. Высота вечнозеленых лесных сообществ достигает 30 метров. Полог леса разделяется на три–четыре яруса. Сообщества исключительно многовидовые. A. serrulatum дорастает до 20 м и входит во второй-третий ярус, что позволяет отнести его к теневыносливым растениям. В состав верхних ярусов входят Beilschmiedia erythrophlora Hayata, Castanopsis longicaudata (Hayata) Nakai, Quercus stenophylloides Hayata, Q. morii Hayata, Q. tatakaensis Tomiya, Lithocarpus amygdalifolius (Skan) Hayata, L. lepidocarpus (Hayata) Hayata, L. kawakamii (Hayata) Hayata, Litsea acuminata (Blume) Sa. Kurata, L. akoensis Hayata, Machilus thunbergii Siebold et Zucc., M. japonica Siebold & Zucc., Cinnamomum insularimontanum Hayata (Yang et al., 2010). Бриофиты и лишайники здесь покрывают стволы деревьев и кроны большими гирляндами. На поверхности почвы в таких лесах также широко представлены многовидовые сообщества настоящих мхов. Вследствие этого ювенильные особи деревьев развиваются в условиях большой влажности и значительного затенения.
Несмотря на то, что представители рода Acer издавна выращиваются на Кавказе, A. serrulatum в списках интродуцированных видов не значился (Ginkul, 1936; Pilipenko, 1978; Karpun, 2003; Fedorinova et al., 2013). В Саду Ботанического института Академии наук Абхазии (БИН АНА) этот вид появился немногим более 25 лет назад (Dzhakoniya, 2012) и проявил себя как высокодекоративное растение, потенциально способное занять заметное место в озеленении населенных пунктов республики.
Многие исследователи отмечают, что для Acer oliverianum Pax., A. serrulatum, а также некоторых других видов секции Palmata Pax. характерно явление гетерофиллии. Это, в немалой степени, затрудняет определение таксономической принадлежности особей (De Jong, 1976; Eom et al., 2011). При этом, гетерофиллия проявляется чаще у растений раннего возраста и в генеративном состоянии. Сопоставление морфологических особенностей листьев растений в разных возрастных состояниях может раскрыть важные биологические свойства вида.
Явление гетерофиллии широко известно и у других видов рода Acer (Critchfield, 1970, 1971) и представляет интерес для биологов разных специальностей в вопросе общего синтетического понимания этого явления в биологии растений.
Цель данной работы – подвести итоги исследования развития листовой пластинки A. serrulatum от проростка до генеративной стадии и уделить особое внимание гетерофиллии этого вида.
МАТЕРИАЛЫ И МЕТОДЫ
Исследованные растения Acer serrulatum выращены на территории Сада БИН АНА из семян, собранных в средней части о. Тайвань. В настоящее время особи этого вида представляют собой хорошо развитые генеративные растения, вступившие в стадию плодоношения. Фенологические наблюдения проводили с 2005 по 2021 год за растениями, произрастающими в открытом грунте и высаженными в вазоны. Растения пересаживали в вазоны в ювенильном возрастном состоянии с семядолями и двумя листовыми пластинками начиная с апреля 2005 года. Наблюдения за самосевом проводили в разных частях сада в подкроновом пространстве материнского растения и на клумбах сада. Фенологические характеристики исследованы для более 300 растений (Metodika…, 1975; Shul’ts, 1981; Zaitsev, 1981).
Проведены подробные описания листовых пластинок, их размеров и форм в разных возрастных состояниях. Возрастные состояния (проросток, ювенильное растение, имматурное растение, виргинильное растение, генеративное растение) выделены по методике О.В. Смирновой c соавторами (Smirnova et al., 2018). У растений разных возрастных состояний проведены описания побегов по методике, разработанной в СПбГУ (Antonova, Fatianova, 2016). Выполнено анатомическое исследование листовых пластинок и черешков взрослых растений по методике Фурст (Furst, 1979). На основе данных по анатомическому анализу трех- и пятилопастных листьев проведены факторный и дискриминантный анализы с использованием статистического пакета STATISTICA 10 (StatSoft, Inc.).
Проанализированы описания и изображения листовых пластинок 36 видов секции (Huang, 1993; Xu et al., 2008). По литературным данным, секция объединяет около 40 видов (De Jong, 1976; Xu et al., 2008; Eom et al., 2011). Отнесение вида к определенной градации по признаку лопастности происходило на основании преобладающего количества лопастей листьев у дерева в генеративном возрастном состоянии. Высота дерева бралась по максимальной градации, приводимой в литературе.
РЕЗУЛЬТАТЫ
Почки у Acer serrulatum раннего генеративного состояния набухают в конце февраля (табл. 1). Рост побегов начинается в начале марта и продолжается около месяца. Разворачивающиеся листья и растущий побег вначале окрашены в ярко-бордовый цвет. По мере созревания листовая пластинка бледнеет до блекло-бордового цвета, затем буреет и постепенно к началу июня становится зеленой. Листовая пластинка приобретает форму, характерную для взрослого листа, к концу первой декады марта одновременно с окончанием роста побегов.
Таблица 1.
Фенологические фазы Acer serrulatum в условиях Ботанического сада БИН АНА Table 1. Phenological stages of Acer serrulatum in the conditions of the Botanical Garden of the Botanical Institute of the Academy of Sciences of Abkhazia
| Начало набу-
хания почек Beginning of swelling buds |
Начало распус-
кания почек Beginning of opening buds |
Начало цветения Beginning of flowering |
Начало созре-
вания плодов Beginning of fruit ripening |
Конец созрева-
ния плодов End of fruit ripening |
Начало осеннего
окрашивания листьев Beginning of autumn leaf colour changing |
Конец осеннего
окрашивания листьев End of autumn leaf colour changing |
Начало листопада Beginning of leaf fall |
Конец листопада End of leaf fall |
|---|---|---|---|---|---|---|---|---|
| 27.02 ± 5.1* | 10.03 ± 4.2 | 6.04 ± 6.8 | 23.04 ± 3.3 | 20.10 ± 6.3 | 2.11 ± 6.0 | 19.11 ± 6.5 | 5.12 ± 3.5 | 18.12 ± 2.8 |
Цветение проходит параллельно с ростом побегов и продолжается около 2.5 недель. Плоды созревают в течение семи месяцев. Осеннее окрашивание листьев начинается в декабре. За две недели листья могут измениться в цвете 8 раз. Ко времени листопада листья имеют разнообразную окраску: от желто-зеленой в нижней, красновато-фиолетовой в средней и ярко-красно-оранжевой в верхней части кроны (Dzhakoniya, 2012). Листопад начинается почти через месяц после окончания окрашивания листьев, полное опадение листьев происходит поздно (к середине декабря) и продолжается около недели.
Согласно литературным данным, на Тайване A. serrulatum развертывает листья в конце февраля – начале марта (Hayashida, 2015), что совпадает со сроками, наблюдаемыми в Саду БИН АНА. Аналогичная картина наблюдается и для сроков цветения, созревания плодов, осеннего окрашивания листьев и листопада (Dzhakoniya, 2012). Таким образом, несмотря на очень большую удаленность территории Абхазии от о. Тайвань и несомненно меньшее количество солнечной радиации, сроки прохождения важных фенологических фаз сходны.
Интересно отметить, что молодые растения, привезенные из Тайваня, поначалу не сбрасывали листья, оставаясь вечнозелеными. У семенных особей, развивающихся в условиях г. Сухум, листья опадают в 20-х числах декабря, а новые начинают развертываться уже в начале марта.
Первое плодоношение наблюдалось у растений в 12-летнем возрасте. При этом все семена оказались стерильными. Лишь через 4 года стали формироваться полноценные семена. В Сочинском дендрарии деревья также перешли в генеративную фазу в 12–13-летнем возрасте (Dzhakoniya, 2012).
В саду БИН АНА дерево 25-летнего возраста значительно превосходит по высоте и ширине кроны экземпляры того же возраста в сочинском “Дендрарии”, где температура и влажность менее соответствуют условиям Тайваня, нежели в Сухуме.
В Сухуме A. serrulatum имеет очень длительный период вегетации. В конце имматурного и в виргинильном возрастном состоянии у этого вида наблюдали две волны роста. Вторая волна приходилась на осень, поэтому побеги не успевали одревесневать и зимой подмерзали. Две волны роста связаны с более влажными весенним и осенним сезонами, по сравнению с летним. В особо влажные годы рост не прекращался и летом, и тогда отдельной осенней волны не наблюдалось.
Наши исследования показали, что у взрослого генеративного растения пятилопастные листья присущи всем генеративным побегам. У вегетативных побегов такая форма листа свойственна коротким побегам с двумя или тремя парами листьев. У всех многолистных ростовых побегов, составляющих скелет кроны, после образования двух пар листовых пластинок с пятью лопастями (рис. 1a, b) развиваются трехлопастные листовые пластинки, не имеющие зачатков нижних четвертой и пятой долей (рис. 1d–h). Пятилопастные листья вполне соответствуют листьям генеративных и коротких вегетативных побегов. Иногда за пятилопастными листовыми пластинками образуются четырехлопастные пластинки, у которых отсутствуют симметричная четвертой пятая доля (рис. 1c). При этом у одного листа может быть четырехлопастная пластинка, а у другого, отходящего от того же узла – трехлопастная.
Рис. 1.
Серия фотосинтезирующих листьев ростового побега дерева. Из каждой пары листьев представлен только один.
Fig. 1. A series of photosynthetic leaves of a growth shoot of a tree. Only one leaf of each pair is represented.
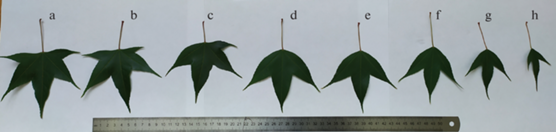
Последующие листовые пластинки ростовых побегов отчетливо трехлопастные. Количество пар трехлопастных пластинок обычно превышает количество пятилопастных или может быть равно ему. У части побегов трехлопастные листья появляются сразу за пятилопастными. Чаще такие побеги имеют несколько меньшую длину и количество листьев. Они развиваются на осях 4-го, реже 3-го порядка.
Пропорции долей трехлопастных листьев изменяются в сторону удлинения капельницы на вершине листа и сокращения ширины долей (рис. 1d–h). По консистенции эти листья более плотные, чем пятилопастные. На следующий год из почек ростовых побегов формируются многочисленные боковые побеги, образующие плоскую плагиотропную ветвь, подобную ветвям Tilia cordata Mill. и Ulmus glabra Huds.
Таким образом, пятилопастные листья у генеративных растений формируются на всех типах побегов. Листовая серия A. serrulatum полностью реализуется в благоприятных экологических условиях и лишь частично в неблагоприятных. Трехлопастные листья присутствуют на крупных ростовых побегах в их дистальной части. Такие побеги развиваются у деревьев в благоприятных условиях произрастания. У особей со сниженной жизненностью формируются только побеги средней длины с меньшим количеством листьев, из которых только верхняя пара имеет четырехлопастную, а еще реже трехлопастную листовую пластинку.
Исследование анатомического строения поперечных срезов листьев A. serrulatum показало, что лист может быть охарактеризован как тонкий, верхняя и нижняя поверхности листа ровные (рис. 2a, b; табл. 2). Мелкие жилки не выступают над поверхностями листа. Жилки, проходящие по центру каждой из лопастей листа, выступают над адаксиальной и абаксиальной его поверхностями. Столбчатый мезофилл плотный, составляет меньше половины толщины листа. Губчатый мезофилл умеренно рыхлый, состоит из 4 слоев, его клетки округлые, наиболее крупные межклетники не превышают среднего размера клетки соответствующего слоя мезофилла. Клетки верхней эпидермы крупные, имеют округлые очертания и при этом утоплены вглубь листа, создавая гладкую верхнюю поверхность. Слой мезофилла, прилегающий к нижней эпидерме, мелкоклеточный, отчего кажется, что он содержит большее количество хлоропластов, чем остальные слои губчатого мезофилла. Клетки нижней эпидермы на срезе мелкие, имеют прямоугольную форму.
Рис. 2.
Поперечные срезы листовой пластинки и черешка особи Acer serrulatum генеративного возрастного состояния (a – поперечный срез пятилопастного листа, b – поперечный срез трехлопастного листа, с – поперечный срез черешка в средней части).
Fig. 2. Cross sections of leaf blades and petioles of an Acer serrulatum specimen of a generative age state (a – cross section of a five-lobed leaf, b – cross section of a three-lobed leaf, c – cross section of a petiole in the middle part).

Таблица 2.
Характеристики анатомического строения пятилопастного листа Table 2. Characteristics of anatomic structure of five-lobed leaf
| Структура/Structure | Толщина (мкм) ± станд. откл./ Thickness (μm) ± standard deviation |
|---|---|
| Мезофилл/Mesophyll | 116.4 ± 11.4 |
| Столбчатый мезофилл/Palisade mesophyll | 55.8 ± 7.0 |
| Верхняя эпидерма/Upper epidermis | 22.5 ± 4.0 |
| Нижняя эпидерма/Lower epidermis | 11.1 ± 0.8 |
| Кутикула/Cuticle | 4.5 ± 0.9 |
Поперечный срез черешка имеет овальную форму, край черешка укреплен шестью рядами клеток колленхимы. Механические ткани, окружающие проводящий пучок сверху, выражены слабо и составляют 2 слоя клеток. Проводящие пучки черешка разделены крупными паренхимными промежутками. Самый крупный пучок находится на адаксиальной стороне черешка. Всего на срезе черешка в средней его части 10 проводящих пучков. На адаксиальной стороне черешка выражена ложбинка (рис. 2c).
Сравнение анатомического строения трех- и пятилопастных листьев из средней части кроны показало статистически значимые различия толщины (F-критерий, p < 0.00001). Проведенный дискриминантный анализ показал, что с точностью классификации 93% трех- и пятилопастные листовые пластинки A. serrulatum различаются (табл. 3).
Таблица 3.
Результаты дискриминантного анализа для трехлопастных и пятилопастных листьев Acer serrulatum Table 3. The results of the discriminant analysis for the three-lobed and five-lobed leaves of Acer serrulatum
| Признаки/Traits | Коэффициенты/Coefficients | Факторные нагрузки/Factor loadings | |
|---|---|---|---|
| Толщина/ Thickness of |
кутикулы/cuticle | –1.110 | –0.59 |
| нижней эпидермы/ lower epidermis |
0.612 | 0.28 | |
| столбчатого мезофилла/ palisade mesophyll |
–0.180 | –0.23 | |
| мезофилла/mesophyll | 0.077 | 0.08 | |
| Constant | –2.567 | – | |
В дискриминантную функцию вошли признаки толщины столбчатого и губчатого мезофилла, нижней эпидермы и кутикулы. Факторный анализ выделил 4 фактора, объясняющих дисперсию с точностью 90% (табл. 4).
Таблица 4.
Результаты факторного анализа для трехлопастных и пятилопастных листьев Acer serrulatum Table 4. Results of factor analysis for three-lobed and five-lobed leaves of Acer serrulatum
| Признаки/Traits | F1 | F2 | F3 | F4 |
|---|---|---|---|---|
| Мезофилл/Mesophyll | –0.67 | 0.68 | –0.14 | –0.17 |
| Столбчатый мезофилл/Palisade mesophyll | 0.02 | 0.93 | –0.14 | 0.16 |
| Верхняя эпидерма/Upper epidermis | –0.62 | –0.38 | -0.30 | 0.50 |
| Нижняя эпидерма/Lower epidermis | –0.20 | 0.18 | 0.79 | 0.48 |
| Кутикула/Cuticle | 0.49 | 0.12 | –0.67 | 0.38 |
| Губчатый мезофилл/Spongy mesophyll | –0.86 | –0.21 | –0.24 | –0.11 |
| Накопленная объясненная дисперсия, %/ Cumulative explained variance, % |
31 | 57 | 78 | 90 |
Выявлена общая тенденция к увеличению показателей толщины столбчатого и губчатого мезофилла, верхней и нижней эпидермы, кутикулы у трехлопастных листьев, что соответствует представлению об их большем светолюбии (рис. 2a, b).
В монографии “An Illustrated Guide to Maples” (Beaulieu et al., 2003) для A. oliverianum отмечено наличие гетерофиллии, то есть присутствие пяти, четырех и трехлопастных листьев, однако подробности строения листьев и их расположения на коротких и удлиненных побегах у виргинильных и генеративных растений не приводятся.
У A. serrulatum особи из самосева в открытом грунте имеют только один прирост в год. Для проростка A. serrulatum характерны зеленые фотосинтезирующие семядоли с тремя параллельно идущими жилками, видимыми на просвет. Продолжительность жизни семядолей около трех месяцев. Выше по оси побега развиваются две-три пары ювенильных листьев. Форма листовой пластинки первой пары листьев вытянутая, с заостренной вершиной и тремя лопастями (рис. 3а, b), причем боковые лопасти значительно меньше верхней.
Рис. 3.
Внешний вид листьев однолетней и трехлетней особей самосева Acer serrulatum (а – однолетняя особь, b – трехлетняя особь).
Fig. 3. Appearance of leaves of annual (a) and three-year-old (b) self-sown plants of Acer serrulatum.

Вторая и особенно третья пара листьев отличается от первой лучшим развитием “капельницы” (рис. 4d), характерной для тропических растений (Richards, 1957). Вытянутая верхняя лопасть листа преобладает и у последующих пар листьев (рис. 4e–h).
Рис. 4.
Примеры листовых пластинок первого и второго годов жизни Acer serrulatum (a – внешний вид проростка с семядолями; b, c, d, e, f – последовательное изменение формы листа у растений первого года жизни; g, h – форма листовой пластинки растения второго–третьего года жизни).
Fig. 4. Examples of leaf blades of Acer serrulatum of the 1st and 2nd years of life (a – seedling with cotyledons; b, c, d, e, f – sequential changes of the leaf shape in the plants of the 1st year of life; g, h – leaf blade shape of a plant of the 2nd–3rd year of life).

Из-за недостатка влаги у растений, произрастающих под материнской особью, вскоре за отмиранием семядолей усыхает и часть нижних настоящих листьев. У растений, пересаженных в вазоны, этого не наблюдается. Напротив, при выращивании в затенении с регулярным поливом растения первого года образуют второй прирост, состоящий из двух пар чешуй и одной, двух или даже трех пар листовых пластинок. При этом расстояние между почечными чешуями может сильно варьировать – от 1 мм до 25 мм (рис. 5а–с).
Рис. 5.
Расположение листовых органов в начале второго прироста при выращивании Acer serrulatum в культуре (a – две пары не фотосинтезирующих чешуй сближены; b – две пары почечных чешуй разнесены; c – верхняя пара почечных чешуй удалена на расстояние 25 мм от начала побега).
Fig. 5. The location of leaf organs at the beginning of the second growth of Acer serrulatum grown in culture (a – two pairs of non-photosynthetic scales close together; b – two pairs of bud scales spaced; c – upper pair of bud scales spaced 25 mm from the shoot base).

В сухие жаркие годы семена A. serrulatum наиболее успешно прорастали между плитками мощения дорожек Ботанического сада в глубокой тени здания, там, где влажность воздуха и почвы поддерживается растущими в углублениях мхами. Моховые куртины поддерживали жизнь проростков в течение одного сезона, а затем проростки отмирали. Листовые пластинки в количестве не более двух листовых пар имели те же очертания, что и в открытом грунте.
Нередко у растений в вазонах вторая пара листьев на втором приросте имеет недоразвитый лист с расширенным основанием и очень мелкой листовой пластинкой. Другой лист в такой паре развивается нормально. Все это указывает на то, что определение характера трансформации листового зачатка (в чешуевидный или настоящий лист), происходит в ходе развития на поздних стадиях его формирования и, вероятно, некоторую роль здесь играют внешние условия. Угол расхождения между первой центральной, удлиняющейся в капельницу лопастью, и формирующейся второй парой лопастей у молодых растений больше, чем у листьев взрослого генеративного возраста (табл. 5).
Таблица 5.
Характеристики изменения формы листовой пластинки и ее площади у Acer serrulatum в разные возрастные периоды Table 5. Characteristics of changes in the leaf blade shape and area in Acer serrulatum in different age periods
| Возраст (год) Age (years) |
Площадь листовой
пластинки, (мм2)
± станд. откл. Leaf blade area (mm2) ± standard deviation |
Угол расхождения
1–2 жилки (°) Angle of divergence between 1st–2nd veins (°) |
Угол расхождения
2–3 жилки (°) Angle of divergence between 2nd–3rd veins (°) |
Соотношение
длины и ширины Length to width ratio |
Расстояние до
выемки между 1
и 2 жилками, (мм) Distance to sinus between 1st and 2nd veins (mm) |
Высота особи, (м) Plant height (m) |
|---|---|---|---|---|---|---|
| 4 | 9 ± 0.25 | 40–45 | 50 | 7:1 | 9–11 | 0.1 |
| 5 | 22 ± 0.29 | 47–49 | 49–50 | 5:1 | 15–20 | 0.5 |
| 10 | 30 ± 0.34 | 43–44 | 44–45 | 4.6:1 | 22–26 | 2 |
| 25 | 50 ± 1.0 | 34–35 | 36–38 | 3.4:1 | 50–52 | 12 |
На второй и третий годы в открытом грунте длина годичных приростов составляет 5–6 мм. На побегах образуются две-три пары листьев с мелкими, едва заметными четырьмя и пятью лопастями.
Установлено, что у особей A. serrulatum, произрастающих на сухих и открытых клумбах Ботанического сада, в течение трех лет развивались листья с очень короткими листовыми “капельницами” (Richards, 1957), сходными с капельницами первых листьев проростков. Растение как бы задерживалось на стадии проростка. Междоузлия между такими листьями составляли доли миллиметра. В связи с этим, приросты побегов были очень малы.
На четвертый-пятый год жизни дерева у листьев хорошо выражены пять лопастей. Пяти- и десятилетние растения отличаются от более молодых углом отхождения крупных боковых долей и вытянутостью верхней доли, а также общей шириной листа. У растений активизируется рост побегов в длину. При этом прирост может составлять 30–50 см в год. Ведущим экологическим фактором для быстрого роста является влажность воздуха и почвы. Напротив, иссушение, возникающее под действием света, тормозит развитие проростков и имматурных растений.
У имматурных и виргинильных растений при достаточном увлажнении за один вегетационный сезон могут развиваться очень длинные ростовые побеги – от 1.5 до 2.3 м, но становление окончательной формы листовых пластинок удлиненных побегов у A. serrulatum происходит очень медленно – только к десятому году жизни и позже.
При пересадке проростков в вазоны, а, следовательно, удалении конкуренции с травянистыми и материнскими растениями, изменение формы листьев происходит быстрее. Возрастные состояния протекают в более короткие отрезки времени.
Следует отметить, что хотя листья четырех-пятилетних растений имеют хорошо выраженные пять лопастей, их пропорции отличаются от пятилопастных листьев взрослых генеративных растений по нескольким параметрам. Во-первых, отчетливо длиннее остальных верхняя лопасть. Во-вторых, нижние лопасти существенно меньше верхних, и угол их отклонения от верхней лопасти больше, чем 90 градусов. Это определяет соотношение длины и ширины листа в сторону большей вытянутости. Вырезы между лопастями глубокие (табл. 5).
Характерной особенностью ювенильных листьев A. serrulatum является так же более выраженный двоякозубчатый край листа. По мере взросления растения образуются листья с пильчатым краем. В ходе развития особи увеличивается площадь листовой пластинки, при этом размер черешка не меняется. Удлиненность верхней лопасти и большой угол между второй и третьей парами лопастей сохраняется до 11–12-летнего возраста дерева, по достижении которого листовые пластинки растения приобретают форму листа, характерного для виргинильного и последующих возрастных состояний (рис. 4). Угол расхождения между второй и третьей парами лопастей уменьшается на 12–14°. Соотношение длины и ширины листовой пластинки меняется, так как у растений в 5–10-летнем возрасте максимальная ширина определяется второй, а у зрелого листа – третьей парой лопастей. Расстояние от черешка до выемки между первой и второй лопастями увеличивается от 10 до 51 мм, что делает лист более широким и менее изрезанным. Площадь листа при этом увеличивается в 6 раз (табл. 5).
Интересно, что у 6–7-летних растений иногда образуются семилопастные листовые пластинки. В 10-летнем возрасте таких листьев уже нет.
При пересадке проростков в вазоны, а, следовательно, удаления конкуренции с травянистыми и материнскими растениями, изменение формы листьев происходит быстрее. Возрастные состояния протекают в более короткие отрезки времени.
Проведенное исследование показало: в ходе онтогенеза у A. serrulatum происходит переход от нерасчлененной листовой пластинки с зубчатым краем к трехлопастной, а затем к пяти- и даже семилопастной пластинке. Еще одной важной особенностью гетерофиллии A. serrulatum является то, что боковые побеги, развивающиеся из пазушных почек трехлопастных листьев ростового побега, несут только пятилопастные листовые пластинки.
У A. serrulatum гетерофиллия отсутствует у проростков, а также у молодых и интенсивно растущих деревьев 10–12-летнего возраста. У имматурных и виргинильных растений все побеги (и ростовые, и короткие) имеют строго пятилопастные листья. Гетерофиллия наиболее отчетливо проявляется у зрелых генеративных растений, у которых строение листьев различается в зависимости от того, на каких побегах они расположены. На генеративных 2–4 (6)-листных побегах все листья пятилопастные, также как и на коротких вегетативных 2–4 (6)-листных побегах. На ростовых побегах A. serrulatum обычно за двумя парами пятилопастных пластинок развиваются одна пара четырехлопастных и 4–7 пар трехлопастных листьев. При этом отсутствуют побеги, у которых листовая серия заканчивается четырехлопастной пластинкой. За четырехлопастными всегда следуют трехлопастные листья, причем их количество больше, чем количество четырехлопастных. В листовой серии трехлопастные листовые пластинки постепенно уменьшаются в размерах. Важно, что по характеру зубчатости края листа, консистенции и форме лопастей трехлопастные листья близки к пятилопастным и совсем не похожи на ювенильные трехлопастные листья, в том числе и наличием внезапно оттянутой верхушки (рис. 1, 6).
Рис. 6.
Форма листовой пластинки от первого года жизни до генеративного возрастного состояния. a – семядоли и первый лист проростка; b, c, d, e – ювенильные листья первого года развития; f, g – ювенильные листья второго–третьего года развития; h – лист имматурного возрастного состояния пятого года развития; i – лист виргинильного возрастного состояния десятого года развития особи; j, k – листья взрослой особи первого генеративного возрастного состояния.
Fig. 6. Leaf blade shape from the 1st year of life to a generative age state. a – cotyledons and the 1st seedling leaf; b, c, d, e – juvenile leaves of the 1st year of development; f, g – juvenile leaves of the 2nd–3rd year of development; h – leaf of the immature age state of the 5th year of development; i – leaf of the virginal age state of the 10th year of development of a plant; j, k – leaves of an adult plant at the first generative age state.

При рассмотрении характера изменения параметров метамеров вдоль оси ростового побега у A. serrulatum наблюдается отклонение от типичного. Обычно у деревьев в средней части ростового побега метамеры с самыми крупными листьями имеют и самые длинные междоузлия. У A. serrulatum на ростовых побегах самые длинные междоузлия сочетаются с небольшими трехлопастными листьями. На основе мощной оси ростовых побегов в будущем году развивается много боковых побегов с пятилопастными листьями, образующими значительную фотосинтезирующую поверхность.
Такие эффекты (несоответствие самого крупного междоузлия самому крупному листу на ростовых побегах, формирование мелких листовых пластинок в дистальной части ростового побега имеющей крупные междоузлия) наблюдаются в том числе у ростовых побегов Fagus orientalis Lipsky, произрастающего на Кавказе.
Было установлено, что среди вечнозеленых видов клена (в секции – 20%) только у A. kwangnanense Hu et W.C. Cheng имеются трехлопастные листья. Для этого вида не характерна гетерофиллия. У остальных вечнозеленых видов листья не расчленены на доли (А. laevigatum Wall., А. fabri Hance, A. wangchii W.P. Fang, A. hilaense Hu et W.C. Cheng, A. crissum Hu et W.C. Cheng, A. sino-oblongum F.P. Metcalf). По высоте особи вечнозеленых видов представлены от совсем низких растений (до 5 м) до 15-ти метровых.
Общее количество видов с изменяющейся в онтогенезе листовой пластинкой на прегенеративном этапе составляет 90% от числа листопадных видов секции.
У 65% листопадных видов гетерофиллия во взрослом генеративном состоянии не встречается. Наибольшее количество видов с неизменными листовыми пластинками имеют 9 лопастей (De Jong, 1976; Xu et al., 2008; Eom et al., 2011), что составляет 39% от числа видов с неизменными листовыми пластинками. Остальные виды с неизменными листьями имеют три, пять, семь лопастей. Многолопастные листовые пластинки характерны для видов с высотой от 7 до 10 метров (A. duplicatoserratum Hayata, A. japonicum Thunb., A. pseudosieboldianum (Pax) Kom., A. linganense Hayata, A. sinense Pax, A. erianthum Schwer., A. tenuifolium (Koidz.) Koidz.). Только виды A. campbellii Hook.f. et Thomson ex Hiern и A. shirasawanum Koidz. имеют высоту 15 метров.
В группе листопадных видов с неизменными листовыми пластинками представителей с 3-лопастными листьями всего два (A. fenzelianum и A. confertifolium Merr. et F.P. Metcalf.). Листопадные виды с неизменными цельными листовыми пластинками представлены деревьями высотой 10–12 м (A. oligocarpum W.P. Fang et L.C. Hu, A. coriaceifolium H. Lev).
Изменяющаяся на генеративном этапе онтогенеза листовая пластинка характерна для видов с 3, 5 и 9 лопастями, причем 5-лопастные виды преобладают. Именно к этой группе относится A. serrulatum. Высота деревьев этой группы в основном меняется от 7 до 12 метров.
Анализ полученных данных показывает, что намечается тенденция к увеличению количества лопастей у растений, имеющих высоту 10 метров и ниже. Следует отметить, что график (рис. 7) построен по максимальной высоте деревьев, значит, в природе они имеют меньшие размеры. Лист с большим количеством лопастей имеет меньшую потерю площади на вырезы, для фотосинтеза используется вся площадь листовой пластинки, приближающаяся по форме к кругу. Это характерно, в основном, для растений нижних ярусов леса. Более высокие растения (15–20 м) составляют в группе растений с неизменным строением листа 34%, а более низкие – 66%.
Рис. 7.
Соотношение высоты дерева и количества лопастей листьев во взрослом состоянии для листьев с неизменным и меняющимся в онтогенезе количеством лопастей. Представлен результат для 36 видов на основе Флоры Китая и Флоры Тайваня (Huang et Editorial Committee of the Flora of Taiwan, 1993, Xu et al., 2008).
Fig. 7. The ratio of the tree height to the number of leaf lobes in the adult state for the leaves with the lobe number unchanged and changing in ontogenesis. The result is presented for 36 species on the base of Flora of China and Flora of Taiwan (Huang et Editorial Committee of the Flora of Taiwan, 1993, Xu et al., 2008).
Количество лопастей – Number of lobes.

ОБСУЖДЕНИЕ
Acer serrulatum, интродуцированный на Черноморском побережье Кавказа, сохраняет целый ряд тропических черт строения побега и листа. К ним относятся, длина “капельницы” листьев, продолжительность ростовых процессов, окраска листьев и т.д.
Сбрасывание лишней воды с поверхности листа – важная задача выживания, особенно во влажных тропиках. У ряда тропических деревьев при формировании листа формируется длинная “капельница” – заостренный конец, называемый еще капельным наконечником, что ускоряет сток воды. Т.И. Серебрякова (Serebryakova, 1948) показала, что при выращивании в тропической оранжерее Tilia cordata Mill., у листьев резко увеличивается “капельница”, за счет которой лист удлиняется. При этом известно то, что род Tilia L. и семейство Tiliaceae имеют тропическое происхождение, и в тепле оранжереи появление оттянутой верхушки можно рассматривать как проявление анцестрального признака.
Яркая окраска молодых листьев при разворачивании, присущая представителям разных систематических групп, по мнению П.У. Ричардса (Richards, 1961), является тропической чертой, так как в тропиках световой поток значительно сильнее, а это свойство позволяет защитить молодые листья. Существуют и современные, в том числе физиологические, подтверждения этому факту. Например, в работе W.C. Gong с соавторами обсуждается, как красная окраска молодых листьев соотносится с адаптивными свойствами древесных тропических растений (Gong et al., 2020). Таким образом тропической чертой A. serrulatum можно считать очень яркую окраску молодых листьев – почти алых, по внешнему виду напоминающих бархатистые лепестки роз, что защищает молодые листовые пластинки от избытка солнечного света.
В тропическом теплом и важном климате формирование новых элементов ксилемы продолжается в течение длительного времени. При продвижении растения на север длительное образование и созревание (одревеснение) элементов ксилемы – одна из важнейших причин, тормозящих успешное продвижение в более высокие широты. Чем позже заканчивается рост побега, тем больше вероятность его гибели зимой. Таким образом, способность A. serrulatum формировать многолистные долго растущие и медленно одревесневающие побеги длиной до 2.3 м является чертой, сохраненной видом от своего тропического прошлого.
В Сухуме у A. serrulatum становление окончательной формы листовых пластинок происходит в течение 10 лет, что характерно для видов, у которых онтогенез протекает медленно. Адаптация к влажному сутропическому климату Черноморского побережья Кавказа у A. serrulatum еще не произошла в достаточной степени.
Ранее была исследована зависимость развития проростков Acer negundo L. в условиях Белгородской области от факторов влажности и освещенности (Efimova, Antonova, 2012). Было установлено, что на проростки A. negundo, а именно, на количество пар листьев, длину междоузлий и общую высоту проростка, а значит и на переход в следующую фазу онтогенеза, освещенность влияет в большей мере, чем увлажненность. Сравнение условий существования проростков A. serrulatum в вазонах и под деревом показывает, что в вазонах почвенные условия несколько суше, освещенность больше, тогда как под материнским растением освещенность меньше, а влажность больше. Данное исследование показало, что у A. serrulatum в условиях интродукции главным экологическим фактором быстрого роста и перехода к следующему этапу онтогенеза является влажность воздуха и почвы.
Достоверно известна разница между морфологическими, анатомическими и физиологическими характеристиками листьев в разных частях кроны и в дистальной и проксимальной частях ветвей, как у покрытосеменных, так и у голосеменных растений (Huzulak, Elias, 1975; Chin, Sillett, 2019). Гетерофиллия на уровне срединных листьев побегов для растений Северо-Запада России проявляется обычно в увеличении расчлененности листовой пластинки на отдельные доли. Это наблюдается у растений со сложными листьями, таких как Acer negundo, Fraxinus excelsior, Sorbus aucuparia. Данное явление описано многими авторами (Serebryakov, 1962; Zaugol’nova, 1971; Korona, Vasilev, 2007).
У Acer platanoides L. в верхней части ростовых побегов имматурного возрастного состояния три верхние лопасти листа получают преобладающее развитие. Нижние доли развиты слабо. У зрелых генеративных растений (g2) все листья пятилопастные.
По мнению Curtis, Lestern (1978), для Populus grandidentata и ряда других деревьев характерно явление гетерофиллии, заключающееся в том, что форма и размер листовых пластинок, образующихся в результате разворачивания зимующих почек (преформация), существенно отличаются от формы и размера листьев, образующихся в ходе открытого роста (неоформация). Листья различаются также по количеству зубцов, размеру и расположению смолистых железок и экстрафлоральных нектарников, которые при этом имеют сходное анатомическое строение. Zimmerman и Brown (1971) отмечают, что большинство северных деревьев на укороченных и коротких побегах разворачивают только преформированные листья. На ростовых побегах эта группа “ранних листьев” может быть дополнена группой “поздних листьев”, отличающихся морфологически. При этом, первые один-два листа могут развиваться из примордия, инициированного в конце предыдущего периода роста, в связи с чем они габитуально похожи на ранние листья.
Гетерофиллия листьев на побеге рассматривается как стратегия, используемая растениями для приспособления к окружающей среде. Относительно недавно описана морфометрическая модель и создана вычислительная платформа на основе R, которая подтверждена для Prunus mume Siebold et Zucc. Это новый подход к исследованиям, направленным на анализ запрограммированной регуляции развития растений (Sun et al., 2018).
Морфологический анализ представителей рода Berberis L. из тропической и умеренной зон показал гетерофиллию трех вариантов: листья длинных побегов, листья коротких побегов и катафиллы в пазушных почках. Выявлены рудиментарные перисто-сложные листовые пластинки у Mahonia Nutt. Гетерофиллия у Berberidaceae генетически фиксирована и не зависит от окружающей среды (Pabon-Mora, Gonzalez, 2012).
Нами было проанализировано явление гетерофиллии у различных представителей секции Palmata. При рассмотрении двух видов гетерофиллии, онтогенетической и гетерофиллии зрелого возрастного состояния, у A. serrulatum необходимо учитывать, насколько это явление характерно для других видов секции. Для этого проанализированы описания и изображения листовых пластинок 36 видов секции (Huang, 1993; Xu et al., 2008). По литературным данным, секция объединяет около 40 видов (De Jong, 1976; Xu et al., 2008; Eom et al., 2011).
Изменение листовой пластинки в сторону уменьшения или увеличения количества лопастей всегда позиционировалось как присущая виду изменчивость. Формирование большего или меньшего количества лопастей листовой пластинки не связывалось у A. serrulatum с качественными функциональными характеристиками побегов (их удлиненностью и укороченностью). Проведенное исследование показывает, что у A. serrulatum эти признаки отчетливо коррелируют. Основная часть побегов имеет пятилопастные листья. Только на удлиненных ростовых побегах “захвата пространства” образуются трехлопастные листья, отличные по форме от таковых, формирующихся в ранних возрастных состояниях. Образование таких листьев происходит в дистальных частях удлиненных побегов после разворачивания, по крайней мере, двух пар пятилопастных листьев. Важно, что это явление имеет место только у генеративных особей и отсутствует у более молодых. У вида A. mioshanicum наблюдается сходная картина (Xu et al., 2008).
Полученные результаты по анатомическому строению разных по признакам лопастности и расположения в кроне листьев A. serrulatum сопоставимы с исследованием пластичности листьев на разных типах побегов трех видов хвойных, проведенных Chin, Sillett (2019).
ЗАКЛЮЧЕНИЕ
Исследование особенностей фенологических и отчасти ценотических свойств Acer serrulatum в условиях интродукции на Черноморском побережье Кавказа показало, что вид сохраняет многие свойства, сформированные в условиях естественного произрастания. Это наличие “капельницы”, красный цвет молодых листьев, осеннее окрашивание, высокая влаголюбивость взрослого организма и сильная зависимость от влажности воздуха и почвы на ранних стадиях развития, медленная скорость онтогенеза и др.
Морфологический аспект явления гетерофиллии рассмотрен у генеративных растений и в ранних онтогенетических состояниях. Гетерофиллию взрослых растений можно рассматривать с разных позиций: во-первых, филогенетически, т.е. сравнивая эволюционно более и менее продвинутые виды. Во-вторых, с учетом экологических свойств вида – более лопастные пластинки обладают большей фотосинтетической поверхностью и предпочтительнее в условиях сильного затенения.
Пятилопастной лист A. serrulatum лучше приспособлен к условиям затенения, чем трехлопастной. Это подтверждается морфолого-анатомическим строением листа, а именно, его большей площадью, малой толщиной столбчатого мезофилла.
Выявлено, что у A. serrulatum в средней части ростового побега соотношение крупное междоузлие–крупный лист не соблюдается, что связано с недоразвитием нижних лопастей пятилопастного листа. На основе такого побега на следующий год формируется плагиотропная ветвь с большой фотосинтетической поверхностью.
Сравнение высоты деревьев вечнозеленых и листопадных представителей секции Palmata показало, что у вечнозеленых кленов гетерофиллия в генеративном возрастном состоянии не обнаруживается. Выявлена тенденция формирования многолопастных листовых пластинок листопадных видов, имеющих наименьшую высоту в сообществах, по сравнению с другими кленами секции.
Гетерофиллия, выявленная у A. serrulatum на ранних стадиях онтогенеза, напрямую не связана с гетерофиллией зрелого возрастного состояния, что подтверждается иными пропорциями и формой листа, особенностями края листовой пластинки и “капельницы”. Для некоторых 8 видов секции Palmata гетерофиллия на ранних стадиях онтогенеза так же подтверждена. У A. palmatum эта разновидность гетерофиллии выражена слабее, и лист почти сразу приобретает форму зрелого. Однако, подробных материалов по описанию листовой серии в онтогенезе представителей секции Palmata очень мало. Поэтому, провести хотя бы первичное сравнение пока затруднительно.
Список литературы
[Antonova, Fatianova] Антонова И.С., Фатьянова Е.В. 2016. О системе иерархических уровней строения крон древесных растений умеренной зоны. – Бот. журн. 101 (6): 628–649.
Beaulieu A.L.H. de, Mechelynck A.L., Timacheff M. 2003. An Illustrated Guide to Maples. – Portland. Cambridge. 464 p.
[Bebiya et al.] Бебия С.М., Дебреци Ж., Рац И. 2000. Эколого-географические особенности голосеменных растений о. Тайвань. – Бюл. МОИП. Отд. биология. 105 (3): 45–51.
Chin A.R.O., Sillett S.C. 2019. Within crown plasticity in leaf traits among the tallest conifers. – Am. J. Bot. 106 (2): 174–186.
Critchfield W.B. 1970. Shoot growth and leaf dimorphism in Boston ivy (Parthenocissus tricuspidata). – Am. J. Bot. 57: 535–542.
Critchfield W.B. 1971. Shoot growth and heterophylly in Acer. – Journal of the Arnold Arboretum. 52: 248–266.
Curtis J.D., Lersten N.R. 1978. Heterophylly in Populus grandidentata (Salicacea) with emphasis on resin glands and extrafloral nectaries. – Am. J. Bot. 65 (9): 1003–1010.
[Dzhakoniya] Джакония Е.Ф. 2012. Клен мелкопильчатый – эндемик о. Тайвань как ценный древесный и декоративный вид на Черноморском побережье Кавказа. – Вестник Московского гос. ун-та леса. – Лесной вестник. 1: 139–142.
[Efimova, Antonova] Ефимова И.В., Антонова И.С. 2012. Развитие однолетних проростков Acer negundo L. в разных климатических и экологических условиях. – Вестник СпбГУ. Сер. 3. С. 31–37.
Eom H.J., Jong P.C. de, Chang C.S. 2011. A reappraisal of the Acer wilsonii complex and Related Species in China. – Korean Journal of Plant Taxonomy. 41 (4): 329–337.
[Fedorinova et al.] Федоринова О.И., Козловский Б.Л., Куропятников М.В. 2013. Результаты интродукции видов рода Acer L. в Ботаническом саду ЮФУ. – Изв. высших учебных заведений. Северо-Кавказский регион. Естественные науки. 4: 55–58.
[Furst] Фурст Г.Г. 1979. Методы анатомо-гистохимического исследования растительных тканей. М. 155 с.
[Ginkul] Гинкул С.Г. 1936. Интродукция и натурализация растений во влажных субтропиках СССР. – Изв. Батумского субтроп. Бот. сада. 1: 12–26.
Gong W.C., Liu Y.H., Wang C.M., Chen Y.Q., Martin K., Meng L.Z. 2020. Why are there so many plant species that transiently flush young leaves red in the tropics? // Frontiers in Plant Science. V. 11. P. 83.
Hayashida H. 2015. Maples and Japanese Culture. Available from: http://mohsho.image.coocan.jp/2006springE1.html. Last accessed 24.08.2019.
Huang T.-C., Editorial Committee of the Flora of Taiwan. (eds.). 1993. Flora of Taiwan. Vol. 3. 2-nd ed. Taipei, Taiwan.
Huzulak J., Elias P. 1975. Within-crown pattern of ecophysiological features in leaves of Acer campestre and Carpinus betulus. – Folia geobot. phytotax. 10 (4): 337–350.
IPNI 2019. International Plant Names Index. https://beta.ipni.org. Last accessed: 10 October 2019.
Jong P.C. de. 1976. Flowering and Sex Expression in Acer L. – A Biosystematic Study. Nederland. 202 p.
Jong P.C. de. 1994. Taxonomy and reproductive biology of maples. – In: Maples of the World. Portland. P. 69–103.
[Karpun et al.] Карпун Ю.Н., Адамов М.Г., Арнаутов Н.Н., Бардакова С.А., Бибкова Е.П., Бобров А.В., Бочкарева К.Н. и др. 2003. Каталог культивируемых древесных растений Северного Кавказа. Сочи. 100 с.
[Korona, Vasiliev] Корона В.В., Васильев А.Г. 2007. Строение и изменчивость листьев растений: основы модульной теории. Екатеринбург. 280 с.
[Metodika…] Методика фенологических наблюдений в ботанических садах СССР. 1975. М. 27 с.
Ogata K. 1967. A systematic study of the genus Acer. – Bull. Tokyo Univ. Forest. 63: 89–206.
Pabon-Mora N., Gonzalez F. 2012. Leaf Development, Metamorphic Heteroblasty and Heterophylly in Berberis s.l. (Berberidaceae). – Botanical Review. 78 (4): 463–489.
Pax F. 1886. Monographie der Gattung Acer. – Bot. Jahrb. Syst. 7: 177–263.
[Pilipenko] Пилипенко Ф.С. 1978. Иноземные деревья и кустарники на Черноморском побережье Кавказа. Итоги и перспективы интродукции. Л. 293 с.
POWO 2019. Plants of the World Online. Facilitated by the Royal Botanic Gardens, Kew. Available from: http://www.plantsoftheworldonline.org. Last accessed: 10 October 2019.
[Poyarkova] Пояркова А.И. 1933. Ботанико-географический обзор кленов СССР в связи с историей всего рода Acer L. – Тр. Бот. инст. АН СССР. Сер. I. С. 225–274.
[Richards] Ричардс П.У. 1961. Дождевой тропический лес. М. 448 с.
[Serebryakov] Серебряков И.Г. 1962. Экологическая морфология растений. М. 378 с.
[Serebryakova] Серебрякова Т.И. 1948. О ритме сезонного развития некоторых оранжерейных растений Ботанического сада Московского университета. – Вестн. Моск. ун-та. 3: 106–118.
[Shul’ts] Шульц Г.Э. 1981. Общая фенология. Л. 188 с.
Sun L., Wang J., Zhu X., Jiang L., Gosik K., Sang M., Sun F., Cheng T., Zhang Q., Wu R. 2018. HpQTL: a geometric morphometric platform to compute the genetic architecture of heterophylly. – Briefings in Bioinformatics. 19 (4): 603–612.
[Takhtajan] Тахтаджан А.Л. 1964. Основы эволюционной морфологии растений. М.-Л. 236 с.
[Wu] У Чжуан-да. 1959. Тайвань: Географический очерк. М. 329 с.
Xu T.Z., Chen Y.S., Jong P.C. de, Oterdoom H.J. 2008. Aceraceae. – In: Flora of China. Vol. 11. St. Louis: Missouri Botanical Garden Press. P. 515–553.
Yang K.C., Lin J.K., Hsieh C.F., Huang C.L., Chang Y.M., Kuan L.H., Su J.F., S.T. Chiu. 2008. Vegetation pattern and woody species composition of a broad-leaved forest at the upstream basin of Nantzuhsienhsi in mid-southern Taiwan. – Taiwania. 53: 325–37.
Yang K.C., Lin J.K., Wang Y.H., Hsieh C.F., Kuan L.H. 2010. Vegetation composition and structure in the ecotone between deciduous and evergreen broadleaf forests in an upstream region of Nantzuhsiensi, South-Central Taiwan. – Taiwan J. For. Sci. 25 (1): 39–50.
[Zaitsev] Зайцев Г.Н. 1981. Фенология древесных растений. М. 122 с.
[Zaugolnova] Заугольнова Л.Б. 1971. Анатомо-морфологическое строение листьев и почек у разных возрастных групп ясеня обыкновенного (Fraxinus excelsior L.). – Биологические науки. 9: 56–64.
Zimmerman M.H., Brown C.L. 1971. Trees: Structure and function. New York. 336 p.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


