Ботанический журнал, 2022, T. 107, № 11, стр. 1083-1099
ЭМБРИОЛОГИЯ HELIANTHUS MAXIMILIANI (ASTERACEAE)
О. Н. Воронова 1, *, М. К. Рязанова 2, **
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Профессора Попова, 2, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
* E-mail: o_voronova@binran.ru
** E-mail: rmari1605@gmail.com
Поступила в редакцию 05.05.2022
После доработки 07.09.2022
Принята к публикации 20.09.2022
- EDN: XSBNTY
- DOI: 10.31857/S0006813622110084
Аннотация
Helianthus maximiliani Schrad. – многолетние растения, с преобладанием вегетативного размножения (посредством корневищ) и угнетенным семенным размножением. Вид представляет интерес для селекции культурного подсолнечника (как источник ЦМС и других полезных свойств), однако является эмбриологически не изученным. Установлено, что основные репродуктивные процессы у H. maximilianii протекают сходно с таковыми у H. tuberosus, H. ciliaris и других видов Helianthus. Пыльники тетраспорангиатные, стенка пыльника развивается по двудольному типу. Сформированная стенка пыльника 4-слойная, стенка зрелого пыльника 2-слойная. Тапетум клеточный с реорганизацией в синцитий в постмейотическом периоде (по классификации Kamelina, 2002b, 2009) или типичный периплазмодиальный (по классификации Shamrov et al., 2021). Микроспорогенез симультантного типа. Тетрады микроспор в основном тетраэдральные. Зрелые пыльцевые зерна 3-клеточные, с шиповатой экзиной. Средний диаметр пыльцы 25.14 ± 0.11 мкм, фертильность составляет около 98%. Семязачаток анатропный, унитегмальный, медионуцеллятный (синдермальная вариация однослойная субвариация, по классификации И.И. Шамрова (Shamrov, 2008)), или неполностью тенуинуцеллятный, по классификации P.K. Endress (2011). Археспориальная клетка формируется из субэпидермальной клетки примордия семязачатка после двух периклинальных делений вглубь семязачатка с отделением базальных клеток, с последующим преобразованием в мегаспороцит (без отделения париетальных клеток). Тетрада мегаспор линейного типа, с функциональной халазальной мегаспорой. Зародышевый мешок Polygonum-типа, но 6-клеточный и 7-ядерный (реже – 6 ядерный) вследствие отсутствия заложения клеточной перегородки между двумя из трех клеток антипод и образованием двух антипод, одна из которых двуядерная (реже одноядерная с полиплоидным ядром). Только половина семязачатков трансформируются в семена, в которых формируются эндосперм нуклеарного типа и нормальный зародыш. В остальных случаях отмечено отсутствие или дегенерация женского гаметофита в сформированных семязачатках. Высказано предположение, что низкий уровень завязываемости семян у H. maximilianii связан с отсутствием процессов опыления и оплодотворения его цветков (вследствие самонесовместимости), а не с отклонениями в развитии его мужской и женской репродуктивных сфер.
Подсолнечник Максимилиана (Helianthus maximiliani Schrad.) – многолетний вид подсолнечника, родиной которого является центральная часть Северной Америки. Данные по эмбриологии и репродуктивной биологии этого вида практически отсутствуют в литературе. В то же время вид интересен для селекционно-генетических разработок. Как и ряд других подсолнечников, растущих в дикой природе, он обладает устойчивостью к болезням, которым подвержены культурные формы однолетнего подсолнечника (например, к ложной мучнистой росе Plasmopa rahelianthi) и рядом других полезных свойств. Дикие подсолнечники несут гены восстановления фертильности пыльцы, что используется для получения форм с цитоплазматической мужской стерильностью (Georgieva-Todorova, 1990, 1993; Seiler, 2007; Christov, 2013; Seiler et al., 2017). Одним из важных приемов, который используют для внедрения полезных генов в генотип культурного подсолнечника, является межвидовая гибридизация. Первыми были получены межвидовые гибриды с топинамбуром, а уже на их основе создавались многолетние хозяйственно-ценные гибридные формы подсолнечника (Shchibrya, 1936, 1941; Marchenko, 1939, 1968). В настоящее время в межвидовую гибридизацию вовлекаются и другие виды подсолнечника (Gavrilova, Anisimova, 2003; Breton et al., 2010, 2017; Anisimova, Gavrilova, 2012; Christov, 2013). Кроме того, H. maximiliani является декоративным растением (Gavrilova, Anisimova, 2003), благодаря его неприхотливости и засухоустойчивости он хорошо подходит для озеленения.
H. maximiliani, как и большинство многолетних подсолнечников, размножается преимущественно корневищами, а семенное размножение угнетено, что создает определенные проблемы для семеноводства, а также селекции и выведения новых сортов. Для выяснения причин низкой завязываемости семян у данного вида необходимы не только цитогенетические, но и эмбриологические исследования (Atlagić, 2004; Atlagić et al., 2012), в частности, подробное изучение процессов формирования его мужских и женских репродуктивных структур, что обусловило цели и задачи настоящего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор материала проводили с растений, выращиваемых на Интродукционно-карантином питомнике Кубанской опытной станции Федерального исследовательского центра Всероссийского института генетических ресурсов растений им. Н.И. Вавилова (КОС ВИР) (45°21'N, 40°80'E). Целые корзинки на разных стадиях развития собирали с разных растений одной делянки и фиксировали в смеси FAA. Обработку зафиксированного материала и изготовление постоянных препаратов для световой микроскопии осуществляли по общепринятой методике (Barykina et al., 2004). Препараты окрашивали несколькими красителями – толуидиновым синим, гематоксилином по Эрлиху с подкраской эозином или алциановым синим, гематоксилином по Гейденгайну с подкраской алциановым синим (Zhinkina, Voronova, 2000), реактивом Шиффа по Фельгену с подкраской алциановым синим и гематоксилином по Эрлиху (Kamelina et al., 1992).
Для исследования семязачатков также использовали метод тотальных просветленных препаратов (Voronova, 2008), а для оценки фертильности пыльцы использовали тотальные препараты, окрашенные ацетокармином (Voronova, Gavrilova, 2019).
Микрофотографии получали с помощью микроскопа Zeiss Axioplan 2 Imaging оснащенного цифровой фотокамерой AxioVision и программным обеспечением AxioVision 4.8 (Carl Zeiss). Подсчет пыльцевых зерен и оценку фертильности осуществляли с использованием программ ImageJ и Excell (Microsoft).
РЕЗУЛЬТАТЫ
Для подсолнечников характерно соцветие-корзинка, состоящее из язычковых и трубчатых цветков. Трубчатые цветки обоеполые. Андроцей состоит из пяти одинаковых тычинок, которые срастаются в трубку. Гинецей псевдомономерный, состоит из двух сросшихся плодолистиков, завязь нижняя, одногнездная, с единственным семязачатком.
Пыльники H. maximiliani тетраспорангиатные, гнезда объединены попарно в две теки. Формирование гнезд происходит в период, когда тычинки и пестик уже оформились и становятся заметными лопасти рыльца, что хорошо видно на поперечных срезах трубчатых цветков. Внешние (абаксиальные) микроспорангии развиваются чуть быстрее, чем внутренние (адаксиальные), и поэтому немного крупнее. На поперечном срезе они имеют характерный вид “бабочки” (рис. 1a, 2a, b).
Рис. 1.
Ранние стадии развития андроцея и начало формирования микроспор.
а – строение трубчатого цветка на стадии ранней дифференциации стенки пыльника на поперечном срезе (общий вид; видны рыльце, молодые тычинки и лепестки); b – часть тычинки, два гнезда пыльника (начало дифференциации слоев стенки пыльника, в адаксиальном микроспорангии – из двух слоев, в абаксиальном – из трех, с отделением слоя тапетума, поперечный срез); c–f – строение гнезда пыльника на продольном (с) и на поперечном (d–f) срезах (стенка пыльника преимущественно 3-слойная, четвертый – средний слой, в состоянии дегенерации, d – профаза, e – анафаза мейоза I, f – анафаза мейоза II).
e l – эпидермальный слой, en – эндотеций, m l – средний слой, msc – микроспороцит, pe – лепесток, p p c – первичная париетальная клетка, s – тычинка, s c – спорогенная клетка, s p с – вторичная париетальная клетка, st – рыльце, ta – тапетум. Масштабная линейка: а – 50, b–f – 10 мкм.
Fig. 1. Early stages of androecium development and the beginning of microspores formation.
a – structure of a tubular flower at the stage of early differentiation of the anther wall, cross section (general view; stigma, young stamens and petals are visible); b – part of a stamen, two anther locules (beginning of differentiation of the layers of the anther wall, in the adaxial microsporangium from two layers, in the abaxial one from three layers, with separation of the tapetum layer, cross section); c–f – structure of the anther locule in the longitudinal (c) and cross (d–f) sections (the anther wall is predominantly 3-layered, the fourth is the middle layer, at the state of degeneration, d – prophase, e – anaphase of meiosis I, f – anaphase of meiosis II).
e l – epidermal layer, en – endotheсium, m l – middle layer, msc – microsporocyte, pe – petal, p p c – primary parietal cell, s – stamen, s c – sporogenous cell, s p c – secondary parietal cell, st – stigma, ta – tapetum. Scale bars, µm: а – 50 µm; b–f – 10.
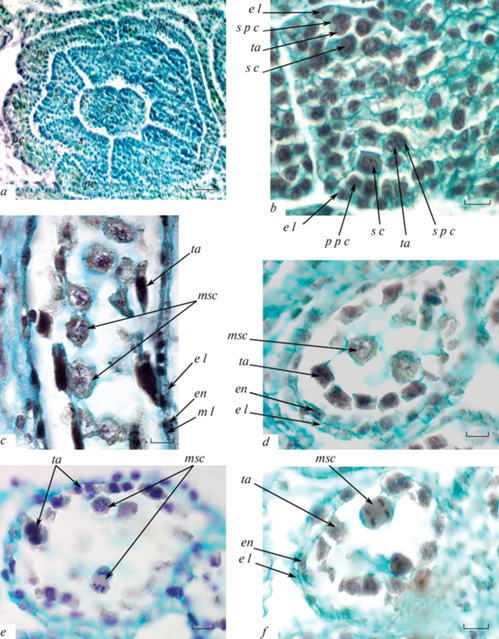
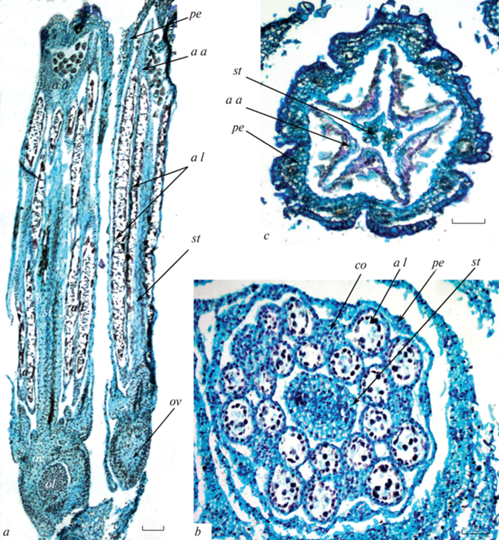
Рис. 2.
Трубчатый цветок на стадии мужского мейоза.
а – два трубчатых цветка, общий вид (продольный срез); b – трубчатый цветок, поперечный срез на уровне средней части пыльников, стенки соседних гнезд пыльников находятся в тесном контакте, c – трубчатый цветок, поперечный срез на уровне стерильных выростов пыльников.
a a – вырост пыльника, a l – гнездо пыльника, co – связник, ol – семязачаток, ov – завязь, pe – лепесток, st – рыльце. Масштабная линейка: а – 100 мкм, b, c – 50 мкм.
Fig. 2. Tubular flower at the stage of male meiosis.
а – two tubular flowers, general view (longitudinal section); b – tubular flower, cross section at the level of the middle part of the anthers, the walls of adjacent anther locules are in close contact, c – tubular flower, cross section at the level of sterile outgrowths of anthers.
a a – anther appendage, a l – anther locule, co – connectivum, ol – ovule, ov – ovary, pe – petal, st – stigma. Scale bars, µm: а – 100, b, c – 50.
Тычиночная нить иннервирована единственным пучком, продолжающимся в массивный связник. Она намного короче, чем пыльник по длине, и такое соотношение сохраняется до цветения. В верхней части пыльники имеют длинные выросты, являющиеся продолжением верхней части гнезд, но состоящие из стерильной ткани (рис. 2a, c). Максимального размера выросты достигают на стадии образования микроспороцитов.
Стенка пыльника формируется в несколько этапов. На самых ранних этапах развития (в примордиях гнезд пыльников) стенка пыльника представлена эпидермисом, под которым дифференцируются клетки мужского археспория (рис. 1a). Далее клетки археспория делятся периклинально, с отделением наружу слоя первичных париетальных клеток, а внутрь – спорогенных, формируя спорогенную ткань. С внутренней стороны микроспорангия париетальный слой образуется за счет деления клеток микроспорангия, расположенных рядом со спорогенными клетками. В результате повторных периклинальных делений клеток первичного париетального слоя формируется 2 новых слоя: вторичный париетальный слой и тапетум (рис. 1b). Тапетум дифференцируется первым. Периклинальные деления клеток вторичного париетального слоя дают начало эндотецию и среднему слою. Сформированная стенка микроспорангия включает четыре слоя – эпидермис, эндотеций, средний слой и тапетум. Средний слой – эфемерный и быстро подвергается деструкции, вследствие чего уже к концу премейотического периода он представлен лишь остатками отдельных клеток (рис. 1с).
В премейотическом периоде развития пыльника происходит увеличение количества спорогенных клеток, а также деление и рост клеток слоев стенки его гнезд. В эпидермисе рост наблюдается преимущественно за счет растяжения клеток, в эндотеции – за счет деления, что приводит к увеличению количества его клеток. В клетках тапетума делятся ядра, но перегородки не формируются, что приводит к их многоядерности. Клетки тапетума увеличиваются в размерах, но рост тапетального слоя идет не так интенсивно, как внешних слоев пыльника. Внешняя часть микроспорангия (эпидермис, эндотеций) растет быстрее внутренней (тапетум, спорогенная ткань). Граничащий с тапетумом средний слой к этому моменту полностью дегенерирует. Это все приводит к тому, что по линии бывшего среднего слоя клетки тапетума отслаиваются от остальной стенки пыльника и остаются в центре полости пыльника вместе с микроспороцитами (рис. 1c, d).
В дальнейшем спорогенные клетки преобразуются в микроспороциты. Микроспороциты имеют крупные размеры и неправильную форму, близкую к шароообразной или многоугольной, на их клеточных стенках начинается отложение каллозы, которая хорошо заметна благодаря окрашиванию алциановым синим (рис. 1c, d).
В конце премейотического периода начинается объединение всех пяти пыльников в тычиночную (пыльниковую) трубку. Пыльники расположены в цветке плотно и контактируют друг с другом своими микроспорангиями – это приводит к тому, что эпидермальные слои соседних структур слипаются и остаются единым целым даже после фиксации и обработки материала, что четко видно на поперечных срезах пыльников (рис. 2b).
В мейотический период пыльник интенсивно увеличивается в объеме и начинается изоляция микроспороцитов друг от друга. Микроспорогенез симультантного типа. После первого деления мейоза перегородка не образуется, цитокинез происходит после второго мейотического деления, с образованием тетрады микроспор, которая располагается внутри общей оболочки бывшего микроспороцита (рис. 1d, e, f, 3a, b). В большинстве случаев веретена делений мейоза II располагаются перпендикулярно друг к другу и формируются тетраэдральные тетрады микроспор (рис. 3a), но изредка встречается расположение делящихся ядер в одной плоскости (рис. 1f) и изобилатеральное положение микроспор в тетраде. Процесс дальнейшей дифференциации микроспор сопровождается образованием каллозных оболочек вокруг каждой микроспоры (рис. 3b). Аномалий в процессе мейоза не выявлено.
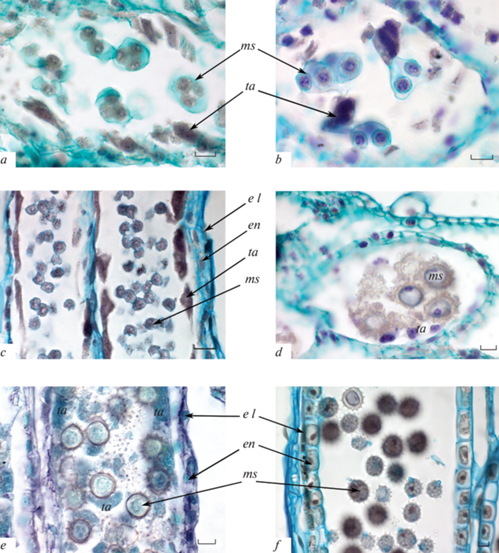
Рис. 3.
Строение пыльника на стадии завершения мейоза в микроспороцитах и начала формирования пыльцевых зерен.
a – телофаза мейоза II в микроспороцитах; b – распад тетрад на отдельные микроспоры; c – фрагмент пыльника на стадии полностью сформированных микроспор; d, e – пыльники с микроспорами на стадии вакуолизации, стенка пыльника трехслойная, тапетум реорганизуется в синцитий (d – поперечный срез, e – продольный срез); f – пыльник с формирующимися пыльцевыми зернами, тапетум полностью дегенерировал и стенка пыльника стала двухслойной.
el – эпидермальный слой, en – эндотеций, ms – микроспора, ta – тапетум. Масштабная линейка: а, b, d, e, f – 10, c – 20 мкм.
Fig. 3. Anther structure at the end of meiosis in microsporocytes, and the beginning of the pollen grains formation.
a – teleophase meiosis II in microsporocytes; b – disintegration of tetrads into separate microspores; c – anthers at the stage of fully formed microspores; d, e – anthers with microspores at the vacuolization stage, the anther wall is 3-layered, a tapetum is reorganized into syncytium (d – cross section, e – longitudinal section); f – anthers with forming pollen grains, the tapetum is fully degenerated and the anther wall became 2-layered.
el – epidermal layer, en – endotheсium, ms – microspore, ta – tapetum. Scale bars, µm: а, b, d, e, f – 10, c – 20.
В постмейотическом периоде тетрады микроспор в гнезде пыльника уже лежат свободно. Оболочка микроспороцита, окружающая тетрады, разрывается. Каллоза разрушается, и микроспоры высвобождаются из нее (рис. 3с).
В ходе постмейотического периода происходит окончательная реорганизация клеточного тапетума в синцитий (рис. 3d, e), затем остатки тапетума дегенерируют, и стенка пыльника становится двухслойной (рис. 3f, 4а, b). Стенка зрелого пыльника состоит из эпидермиса и эндотеция с фиброзными утолщениями (рис. 4e), которые участвуют в процессе вскрывания пыльников.
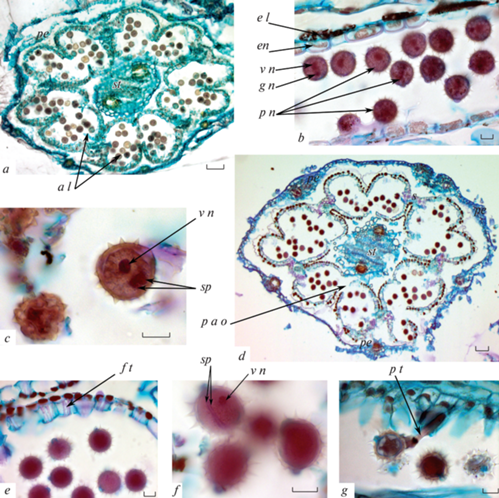
Рис. 4.
Формирование пыльцевых зерен.
a – трубчатый цветок, начало формирования пыльцевых зерен (поперечный срез); b – переход от одноклеточных микроспор к двуклеточным, начинает видоизменяться эндотеций, с – сформированное трехклеточное пыльцевое зерно; d – трубчатый цветок со зрелыми пыльцевыми зернами перед началом цветения (поперечный срез); e – формирование в эндотеции фиброзных утолщений; f – зрелое трехклеточное пыльцевое зерно; g – прорастающее пыльцевое зерно с вздувшейся пыльцевой трубкой.
a l – гнездо пыльника, e l – эпидермальный слой, en – эндотеций, f t – фиброзные утолщения, g n – генеративное ядро, pe – лепесток, p a o – область вскрытия пыльника, p g – пыльцевое зерно, p t – пыльцевая трубка, sp – спермий, st – рыльце, v n – вегетативное ядро. Масштабная линейка: a, d – 50, b, c, e, f, g – 10 мкм.
Fig. 4. Pollen grains formation.
a – tubular flower, the beginning of the pollen grains formation (cross section); b – transition from unicellular microspores to a 2-celled ones, endothecium begins changing; с – formed 3-celled pollen grain; d – tubular flower with mature pollen grains before flowering (cross section); e – formation of fibrous thickening in the endothecium; f – mature 3-celled pollen grain; g – germinated pollen grain with a swollen pollen tube.
al – anther locule, e l – epidermal layer, en – endothecium, f t – fibrous thickening, g n – generative nucleus, pe – petal, p a o – place of anther opening, p g – pollen grain, p t – pollen tube, sp – sperm cell, st – stigma, v n – vegetative nucleus.
Scale bars, µm: a, d – 50, b, c, e, f, g – 10.
Микроспора претерпевает два цикла митотических делений и цитокинеза. Первое деление заканчивается формированием крупной вегетативной и мелкой генеративной клеток, затем генеративная клетка делится с образованием двух спермиев, сначала мелких и округлых (рис. 4с), но постепенно видоизменяющихся до удлиненных и вытянутых (рис. 4f). Таким образом, зрелые пыльцевые зерна H. maximiliani трехклеточные. К моменту цветения длина спермиев уже превышает радиус пыльцевого зерна, поэтому они располагаются внутри пыльцевого зерна изогнувшись полукругом.
Одновременно с образованием гамет идет процесс формирования оболочки пыльцевого зерна, с образованием на экзине характерных для многих сложноцветных выростов в виде шипов (рис. 4b, c).
Аномалий в микрогаметофитогенезе выявлено не было.
В постмейотическом периоде в тычиночной трубке образуются разрывы между стенками соседних гнезд пыльников, что приводит к их объединению в общую крупную полость, состоящую из 4 гнезд (2 + 2) двух соседних пыльников (рис. 4a). Всего образуется пять полостей, каждая из которых вскрывается продольной щелью к центру цветка, где располагаются сложенные вместе рыльца пестика (рис. 4d). Во время цветения тычиночная трубка сначала быстро выдвигается вверх (за счет роста тычиночных нитей) и пыльца высыпается в пространство, появившееся на месте, где располагалось рыльце пестика. Во второй фазе цветения начинается рост рыльца, которое как поршень выталкивает всю пыльцу на вершину тычиночной трубки.
Оценка фертильности пыльцы ацетокарминовым методом выявила неоднородность в восприимчивости красителя цитоплазмой пыльцевых зерен: примерно 71% пыльцевых зерен имеют светло-розовый оттенок, около 27% имеют интенсивную карминно-красную окраску, доля неокрашенных стерильных зерен составляла 2%. Среднее значение диаметра пыльцы составляет 25.14 ± 0.11 мкм.
Специального исследования по оценке способности пыльцы к прорастанию in vivo не проводилось, но на единичных препаратах были отмечены на рыльце пестика проросшие пыльцевые зерна с неправильно растущими (короткими, булавовидными) пыльцевыми трубками (рис. 4g).
Семязачаток анатропный, медионуцеллятный, унитегмальный с интегументальным тапетумом. Поворот в анатропное положение завершает к моменту созревания зародышевого мешка.
Процессы формирования зародышевого мешка и развития семязачатка исследовались от стадии заложения примордия семязачатка до начальных этапов формирования семени.
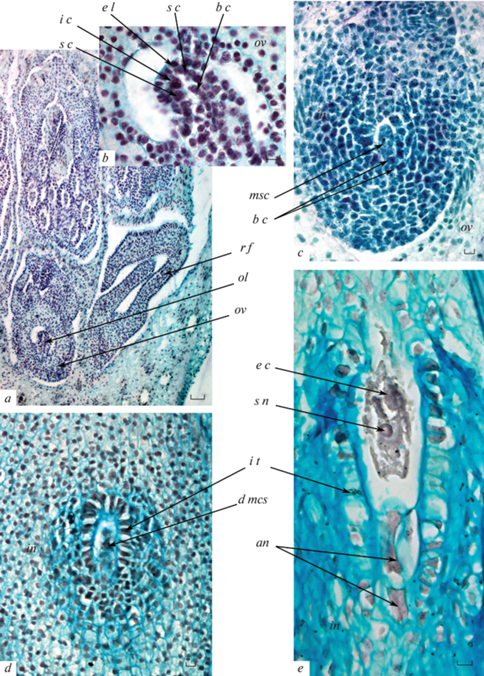
Археспориальная клетка формируется в примордии семязачатка из группы субэпидермальных (инициальных) клеток после двух периклинальных делений, приводящих к отделению вниз базальных клеток (рис. 5a, b). В дальнейшем археспориальная клетка дифференцируется в мегаспороцит без отделения париетальных клеток (рис. 5c). В результате мейоза образуется линейная тетрада мегаспор.
Рис. 5.
Формирование семязачатка и зародышевого мешка.
a – часть корзинки на стадии заложения инициальной клетки археспория в трубчатых цветках, b – семязачаток с инициальной клеткой археспория, c – семязачаток с формирующимся мегаспороцитом, d – часть семязачатка с интегументальным тапетумом и дегенерировавшим мегаспороцитом, e – часть семязачатка с интегументальным тапетумом и зрелым зародышевым мешком.
an – антипода, b c – базальная клетка, d msc – дегенерирующий мегаспороцит, e c – яйцеклетка, e l – эпидермальный слой, i c – инициальная клетка археспория, in – интегумент, i t – интегументальный тапетум, msc – мегаспороцит, ol – семязачаток, ov – завязь, r f – язычковый цветок, s c – спорогенная клетка, s n – вторичное ядро центральной клетки. Масштабная линейка: a – 50, b, c, d, e – 10 мкм.
Fig. 5. Formation of the ovule and embryo sac.
a – part of the head at the stage of formation of the initial cell of archesporium in tubular flowers, b – ovule with the initial cell, c – ovule with developing megasporocyte, d – part of the ovule with integumental tapetum and degenerated megasporocyte, e – part of the ovule with integumental tapetum and mature embryo sac.
an – antipodal cell, b c – basal cell, d msc – degenerating megasporocyte, ec – egg cell, e l – epidermal layer, i c – initial cell of archesporium, in – integument, i t – integumental tapetum, msc – megasporocyte, ol – ovule, ov – ovary, r f – row flower, s c – sporogenous cell, s n – secondary nucleus of the central cell. Scale bars, µm: a – 50, b, c, d, e – 10.
Аномалий в протекании женского мейоза обнаружено не было.
В процессе развития нуцеллуса можно выделить существование трех его областей: апикальной (эпидермис), латеральной (субэпидермальные клетки, расположенные вокруг археспориальной) и базальной (базальные клетки). Нуцеллус рано дегенерирует и к стадии сформированного зародышевого мешка представлен одним эпидермальным слоем (апикальная область) и единичными клетками в базальной области. Исходя из этого семязачаток может быть определен как медионуцеллятный (синдермальная вариация, однослойная субвариация, по классификации И.И. Шамрова (Shamrov, 2008), или не полностью тенуинуцеллятный (“incompletely tenuinucellar”, по классификации P.K. Endress (2011)).
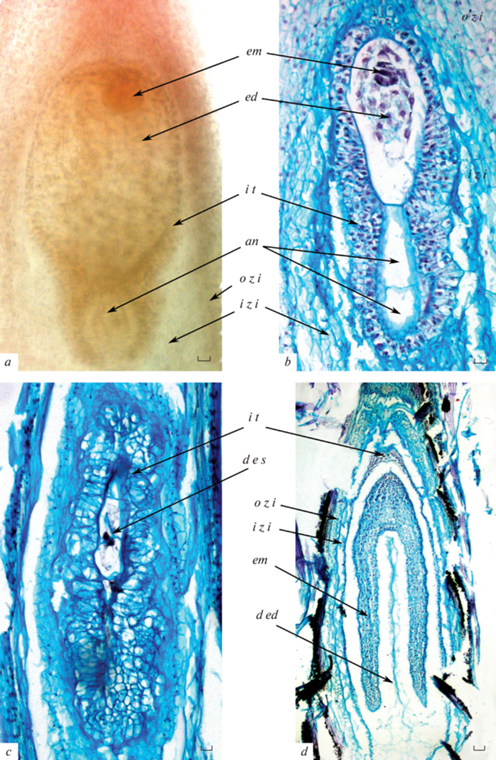
Интегумент дифференцируется на две зоны: внутреннюю – с интегументальным тапетумом, примыкающим к женскому гаметофиту, и разрушающимися крупными рыхлыми клетками с ослизняющимися оболочками, вытянутыми вдоль продольной оси семязачатка, и наружную – представленную упорядоченными рядами мелких клеток. Первые признаки формирования интегументального тапетума (эндотелия) появляются еще во время начала мейоза в мегаспороците, полностью сформированным он становится ко времени созревания зародышевого мешка (рис. 5e). К этому времени внешняя зона интегумента насчитывает 12–15 рядов мелких клеток, внутренняя – 5–7 рядов разрушающихся клеток с ослизняющими клеточными стенками. После оплодотворения внутренняя зона интегумента быстро разрушается, внешняя часть преобразуется в тонкую пленку, окружающую зародыш в семени (рис. 6a, b, d).
Рис. 6.
Формирование семени.
a – формирующиеся семя с глобулярным 4-клеточным зародышем и клеточным эндоспермом, b – формирующиеся семя с 8-клеточным зародышем, клеточным эндоспермом и с 4–5-слойным интегументальным тапетумом, c – часть семязачатка с остатками дегенерирующего зародышевого мешка, d – семя с торпедовидным зародышем, остатками эндосперма и интегументального тапетума.
an – антипода, d e s – дегенерирующий зародышевый мешок, d ed – дегенерирующий эндосперм, ed – эндосперм, em – зародыш, in – интегумент, i t – интегументальный тапетум, i z i –внутренняя зона интегумента, o z i – внешняя зона интегумента. Масштабная линейка – 10 мкм.
Fig. 6. Formation of the seed.
a – developing seed with a globular 4-celled embryo and cellular endosperm, b – developing seed with an 8-celled embryo, cellular endosperm and a 4–5-layered integumental tapetum, c – part of the ovule with the remains of degenerating embryo sac, d – seed with torpedo-shaped embryo, remains of endosperm and integumental tapetum.
an – antipodal cell, d e s – degenerating embryo sac, d ed – degenerating endosperm, ed – endosperm, em – embryo, in – integument, i t – integumental tapetum, i z i – inner zone of integument, o z i – outer zone of integument. Scale bar – 10 µm.
Халазальная мегаспора дает начало зародышевому мешку Polygonum-типа. Однако, особенностью его формирования является отсутствие заложения клеточной перегородки между двумя из трех антиподальных ядер в процессе клеткообразования, вследствие чего сформированный зародышевый мешок является 6-клеточным 7-ядерным (реже – 6-ядерным), состоящим из яйцеклетки, двух синергид, слившегося ядра центральной клетки и двух антипод (рис. 5e). Антиподы расположены линейно; одна из них, ближайшая к центральной клетке, является двуядерной или имеет единственное полиплоидное ядро, образующееся в результате слияния двух ее исходных ядер.
Были выявлены единичные случаи полного отсутствия в семязачатке женского гаметофита. В этих случаях в центре семязачатка, под слоем эпидермиса, присутствовали несколько сжатых клеток без выраженной структуры, которые, вероятно, представляли собой дегенерирующий мегаспороцит и остатки лизирующихся клеток нуцеллуса, окруженные слоем клеток интегументального тапетума (рис. 5d).
Примерно в половине исследованных завязей наблюдалось формирование семян с зародышем от глобулярной до торпедовидной стадии развития (рис. 6a, b, d). В остальных завязях присутствовали семязачатки со стареющими зародышевыми мешками с признаками деструкции (рис. 6с).
При отсутствии оплодотворения зародышевый мешок сохраняется в течение длительного времени, при этом клетки интегументального тапетума продолжают делиться, и он становится все более многослойным (рис. 6с).
Эндосперм нуклеарный, клеткообразование начинается на ранних стадиях эмбриогенеза – на стадии 8-клеточного зародыша можно наблюдать уже 16–32-клеточный эндосперм (рис. 6b). На ранних этапах развития деления клеток эндосперма происходят интенсивно, что приводит к образованию его многоклеточной ткани. Однако, начиная со стадии сердечковидного зародыша, в нем начинаются процессы деструкции и на стадии торпедовидного зародыша эндосперм почти полностью дегенерирует (рис. 6d).
ОБСУЖДЕНИЕ
Полученные эмбриологические данные сравнивались с результатами, описанными ранее для других многолетних видов подсолнечника. Процессы формирования репродуктивных структур у H. maximiliani идут сходно с таковыми у H. tuberosus L. и H. ciliaris DC (Babro, Voronova, 2018; Voronova, Babro, 2018, 2021) и у других многолетних видов подсолнечника (Dziubenko, 1965; Toderich, 1988; Kamelina, 2009 и др.).
Формирование в пыльнике четырех микроспорангиев, объединенных попарно в две, теки, а также несколько большие размеры микроспорангиев с абаксиальной стороны пыльника по сравнению с адаксиальными (обращенными к пестику) характерно не только для видов рода Helianthus, но для видов многих других семейств цветковых растений (Eupomatiaceae, Ceratophyllaceae и другие) (Kamelina, 2002a).
Стенка пыльника развивается согласно Solanaceae-типу (Batygina et al., 1963), или по типу двудольных (Davis, 1966), или центробежному типу (Teryokhin et al., 1993). При этом способе формирования первым из внутреннего париетального слоя дифференцируется тапетум, затем деления в субэпидермальном (наружном париетальном) слое приводят к образованию эндотеция и среднего слоя.
Существуют разные точки зрения на то, как именно происходят самые первые этапы формирования стенки микроспорангия у цветковых растений. Основным дискуссионным моментом является вопрос о происхождении слоев стенки микроспорангия с адаксиальной (внутренней) стороны. Л.Н. Константинова (Konstantinova, 1980) отмечала, что клетки внутреннего тапетума (со стороны связника) у подсолнечника отличаются от наружной его части по происхождению и после обработки соцветий гиббереллином выявлялось сильное разрастание клеток именно внутреннего тапетума. К.Н. Тодерич (Toderich, 1988) описывала, что у подсолнечника тапетум двойного происхождения: клетки с наружной стороны являются продуктом деления первичного париетального слоя, а с внутренней – выделяются из меристемы связника, расположенной под археспорием. И.И. Шамров с соавторами (Shamrov, 2006, 2008, Shamrov, Babro, 2008; Shamrov et al., 2021) полагает, что в субэпидермальном слое формирующегося микроспорангия идет выделение инициальных клеток (центральной и латеральных), из которых образуются все области стенки микроспорангия. Наши исследования позволяют нам присоединиться к этой точке зрения. У H. maximiliani, как и ряда других видов подсолнечника (Babro, Voronova, 2018), мы выявили двойственную природу париетального слоя, и тапетума (из центральных и латеральных инициалей). Внешняя и внутренняя части этих тканей различаются по происхождению, но в развитии объединяются в единый концентрический слой.
В пределах одного микроспорангия процессы микроспорогенеза протекают асинхронно. На последовательных поперечных срезах одного пыльника можно наблюдать все стадии мейоза. Подобная асинхронность мужского мейоза отмечалась ранее у H. tuberosus (Tatintseva, 1971; Babro, Voronova, 2018), H. ciliaris (Babro, Voronova, 2018), а также у других цветковых растений, например, у Spheaerophysa (Kamelina et al., 1990). Поскольку во время мейоза микроспороциты наиболее чувствительны к воздействию неблагоприятных факторов, то асинхронность клеточных делений – один из способов реализации системы надежности в репродуктивной сфере (Grodzinskii, 1983).
Тапетум закладывается и формируется как клеточный, но в постмейотическом периоде, начиная со стадии распада тетрад микроспор, клеточные стенки тапетума разрушаются, что приводит к формированию отдельных протопластов с 2–4 ядрами. Таким образом, тапетум у H. maximiliani может быть определен, как клеточный с реорганизацией в постмейотическом периоде в ложный периплазмодий (по классификации Kamelina, 1980) или “синцитий” (по Kamelina, 2002b, 2009). По мнению И.И. Шамрова (Shamrov et al., 2019, 2021), тапетум у подсолнечника следует классифицировать как типичный периплазмодиальный, о чем свидетельствует весь комплекс признаков его развития (раннее разрушение клеточных стенок, слияние протопластов и их внедрение в полость микроспорангия, но не во время мейоза, а чуть позже – на стадии обособленных микроспор).
Формирование плазмодиального тапетума с момента появления шипов на оболочке пыльцевых зерен и его быстрая дегенерация отмечались у подсолнечника сорта Армавир (Konstantinova, 1980). Слияние клеток тапетума в плазмодий на стадии свободных микроспор и его полная дегенерация к стадии трехклеточного пыльцевого зерна отмечались также для других культурных форм подсолнечника (Gotelli et al., 2008). Подобное формирование тапетума описывалось и у других представителей рода Helianthus (Toderich, 1988; Babro, Voronova, 2018). В то же время виды различаются по времени реорганизации тапетума: у H. annuus на стадии окончания распада тетрад микроспор, у H. rigidus Desf. – на стадии вакуолизированной микроспоры, а у H. scaberimus Benth., по данным К.Н. Тодерич, утрата клеточной структуры тапетума так и не наблюдалась (Toderich, 1988). У H. ciliaris и H. tuberosus первые признаки реорганизации отмечались в конце II деления мейоза (Babro, Voronova, 2018), что немного раньше, чем у видов, изученных предыдущим автором. У H. maximiliani первые признаки реорганизации (смещение клеток тапетума из пристенного положения в сторону центра пыльника) также были отмечены в конце II деления мейоза, а полноценный периплазмодиальный тапетум наблюдался на стадии одноклеточного пыльцевого зерна.
Тетрады микроспор формируются по симультанному типу (Alimova, 2002).
У H. maximiliani не было выявлено нарушений в процессе микроспорогенеза, а также в развитии стенки пыльника. Это отличает его от изученных ранее других видов подсолнечника с различными нарушениями развития. Например, у культурного подсолнечника отмечены разнообразные нарушения, начиная с мейотической стадии: в микроспороцитах – аномалии мейоза, а в тапетальной ткани – ранняя дегенерация клеток, что может быть связано с воздействием высоких температур (выше 40°С) в период сбора материала (Tatintseva, 1971).
В других работах отмечалось, что отклонения в развитии микроспор выявляются после стадии разъединения тетрад: уже на одноядерной стадии микроспоры становятся морфологически неоднородными – среди пыльцы нормального размера встречаются карликовые и гигантские пыльцевые зерна, с очень крупными ядрами и несколькими ядрышками (Dzyubenko, 1965). Сходная картина наблюдалась у H. tuberosus, в меньшей степени у H. ciliaris – морфологическая неоднородность и аномалии в развитии пыльцы у которых проявлялись со стадии одноядерной невакуолизированной микроспоры (Babro, Voronova, 2018).
Пыльцевые зерна у H. maximiliani трехклеточные, как и у других подсолнечников (Toderich, 1988; Babro, Voronova, 2018; Voronova, Gavrilova, 2019), а также большинства других представителей семейства Asteraceae (Solntseva, 1987). Средний диаметр пыльцы сопоставим с другими дикими видами, например, пыльца у H. occidentalis в среднем 25–27 мкм в диаметре, несколько мельче у H. angustifolius L. и H. ciliaris – 20–22 мкм. Средний размер пыльцевых зерен у культурного подсолнечника находится в диапазоне 28–32 мкм. Крупные пыльцевые зерна отмечены у H. tuberosus, а у H. giganteus L. встречаются зерна размером более 40 мкм (Voronova, Gavrilova, 2019).
У H. maximiliani не отмечалось аномалий в формировании пыльцы, и, несмотря на некоторую неоднородность окрашивания и присутствия темноокрашенных и светлоокрашенных пыльцевых зерен, можно предполагать, что все они фертильны и считать общую фертильность пыльцы на уровне 98%.
Таким образом, исследуемый вид имеет довольно стабильный ход развития мужских генеративных структур и формирует высокофертильную пыльцу, следовательно, причина низкой завязываемости семян не связана с развитием мужской репродуктивной сферы и этот вид можно рекомендовать для использования в селекционных программах и межвидовых скрещиваниях в качестве отцовского родителя.
Семязачаток у H. maximiliani анатропный, унитегмальный с интегументальным тапетумом. По строению, процессу развития и дегенерации нуцеллуса семязачаток сходен с H. ciliaris и H. tuberosus (Voronova, Babro, 2018, 2021) и может быть так же классифицирован как медионуцеллятный (синдермальная вариация однослойная субвариация, по классификации И.И. Шамрова (Shamrov, 2008) или не полностью тенуинуцеллятный (“incompletely tenuinucellar” – по классификации P.K. Endress (2011)).
Морфологическое разделение интегумента на внешнюю и внутреннюю зоны, а также выделение интегументального тапетума характерно не только для подсолнечника H. annuus (Newcomb, 1973a, b), но отмечалась и у других представителей Asteraceae, например, у Taraxacum (Musial et al., 2013).
Обычно отмечают, что у культурных сортов и ряда диких видов подсолнечника интегументальный тапетум к моменту созревания зародышевого мешка однослойный, увеличение числа слоев происходит после оплодотворения (Newcomb, 1973a; Voronova, 2013; Voronova, Babro, 2018, 2021), а у некоторых гибридов культурного подсолнечника и линии НА89 его толщина может достигать до 6 слоев, особенно в области антипод (Gotelli et al., 2008). У H. maximiliani интегументальный тапетум к моменту созревания зародышевого мешка также, как правило, однослойный, но вскоре число его слоев увеличивается, и в случае отсутствия оплодотворения он становится особенно массивным (5–6 и более слоев). Сходная картина наблюдалась у H. ciliaris и H. tuberosus (Voronova, Babro, 2018, 2021). Можно предположить, что при отсутствии оплодотворения метаболиты, продолжающие поступать в семязачаток, утилизируются в интегументальном тапетуме, что приводит к наращиванию числа клеточных слоев.
Развитие зародышевого мешка, в целом, осуществляется по Polygonum-типу, за исключением числа закладывающихся антиподальных клеток. У H. maximiliani, как и у некоторых других ранее исследованных видов подсолнечника (Ustinova, 1964; Dzubenko, 1965; Newcomb, 1973a; Teleżyńska, Teleżyński, 1973; Gotelli et al., 2008; Voronova, Babro, 2018, 2021), отмечалось преимущественно формирование только двух линейно расположенных антипод (одна из них обычно двуядерная) и, соответственно, образование 6-клеточного зародышевого мешка.
Сформированный зародышевый мешок длительно сохраняется без изменений при отсутствии опыления. В исследованном нами материале отмечалось как формирование зародыша, так и старение и дегенерация зародышевого мешка.
Нам не удалось детально проследить весь путь формирования зародыша, но, согласно литературным данным, у исследованных ранее видов подсолнечника эндосперм нуклеарный, клеткообразование начинается на ранней стадии развития зародыша (4–8-клеточной, по данным Newcomb (1973b) и Toderich (1988)). Эмбриогенез осуществляется по Asterad-типу (Senecio-вариация), что отмечалось как для дикорастущих (Toderich, 1988), так и для культурных форм (Voronova, 2013).
В единичных случаях у H. maximiliani наблюдалось полное отсутствие зародышевого мешка. В литературе такие случаи отмечены у некоторых линий культурного подсолнечника (Voronova, 2013) и ряда его тетраплоидных форм (Efremov, 1967), а также у H. tuberosus (Voronova, Babro, 2021).
Примерно в половине исследованных семязачатков на поздних стадиях развития отмечалось отсутствие зародыша и эндосперма, при наличии стареющего, дегенерирующего зародышевого мешка и продолжающего развиваться многослойного интегументального тапетума. Вероятно, причиной отсутствия оплодотворения является самонесовместимость. В пользу этой гипотезы говорят выявленные нами картины нарушений прорастания пыльцы на рыльце пестика.
ЗАКЛЮЧЕНИЕ
Проведенное нами исследование не выявило каких-либо существенных отклонений в развитии мужской или женской репродуктивной сферы у Helianthus maximiliani. Для вида характерно формирование высокого процента фертильной пыльцы, а также преимущественно нормально развитых зародышевых мешков. Выявленные единичные случаи дегенерации женского гаметофита в семязачатках не могут являться причиной крайне низкого уровня завязываемости семян у данного вида. Низкий уровень продукции семян у H. maximiliani, вероятно, является следствием нарушений процессов опыления и оплодотворения у этого вида (вследствие самонесовместимости, и соответственно, отсутствия прорастания большей части пыльцы на рыльце пестика – при ограниченном числе растений и отсутствии возможности их перекрестного опыления). В пользу этой точки зрения свидетельствуют выявленные нами случаи аномального характера прорастания пыльцы на рыльце (с отклоняющейся структурой пыльцевых трубок), однако этот вопрос нуждается в дальнейших исследованиях с применением специальных методов.
Список литературы
Alimova G.K. 2002. Microspore tetrad. – In: Embryology of Flowering Plants: Terminology and Concepts. Vol. 1: Generative Organs of Flower. Enfield, Plymouth. P. 50–52.
[Anisimova, Gavrilova] Анисимова И.Н., Гаврилова В.А. 2012. Теоретические и прикладные аспекты отдаленной гибридизации у подсолнечника. – Сельскохозяйственная биология. 5: 88–99. https://doi.org/10.15389/agrobiology.2012.5.88rus
Atlagić J. 2004. Roles of interspecific hybridization and cytogenetic studies in sunflower breeding. – Helia. 27 (41): 1–24. https://doi.org/10.2298/hel0441001a
Atlagić J., Terzić S., Marjanović-Jeromela A. 2012. Staining and fluorescent microscopy methods for pollen viability determination in sunflower and other plant species. – Industrial Crops and Products. 35 (1): 88–91. https://doi.org/10.1016/j.indcrop.2011.06.012
[Babro, Voronova] Бабро А.А., Воронова О.Н. 2018. Развитие мужских репродуктивных структур у Helianthus ciliaris и H. tuberosus (Asteraceae). – Бот. журн. 103 (9): 1093–1108. https://doi.org/10.7868/S0006813618090028
[Barykina et al.] Барыкина И.П. Веселова Т.Д., Девятов А.Г. и др. 2004. Справочник по ботанической микротехнике. Основы и методы. М. 312 с. ISBN 5-211-06103-9.
[Batygina et al.] Батыгина Т.Б., Терехин Э.С., Алимова Г.К., Яковлев М.С. 1963. Генезис мужских спорангиев Gramineae и Ericaceae. – Бот.журн. 48 (8): 1108–1120.
Breton C., Serieys H., Bervillé A. 2010. Gene transfer from wild Helianthus to sunflower: topicalities and limits. – Oléagineux, Corps Gras, Lipides. 17 (2): 104–114. https://doi.org/10.1684/ocl.2010.0296
Breton C., Киру С.Д., Bervillé A., Анушкевич Н.Ю. 2017. Селекция топинамбура (Helianthus tuberosus L.) для нетрадиционного использования: ретроспектива, подходы и перспективы (обзор) – Сельскохозяйственная биология. 52 (5): 940–951. https://doi.org/10.15389/agrobiology.2017.5.940rus
Christov M. 2013. Contribution of interspecific and intergeneric hybridization to sunflower breeding. – Helia. 36 (58): 1–18. https://doi.org/10.2298/HEL1358001A
Davis G.L. 1966. Anther wall formation. – In: Systematic embryology of the Angiosperms. New York, London, Sydney. P. 8–11.
[Dzyubenko] Дзюбенко Л.К. 1965. Особливостi розвитку чоловiчного та жiночного гаметофiтiв топiнамбура (Helianthus tuberosus L.). – Укр. бот. журн. 22 (1): 43–53.
[Efremov] Ефремов А.Е. 1967. Морфологические и цитоэмбриологические особенности тетраплоидного подсолнечника. – Генетика. 11: 31–36.
Endress P.K. 2011. Angiosperm ovules: diversity, development, evolution. – Annals of Botany. 107 (9): 1465–1489.
[Gavrilova, Anisimova] Гаврилова В.А., Анисимова И.Н. 2003. Подсолнечник. СПб. 209 с.
Georgieva-Todorova J. 1990. Genetic and Cytogenetic Investigation of the Genus Helianthus L. Sofia. 132 p.
Georgieva-Todorova J. 1993. Interspecific hybridization and its application in sunflower breeding. – Biotechnology and biotechnology equipment. 7 (4): 153–157. https://doi.org/10.1080/13102818.1993.10818729
Gotelli M.M., Galati B.G., Medan D. 2008. Embryology of Helianthus annuus (Asteraceae). – Annales Botanici Fennici. 45 (2): 81–96. https://doi.org/10.5735/085.045.0201
[Grodzinskii] Гродзинский Д.М. 1983. Надежность растительных систем. Киев. 367 с.
[Kamelina] Камелина О.П. 1980. Сравнительная эмбриология семейства Dipsacaceae и Morinaceae. Л. 102 с.
Kamelina O.P. 2002a. Microsporangium. In: Embryology of Flowering Plants: Terminology and Concepts. Vol. 1: Generative Organs of Flower. Enfield, Plymouth. P. 40–41.
Kamelina O.P. 2002b. New approach to the classification of tapetum types. In: Embryology of Flowering Plants: Terminology and Concepts. Vol. 1: Generative Organs of Flower. Enfield, Plymouth. P. 28–32.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
[Kamelina et al.] Камелина О.П., Проскурина О.Б., Жинкина Н.А. 1992. К методике окраски эмбриологических препаратов. – Бот. журн. 77 (4): 93–96.
[Kamelina et al.] Камелина О.П., Хоролсурен Шухер, Проскурина О.Б. 1990. К эмбриологии Incarvillea potaninii (Bignoniaceae) и Sphaerophysa salsula (Fabaceae) флоры МНР. – Бот. журн. 75 (9): 1248–1261.
[Konstantinova] Константинова Л.Н. 1980. Цитологические нарушения развития пыльников при гаметоцидной мужской стерильности у подсолнечника (Helianthus annuus L.). – Труды по прикл. ботанике, генетике и селекции. 67 (3): 134–140.
[Marchenko] Марченко И.И. 1939. Пути выведения многолетнего и клубненосного подсолнечника. – Селекция и семеноводство. 5: 37–39.
[Marchenko] Марченко И.И. 1968. Топинамбур–подсолнечниковые гибриды и их цитологическое исследование. – Цитология и генетика. II (1): 41–48.
Musial K., Plachno B.J., Swiatek P., Marciniuk J. 2013. Anatomy of ovary and ovule in dandelions (Taraxacum, Asteraceae). – Protoplasma. 250 (3): 715–722. https://doi.org/10.1007/s00709-012-0455-x
Newcomb W. 1973a. The development of the embryo sac of sunflower Helianthus annuus before fertilization. – Can. J. Bot. 51: 863–878.
Newcomb W. 1973b. The development of the embryo sac of sunflower Helianthus annuus after fertilization. – Can. J. Bot. 51: 879–890.
[Shamrov] Шамров И.И. 2006. Морфологическая природа семязачатка и эволюционные тенденции его развития у цветковых растений. – Бот. журн. 91 (11): 1601–1636.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 350 с.
[Shamrov, Babro] Шамров И.И., Бабро А.А. 2008. Развитие и строение пыльника у Rhododendron schlippenbachii и R. luteum (Ericaceae). – Бот. журн. 93 (8): 61–80.
[Shamrov et al.] Шамров И.И., Анисимова Г.М., Бабро А.А. 2019. Формирование стенки микроспорангия пыльника и типизация тапетума покрытосеменных растений. – Бот. журн. 104 (7): 1001–1032. https://doi.org/10.1134/S0006813619070093
Shamrov I.I., Anisimova G.M., Babro A.A. 2021. Tapetum types and forms in Angiosperms. – Proceedings of the Latvian academy of science. Section B. 75: 167–179.
[Shchibrya] Щибря Н.А. 1936. Скрещивание топинамбура (Helianthus tuberosus L.) с подсолнечником (Helianthus annuus L.). – Докл. АН СССР. 2 (5): 189–192.
[Shchibrya] Щибря Н.А. 1941. Скрещивание топинамбура с подсолнечником. – Гибридизация. 1: 66–84.
Schilling E.E., Heiser C.B. 1981. Infrageneric Classification of Helianthus (Compositae). – Taxon. 30 (2): 393–403.
Seiler G.J. 2007. The potential of wild sunflower species for industrial uses. – Helia. 30 (46): 175–198. https://doi.org/10.2298/HEL0746175S
Seiler G.J., Qi L.L., Marek L.F. 2017. Utilization of sunflower crop wild relatives for cultivated sunflower improvement. – Crop Sci. 57: 1083–1101. https://doi.org/10.2135/cropsci2016.10.0856
[Solntseva] Солнцева М.П. 1987. Семейство Asteraceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae – Asteraceae. Л. С. 318–331.
[Tatintseva] Татинцева С.С. 1971. Развитие мужского гаметофита топинамбура (Helianthus tuberosus L.). – Изв. АН Туркменской ССР. Сер. Биол. 1: 14–21.
Teleżyńska J., Teleżyński H. 1973. Double fertilization in Helianthus. – Societatis Botanicorum Poloniae. XLII (2): 323–343. https://doi.org/10.5586/asbp.1973.025
[Teryokhin et al.] Терёхин Э.С., Батыгина Т.Б., Шамров И.И. 1993. Классификация типов стенки микроспорангия у покрытосеменных. Терминология и концепции. – Бот. журн. 78 (6): 16–24.
[Toderich] Тодерич К.Н. 1988. Эмбриология подсолнечника (Helianthus annuus, H. rigidus и другие): Дис. … канд. биол. наук. Л. 256 с.
[Ustinova] Устинова Е.И. 1964. Изменчивость женского гаметофита у подсолнечника (Helianthus annuus L.). – Бюл. МОИП. Отдел биологический. 69 (4): 111–117.
[Voronova] Воронова О.Н. 2008. Экспресс-анализ методом просветления и его использование в эмбриологии. – Бот. журн. 93 (10): 1620–1625.
Voronova O.N. 2013. Development of female reproduction structures and apomixis in some CMS lines of sunflower. – Helia. 36 (58): 47–60. https://doi.org/10.2298/HEL1358047V
[Voronova, Babro] Воронова О.Н., Бабро А.А. 2018. Ранние этапы формирования женских репродуктивных структур у Helianthus ciliaris и H. tuberosus (Asteraceae). – Бот. журн. 103 (4): 488–504. https://doi.org/10.1134/S0006813618040051
[Voronova, Babro] Воронова О.Н., Бабро А.А. 2021. Формирование зародышевого мешка, развитие семязачатка и семени у Helianthus ciliaris и H. tuberosus (Asteraceae). – Бот. журн. 106 (3): 239–254. https://doi.org/10.31857/S0006813621030091
[Voronova, Gavrilova] Воронова О.Н., Гаврилова В.А., 2019. Количественный и качественный анализ пыльцы подсолнечника (Helianthus L.) и его использование в селекционной работе. – Труды по прикл. ботанике, генетике и селекции. 180: 95–104. https://doi.org/10.30901/2227-8834-2019-1-95-104
[Zhinkina, Voronova] Жинкина Н.А., Воронова О.Н. 2000. К методике окраски эмбриологических препаратов. – Бот. журн. 85 (6): 168–171.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


