Ботанический журнал, 2022, T. 107, № 3, стр. 237-246
ОСОБЕННОСТИ ТЕМПЕРАТУРНОЙ АДАПТАЦИИ PHAEODACTYLUM TRICORNUTUM, NITZSCHIA SP. И SKELETONEMA COSTATUM (BACILLARIOPHYCEAE) ПРИ РАЗНОЙ ОСВЕЩЕННОСТИ
Н. Ю. Шоман 1, *, А. И. Акимов 1
1 Федеральный исследовательский центр “Институт биологии южных морей имени А.О. Ковалевского РАН”
299011 Севастополь, пр. Нахимова, 2, Россия
* E-mail: n-zaichencko@yandex.ru
Поступила в редакцию 21.01.2021
После доработки 23.11.2021
Принята к публикации 14.12.2021
- EDN: JYHHUS
- DOI: 10.31857/S0006813622030048
Аннотация
Показано два типа адаптационного отклика фотосинтетического аппарата диатомовых водорослей на изменение температурных условий роста. Первый тип – температурно-зависимое изменение содержания хлорофилла в клетке, направленное на согласование скоростей световых и темновых реакций фотосинтеза (отмечен у Phaeodactylum tricornutum и Nitzschia sp. № 3). При лимитирующей рост интенсивности света снижение температуры от 20 до 5°С приводит к повышению начального угла наклона световой зависимости отношения углерода к хлорофиллу а (С/Хл) у обоих видов, тогда как в оптимальных световых условиях при снижении температуры от 20 до 10°С и от 10 до 5°С отношение С/Хл повышается в 1.5 раза. Второй тип отклика на изменение температурных условий роста отмечен у Skeletonema costatum, для которого содержание хлорофилла в клетке не зависит от температуры культивирования в диапазоне 10–20°С. Адаптация фотосинтетического аппарата в данном случае, вероятно, происходит за счет изменения активности ферментных систем и скорости протекания энзимных процессов. Потенциальная продуктивность всех исследуемых видов при 10°С, рассчитанная как прирост биомассы на единицу хлорофилла в сутки, достоверно не различается. В условиях светового ингибирования снижение температуры приводит к прогрессирующему уменьшению содержания хлорофилла в клетках всех исследуемых видов водорослей, что обусловлено снижением скорости синтеза пигмента на фоне его интенсивного фотоокисления.
Понимание механизмов адаптации фотосинтезирующих растений к изменяющимся условиям внешней среды до сих пор остается одним из основополагающих и актуальных вопросов современной гидробиологии. Выявление закономерностей изменения структурно-функциональных характеристик микроводорослей в зависимости от условий их роста важно для понимания закономерностей формирования первичной продукции в море, особенно с точки зрения прогнозирования этих процессов в условиях изменяющего климата на фоне возрастающего антропогенного воздействия на морские экосистемы. Результаты экспериментальных исследований физиологии морских микроводорослей необходимы также для построения точных моделей первичного продуцирования в море, а также при интерпретации данных мониторинга природных вод и в биотехнологии массового культивирования микроводорослей.
Температура является одним из основных абиотических факторов, влияющих на физиологическое состояние водорослей. Она влияет на скорость протекания ферментативных реакций в клетках, тем самым определяя интенсивность ключевых биологических процессов в клетках микроводорослей – роста, фотосинтеза и дыхания (Raven, Geider, 1988; Davison, 1991; Akimov, Solomonova, 2019). Многие представители фитопланктона способны существовать в широком диапазоне изменения температуры (эвритермные виды) и встречаются в планктонных сообществах разных географических широт и в разные сезоны года. Однако зона температурного оптимума, в пределах которого поддерживается максимальная скорость роста, для каждого вида обычно ограничена достаточно узким интервалом температур (Akimov, Solomonova, 2019). В то же время особенности адаптации фотосинтетического аппарата водорослей к изменению температурных условий роста могут определять конкурентные преимущества вида перед другими представителями фитопланктона. Ввиду этого температура выступает одним из факторов, определяющих сезонную сукцессию видов в водоеме (Richardson et al., 2000; Bardan, Serbov, 2013).
Немаловажным при исследовании физиологического отклика водорослей на изменение температуры является оценка роли других ключевых абиотических факторов, в частности освещенности, так как в природных условиях на рост водорослей действует целый комплекс факторов и, нередко, при изменении одного из них изменяется действие другого. Актуальность и новизна представленного исследования определяется существенными пробелами в знаниях о механизмах совместного действия интенсивности света и температуры на структурно-функциональные характеристики микроводорослей. К настоящему времени накоплен обширный материал об особенностях температурной адаптации водорослей при оптимальном уровне освещенности и обеспеченности минеральным питанием (Berges et al., 2002; Montagnes et al., 2003; Behrenfeld et al., 2005; Claquin et al., 2008). В то же время вопрос влияния температуры на основные структурно-функциональные характеристики водорослей, вегетирующих в условиях светового лимитирования и ингибирования недостаточно изучен, имеющиеся данные фрагментарны (Ottander et al., 1993; Finenko et al., 2003; Manhaeghe et al., 2019). Ввиду этого цель представленного исследования заключалась в изучении особенностей адаптационного отклика диатомовых водорослей на изменение температурных условий роста при разной интенсивности света.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования были выбраны альгологически чистые культуры морских диатомовых водорослей – Phaeodactylum tricornutum Bohlin, 1897, (штамм IBSS-41), “Nitzschia sp. № 3” в Прошкина-Лавренко (1955) (штамм IBSS-40), а также один штамм Skeletonema costatum Cleve, 1873, IBSS-53 – из коллекции культур микроводорослей и цианобактерий (IBSS) научно-образовательного центра коллективного пользования “Гидробионты мирового океана” (WDCM № 1201) ФИЦ ИнБЮМ РАН. Выбор штаммов обусловлен тем, что первые два из них, принадлежащие видам Phaeodactylum tricornutum и Nitzschia sp. № 3, обладают высокой жизнестойкостью при культивировании и часто используются в гидробиологических исследованиях в качестве модельных объектов. Все три исследуемых вида диатомовых водорослей являются представителями фитопланктона Черного моря, при этом Skeletonema costatum – один из доминирующих видов черноморского альгоценоза.
Оценку совместного действия света и температуры на структурно-функциональные характеристики водорослей проводили в 40 различных вариантах сочетания указанных факторов для каждого исследуемого вида. P. tricornutum и Nitzschia sp. № 3 культивировали при интенсивности света – 4, 14, 25, 42, 85, 225, 430, 600, 900 и 1200 мкЭ м–2 с–1 – и температуре: 5, 10, 20 и 25°С. Для S. costatum был выбран более узкий диапазон освещенности – 5, 16, 24, 35, 100, 115, 170, 240, 350 и 530 мкЭ м2 с–1, что связано с низкой толерантностью вида к действию света высокой интенсивности, и четыре варианта температуры: 5, 10, 15, 20°С. Культивирование S. costatum при температуре выше 23°С приводило к гибели водорослей. Приведенные в работе результаты представляют собой средние значения четырех аналитических повторностей для каждого из 40 вариантов опыта.
Водоросли в экспериментах культивировали в неаксеничных условиях на питательной среде F/2 (Andersen, 2005). Для создания необходимых условий освещения использовали световую решетку, представляющую собой закрытую конструкцию с отдельными ячейками для 20 склянок и независимым источником освещения (светодиод) для каждой из них. Освещение инкубационных склянок осуществлялось снизу. Различную освещенность создавали с помощью сетчатых фильтров, помещаемых между светодиодом и склянкой. Уровень освещенности определяли внутри склянок зондирующим 4П датчиком квантометра QSL 2101. Для создания необходимых температурных условий использовали термостатированный бокс на базе холодильной витрины, оборудованной температурным регулятором W3230. Величина рН культуральной среды находилась в пределах 8.2–8.4.
До начала эксперимента в течение трех суток каждую из культур водорослей предварительно адаптировали к исследуемой температуре при непрерывном освещении интенсивностью 35 мкЭ м–2 с–1, для создания которого использовали люминесцентные лампы белого света Oreol White/15 W. Затем культуры помещали на световую решетку с десятью различными интенсивностями света. Адаптацию водорослей к каждой освещенности проводили в течение еще трех суток. За указанный временной промежуток водоросли осуществляли как минимум два клеточных деления, после чего считались адаптированными к новым условиям освещения. После периода адаптации водоросли разбавляли свежей питательной средой до низкой плотности (концентрация углерода варьировала от 1 до 1.2 мг л–1), через сутки измеряли содержание углерода и хлорофилла а в каждой пробе.
В представленной работе для количественной оценки изменения внутриклеточной концентрации хлорофилла в различных световых и температурных условиях роста нами использовано соотношение между органическим углеродом и хлорофиллом а (С/Хл), отражающее относительное содержание хлорофилла у водорослей. Данное отношение – более информативный параметр, чем абсолютное содержание хлорофилла в единице объема, так как позволяет оценивать и сравнивать физиологическое состояние водорослей, вегетирующих в различных условиях роста. Кроме того, в практике гидробиологических исследований отношение С/Хл часто используют в качестве переходного коэффициента от измеренной концентрации хлорофилла к биомассе водорослей (Finenko et al., 2003; Behrenfeld et al., 2005).
Определение концентрации хлорофилла а в пробе проводили стандартным спектрофотометрическим методом. Для этого определенное количество суспензии водорослей фильтровали через стекловолокнистые фильтры Whatman (GF/C) диаметром 15 мм при вакууме не более 0.2 атмосфер. Осевшую на фильтре взвесь экстрагировали 90%-м раствором ацетона при температуре 8–10°С в течение 18–24 ч. Полученный экстракт центрифугировали при скорости 3000 об./мин в течение 10 минут, используя лабораторную центрифугу ОПН-3. Оптическую плотность ацетоновых экстрактов определяли на двухлучевом регистрирующем спектрофотометре Specord UV-VIS (KarlZeissJena). Расчет концентрации хлорофилла а проводили по формуле (Jeffrey, Humphrey, 1975):
Концентрацию углерода в пробе определяли путем измерения оптической плотности суспензии клеток при длине волны 750 нм на спектрофотометре СФ-26 (Gevorgiz, Shchepachev, 2008). Предварительно для каждого вида была проведена калибровка значений оптической плотности и содержания углерода, измеренного методом газо-адсорбционного хроматографического анализа на CHN-анализаторе CHN-1 (Grasshoff et al., 1983). Калибровочные графики приведены ранее в работе (Shoman, Akimov, 2013). Для проверки достоверности получаемых результатов для выборочных проб проводили параллельное измерение содержания углерода по оптической плотности и методом газо-адсорбционного хроматографического анализа на газоанализаторе CHN-1.
Удельную скорость роста микроводорослей рассчитывали по приросту углерода в пробе по уравнению, приведенному в работе (Finenko, Lanskaya, 1971):
где μ – удельная скорость роста, сут–1; Сo и Сt – исходная концентрация углерода в пробе и его количество через время t, мг л–1; t – время между измерениями в сутках.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По результатам проведенного экспериментального исследования выявлено два типа адаптационного отклика фотосинтетического аппарата водорослей на изменение температурных условий роста. Первый – это температурно-зависимое изменение содержания хлорофилла в клетке. Как известно, концентрация фотосинтетических пигментов, в частности хлорофилла а, в растительной клетке определяет ее способность поглощать световую энергию и является важнейшей характеристикой продукционных возможностей организма (Tihonov, 1999; Halsey, Jones, 2015; Li, Chen, 2015). В представленной работе, как уже было указано выше, для количественной оценки изменения внутриклеточной концентрации хлорофилла в различных световых и температурных условиях роста использовано соотношение между органическим углеродом и хлорофиллом а (С/Хл).
Первый тип температурной адаптации отмечен у P. tricornutum и Nitzschia sp. № 3. Минимальные значения отношения С/Хл в клетках P. tricornutum и Nitzschia sp. № 3 наблюдались при температуре 20°С, являющейся оптимальной для их роста во всем диапазоне освещенностей (рис. 1а, b). Как снижение, так и повышение температуры в эксперименте (относительно 20°С) приводило к уменьшению содержания хлорофилла и соответствующему ему увеличению отношения С/Хл в клетках водорослей.
Рис. 1.
Зависимость удельного содержания хлорофилла (С/Хл) у Phaeodactylum tricornutum (a), Nitzschia sp. № 3 (b) и Skeletonema costatum (c) от интенсивности света (без учета фотоингибирования) при температуре 5 (○), 10 (●), 15 (+), 20 (◊) и 25 (- -■- -) °С.
Fig. 1. Dependence of the specific chlorophyll content (С/Хл, mg mg–1) in Phaeodactylum tricornutum (a), Nitzschia sp. № 3 (b) and Skeletonema costatum (c) from light intensity (excluding photoinhibition) at temperature 5 (○), 10 (●), 15 (+), 20 (◊) and 25 (- -■- -) °С.
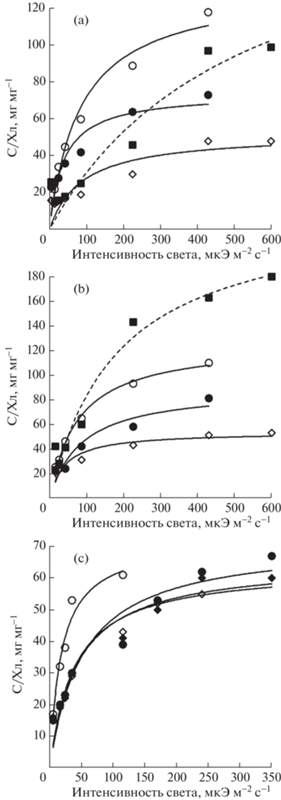
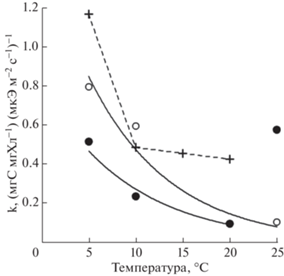
На начальном участке зависимости С/Хл-свет величина отношения С/Хл повышалась пропорционально увеличению освещенности при всех исследуемых температурах. Для данного участка световой кривой характерна максимальная скорость изменения внутриклеточной концентрации хлорофилла, отражающая адаптационные трансформации в фотосинтетическом аппарате водорослей в ответ на изменение световых условий роста. Это связано с тем, что основной “задачей” клетки при адаптации к свету слабой интенсивности является повышение вероятности захвата фотонов света, что в первую очередь достигается путем увеличения количества светособирающих пигментов, в частности хлорофилла а (Halsey, Jones, 2015). Снижение температуры в эксперименте приводило к повышению начального угла наклона (k) зависимости С/Хл-свет, что отражено на графиках веерообразной формой световых кривых при разной температуре (рис. 1а,b). Так, у P. tricornutum угол k экспоненциально возрастал от 0.1 (мгС мгХл–1) (мкЭ м–2 с–1)–1 при 20 и 25°С до 0.8 (мгС мгХл–1) (мкЭ м–2 с–1)–1 при 5°С, у Nitzschia sp. № 3 при снижении температуры от 20 до 5°С угол k повышался от 0.1 до 0.5 (рис. 2). При 25°С отмечено существенное различие в изменении описываемого параметра у P. tricornutum и Nitzschia sp. № 3. Так, у P. tricornutum значения угла k при 20 и 25°С не различались, а у Nitzschia sp. № 3 отмечено снижение начального угла наклона до значения, наблюдаемого при 5°С.
Рис. 2.
Влияние температуры на начальный угол наклона (k) световой зависимости отношения С/Хл у Phaeodactylum tricornutum (○), Nitzschia sp. № 3 (●) и Skeletonema costatum (+).
Fig. 2. Effect of temperature on the initial slope (k) of the C/Chl ratio light dependence in Phaeodactylum tricornutum (○), Nitzschia sp. № 3 (●) and Skeletonema costatum (+).
В оптимальных для роста водорослей световых условиях (область плато зависимости С/Хл-свет) снижение температуры культивирования от 20 до 10°С сопровождалось повышением отношения С/Хл в клетках примерно в 1.5 раза. При дальнейшем понижении температуры от 10 до 5°С С/Хл повышалось в среднем еще в 1.5 раза у обоих видов. Изменение температуры в эксперименте от 20 до 25°С приводило к повышению внутриклеточного отношения С/Хл в 2 раза у P. tricornutum и 3–3.5 раза у Nitzschia sp. № 3 (рис. 1а, b).
Адаптивные преобразования в клетке являются физиологическим откликом организма на меняющиеся условия роста и направлены на оптимизацию энергетического баланса, необходимого для поддержания скорости роста водорослей на максимально возможном уровне. Исходя из этого, снижение содержания хлорофилла в клетке при уменьшении или повышении температуры относительно ее оптимального значения следует интерпретировать как адаптивную реакцию, основанную на распределении клеточных ресурсов между не зависящими от температуры биофизическими реакциями (отвечают за сбор фотонов света) и температурно-зависимыми биохимическими реакциями (Tikhonov, 1999). Такой способ адаптации пигментной системы к меняющимся условиям роста характерен для большинства микроводорослей. Анализ имеющихся в литературе данных по температурно-зависимому изменению содержания хлорофилла у водорослей в условиях светового насыщения показал, что снижение температуры с 20–30 до 5–10°С приводит к повышению внутриклеточного отношения С/Хл примерно в 2–5 раз (Strzepek, Price, 2000; Behrenfeld et al., 2005; Carvalho et al., 2009; Chen et al., 2011). К примеру, при работе с Thalassiosira weissflogii было установлено, что в температурном диапазоне 21–29°С отношение С/Хл было практически постоянно, в то время как снижение температуры выращивания с 21 до 13°С сопровождалось линейным повышением С/Хл в 2–2.5 раза (Strzepek, Price, 2000). В исследовании (Geider, 1987) показано, что С/Хл в клетках водорослей повышается при низкой температуре и это повышение в большей степени проявляется при высокой освещенности: зависимость С/Хл от света линейна во всем диапазоне изменения освещенности, а угол наклона световых кривых, полученных при разной интенсивности света, экспоненциально возрастает со снижением температуры. Результаты же нашего исследования на примере P. tricornutum и Nitzschia sp. № 3 показывают, что в условиях светового насыщения интенсивность света и температура выступают как два независящих друг от друга фактора, а их совместное действие на изменение внутриклеточного отношения С/Хл носит аддитивный характер.
Другой тип адаптационного отклика на изменение температурных условий роста выявлен у S. costatum: снижение температуры культивирования с 20 до 10°С слабо влияло на внутриклеточное содержание хлорофилла. Так, значения отношения С/Хл, полученные у S. costatum при 10, 15 и 20°С, достоверно не различались, повышаясь с 16 при освещенности 5 мкЭ м–2 с–1 до 60–65 при 350 мкЭ м–2 с–1 (рис. 1с), начальный угол наклона световой зависимости отношения С/Хл составлял 0.4–0.5 (мгС мгХл–1) (мкЭ м–2 с–1)–1 (рис. 2).
Отметим, что при 5°С у S. costatum отмечено двукратное повышение начального угла наклона зависимости С/Хл-свет (рис. 1c). Ранее при работе с S. costatum нами установлено, что температура 5°С оказывает угнетающее действие на рост водорослей: снижение температуры от 10 до 5°С приводило к двукратному уменьшению начального угла наклона световой зависимости скорости роста S. costatum, отражающего эффективность роста водорослей в условиях светового лимитирования, наблюдалось раннее фотоингибирование роста и гибель культуры при интенсивности света 230 мкЭ м–2 с–1 (Shoman, Akimov, 2012). Дополнительным параметром, позволяющим оценить влияние температуры на функциональное состояние микроводорослей, является температурный коэффициент Вант-Гоффа Q10 (Q10 = ${{({{\mu }_{2}}{\text{/}}{{\mu }_{1}})}^{{10/({{{\text{t}}}_{2}} - {{{\text{t}}}_{1}})}}}$), где μ1 и μ2 – скорости роста при температурах t1 и t2 соответственно), количественно отражающий изменение скорости роста клеток при изменении температуры на 10°С. У S. costatum в температурном диапазоне 10 → 5°С коэффициент Q10 составил 5.5, в то время как значения Q10 = 2–3 соответствуют типовым величинам для биохимических реакций (Raven, Geider, 1988). Ввиду этого повышение внутриклеточного отношения С/Хл у S. costatum при 5°С, следует рассматривать как результат низкотемпературного хлороза в клетках, при котором нарушается образование молекул хлорофилла и снижается интенсивность фотосинтеза (Raven, Geider, 1988).
Согласно результатам экспериментального исследования (Akimov, Solomonova, 2019), среди видов диатомового комплекса зимне-весенней сукцессии фитопланктона Черного моря для S. costatum характерна максимальная скорость роста, как при низких, так и при высоких температурах. Высокая скорость роста S. costatum и независимость внутриклеточной концентрации хлорофилла от температуры могли бы объяснить превалирующее развитие вида в Черном море в зимне-весенний период. Однако проведенный в данном исследовании расчет показал, что несмотря на то, что снижение температуры от 20 до 10°С приводило к почти двукратному повышению С/Хл у P. tricornutum и Nitzschia sp. № 3 и не влияло на величину отношения у S. costatum, потенциальная продуктивность трех исследуемых видов водорослей при 10°С, рассчитанная как прирост биомассы на единицу хлорофилла в сутки (мг С/мг Хл сут–1), достоверно не различалась (рис. 3). Резкое снижение потенциальной первичной продукции S. costatum при 240 и 350 мкЭ м–2 с–1 обусловлено низкой толерантностью вида к действию света высокой интенсивности и ингибированием скорости роста водорослей при этой освещенности (Shoman, Akimov, 2012). Расчетная величина продуктивности косвенно отражает эффективность работы фотосинтетического аппарата водорослей в определенных условиях роста и показывает, что высокое содержание хлорофилла в клетках S. costatum при 10°С (по сравнению с другими исследованными видами) не приводит к увеличению продукционной способности вида. Адаптация фотосинтетического аппарата S. costatum к изменению температурных условий роста, вероятно, происходит за счет перестройки активности ферментных систем и скорости протекания энзимных процессов, в частности изменения каталитических свойств рибулозо-1.5-бисфосфаткарбоксилазы/оксигеназы (РуБисКо) (Gapochka, 1981; Bechet et al., 2013), при этом содержание пигментов в клетках остается неизменным. Известно, что температурная реакция каталитических свойств РуБисКо напрямую определяет способность фотосинтетических организмов к усвоению СО2, а также их выживаемость в средах с различными тепловыми условиями. При этом в ряде работ показана изменчивость температурных реакций РуБисКо в различных группах фотосинтезирующих организмов из теплых и холодных местообитаний (Galmes et al., 2015; Galmes et al., 2016). Высказано предположение, что каталитические свойства фермента РуБисКо могут быть связаны с оптимальной для фотосинтеза и роста температурой (Cavanagh and Kubien, 2013).
Рис. 3.
Потенциальная суточная продуктивность Phaeodactylum tricornutum, Nitzschia sp. № 3 и Skeletonema costatum при температуре 10°С, нормированная на хлорофилл.
Fig. 3. Potential daily productivity of Phaeodactylum tricornutum, Nitzschia sp. № 3 and Skeletonema costatum at a temperature of 10°C, normalized to the chlorophyll.

Отметим, что описанные выше закономерности изменения внутриклеточного отношения С/Хл соблюдаются при условии, что свет не оказывает угнетающее действие на функциональное состояние водорослей. При световом ингибировании у всех исследуемых видов снижение концентрации хлорофилла в клетках (повышение отношения С/Хл) происходило на фоне светозависимого снижения их скорости роста (рис. 4). При этом снижение температуры культивирования усиливало ингибирующее действие света на рост водорослей, приводя к прогрессирующему уменьшению внутриклеточного содержания хлорофилла. Так, при температуре 20°С P. tricornutum и Nitzschia sp. № 3 характеризовались высокой удельной скоростью роста (µ = 1–1.9 сут–1), а значения отношения С/Хл не превышали 100. При снижении температуры культивирования наблюдалось уменьшение скорости роста и значительное повышение величины С/Хл у водорослей. При этом высокие значения С/Хл (100–500) отмечались у клеток с низкой функциональной активностью – удельная скорость роста не превышала 0.5 сут–1. Аналогичные результаты получены и для S. costatum – замедление роста культуры (µ < 0.3 сут–1) в условиях фотоингибирования сопровождалось повышением значений С/Хл выше 100.
Рис. 4.
Зависимость между отношением С/Хл и удельной скоростью роста при различной температуре в световом диапазоне 225–1200 мкЭ м–2 с–1 у Phaeodactylum tricornutum (a), Nitzschia sp. № 3 (b) и 100–530 мкЭ м–2 с–1 у Skeletonema costatum (c).
Fig. 4. Relationship between C/Chl (С/Хл) ratio and specific growth rate at different temperatures in the light range 225–1200 mkE m–2 s–1 for Phaeodactylum tricornutum (a), Nitzschia sp. № 3 (b), and 100–530 mkE m–2 s–1 for Skeletonema costatum (c).
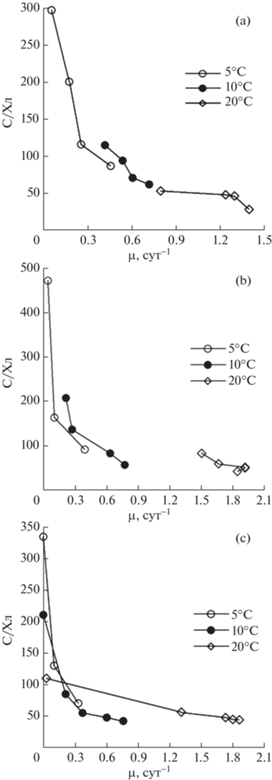
Температурно-зависимое изменение концентрации хлорофилла в клетках в условиях избыточного освещения определяется балансом между скоростями синтеза и разрушения пигмента. Известно, что биосинтез хлорофилла в растениях ─ строго координируемый температурно-зависимый процесс, включающий серию последовательных ферментативных реакций (Brzezowski, Grimm, 2013.). Увеличение чувствительности фотосинтетического аппарата клеток к действию света при понижении температуры может быть обусловлено рядом причин. Так, восстановление реакционных центров ФС II замедляется при низкой температуре, так как снижается соотношение между синтезом (скорость синтеза – температурно-зависимый процесс) и разрушением белка D1, интенсивность которого определяется количеством поглощенных квантов света и не зависит от температуры (Godde, 2018). Вторая причина – вегетация водорослей при низкой температуре приводит к снижению максимальной скорости фотосинтеза и тем самым увеличивает вероятность чрезмерного возбуждения ФС II при высокой освещенности, а также усиливается фотоиндуцируемое разрушение (окисление) молекул хлорофилла (Salama et al., 2018). Другой возможной причиной может быть то, что скорость процессов дезактивации активных форм кислорода, обеспечивающих защиту клетки от фотоингибирования, уменьшается при снижении температуры (Bischof, Rautenberger, 2012). Кроме того при низкой температуре уменьшается скорость синтеза вспомогательного пигмента – фотопротектора зеаксантина, используемого клеткой для рассеивания избыточной энергии в виде тепла (Han et al., 2000). Таким образом, при субоптимальных значениях интенсивности света и температуры изменение внутриклеточного содержания хлорофилла в большей степени регулируется скоростью разрушения молекул пигмента, чем адаптационными перестройками клеточных ресурсов для оптимизации скорости фотосинтеза.
ЗАКЛЮЧЕНИЕ
Результаты экспериментального исследования показали, что влияние температуры на основные структурно-функциональные показатели диатомовых водорослей зависит от световых условий роста культуры. При лимитирующей и оптимальной для роста освещенности отмечено два типа адаптационного отклика фотосинтетического аппарата водорослей на изменение температурных условий роста: 1) уменьшение внутриклеточной концентрации хлорофилла при снижении температуры, которое, как можно предполагать, направлено на балансирование скоростей световых и темновых реакций фотосинтеза (P. tricornutum, Nitzschia sp. № 3); 2) поддержание постоянного содержания хлорофилла в клетке независимо от температуры культивирования, при котором адаптация фотосинтетического аппарата, по-видимому, происходит за счет изменения активности ферментных систем и скорости протекания энзимных процессов (S. costatum). При этом потенциальная продуктивность всех исследуемых видов водорослей при 10°С, рассчитанная как прирост биомассы на единицу хлорофилла в сутки, достоверно не различается. В условиях светового ингибирования снижение температуры приводит к прогрессирующему уменьшению содержания хлорофилла в клетках всех исследуемых видов водорослей, что обусловлено снижением скорости синтеза пигмента на фоне его интенсивного фотоокисления. При субоптимальных значениях интенсивности света и температуры изменение внутриклеточного содержания хлорофилла в большей степени регулируется скоростью разрушения молекул пигмента, чем адаптационными перестройками клеточных ресурсов для оптимизации скорости фотосинтеза.
Список литературы
[Akimov, Solomonova] Акимов А.И., Соломонова Е.С. 2019. Характеристики роста и флуоресценции некоторых видов водорослей при акклимации к различным температурам в условиях культур. – Океанология. 59 (3): 347–359.
Andersen R.A. 2005. Algal culturing techniques.New York. 578 p.
[Bardan, Serbov] Бардан С.И., Сербов Н.Г. 2013. Формирование бимодального сценария сукцессии автотрофных компонент планктона в Баренцевом и Черном морях и оценка роли температурного фактора. – Вісник Одеського державного екологічного університету. 16: 90–114.
Béchet Q., Shilton A., Guieysse B. 2013. Modeling the effects of light and temperature on algae growth: state of the art and critical assessment for productivity prediction during outdoor cultivation. – Biotechnology Advances. 31 (8): 1648–1663.
Behrenfeld M., Boss E., Siegel D.A., Shea D.M. 2005. Carbon-based ocean productivity and phytoplankton physiology from space. – Global Biogeochemical Cycles. 19 (1): GB1006.
Berges J.A., Varela D.E., Harrison P.J. 2002. Effects of temperature on growth rate, cell composition and nitrogen metabolismin the marine diatom Thalassiosira pseudonana (Bacillariophyceae). – Marine Ecology Progress Series. 225: 139–146.
Bischof K., Rautenberger R. 2012. Seaweed responses to environmental stress: reactive oxygen and antioxidative strategies. – Ecological studies. 219: 109–132.
Brzezowski P., Grimm B. 2013. Chlorophyll metabolism. – eLS.
Carvalho A.P., Monteiro C.M., Malcata F.X. 2009. Simultaneous effect of irradiance and temperature on biochemical composition of the microalga Pavlova lutheri. – J. Appl. Phycol. 21: 543–552.
Cavanagh A.P., Kubien D.S. 2014. Can phenotypic plasticity in Rubisco performance contribute to photosynthetic acclimation? – Photosynth Res. 119: 203–214.
Chen M., Li J., Dai X., Sun Y., Chen, F. 2011. Effect of phosphorus and temperature on chlorophyll a contents and cell sizes of Scenedesmus obliquus and Microcystis aeruginosa. – Limnology. 12: 187–192.
Claquin P., Probert I., Lefebvre S., Veron B. 2008. Effects of temperature on photosynthetic parameters and TEP productionin eight species of marine microalgae. –Aquatic Microbial Ecology. 51 (1): 1–11.
Davison I.R. 1991. Environmental effects on algal photosynthesis: temperature. Minireview. – J. Phycol. 27: 2–8.
Finenko Z.Z., Hoepffner N., Williams R., Piontkovski S.A. 2003. Phytoplankton carbon to chlorophyll aratio: response to light, temperature and nutrient limitation. – Morskoy Ecologicheskiy Zhurnal. 2 (2): 40–64.
[Finenko, Lanskaya] Финенко З.З., Ланская Л.А. 1971. Рост и скорость деления водорослей в лимитированных объемах воды. – В кн.: Экологическая физиология морских планктонных водорослей (в условиях культур). Киев. С. 22–51.
Galmes J., Kapralov M.V., Copolovici L.O., Hermida-Carrera C., Niinemets U. 2015. Temperature responses of the Rubisco maximum carboxylase activity across domains of life: phylogenetic signals, trade-offs, and importance for carbon gain. – Photosynth. Res. 123: 183–201.
Galmes J., Hermida-Carrera C., Laanisto L., Niinemets U. 2016. A compendium of temperature responses of Rubisco kinetic traits: variability among and within photosynthetic groups and impacts on photosynthesis modeling. – J. Exp. Bot. 67 (17): 5067–5091.
[Gapochka] Гапочка Л.Д. 1981. Об адаптации водорослей. М. 80 с.
Geider R.J. 1987. Light and temperature dependence of the carbon to chlorophyll “a” ratio in microalgae and cyanobacteria: implication for physiology and growth of phytoplankton. – New Phytol. 106: 1–34.
[Gevorgiz, Shchepachev] Геворгиз Р.Г., Щепачев С.Г. 2008. Методика измерения оптической плотности суспензии низших фототрофов на длине волны света 750 нм. Севастополь. 11 с.
Godde D. 2018. Adaptations of the photosynthetic apparatus to stress conditions. – Plant Responses to Environmental Stresses. Routledge. P. 449–474.
Grasshoff K., Ehrhardt M., Kremling K. 1983. Methods of seawater analysis, 2nd rev. and extended ed. Weinheim. VerlagChemie. 419 p.
Halsey K.H., Jones B.M. 2015. Phytoplankton strategies for photosynthetic energy allocation. – Annual Review of Marine Science. 7: 265–297.
Han P., Virtanen M., Koponen J., Straskraba M. 2000. Effect of photoinhibition on algal photosynthesis: a dynamic model. – J. Plankton Res. 22 (5): 865–885.
Jeffrey S.W., Humphrey G.F. 1975. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. –Biochemie und Physiologie der Pflanzen. 167: 191–194.
Li Y., Chen M. 2015. Novel chlorophylls and new directions in photosynthesis research. – Funct Plant Biol. 42: 493–501.
Manhaeghe D., Michels S., Rousseau D.P., Van Hulle S.W. 2019. A semi-mechanistic model describing the influence of light and temperature on the respiration and photosynthetic growth of Chlorella vulgaris. – Bioresource Technology. 274: 361–370.
Montagnes D.J.S., Kimmance S.A., Atkinson D. 2003. Using Q10: Can growth rates increase linearly with temperature? – Aquatic Microbial Ecology. 32: 307–313.
Ottander C., Hundal T., Andersson B., Huner N.P.A., Öquistet G. 1993. Photosystem II reaction centers stay intact during low temperature photoinhibition. – Photosynthesis Research. 35 (2): 191–200.
[Proshkina-Lavrenko] Прошкина-Лавренко А.И. 1955. Диатомовые водоросли планктона Черного моря. М.; Л. 222 с.
Raven J.A., Geider R.J. 1988. Temperature and algal growth. – New Phytologist. 110 (4): 441–461.
Richardson T.L., Gibson C.E., Heaney S.I. 2000. Temperature, growth and seasonal succession of phytoplankton in Lake Baikal, Siberia. – Freshwater Biology. 44 (3): 431–440.
Salama E.S., Hwang J.H., El-Dalatony M.M., Kurade M.B., Kabra A.N., Abou-Shanab R.A., Jeon B.H. 2018. Enhancement of microalgal growth and biocomponent-based transformations for improved biofuel recovery: a review. – Bioresource technology. 258: 365–375.
[Shoman, Akimov] Шоман Н.Ю., Акимов А.И. 2012. Совместное действие света и температуры на удельную скорость роста диатомовой водоросли Skeletonema costatum. – В кн.: Сб. материалов ІІІ Междунар. конф. “Современные проблемы биологии, экологии и химии”. Запорожье. С. 61–62.
[Shoman, Akimov] Шоман Н.Ю., Акимов А.И. 2013. Действие света и температуры на удельную скорость роста диатомовых водорослей Phaeodactylum tricornutum и Nitzschia sp. № 3. – Морской экологический журнал. 12 (1): 85–91.
Strzepek R.F., Price N.M. 2000. Influence of irradiance and temperature on the iron content of the marine diatom Thalassiosira weissflogii (Bacillariophyceae). – Marine Ecology Progress Series. 206: 107–117.
[Tikhonov] Тихонов А.Н. 1999. Регуляция световых и темновых стадий фотосинтеза. – Соросовский образовательный журнал. 11: 8–15.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


