Ботанический журнал, 2022, T. 107, № 6, стр. 561-581
ФОРМИРОВАНИЕ СТЕНКИ ПЫЛЬНИКА У AEONIUM BALSAMIFERUM И A. CILIATUM (CRASSULACEAE)
Г. М. Анисимова 1, *, И. И. Шамров 1, 2, **
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, Наб. р. Мойки, 48, Россия
* E-mail: galina0353@mail.ru
** E-mail: ivan.shamrov@gmail.com
Поступила в редакцию 23.02.2022
После доработки 05.03.2022
Принята к публикации 29.03.2022
- EDN: SVLWUK
- DOI: 10.31857/S0006813622060035
Аннотация
У Aeonium balsamiferum и A. ciliatum выявлены черты сходства (признаки, характерные для семейства Crassulaceae) и различия в развитии и строении пыльника. Микроспорангии у A. ciliatum имеют округлую форму, а у A. balsamiferum овально-продолговатую. Вследствие этого септа между микроспорангиями тек оказывается протяженной у A. ciliatum и очень короткой у A. balsamiferum. У последнего вида пыльца может высыпаться как через стомиум, так и через апикальную пору (этот феномен обнаружен нами впервые у представителей сем. Crassulaceae), причем оба способа вскрывания тек осуществляются одновременно, что свидетельствует, вероятно, о большей специализации пыльника A. balsamiferum к опылению. Хотя наружный тапетум у обоих видов однослойный, его клетки одноядерные у A. ciliatum и 2-ядерные у A. balsamiferum. Внутренний тапетум обычно 1-слойный, редко нерегулярно 2-слойный, при этом его клетки в ходе развития увеличиваются в размерах в 2 раза у A. ciliatum и в 3–4 раза у A. balsamiferum (у последнего напоминают по строению папилловидные клетки).
В строении пыльника обнаружено сходство между родами Aeonium и Sedum. К ним относятся следующие: изобилатеральный (на поперечном срезе) пыльник с надсвязником, 4-лучевым связником и кольцевидным фиброзным слоем с внутренней стороны связника в нижней области, где нет срастания пыльника и тычиночной нити; 3-бороздно-оровые пыльцевые зерна, их поверхность – струйчатая. Полученные данные не противоречат кладистическим построениям, свидетельствующим о том, что виды полифилетического рода Sedum включаются в состав триб Aeonieae, Semperviveae и Sedeae. Изученные виды Aeonium balsamiferum и A. ciliatum, входящие в Aeonium-кладу, занимают промежуточное положение между кладами Telephium (Sedum kamtschaticum) и кладой Acre (S. palmeri).
Эмбриология представителей сем. Crassulaceae до сих пор изучена недостаточно. Ранее нами были исследованы некоторые виды родов Kalanchoe и Sedum. При рестриктазном анализе ДНК хлоропластов в семействе Crassulaceae выделяются 7 клад: Crassula, Kalanchoe, Telephium, Sempervivum, Aeonium, Leucosedum и Acre. Клада Kalanchoe является монофилетической и находится почти в основании филогенетического древа (Nikulin, Goncharov, 2017). Виды Kalanchoe laxiflora Baker, K. tubiflora (Harv.) Raym.-Hamet мало различаются как по строению пыльника, так и семязачатка (Anisimova, 2016; Anisimova, Shamrov, 2018). Структура полифилетического рода Sedum остается мало исследованной. Большинство его видов, включенных в трибу Sedeae, расположены между кластером Leucosedum и кладой Acre. Изученные нами виды относятся к кладам Acre (Sedum palmeri S. Watson) и Telephium (S. kamtschaticum Fisch.) (Anisimova, 2020; Anisimova, Shamrov, 2021a, b). Следует отметить, что некоторые виды рода Sedum (S. surculosum Cosson, S. atlantica Ball.) рассматривались в составе рода Monanthes, вероятного родственного таксона рода Aeonium. Последний включает около 40 видов (Mes et al., 1996, 1997). Именно наличие возможной филогенетической близости родов Sedum и Aeonium побудило нас провести исследование морфогенеза андроцея, развития и строения стенки пыльника у двух видов рода Aeonium.
МАТЕРИАЛ И МЕТОДИКА
Для исследования были выбраны два вида Aeonium: A. balsamiferum Webb et Berthel. (эониум бальзамический) и A. ciliatum (Willd.) Webb et Berthel (эониум реснитчатый). В природных условиях они являются эндемичными растениями Канарских островов (Mes et al., 1996).
Материалом для изучения послужили растения коллекции Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН. Изученные виды произрастают в условиях оранжереи.
Бутоны и цветки на разных стадиях развития фиксировали в смеси FAA (70° этиловый спирт, 40% формалин, ледяная уксусная кислота в пропорции 100 : 7 : 7). Затем проводили инфильтрацию парафином. Срезы толщиной 12 мкм окрашивали фуксин-сернистой кислотой по Фельгену (ядра клеток) с подкраской гематоксилином по Эрлиху (цитоплазма) и алциановым синим (клеточные стенки), сафранином по Картису, генциан–виолеттом по Ньютону с подкраской оранжем “G” в гвоздичном масле (Pausheva, 1974).
Постоянные препараты исследовали с помощью светового микроскопа Amplival (фирмы Carl Zeiss). Микрофотосъемка с препаратов проводилась с использованием светового микроскопа Axioplan-2 mot, камеры AxioCam MRc 5 и программы AxioVision 4.8 (фирмы Carl Zeiss). Рисунки выполнены с помощью рисовального аппарата. Живой и фиксированный материал исследовали с помощью бинокулярного микроскопов МБС-1 и Stemy. Строение пыльцевых зерен осуществлено с помощью сканирующего электронного микроскопа Jeol JSM-6390 LA в Центре коллективного пользования БИН РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Соцветие и цветок. У Aeonium balsamiferum и A. ciliatum цветки собраны в сложные цимозные соцветия. У A. balsamiferum они представлены как монохазиями, так и дихазиями (рис. 1, 2, 3). Структурной единицей соцветия является завиток, который является двойным в дихазиях. У A. ciliatum соцветия образованы преимущественно сложными дихазиями (рис. 1, 6). Число элементов цветка в пределах одного соцветия варьирует, при этом в одном цветке оно может быть кратным 8: 8 чашелистиков, 8 лепестков, 16 тычинок (8 наружного и 8 внутреннего кругов), 8 плодолистиков, 8 нектарников. В других случаях число элементов в кругах цветка может различаться: 9 чашелистиков, 9 лепестков венчика, 18 тычинок (9 наружного и 9 внутреннего кругов), но 8 плодолистиков и 8 нектарников. Проведенный анализ показал, что у A. balsamiferum доминируют цветки с числом элементов в кругах, равным 8 и 9. Отмечены в небольшом количестве цветки, число элементов в которых иное – 7 и 10. У A. ciliatum в большинстве цветков число элементов в кругах составляет 7. Выявлены цветки с числом элементов 5, 6 и 8.
Рис. 1.
Строение цветка и соцветия у Aeonium balsamiferum (1–3) и A. ciliatum (4–6).
Строение цветка: во время цветения (1), после опыления (5), тычинки и лепестки перед опылением (4). Строение соцветий: монохазий в форме завитка (2) и дихазий, представленный двойным завитком (3, 6). g – гинецей, p – лепесток, s – чашелистик, st – тычинка. Масштабная линейка, мм: 1.
Fig. 1. Structure of flower and inflorescence in Aeonium balsamiferum (1–3) and A. ciliatum (4–6).
Flower structure: during flowering (1), after pollination (5), stamens and petals before pollination (4). The structure of inflorescences: monochasium in the form of a cincinnus (2) and dichasium represented by a double cincinnus (3, 6). g – gynoecium, p – petal, s – sepal, st – stamen. Scale bar, mm: 1.

Цветок характеризуется двойным околоцветником. Чашечка и венчик – сростнолистные. Свободные лопасти чашечки треугольной формы (рис. 1, 6). Окраска венчика различается у изученных видов. У A. balsamiferum лепестки желтого (рис. 1, 1), а у A. ciliatum белого (рис. 1, 6) цвета.
Тычинка и пыльник. Как уже было отмечено, в цветках разного строения андроцей чаще всего состоит из 16 и 18 тычинок у A. balsamiferum, 14 тычинок у A. ciliatum (см. рис. 3, 1; 4, 1). Выявлены случаи с 10, 12 и 20 тычинками. Чаще всего они располагаются в 2 круга. Лепестки венчика и тычинки наружного круга находятся между лопастями чашечки. Тычинки внутреннего круга прикрепляются в средней части лепестков венчика (рис. 1, 4). Чашечка, венчик и тычинки андроцея долго сохраняются в цветке после опыления (рис. 1, 5).
Рис. 2.
Строение тычинок у Aeonium balsamiferum (продольные срезы).
Строение тычинки (1); образование группы густоплазменных клеток в апикальной части пыльника (2), их разрушение и образование полости, которая соединяет пространства обеих тек с пыльцой (3, 4), формирование клювовидной структуры и поры (5), вскрывшаяся пора (6). an – пыльник, p – пора, st f – тычиночная нить. Масштабная линейка, мкм: 1 – 50, 2, 8 – 20, 3, 4, 6 – 100, 5 – 10.
Fig. 2. Stamen structure in Aeonium balsamiferum (longitudinal sections).
Structure of the stamen (1); formation of a group of cells with dense cytoplasm in the apical part of the anther (2), their destruction and formation of a cavity to unite the spaces of both thecae with pollen (3, 4), formation of a beak-like structure and a pore (5), open pore (6). an – anther, p – pore, st f – stamen filament. Scale bars, µm: 1 – 50, 2, 8 – 20, 3, 4, 6 – 100, 5 – 10.
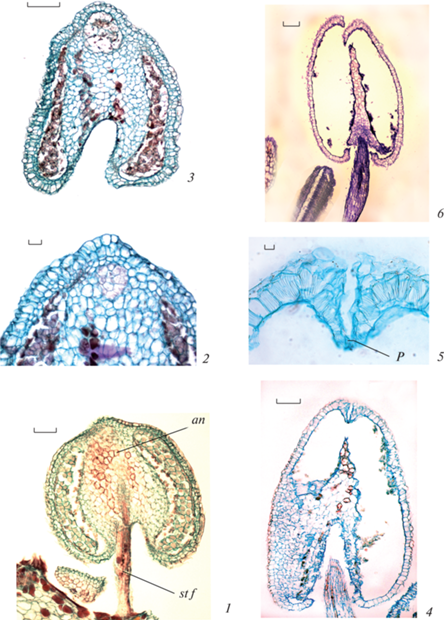
Рис. 3.
Строение тычинок у Aeonium ciliatum (2, 3 – продольные, 4–8 – поперечные срезы).
Число и положение тычинок в цветке (1); строение тычинок (2а, 2b), покрытых железистыми волосками (2а); апикальная часть пыльника вытягивается в клювовидную структуру, часть клеток связника разрушается, но полость не образуется и теки остаются свободными (2b, 3); строение пыльника в разных его частях: в области, сросшейся с тычиночной нитью (4), свободной от тычиночной нити (ближе к месту срастания – 5, в базальной части – 6); связник, видны клетки с танинами, а в центре проводящий пучок (7); вскрывшийся пыльник (8). an – пыльник, cn – связник, g h – железистый волосок, p – лепесток, s – чашелистик, st – тычинка, st f – тычиночная нить, v b – проводящий пучок. Масштабная линейка, мкм: 1 – 50, 2a – 150, 2b – 100, 3–6, 8 – 50, 7 – 20.
Fig. 3. Stamen structure in Aeonium ciliatum (2, 3 – longitudinal and 4–8 – transverse sections).
Number and position of stamens in a flower (1); structure of the stamens (2a, 2b) covered with glandular hairs (2a); the apical part of an anther extends into a beak-like structure, a part of cells of the connective tissue is destroyed, but the cavity is not formed and the thecae remain free (2b, 3); structure of the anther in its different portions: in the zone fused with the stamen filament (4), free from the stamen filament (5 – closer to the place of fusion, 6 – in the basal part); connective, cells with tannins are visible, in the center there is a vascular bundle (7); dehisced anther (8). an – anther, cn – connective, g h – glandular hair, p – petal, s – sepal, st – stamen, st f – stamen filament, v b – vascular bundle. Scale bars, µm: 1 – 50, 2a – 150, 2b – 100, 3–6, 8 – 50, 7 – 20.

В базальной части пыльник не срастается с тычиночной нитью (составляет примерно 1/3 его длины). Его края опускаются, напоминая шляпку гриба (рис. 2, 1; 3, 2б). К месту прикрепления на цветоложе тычиночная нить уплощается и становится продолговато-овальной (рис. 2, 6; 3, 1). Однако на уровне вхождения в пыльник она принимает цилиндрическую форму и расширяется по мере приближения к зоне срастания с ним. У A. ciliatum на поверхности тычинки формируются железистые волоски. Они имеют эпидермальное происхождение. На тычиночной нити волоски расположены густо, а на пыльнике редко (см. рис. 3, 2а). В центре тычиночной нити, состоящей из паренхимных клеток, проходит проводящий пучок (рис. 2, 1; 3, 3–8; 4, 2–5). Продолжением тычиночной нити, соединяющей теки пыльника, является связник, клетки которого вокруг проводящего пучка заполняются танинами. Позднее в некоторых из них появляются фиброзные утолщения (см. рис. 3, 5; 4, 2–5). Особый случай представляет образование кольцевидного фиброзного слоя с внутренней стороны связника в нижней области, где нет срастания пыльника и тычиночной нити (см. рис. 3, 5; 4, 4). В период микроспорогенеза развивается надсвязник. Апикальная часть пыльника округлая и слегка заостренная в области надсвязника (рис. 2, 1–3; 3, 2b).
В ходе развития, особенно при подготовке к вскрыванию, в апикальной части пыльника A. balsamiferum происходит образование группы густоплазменных клеток (рис. 2, 2), которые затем разрушаются. Образуется полость, обьединяющая пространства обеих тек с пыльцой (рис. 2, 3, 4). В итоге формируется клювовидная структура, в которой образуется пора, вскрывающаяся подобно стомиуму (рис. 2, 4). Перед открыванием края поры лишь сомкнуты, а в окружающих клетках эндотеция обнаруживаются фиброзные утолщения (рис. 2, 5). Пыльца может высыпаться как через пору, так и через стомиум. У A. ciliatum апикальная часть пыльника также вытягивается в клювовидную структуру, клетки связника между теками сохраняются, при этом полость не образуется, теки остаются свободными и пора не формируется. Поэтому пыльник у этого вида вскрывается только в области стомиума (рис. 3, 2–5, 8; 4, 3, 4).
Пыльники – тетраспорангиатные (рис. 3, 2–4; 4, 4–6). На ранних этапах развития они асимметричные, широкой (абаксиальной) частью направлены наружу, а узкой (адаксиальной) – внутрь (рис. 4, 2). Но постепенно размеры абаксиальных и адаксиальных микроспорангиев выравниваются, и пыльник на поперечном срезе напоминает изобилатеральную структуру (рис. 3, 5; 4, 2). Однако у A.ciliatum некоторые пыльники сохраняют форму “бабочки” (рис. 4, 4, 6; 7, 1а). У изученных видов выявлено особое строение связника. Его форма характеризуется 4 лучами, напоминая первичное тетрархное строение корня. Подобно тому, как в корне между лучами ксилемы располагается флоэма, в пыльнике между лучами связника находятся микроспорангии. У A. ciliatum они имеют округлую форму и, соответственно, септа между микроспорангиями тек оказывается протяженной (рис. 3, 4–6). У A. balsamiferum микроспорангии овально-продолговатые, а септа оказывается очень короткой (рис. 4, 2–4).
Рис. 4.
Строение тычинок у Aeonium balsamiferum (поперечные срезы).
Число и положение тычинок в цветке (1); строение пыльника в разных его частях: в области, сросшейся с тычиночной нитью (3), свободной от тычиночной нити (ближе к месту срастания – 4, в базальной части – 2); связник, видны клетки с танинами, с фиброзными утолщениями, а в центре проводящий пучок (5); пыльник перед вскрыванием (6). g – гинецей, cn – связник, p – лепесток, s – стомиум, st – тычинка, v b – проводящий пучок. Масштабная линейка, мкм: 1 – 100, 2–4 – 50, 5, 6 – 10.
Fig. 4. Stamen structure in Aeonium balsamiferum (transverse sections).
Number and position of stamens in a flower (1); structure of the anther in its different portions: in the zone fused with the stamen filament (3), free from the stamen filament (4 – closer to the place of fusion, 2 – in the basal part); connective, cells with tannins and fibrous thickening are visible, in the center there is a vascular bundle (5); anther before dehiscence (6). g – gynoecium, cn – connective, p – petal, s – stomium, st – stamen, v b – vascular bundle. Scale bars, µm: 1 – 100, 2–4 – 50, 5, 6 – 10.

Формирование стенки микроспорангия. Вопросы типизации стенки микроспорангия и последовательность возникновения ее слоев обсуждаются в литературе. В нашем исследовании мы используем представления, разработанные И.И. Шамровым (Shamrov, 2008) и группой его коллег (Shamrov, Anisimova, Babro, 2019, 2020). Изучение пыльника у A. balsamiferum и A. ciliatum показало, что в его субпидермальном слое на ранних этапах развития дифференцируется группа инициальных клеток (центральная и латеральные – см. рис. 7, 1), которые образуют как слои стенки микроспорангия со всех сторон микроспорангия, так и сам археспорий, а затем спорогенные клетки и микроспороциты. После периклинального деления центральной субэпидермальной клетки наружу отделяется археспориальная клетка, а внутрь – клетка, из которой формируется проксимальная (ближайшая к связнику) часть стенки микроспорангия, преобразующаяся в клетки внутреннего тапетума. Латеральные субэпидермальные инициальные клетки за счет делений образуют латеральные части стенки микроспорангия (рис. 5, 1; 6, 1–4; 7, 2). В результате периклинальных делений археспориальных клеток возникают наружный (париетальные клетки) и внутренний (спорогенные клетки) слои.
Рис. 5.
Стадии развития пыльника у Aeonium balsamiferum (1, 3, 5–8) и A. ciliatum (2, 4) (поперечные срезы).
1 – бугорок пыльника, деления инициалей микроспорангия, образование клеток внутреннего тапетума, археспория и инициалей латеральных частей стенки; 2, 3 – сформированная стенка микроспорангия, клетки тапетума с внутренней и наружной сторон стенки различаются; 4 – строение клеток внутреннего тапетума на стадии тетрад микроспор; 5 – тетраэдральные тетрады микроспор; 6 – стенка микроспорангия с наружной стороны на стадии одиночных микроспор; 7, 8 – аномалии в развитии пыльника во время микроспорогенеза, в клетках эндотеция уже сформировались фиброзные утолщения, в тапетуме наблюдается разрастание и образование крупных клеток во всех областях. a c – археспориальная клетка, e – эпидерма, en – эндотеций, i t – внутренний тапетум, l i w mc – инициали латеральной части стенки микроспорангия, o t – наружный тапетум. Масштабная линейка, мкм: 1–6 – 10, 7 – 50, 8 – 20.
Fig. 5. Anther formation in Aeonium balsamiferum (1, 3, 5–8) and A. ciliatum (2, 4) (transverse sections).
1 – anther primordium, divisions of the microsporangium initials, formation of cells of the inner tapetum, archesporium and the initials of the lateral parts of the wall; 2, 3 – formed microsporangium wall, the cells of the tapetum on the inner and outer sides of the wall are different; 4 – cell structure of the inner tapetum at the stage of microspore tetrads; 5 – tetrahedral tetrads of microspores; 6 – wall of microsporangium from the outside at the stage of free microspores; 7, 8 – abnormalities in the anther development during microsporogenesis, fibrous thickenings have already formed in the endothecium cells, growth and formation of large cells in all areas in the tapetum are observed. a c – archesporial cell, e – epiderm, en – endothecium, i t – inner tapetum, l i w mc – lateral initials of microsporangium wall, o t – outer tapetum. Scale bars, µm: 1–6 – 10, 7 – 50, 8 – 20.

Рис. 6.
Формирование пыльника в премейотический период развития у Aeonium balsamiferum (поперечные срезы).
1–3 – начальные стадии формирования стенки микроспорангия: деления центральной и латеральных инициалей микроспорангия, образование единого слоя вокруг спорогенных клеток, дифференциация внутреннего тапетума и париетальных слоев; 4 – образование двух париетальных слоев. i t – внутренний тапетум, l i w mc – инициали латеральной части стенки микроспорангия, p l – париетальный слой, s c – спорогенная клетка. Масштабная линейка, мкм – 10.
Fig. 6. Anther formation during premeiotic period of development in Aeonium balsamiferum (transverse sections).
1–3 – early stages of microsporangium wall formation: dividing central and lateral initials of the microsporangium, arising of unite layer around sporogenous cells, differentiation of inner tapetum and parietal layers; 4 – formation of two parietal layers. i t – inner tapetum, l i w mc – lateral initials of microsporangium wall, p l – parietal layer, s c – sporogenous cell. Scale bar, µm – 10.

Рис. 7.
Формирование пыльника в премейотический период развития у Aeonium ciliatum (поперечные срезы).
1 – бугорок пыльника, дифференциация инициалей микроспорангия; 2 – начальные стадии формирования стенки микроспорангия, образование археспориальных клеток, инициалей внутреннего тапетума и латеральных частей стенки; 3 – образование единого слоя вокруг спорогенных клеток, дифференциация внутреннего тапетума и париетальных слоев. a c – археспориальная клетка, i c mc – инициальные клетки микроспорангия, i t – внутренний тапетум, l i w mc – инициали латеральной части стенки микроспорангия, p l – париетальный слой, s c – спорогенная клетка. Масштабная линейка, мкм – 10.
Fig. 7. Anther formation during premeiotic period of development in Aeonium ciliatum (transverse sections).
1 – anther primordium, differentiation of microsporangium initial cells; 2 – early stages of microsporangium wall formation, forming archesporial cells, initials of inner tapetum and lateral parts of wall; 3 – arising of unite layer around sporogenous cells, differentiation of inner tapetum and parietal layers. a c – archesporial cell, i c mc – initial cells of microsporangium, i t – inner tapetum, l i w mc – lateral initials of microsporangium wall, p l – parietal layer, s c – sporogenous cell. Scale bar, µm – 10.

Клетки париетального слоя делятся периклинальными и антиклинальными делениями, в результате чего образуются слои, входящие в состав дистальной части стенки микроспорангиев. Периклинальные деления происходят в определенной последовательности. После деления клеток исходного париетального образуются два слоя, участие которых различно в дальнейшем построении стенки микроспорангия (рис. 6, 4; 7, 3). Клетки внутреннего париетального слоя становятся тапетумом, тогда как клетки наружного слоя образуют 2 слоя (наружный – эндотеций и внутренний – средний слой). Таким образом, завершаются начальные стадии формирования стенки микроспорангия – возникновение и дифференциация ее слоев (от археспория до спорогенной ткани).
В дальнейшем на стадии преобразования спорогенных клеток в микроспороциты (рис. 8, 1) или в начале мейоза (рис. 8, 2; 9, 1, 2) происходят дополнительные (формирующие) периклинальные деления во всех слоях, кроме эпидермы. Делятся клетки среднего слоя, иногда эндотеция и тапетума. Устанавливается окончательное число слоев микроспорангия. Сформированная стенка микроспорангия у исследованных видов состоит из 5 слоев клеток – эпидермы, эндотеция, 2 средних слоев и тапетума. Тапетум и эндотеций могут быть нерегулярно 2-слойными. Латеральные и, главным образом, проксимальная части стенки микроспорангия становятся 4–5-слойными (рис. 8, 1, 2; 9, 1–3). Таким образом, на отдельных этапах развития стенка микроспорангия может быть 6–7-слойной.
Рис. 8.
Заключительные стадии формирования стенки микроспорангия в мейотический период у Aeonium balsamiferum (поперечные срезы).
1, 2 – формирующие деления в слоях стенки микроспорангия, по периферии клеток эпидермы начинается отложение танинов, видны различия в строении тапетума; 3 – стенка микроспорангия на стадии тетрад микроспор, произошло разрушение стенок между клетками тапетума, также разрушаются клетки средних слоев. 1а – 3а – схемы пыльника. en – эндотеций, ep – эпидерма, i t – внутренний тапетум, m l – средний слой, o t – наружный тапетум, s t – спорогенная ткань, t ms – тетрада микроспор, tn – танины. Масштабная линейка, мкм: 1–3 – 10, 1а – 50, 2а – 20, 3а – 100.
Fig. 8. Last stages of microsporangium wall fornation during meiotic period in Aeonium balsamiferum (transverse sections).
1, 2 – forming divisions in the layers of the microsporangium wall, deposition of tannins begins along the periphery of epidermal cells, differences in the tapetum structure are visible; 3 – the microsporangium wall at the stage of microspore tetrads, the walls between the tapetum cells were destroyed, the cells of the middle layers were also destroyed. 1a–3a – anther schemes. en – endothecium, ep – epiderm, i t – inner tapetum, m l – middle layer, o t – outer tapetum, s t – sporogenous tissue, t ms – tetrad of microspores, tn – tannins. Scale bars, µm: 1–3 – 10, 1а – 50, 2а – 20, 3а – 100.

Затем во время микроспорогенеза и формирования пыльцевых зерен происходят преобразования слоев стенки микроспорангия. Рассмотрим подробно характеристику каждого слоя стенки микроспорангия.
На стадии микроспороцитов клетки эпидермального слоя линзовидные, с крупным ядром и плотной цитоплазмой. Затем они принимают прямоугольную форму с закругленными углами. Клетки теряют содержимое и становятся сильно вакуолизированными. 2–3 клетки этого слоя в области стомиума отличаются меньшими размерами. У обоих изученных видов по периферии эпидермальных клеток на границе цитоплазмы и вакуоли накапливаются танины, за исключением клеток, которые формируют стомиум (рис. 8, 2, 3; 9, 2–4; 10, 1, 2, 3а; 11, 1а, 2, 3).
Вытянутые клетки эндотеция постепенно увеличиваются в радиальном направлении. У A. balsamiferum этот процесс становится заметным после стадии тетрад микроспор, особенно к началу деления отдельных микроспор (рис. 8, 3; 10, 1, 2а), тогда как у A. ciliatum – лишь в период созревания пыльцевых зерен (рис. 11, 2, 3). Стенки клеток эндотеция к моменту созревания пыльника приобретают неравномерно утолщенные фиброзные утолщения (рис. 10, 3; 11, 2, 3). Только 1–2 клетки эндотеция, входящие в состав стомиума, остаются меньших размеров и без фиброзных утолщений (рис. 11, 3). Ранее нами был отмечен особый случай образования кольцевидного фиброзного слоя с внутренней стороны связника в нижней области, где нет срастания пыльника и тычиночной нити (рис. 3, 5; 4, 4), при этом хорошо видно, что внутреннее кольцо контактирует с наружным слоем эндотеция. Клетки, соединяющие наружный и внутренний эндотеций, располагаются тяжами и имеют фиброзные утолщения.
Рис. 9.
Заключительные стадии формирования стенки микроспорангия в премейотический (1, 2), мейотический (3) и в начале постмейотического (4) периодов у Aeonium ciliatum (поперечные срезы).
1–3 – формирующие деления в слоях стенки микроспорангия, по периферии клеток эпидермы начинается отложение танинов, видны различия в строении тапетума; 4 – стенка микроспорангия на стадии одиночных микроспор, произошло разрушение стенок между клетками тапетума, также разрушаются клетки средних слоев, на внутренних мембранах тапетума орбикулы. 1а–3а – схемы пыльника. en – эндотеций, ep – эпидерма, m l – средний слой, ms – микроспора, o – орбикулы, o t – наружный тапетум, tn – танины. Масштабная линейка, мкм: 1–4 – 10, 1а – 20.
Fig. 9. Last stages of microsporangium wall fornation during premeiotic (1, 2), meiotic (3) and beginning of postmeiotic (4) periods in Aeonium ciliatum (transverse sections).
1–3 – forming divisions in the layers of the microsporangium wall, deposition of tannins begins along the periphery of epidermal cells, differences in the tapetum structure are visible; 4 – the microsporangium wall at the stage of single microspores, the walls between the tapetum cells were destroyed, the cells of the middle layers were also destroyed, the orbicules are formed at inner membranes of tapetum. 1a–3a – anther schemes. en – endothecium, ep – epiderm, m l – middle layer, ms – microspore, o – orbicules, o t – outer tapetum, tn – tannins. Scale bars, µm: 1–4 – 10, 1а – 20.

Рис. 10.
Развитие пыльника в постмейотический период у Aeonium balsamiferum (поперечные срезы).
1 – стенка микроспорангия на стадии распада тетрад микроспор, видны различия в строении тапетума; 2а, 2b – стенка микроспорангия на стадии микроспор перед делением, видны различия в строении тапетума, 3 – стенка микроспорангия перед вскрыванием тек; 1а, 3а – схемы пыльника. en – эндотеций, ep – эпидерма, f t – фиброзные утолщения, i t – внутренний тапетум, m l – средний слой, o t – наружный тапетум, p g - пыльцевое зерно, t ms – тетрада микроспор, tn – танины. Масштабная линейка, мкм – 20.
Fig. 10. Anther development during postmeiotic period in Aeonium balsamiferum (transverse sections).
1 – microsporangium wall at the stage of disintegration of microspore tetrads, differences in the tapetum structure are visible; 2a, 2b – microsporangium wall at the stage of microspores before division, differences in the tapetum structure are visible; 3 – microsporangium wall before dehiscence of thecae; 1a, 3a – schemes of anther. en – endothecium, ep – epiderm, f t – fibrous thickenings, i t – inner tapetum, m l – middle layer, o t – outer tapetum, p g – pollen grain, t ms – tetrad of microspores, tn – tannins. Scale bars, µm – 20.

Рис. 11.
Развитие пыльника в постмейотический период у Aeonium ciliatum (поперечные срезы).
1а, 1b – стенка микроспорангия на стадии микроспор перед делением (1а) и во время формирования 2-клеточных пыльцевых зерен (3), видны различия в строении тапетума, 2 – стенка микроспорангия перед вскрыванием тек; 3 – вскрывание теки; 2а, 3а – схемы пыльника. en – эндотеций, ep – эпидерма, f t – фиброзные утолщения, i t – внутренний тапетум, ms – микроспора, o – орбикулы, o t – наружный тапетум, p g - пыльцевое зерно, st – стомиум, tn – танины. Масштабная линейка, мкм: 1а, 1b – 10, 2, 3 – 20, 2а, 3а – 200.
Fig. 11. Anther development during postmeiotic period in Aeonium ciliatum (transverse sections).
1a, 1b – microsporangium wall at the stage of microspores before division, and during 2-celled pollen grain formation (3), differences in the tapetum structure are visible; 2 – microsporangium wall before dehiscence of thecae; 3 – dehiscence of theca. 2a, 3a – schemes of anther. en – endothecium, ep – epiderm, f t – fibrous thickenings, i t – inner tapetum, ms – microspore, o – orbicules, o t – outer tapetum, p g – pollen grain, st – stomium, tn – tannins. Scale bars, µm – 20.

Средние слои состоят из небольших узких клеток. Обычно их 2, иногда может 3 (рис. 8, 2; 9, 3). В ходе развития они постепенно вытягиваются, и к моменту формирования пыльцевых зерен их остатки представлены в виде темноокрашенных сгустков (рис. 8, 3; 9, 3; 10, 1, 2а, 3; 11, 1а, 2, 3). В некоторых пыльниках клетки сохраняются до вскрывания тек. Обычно такие клетки, бедные цитоплазмой, обнаруживаются со стороны связника.
Тапетум. Существующие определения типов и форм тапетума крайне противоречивы (обзор проблемы см. Shamrov et al., 2021). Особенно сложное положение обстоит с одним из распространенных типов тапетума, который часто называют секреторным (клеточным). Такой тип тапетума описан у исследованных видов, и мы будем называть его париетальным, как это предложено в упомянутом исследовании.
Тапетум у обоих видов гетероморфный, что связано как с происхождением, так и положением в стенке микроспорангия. Внутренний тапетум дифференцируется первым и образуется из клеток, которые возникают при делении центральных инициалей микроспорангия. Следующими появляются клетки латеральных областей тапетума, которые формируются из латеральных инициалей микроспорангия. Последними дифференцируются клетки наружного тапетума из клеток внутреннего париетального слоя.
У обоих видов клетки тапетума до мейоза вытянутые (рис. 8, 2; 9, 2, 3). Но уже с началом микроспорогенеза хорошо видно, что у обоих видов наружный тапетум однослойный с одноядерными у A. ciliatum (рис. 9, 3) и 2-ядерными у A. balsamiferum клетками (рис. 8, 2). В дальнейшем эта тенденция сохраняется (рис. 9, 4; 11, 1а; 8, 3; 10, 1, 2). Следует отметить, что размер клеток увеличивается почти в 2 раза. Внутренний тапетум обычно 2–3-слойный на ранних стадиях развития (рис. 8, 2; 9, 2, 3). Но после стадии тетрад микроспор обычно наблюдается 1-слойный, редко нерегулярно 2-слойный тапетум, при этом его клетки сильно увеличиваются в размерах, особенно у A. balsamiferum – в 3–4 раза, напоминая по строению папилловидные. Уменьшение числа слоев клеток внутреннего тапетума, возможно, связано с тем, что дополнительные потенциальные слои преобразуются не в клетки тапетума, а в клетки средних слоев. Но оставшиеся клетки тапетума продолжают активно функционировать, вследствие чего они сильно увеличиваются в размерах.
У A. ciliatum клетки тапетума одноядерные, а у A. balsamiferum – 1–2-ядерные (рис. 5, 4; 10, 1, 2b). Клетки тапетума сначала характеризуются плотной цитоплазмой, но затем происходит их вакуолизация. У обоих видов клетками тапетума на поздних стадиях развития выделяются глобулы полленкита (рис. 5, 4, 6; 9, 4; 11, 1а).
У изученных видов тапетум в премейотическом и мейотическом периодах характеризуется клеточной структурой. Однако уже на стадиях тетрад микроспор у A. balsamiferum (рис. 8, 3) или одиночных микроспор у A. ciliatum (рис. 9, 4) стенки между клетками тапетума начинают разрушаться. Следует отметить, что процесс исчезновения клеточных стенок сопровождается выпячиванием образующихся протопластов внутрь полости микроспорангия, а на внутренних тапетальных мембранах начинают выявляться орбикулы (рис. 5, 4, 6; 8, 3; 9, 4; 10, 1). У обоих видов протопласты сохраняются по краю полости микроспорангия, где разрушаются, причем их остатки с ядрами сохраняются почти до созревания пыльника. Протопласты постепенно уменьшаются в размерах, а их содержимое лизирует. Таким образом, у обоих изученных видов выявлена вариация 2 париетального типа – амебоидный тапетум (Shamrov et al., 2019, 2021).
На стадии формирования тетрад микроспор выявлены аномалии в строении пыльника. Выявлены случаи, когда в клетках эндотеция преждевременно были сформированы фиброзные утолщения, а в тапетуме происходило разрастание и образование крупных клеток во всех его областях (рис. 5, 7, 8).
Вскрывание пыльника. Мы уже отмечали, что у обоих видов в апикальной части пыльника формируется клювовидная структура, напоминающая стомиум. У A. balsamiferum ей предшествует образование группы густоплазменных клеток (рис. 2, 2), которые затем разрушаются и образуется полость, обьединяющая пространства обеих тек с пыльцой (рис. 2, 3, 4). Возникает пора через которую, как и через стомиум, высыпается пыльца. Перед открыванием края поры лишь сомкнуты, а в окружающих клетках эндотеция обнаруживаются фиброзные утолщения (рис. 2, 5). Пора вскрывается подобно стомиуму (рис. 2, 4). У A. ciliatum клетки связника между теками сохраняются, при этом полость не образуется, теки остаются свободными и пора не формируется. Поэтому пыльник у этого вида вскрывается только в области стомиума (рис. 3, 2–5, 8; 4, 3, 4).
Второй особенностью пыльника является необычное строение связника. Его форма характеризуется 4 лучами, между которыми находятся микроспорангии. У A. ciliatum последние имеют округлую форму и, соответственно, септа между микроспорангиями тек оказывается протяженной (рис. 3, 4–6). У A. balsamiferum микроспорангии овально-продолговатые, а септа оказывается очень короткой (рис. 4, 2–4).
Вскрываются пыльники продольными щелями, лартрозно. Вскрывание – 2-фазное. Сначала разрушается перегородка между смежными гнездами, а также группа мелких клеток, входящих в стомиум (рис. 3, 4; 4, 3, 4; 11, 1а). С наружной стороны в области стомиума в клетках эндотеция не формируются фиброзные утолщения. Нижние части клеток эндотеция плотно смыкаются и, возможно, слипаются (рис. 3, 4; 4, 3, 6; 10, 3). Затем происходит обезвоживание клеток эндотеция и их сжатие, подобно пружине, в результате укорачивания фиброзных утолщений. За счет этого уменьшаются размеры клеток эндотеция, которые в области стомиума отрываются друг от друга. Прохождение обеих фаз приводит к вскрыванию тек пыльника (рис. 11, 2, 3, 3а), при этом вся стенка микроспорангия раскрывается наружу под углом 90° относительно щели теки (рис. 3, 8).
Тетрады микроспор и пыльцевые зерна. Спорогенная ткань многослойная и располагается 2–3 тяжами клеток (рис. 9, 3). У A. balsamiferum наблюдали образование 3 тяжей, при этом деления происходили со стороны внутреннего тапетума. Клетки двух внутренних возникающих тяжей спорогенных клеток позже становятся микроспороцитами и, соответственно, позже вступают в мейоз (рис. 8, 2). Специально микроспорогенез и формирование пыльцевого зерна у изученных видов не рассматривались. Они происходят, как у большинства представителей сем. Crassulaceae. В результате мейоза и последующих процессов цитокинеза (микроспорогенез симультанный) образуются преимущественно тетраэдральные тетрады гаплоидных микроспор (рис. 5, 5; 8, 3). Каждая микроспора и тетрада в целом окружены каллозой, которая постепенно резорбируется, а тетрады распадаются на отдельные микроспоры (рис. 10, 1). Вскоре микроспоры делятся и формируются 2 клеточные пыльцевые зерна (рис. 10, 3; 11, 2).
Зрелые пыльцевые зерна изученных видов 3-бороздно-оровые, эллипсоидальные; в очертании с полюса 3-лопастные, с экватора эллиптические, с закругленными полюсами (рис. 12, 1–4). Мезокольпиумы пыльцы ромбические, реже эллиптические (рис. 12, 5). Пыльца небольших размеров, с полярной осью около 20–25 мкм. Апертуры сложные, состоят из внешней меридионально ориентированной борозды и внутренней экваториально расположенной оры. Борозды (экзо-апертуры) длинные, глубокие, широкие, сужающиеся к полюсам, со слегка закругленными концами и более или менее ровными краями. Оры (эндоапертуры) у пыльцы большинства исследованных видов с нечеткими, часто неровными краями. Они небольшие, располагаются в центре борозд и не заходят за их границы. Скульптура струйчатая (рис. 12, 6). С помощью электронного сканирующего микроскопа видно, что длина и ширина струй различаются, а их переплетения в разных направлениях образуют небольшие локальные углубления и возвышения. Наблюдались стерильные пыльцевые зерна, которые были меньших размеров, бедны цитоплазмой и часто деформированы.
Рис. 12.
Строение 3-бороздно-оровых пыльцевых зерен у Aeonium balsamiferum (1–3) и A. ciliatum (4–6).
1, 2, 4, 5 – вид пыльцевых зерен; 3, 6 – поверхность пыльцевого зерна. Масштабная линейка, мкм: 1 – 2, 2, 4, 5 – 5, 3, 6 – 1.
Fig. 12. Structure of 3-colporate pollen grains in Aeonium balsamiferum (1–3) and A. ciliatum (4–6).
1, 2, 4, 5 – view of pollen grains; 3, 6 – surface of pollen grain. Scale bars, µm: 1 – 2, 2, 4, 5 – 5, 3, 6 – 1.

ОБСУЖДЕНИЕ
Впервые изучены морфогенез андроцея, а также развитие и строение стенки пыльника у Aeonium balsamiferum и A. ciliatum. Полученные нами данные дополняют эмбриологическую характеристику сем. Crassulaceae (Nikiticheva, 1985; Kamelina, 2009; Anisimova, 2016, 2020). Кроме того, нам удалось проследить самые ранние стадии развития микроспорангия еще до дифференциации археспория. Мы подтвердили имеющуюся точку зрения (Shamrov, 2008; Shamrov et al., 2019, 2020), согласно которой в субпидермальном слое развивающегося пыльника дифференцируется группа инициальных клеток (центральная и латеральные), которые образуют как слои стенки микроспорангия, так и сам археспорий, а затем париетальные и спорогенные клетки. У видов сем. Crassulaceae способ формирования стенки микроспорангия из клеток париетального слоя с наружной стороны обычно определяют как тип двудольных (Nikiticheva, 1985; Kamelina, 2009), согласно представлениям Davis (1966), или центробежный тип, типовая вариация (Teryokhin et al., 2002). Поскольку у изученных нами видов во всех слоях стенки микроспорангия происходят дополнительные деления, приводящие к увеличению их числа, то тип формирования следует определять как центробежный, компликатная вариация (Shamrov et al., 2019, 2020).
Исследование позволило выявить сходство и различия в развитии и строении пыльника у A. balsamiferum и A. ciliatum. Черты сходства: 4‑гнездный изобилатеральный (на поперечном срезе) пыльник с надсвязником и 4-лучевым связником, стенка микроспорангия с дистальной стороны формируется по типу двудольных, сформированная стенка микроспорангия состоит из пяти слоев клеток (эпидермы, эндотеция, двух средних слоев и париетального тапетума), микроспорогенез – симультанный, тетрады микроспор – тетраэдральные, пыльцевые зерна – 2-клеточные. За счет дополнительных периклинальных делений клеток тапетум и эндотеций могут быть нерегулярно 2-слойными, а число средних слоев может достигать 3. Таким образом, на отдельных этапах развития стенка микроспорангия может быть 6–7-слойной. В клетках эпидермы с дистальной стороны стенки микроспорангия по периферии большой вакуоли накапливаются танины. У обоих изученных видов выявлена вариация 2 париетального типа (амебоидный тапетум) и кольцевидный фиброзный слой с внутренней стороны связника в нижней области, где нет срастания пыльника и тычиночной нити.
Наше исследование подтвердило результаты других авторов о поразительном однообразии и стабильности признаков морфологии пыльцы в сем. Crassulaceae (Hart, 1974; Sin et al., 2002; Grigorieva, Britski, 2001; Goncharova, 2006). Пыльцевые зерна исследованных нами видов из родов Aeonium, Kalanchoe и Sedum однотипны по строению и являются 3-бороздно-оровыми.
Различия между видами касаются строения соцветия и цветка. У A. balsamiferum цимозные соцветия представлены сложными монохазиями и дихазиями, а у A. ciliatum преимущественно сложными дихазиями. Андроцей чаще всего состоит из 16 или 18 тычинок у A. balsamiferum и 14 тычинок у A. ciliatum. У последнего вида на поверхности тычинки формируются железистые волоски. Микроспорангии у A. ciliatum имеют округлую форму, а у A. balsamiferum овально-продолговатую. Вследствие этого септа между микроспорангиями тек оказывается протяженной у A. ciliatum и очень короткой у A. balsamiferum. И хотя вскрывание тек пыльника у обоих видов является септицидным, у A. balsamiferum оно приближается к асептицидному, поскольку стомиум находится почти рядом со связником (Zhinkina, Evdokimova, Shamrov, 2022). Следует подчеркнуть, что у последнего вида пыльца может высыпаться как через стомиум, так и через апикальную пору (этот феномен обнаружен нами впервые у представителей сем. Crassulaceae), причем оба способа вскрывания тек осуществляются одновременно, что свидетельствует, вероятно, о большей специализации пыльника A. balsamiferum к опылению. Из других черт различий следует обратить внимание на особенности строения тапетума. Хотя наружный тапетум у обоих видов однослойный, его клетки одноядерные у A. ciliatum и 2-ядерные у A. balsamiferum. Внутренний тапетум обычно 1‑слойный, редко нерегулярно 2-слойный тапетум, при этом его клетки увеличиваются в размерах в 2 раза у A. ciliatum и 3–4 раза у A. balsamiferum (у последнего напоминают по строению папилловидные клетки).
Данные сравнительно-эмбриологических и морфолого-анатомических исследований могут оказаться полезными для понимания эволюции структурных признаков тычинки, пыльника, гинецея и семязачатка в сем. Crassulaceae. Однако вопросы их использования определяются не только слабой изученностью большинства видов, но и неоднозначностью трактовки полученных молекулярно-генетических данных и их значительным несоответствием классическим системам родов этого семейства. Как уже отмечалось, ранее мы изучили развитие пыльника, семязачатка и гинецея у некоторых видов Kalanchoe и Sedum. Подведем промежуточный итог о значении полученных признаков для целей систематики и филогении.
При рестриктазном анализе ДНК хлоропластов (ген mat K) в сем. Crassulaceae выделяются 7 клад, среди которых особенно спорным является положение клад Aeonium, Crassula, Kalanchoe (Mort et al., 2010). Положение клад на древе семейства (от базальных до продвинутых) несколько различается по представлениям разных авторов: Crassula, Telephium, Sempervivum, Leucosedum, Acre, Aeonium, Kalanchoe (Mort et al., 2010; по данным Mort et al., 2001 и Ham, t’Hart, 1998) и Crassula, Kalanchoe, Telephium, Sempervivum, Aeonium, Leucosedum и Acre (Nikulin, Goncharov, 2017). Таким образом, изменилось положение клады Aeonium, особенно кардинально клады Kalanchoe – перенос клады из основания в верхнюю часть древа семейства. Клада Crassula в обеих системах занимает базальное положение.
На основании анализа последовательностей ITS рДНК подтверждена монофилия рода Kalanchoe и выявлены три основные линии развития (Goncharova, Goncharov, 2009). Полученные нами данные не противоречат имеющимся кладистическим построениям. Изученные виды Kalanchoe laxiflora, K. tubiflora мало отличаются друг от друга. Имеются некоторые количественные различия, но они не относятся к категории альтернативных, характеризующих разные линии рода: K. tubiflora – 2-слойные наружный интегумент и париетальная ткань, 2–3-слойный нуцеллярный колпачок, лишь в отдельных клетках семязачатка накапливаются танины; K. laxiflora – 3-слойные наружный и внутренний (последний только в основании) интегументы, 3-слойная париетальная ткань, 3–4-слойный нуцеллярный колпачок, в клетках наружной эпидермы наружного интегумента накапливаются танины. Ранее также не были выявлены существенные различия в строении мужских репродуктивных структур у видов Kalanchoe. Они касаются локализации танинов в клетках эпидермы и эндотеция стенки микроспорангия. У K. laxiflora, K. tubiflora и K. rosei Raym.-Hamet et H. Perrier танины обнаружены только в некоторых клетках эндотеция. У K. nyikae Engl. они накапливаются как в клетках эндотеция, так и преимущественно в клетках эпидермы (Anisimova, 2016).
Филогенетическая структура Sedum остается также слабо изученной. Большинство его видов относятся к трибе Sedeae, находясь между кладами Leucosedum и Acre (в последнюю помещен S. palmeri S. Watson) (Nikulin, 2017). S. kamtschaticum Fisch. (=Phedicus kamtschaticus (Fisch.) t’Hart) был отнесен к другой кладе Telephium (Ham, 1995). При изучении пыльника было показано, что различия между этими видами касаются, главным образом, временных характеристик специализации клеток стенки микроспорангия (строения эпидермы, эндотеция и тапетума). Весь протопласт эпидермальных клеток у S. kamtschaticum заполнен танинами, а у S. palmeri танины выявляются в виде отдельных глобул. У S. kamtschaticum специализация клеток эндотеция становится заметной после стадии тетрад микроспор, тогда как у S. palmeri – лишь в период созревания пыльцевых зерен. Несмотря на то, что тапетум у обоих видов париетальный, особенности его реорганизации в постмейотический период различаются: у S. kamtschaticum происходит реорганизация (вариация 2 – амебоидный тапетум), а у S. palmeri тапетум развивается без реорганизации (вариация 1 – типичный париетальный тапетум) (Anisimova, 2020). Среди признаков строения гинецея и семязачатка следует отметить следующие черты различия: у S. kamtschaticum – наряду с 5-членными обнаружены 6-членные цветки, отложение танинов происходит в клетках как наружной, так и внутренней эпидермы плодолистиков, число семязачатков в рядах на плаценте составляет 3–5, семязачатки геми-кампилотропные, с 6–7-слойным нуцеллярным колпачком в виде клюва; у S. palmeri – наряду с 5-членными выявлены 4‑членные цветки, отложение танинов происходит только в клетках наружной эпидермы плодолистиков, число семязачатков в рядах на плаценте составляет 10–12, семязачатки гипертропные, с 2–3-слойным нуцеллярным колпачком в виде клюва (Anisimova, Shamrov, 2021a, b). Сравнительный анализ строения гинецея и семязачатка у видов Sedum и Kalanchoe свидетельствует о том, что наличие массивного нуцеллуса в базальной области и типичных анатропных семязачатков у Kalanchoe laxiflora и K. tubiflora, по сравнению с изученными представителями Sedum (менее массивный нуцеллус и формирование более специализированных гипертропных и геми-кампилотропных семязачатков), не противоречит мнению авторов о суббазальном положении клады Kalanchoe на филогенетическом древе семейства Crassulaceae (Nikulin, Goncharov, 2017). С другой стороны, различия в организации гинецея и семязачатка между видами Sedum показывают более высокое положение S. palmeri (в верхушечной кладе Acre), чем S. kamtschaticum (в срединной кладе Telephium).
ЗАКЛЮЧЕНИЕ
В настоящем исследовании анализировались особенности развития пыльника. Поэтому эмбриологическое сравнение будет касаться только его признаков. Из изученных нами представителей сем. Crassulaceae наибольшее сходство в строении пыльника обнаружено между родами Aeonium и Sedum. Базовые признаки семейства, связанные с процессами репродукции, не учитываются. К ним относятся: тетраспорангиатный пыльник, симультанный микроспорогенез, преимущественно тетраэдральные тетрады микроспор, 2‑клеточные зрелые пыльцевые зерна. К другим чертам сходства относятся следующие: изобилатеральный (на поперечном срезе) пыльник с надсвязником, 4-лучевым связником и кольцевидным фиброзным слоем с внутренней стороны связника в нижней области, где нет срастания пыльника и тычиночной нити; пыльцевые зерна однотипны по строению – 3-бороздно-оровые, поверхность – струйчатая. Полученные данные не противоречат кладистическим построениям, свидетельствующим о том, что виды полифилетического рода Sedum включаются в состав триб Aeonieae, Semperviveae и Sedeae. Изученные виды Aeonium balsamiferum и A. ciliatum, входящие в Aeonium-кладу, занимают промежуточное положение между кладами Telephium (Sedum kamtschaticum) и кладой Acre (S. palmeri) (Nikulin, 2017; Nikulin, Goncharov, 2017).
Список литературы
[Anisimova] Анисимова Г.М. 2016. Строение пыльника, микроспорогенез и пыльцевое зерно У Kalanchoe nyikae (Crassulaceae). – Бот. журн. 101 (12): 1378–1389.
[Anisimova, Shamrov] Анисимова Г.М., Шамров И.И. 2018. Морфогенез гинецея и семязачатка у Kalanchoe laxiflora и K. tubiflora (Crassulaceae). – Бот. журн. 103 (6): 675–694. https://doi.org/10.1134/S0006813618060017
[Anisimova] Анисимова Г.М. 2020. Развитие и строение пыльника Sedum kamtschaticum и Sedum palmeri (Crassulaceae). – Бот. журн. 105 (11): 1093–1110. https://doi.org/10.31857/S0006813620090021
[Anisimova, Shamrov] Анисимова Г.М., Шамров И.И. 2021a. Строение гинецея и семязачатка у Sedum kamtschaticum и Sedum palmeri (Crassulaceae). – Бот. журн. 106 (4): 50–68. https://doi.org/10.31857/S000681362104002
[Anisimova, Shamrov] Анисимова Г.М., Шамров И.И. 2021b. Сравнительный анализ строения гинецея и семязачатка у некоторых видов Sedum и Kalanchoe (Crassulaceae). – Бюл. ГБС. 4: 31–39. https://doi.org/10.25791/BBGRAN.04.2021.1097
Davis G.L. 1966. Systematic embryology of angiosperms. New York etc. 528 p.
[Goncharova] Гончарова С.Б. 2006. Очитковые (Sedoideae, Crassulaceae) флоры Российского Дальнего Востока. Владивосток. 222 с.
[Goncharova, Goncharov] Гончарова С.Б., Гончаров А.А. 2009. Молекулярная филогения и систематика цветковых растений семейства Толстянковых (Crassulaceae DC.). – Молекулярная биология. 43 (5): 856–865.
[Grigorieva, Britski] Григорьева В.В., Брицкий Д.А. 2001. Морфология пыльцы представителей подсемейства Sedoideae (Crassulaceae). – В кн.: Проблемы современной палинологии. Материалы XIII Российской палинологической конференции. Т. 1. Сыктывкар. С. 22–25.
Hart H. 1974. The pollen morphology of 24 species of the genus Sedum L. – Pollen and Spores. 16 (4): 373–387.
Ham R.C.H.J. van. 1995. Phylogenetic relationships in the Crassulaceae inferred from chloroplast DNA variation. Chapter 2. – In: Evolution and systematics of the Crassulaceae (Eds Henk’t Hart and Uts Eggli. Leiden. P. 16–29.
Ham R.C.H.J. van, t’Hart H. 1998. Phylogenetic relationships in the Crassulaceae inferred from chloroplast DNA restriction-site variation. – Am. J. Bot. 85: 123–134.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
Mes T.H.M., van Brederode J., ‘t Hart H. 1996. Origin of the woody Macaronesian Sempervivoideae and the phylogenetic position of the East African species of Aeonium. – Bot. Acta 109: 477–491.
Mes T.H.M., Wijers G.-J., 't Hart H. 1997. Phylogenetic relationships in Monanthes (Crassulaceae) based on morphological, chloroplast and nuclear DNA variation. – J. Evol. Biol. 10: 193–216. https://doi.org/10.1046/j.1420-9101.1997.10020193.x
Mort M.E., Soltis D.E., Soltis P.S., Francisco-Ortega J., Santos-Guerra A. 2001. Phylogenetic relationships and evolution of Crassulaceae inferred from matK sequence data. – Am. J. Bot. 88: 76–91.
Mort M.E., O’Leary T.R., Carrillo-Reyes P., Nowell T., Archibald J.K., Randle Ch.P. Phylogeny and evolution of Crassulaceae: past, present, and future. – Schumannia 6. Biodiversity and Ecology. 3: 69–86.
[Nikulin] Никулин В.Ю. 2017. Филогенетические отношения в роде Sedum L. (Crassulaceae J. St.-Hil.) и близких ему родах на основании сравнения нуклеотидных последовательностей ядерной и хлоропластной ДНК: Дис. … канд. биол. наук. Владивосток. 114 с.
[Nikulin, Goncharov] Никулин В.Ю., Гончаров A.A. 2017. Молекулярно-филогенетическая характеристика Sedum (Crassulaceae) и близких ему родов на основании сравнения нуклеотидных последовательностей гена matK хлоропластной ДНК и его региона рибосомной ДНК. – Бот. журн. 102 (3): 309–328.
[Nikiticheva] Никитичева З.И. 1985. Семейство Crassulaceae. – В кн.: Сравнительная эмбриология цветковых растений. Brunneliaceae–Tremandraceae. Л. С. 29–34.
[Pausheva] Паушева З.П. 1974. Практикум по цитологии растений. М. 288 с.
[Shamrov] Шамров И.И. 2008. Формирование спорангиев высших растений. – Бот. журн. 93 (12): 1817–1845.
[Shamrov, Anisimova, Babro] Шамров И.И., Анисимова Г.М., Бабро А.А. 2019. Формирование стенки микроспорангия пыльника и типизация тапетума покрытосеменных растений. – Бот. журн. 104(7): 1001–1032. https://doi.org/10.1134/S0006813619070093
Shamrov I.I., Anisimova G.M., Babro A.A. 2020. Early stages of anther development in flowering plants. – Botanica Pacifica. A journal of plant science and conservation. 9 (2): 1–10. https://doi.org/10.17581/bp.2020.09202
Shamrov I.I., Anisimova G.M., Babro A.A. Tapetum types and forms in angiosperms. - Proceedings of the Latvian Academy of Sciences, Section B. 2021. – 75 (3): 167–179. https://doi.org/10.2478/prolas-2021-0026
Sin J.-H., Yoo Y.-G., Park K.-R. 2002. A palynotaxonomic studies of Korean Crassulaceae. – Korean J. Electron Microscopy. 32 (4): 345–360.
Teryokhin E.S., Batygina T.B., Shamrov I.I. 2002. New approach to classifying modes of microsporangium wall formation. – In: Embryology of flowering plants. Terminology and concepts. Enfield (NH), USA, Plymouth, UK. Vol. 1. P. 32–39.
[Zhinkina, Evdokimov, Shamrov] Жинкина Н.А., Евдокимова Е.Е., Шамров И.И. 2022. Особенности строения пыльника у Codonopsis clematidea (Campanulaceae). – Бот. журн. 107 (3): 287–301. https://doi.org/10.31857/S0006813621120115
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


