Ботанический журнал, 2022, T. 107, № 8, стр. 766-780
АПОМИКСИС У ЗЛАКОВ ФЛОРЫ САРАТОВСКОЙ ОБЛАСТИ
Э. И. Кайбелева 1, *, О. И. Юдакова 1, **
1 Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
410012 Саратов, ул. Астраханская, 83, Россия
* E-mail: kaybeleva-elmira@mail.ru
** E-mail: yudakovaoi@info.sgu.ru
Поступила в редакцию 08.02.2022
После доработки 04.06.2022
Принята к публикации 14.06.2022
- EDN: HFINZH
- DOI: 10.31857/S0006813622080087
Аннотация
Цели и задачи исследования: Выявление апомиктичных видов злаков во флоре Саратовской области.
Материалы и методы: Способ семенной репродукции у растений диагностировали на основе результатов цитоэмбриологического анализа женской генеративной сферы. Материалом исследования послужили растения 117 природных популяций 71 вида злаков. В каждой популяции ацетоалкоголем (3:1) фиксировали соцветия 10–15 растений. Препараты семязачатков, приготовленные методом просветления растительных тканей, анализировали с помощью фазово-контрастного микроскопа.
Основные результаты и выводы: Облигатно половой способ репродукции зарегистрирован у 51 (71.8%) из 71 изученного вида. Цитоэмбриологические признаки факультативного гаметофитного апомиксиса обнаружены у 20 (28.2%) видов 8 родов: Agrostis, Anthoxanthum, Bromus, Dactylis, Festuca, Koeleria, Lolium и Poa. Преобладающий тип апомиксиса – апоспория Hieracium-типа в сочетании с псевдогамией. Впервые установлен тип гаметофитного апомиксиса у трех видов: Agrostis stolonifera (диплоспория Taraxacum-типа и псевдогамия), Bromus inermis и Dactylis glomerata (апоспория Hieracium-типа и псевдогамия).
Злаки (Poaceae Barnh.) – одно из наиболее крупных семейств покрытосеменных растений, которое объединяет около 11000 видов 900 родов (Tzvelev, 1987). Его представители играют огромную роль в сложении растительного покрова Земли и широко используются как хлебные, кормовые, газонные, декоративные и технические культуры. Наряду с розоцветными и сложноцветными, злаки составляют тройку лидеров по количеству видов, у которых зарегистрирован апомиксис – размножение семенами без оплодотворения (Carman, 1995, 1997; Shishkinskaya et al., 2004; Yudakova, Shishkinskaya, 2008; Hojsgaard et al., 2014). К настоящему времени апомиктичный способ репродукции установлен более чем у 200 видов злаков (Shishkinskaya et al., 2004; Yudakova, 2010), но эти цифры едва ли отражают истинное количество апомиктичных таксонов в данном семействе. Эмбриология многих дикорастущих злаков не изучена (Kashin et al., 2009), а именно цитоэмбриологический анализ до сих пор остается наиболее эффективным и информативным методом диагностики апомиксиса (Asker, Jerling, 1992; Mazzucato et al., 1996; Spillane et al., 2001; Ozias-Akins, 2006). Масштабные исследования по определению способа репродукции покрытосеменных растений велись с начала 20 в. и до конца 1970-х гг. В 1980-х гг. акцент в изучении апомиксиса сместился на выявление механизмов его генетической детерминации, и целенаправленный поиск апомиктичных видов во флоре практически прекратился. К этому времени на основе во многом фрагментарных данных были разработаны теории и гипотезы о закономерностях географического распределения апомиктов и их эволюционном значении (Vandel, 1925; Stebbins, 1950; Van Valen, 1973; Bierzychudek, 1985). Некоторые из них популярны до сих пор, несмотря на то, что результаты современных исследований апомиктичных видов зачастую не укладываются в их рамки (Hörand et al., 2011; Kashin et al., 2012; Burgess et al., 2014; Hojsgaard et al., 2014; Brožova et al., 2019). Для уточнения и корректировки сложившихся представлений об апомиксисе необходимо значительно расширить наши знания о количестве апомиктичных видов, их распределении в системе покрытосеменных растений и представленности во флоре различных регионов. Все это возможно только при условии интенсификации исследований по диагностике способа репродукции покрытосеменных растений.
Выявление апомиктичных форм и изучение степени распространения апомиксиса также важно для решения вопросов, касающихся направлений эволюции систем репродукции и эволюции растений в целом (Petrov, 1988; Asker, Jerling, 1992; Savidan, 2007; Barcaccia, Albertini, 2013). Кроме того, эти исследования имеют важное практическое приложение, поскольку способ репродукции растений необходимо учитывать при разработке селекционно-генетических программ, мероприятий по сохранению биоразнообразия, интродукции и реинтродукции.
Цель настоящей работы состоит в выявлении апомиктичных видов злаков во флоре Саратовской области с использованием методов цитоэмбриологического анализа.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования послужили растения 117 природных популяций 71 вида злаков флоры Саратовской области (табл. 1). Видовую принадлежность злаков определяли по Н.Н. Цвелеву (Tzvelev, 1976). Названия видов и их авторы приведены в соответствие с “The Wold checklist of Vascular Plants (WCVP) (https://wcvp.science.kew.org).
Таблица 1.
Эмбриологические признаки апомиксиса у изученных злаков Table 1. Embryological signs of apomixis in the studied cereals
| № | Вид Species |
Место сбора материала* Districts of material collecting |
Количество семязачатков Number of ovules |
Количество зародышевых мешков Number of embryo sacs |
||||
|---|---|---|---|---|---|---|---|---|
| всего, шт. total |
с признаками апоспории, % with signs of apospory, % |
с признаками диплоспории, % with signs of diplospory, % |
всего, шт. total |
аномального строения, % abnormal structure, % |
с проэмбрио и полярными ядрами, % with proembryo and polar nuclei, % |
|||
| Виды без эмбриологических признаков апомиксиса Species without embryological signs of apomixis |
||||||||
| 1 | Agropyron cristatum (L.) Gaerth. | Sar | 88 | 0.0 | 0.0 | 88 | 0.0 | 0.0 |
| 2 | Agropyron desertorum (Fisch. ex Link) Schult. | Khv | 101 | 0.0 | 0.0 | 101 | 0.0 | 0.0 |
| 3 | Agropyron fragile (Roth) P. Candargy | Kr | 84 | 0.0 | 0.0 | 84 | 0.0 | 0.0 |
| 4 | Agrostis vinealis Schreb. | At | 87 | 0.0 | 0.0 | 87 | 0.0 | 0.0 |
| B-K | 104 | 0.0 | 0.0 | 104 | 0.0 | 0.0 | ||
| 5 | Alopecurus geniculatus L. | Vs | 112 | 0.0 | 0.0 | 112 | 0.0 | 0.0 |
| Khv | 91 | 0.0 | 0.0 | 91 | 0.0 | 0.0 | ||
| 6 | Alopecurus pratensis L. | B-K | 89 | 0.0 | 0.0 | 89 | 0.0 | 0.0 |
| Khv | 97 | 0.0 | 0.0 | 97 | 0.0 | 0.0 | ||
| 7 | Brachypodium pinnatum (L.) Beauv. | B-K | 99 | 0.0 | 0.0 | 99 | 0.0 | 0.0 |
| Khv | 112 | 0.0 | 0.0 | 112 | 0.0 | 0.0 | ||
| Vs | 102 | 0.0 | 0.0 | 102 | 0.0 | 0.0 | ||
| 8 | Bromus riparius (Rehmann) Holub | B-K | 87 | 0.0 | 0.0 | 87 | 0.0 | 0.0 |
| Vs | 95 | 0.0 | 0.0 | 95 | 0.0 | 0.0 | ||
| 9 | Bromus squarrossus L. | Kr | 110 | 0.0 | 0.0 | 110 | 0.0 | 0.0 |
| Sar | 120 | 0.0 | 0.0 | 120 | 0.0 | 0.0 | ||
| 10 | Bromus tectorum L. | B-K | 98 | 0.0 | 0.0 | 98 | 0.0 | 0.0 |
| Khv | 102 | 0.0 | 0.0 | 102 | 0.0 | 0.0 | ||
| Kr | 89 | 0.0 | 0.0 | 89 | 0.0 | 0.0 | ||
| Vs | 87 | 0.0 | 0.0 | 87 | 0.0 | 0.0 | ||
| 11 | Calamagrostis epigejos (L.) Roth | B-K | 105 | 0.0 | 0.0 | 105 | 0.0 | 0.0 |
| Khv | 90 | 0.0 | 0.0 | 90 | 0.0 | 0.0 | ||
| Vs | 93 | 0.0 | 0.0 | 93 | 0.0 | 0.0 | ||
| 12 | Catabrosa aquatica (L.) P. Beauv. | Sar | 101 | 0.0 | 0.0 | 101 | 0.0 | 0.0 |
| 13 | Digitaria sanguinalis (L.) Scop. | Sar | 126 | 0.0 | 0.0 | 126 | 0.0 | 0.0 |
| Vs | 117 | 0.0 | 0.0 | 117 | 0.0 | 0.0 | ||
| 14 | Echinochloa crus-galli (L.) P. Beauv. | Sar | 108 | 0.0 | 0.0 | 108 | 0.0 | 0.0 |
| 15 | Elymus caninus (L.) L. | Khv | 86 | 0.0 | 0.0 | 86 | 0.0 | 0.0 |
| 16 | Elymus repens (L.) Gould | Vs | 94 | 0.0 | 0.0 | 94 | 0.0 | 0.0 |
| 17 | Eragrostis minor Host | Sar | 120 | 0.0 | 0.0 | 120 | 0.0 | 0.0 |
| 18 | Eremopyrum orientale (L.) Jaub. & Spach | Sar | 114 | 0.0 | 0.0 | 114 | 0.0 | 0.0 |
| 19 | Eremopyrum triticeum (Gaertn.) Nevski | B-K | 103 | 0.0 | 0.0 | 103 | 0.0 | 0.0 |
| Khv | 100 | 0.0 | 0.0 | 100 | 0.0 | 0.0 | ||
| Vs | 98 | 0.0 | 0.0 | 98 | 0.0 | 0.0 | ||
| 20 | Glyceria notata Chevall. | Khv | 96 | 0.0 | 0.0 | 96 | 0.0 | 0.0 |
| 21 | Helictotrichon desertorum (Less.) Pilg. | Sar | 118 | 0.0 | 0.0 | 118 | 0.0 | 0.0 |
| 22 | Hordeum brevisubulatum (Haller f.) Koeler | Khv | 115 | 0.0 | 0.0 | 115 | 0.0 | 0.0 |
| 23 | Hordeum jubatum L. | Vs | 93 | 0.0 | 0.0 | 93 | 0.0 | 0.0 |
| 24 | Koeleria macrantha (Ledeb.) Schult. | Oz | 87 | 0.0 | 0.0 | 87 | 0.0 | 0.0 |
| 25 | Leersia oryzoides (L.) Sw. | B-K | 128 | 0.0 | 0.0 | 128 | 0.0 | 0.0 |
| Vs | 105 | 0.0 | 0.0 | 105 | 0.0 | 0.0 | ||
| 26 | Leymus paboanus (Claus) Pilg. | Kr | 116 | 0.0 | 0.0 | 116 | 0.0 | 0.0 |
| 27 | Leymus racemosus (Lam.) Tzvelev | Sar | 130 | 0.0 | 0.0 | 130 | 0.0 | 0.0 |
| 28 | Lolium arundinaceum (Schreb.) Darbysh. | Khv | 98 | 0.0 | 0.0 | 98 | 0.0 | 0.0 |
| 29 | Melica altissima L. | B-K | 85 | 0.0 | 0.0 | 85 | 0.0 | 0.0 |
| Khv | 80 | 0.0 | 0.0 | 80 | 0.0 | 0.0 | ||
| 30 | Melica nutans L. | B-K | 92 | 0.0 | 0.0 | 92 | 0.0 | 0.0 |
| Khv | 89 | 0.0 | 0.0 | 89 | 0.0 | 0.0 | ||
| 31 | Milium effusum L. | Khv | 104 | 0.0 | 0.0 | 104 | 0.0 | 0.0 |
| Ls | 117 | 0.0 | 0.0 | 117 | 0.0 | 0.0 | ||
| 32 | Phalaris arundinacea L. | B-K | 120 | 0.0 | 0.0 | 120 | 0.0 | 0.0 |
| Khv | 106 | 0.0 | 0.0 | 106 | 0.0 | 0.0 | ||
| 33 | Phleum phleoides (L.) H. Karst. | Khv | 118 | 0.0 | 0.0 | 118 | 0.0 | 0.0 |
| 34 | Phleum pratense L. | Sar | 116 | 0.0 | 0.0 | 116 | 0.0 | 0.0 |
| 35 | Poa annua L. | Khv | 90 | 0.0 | 0.0 | 90 | 0.0 | 0.0 |
| 36 | Poa versicolor Besser | Ls | 94 | 0.0 | 0.0 | 94 | 0.0 | 0.0 |
| 37 | Puccinellia convoluta (Hornem.) Fourr. | Oz | 83 | 0.0 | 0.0 | 83 | 0.0 | 0.0 |
| 38 | Puccinellia dolicholepis (V.I. Krecz.) Pavlov | Kr | 104 | 0.0 | 0.0 | 104 | 0.0 | 0.0 |
| 39 | Scolochloa festucacea (Willd.) Link | Sar | 115 | 0.0 | 0.0 | 115 | 0.0 | 0.0 |
| 40 | Secale sylvestre Host | Kr | 127 | 0.0 | 0.0 | 127 | 0.0 | 0.0 |
| 41 | Setaria pumila (Poir.) Roem. & Schult. | Sar | 86 | 0.0 | 0.0 | 86 | 0.0 | 0.0 |
| 42 | Setaria verticillata (L.) P. Beauv. | Sar | 102 | 0.0 | 0.0 | 102 | 0.0 | 0.0 |
| 43 | Setaria viridis (L.) P. Beauv. | Sar | 92 | 0.0 | 0.0 | 92 | 0.0 | 0.0 |
| 44 | Stipa borysthenica Klokov ex Prokudin | Khv | 100 | 0.0 | 0.0 | 100 | 0.0 | 0.0 |
| 45 | Stipa capillata L. | Nv | 124 | 0.0 | 0.0 | 124 | 0.0 | 0.0 |
| 46 | Stipa dasyphylla (Lindem.) Czern. ex Trautv. | Bl | 118 | 0.0 | 0.0 | 118 | 0.0 | 0.0 |
| 47 | Stipa lessingiana Trin. et Rupr. | Khv | 106 | 0.0 | 0.0 | 106 | 0.0 | 0.0 |
| 48 | Stipa pennata L. | Oz | 96 | 0.0 | 0.0 | 96 | 0.0 | 0.0 |
| 49 | Stipa sareptana A.K. Becker | Ls | 89 | 0.0 | 0.0 | 89 | 0.0 | 0.0 |
| 50 | Stipa tirsa Steven | Kr | 108 | 0.0 | 0.0 | 108 | 0.0 | 0.0 |
| 51 | Thinopyrum intermedium (Host) Barkworth & D.R. Dewey | Kr | 131 | 0.0 | 0.0 | 131 | 0.0 | 0.0 |
| Виды с эмбриологическими признаками апомиксиса Species with embryological signs of apomixis |
||||||||
| 52 | Agrostis gigantea Roth | Khv | 87 | 0.0 | 0.0 | 87 | 2.3 | 27.5 |
| Sar | 108 | 0.0 | 1.9 | 104 | 3.8 | 96.1 | ||
| 53 | A. stolonifera L. | Khv | 101 | 0.0 | 1.0 | 98 | 0.0 | 63.2 |
| Vs | 112 | 0.0 | 0.0 | 112 | 0.8 | 51.7 | ||
| B-K | 89 | 0.0 | 0.0 | 89 | 0.0 | 46.1 | ||
| Ls | 121 | 0.0 | 0.0 | 121 | 1.6 | 6.6 | ||
| 54 | Anthoxanthum repens (Host) Veldkamp | Sar | 80 | 25.0 | 0.0 | 105 | 7.6 | 15.2 |
| Vs | 60 | 21.6 | 0.0 | 72 | 5.5 | 2.7 | ||
| Кр | 71 | 38.0 | 0.0 | 98 | 3.0 | 1.0 | ||
| 55 | A.nitens (Weber) Y. Schouten & Veldkamp | Vs | 68 | 22.0 | 0.0 | 81 | 1.2 | 0.0 |
| 56 | Bromus inermis Leyss. | Vs | 85 | 35.6 | 0.0 | 115 | 6.1 | 1.7 |
| Khv | 64 | 34.3 | 0.0 | 83 | 8.4 | 0.0 | ||
| 57 | Dactylis glomerata L. | Vs | 76 | 13.2 | 0.0 | 106 | 2.3 | 38.1 |
| Sar | 120 | 26.6 | 0.0 | 152 | 1.9 | 9.2 | ||
| Khv | 105 | 14.2 | 0.0 | 121 | 1.6 | 2.4 | ||
| 58 | Festuca altissima All. | B-K | 102 | 12.7 | 0.0 | 106 | 1.8 | 0.0 |
| Sar | 115 | 9.5 | 0.0 | 124 | 3.2 | 0.0 | ||
| Khv | 126 | 11.9 | 0.0 | 142 | 4.2 | 0.0 | ||
| 59 | F. beckeri (Hack.) Trautv. | Kr | 80 | 8.8 | 0.0 | 87 | 4.5 | 0.0 |
| Khv | 78 | 11.5 | 0.0 | 88 | 5.6 | 0.0 | ||
| 60 | F. rubra L. | B-K | 134 | 9.6 | 0.0 | 144 | 2.1 | 0.0 |
| 61 | F. rupicola Heuff. | Khv | 102 | 14.6 | 0.0 | 108 | 5.5 | 0.0 |
| 62 | F. valesiaca Schleich. ex Gaudin | B-K | 97 | 32.0 | 0.0 | 117 | 8.5 | 0.0 |
| Vs | 114 | 16.6 | 0.0 | 124 | 4.8 | 0.0 | ||
| Kr | 87 | 22.9 | 0.0 | 112 | 7.2 | 0.0 | ||
| Khv | 130 | 15.3 | 0.0 | 152 | 5.9 | 0.0 | ||
| 63 | Koeleria glauca (Spreng.) DC. | B-K | 60 | 30.0 | 0.0 | 117 | 8.5 | 2.5 |
| Kr | 76 | 23.7 | 0.0 | 94 | 0.0 | 1.3 | ||
| 64 | K. pyramidata (Lam.) P. Beauv. | Vs | 65 | 18.4 | 0.0 | 77 | 2.6 | 0.0 |
| 65 | Lolium giganteum (L.) Darbysh. | Khv | 98 | 0.0 | 5.1 | 98 | 9.1 | 0.0 |
| 66 | L. pratense (Huds.) Darbysh. | Khv | 104 | 9.6 | 0.0 | 114 | 5.2 | 0.0 |
| 67 | Poa angustifolia L. | Vs | 86 | 25.5 | 0.0 | 89 | 6.7 | 60.6 |
| B-K | 63 | 39.6 | 0.0 | 86 | 10.8 | 80.2 | ||
| 68 | P. bulbosa L. | Kr | 152 | 57.8 | 0.0 | 134 | 3.7 | 7.4 |
| Рт | 140 | 62.8 | 0.0 | 119 | 1.7 | 31.9 | ||
| Khv | 98 | 19.3 | 0.0 | 101 | 0.9 | 58.4 | ||
| 69 | P. compressa L. | B-K | 78 | 30.7 | 0.0 | 85 | 4.7 | 32.9 |
| Vs | 101 | 11.8 | 0.0 | 113 | 4.4 | 56.6 | ||
| Sar | 56 | 5.3 | 0.0 | 59 | 1.7 | 85.7 | ||
| 70 | P. nemoralis L. | B-K | 76 | 0.0 | 0.0 | 76 | 6.5 | 57.8 |
| Vs | 68 | 0.0 | 0.0 | 64 | 3.1 | 31.2 | ||
| Khv | 87 | 0.0 | 2.3 | 87 | 5.7 | 73.5 | ||
| 71 | P. pratensis L. | B-K | 103 | 7.7 | 0.0 | 111 | 3.6 | 61.2 |
| Vs | 90 | 21 | 0.0 | 101 | 4.9 | 14.8 | ||
| Sar | 112 | 21.3 | 0.0 | 117 | 7.6 | 16.2 | ||
| Khv | 95 | 18.9 | 0.0 | 113 | 4.4 | 51.3 | ||
Примечание. * Районы Саратовской области: At – Аткарский; B-K – Базарно-Карабулакский; Bl – Балашовский; Khv – Хвалынский; Kr – Краснокутский; Ls – Лысогорский; Nv – Новобурасский; Oz – Озинский; Rt – Ртищевский; Sar – Саратовский; Vs – Воскресенский.
Note. * Districts of the Saratov Region: At – Atkarsky; B-K – Bazarno-Karabulaksky; Bl – Balashovsky; Khv – Khvalynsky; Kr – Krasnokutsky; Ls – Lysogorsky; Nv – Novoburassky; Oz – Ozinsky; Rt – Rtishchevsky; Sar – Saratovsky; Vs – Voskresensky.
В каждой популяции проводили сбор и однократную фиксацию 10–15 растений в разгар цветения непосредственно на месте произрастания. Вследствие асинхронности развития растений в популяции и цветков в соцветиях однократная фиксация позволяла исследовать процессы мегаспорогенеза, мегагаметофитогенеза и ранние этапы эмбрио- и эндоспермогенеза. Из зафиксированных ацетоалкоголем (3 : 1) цветков приготавливали препараты семязачатков с использованием модифицированного метода просветления растительных тканей (Herr, 1971). В отличие от методики J. Herr (1971) обработку материала перед просветлением осуществляли не ацетоном, а глицерином, выдерживая в нем завязи не менее 3 сут (Yudakova et al., 2012). Выделенные из завязей семязачатки обрабатывали смесью 80%-ной молочной кислоты, хлоралгидрата, фенола, гвоздичного масла и ксилола в соотношении 2 : 2 : 2 : 2 : 1 по весу. Препараты анализировали с помощью микроскопа “AxioStar Plus” (С. Zeiss, Германия) в фазово-контрастном режиме. В каждой популяции исследовали структуру не менее 50 семязачатков. Всего проанализировано около 12000 препаратов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По данным А.Г. Еленевского (Elenevskiy et al., 2008) в Саратовской области злаки представлены 131 видом. Однако при сборе материала мы обнаружили два вида, которые отсутствовали в данной сводке: Anthoxanthum nitens (Weber) Y. Schouten & Veldkamp, 1812 и Stipa borysthenica Klokov ex Prokudin, 1951 (табл. 1). Ранее они указывались в “Конспектах флоры Саратовской области”, изданных под редакцией А.А. Чигуряевой (Konspekt…, 1991), но позднее были исключены из флористических списков. Собранные нами образцы A. nitens и S. borysthenica переданы на хранение в гербарий Саратовского государственного университета имени Н.Г. Чернышевского (SARAT). Далее при анализе полученных результатов мы будем исходить из того, что на территории Саратовской области произрастают 133 вида злаков.
Злаки с половым способом семенной репродукции
Облигатно половой способ семенной репродукции констатировали при отсутствии эмбриологических признаков апомиксиса (Khokhlov et al., 1978; Yudakova, Shishkinskaya, 2008) и наличии эмбриологических доказательств осуществления мейоза и двойного оплодотворения. По результатам анализа к облигатным амфимиктам отнесен 51 (71.8%) из 71 вида (табл. 1).
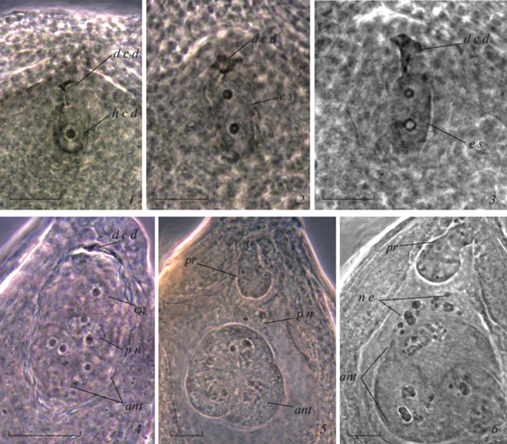
У растений половых видов эмбриологические процессы в женской генеративной сфере осуществлялись типично для злаков (Batygina, 1987, 1997; Yudakova, Shishkinskaya, 2008). В субэпидермальном слое нуцеллуса семязачатка закладывалась единственная археспориальная клетка. Пройдя период роста, она становилась материнской клеткой мегаспор, которая в результате мейоза давала начало тетраде мегаспор с линейным расположением клеток (рис. 1, 1–3). Из халазальной мегаспоры в результате трех последовательных митозов формировался биполярный, восьмиядерный, семиклеточный зародышевый мешок Polygonum-типа (рис. 1, 4; 2, 1). Зрелые мегагаметофиты разных видов различались своими размерами и морфологией антиподального комплекса (рис. 1, 5, 6). Количество антипод варьировало от 3 (например, у Melica nutans и Poa annua) до 10 и более (Agropyron desertorum, Elymus caninus). Исключение составил Melica altissima, у которого обнаружена нехарактерная для злаков ранняя дегенерация антипод, вследствие чего зрелые мегагаметофиты имели четырехклеточное пятиядерное строение (рис. 2, 2, 3). У исследованных половых видов злаков после двойного оплодотворения развивался зародыш (по Graminad-типу эмбриогенеза) и нуклеарный эндосперм, приобретающий к стадии глобулярного зародыша клеточное строение (рис. 1, 7–9). Аномалий мегагаметофитогенеза, эмбрио- и эндоспермогенеза не зарегистрировано.
Рис. 1.
Половые злаки:
1 – тетрада мегаспор (Thinopyrum intermedium), 2, 3 – функциональная халазальная мегаспора и три дегенерирующие микропилярные мегаспоры (Poa annua), 4 – сформированный зародышевый мешок (Poa annua), 5 – зрелый зародышевый мешок (Elymus caninus), 6 – зародышевый мешок на стадии двойного оплодотворения (Thinopyrum intermedium), 7 – зародышевый мешкок с зиготой и ядром первичной клетки эндосперма на стадии телофазы митоза (Poa annua), 8 – проэмбрио и ядерный эндосперм (Poa annua), 9 – глобулярный зародыш и клеточный эндосперм (Setaria verticillata). ant – антиподы, c e – клеточный эндосперм, d ms – дегенерирующие мегаспоры, eg – яйцеклетка, g e – глобулярный зародыш, h ms – халазальная мегаспора, e n – ядра эндосперма, p n – полярные ядра, pr – проэмбрио, sp – спермий, t ms – тетрада мегаспор, zg – зигота. Масштабная линейка – 30 мкм.
Fig. 1. Sexual grasses:
1 – tetrad of megaspores (Thinopyrum intermedium), 2, 3 – functional chalazal megaspore and three degenerating micropylar megaspores (Poa annua), 4 – immature embryo sac (Poa annua), 5 – mature embryo sac (Elymus caninus), 6 – embryo sac at the stage of double fertilization (Thinopyrum intermedium), 7 – embryo sac with zygote and primary cell of endosperm at the telophase of mitosis (Poa annua), 8 – proembryo and nuclear endosperm (Poa annua), 9 – globular embryo and cellular endosperm (Setaria verticillata). ant – antipodes, c e – cellular endosperm, d ms – degenerating megaspores, eg – egg cell, g e – globular embryo, h ms – chalazal megaspore, e n – endosperm nuclei, p n – polar nuclei, pr – proembryo, sp – sperm cell, t ms – tetrad of megaspores, zg – zygote. Scale bar – 30 µm.

Рис. 2.
Дегенерация антипод в зародышевом мешке Melica altissima в процессе его созревания:
1 – сформированный зародышевый мешок, 2, 3 – зрелый зародышевый мешок с дегенерирующими антиподами. ant – антиподы, d ant – дегенерирующие антиподы, eg – яйцеклетка, p n – полярные ядра; s – синергиды. Масштабная линейка – 20 мкм.
Fig. 2. Degeneration of antipodes in the Melica altissima embryo sac during its maturation:
1 – formed embryo sac, 2, 3 – mature embryo sac with degenerating antipodes. ant – antipodes, d ant – degenerating antipodes, eg – egg cell, p n – polar nuclei, s – synergids. Scale bar – 20 µm.

Злаки с эмбриологическими признаками апомиксиса
Апомиктичный способ семенной репродукции констатировали при наличии у изученных растений эмбриологических признаков апомиксиса (Khokhlov et al., 1978; Yudakova, Shishkinskaya, 2008), таких как:
1) присутствие в нуцеллусе рядом с диадами или тетрадами мегаспор апоспорических инициальных клеток или зародышевых мешков (признак апоспории);
2) наличие у видов с одноклеточным археспорием в одном семязачатке нескольких зародышевых мешков на одной или на разных стадиях развития (признак апоспории);
3) развитие зародышевого мешка из халазальной клетки диады мегаспор (признак диплоспории);
4) присутствие в неоплодотворенном зародышевом мешке проэмбрио при интактных полярных ядрах (признак псевдогамии);
5) деление ядер эндосперма в зародышевом мешке без следов проникновения в него пыльцевой трубки (признак автономного апомиксиса).
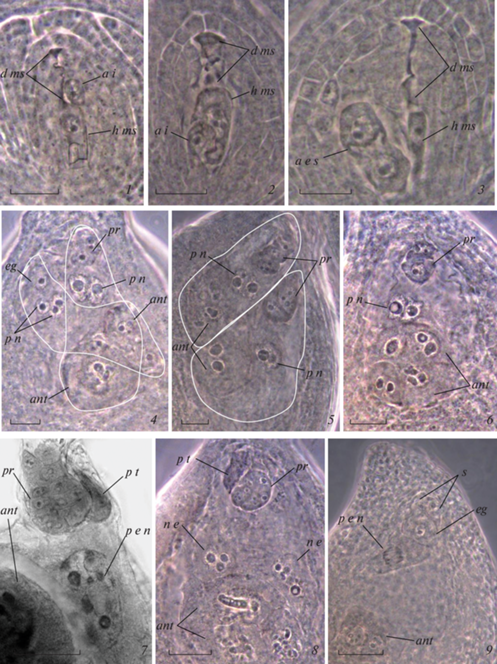
Перечисленные признаки апомиксиса зарегистрированы у 20 (28.2%) из 71 вида, относящихся к 8 родам (табл. 1). В семязачатках растений Agrostis gigantea, A. stolonifera, Lolium gigantea и Poa nemoralis обнаружены функциональные мегаспоры, дву- и четырехъядерные зародышевые мешки, над которыми располагались остатки одной дегенерирующей клетки (рис. 3, 1–3). Сформированные мегагаметофиты были восьмиядерными семиклеточными (рис. 3, 4). Такие эмбриологические особенности характерны для диплоспории Taraxacum-типа (Nogler, 1984; Asker, Jerling, 1992; Shishkinskaya, Yudakova, 2000), при которой в результате модификации мейоза вместо тетрады гаплоидных мегаспор образуется диада клеток с нередуцированным числом хромосом, халазальная клетка диады претерпевает три митоза и дает начало биполярному, восьмиядерному, семиклеточному зародышевому мешку.
Рис. 3.
Злаки с эмбриологическими признаками диплоспории:
1 – диада с развивающейся халазальной и дегенерирующей микропилярной клетками (Lolium giganteum), 2, 3 – двуядерный диплоспорический зародышевый мешок и остатки дегенерирующей микропилярной клетки диады (Agrostis gigantea, L. giganteum), 4 – сформированный диплоспорический зародышевый мешок и остатки дегенерировавшей микропилярной клетки диады (A. stolonifera), 5 – зрелый зародышевый мешок с проэмбрио и полярными ядрами (A. gigantea), 6 – зародышевый мешок с проэмбрио и ядрами эндосперма (A. gigantea). ant – антиподы; d c d – дегенерирующая клетка диады, eg – яйцеклетка, e s – зародышевый мешок, h c d – халазальная клетка диады, e n – ядра эндосперма, p n – полярные ядра, pr – проэмбрио. Масштабная линейка – 30 мкм.
Fig. 3. Grasses with embryological signs of diplospory:
1 – dyad with developing chalazal cell and degenerating micropylar one (Lolium giganteum), 2, 3 – binuclear diplosporic embryo sac and remnants of degenerating micropylar cell of dyad (Agrostis gigantea, L. giganteum), 4 – immature diplosporic embryo sac and remnants of degenerated micropylar cell of dyad (A. stolonifera), 5 – mature embryo sac with proembryo and polar nuclei (A. gigantea), 6 – embryo sac with proembryo and endosperm nuclei (A. gigantea). ant – antipodes; d c d – degenerating cell of dyad, eg – egg cell, e s – embryo sac, h c d – chalazal cell of the dyad, e n – endosperm nuclei, p n – polar nuclei, pr – proembryo. Scale bar – 30 µm.
У изученных растений Anthoxanthum repens, A. nitens, Bromus inermis, Dactylis glomerata, Festuca altissima, F. beckeri, F. rubra, F. rupicola, F. valesiaca, Koeleria glauca, K. piramidata, Lolium pratense, Poa angustifolium, P. bulbosa, P. compressa, P. pratensis обнаружены признаки апоспории: атипичные клетки нуцеллуса, морфология которых соответствовала инициальным клеткам апоспорических зародышевых мешков (рис. 4, 1, 2), апоспорические зародышевые мешки, расположенные рядом с тетрадой мегаспор (рис. 4, 3) и развитие в одном семязачатке нескольких (чаще двух) мегагаметофитов (табл. 1, рис. 4, 4, 5). Зрелые мегагаметофиты были биполярными, содержали трехклеточный яйцевой аппарат, комплекс антипод и центральную клетку с двумя полярными ядрами. Выявленные особенности указывают на развитие нередуцированных зародышевых мешков из соматических клеток нуцеллуса посредством трех митотических делений, т.е. на апоспорию Hieracium-типа (Nogler, 1984; Asker, Jerling, 1992; Shishkinskaya, Yudakova, 2000).
Рис. 4.
Злаки с эмбриологическими признаками апоспории:
1, 2 – апоспорическая инициаль и тетрада мегaспор с функциональной халазальной и тремя дегенерирующими микропилярными клетками (Poa bulbosa, P. angustifiloia), 3 – двуядерный апоспорический зародышевый мешок и тетрада мегaспор (P. angustifiloia), 4, 5 – семязачатки с двумя зародышевыми мешками (P. angustifiloia, P. bulbosa), 6 – зрелый зародышевый мешок с партеногенетическим двуклеточным проэмбрио и неслившимися полярными ядрами, 7 – зародышевый мешок с проэмбрио, остатками пыльцевой трубки и первичным ядром эндосперма (P. angustifiloia), 8 – зародышевый мешок с проэмбрио, остатками пыльцевой трубки и первичной клеткой эндосперма на стадии телофазы митоза (P. angustifiloia), 9 – неоплодотворенный зародышевый мешок с яйцеклеткой, синергидами и первичной клеткой эндосперма на стадии анафазы митоза (Anthoxanthum repens). a e s – апоспорический зародышевый мешок, a i – апоспорическая инициаль, ant – антиподы; d ms – дегенерирующие мегаспоры, eg – яйцеклетка, h ms – халазальная мегаспора, e n – ядра эндосперма, p n – полярные ядра, pr – проэмбрио, p t – остатки пыльцевой трубки, p e n – первичное ядро эндосперма. Масштабная линейка – 30 мкм.
Fig. 4. Grasses with embryological signs of apospory:
1, 2 – aposporic initial and tetrad of megaspores with functional chalazal cell and three degenerating micropilar ones (Poa bulbosa, P. angustifiloia), 3 – binuclear aposporic embryo sac and tetrad of megaspores (P. angustifiloia), 4, 5 – ovules with two embryo sacs (P. angustifiloia, P. bulbosa), 6 – mature embryo sac with parthenogenetic bicellular proembryo and unfused polar nuclei, 7 – fertilized embryo sac with proembryo, pollen tube remnants and primary endosperm nucleus (P. angustifiloia), 8 – embryo sac with proembryo, pollen tube remnants and primary endosperm cell at the telophase of mitosis (P. angustifiloia), 9 – unfertilized embryo sac with an egg cell, synergids and primary endosperm cell at the anaphase of mitosis (Anthoxanthum repens). a e s – aposporic embryo sac, a i – aposporic initial, ant – antipodes; d ms – degenerating megaspores, eg – egg cell, h ms – chalazal megaspore, e n – endosperm nuclei; p n – polar nuclei, pr – proembryo, p t – pollen tube remnants, p e n – primary endosperm nucleus. Scale bar – 30 µm.
Большинство видов с эмбриологическими признаками диплоспории и апоспории характеризовались псевдогамией, при которой сохраняется необходимость оплодотворения центральной клетки зародышевого мешка для образования эндосперма. Партеногенетическое развитие яйцеклетки, как правило, начинается в неоплодотворенных семязачатках (рис. 4, 5, 6), и к моменту проникновения в зародышевый мешок пыльцевой трубки в нем уже присутствует многоклеточный проэмбрио (рис. 4, 7). Наличие в неоплодотворенных зародышевых мешках многоклеточных проэмбрио при интактных полярных ядрах (табл. 1) и деление ядер эндосперма только в тех мегагаметофитах, которые содержали остатки пыльцевых трубок (рис. 4, 8), послужили основанием для констатации псевдогамии у Agrostis gigantea, A. stolonifera, Anthoxanthum repens, Bromus inermis, Dactylis glomerata, Koeleria glauca, K. piramidata, Poa angustifolium, P. bulbosa, P. compressa, P. pratensis.
У Anthoxanthum repens в нескольких зародышевых мешках без следов проникновения пыльцевой трубки присутствовали зиготоподобная яйцеклетка, интактные синергиды и ядерный эндосперм (рис. 4, 9), что может указывать на автономный апомиксис, т.е. возможность развития зародыша и эндосперма без оплодотворения.
У 5 видов Festuca были выявлены эмбриологические признаки апоспории, но убедительных эмбриологических доказательств псевдогамии или автономного развития эндосперма получить не удалось. Возможно, им свойственен редкий тип псевдогамии, когда партеногенетическое развитие яйцеклетки начинается одновременно или после начала развития зародыша (Nogler, 1984). Этот вопрос требует более детального исследования с использованием беспыльцевого режима и других методов.
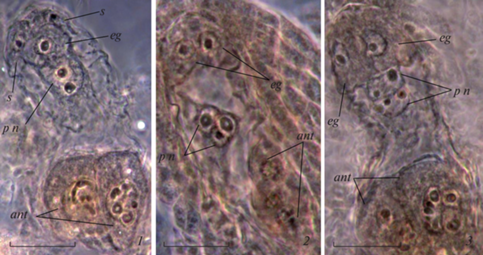
Практически у всех видов с эмбриологическими признаками диплоспории и апоспории наряду с мегагаметофитами нормального строения (рис. 5, 1) были зарегистрированы зародышевые мешки атипичного строения: с тремя полярными ядрами (табл. 1, рис. 4, 4; 5, 2) и яйцеклеткоподобными синергидами (табл. 1, рис. 5, 2, 3). Такие гаметофитные аномалии являются неотъемлемым атрибутом апомиктичных форм, и факт их обнаружения может служить дополнительным косвенным подтверждением наличия апомиксиса у исследованных растений (Khokhlov et al., 1978; Yudakova, Shishkinskaya, 2008). У всех видов апомиксис носил факультативный характер, о чем свидетельствуют обнаруженные тетрады мегаспор (рис. 4, 1–3) и единичные зародышевые мешки на стадии двойного оплодотворения.
Рис. 5.
Зародышевые мешки Festuca rubra:
1 – нормального строения (приводится для сравнения), 2 – с двумя яйцеклеткоподобными клетками и тремя полярными ядрами; 3 – с двумя яйцеклеткоподобными клетками. ant – антиподы, eg – яйцеклетка, p n – полярные ядра, s – синергида. Масштабная линейка – 30 мкм.
Fig. 5. Festuca rubra embryo sacs:
1 – normal structure (given for comparison), 2 – with two egg-like cells and three polar nuclei, 3 – with two egg-like cells. ant – antipodes, eg – egg-like cell, p n – polar nuclei, s – synergid. Scale bar – 30 µm.
Растения разных популяций одного вида характеризовались сходными эмбриологическими особенностями даже в тех случаях, когда микроклиматические условия их произрастания различались. Например, признаки апоспории и псевдогамии были зарегистрированы у растений Poa bulbosa, собранных как в Крастокутском районе, расположенном в зоне сухих степей в южной части Левобережья, так и в Правобережных районах (Ртищевском и Хвалынском), расположенных в зоне лесостепей (табл. 1). Различия по частоте эмбриологических признаков апомиксиса у растений разных популяций одного вида, на наш взгляд, не являются отражением разной степени проявления у них апомиксиса. Скорее всего, они обусловлены тем, что фиксацию материала проводили однократно, и поэтому анализируемые растения могли находиться на разных стадиях генеративного развития.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ранее проведенных исследованиях злаков флоры Саратовской области апомиксис был диагностирован у Lolium arundinaceum subsp. orientale (Hack.) G.H. Loos (Kashin et al., 2009) и Poa remota Forsell. (Yudakova, Shakina, 2006). Флора региона также включает еще 2 апомиктичных вида: Digitaria eriantha Steud. (Purcell, 1965) и Poa palustris L. (Zhirov, 1967; Naumova at al., 1999). Суммируя эти данные с результатами наших исследований, можно констатировать, что 18.0% (24 из 133) видов злаков флоры Саратовской области способны размножаться апомиктично. Такая значительная доля апомиктов в злаковом компоненте флоры не совсем согласуется с популярной теорией географического партеногенеза, которая постулирует приуроченность апомиктов к большим высотам и/или северным широтам (Vandel, 1928; Bierzychudek, 1985; van Dijk, 2003). Исходя из положений этой теории, Саратовскую область нельзя отности к районам, благоприятствующим для произрастания апомиктов. Она расположена в умеренной климатической зоне, в средних широтах и, главным образом, на равнине (самая высокая точка – гора Беленькая, 379 м над уровнем моря).
Выявленные апомиктичные злаки относятся к 9 родам: Agrostis, Anthoxanthum, Bromus, Dactylis, Digitaria, Festuca, Koeleria, Lolium и Poa. Впервые был установлен тип апомиксиса у Bromus inermis, Dactylis glomerata и Agrostis stolonifera. В 1978 г. С.С. Хохлов и соавт. (Khokhlov et al., 1978) внесли B. inermis и D. glomerata в список апомиктов, как виды с нерегулярным гаплоидным партеногенезом, а A. stolonifera, как вид, у которого апомиксис установлен экспериментально, но его тип не определен. В списке J. Carman (1997) роды Agrostis и Dactylis отсутствуют, а Bromus включен в перечень, как род, у представителей которого зарегистрирован не гаметофитный, а спорофитный апомиксис (нуцеллярная эмбриония). В ходе проведенного нами анализа установлено, что у A. stolonifera апомиксис реализуется в форме диплоспории Taraxacum-типа и псевдогамии, а у B. inermis и D. glomerata – в форме апоспории Hieracium-типа и псевдогамии.
Ранее неоднократно отмечалось, что основное количество апомиктов сосредоточено внутри высоко полиморфных родов с большим числом видов, для которых характерна полиплоидия и гибридизация (Gustafsson, 1947; Khokhlov, 1970; Asker, Jerling, 1992). Именно к таким родам принадлежат выявленные апомиктичные злаки флоры Саратовской области. Исключение составляет только D. glomerata, который относится к роду, объединяющему всего два вида. Однако D. glome-rata характеризуется значительным внутривидовым полиморфизмом, в нем выделяют 20 подвидов (The Wold…, 2022). Кроме того, ранее его включали в высоко полиморфные апомиктичные роды Koeleria и Festuca. Наличие апомиксиса у представителя олиготипного рода и значительный внутривидовой полиморфизм могут быть обусловлены тем, что род Dactylis – в эволюционном масштабе молодой, возможно, “недавно” отделившийся от какого-либо крупного полиморфного рода, и в котором в настоящее время активно осуществляются микроэволюционные процессы.
Накопленные к настоящему времени данные о распределении апомиктов в системе покрытосеменных растений показывают, что они, как правило, приурочены к определенным систематическим группам (Asker, Jerling, 1992; Shishkinskaya et al., 2004; Hojsgaard et al., 2014). Виды одного рода чаще всего имеют одну и ту же форму апомиксиса. Обнаружение апомиксиса хотя бы у одного из представителей рода, открывает перспективы выявления его у близкородственных видов. В связи с этим, особого внимания заслуживают роды Agrostis и Dactilis, поскольку A. gigantea, А. stoloni-fera и D. glomerata стали их первыми представителями, у которых обнаружен гаметофитный апомиксис.
ЗАКЛЮЧЕНИЕ
В результате анализа растений 117 популяций 71 вида злаков флоры Саратовской области облигатно половой способ семенной репродукции зарегистрирован у 51 вида (71.8%), цитоэмбриологические признаки факультативного гаметофитного апомиксиса обнаружены у 20 (28.2%) видов. Суммирование полученных данных с результатами ранее проведенных исследований свидетельствуют о том, что во флоре Саратовской области апомиктичные злаки представлены 24 видами 9 родов. Преобладающим типом апомиксиса у них является апоспория Hieracium-типа в сочетании с псевдогамией. Исключение составляют Agrostis gigantea, A. stolonifera, Lolium gigantea и Poa nemoralis, которым свойственна диплоспория Taraxacum-типа.
Список литературы
Asker S.E., Jerling L. 1992. Apomixis in plants. Boca Raton. London. 292 p.
[Batygina] Батыгина Т.Б. 1987. Хлебное зерно. Л. 102 с.
[Batygina] Батыгина Т.Б. 1997. Эмбриогенез злаков. – В кн.: Эмбриология цветковых растений. Терминология и концепции. Т. 2. Семя. СПб. С. 528–539.
Barcaccia G., Albertini E. 2013. Apomixis in plant reproduction: a novel perspective on an old dilemma. – Plant Reprod. 26 (3): 159–179. https://doi.org/10.1007/s00497-013-0222-y
Bierzychudek P. 1985. Petterns in plant parthenogenesis. – Experientia. 41: 1255–1264. https://doi.org/10.1007/BF01952068
Brožová V., Koutecký P., Doležal J. 2019. Plant apomixis is rare in Himalayan high-alpine flora. – Sci. Rep. 9: 14386. https://doi.org/10.1038/s41598-019-50907-5
Burgess M.B., Cushman K.R., Doucette E.T., Talent N., Frye C.T., Campbell C.S. 2014. Effects of apomixis and polyploidy on diversification and geographic distribution in Amelanchier (Rosaceae). – Am. J. Bot. 101 (8): 1375–1387. http://www.jstor.org/stable/43826691
Carman J.G. 1995. Gametophytic angiosperm apomicts and the occurrence of polyspory and polyembryony among their relatives. – Apomixis newsletter. 8: 39–53.
Carman J.G. 1997. Asynchronous expression of duplicate genes in angiosperms may cause apomixis, bispory, tetraspory and polyembryony. – Biol. J. Linn. Soc. 61 (1): 51–94. https://doi.org/10.1111/j.1095-8312.1997.tb01778.x
[Elenevskiy et al.] Еленевский А.Г., Буланый Ю.И., Радыгина В.И. 2008. Конспект флоры Саратовской области. Саратов. 232 с.
[Flora…] Флора Саратовской области. 1991. Т. 8. Саратов. 76 с.
Gustafsson A. 1947. Apomixis in higher plants. – Lunds. Univ. Arsskrift. 43 (69): 1–370.
Herr Jm.J.M. 1971. A new clearing-squash technique for study of ovule, development in angiosperms. – Am. J. Bot. 58 (8): 785–790. https://doi.org/10.2307/2441475
Hojsgaard D., Klatt S., Baier R., Carman J.G., Hörandl E. 2014. Taxonomy and biogeography of apomixis in angiosperms and associated biodiversity characteristics. – Crit. Rev. Plant Sci. 33 (5): 414–427. https://doi.org/10.1080/07352689.2014.898488
Hörandl E., Dobeš C., Suda J., Vít P., Urfus T., Temsch E.M., Cosendai A.-C., Wagner J., Ladinig U. 2011. Apomixis is not prevalent in subnival to nival plants of the European Alps. – Annals of Botany. 108 (2): 381–390. https://doi.org/10.1093/aob/mcr142
[Kashin et al.] Кашин А.С., Кочанова И.С., Лисицкая Н.М., Березуцкий М.А. 2012. Распространение гаметофитного апомиксиса у представителей семейства Asteraceae во флорах Нижнего Поволжья и Северо-Западного Кавказа. – Поволжский экологический журнал. 1: 22–32.
[Kashin et al.] Кашин А.С., Юдакова О.И., Кочанова И.С., Полянская М.В., Миндубаева А.Х. 2009. Распространение гаметофитного апомиксиса в семействах Asteraceae и Poaceae (на примере видов флоры Саратовской области). – Бот. журн. 94 (5): 744–756.
[Khokhlov et al.] Хохлов С.С., Зайцева М.И., Куприянов П.Г. 1978. Выявление апомиктичных форм во флоре цветковых растений СССР. Саратов. 224 с.
[Khokhlov] Хохлов С.С. 1970. Эволюционно-генетические проблемы апомиксиса у покрытосеменных растений. – В кн.: Апомиксис и селекция. М. С. 7–21.
Mazzucato A., Falcinelli M., Veronesi F. 1996. Evolution and adaptedness in facultatively apomictic Poa pratensis L. – Euphytics. 92 (1–2): 13–19.
Naumova T.N., Osadtchiy J.V., Sharma V.K., Dijkhuis P., Ramulu K.S. 1999. Apomixis in plants: structural and functional aspects of diplospory in Poa nemoralis and P. palustris. – Protoplasma. 208 (1–4): 186–195.
Nogler G.A. 1984. Gametophytic apomixis. – In: Embryology of angiosperms. Berlin. P. 475–517.
Ozias-Akins P. 2006. Apomixis: developmental characteristics and genetics. – Critical reviews in plant sciences. 25: 199–214. https://doi.org/10.1080/07352680600563926
[Petrov] Петров Д.Ф. 1988. Апомиксис в природе и в опыте. Новосибирск. 213 с.
Purcell C.M. 1965. Embryo-sac development in two accessions of giant pangola Digitaria valida Stent. – J. Agric. Univ. of Puerto Rico. 49 (4): 477–483.
Savidan Y.H. 2007. Apomixis in higher plants. – In: Apomixis: evolution, mechanisms and perspectives. Liechtenstein. P. 15–22.
[Shishkinskaya, Yudakova] Шишкинская Н.А., Юдакова О.И. 2000. Классификация апомиксиса. – В кн.: Эмбриология растений: Терминология и концепции. Т. 3. СПб. С. 168–180.
[Shishkinskaya et al.] Шишкинская Н.А., Юдакова О.И., Тырнов В.С. 2004. Популяционная эмбриология и апомиксис у злаков. Саратов. 145 с.
Spillane Ch., Steimer A., Grossniklaus U. 2001. Apomixis in agriculture: the quest for clonal seeds. – Sex. Plant Reprod. 14 (4): 179–187. https://doi.org/10.1007/s00497-001-0117-1
Stebbins G.L. 1950. Variation and evolution in plants. New-York. 643 p.
The Wold checklist of Vascular Plants (WCVP). 2022. https://wcvp.science.kew.org (Accessed 05.02.2022).
[Tzvelev] Цвелев Н.Н. 1976. Злаки. Л. 788 с.
[Tzvelev] Цвелев Н.Н. 1987. Система злаков (Poaceae) и их эволюция. – Комаровские чтения. Л. 37. С. 1–75.
Van Dijk P.J. 2003. Ecological and evolutionary opportunities of apomixis: insights from Taraxacum and Chondrilla. – Trans. R. Soc. Lond. B. Biol. Sci. 358 (1434): 1113–1121. https://doi.org/10.1098/rstb.2003.1302
Van Valen L. 1973. A new evolutionary law. – Evol. Theory. 1: 1–30.
Vandel A. 1928. La parthenogenese geograhpique. Contribution a l’etude biologique de la parthenogenese naturelle. – Bullrtin Bilogique de la France et de la Belgique. 62: 164–182.
[Yudakova et al.] Юдакова О.И., Гуторова О.В., Беляченко Ю.А. 2012. Методы исследования репродуктивных структур и органов растений. Саратов. 34 с.
[Yudakova, Shakina] Юдакова О.И., Шакина Т.Н. 2006. Псевдогамный апомиксис у Poa сhaixii. – Изв. Высших учебных заведений. Поволжский регион. Сер. Естественные науки. 5: 277–284.
[Yudakova, Shishkinskaya] Юдакова О.И., Шишкинская Н.А. 2008. Особенности эмбриологии апомиктичных злаков. Саратов. 105 с.
[Yudakova] Юдакова О.И. 2010. Апомиксис у дикорастущих злаков. – В кн.: Апомиксис и репродуктивная биология. Саратов. С. 17–25.
[Zhirov] Жиров Е.Г. 1967. Цитоэмбриологическое изучение наследования диплоспории у Poa palustris. – В кн.: Цитология и генетика культурных растений. Новосибирск. С. 184–201.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


