Ботанический журнал, 2023, T. 108, № 1, стр. 23-36
МИКРОМОРФОЛОГИЯ ПОВЕРХНОСТИ ЭПИДЕРМЫ ЛИСТЬЕВ НЕКОТОРЫХ ВИДОВ PYRINAE (ROSACEAE)
А. В. Бабоша 1, *, А. С. Рябченко 1, **, Т. Х. Кумахова 2, ***
1 Главный ботанический сад им. Н.В. Цицина РАН
127276 Москва, ул. Ботаническая, 4, Россия
2 Российский государственный аграрный университет – МСХА им. К.А. Тимирязева
127550 Москва, Тимирязевская ул., 49, Россия
* E-mail: phimmunitet@yandex.ru
** E-mail: marchellos@yandex.ru
*** E-mail: tkumachova@yandex.ru
Поступила в редакцию 27.04.2022
После доработки 11.12.2022
Принята к публикации 16.12.2022
- EDN: LNHXBL
- DOI: 10.31857/S0006813623010027
Аннотация
Методом сканирующей электронной микроскопии (криоСЭМ) исследованы особенности микроморфологии поверхности эпидермы листьев представителей 6 родов: Sorbus L., Aronia Medik., Amelanchier Medik., Cydonia Mill., Cotoneaster Medik., Crataegus L. (Rosaceae). Поверхность листьев исследованных растений имела кутикулярную складчатость двух типов. У Cotoneaster melanocarpus и Sorbus aucuparia наблюдали одиночные кутикулярные тяжи, как правило, расположенные на одной клетке, но более крупные и иногда разветвленные. У остальных видов складчатость имела форму многочисленных мелких параллельных микротяжей, идущих вдоль длинной оси клетки. Разную степень проявления кутикулярной складчатости обоих типов наблюдали на поверхности основных клеток эпидермы на одной или обеих сторонах листовой пластинки. Кроме того, радиально расходящиеся микротяжи окружали устьица и трихомы, а у Amelanchier spicata и Sorbus aucuparia также и папиллы в области устьиц. Все исследованные виды имели хорошо выраженный устьичный диморфизм. Более крупные первичные устьица с хорошо выраженной складчатостью располагались на некотором удалении или в центре группы из нескольких более мелких вторичных устьиц. Доля первичных устьиц составляла от 5 до 17%. У исследованных видов наблюдалась отрицательная корреляция между длиной устьиц и плотностью их размещения на поверхности листьев, которая близка к аналогичной корреляции в других таксонах.
Особенности тонкого строения эпидермы листьев покрытосеменных растений привлекают особое внимание при проведении экологических и мониторинговых исследований. Предполагают, что кутикулярная складчатость влияет на смачиваемость поверхности листьев, складки принимают участие в согласовании роста эпидермы в ходе развития пластинки, изменяют механические свойства поверхности, придавая жесткость и прочность на изгиб, регулируют работу устьичного комплекса и др. (Evert, Eichhorn, 2006; Pautov, Vasil’yeva, 2010; Pautov et al., 2017, 2019; Кumakhova et al., 2021 и др.). Микрорельеф эпидермы листьев обладает высоким уровнем стабильности в пределах вида. Это позволяет использовать признаки микрорельефа в качестве диагностических в систематике растений при составлении ключей (Dehgan, 1980; Carr, Carr, 1990; Fontenelle et al., 1994; Akçin et al., 2013; Pautov et al., 2014; Ullah et al., 2021). У ряда видов покрытосеменных обнаружен полиморфизм устьиц. Так, в листьях Populus tremula обнаружены парацитные и латероцитные устьица (Pautov, 2009). Устьица Exbucklandia po-pulnea могут быть парацитными, латероцитными, энциклоцитными и переходных типов (Pautov et al., 2015). Однако, среди устьиц одного и того же типа можно выделить более или менее различающиеся группы. Довольно крупные или одиночные первичные устьица закладываются и начинают функционировать на ранних этапах развития листовой пластинки в отличие от более поздних вторичных устьиц меньшего размера (Carr, Carr, 1990). Устьичный диморфизм подобного типа был обнаружен у более чем 200 видов двудольных (Boldt, Rank, 2010). В этом списке присутствуют и представители Pyrinae, в частности родов Malus и Pyrus (Boldt, Rank, 2010) и др. Ранее устьица разных типов были найдены нами у представителей Malus domestica (Babosha et al., 2020).
Подтриба Pyrinae (ранее подсемейство Maloideae, Rosaceae) включает до 950 видов, среди которых представлены виды со съедобными плодами и виды, имеющие декоративную и лекарственную ценность (Campbell et al., 2007). Pyrinae отличаются хромосомным числом 17 и наличием многочисленных тычинок (20 и более) в цветке. Плоды Pyrinae – это яблоки (pome) или многокостянки (polypyrenous drupe) (Kamelin, 2006; Takhtajan, 2009; Xiang et al., 2017 и др.).
Представители подтрибы широко распространены в умеренном и субтропическом поясах северного полушария (Kamelin, 2006). По числу видов среди них преобладают: Crataegus (200 и более видов), произрастающие в северной умеренной зоне; Cotoneaster (около 100 видов) – в Евразии, особенно в Гималаях, Китае и Северной Африке и Sorbus (100 и более видов) – в северной умеренной зоне. Многие виды Pyrinae – горные и высокогорные растения. Например, виды Cotoneaster и Sorbus произрастают в светлых редколесьях горных склонов и по горным ущельям, образуя рощи, зачастую они поднимаются до верхней границы лесного пояса и заходят за полярный круг. Даже в тропиках за некоторым исключением немногочисленные представители Pyrinae (Maloideae) произрастают главным образом в горах (Takhtajan et al., 1981).
Целью данной работы является изучение адаксиальной и абаксиальной кутикулярной складчатости на поверхности листьев, а также полиморфизма устьиц у некоторых представителей Pyrinae, для возможного их использования в качестве дополнительных микроморфологических признаков в таксономии.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве модельных объектов для исследования были выбраны закончившие рост листья представителей 6 родов подтрибы Pyrinae семейства Rosaceae: Sorbus L. (Sorbus aucuparia L.), Cydonia Mill. (Cydonia oblonga Mill.), Aronia Medik. (Aronia mitschurinii A. Skvorts. et Maitulina), Amelanchier Medik. (Amelanchier spicata (Lam.) C. Koch), Cotoneaster Medik. (Cotoneaster melanocarpus Fisch. ex A. Blytt.) и Crataegus L. (Crataegus sanguinea Pall., C. submollis Sarg.). Видовые названия изученных растений приведены по С.К.Черепанову (Czerepanov, 1995). Материал для исследований собран в Ботаническом саду имени С.И. Ростовцева (РГАУ – МСХА имени К.А. Тимирязева) и Кабардино-Балкарии, кроме образцов Cydonia oblonga Mill., собранных в республике Дагестан (Murtazaliyev, 2009). Зрелые листья средних размеров отбирали из средней части кроны 3-х модельных деревьев.
Фрагменты (1 см2) живых листьев вырезали из средней части и наклеивали на медную пластинку 2 × 4 см с помощью термопасты АлСил-3 либо КПТ-8 (Ryabchenko, Babosha, 2011). Затем пластинку с препаратами закрепляли на столике замораживающей приставки “Deben Coolstage” (Великобритания) с небольшим количеством той же термопасты. Препараты исследовали с помощью сканирующего электронного микроскопа (СЭМ) – LEO – 1430 VP (Carl Zeiss) при –30°С в режиме высокого вакуума (криоСЭМ).
Количественные параметры основных клеток эпидермы – среднюю площадь клетки (мкм2) верхней (Sada) и нижней (Saba) поверхности листьев, плотность размещения устьиц (St, мм–2), длину (L, мкм) и ширину (S, мкм) замыкающих клеток – измеряли на 5−10 цифровых микрографиях в программе Image J. Приведены средние значения величин и стандартные ошибки. Статистические вычисления проводили с использованием программы Microsoft Excel, а также пакета Shiny (Assaad et al., 2014).
РЕЗУЛЬТАТЫ
Адаксиальная сторона поверхности листьев большинства изученных видов образована однотипными клетками эпидермы (рис. 1). Только у видов Crataegus sanguinea и Sorbus aucuparia наблюдали единичные простые трихомы (рис. 2.3; 3.1). По форме клетки эпидермы почти изодиаметрические, слегка продолговатые, многоугольные или лопастные. Очертания стенок клеток адаксиальной эпидермы варьировали от прямолинейных (S. aucuparia, Aronia mitschurinii, Cotoneaster melanocarpus), до извилистых у Amelanchier spicata и Cydonia oblonga (рис. 1). Наиболее крупные клетки наблюдали у A. mitschurinii, а у обоих видов Crataegus, Cydonia oblonga и Cotoneaster melanocarpus клетки адаксиальной эпидермы были относительно небольшой величины (табл. 1).
Рис. 1.
Фрагменты адаксиальной поверхности (1−4, кутикулярная складчатость; 5, 6 − восковые отложения) листьев Pyrinae (Rosaceae), СЭМ-микрографии: 1 − Sorbus aucuparia L.; 2 − Crataegus sanguinea Pall.; 3 − Cydonia oblonga Mill., дикорастущий; 4 − Aronia mitschurinii A. Skvortsov et Maitul.; 5 – Amelanchier spicata (Lam.) C. Koch; 6 − Cotoneaster melanocarpus Fisch. ex A. Blytt (→ кутикулярные складки).
Fig. 1. Fragments of the adaxial surface (1−4, cuticular folding; 5, 6 − wax deposits) of Pyrinae (Rosaceae) leaves, SEM micrographs: 1 − Sorbus aucuparia L.; 2 − Crataegus sanguinea Pall.; 3 − Cydonia oblonga Mill., wild; 4 − Aronia mitschurinii A. Skvortsov et Maitul.; 5 − Amelanchier spicata (Lam.) C. Koch; 6 − Cotoneaster melanocarpus Fisch. ex A. Blytt (→ cuticular folds).

Таблица 1.
Основные параметры изучаемых видов Pyrinae Table 1. Main parameters of the studied Pyrinae species
| Sada | Saba | St | L | S | L/S | I, % | |
|---|---|---|---|---|---|---|---|
| Amelanchierspicata (Lam.) C. Koch | 1480 ± 106b | 743 ± 38bc | 189 ± 24cd | 22.7 ± 0.5d | 9.9 ± 0.3d | 2.32 ± 0.055a | 12.4 ± 3.1 |
| Aronia mitschurinii A.K. Skvortsov et Maitul. | 3330 ± 98a | 2190 ± 86a | 112 ± 10d | 36.5 ± 0.4a | 20.6 ± 0.3a | 1.78 ± 0.02b | 6.1 ± 1.1 |
| Cotoneaster melanocarpus Fisch. ex A. Blytt | 1030 ± 70c | 434 ± 34a | 19.0 ± 0.2e | 15.1 ± 0.2c | 1.28 ± 0.03f | 5.0 ± 1.7 | |
| Crataegus sanguinea Pall. | 625 c | 608 ± 38cd | 149 ± 8.6cd | 30.5 ± 0.5b | 21.7 ± 0.3a | 1.41 ± 0.02e | 15.1 ± 2.7 |
| Сrataegus submollis Sarg. | 1040bc | 784 ± 92bc | 253 ± 36bc | 26.2 ± 0.4c | 16.4 ± 0.2b | 1.6 ± 0.03cd | 14.5 ± 4.2 |
| Cydonia oblonga Mill. | 881 ± 36.1c | 421 ± 25.9d | 344 ± 44.7ab | 17.6 ± 0.274e | 10.5 ± 0.201d | 1.69 ± 0.03bc | 10 ± 2.6 |
| Sorbus aucuparia L. | 1270 ± 31bc | 883 ± 33b | 120 ± 12d | 24.3 ± 0.7cd | 16.3 ± 0.5b | 1.5 ± 0.03de | 17.4 ± 4.1 |
Примечание. Приведены средняя площадь клетки (мкм2) верхней (Sada) и нижней (Saba) поверхности листьев, плотность размещения устьиц (St, мм–2), длина (L, мкм) и ширина (S, мкм) устьиц и процент первичных устьиц (I, %), а также их ошибки. Средние значения в одном столбце, отмеченные разными буквами, достоверно (p < 0.05) отличаются по результатам проведения однофакторной ANOVA и TUKEY-теста.
Note. Given in the Table are: average cell area (µm2) of the upper (Sada) and lower (Saba) leaf surfaces, density of stomata placement (St, mm–2), length (L, µm) and width (S, µm) of stomata, and the percentage of primary stomata (I, %), as well as their errors. Mean values in the same column, marked with different letters, differ significantly (p < 0.05) according to the results of one-way ANOVA and TUKEY test.
На поверхности адаксиальной эпидермы большинства видов отмечается по-разному организованный складчатый микрорельеф кутикулярной природы (рис. 1.1−5). Можно выделить следующие варианты микрорельефа: 1) многочисленные на каждой клетке, длинные, слегка извилистые складки, которые продолжаются на соседние клетки и образуют единую структуру по всей поверхности листовой пластинки (C. oblonga, оба вида Сrataegus, рис. 1.2, 3); 2) на одной клетке располагается по одной разветвляющейся короткой складке, между которыми находятся плоские нерельефные участки (S. aucuparia, рис. 1.1); 3) длинные одиночные складки, лежащие над антиклинальными стенками клеток эпидермы (Aronia mitschurinii, рис. 1.4); 4) складки или микротяжи отсутствуют или не видны (Amelanchier spicata и Cotoneaster melanocarpus), при этом на поверхности листьев наблюдали небольшие отложения эпикутикулярного воска в виде мелких гранул и хлопьев (рис. 1.5, 6).
Абаксиальная эпидерма всех модельных объектов состояла из нескольких клеточных типов: клеток основной эпидермы, устьиц и трихом (рис. 2.1−6; 5.1−6; 6.1−6). Антиклинальные стенки основных клеток эпидермы в очертаниях прямые (S. aucuparia) или извилистые (A. spicata, A. mitschurinii, C. oblonga, C. sanguinea, C. submollis). У C. melanocarpus антиклинальные стенки эпидермальных клеток практически не просматривались из-под многочисленных кутикулярных складок (рис. 5.6; 6.6). На абаксиальной стороне наиболее крупными были клетки эпидермы A. mitschurinii. Небольшой величиной эпидермальной клетки выделялся C. oblonga (табл. 1). Средняя площадь клеток абаксиальной и адаксиальной эпидермы на выборке исследованных видов сильно коррелировали между собой (табл. 2 ).
На абаксиальной стороне листьев у всех видов наблюдали простые одиночные трихомы, которые либо сохранялись на протяжении всей жизни листа, либо опадали на ранней стадии развития или по окончании роста листовой пластинки (рис. 2; 3.4). Сильная опушенность с равномерным распределением трихом была характерна для C. oblonga (рис. 2.2 ). Трихомы C. oblonga очень длинные, несколько извилистые, не имели определенной ориентации. У C. sanguinea и C. submollis трихомы были сосредоточены вдоль крупных жилок, они были окружены розеткой из 5−6 клеток, приподнятых над основными клетками эпидермы (рис. 3.1, 2).
Рис. 2.
Фрагменты абаксиальной (1, 2, 4−6) и адаксиальной (3) поверхности поверхности листьев Pyrinae (Rosaceae), СЭМ-микрографии: 1 − Sorbus aucuparia L.; 2 − Cydonia oblonga Mill., дикорастущий; 3 − Crataegus submollis Sarg., 4 − Crataegus sanguinea Pall.; 5 – Amelanchier spicata (Lam.) C. Koch; 6 − Aronia mitschurinii A. Skvortsov et Maitul. (→ трихомы).
Fig. 2. Fragments of abaxial (1, 2, 4−6) and adaxial (3) surfaces of Pyrinae (Rosaceae) leaves, SEM micrographs: 1 − Sorbus aucuparia L.; 2 − Cydonia oblonga Mill., wild; 3 − Crataegus submollis Sarg., 4 − Crataegus sanguinea Pall.; 5 − Amelanchier spicata (Lam.) C. Koch; 6 − Aronia mitschurinii A. Skvortsov et Maitul. (→ trichomes).

У S. aucuparia и A. spicata большинство основных клеток эпидермы имели папиллы (рис. 4.). Зрелая папилла состояла из более компактной, расширенной верхней части (головки) и ножки с 5−7 мощными расходящимися в разные стороны ребрами. В большинстве случаев ребра ножки одной клетки соединялись с аналогичными образованиями соседних клеток, либо с микротяжами. У S. aucuparia папиллы имелись у 80−90% основных клеток эпидермы. Встречались клетки, которые имели несформированные или редуцированные папиллозные образования. Чаще клетки с крупными зрелыми папиллами наблюдали вокруг устьиц (рис. 4.1−2). На замыкающих клетках папилл не было, но каждое устьице окружали 6−8 клеток эпидермы с хорошо развитыми папиллами.
Рис. 3.
Трихомы на поверхности (1, 2 − адаксиальная, 3, 4 − абаксиальная) листьев Pyrinae (Rosaceae), СЭМ-микрографии: 1 − Crataegus sanguinea Pall.; 2 − Crataegus submollis Sarg.; 3 − Cydonia oblonga Mill., дикорастущий; 4 − Sorbus aucuparia L. тр − трихомы (→ основание опавшей трихомы, * − кутикулярные микротяжи).
Fig. 3. Trichomes on the surface (1, 2 − adaxial, 3, 4− abaxial) of Pyrinae (Rosaceae) leaves, SEM micrographs: 1 − Crataegus sanguinea Pall.; 2 − Crataegus submollis Sarg.; 3 − Cydonia oblonga Mill., wild; 4 − Sorbus aucuparia L. mр − trichomes (→ base of a fallen trichome, * − cuticular microstrands).

Рис. 4.
Папиллы на абаксиальной поверхности листьев Pyrinae (Rosaceae), СЭМ микрографии: 1, 2 − Sorbus aucuparia L.; 3 − Amelanchier spicata (Lam.) C. Koch. у − устьице (* − папилла).
Fig. 4. Papillae on the abaxial surface of Pyrinae (Rosaceae) leaves, SEM micrographs: 1, 2 − Sorbus aucuparia L.; 3 − Amelanchier spicata (Lam.) C. Koch. у − stoma (* − papilla).
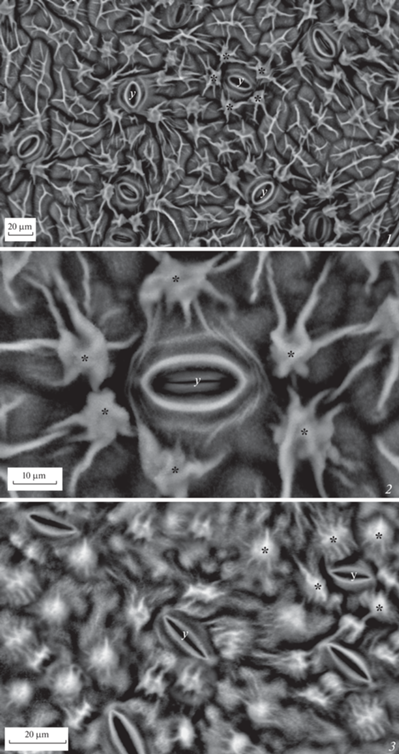
Абаксиальная поверхность имела складчатый микрорельеф (рис. 6). У A. mitschurinii, C. oblonga, C. sanguinea и С. submollis основные клетки абаксиальной эпидермы были покрыты многочисленными мелкими параллельными складками вдоль длинной оси клетки. Кутикулярные тяжи радиально расходились также от клеток устьичного комплекса (рис. 5). Несколько крупных тяжей и множество мелких складок окружали основания трихом С. sanguinea и C. submollis, C. oblonga, S. aucuparia (рис. 3). Как указывалось ранее (табл. 1), все эти виды имели сходную складчатость и на адаксиальной поверхности.
Рис. 5.
Устьица на абаксиальной стороне поверхности листьев Pyrinae (Rosaceae), СЭМ-микрографии: 1 − Sorbus aucuparia L.; 2 − Crataegus sanguinea Pall; 3 − Cydonia oblonga Mill., дикорастущий; 4 − Amelanchier spicata (Lam.) C. Koch; 5 − Aronia mitschurinii A A. Skvortsov et Maitul.; 6 − Cotoneaster melanocarpus Fisch. ex A. Blytt. у − устьице (→ кутикулярные микротяжи, * − папиллы).
Fig. 5. Stomata on the abaxial side of the leaf surface of Pyrinae (Rosaceae), SEM micrographs: 1 − Sorbus aucuparia L.; 2 − Crataegus sanguinea Pall; 3 − Cydonia oblonga Mill., wild; 4 − Amelanchier spicata (Lam.) C. Koch; 5 − Aronia mitschurinii A. Skvortsov et Maitul.; 6 − Cotoneaster melanocarpus Fisch. ex A. Blytt. y − stoma (→ cuticular microstrands, * − papillae).

Рис. 6.
Устьица (первичные и вторичные) на абаксиальной поверхности листьев Pyrinae (Rosaceae), СЭМ микрографии: 1 − Sorbus aucuparia L.; 2 − Cydonia oblonga Mill., дикорастущий; 3 − Crataegus sanguinea Pall.; 4 − Amelanchier spicata (Lam.) C. Koch; 5 − Aronia mitschurinii A. Skvortsov et Maitul.; 6 − Cotoneaster melanocarpus Fisch. ex A. Blytt. у − устьице.
Fig. 6. Stomata (primary and secondary) on the abaxial surface of Pyrinae (Rosaceae) leaves, SEM micrographs: 1 − Sorbus aucuparia L.; 2 − Cydonia oblonga Mill., wild; 3 − Crataegus sanguinea Pall.; 4 − Amelanchier spicata (Lam.) C. Koch; 5 − Aronia mitschurinii A. Skvortsov et Maitul.; 6 − Cotoneaster melanocarpus Fisch. ex A. Blytt. y – stoma.

У A. spicata и S. aucuparia отмечались складки, расходящиеся от папиллозных образований, окружающих устьица, а у S. aucuparia – складки, радиально расходящиеся от клеток трихом (рис. 4). У C. melanocarpus одна крупная разветвляющаяся складка находилась на поверхности основных клеток между устьицами и клетками над жилками. У этого вида аналогичные крупные складки радиально окружали устьичный комплекс и клетки трихом.
Устьица всех модельных растений аномоцитные. A. mitschurinii выделялся среди исследованных видов наиболее крупными устьицами. Устьица C. melanocarpus и C. oblonga были небольшого размера (табл. 1). У всех видов наблюдали устьичный диморфизм. Даже визуально можно было выделить, по крайней мере, 2 типа устьиц (рис. 6.). Первичные устьица были более крупного размера и располагались на некотором расстоянии от остальных или в центре группы из нескольких более мелких вторичных устьиц. Доля первичных устьиц составляла от 5 до 17% (табл. 1). Помимо более крупных размеров первичные устьица выделялись также более выраженной радиальной складчатостью и большим числом кутикулярных тяжей.
В табл. 2 представлена корреляционная матрица для измеренных микроморфологических параметров. Из вычисленных коэффициентов корреляции 4 достигали достоверной величины или близки к ней. Их графики разброса и соответствующие линии регрессии представлены на рис. 7. Корреляция длины и ширины устьиц предполагает определенное постоянство формы. Устьица Amelanchier spicata и Aronia mitschurinii были более сильно вытянуты, у остальных видов, судя по величине отношения L/S, имели существенно более округлую форму. Тем не менее, длина и ширина устьиц у исследованных видов находились в пределах доверительного интервала линии регрессии L(S) или эти параметры не слишком сильно выходили за пределы интервала (рис. 7.1).
Рис. 7.
Взаимозависимость некоторых параметров микроморфологии для 7 видов Pyrinae: 1 − зависимость средней длины устьица (L) от его ширины (S); 2 − плотности размещения устьиц (St) от средней длины устьица (L); 3 − средней площади основных клеток адаксиальной эпидермы (Sada) от средней площади клеток абаксиальной эпидермы (Saba); 4 − средней площади клеток абаксиальной эпидермы (Saba) от длины устьица (L). На графиках представлены средние значения каждого параметра и их доверительный интервал для каждого исследованного вида растений, линии регрессии и их доверительный интервал, уравнения для каждой линии регрессии.
Fig. 7. Interdependence of some micromorphological parameters in 7 Pyrinae species. Dependence of: 1 − the average length of stoma (L) on its width (S); 2 − the density of stomata placement (St) on the average stoma length (L); 3 − the average cell area in adaxial epidermis (Sada) on that in abaxial epidermis (Saba); 4 – the average cell area in abaxial epidermis (Saba) on stoma length (L). For each studied plant species, the average values of each parameter and their confidential interval, as well as the regression lines, their confidential intervals and equations are presented on the figures.
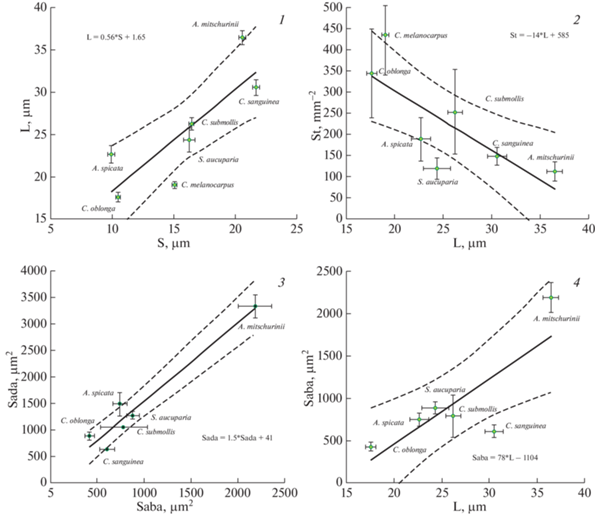
Плотность размещения устьиц у исследованных видов сильно варьировала (табл. 1). При этом у вида A. mitschurinii с наиболее крупными устьицами она была наименьшей. На рис. 7.2 представлена зависимость плотности размещения устьиц от их длины. Корреляция между этими параметрами имела отрицательный знак и была существенной по величине (табл. 2 ). Из всех видов только Cotoneaster melanocarpus и Sorbus aucuparia немного выходили за пределы доверительного интервала линии регрессии St(L). Величина корреляции Saba с параметрами Sada и L в табл. 2 достигает достоверных значений. Однако из графика разброса данных на рис. 7.3 и 7.4 видно, что точка A. mitschurinii сильно удалена от более плотной группы, включающей все остальные виды. Пересчет этих коэффициентов корреляции без A. mitschurinii дает величину корреляции меньше критического значения при p = 0.05.
Список литературы
Akçin Ö.E., Şenel G., Akçin Y. 2013. Leaf epidermis morphology of some Onosma (Boraginaceae) species from Turkey. – Turk. J. Bot. 37: 55–64. https://doi.org/10.3906/bot-1202-33
Assaad H., Zhou L., Carroll R.J., Wu G. 2014. Rapid publication-ready MS-Word tables for one-way ANOVA. – Springer Plus. 3: 474.
[Babosha et al.] Бабоша А.В., Кумахова Т.Х., Рябченко А.С., Комарова Г.И. 2020. Полиморфизм устьиц листьев яблони Malus domestica Borkh. в горах и на равнине. – Изв. РАН. Серия биологическая. 4: 361–374.
Blanke M.M., Höfer M., Pring R.J. 1994. Stomata and structure of tetraploid apple leaves cultured in vitro. – Ann. Bot. 73 (6): 651–654.
Boldt K.M., Rank B. 2010. Stomata dimorphism in dicotyledonous plants of temperate climate. – Feddes Repertorium. 121 (5–6): 167–183. https://doi.org/10.1002/fedr.201000023
Campbell C.S., Evans R.C., Morgan D.R., Dickinson T.A., Arsenault M.P. 2007. Phylogeny of subtribe Pyrinae (formerly the Maloideae, Rosaceae): limited resolution of a complex evolutionary history. – Plant Syst. Evol. 266: 119–145. https://doi.org/10.1007/s00606-007-0545-y
Carr S.G.M., Carr D.G. 1990. Cuticular features of the Central Australian bloodwoods Eucalyptus, section Corymbosae (Myrtaceae). – Bot. J. Linn. 102: 123–156.
[Czerepanov] Черепанов С.К. 1995. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб. 990 с.
Dehgan B. 1980. Application of epidermal morphology to taxonomic delimitations in the genus Jatropha L. (Euphorbiaceae). – Bot. J. Linn. Soc. 80: 257–278. https://doi.org/10.1111/j.1095-8339.1980.tb01989.x
[Evert] Эверт Р.Ф. 2015. Анатомия растений Эзау. Меристемы, клетки и ткани растений: строение, функции и развитие. М. 600 с.
Evert R.F., Eichhorn S.E. 2006. Esau’s plant anatomy: meristems, cells, and tissues of the plant body: their structure, function, and development, 3rd ed. – Hoboken, New Jersey, USA. 601 p.
Fontenelle G.B., Costa C.G., Machado R.D. 1994. Foliar anatomy and micromorphology of eleven species of Eugenia L. (Myrtaceae). – Bot. J. Linn. Soc. 116: 111–133. https://doi.org/10.1006/bojl.1994.1056
Franks P.J., Farquhar G.D. 2007. The mechanical diversity of stomata and its significance in gas-exchange control. – Plant physiol. 143 (1): 78–87. https://doi.org/10.1104/pp.106.089367
Franks P.J., Franks P.J., Drake P.L., Beerling D.J. 2009. Plasticity in maximum stomatal conductance constrained by negative correlation between stomatal size and density: an analysis using Eucalyptus globulus. – Plant Cell Environ. 32: 1737–1748. https://doi.org/10.1111/j.1365-3040.2009.002031.x
Giday H. et al. 2013. Smaller stomata require less severe leaf drying to close: a case study in Rosa hydrida. – J. Plant Physiol. 170: 1309–1316. https://doi.org/10.1016/j.jplph.2013.04.007
[Kamelin] Камелин P.В. 2006. Розоцветные (Rosaceae). Барнаул. 100 с.
[Kumachova et al.] Кумахова Т.Х., Белошапкина О.О., Воронков А.С., Рябченко А.С. 2019. Морфофункциональная характеристика листьев и плодов Maloideae (Rosaceae): б. Роль поверхностных тканей в формировании устойчивости к грибным болезням. – Труды по прикладной ботанике, генетике и селекции. 180 (2): 95–101. https://doi.org/10.30901/2227-8834-2019-2-95-101
Kumachova T.Kh. et al. 2021. Leaf Epidermis in Rosaceae: Diversity of the Cuticular Folding and Microstructure. – Proc. Natl. Acad. Sci., India Sect. B: Biol Sci. 91 (2): 455–470. https://doi.org/10.1007/s40011-021-01244-z
[Mirosvavov] Мирославов Е.А. 1994. Структурные адаптации растений к холодному климату. – Бот. журн. 79 (2): 20–26.
[Mirosvavov, Kravkina] Мирославов Е.А., Кравкина Е.М. 1990. Сравнительная анатомия листа растений, произрастающих в горах на разных высотах. – Бот. журн. 75 (3): 368–375.
[Murtazaliev] Муртазалиев Р.А. 2009. Конспект Флоры Дагестана. Т. II. Махачкала. 222 с.
[Pautov] Паутов А.А. 2009. Роль морфогенетических корреляций в возникновении гетеростоматности. – Бот. журн. 94 (6): 785–792.
[Pautov] Паутов А.А. 2011. Расположение складок микрорельефа на побочных клетках устьиц Hydrangea macrophylla (Thunb.) Ser. (Hydrangeaceae). – Вестник СПбГУ. 3 (2): 39–44.
[Pautov, Vasilieva] Паутов А.А., Васильева В.А. 2010. Роль формы основных клеток эпидермы в морфогенезе листа представителей Hamamelidaceae. – Бот. журн. 95 (3): 338–344.
[Pautov et al.] Паутов А.А., Арбичева А.И., Яковлева О.В. 2010. Корреляции признаков строения листа Agathis brownii Lem. – Вестник СПбГУ. 3 (3): 21–28.
[Pautov et al.] Паутов А.А., Васильева В.А., Крылова Е.Г. 2015. Полиморфизм устьиц в эпидерме листа Exbucklandia populnea (Hamamelidaceae) и его возможное значение. – Бот. журн. 100 (6): 540–549.
Pautov A., Bauer S., Ivanova O., Krylova E., Sapach Y., Gussarova G. 2017. Role of the outer stomatal ledges in the mechanics of guard cell movements. – Trees. 31 (1): 125–135. https://doi.org/10.1007/s00468-016-1462-x
Pautov A., Bauer S., Ivanova O., Krylova E., Yakovleva O., Sapach Y., Pautova I. 2019. Influence of stomatal rings on movements of guard cells. – Trees. 33 (5): 1459–1474. https://doi.org/10.1007/s00468-019-01873-y
[Pautov et al.] Паутов А.А., Сапач Ю.О., Иванова О.В., Крылова Е.Г. 2014. Микрорельеф поверхности листьев цветковых растений: устьичные кольца и выступы. – Бот. журн. 99 (6): 625–640.
Potter D., Eriksson T., Evans R.C., Oh S., Smedmark J.E.E., Morgan D.R., … and Campbell C.S. 2007. Phylogeny and classification of Rosaceae. – Plant Syst. Evol. 266 (1): 5–43. https://doi.org/10.1007/s00606-007-0539-9
[Ryabchenko, Babosha] Рябченко А.С., Бабоша А.В. 2011. Применение термопасты в качестве клеящего и теплопроводящего состава при исследовании биологических образцов на сканирующем электронном микроскопе с использованием замораживающей приставки. Патент РФ № 2445660, 20.03.2012. Бюл. № 8.
[Taktajan et al.] Тахтаджян А.Л. и др. 1981. Жизнь растений (Цветковые растения). М. Т. 5 (2). С. 175–187.
Takhtajan A. (ed.). 2009. Flowering plants. – Dordrecht, Netherlands. P. 293–324.
Ullah F., Ayaz A., Saqib S., Parmar G., Bahadur S., Zaman W. 2021. Taxonomic implication of leaf epidermal anatomy of selected taxa of Scrophulariaceae from Pakistan. – Microsc. Res. Tech. 84 (3): 521–530. https://doi.org/10.1002/jemt.23608
Xiang Y., Huang C.H., Hu Y., Wen J., Li S., Yi T., Chen H., Xiang J., Ma H. 2017. Evolution of Rosaceae fruit types based on nuclear phylogeny in the context of geological times and genome duplication. – Mol. Biol. Evol. 34 (2): 262–281. https://doi.org/10.1093/molbev/msw242
Zhang S.D., Jin J.J., Chen S.Y., Chase M.W., Soltis D.E., Li H.T., Yang J.B., Li D.Z., Yi T.S. 2017. Diversification of Rosaceae since the Late Cretaceous based on plastid phylogenomics. – New Phytol. 214 (3): 1355–1367. https://doi.org/10.1111/nph.14461
[Zitte et al.] Зитте П., Вайлер Э.В., Кадерайт Й.В., Брезински А., Кёрнер К. 2007. Ботаника. Учебник для вузов. Т. 4. Экология. М. 256 с.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


