Ботанический журнал, 2023, T. 108, № 3, стр. 248-256
О ВОЗМОЖНОСТИ ВЛИЯНИЯ РЕЛЬЕФА ПОВЕРХНОСТИ КЛЕТОК НА УСТЬИЧНЫЕ ДВИЖЕНИЯ
А. А. Паутов 1, *, Е. Г. Крылова 1, Ю. О. Сапач 1, О. В. Яковлева 2, К. А. Ахметгалеева 1, И. А. Паутова 2
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197022 Санкт-Петербург, Ул. Проф. Попова, 2, Россия
* E-mail: a.pautov@spbu.ru
Поступила в редакцию 06.02.2023
После доработки 10.02.2023
Принята к публикации 28.02.2023
- EDN: VQYPEW
- DOI: 10.31857/S0006813623030109
Аннотация
Складки часто присутствуют на поверхности клеток устьичных комплексов. Это позволяет предположить, что они влияют на устьичные движения. Чтобы оценить справедливость этого предположения, изучены устьичные комплексы с разным рельефом поверхности их клеток, а именно, комплексы с латеральными складками, краевыми устьичными кольцами, кольцами выступов, перистоматическими кольцами, а также складками, расположенными на побочных и основных клетках эпидермы без видимого порядка у Acokanthera oblongifolia, A. oppositifolia, Prunus laurocerasus, Populus tremula, Osmanthus yunnanensis, Raphiolepis ×delacourii, Ternstroemia gymnanthera. У всех изученных видов обнаружена деформация устьиц, обусловленная наличием складок микрорельефа. Поскольку процессы деформации лежат в основе устьичных движений, можно заключить, что складки поверхности клеток устьичных комплексов принадлежат к числу структурных особенностей этих клеток, которые способны влиять на механику устьичных движений.
Устьица относятся к числу наиболее активно изучаемых структурных элементов растений. За более чем столетнюю историю их изучения накоплен огромный массив данных и сложились устойчивые представления о механике устьичных движений. Не вызывает сомнений, что в основе активных устьичных движений лежит деформация замыкающих клеток, которая зависит от тургорного давления в этих клетках и строения их стенок. Согласно наиболее распространенной версии, в качестве осмотиков выступают ионы калия и хлора, а также малат (Fischer, 1968; Raschke, 1975; Outlaw, 1983). Что касается роли клеточных стенок в устьичных движениях, то зачастую исключительная роль отводится радиальной мицелляции, то есть наличию в стенках микрофибрилл целлюлозы, которые опоясывают замыкающие клетки (Aylor et al., 1973; Woolfenden et al., 2017).
Эти взгляды пришли на смену представлениям, полагавшим, что роль осмотиков играют сахара (Lloyd, 1908; цит. по Santelia, Lawson, 2016), а направление деформации замыкающих клеток определяется неравномерным утолщением их стенок (Jost, 1907; Guttenberg, 1959). Несмотря на наличие упомянутых выше устойчивых представлений, есть и другие взгляды на устьичные движения. Так, ряд исследователей убежден в том, что важная роль в качестве осмотика, обеспечивающего поддержание устьичной апертуры в открытом состоянии, а также в достижении компромисса между ассимиляцией углерода и потерей воды через устьица, то есть состоянием устьичной щели, может принадлежать сахарозе (Santelia, Lawson, 2016).
Не все однозначно и с исключительной ролью радиальной мицелляции. Прежде всего, стоит отметить, что ее роль рассматривается на примере устьиц, чьи замыкающие клетки имеют почковидную форму, лежат на одном уровне с побочными клетками и при увеличении тургорного давления совершают латеральные движения, вдавливаясь при этом в побочные клетки (Aylor et al., 1973; Franks, Farquhar, 2007). Однако, замыкающие клетки далеко не всех видов растений занимают такое положение в эпидерме и (или) совершают такие же движения при изменении в них тургорного давления. Показательно сопоставление устьичных движений Tradescantia virginiana, Huperzia prolifera, Nephrolepis exaltata, имеющих разные утолщения стенок замыкающих клеток (Franks, Farquhar, 2007). Были изучены поперечные срезы устьичных комплексов, то есть замыкающих и побочных клеток, у быстро замороженных листьев. Оказалось, что устьичные движения коррелируют с характером утолщения стенок замыкающих клеток. При этом замыкающие клетки H. prolifera и N. exaltata не совершали, в отличие от T. virginiana, латеральных движений. При набухании замыкающих клеток H. prolifera их внутренние тангентальные стенки смещались в подустьичную полость. В свою очередь, у N. exaltata изгибались как внутренние, так и наружные тангентальные стенки замыкающих клеток.
При обсуждении роли структурных особенностей стенок клеток, входящих в состав устьичных комплексов, нельзя не отметить частое наличие на их поверхности складок. Они могут представлять собой как складки кутикулы, субкутикулярное пространство которых заполнено пектиновыми веществами, так и покрытые кутикулой гребневидные выросты целлюлозных стенок (Koch et al., 2009; Pautov et al., 2022). Эти складки могут по-разному располагаться на клетках устьичных комплексов.
Перечислим основные типы расположения складок, между которыми могут быть переходные варианты, на клетках устьичных комплексов. 1. Расходящиеся складки, или расходящиеся бороздки (Stace, 1965) – cкладки более или менее равномерно расходятся во все стороны от устьица. В отличие от них, латеральные складки отходят в стороны от дорсальных стенок замыкающих клеток. При этом складки отсутствуют на полюсах устьиц. 2. Перистоматические кольца (Wilkinson, 1979) – окружающие устьице кольцеобразные складки или складка, которые располагаются на околоустьичных клетках (соседних или побочных клетках, а в некоторых типах устьичных комплексов и на основных клетках эпидермы, лежащих на полюсах устьица). В отличие от перистоматических колец, продольные складки лежат вдоль дорсальных стенок замыкающих клеток, не смыкаясь на полюсах устьица в замкнутые кольца (кольцо). 3. Складки микрорельефа могут располагаться на околоустьичных клетках без видимого порядка. 4. Устьичные кольца (Pautov et al., 2019) – опоясывающие устьица кольцеобразные складки, расположенные на замыкающих клетках. Они могут находиться как непосредственно на стенках замыкающих клеток (краевые устьичные кольца), так и на наружных устьичных выступах (кольца выступов).
Приуроченность складок к клеткам устьичных комплексов дала повод для предположения, что от них может зависеть деформация этих клеток при изменении в них тургорного давления. Компьютерное моделирование, проведенное с использованием метода конечных элементов (FEM), свидетельствует о том, что как устьичные выступы, так и складки микрорельефа действительно способны влиять на устьичные движения (Pautov et al., 2017; 2019). Однако результаты моделирования не могут считаться безупречным доказательством такого влияния по крайней мере по двум причинам. Во-первых, довольно сложно воспроизвести в деталях моделируемый объект. Именно по этой причине некоторые модели, в которых отрицается роль в устьичных движениях геометрии клеточных стенок, не кажутся убедительными (см, например, Woolfenden et al., 2017). Во-вторых, возникают значительные сложности с тем, какие механические характеристики следует задать стенкам клеток модельного устьица. Об этих сложностях свидетельствует, например, разброс значений модуля Юнга первичных клеточных стенок – от менее 10 МПа до более 2 ГПа (Radotić et al., 2012; Forouzech et al., 2013; Digiuni et al., 2015).
В данной работе предпринята попытка оценки того, могут ли складки поверхности обладать жесткостью, достаточной для того, чтобы вызывать деформацию стенок клеток устьичных комплексов, прежде всего – стенок замыкающих клеток. С целью выявления таких деформаций с помощью сканирующей (СЭМ) и трансмиссионной электронной микроскопии (ТЭМ) изучены устьичные комплексы, имеющие разную организацию складчатого рельефа поверхности их клеток, а именно, комплексы с латеральными складками, перистоматическими и устьичными кольцами, со складками, расположенными без видимого порядка.
МАТЕРИАЛЫ И МЕТОДЫ
Материал собран в ботанических садах им. Петра Великого БИН РАН и Санкт-Петербургского государственного университета, в парке Сергиевка – памятнике природы регионального значения (Петродворцовый район Санкт-Петербурга), а также в субтропическом ботаническом саду Кубани “Белые ночи” (Лазаревский район Сочи).
Изучена поверхность клеток устьичных комплексов Acokanthera oblongifolia (Hochst.) Codd (Apocynaceae), A. oppositifolia (Lam.) Codd (Apocynaceae), Osmanthus yunnanensis (Franch.) P.S. Green (Oleaceae), Populus tremula L. (Salicaceae), Prunus laurocerasus L. (Rosaceae), Raphiolepis ×delacourii André (Rosaceae), Ternstroemia gymnanthera (Wight et Arn.) Bedd. (Pentaphylacaceae). Названия видов приведены в соответствии с International Plant Names Index (IPNI) (https://www.ipni.org. Дата обращения 10.06.2022).
Три завершивших рост листа были взяты с трех растений перечисленных выше видов. Изучены фрагменты листовой пластинки, взятые из ее средней части между главной жилкой и краем листа. Материал для электронной микроскопии фиксировали в 3%-м растворе глутарового альдегида на 0.1 М фосфатном буфере (рН 7.4) с постфиксацией в 2%-м растворе OsO4 на 0.1 М фосфатном буфере (рН 8.0). После обезвоживания в серии спиртов и ацетонов возрастающих концентраций материал заключали в смесь эпона и аралдита. Полутонкие срезы клеток эпидермы толщиной 2 мкм и ультратонкие срезы толщиной 60 нм были изготовлены на ультратоме Ultracut E (Reichert-Yung, Vienna, Austria). Их контрастировали раствором цитрата свинца, приготовленного по методике E.S. Reynolds (Reynolds, 1963). Срезы были изучены на трансмиссионном электронном микроскопе Zeiss Libra 120 (Oberkochen, Germany).
Для сканирующей электронной микроскопии объекты исследования обезвоживали в серии спиртов, проводили через смесь изоамилацетата со спиртом и чистый изоамилацетат. Затем образцы высушивали при критической точке жидкой углекислоты. Сухие объекты наклеивали на столики, напыляли золотом и изучали в микроскопе JSM-6390LA (Akishima, Japan).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Из числа изученных в этой работе видов растений латеральные складки свойственны Populus tremula. Первичные устьица P. tremula, т.е. устьица первыми закладывающиеся в ходе гистогенеза эпидермы, в той или иной степени приподняты над поверхностью эпидермы. Происходит это в результате того, что сопровождающие их побочные клетки частично погружены под замыкающие клетки. Первичные устьичные комплексы относятся к латероцитному типу. Поверхность клеток, расположенных справа и слева от первичного устьица, представленного на рис. 1a несет по-разному расположенные складки: с одной стороны лежат отходящие от устьица латеральные складки, с другой – продольные складки. Все они представляют собой складки кутикулы с выраженным субкутикулярным пространством, заполненным пектиновыми веществами. Замыкающая клетка, в которую упираются отходящие от устьица складки, сжата. Апертура наружных устьичных выступов закрыта и сильно изогнута (рис. 1a).
Рис. 1.
Устьичные комплексы с латеральными складками у Populus tremula. а, с – первичный (a) и вторичный (с) устьичные комплексы по данным СЭМ, b – фрагмент поперечного среза вторичного устьичного комплекса по данным ТЭМ. gc – замыкающая клетка, sc – побочная клетка, la – апертура наружных устьичных выступов, mf – краевая складка побочной клетки, lf – латеральные складки, fl – продольные складки, sf – складки поверхности основных клеток эпидермы. Масштабные линейки: a, с – 10 мкм; b – 2 мкм.
Fig. 1. Stomatal complexes with lateral folds in Populus tremula. a, c – primary (a) and secondary (с) stomatal complexes under SEM, b – fragment of cross section of a stomatal complex under TEM. gc – guard cell, sc – subsidiary cell, la – outer stomatal ledge aperture, mf – marginal fold of subsidiary cell, lf – lateral folds, fl – longitudinal folds, sf – folds of the surfaces of ordinary epidermal cells. Scale bars: a, c – 10 μm; b – 2 μm.
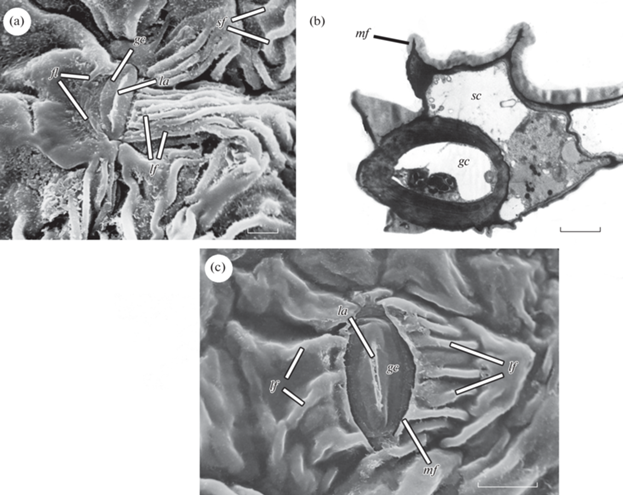
Вторичные устьичные комплексы P. tremula относятся к парацитному и латероцитному типам. Замыкающие и побочные клетки этих комплексов лежат на одном уровне друг с другом (рис. 1b). Края наружных тангентальных стенок побочных клеток частично перекрываются с замыкающими клетками, нависая над ними. Нависающие края несут складки (краевые складки побочных клеток), от которых отходят латеральные складки (рис. 1b, c). Как и в предыдущем случае, складки образованы кутикулой. Их субкутикулярное пространство также заполнено пектиновыми веществами. Степень перекрывания побочными клетками замыкающих клеток зависит от мощности латеральных складок (рис. 1c).
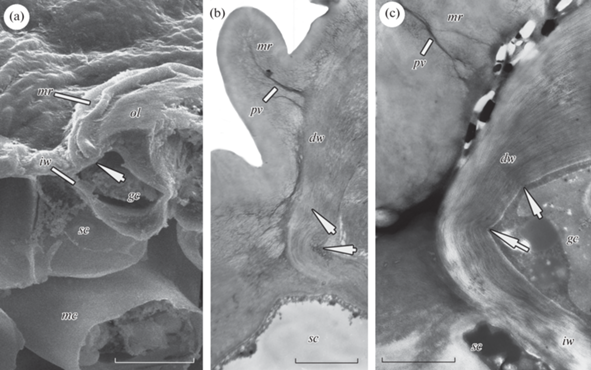
Краевые устьичные кольца наблюдаются у Acokanthera oblongifolia, Osmanthus yunnanensis, Prunus laurocerasus (рис. 2а), имеющих, соответственно, энциклоцитные, латероцитные и аномоцитные устьичные комплексы. Кольца образованы кутикулой. Субкутикулярное пространство редуцировано до узких пектиновых прожилок (рис. 2b, c). Располагаясь на побочных клетках, устьица занимают поверхностное положение в эпидерме (рис. 2а). Согласно результатам моделирования, совместное присутствие на устьицах краевых устьичных колец и крупных наружных выступов ограничивает движение дорсальных и наружных тангентальных стенок замыкающих клеток. Слабая подвижность этих стенок компенсируется (при увеличении тургорного давления в замыкающих клетках) сильными движениями внутренних тангентальных стенок, приводящими к погружению открывающейся устьичной щели поверхностно расположенных устьиц в эпидерму (Pautov et al., 2019). На приведенных микрофотографиях видна деформация дорсальных стенок под краевыми кольцами (рис. 2а–2c). Иными словами, краевые устьичные кольца способны оказывать механическое давление на дорсальные стенки набухающих замыкающих клеток и ограничивать их движения, что свидетельствует в пользу результатов моделирования.
Рис. 2.
Деформация стенок замыкающих клеток, лежащих под краевыми устьичными кольцами у Acokanthera oblongifolia (a), Osmanthus yunnanensis (b) и Prunus laurocerasus (c). a – фрагмент поперечного среза устьичного комплекса по данным СЭМ, b, c – поперечные срезы дорсальных стенок замыкающих клеток по данным ТЭМ. gc – замыкающая клетка, sc – побочная клетка, mc – клетка мезофилла, ol – наружный устьичный выступ, mr – краевое устьичное кольцо, pv – пектиновая прожилка, dw – дорсальная стенка замыкающей клетки, iw – внутренняя тангентальная стенка замыкающей клетки. Деформация стенок замыкающих клеток отмечена стрелками. Масштабные линейки: a – 10 мкм, b, c – 1 мкм.
Fig. 2. Deformation of the walls of the guard cells lying under marginal stomatal rings in Acokanthera oblongifolia (a), Osmanthus yunnanensis (b), and Prunus laurocerasus (c). a – fragment of cross section of a stomatal complex under SEM, b, c – cross sections of dorsal walls of guard cells under TEM. gc – guard cell, sc – subsidiary cell, mc – mesophyll cell, ol – outer stomatal ledge, mr – marginal stomatal ring, pv – pectin vein, dw – dorsal wall of the guard cell, iw – inner tangential wall of the guard cell. Deformation of the guard cell walls is marked with arrows. Scale bars: a – 10 μm; b, c – 1 μm.
Устьица Acokanthera oppositifolia имеют кольца выступов. Они входят в состав устьичных комплексов энциклоцитного типа. Как и в предыдущем случае устьица лежат на побочных клетках. Характерная черта каждого такого устьица – наличие гипертрофированно развитых наружных устьичных выступов, образующих стенки и свод устьичной камеры, на дне которой располагается устьичная щель. Апертура наружных устьичных выступов узкая (4.9 ± 0.3 мкм, n = 18) (рис. 3а–3c). Свод устьичной камеры окаймлен образованным кутикулой кольцом выступов. Устьица слегка погружены в эпидерму. Каждое из них располагается в неглубокой ямке.
Рис. 3.
Устьичные комплексы с кольцами выступов у Acokanthera oppositifolia (a–c) и Ternstroemia gymnanthera (d) (СЭМ). la – апертура наружных устьичных выступов, rl – кольцо выступов, srl – дополнительное кольцо выступов, a – свод устьичной камеры, образованный наружными выступами. Устьица лежат в неглубоких ямках. Кольца выступов A. oppositifolia упираются в стенки ямок. Своды устьичных камер деформированы. Масштабные линейки: a–d – 10 мкм.
Fig. 3. Stomatal complexes with rings of ledges in Acokanthera oppositifolia (a–c) and Ternstroemia gymnanthera (d) (SEM). la – outer stomatal ledge aperture, rl – ring of ledges, srl – supplementary ring of ledges, a – arch of stomatal cavity formed with outer ledges. The stomata lie in shallow pits. Rings of ledges in A. oppositifolia push against the walls of the pits. Arches of stomatal cavities are deformed. Scale bars: a–d – 10 μm.

Функциональное значение притопленности устьиц носит дискуссионный характер. Напомним, что устьица A. oppositifolia лежат на побочных клетках. Таким образом, если бы не было ямок, то устьица бы открыто лежали на поверхности листа. Согласно традиционной точке зрения погруженность устьиц снижает подвижность воздуха над ними и, как следствие, уменьшает потери воды. Такое представление оспаривается. Так, по мнению A. Roth-Nebelsick с соавторами (2009), основанному на результатах моделирования процессов транспирации, при разном расположении устьиц, само по себе погружение устьиц в ткани листа мало влияет на потери воды. К аналогичному выводу пришел G.J. Jordan с коллегами (2008). Проведенное ими изучение эпидермы представителей Proteaceae, включавшее палеоботанические материалы, показало, что появление целого ряда так называемых ксероморфных признаков, в том числе неглубокой погруженности устьиц, не было связано с аридизацией климата.
На представленных микрофотографиях поверхности листьев A. oppositifolia видно, что кольца выступов часто упираются в стенки углублений. При этом окаймленные кольцами своды устьичных камер в той или иной степени деформированы (рис. 3а–3c). Такая ситуация может иметь существенные последствия. Во-первых, ограничение стенками углублений движений наружных выступов, а с ними и движений наружных тангентальных стенок замыкающих клеток, неизбежно будет компенсировано движениями внутренних тангентальных стенок, от которых зависит состояние и положение устьичной щели. Во-вторых, неподвижность сводов наружных устьичных камер способствует сохранению небольшого диаметра апертуры наружных выступов. Это крайне значимый признак. Изучение устьичной проводимости Quercus coсcifera показало, что она сильно зависит от величины апертуры наружных выступов: чем ỳже апертура, тем ниже устьичная проводимость. Такая оценка очень хорошо согласуется с наблюдениями в природе. Растения Q. coсcifera, произрастающие в более аридных условиях, имеют более узкие апертуры наружных выступов (A. Roth-Nebelsick et al., 2013).
Определенное сходство в организации рельефа поверхности листа с только что рассмотренным у A. oppositifolia демонстрирует Ternstroemia gymnanthera. Устьичные комплексы этого вида относятся к аномоцитному типу. Сами устьица слегка погружены в эпидерму. Их наружные выступы несут кольца, но последние обычно не касаются стенок углублений. У таких устьиц отмечены случаи образования дополнительных колец выступов, лежащих вблизи стенок углублений (рис. 3d). Их наличие, вероятно, позволяет подобно кольцам выступов Acokanthera oppositifolia ограничивать движения наружных тангентальных стенок, что может способствовать движениям других стенок замыкающих клеток.
Устьичные комплексы Raphiolepis ×delacourii относятся к стефаноцитному типу. Их устьица имеют гипертрофированно развитые наружные выступы, образующие стенки и своды устьичных камер. Свод каждой такой камеры окаймлен кольцом выступов (рис. 4a, b). В отличии от A. oppositifolia и T. gymnanthera, устьица R. ×delacourii не погружены в эпидерму. Они, однако, окружены плотно расположенными складками, лежащими без видимого порядка. Судя по форме сводов устьичных камер, эти складки, как и стенки углублений, оказывают деформирующее влияние на устьица. Сходный эффект может возникать также под влиянием перистоматических колец. Деформация устьиц, обусловленная мощными перистоматическими кольцами, обнаружена у Prunus laurocerasus (рис. 4с). Выше была отмечена возможность деформации у этого вида дорсальных стенок замыкающих клеток, расположенных под краевыми устьичными кольцами (рис. 2с). Она, вероятно, может быть усилена при контакте краевых устьичных и перистоматических колец (рис. 4d).
Рис. 4.
Устьичные комплексы Raphiolepis ×delacourii (a, b) и Prunus laurocerasus (c, d) со складками на побочных и соседних клетках (СЭМ). a–c – фрагменты поверхности листовой пластинки, d – фрагмент поперечного среза устьичного комплекса. rl – кольцо выступов, mr – краевое устьичное кольцо, pr – перистоматическое кольцо, sf – складки поверхности побочных клеток и основных клеток эпидермы, ol – наружный устьичный выступ, la – апертура наружных устьичных выступов, sp – устьичная щель. Масштабные линейки: a–d – 10 мкм.
Fig. 4. Stomatal complexes of Raphiolepis ×delacourii (a, b) and Prunus laurocerasus (c, d) with folds on subsidiary and neighbouring cells (SEM). a–c – fragments of leaf blade surface, d – fragment of a stomatal complex cross section. rl – ring of ledges, mr – marginal stomatal ring, pr – peristomatal rim, sf – folds of the surfaces of subsidiary and ordinary epidermal cells, ol – outer stomatal ledge, la – outer stomatal ledge aperture, sp – stomatal pore. Scale bars: a–d – 10 μm.

ЗАКЛЮЧЕНИЕ
Приведенные примеры наглядно свидетельствуют в пользу того, что рельеф поверхности листьев цветковых растений способен влиять на деформацию замыкающих клеток. Поскольку деформация этих клеток лежит в основе устьичных движений, с определенной долей уверенности можно заключить, что по крайней мере некоторые варианты микрорельефа поверхности устьичных комплексов могут быть причислены к числу структурных особенностей этих клеток, которые непосредственно влияют на механику устьичных движений.
Список литературы
Aylor D.E., Parlange J.-Y., Krikorian A.D. 1973. Stomatal mechanics. – Am. J. Bot. 60 (2): 163–171. https://doi.org/10.1002/j.1537-2197.1973.tb10213.x
Digiuni S., Berne-Dedieu A., Martinez-Torres C., Szecsi J., Bendahmane M., Arneodo A., Argoul F. 2015. Single Cell Wall Nonlinear Mechanics Revealed by a Multiscale Analysis of AFM Force-Indentation Curves. – Biophys. J. 108 (9): 2235–2248. https://doi.org/10.1016/j.bpj.2015.02.024
Fischer R.A. 1968. Stomatal opening: role of potassium uptake by guard cells. – Science 160: 784–785.
Forouzesh E., Goel A., Mackenzie S.A., Turner J.A. 2013. In vivo extraction of Arabidopsis cell turgor pressure using nanoindentation in conjunction with finite element modeling. – Plant J. 73 (3): 509–520. https://doi.org/10.1111/tpj.12042
Franks P.J., Farquhar G.D. 2007. The mechanical diversity of stomata and its significance in gas-exchange control. – Plant Physiol. 143: 78–87. https://doi.org/10.1104/pp.106.089367
Guttenberg H. 1959. Die physiologische Anatomie der Spaltöffnungen. Handb. – Pflanzen Physiol. 17: 399–414.
Jordan G.J., Weston P.H., Carpenter R.J., Dillon R.A., Brodribb T.J. 2008. The evolutionary relations of sunken, covered, and encrypted stomata to dry habitats in Proteaceae. – Am. J. Bot. 95: 521–530. https://doi.org/ 33https://doi.org/10.3732/ajb.20073
Jost L. 1907. Lectures on plant physiology. Oxford. 564 p.
Koch K., Bhushan B., Barthlott W. 2009. Multifunctional surface structures of plants: an inspiration for biomimetics: invited review. – Prog. Mater. Sci. 54: 137–178. https://doi.org/10.1016/j.pmatsci.2008.07.003
Outlaw W.H. 1983. Current concepts on the role of potassium in stomatal movements. – Physiol. Plant. 59: 302–311.
Pautov A., Bauer S., Ivanova O., Krylova E., Sapach Yu., Gussarova G. 2017. Role of the outer stomatal ledges in the mechanics of guard cell movements. – Trees: Structure and Function. 31 (1): 125–135. https://doi.org/10.1007/s00468-016-1462-x
Pautov A., Bauer S., Ivanova O., Krylova E., Yakovleva O.V., Sapach Yu., Pautova I. 2019. Influence of stomatal rings on movements of guard cells. – Trees: Structure and Function. 33 (5): 1459–1474. https://doi.org/10.1007/s00468-019-01873-y
[Pautov et al.] Паутов А.А., Сапач Ю.О., Трухманова Г.Р., Яковлева О.В., Крылова Е.Г., Паутова И.А. 2022. Структурное разнообразие устьичных и перистоматических колец. – Бот. журн. 107 (9): 869–884. https://doi.org/10.31857/S0006813622090083
Radotić K., Roduit Ch., Simonović J., Hornitschek P., Fankhauser Ch., Mutavdžić D., Steinbach G., Dietler G., Kasas S. 2012. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. – Biophys. J. 103 (3): 386–394. https://doi.org/10.1016/j.bpj.2012.06.046
Raschke K. 1975. Stomatal action. – Annu. Rev. Plant Physiol. 26: 309–340.
Reynolds E.S. 1963. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. – J. Cell Biology. 17: 208–212.
Roth-Nebelsick A., Fernández V., Peguero-Pina J.J., Sancho-Knapik D., Gil-Pelegrín E. 2013. Stomatal encryption by epicuticular waxes as a plastic trait modifying gas exchange in a Mediterranean evergreen species (Quercus coccifera L.). – Plant Cell Environ. 36(3): 579–589. https://doi.org/10.1111/j.1365-3040.2012.02597.x
Roth-Nebelsick A., Hassiotou F., Veneklaas E.J. 2009. Stomatal crypts have small effects on transpiration: a numerical model analysis. – Plant Physiol. 151: 2018–2027. https://doi.org/10.1104/pp.109.146969
Santelia D., Lawson T. 2016. Rethinking Guard Cell Metabolism. – Plant Physiol. 172: 1371–1392. https://doi.org/10.1104/pp.16.00767
Stace C.A. 1965. Cuticular studies as an aid to plant taxonomy. – Bull. Br. Mus. (Nat. Hist.). 4 (1): 1–78.
Wilkinson H.P. 1979. The plant surface (mainly leaf). – In: Anatomy of the dicotyledons. Ed. 2. Vol. I. Oxford. P. 97–117.
Woolfenden H.C., Bourdais G., Kopischke M., Miedes E., Molina A., Robatzek S., Morris R.J. 2017. A computational approach for inferring the cell wall properties that govern guard cell dynamics. – Plant J. 92: 5–18. https://doi.org/10.1111/tpj.13640
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


