Физиология человека, 2020, T. 46, № 2, стр. 76-83
Цитокиновый профиль испытателей-добровольцев в 21-суточной “сухой” иммерсии
С. А. Пономарёв 1, *, М. П. Рыкова 1, **, Е. Н. Антропова 1, О. В. Кутько 1, С. А. Калинин 1, С. М. Шульгина 1, А. А. Садова 1, К. Д. Орлова 1, В. А. Шмаров 1, Д. Д. Киселёва 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: cd147@bk.ru
** E-mail: rykovamarina@yandex.ru
Поступила в редакцию 14.10.2019
После доработки 23.11.2019
Принята к публикации 04.12.2019
Аннотация
Представлены результаты изучения цитокинового профиля десяти практически здоровых добровольцев-испытателей, участников эксперимента с 21-суточной “сухой” иммерсией (СИ). В результате проведенных исследований отмечен выраженный индивидуальный характер реакции иммунной системы на длительное воздействие моделированных эффектов микрогравитации. Показано, что пребывание человека в условиях СИ приводит к изменениям содержания в плазме крови цитокинов, преимущественно в сторону увеличения их концентрации, TH1/TH2 баланса, а также активационного потенциала моноцитов, проявляющегося в виде снижения синтеза цитокинов клетками с фенотипом TLR+CD14+ в ответ на стимуляцию различными лигандами in vitro.
В настоящее время одной из приоритетных задач пилотируемой космонавтики является осуществление длительного космического полета (КП) на Луну, а впоследствии – на Марс. Известно, что во время орбитального КП на организм человека действует ряд экстремальных факторов, оказывающих существенное влияние на иммунный гомеостаз [1, 2], поэтому одной из первостепенных задач космической иммунологии является детальное изучение закономерностей и механизмов влияния микрогравитации, перегрузок, радиации, измененных условий окружающей среды, психологического стресса на иммунную систему человека и животных. Полученные данные впоследствии лягут в основу разработки новых эффективных программ профилактики и коррекции иммунодефицитных состояний с учетом индивидуальных особенностей членов экипажей космических миссий.
К сожалению, используемое в настоящее время на борту Международной космической станции оборудование не позволяет проводить масштабные иммунологические исследования непосредственно на борту станции [3], в этой связи широко применяются наземные модели, имитирующие основные факторы КП. К одной из таких моделей относится “сухая” иммерсия (СИ), создающая условия безопорности и градиент перераспределения жидкостей [4].
Иммунная система человека и животных реализует свое действие посредством фагоцитоза чужеродных структур, выработки антител, связывающих антигены с последующей их элиминацией, запуска процессов апоптоза в поврежденных клеточных компонентах тканей или клетках с измененным генетическим кодом, а также синтезом цитокинов [5, 6].
Цитокины представляют собой гетерогенную группу небольших протеинов массой от 5 до 20 кДа, которые играют ключевую роль в развитии иммунного ответа [7]. Было показано, что цитокины участвуют в аутокринной, паракринной и эндокринной передаче сигналов в качестве иммуномодулирующих агентов [7, 8], а также непосредственном воздействии на некоторые инфекционные агенты [9]. Они включают в себя несколько классов соединений, различающихся по своему функциональному предназначению и продуцирующим клеткам. К ним относятся хемокины, интерфероны, интерлейкины, лимфокины и факторы некроза опухолей [7], которые продуцируются широким спектром клеток, включая иммунные клетки, такие как макрофаги, В-лимфоциты, Т-лимфоциты и тучные клетки, а также эндотелиальные клетки, фибробласты и различные стромальные клетки; каждый цитокин может продуцироваться более чем одним типом клеток [9, 10]. Цитокины действуют непосредственно через клеточные рецепторы, так как неспособны проникать через билипидный слой клеточной мембраны. В иммунной системе их задачи заключаются в модулировании баланса между гуморальными и клеточными иммунными реакциями, регулируют созревание, рост и чувствительность определенных популяций клеток. Некоторые цитокины усиливают или ингибируют действие других цитокинов [11].
Условно, цитокины можно разделить на:
– провоспалительные, вовлеченные в развитие воспалительного ответа (IL-1, -2, -6, -8, TNFα, IFNγ);
– противовоспалительные, ограничивающие развитие воспаления (IL-4, -10, TGFβ) [8].
Все они играют решающую роль при борьбе с инфекциями, однако их синтез может стать патологически неконтролируемым при воспалении, травмах и сепсисе [12]. Нарушение воспалительного ответа, во многом связанного с изменением баланса про- и противовоспалительных цитокинов, способствует переходу заболевания из острой стадии в хроническую [13].
Избыточная секреция цитокинов может вызвать опасный синдром, известный в мировой литературе как гиперцитокинемия или “цитокиновый шторм” [14]. Подобный процесс является потенциально летальным за счет неконтролируемой патологической активации цитокинами иммунокомпетентных клеток в очаге воспаления и продукции последними новой порции цитокинов, вследствие наличия взаимосвязи между данными процессами. Порочный круг приводит к деструкции тканей сначала локального очага воспаления, с последующим распространением на соседние ткани. По мере развития реакция становится генерализованной и может охватывать весь организм в целом [15]. Предполагается, что цитокиновые бури также являлись основной причиной смерти во время пандемии “испанского гриппа” 1918 г. Важно отметить, что действию цитокинового шторма более подвержены люди со здоровой иммунной системой, способной давать гиперергическую реакцию на попадание инфекционного агента [14].
Во время космического полета также наблюдается изменение цитокинового баланса, способного приводить к развитию заболеваний различного генеза [16].
На сегодняшний день СИ является одной из самых адекватных моделей, имитирующей эффекты одного из ключевых факторов КП – микрогравитации [4], в связи с чем, целью настоящего исследования являлась оценка влияния 21-суточной СИ на содержание цитокинов в плазме крови и стимулированныx моноцитарных культурах in vitro.
МЕТОДИКА
Эксперимент с 21-суточной СИ проводили с участием десяти практически здоровых мужчин в возрасте от 24 до 32 лет, получивших допуск врачебно-экспертной комиссии. Взятие проб венозной крови для иммунологических исследований проводили натощак в утренние часы в фоновом периоде (7 и 2 сут), во время экспериментального воздействия (3, 7, 14, 21 сут), и после завершения пребывания в условиях СИ (7 сут).
Концентрацию цитокинов в плазме крови оценивали методом иммуноферментного анализа (ИФА) с использованием стандартных наборов реактивов для определения IFNα, IFNγ, TNFα, IL-1β, IL-6, IL-8, IL-10 (АО “ВЕКТОР-БЕСТ”, Россия) и IL12p70 (Affymetrix, США).
Анализ способности моноцитов периферической крови синтезировать цитокины IL-1β, IL-6, IL-8, IL-10, IL12p70, TNFα, IFNγ, IFNα, GM-CSF в системе in vitro при стимуляции соответствующими для каждого Toll-подобного рецептора (TLR) лигандами из набора Human TLR1-9 Agonist kit (InvivoGen, США) выполняли с применением коммерческого набора для мультиплексного анализа цитокинов, хемокинов и факторов роста Cyto/Chemo MAG Premix 41 Milliplex (Merck Millipore, Германия). Концентрацию цитокинов определяли в 24-часовых клеточных культурах моноцитов, высеянных в 24-луночные планшеты (Corning Costar, США).
Статистическую обработку результатов эксперимента осуществляли при помощи пакета прикладных программ “Statistica v.10.0 for Microsoft Windows”. Данные исследования представлены в виде медианы (Ме) и интерквартильной широты (q25–q75). Достоверность полученных результатов оценивали при помощи непараметрического критерия Вилкоксона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
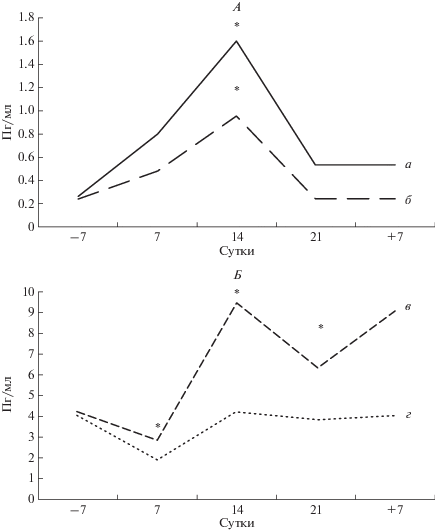
Исследования цитокинового профиля на разных стадиях моделирования эффектов микрогравитационного воздействия показали, что уровень цитокинов в плазме крови имел ярко выраженный индивидуальный характер, однако, следует отметить, что на 14 сут происходило значимое повышение TNFα, IL-12p70 и IFNα (рис. 1, А, Б), причем концентрация последнего достоверно превышала фоновые значения на 21 сут иммерсионного воздействия (рис. 1, Б). Интересно отметить, что в отличие от TNFα и IL-12p70, концентрация которых снижалась к 21 сут эксперимента до фоновых значений, содержание IFNα в плазме крови оставалось выше исходных величин (рис. 1, Б). Содержание в плазме крови IL-10 значимо снижалось на 7 сут эксперимента по сравнению с фоном, восстанавливаясь до исходных значений к 14 сут СИ (рис. 1, Б). Концентрация других цитокинов в плазме крови достоверно не изменялась на протяжении всего эксперимента, однако при этом присутствовали выраженные индивидуальные флуктуации, как в сторону увеличения, так и в сторону снижения концентрации по сравнению с фоновыми значениями.
Рис. 1.
Уровень цитокинов в периферической крови добровольцев-испытателей в эксперименте с 21-суточной “сухой” иммерсией без средств профилактики (n = 10). А – изменение концентрации TNFα и IL-12p70; Б – изменение концентрации IFNα и IL-10; а – содержание TNFα; б – IL-12p70; в – IFNα; г – IL-10; * – достоверное различие с –7 сут (p < 0.05). По оси ординат – содержание цитокинов (пг/мл); по оси абсцисс – сутки экспериментального воздействия (–7 – фоновое исследование до эксперимента, 7, 14, 21 – исследование во время эксперимента, +7 – исследование после завершения эксперимента).
Иммунная система человека поддерживается тонким балансом нескольких систем контроля, действующими по принципу антагонистов, где главная роль отведена T-хелперному (Th) звену CD4+-лимфоцитов. Различают несколько видов T-хелперов, однако наиболее важными типами Th-клеток являются Th1 и Th2-лимфоциты. Th1 запускают каскад реакций клеточного иммунитета, в то время как Th2 выступают триггерным механизмом активации гуморального иммунного ответа [17, 18].
Th1 синтезируют ряд цитокинов, такие как IFNγ, IL-2, TNFα, TNFβ, IL-12, их эффекторным цитокином является IFNγ, активирующий клеточный иммунитет, в первую очередь, для борьбы с бактериями посредством фагоцитоза и выработке IgM c ингибированием синтеза IgG и IgE [17]. Th2, в свою очередь, продуцируют IL-4, IL-5, IL-10, IL-13, их главным эффекторным цитокином являeтся IL-10, ингибирующий дифференцировку CD4+-лимфоцитов в Th1 клетки [19].
При воздействии негативных эндогенных и экзогенных факторов, баланс Th1/Th2 может смещаться в ту или иную сторону. Избыточный Th1-иммунный ответ приводит, в основном, к развитию ряда аутомиммунных заболеваний, таких как рассеянный склероз, болезнь Крона, псориаз, ревматоидный артрит, в то время как усиление Th2-иммунного ответа приводит к развитию аллергических заболеваний, в первую очередь аллергического дерматита, астмы, аллергического ринита [13, 14].
Для оценки Th1/Th2 баланса используют соотношение главных эффекторных цитокинов Th1 и Th2 – IFNγ и IL-10 [19], позволяющее оценить смещение иммунного ответа в клеточную или гуморальную стадию.
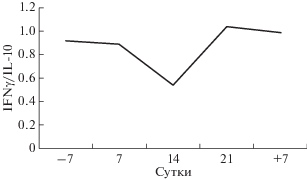
В настоящем исследовании было показано, что сдвиг Th1/Th2 баланса в сторону усиления гуморального ответа наблюдался на 14 сут экспериментального воздействия с последующим восстановлением к 21 сут СИ и сохранением динамики на 7 сут после завершения эксперимента (рис. 2). Полученные данные свидетельствуют о незначительном изменении функционирования иммунной системы, однако потенциально способным приводить к аллергическим проявлениям во время пребывания человека в условиях СИ.
Рис. 2.
Баланс IFNγ/IL-10 в плазме крови у 10 добровольцев-испытателей до, во время и после пребывания в условиях 21-суточной “сухой” иммерсии без средств профилактики. По оси ординат – соотношение IFNγ и IL-10; по оси абсцисс – сутки экспериментального воздействия (–7 – фоновое исследование до эксперимента, 7, 14, 21 – исследование во время эксперимента, +7 – исследование после завершения эксперимента).
Как было указано ранее, цитокины синтезируются не только иммунокомпетентными клетками, но и клетками эндотелия, фибробластами, клетками мышечной ткани [11, 12]. Этот факт лишний раз подчеркивает высокую степень интегрированности иммунной системы в гомеостатические процессы организма, поскольку вырабатываемые иммунокомпетентными клетками цитокины действуют на другие системы организма человека, и наоборот, цитокины, продуцируемые другими типами клеток оказывают влияние на иммунитет. В связи с изложенными выше фактами, оценить вклад клеток иммунной системы в общее количество цитокинов в сыворотке крови в настоящее время не представляется возможным. Для оценки возможности синтеза цитокинов иммунокомпетентными клетками широко используется метод клеточных культур, суть которого заключается в определении синтеза цитокинов клетками адаптивного или врожденного иммунитета при стимулировании специфическими лигандами. В настоящем исследовании проводили оценку способности CD14+-моноцитов синтезировать цитокины при стимулировании TLRs соответствующими лигандами (табл. 1). Как и в случае анализа содержания цитокинов в плазме крови, была показана довольно значительная индивидуальная вариабельность результатов, однако, несмотря на выраженные индивидуальные колебания, наблюдались некоторые общие закономерности. Во-первых, стоит отметить, что спонтанный синтез цитокинов CD14+ моноцитами человека достоверно снижался на протяжении эксперимента. Эта тенденция характерна для всех цитокинов, однако для IL-12р70, IL-8, IL-6, IL-1β, TNFα снижение было статистически достоверным (табл. 1). Спонтанная продукция цитокинов в культуре моноцитов свидетельствует о том, что клетки уже были активированы in vivo. Можно было бы предположить, что во время иммерсии обследуемые находились в условиях карантина, во время которого контакты с экзогенной микрофлорой в значительной степени сокращались, в то время как в фоновом периоде неконтролируемые условия повседневной жизни включали контакт с широким спектром антигенов. Однако для некоторых цитокинов (IL-6, IL-1β, IL-8) достоверное снижение наблюдалось уже за 2 сут до начала СИ, когда еще не было условий ограниченного контакта с экзогенной микрофлорой. Это может быть связано с активацией клеток врожденного иммунитета эндогенными лигандами TLRs [20]. Для других цитокинов наблюдалась лишь тенденция к снижению спонтанной продукции цитокинов. Статистически значимых различий данных, полученных в иммерсии по сравнению со вторым фоном, взятым за двое суток до начала воздействия, обнаружено не было. Представляется вероятным влияние общего стресса, связанного с ожиданием серьезного воздействия [21], на иммунную систему, когда нейрогуморальные факторы оказывают существенное ингибирующее влияние на клеточный и гуморальный компоненты иммунитета [22]. Снижение спонтанного синтеза во время СИ может быть обусловлено комплексом описанных выше факторов в сочетании непосредственно с воздействием моделируемых эффектов микрогравитации на иммунную систему.
Таблица 1.
Синтез цитокинов в стимулированных лигандами TLRs 24-часовых культурах моноцитов, полученных от десяти добровольцев-испытателей в эксперименте с 21-суточной “сухой” иммерсией без средств профилактики
| Спонтанный синтез | ||||||||
| цитокин | –7 с | –2 с | 3 с | 7 с | 14 с | 21 с | +7 с | |
| TNFα | Медиана | 180.14 | 33.25 | 19.06* | 71.58 | 44.53* | 38.31* | 17.69* |
| Q25 | 43.38 | 16.82 | 14.10 | 15.19 | 3.87 | 22.83 | 9.76 | |
| Q75 | 472.89 | 141.22 | 64.73 | 81.53 | 103.82 | 69.83 | 34.93 | |
| IL-1β | Медиана | 37.00 | 5.23* | 17.37 | 7.39 | 13.82 | 4.58* | 4.13* |
| Q25 | 15.24 | 4.16 | 8.49 | 6.22 | 4.74 | 3.91 | 3.12 | |
| Q75 | 109.39 | 11.70 | 24.23 | 8.42 | 14.04 | 6.97 | 7.45 | |
| IL-6 | Медиана | 404.09 | 75.18* | 22.17 | 45.71 | 74.75 | 9.06* | 5.94* |
| Q25 | 304.53 | 13.86 | 3.90 | 6.94 | 8.31 | 8.34 | 5.10 | |
| Q75 | 882.14 | 153.36 | 170.05 | 142.95 | 330.48 | 88.22 | 16.22 | |
| IL-8 | Медиана | 5170.00 | 910.57* | 562.59* | 1046.00 | 683.53 | 1704.00 | 1104.0 |
| Q25 | 1142.32 | 455.22 | 428.15 | 400.00 | 469.94 | 610.21 | 400.00 | |
| Q75 | 9340.50 | 7063.00 | 3551.00 | 4026.50 | 5332.58 | 3570.00 | 288.00 | |
| IL-12р70 | Медиана | 5.49 | 4.56 | 4.33 | 4.10 | 3.94* | 4.25 | 4.41 |
| Q25 | 1.53 | 1.53 | 1.69 | 1.51 | 3.64 | 1.42 | 1.42 | |
| Q75 | 10.26 | 5.34 | 4.52 | 4.95 | 5.49 | 4.51 | 4.56 | |
| Рецептор: TLR1 | ||||||||
| Лиганд: Pam3CSK4 | ||||||||
| IL-1β | Медиана | 51.90 | 8.31 | 54.02 | 32.75* | 26.69* | 36.42 | 15.17 |
| Q25 | 25.65 | 3.03 | 27.68 | 17.58 | 10.93 | 19.86 | 12.65 | |
| Q75 | 83.96 | 51.45 | 88.80 | 58.69 | 99.39 | 43.35 | 27.12 | |
| IL-6 | Медиана | 1295.79 | 481.64 | 842.52 | 896.44 | 847.85* | 800.31 | 400.00 |
| Q25 | 517.14 | 110.54 | 210.09 | 609.70 | 479.52 | 466.79 | 261.78 | |
| Q75 | 5761.00 | 740.10 | 2085.00 | 2067.51 | 1261.40 | 3288.50 | 1705.65 | |
| IL-8 | Медиана | 5217.00 | 2141.00 | 1691.00 | 4218.00 | 3470.04* | 4685.00 | 2141.00 |
| Q25 | 546.12 | 543.14 | 557.30 | 615.42 | 657.16 | 600.33 | 571.08 | |
| Q75 | 9903.00 | 9903.00 | 8483.50 | 9903.00 | 8988.00 | 8996.00 | 6334.50 | |
| IL-10 | Медиана | 31.72 | 6.46 | 55.39 | 31.68 | 20.7805 | 54.02 | 13.38* |
| Q25 | 19.53 | 3.21 | 4.70 | 19.65 | 9.92 | 12.80 | 7.27 | |
| Q75 | 101.00 | 14.22 | 97.34 | 60.70 | 138.05 | 80.93 | 35.91 | |
| IFNα | Медиана | 47.14 | 17.07 | 29.16 | 28.31* | 45.13 | 30.01 | 31.69 |
| Q25 | 28.31 | 2.78 | 5.40 | 4.40 | 13.43 | 5.44 | 4.69 | |
| Q75 | 55.61 | 36.83 | 51.08 | 46.72 | 55.26 | 49.285 | 46.395 | |
| Рецептор: TLR2 | ||||||||
| Лиганд: HKLM | ||||||||
| TNFα | Медиана | 388.09 | 134.61* | 310.07 | 400.00 | 429.91 | 425.90 | 148.35* |
| Q25 | 301.54 | 51.01 | 156.33 | 131.07 | 178.29 | 296.75 | 124.34 | |
| Q75 | 4909.00 | 1433.94 | 562.50 | 451.22 | 582.09 | 742.92 | 312.14 | |
| IL-1β | Медиана | 97.10 | 10.22* | 63.10 | 32.48* | 32.18* | 63.31 | 21.42* |
| Q25 | 23.16 | 5.79 | 26.75 | 18.07 | 19.082 | 41.20 | 11.89 | |
| Q75 | 307.18 | 61.65 | 118.85 | 50.80 | 138.44 | 96.25 | 36.81 | |
| IL-6 | Медиана | 802.15 | 258.53* | 400.00 | 400.00 | 646.04 | 752.23 | 400.00* |
| Q25 | 278.38 | 55.91 | 117.63 | 154.35 | 366.30 | 399.16 | 232.95 | |
| Q75 | 5046.00 | 2088.79 | 639.47 | 669.00 | 1243.02 | 1471.50 | 568.48 | |
| IL-10 | Медиана | 57.62 | 6.96* | 33.39 | 14.23 | 62.93 | 90.65 | 17.90* |
| Q25 | 23.20 | 1.49 | 9.53 | 9.53 | 53.24 | 34.84 | 10.40 | |
| Q75 | 320.96 | 94.64 | 110.94 | 35.98 | 179.04 | 135.84 | 26.23 | |
| IFNγ | Медиана | 12.28 | 8.67* | 8.67 | 6.78 | 7.09 | 9.14 | 7.16* |
| Q25 | 4.36 | 3.45 | 3.53 | 3.56 | 5.36 | 3.92 | 3.66 | |
| Q75 | 13.15 | 11.59 | 11.54 | 12.12 | 9.47 | 10.17 | 9.04 | |
| IL-12р70 | Медиана | 6.89 | 4.715* | 5.49 | 5.33* | 4.72* | 6.11 | 5.18* |
| Q25 | 1.63 | 1.50 | 3.46 | 3.475 | 1.43 | 3.03 | 0.68 | |
| Q75 | 61.43 | 13.36 | 7.08 | 6.03 | 6.49 | 6.96 | 6.19 | |
| GM-CSF | Медиана | 166.16 | 69.64* | 70.84 | 67.49 | 88.2 | 93.255 | 72.73* |
| Q25 | 24.82 | 15.73 | 21.73 | 34.71 | 46.25 | 41.48 | 22.30 | |
| Q75 | 341.98 | 186.17 | 105.92 | 97.21 | 146.22 | 126.4 | 88.10 | |
| Рецептор: TLR3 | ||||||||
| Лиганд: HKLM | ||||||||
| IL-1β | Медиана | 9.26 | 8.51* | 27.38 | 15.68 | 6.84 | 10.18 | 7.50 |
| Q25 | 6.52 | 3.58 | 12.21 | 8.80 | 5.10 | 7.57 | 6.83 | |
| Q75 | 28.07 | 11.58 | 42.87 | 18.89 | 22.07 | 11.09 | 9.79 | |
| IL-6 | Медиана | 284.73 | 112.60 | 166.09 | 119.63* | 30.42 | 38.89 | 61.67* |
| Q25 | 64.41 | 51.49 | 84.86 | 71.36 | 15.17 | 27.51 | 30.45 | |
| Q75 | 676.25 | 322.34 | 423.95 | 202.66 | 173.06 | 154.59 | 89.87 | |
| IL-8 | Медиана | 2291.44 | 1181.93 | 2867.00 | 1145.00* | 1991.81 | 2925.00 | 1485.00 |
| Q25 | 477.72 | 459.46 | 524.14 | 496.76 | 501.90 | 430.81 | 429.51 | |
| Q75 | 8395.25 | 7065.25 | 4956.50 | 7678.00 | 5320.00 | 4638.00 | 5165.50 | |
| Рецептор: TLR6 | ||||||||
| Лиганд: FSL-1 | ||||||||
| IL-1β | Медиана | 60.42 | 18.41* | 43.75 | 46.87 | 26.12 | 39.01 | 26.41 |
| Q25 | 9.95 | 9.19 | 34.65 | 17.41 | 20.78 | 23.36 | 17.28 | |
| Q75 | 106.81 | 63.97 | 57.32 | 75.47 | 79.80 | 49.19 | 39.18 | |
| IL-6 | Медиана | 782.33 | 346.51 | 555.85 | 661.56 | 622.56 | 817.87 | 631.46* |
| Q25 | 526.57 | 149.48 | 285.31 | 415.63 | 436.71 | 400.00 | 315.57 | |
| Q75 | 4087.50 | 4097.00 | 1057.89 | 2589.00 | 805.37 | 1794.00 | 1094.83 | |
| IL-8 | Медиана | 9903.00 | 5975.00 | 2443.00* | 6634.00 | 5066.00 | 9041.00 | 5965.00 |
| Q25 | 528.24 | 562.33 | 554.14 | 634.43 | 1303.15 | 400.00 | 638.71 | |
| Q75 | 9903.00 | 9903.00 | 9588.00 | 9903.00 | 9033.25 | 9260.00 | 9631.00 | |
| Рецептор: TLR8 | ||||||||
| Лиганд: ssRNA40 | ||||||||
| IL-10 | Медиана | 9.50 | 4.36* | 8.83 | 19.85 | 19.45 | 27.91 | 7.84 |
| Q25 | 5.71 | 2.93 | 4.49 | 12.20 | 9.02 | 13.87 | 3.72 | |
| Q75 | 213.28 | 101.13 | 32.10 | 635.27 | 150.83 | 80.43 | 24.32 | |
| IFNα | Медиана | 34.95 | 33.33* | 32.51 | 39.67 | 34.94 | 42.71 | 30.01 |
| Q25 | 5.39 | 3.85 | 3.78 | 4.04 | 13.35 | 4.41 | 4.88 | |
| Q75 | 56.30 | 51.43 | 46.37 | 51.33 | 46.65 | 49.96 | 44.90 | |
| Рецептор: TLR9 | ||||||||
| Лиганд: ODN2006 | ||||||||
| TNFα | Медиана | 87.90 | 37.93* | 86.96 | 18.92 | 64.64 | 43.09* | 27.05* |
| Q25 | 56.70 | 19.75 | 24.66 | 8.36 | 14.34 | 20.74 | 22.06 | |
| Q75 | 128.46 | 66.71 | 178.23 | 115.11 | 138.25 | 87.82 | 38.36 | |
| IL-1β | Медиана | 11.34 | 4.93* | 21.62 | 10.66 | 9.95 | 9.40 | 4.36* |
| Q25 | 7.69 | 3.96 | 5.82 | 3.07 | 1.96 | 4.19 | 3.46 | |
| Q75 | 41.15 | 5.74 | 45.17 | 15.80 | 27.28 | 16.97 | 4.85 | |
| IL-6 | Медиана | 323.04 | 38.58* | 208.62 | 50.82* | 42.65* | 51.70 | 41.92* |
| Q25 | 118.21 | 15.49 | 5.82 | 3.17 | 1.96 | 19.10 | 13.46 | |
| Q75 | 491.83 | 79.26 | 530.37 | 170.49 | 308.66 | 418.46 | 57.29 | |
| IL-8 | Медиана | 1996.74 | 854.50 | 3442.00 | 701.22* | 1383.00 | 3361.00 | 1224.00 |
| Q25 | 488.62 | 400.00 | 400.00 | 482.41 | 592.88 | 583.01 | 487.82 | |
| Q75 | 8237.00 | 3901.00 | 6402.00 | 5773.50 | 1823.00 | 4978.50 | 3788.50 | |
При индуцированном синтезе цитокинов в ответ на стимуляцию ключевых сигнальных образ-распознающих рецепторов семейства Toll-like соответствующими лигандами был обнаружен ряд интересных особенностей. Во-первых, как и в случае спонтанного синтеза, была выявлена значительная индивидуальная вариабельность значений. Во-вторых, показано, что достоверные изменения продукции цитокинов наблюдаются только в случае снижения их количества по сравнению с первым фоном. В-третьих, при стимуляции TLR4 и TLR5 значимого изменения синтеза цитокинов найдено не было, при этом наибольшее количество изменений в продукции всех цитокинов наблюдается при стимулировании TLR2. В некоторых случаях отмечалось повышение продукции отдельных цитокинов, например IL-8 при стимулировании TLR4 или IL-6 при стимулировании TLR5, однако такое повышение не имело статистически значимую достоверность (табл. 1).
Поскольку способность к синтезу цитокинов является одним из ключевых показателей, характеризующих состояние иммунной системы [7], можно сделать вывод о том, что пребывание в условиях СИ оказывает в целом негативное влияние на активационный потенциал моноцитов. Механизм подобных изменений в настоящее время остается неизвестным.
ЗАКЛЮЧЕНИЕ
Представленные в данной работе результаты показывают, что пребывание практически здорового человека в условиях СИ связано с появлением ряда негативных изменений в функционировании системы иммунитета. Стоит обратить внимание на значительную вариабельность результатов, которая указывает на индивидуальную предрасположенность к развитию нарушений иммунологической реактивности при воздействии на организм человека моделируемых эффектов микрогравитации.
Дальнейшее накопление данных в этой области, их систематизация, тщательный анализ и сопоставление с данными, отражающими состояние не только иммунной, но и других систем, в первую очередь, нейроэндокринной, позволит сформировать представление о механизмах влияния экстремальных факторов окружающей среды на молекулярно-клеточном уровне. Это может способствовать развитию принципиально новых перспективных комплексных методов профилактики и коррекции дисбаланса в иммунной системе человека, что чрезвычайно важно не только для успешного осуществления межпланетных полетов, но и в целом для создания эффективных мер помощи лицам, находящимся в экстремальных условиях среды обитания, оказывающих существенное воздействие на систему иммунитета.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при поддержке РНФ (грант № 18-75-10 086).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Моруков Б.В., Рыкова М.П., Антропова Е.Н. и др. Иммунологические аспекты пилотируемого марсианского полета // Физиология человека. 2013. Т. 39. № 2. С. 19.
Пономарёв С.А., Берендеева Т.А., Калинин С.А. и др. Состояние системы сигнальных образ-распознающих рецепторов моноцитов и гранулоцитов периферической крови космонавтов до и после длительных полетов на международную космическую станцию // Авиакосмическая и экологическая медицина. 2016. Т. 50. № 5. С. 18.
Crucian B.E., Choukèr A., Simpson R.J. et al. Immune System Dysregulation During Spaceflight: Potential Countermeasures for Deep Space Exploration Missions // Front. Immunol. 2018. V. 9. P. 1437.
Navasiolava N.M., Custaud M.A., Tomilovskaya E.S. et al. Long-term dry immersion: review and prospects // Eur. J. Appl. Physiol. 2011. V. 111. № 7. P. 1235.
Sattler S. The Role of the Immune System Beyond the Fight Against Infection // Adv. Exp. Med. Biol. 2017. V. 1003. P. 3.
Huse M. Mechanical forces in the immune system // Nat. Rev. Immunol. 2017. V. 17. № 11. P. 679.
Claus M., Dychus N., Ebel M. et al. Measuring the immune system: a comprehensive approach for the analysis of immune functions in humans // Arch. Toxicol. 2016. V. 90. № 10. P. 2481.
Ramani T., Auletta C.S., Weinstock D. et al. Cytokines: The Good, the Bad, and the Deadly // Int. J. Toxicol. 2015. V. 34. № 4. P. 355.
De-Simone F.I., Sariyer R., Otalora Y.L. et al. IFN-Gamma Inhibits JC Virus Replication in Glial Cells by Suppressing T-Antigen Expression // PLoS One. 2015. V. 10. № 6. e0129694.
Schett G., Elewaut D., McInnes I.B. et al. How cytokine networks fuel inflammation: Toward a cytokine-based disease taxonomy // Nat. Med. 2013. V. 19. № 7. P. 822.
Dinarello C.A. Historical insights into cytokines // Eur. J. Immunol. 2007. V. 37. S. 1. P. 34.
Opal S.M., DePalo V.A. Anti-inflammatory cytokines // Chest. 2000. V. 117. № 4. P. 1162.
Boshtam M., Asgary S., Kouhpayeh S. et al. Aptamers Against Pro- and Anti-Inflammatory Cytokines // Inflammation. 2017. V. 40. № 1. P. 340.
Chousterman B.G., Swirski F.K., Weber G.F. Cytokine storm and sepsis disease pathogenesis // Semin. Immunopathol. 2017. V. 39. № 5. P. 517.
Cantan B., Luyt C.E., Martin-Loeches I. Influenza Infections and Emergent Viral Infections in Intensive Care Unit // Semin. Respir. Crit. Care Med. 2019. V. 40. № 4. P. 488.
Morukov B., Rykova M., Antropova E. et al. T-cell immunity and cytokine production in cosmonauts after long-duration space flights // Acta Astronautica. V. 68. № 7–8. P. 739.
Zhang Y., Zhang Y., Gu W., Sun B. TH1/TH2 cell differentiation and molecular signals // Adv. Exp. Med. Biol. 2014. V. 841. P. 15.
Coco G., Foulsham W., Nakao T. et al. Regulatory T cells promote corneal endothelial cell survival following transplantation via Interleukin-10 // Am. J. Transplant. 2019. https://doi.org/10.1111/ajt.15631
Shabrish S., Desai M., Saxena V. et al. IFN-g: IL-10 Ratio: a Putative Predictive Biomarker to Discriminate HLH From Severe Viral Infections // J. Clin. Immunol. 2019. V. 39. № 2. P. 135.
Dimitrova E., Caromile L., Laubenbacher R., Shapiro L.H. The innate immune response to ischemic injury: a multiscale modeling perspective // BMC Syst Biol. 2018. V. 12. № 1. P. 1.
Лебедева С.А., Швед Д.М., Гущин В.И. Предварительные результаты изучения функционального состояния человека-оператора методом анализа акустических характеристик речи в условиях воздействия моделируемых факторов космического полета // Авиакосмическая и экологическая медицина. 2019. Т. 53. № 2. С. 50.
Vitlic A., Lord J.M., Phillips A.C. Stress, ageing and their influence on functional, cellular and molecular aspects of the immune system // AGE. 2014. V. 36. № 3. P. 1169.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


