Физиология человека, 2020, T. 46, № 2, стр. 84-93
Отражение особенностей физиологической регуляции сердечного ритма в протеоме мочи практически здоровых молодых мужчин
В. Б. Русанов 1, *, Л. Х. Пастушкова 1, А. Г. Гончарова 1, А. Г. Черникова 1, А. М. Носовский 1, О. В. Сайк 2, Д. Н. Каширина 1, А. Г. Бржзовский 1, А. С. Кононихин 1, 3, А. Г. Любишева 1, 4, И. М. Ларина 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 Учреждение СО РАН Институт цитологии и генетики РАН
Новосибирск, Россия
3 Сколковский институт науки и технологий
Сколково, Россия
4 ФГАОУ Первый московский государственный университет
имени И.М. Сеченова МЗ РФ
Москва, Россия
* E-mail: vasilyrusanov@gmail.com
Поступила в редакцию 06.03.2019
После доработки 30.09.2019
Принята к публикации 04.12.2019
Аннотация
У практически здоровых мужчин (возраст 28 ± 4 лет, рост 174 ± 1 см, вес 67.9 ± 1.5 кг) проведен хромато-масс-спектрометрический анализ мочи и анализ вариабельности сердечного ритма. На основе математического и биоинформационного анализа из общей совокупности выделены белки, ассоциированные с состоянием сердечно-сосудистой системы и вегетативной регуляцией ритма сердца (серотрансферрин, тирозинкиназный рецептор UFO, простатическая кислая фосфатаза, секретируемый и трансмембранный белок 1, молекула клеточной адгезии 4, галектин-3-связывающий белок, константный домен тяжелой цепи иммуноглобулина А, белок ассоциированный с ремоделированием матрикса 8, биотинидаза). Впервые выстроены ассоциативные связи между белками – маркерами процесса вегетативной регуляции сердечного ритма. На основе протеомики представлены новые данные отражающие особенности физиологической регуляции сердечного ритма в протеоме мочи практически здоровых молодых мужчин.
Молекулярный уровень физиологической регуляции сердечного ритма отражает интегрирующие эффекты многоуровневой иерархически организованной системы управления функциями организма. Изучение белков-маркеров, ассоциированных с ними путей передачи сигналов и их мишеней, дает новое понимание базовых фундаментальных процессов и закладывает основу для новых терапевтических возможностей профилактики и лечения сердечно-сосудистых заболеваний. В связи с этим, протеомные исследования, выполненные с использованием данных практически здоровых лиц молодого возраста в однородной, по особенностям физиологической регуляции сердечного ритма группе, являются уникальной моделью исследования физиологических белковых путей регуляции. Поскольку автономные и гуморальные регуляторные механизмы имеют определяющее значение в поддержании функционального состояния организма в процессе физиологической адаптации, представляется важным выяснить, каким образом вегетативная регуляция ритма сердца может находить свое отражение в протеомном составе биологических жидкостей организма, мочи в частности.
Актуальность поиска протеомных маркеров нормальной физиологической регуляции ритма сердца определяется “омоложением” сроков возникновения сердечно-сосудистых заболеваний и необходимостью поиска неинвазивных маркеров донозологической диагностики состояния сердечно-сосудистой системы у лиц трудоспособного возраста.
МЕТОДИКА
Поиск протеомных маркеров вегетативной регуляции сердечного ритма выполняли у 13 мужчин (возраст 28 ± 4 лет, рост 174 ± 1.0 см, вес 67.9 ± ± 1.5 кг; M ± m) – здоровых добровольцев, прошедших полное клиническое обследование. Регистрацию электрокардиограммы (ЭКГ) осуществляли перед взятием проб мочи в положении сидя, в покое после 15-минутного отдыха. Анализ вариабельности сердечного ритма (ВСР) проводили по 5-минутным участкам записи ЭКГ. Исследование ВСР и расчет показателей для оценки состояния механизмов регуляции кровообращения осуществляли на основе рекомендаций, разработанных Европейским кардиологическим и Северо-Американским электрофизиологическим Обществами, а также Российскими рекомендациями анализа ВСР [1, 2]. Для регистрации использовали прибор “Карди-2” (ООО “Медицинские компьютерные системы”, Россия). Для обработки полученного массива длительностей кардиоинтервалов использовали программное обеспечение “Иским-6” (ООО “Институт внедрения новых медицинских технологий “Рамена”, Россия).
Вычисляли значения показателей, характеризующие вегетативную регуляцию сердечного ритма:
HR (уд./мин) – частота сердечных сокращений, отражает средний уровень функционирования системы кровообращения.
MxDMn (мс) – разность между максимальным и минимальным значениями кардиоинтервалов, отражает максимальную амплитуду регуляторных влияний.
RMSSD (мс) – квадратный корень из среднего значения суммы квадратов разностей между соседними кардиоинтервалами.
pNN50 (%) – число пар кардиоинтервалов с разностью более 50 мс, в % к общему числу кардиоинтервалов в массиве, показатель степени преобладания парасимпатического звена регуляции над симпатическим.
SDNN (мс) – стандартное отклонение полного массива кардиоинтервалов, суммарный эффект действия регуляторных систем.
CV (%) – коэффициент вариации последовательности кардиоинтервалов, нормированный показатель суммарного эффекта регуляции.
Mo (мс) – мода, наиболее часто встречающееся значения кардиоинтервала, наиболее вероятный уровень функционирования сердечно-сосудистой системы.
AMo (%) – амплитуда моды, соответствует максимальному значению функции распределения длительности кардиоинтервалов, условный показатель активности симпатического звена регуляции.
CC1 (у. е.) – значение первого коэффициента автокорреляционной функции, показатель, характеризующий преобладание автономного или центрального контура регуляции.
SI (у. е.) – стресс индекс, индекс напряжения регуляторных систем, характеризует степень преобладания активности центральных механизмов регуляции над автономными.
Power HF (%) – мощность спектра высокочастотного компонента ВСР от суммарной мощности колебаний, относительный уровень активности парасимпатического звена регуляции.
Power LF (%) – мощность спектра низкочастотного компонента ВСР от суммарной мощности колебаний, относительный уровень активности подкоркового вазомоторного центра.
Power VLF (%) – мощность спектра очень низкочастотного компонента ВСР от суммарной мощности колебаний, относительный уровень активности симпатического звена регуляции.
LF/HF (у. е.) – соотношение мощности высокочастотных и низкочастотных волн спектра, показатель, характеризующий баланс симпатических и парасимпатических влияний и относительную активность подкоркового симпатического центра.
IC (у. е.) – индекс централизации, отражает степень централизации управления ритмом сердца и преобладание активности центрального контура регуляции над автономным.
ПАРС (у. е.) – показатель активности регуляторных систем, интегральный критерий успешности адаптации.
В соответствии с требованиями EuroKUP и HKUPP использовали стандартизированный протокол сбора мочи для анализа протеома. В соответствии с этим протоколом для протеомного анализа мочи использовали среднюю порцию второй утренней фракции (после завтрака) [3]. Образцы мочи подвергали пробоподготовке, состоящей из этапов восстановления, алкилирования, осаждения белка и протеолиза с использованием трипсина.
Для полуколичественного анализа полученной полипептидной смеси использовали методологию short-gun протеомики. Смесь разделяли при помощи жидкостной хроматографии с использованием прибора Agilent 1100 (Agilent Technologies Inc., США) в трех повторах и анализировали на гибридном масс-спектрометре LTQ-FT Ultra (Thermo, Германия), ионного циклотронного резонанса, совмещенном с линейной квадрупольной ионной ловушкой. Для хроматографии использовали колонку с обращенной фазой Repro Sil-Pur C18 (диаметр частиц 3 мкм, диаметр пор 100 Å) (Dr. Maisch GmbH, Германия), изготовленную с использованием капилляра-эммитера Pico-tip (New Objective Inc., США).
Результаты масс-спектрометрического анализа смеси пептидов анализировали программой Xcalibur (Thermo Electron, Германия) в 2-х стадийном режиме. С помощью программы Max Quant проводили идентификацию белков по базе данных Swiss Prot. Дальнейшему анализу подвергали только белки, которые идентифицировали минимум по 2 пептидным фрагментам, причем один из них должен был быть уникальным для данного белка.
Для статистического анализа применяли метод главных компонент [4], а для определения молекулярных функций и биологических процессов с участием выявленных белков использовали программный пакет Perseus. Реконструкцию ассоциативных генных сетей осуществляли программой AND System.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В норме сердечный ритм является результатом влияний различных регуляторных механизмов на ритмическую активность синусового узла, гуморальных и рефлекторных воздействий, т.е. комплекса надсистем, работающих взаимосвязанно и согласованно [5–7]. Поскольку показатели ВСР отражают состояние механизмов регуляции и так же, как и белки протеома мочи, генетические свойства организма и внешние влияния на него, то и молекулярный уровень физиологической регуляции сердечного ритма отражается в протеоме жидкостей тела, в нашем исследовании – в протеоме мочи. После хромато-масс-спектрометрического анализа всех образцов мочи 13 молодых здоровых добровольцев было идентифицировано 256 различных белков (по номенклатуре Uni Prot KB).
Экспериментальная группа являлась однородной не только по формальным признакам (пол, возраст, антропометрические и медицинские критерии), но и по особенностям физиологической регуляции сердечного ритма. Это иллюстрируется значениями показателей ВСР и их разбросом (табл. 1). По сравнению с известными нормативами (https://www.medprof.org), диапазон значений показателей, характеризовал высокий уровень активности обоих отделов вегетативной нервной системы. Как видно из табл. 1, в экспериментальной группе, повышен уровень как симпатической (HR, LF, LF/HF) так и парасимпатической активности (RMSSD, pNN50) при сниженном уровне нейро-гуморальной регуляции (VLF). Высокий уровень ВСР (MxDMn, SDNN, CV) характеризует высокий энергетический ресурс организма, что, связано с особенностями вегетативной регуляции, характерными для практически здоровых лиц молодого возраста [8–11].
Таблица 1.
Показатели ВСР, характеризующие вегетативную регуляцию ритма сердца у исследуемого контингента
| Показатели | Медиана | Нижний квартиль | Верхний квартиль | Норматив |
|---|---|---|---|---|
| HR, уд./мин | 81.0 | 69.0 | 88.0 | 56–83 |
| MxDMn, мс | 443.0 | 280.0 | 520.0 | 150–300 |
| RMSSD, мс | 57.5 | 38.0 | 63.9 | 35–65 |
| pNN50, % | 21.5 | 9.9 | 26.4 | 10–49 |
| SDNN, мс | 80.0 | 66.0 | 94.0 | 40–80 |
| CV, % | 9.8 | 8.6 | 10.9 | 4.5–7 |
| Mo, мс | 755.0 | 678.0 | 910.0 | 720–1080 |
| Amo, % | 38.5 | 30.1 | 48.2 | 30–50 |
| SI, у. е. | 62.0 | 38.0 | 119.0 | 50–200 |
| Power HF, % | 26.6 | 20.1 | 31.7 | 15–35 |
| Power LF, % | 51.9 | 48.0 | 57.3 | 15–25 |
| Power VLF, % | 21.3 | 7.6 | 31.5 | 15–45 |
| LF/HF, у. е. | 3.9 | 3.4 | 4.4 | 0.5–2 |
| IC, у. е. | 5.4 | 4.4 | 7.8 | 1–2 |
| ПАРС, у. е. | 6.0 | 5.0 | 6.0 | 1–5 |
Примечание: норматив представлен согласно методическим рекомендациям https://www.medprof.org.
Для понимания того, как формируются физиологические реакции, была сделана попытка перебросить концептуальные и функциональные мостики “от белков к клеткам, далее к органам, и системам организма” [12], поэтому был проведен корреляционный анализ данных хромато-масс-спектрометрического анализа протеома мочи и показателей ВСР.
С помощью программы Statistica 10. Из общего списка было выявлено 9 белков, отражающих регуляторные влияния на ритм сердца и достоверно связанных (p < 0.05) с некоторыми показателями ВСР (табл. 2). Среди этих показателей: RMSSD – показатель активности парасимпатического звена вегетативной регуляции; СС1 – показатель, характеризующий преобладание автономного или центрального контура регуляции; Мо – условный показатель активности симпатического звена регуляции; LF/HF – показатель, характеризующий баланс симпатических и парасимпатических влияний; СV – нормированный показатель суммарного эффекта регуляции; ПАРС – показатель активности регуляторных систем.
Таблица 2.
Корреляционные взаимоотношения между белками протеома мочи и показателями вегетативной регуляции сердечного ритма у исследуемого контингента
| Показатели | RMSSD | СС1 | Mo | AMo | LF/HF | СV | ПАРС |
|---|---|---|---|---|---|---|---|
| TRFE | 0.7 | – | – | – | – | – | – |
| AXL | – | – | – | – | – | 0.7 | – |
| SECTM1 | – | – | 0.7 | – | – | – | – |
| ACPP | – | –0.7 | – | – | – | – | – |
| MXRA8 | – | – | – | 0.7 | – | – | – |
| CADM4 | – | – | – | – | 0.8 | – | – |
| IGHA1 | – | – | – | – | – | – | 0.8 |
| LGALS3BP | – | – | – | – | – | – | 0.8 |
| BTD | – | – | – | – | – | – | 0.7 |
Следуя поисково-теоретическому направлению исследования, было целесообразно привести краткую аннотацию этих белков. Описывая их применительно к процессу регуляции сердечного ритма у практически здоровых молодых мужчин, мы остановились на ключевых моментах, отражающих процессы, модулирующие влияние регуляторных механизмов на ритм сердца.
К белкам, коррелирующим с показателями, отражающими преимущественно парасимпатическую вегетативную регуляцию, среди выявленной когорты протеинов, относятся: серотрансферрин, тирозинкиназный рецептор UFO, простатическая кислая фосфатаза, секретируемый и трансмембранный белок 1.
Серотрансферрин (кодируемый геном TRFE) – гликопротеин плазмы крови, синтезируется в печени. Изучение метаболизма серотрансферрина важно при изучении патогенеза сосудистых заболеваний [13]. Отмечена связь повреждения эндотелия с нарушением реологических свойств крови и серотрансферрином [14]. Серотрансферрин, α-цепь фибриногена, глицеральдегид-3-фосфатдегидрогеназа, сывороточный альбумин, трансгелин-2, кальпонин-2/LIM и домен белка 1 SH3 и хорионический гонадотропин человека тромбоцитарного генеза – достоверно более экспрессированы у здоровых детей по сравнению со взрослыми [15]. Полученные нами данные об участии серотрансферрина в регуляции сердечного ритма дают новое понимание возрастной физиологии сердца и сосудов, реологии крови и ассоциированным с тробоцитарным звеном состоянием сердечно-сосудистой системы здоровых людей.
Тирозинкиназный рецептор UFO (кодируемый геном AXL) экспрессируется в основном в сосудистом эндотелии, и, вместе с Tyro-3 и Mer, составляет семейство TAM – тирозинкиназных рецепторов. UFO преобразует сигналы, поступающие от внеклеточного матрикса в цитоплазму, путем связывания фактора роста Gas6, и, таким образом, регулирует многие физиологические процессы. Путь Gas6/Axl регуляцией сигнального пути PI3K/Akt/mTOR изменяет процессы пролиферации, миграции, инвазии и образованию трубок эндотелиальных клеток [16]. Передача сигналов Gas6/Axl необходима для задержки процесса клеточного старения, регулируемого сигнальным путем PI3K/Akt/FoxO [17]. Показано, что сигнализация Gas6/UFO играет важную роль в выживании эндотелиальных клеток при ацидозе [18]. Данный рецептор принимает участие в регуляции ангиогенеза. Установлена потенциальная роль системы Gas6-Axl в патофизиологии ремоделирования левого желудочка, что свидетельствует об участии данного белка в регуляции ВСР [19]. Axl стимулирует передачу сигналов STAT1 (член семейства транскрипционных факторов преобразователей сигналов и активаторов транскрипции) посредством ингибирования SOCS1 (супрессоры цитокиновой сигнализации) в активированных гладкомышечных клетках при ремоделировании венозного трансплантата [20]. Также как M. Batlle et al., мы полагаем, что sAXL может участвовать в новом молекулярном пути, вовлеченном в ремоделирование миокарда, независимо от BNP [21].
Секретируемый и трансмембранный белок 1 (кодируемый геном SECTM1) – является молекулой суперсемейства иммуноглобулинов, экспрессируемой на Т-, NK-клетках и пре-В-лимфоцитах. Предыдущие исследования продемонстрировали роль CD7 в активации T- и NK-клеток и продукции цитокинов. Недавно секретированный эпителиальными клетками белок SECTM1, был идентифицирован как лиганд CD7 [22]. SECTM1 экспрессируется в эндотелиальных клетках костного мозга человека, и его экспрессия может повышаться с помощью IFN-γ. Клетки KG1a демонстрировали высокие уровни экспрессии CD7 и фактора транскрипции ETS-1, позволяя конститутивную передачу сигналов через путь PI3K/Atk для стимуляции экспрессии гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), тогда как клетки KG1 с низкой экспрессией CD7 и ETS-1 демонстрировали низкую экспрессию GM-CSF. На клетках KG1a экспрессия GM-CSF может отрицательно регулироваться ингибиторами PI3K или рекомбинантным SECTM1-Fc. Сверхэкспрессия CD7 в клетках KG1 была недостаточной для стимуляции экспрессии GM-CSF, тогда как сайленсинг CD7 или ETS-1 приводил к снижению уровней экспрессии GM-CSF. Способные к дифференцировке клетки KG1a, сверхэкспрессирующие протеинкиназу С β2 (PKCβ2), иллюстрировали полную потерю CD7, но сохраняли нормальные уровни экспрессии как ETS-1, так и GM-CSF. Эти данные добавляют дополнительную информацию к ранее описанной аутокринной и паракринной передаче сигналов [23, 24].
Простатическая кислая фосфатаза (кодируемая геном ACPP) – неспецифическая тирозинфосфатаза катализирует гидролиз сложных эфиров фосфорной кислоты и органических соединений. Этот лизосомальный фермент содержится практически во всех тканях. Самая высокая концентрация отмечается в предстательной железе (простатическая фракция), в печени, селезенке, эритроцитах (внелизосомальная локализация), тромбоцитах, костном мозге. Высокая активность кислой фосфатазы отмечается в макрофагах и остеокластах [25]. Применительно к задачам данного исследования и выявленной корреляции с парасимпатической регуляцией сердечного ритма важно, что АСРР генерирует аденозин из AMP, который действует как анальгетик и опосредовано влияет на парасимпатическую активность.
Среди белков, коррелирующих преимущественно с показателями, отражающими симпатическую вегетативную регуляцию, в нашем исследовании выделены: молекулы клеточной адгезии 4, галектин-3-связывающий белок, константный домен тяжелой цепи иммуноглобулина А, белок ассоциированный с ремоделированием матрикса 8, биотинидаза.
Молекула клеточной адгезии 4 (кодируемая геном CADM4) – относится к мембранным белкам. Cadms или Necls представляют собой нектины и нектиноподобные молекулы, являются Ca2+-зависимыми молекулами адгезии клеток суперсемейства иммуноглобулинов, экспрессирующиеся в большинстве типов клеток. Нектины опосредуют не только гомотипическую, но и гетеротипическую клеточную адгезию, в отличие от классических кадгеринов, которые участвуют только в гомофильной адгезии. Участие Necls в органогенезе органов чувств: глаза, внутреннего уха, и коры головного мозга, а также в различных процессах развития, включая образование синапсов, аксонов и миелинизацию, помогает понять связующую роль молекул клеточной адгезии в реализации передачи нервного импульса и особенностей его эффекта [26]. Указана роль этого белка в формировании структур сердца [27].
Галектин-3-связывающий белок (кодируемый геном LGALS3BP) является секретируемым белком, который может стимулировать межклеточную адгезию, а также регулировать межклеточную провоспалительную передачу сигналов, в том числе в макрофагах, происходящих из моноцитов человека [28–30]. Уровни Gal-3BP независимо связаны с маркерами метаболического и воспалительного ответа. Экспрессирующие галектин-3-связывающий белок субклеточные микровезикулы вовлечены в передачу информации от клетки к клетке и осуществляют регуляцию иммунитета, тромбоза и коагуляции, фокусируясь на выделенных участках клеточной мембраны (размером от 200 до 1000 нм), обычно называемых микрочастицами (MP). Число и, в частности, состав MP, по-видимому, отражают состояние их родительских клеток. Поэтому MP могут иметь большой потенциал в качестве клинических биомаркеров исследуемых протеомикой. Этот белок может выступать в качестве маркера “патогенных” субклеточных микровезикул [31]. С другой стороны, он связан с “жесткостью” сосудов, так как высоко экспрессируется в атеросклеротических бляшках [32] и опосредованно влияет на сердечный ритм.
Константный домен тяжелой цепи иммуноглобулина А (кодируемый геном IGHA1) – является мембраносвязанным или секретируемым гликопротеином, продуцируемым В-лимфоцитами. Доказана связь IGHA1 с наличием основных факторов, определяющих “жесткость и эластичность” сосудистой стенки и хроническими сосудистыми заболеваниями. Белками, ассоциированными с атеросклерозом, являются: константный домен тяжелой цепи иммуноглобулина А (IGHA1), сывороточный амилоид А1 (SAA), и четыре белка каскада комплемента: фактор комплемента B (CFAB), комплемент C2 (CO2), комплемент C3 (CO3) и комплемент C1s субкомпонент (C1S), которые могут рассматриваться в качестве биомаркеров риска сердечно-сосудистых заболеваний [33]. Эти же белки вошли в число 43 белков, идентифицированных при хронической церебральной ишемии [34]. Константный домен тяжелой цепи иммуноглобулина А и еще семь белков идентифицированы и коррелируют с наличием диабетической ангиопатии, застойной сердечной недостаточностью, гипертонией, тяжестью, длительностью существования язвенного процесса при хронической венозной недостаточности и возрастом пациента [35]. Данные работы и наши исследования позволяют предположить, что константный домен тяжелой цепи иммуноглобулина А может являться основным белком, влияющим на жесткость и эластичность артерий, вен и сердечной мышцы, опосредуя особенности сердечного сокращения в соответствии с ригидностью сосудистой стенки.
Белок ассоциированный с ремоделированием матрикса 8 (кодируемый геном MXRA8) – этот белок путем посредников связан с белками клеточной адгезии, в том числе, обеспечивая нормальную проницаемость на тканевом уровне [36]. MXRA8 неразрывно связан с нормальной функцией гематоэнцефалического барьера и может рассматриваться как маркер целостности гематоэнцефалического и тканевого барьера [37].
Биотинидаза (кодируемая геном BTD) — это фермент, участвующий в обмене биотина, являющегося кофактором синтеза жирных кислот, катаболизма аминокислот и глюконеогенеза [38, 39]. Он обеспечивает каталитическое высвобождение биотина из биоцитина. Биотин функционирует как коэнзим для 4 карбоксилаз [39, 40]. Биотин накапливается в необычно больших количествах в клетках артериальных хеморецепторов, сонной артерии (CА) и мозгового вещества надпочечников (AM). При дефиците биотина он быстро исчезает из крови и других тканей (включая AM), оставаясь при относительно высоком уровне в CА. По сравнению с другими периферическими нервными тканями клетки CА содержат высокие уровни SLC5a6, переносчика биотина, и SLC19a3, переносчика тиамина, регулируемого биотином.
Таким образом, биотин играет важную роль в гомеостазе допаминергической передачи, модулирующей транспорт и хранение допамина в небольших секреторных гранулах в клетках [41]. Избирательная локализация больших концентраций биотина в артериальных хеморецепторах и сохранение его артериального депо при общем дефиците свидетельствует о эволюционно закрепившейся физиологической роли биотина как жизненно важного вещества, необходимого для нормального функционирования сердечно-сосудистой системы.
Продолжая биоинформационный этап анализа вышеописанных белков, из Gene Ontology был извлечен список протеинов, вовлеченных в процесс регуляции сердечного ритма. С помощью программы для автоматической экстракции данных AND System был выполнен поиск молекулярно-генетических взаимосвязей. Таким путем были обнаружены взаимодействия этих белков канонических процессов регуляции сердечного ритма через различных молекулярных посредников. Можно отметить, что прямых связей этих 9 белков с процессом регуляции сердечного ритма установить не удалось.
Оказалось, что белки, кодируемые генами TRFE_HUMAN, ACPP_HUMAN, UFO_HUMAN, SCTM1_HUMAN, связаны и взаимодействуют с белками, участвующими парасимпатической регуляцией, через 294 белка-посредника. Белки, кодируемые генами BTD_HUMAN, LG3BP_HUMAN, CADM4_HUMAN, MXRA8_HUMAN, IGHA1_HUMAN, связаны и с симпатической регуляцией, через 144 посредника. Определен список этих белков-посредников, а также сверхпредставленные биологические процессы (Gene Ontology), найденные с помощью сервиса DAVID. Таким образом, были выделены 54 достоверных биологических процесса со статистической значимостью p-value < < 0.01 с поправкой на множественное сравнение FDR.
На рис. 1 вычленен один из вариантов такой связи между тирозинкиназным рецептором UFO и 8 белками, участвующими в процессе регуляции сердечного ритма (табл. 3) через 7 белков-посредников.
Рис. 1.
Связи между тирозинкиназным рецептором UFO и белками, участвующими в процессе регуляции сердечного ритма, найденные с помощью сервиса Gene Ontology.
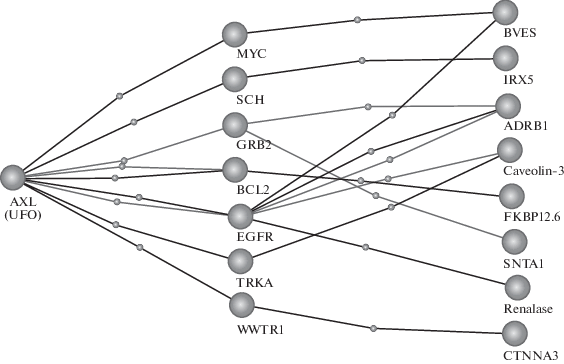
Таблица 3.
Связь между тирозинкиназным рецептором UFO и белками, участвующими в процессе регуляции сердечного ритма, найденные с помощью сервиса Gene Ontology
| AXL (UFO) |
Белки-посредники | Белки процесса регуляции сердечного ритма |
| MYC – proto-oncogene c-myc | BVES – blood vessel epicardial substance | |
| SCH – neurofibromin 2 | IRX5 – iroquois homeobox 5 | |
| GRB2 – growth factor receptor bound protein 2 | ADRB1 – adrenoreceptor beta 1 | |
| SNTA1 – syntrophin alpha 1 | ||
| BCL2 – BCL 2 apoptosis regulator | FKBP-12.6 – FKBP prolyl isomerase 1B | |
| EGFR – epidermal growth factor receptor | ADRB1 – adrenoreceptor beta 1 | |
| Caveolin-3 | ||
| Renalase | ||
| BVES – blood vessel epicardial substance | ||
| TRKA – tropomiosin receptor kinase 2 | Caveolin-3 | |
| WWTR1 – WW domain containing transcription regulator 1 | CTNNA3 – catenin alpha 3 |
Математический и биоинформационный анализ позволил выделить из совокупности белков, ассоциированных с состоянием сердечно-сосудистой системы, которые коррелируют с ВСР, и отражают его регуляцию. Именно эта комбинация явилась предметом исследования, в том числе, применительно к поиску новых мишеней терапевтического воздействия с учетом белков-посредников данного процесса. В данном исследовании установлена достоверная связь 9 белков (серотрансферрин, тирозинкиназный рецептор UFO, простатическая кислая фосфатаза, секретируемый и трансмембранный белок 1, молекулы клеточной адгезии 4, галектин-3-связывающий белок, константный домен тяжелой цепи иммуноглобулина А, белок ассоциированный с ремоделированием матрикса 8, биотинидаза) с процессами, влияющими на вегетативную регуляцию ритма сердца у практически здоровых лиц в возрасте 20–30 лет. Очевидно, описанная комбинация из 9 белков обеспечивает физиологический баланс между симпатическими и парасимпатическими влияниями на сердечный ритм у молодых и здоровых обследованных.
Таким образом, эти белки можно охарактеризовать как ключевые протеомные маркеры метаболического контура регуляции ритма сердца. Поскольку в анализируемой выборке молодых здоровых добровольцев отсутствуют признаки ригидности сосудов, нет гипертрофии сердечной мышцы сердечной недостаточности, не отмечены клинические и биохимические проявления атеросклеротического изменения сердца и сосудов (что подтверждено заключением о состоянии здоровья испытателей – добровольцев) и свидетельствует о значении этих белков для нормальной физиологической регуляции сердечного ритма.
Сложность событий сердечно-сосудистой регуляции делает любой отдельный маркер низко-специфичным, и большинство применяемых в настоящее время маркеров не могут предсказать ранний доклинический риск. Описанные нами биомаркеры физиологической регуляции сердечного ритма потенциально способны заполнить этот пробел. С другой стороны особенностью работы является относительно небольшое число в выборке практически здоровых молодых людей и до ввода совокупности этих протеомных маркеров в клиническую практику должны последовать дальнейшие исследования (такие как исследования более широких когорт). Степень корреляций, обнаруженных в этом исследовании повышает вероятность того, что требуемые более крупные многоцентровые когорты для дальнейшего подтверждения их потенциального использования в стратификации риска сердечно-сосудистых заболеваний могут подтвердить наши данные. Вероятно, дальнейшие исследования потребуются для уточнения – являются ли комбинации указанных белков маркерами риска более чувствительными и специфическими, чем традиционно используемые с этой целью, отражающие факторы риска повреждения сердца и сосудов. Роль этих белков может быть различной в первичной и вторичной профилактике [42].
ВЫВОДЫ
1. Математический и биоинформационный анализ позволил выделить совокупность белков, ассоциированных с состоянием сердечно-сосудистой системы и функцией сердечного ритма. Именно эта комбинация (панель) явилась предметом исследования и описана применительно к поиску новых мишеней терапевтического воздействия с учетом белков-посредников данного процесса.
2. Установлена достоверная связь 9 белков с процессами вегетативной регуляции сердечного ритма у практически здоровых лиц в возрасте 20–30 лет. Описанная комбинация обеспечивает баланс между симпатическими и парасимпатическими влияниями на сердечный ритм у молодых и здоровых обследованных.
3. При анализе полученных данных показано, что сопряженными процессами, в которых участвуют вышеописанные белки, являются: клеточная адгезия, тканевая проницаемость, передача нервного импульса, допаминэргический путь, аутокринная и паракринная передача сигнала, жесткость и эластичность сосудистой стенки.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках базовых тем РАН 64.1 и 65.3. на 2013–2020 гг. Хромато-масс-спектрометрический анализ вы-полнен при поддержке РФФИ (грант № 18-34-00524).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Heart rate variability. Standards of measurement, physiological interpretation and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology // Circulation. 1996. V. 93. № 5. P. 1043.
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В. и др. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем (методические рекомендации) // Вестник аритмологии. 2001. № 24. С. 65.
Nkuipou-Kenfack E., Koeck T., Mischak H. et al. Proteome analysis in the assessment of ageing // Ageing Res Rev. 2014. V. 18. P. 74.
Nosovsky A., Vassilieva G., Kaminskaya E. Application of multidimensional projections in the practice of medical and biological research // Norwegian J. Development of the International Science. 2018. № 15. P. 9.
Киселёв А.Р., Гриднев В.И. Колебательные процессы в вегетативной регуляции сердечно-сосудистой системы // Саратовский научно-медицинский журн. 2011. Т. 7. № 1. С. 34.
Maliani A. Principles of cardiovascular neural regulation in health and disease. Norwell: Kluwer Academic Publishers, 2000. P. 222.
Shankar V. Age-related changes in the parasympathetic control of the heart // International J. Scientific and Research Publications. 2012. V. 2. № 2. P. 1.
Hester R.L., Iliescu R., Summers R., Coleman T.G. Systems biology and integrative physiological modelling // J. Physiol. 2011. V. 589(Pt 5). P. 1053.
Golizeh M., Lee K., Ilchenko S. et al. Increased serotransferrin and ceruloplasmin turnover in diet-controlled patients with type 2 diabetes // Free Radic. Biol. Med. 2017. V. 113. P. 461.
Fukusaki C., Kawakubo K., Yamamoto Y. Assessment of the primary effect of aging on heart rate variability in humans // Clinical Autonomic Research. 2000. V. 10. № 3. P. 123.
Ferrari A.U., Radaelli A., Centova V. Invited review: aging and the cardiovascular system // J. Appl. Physiol. 2003. V. 95. № 6. P. 2591.
Панкова Н.Б. Функциональное развитие вегетативной регуляции сердечно-сосудистой системы человека в онтогенезе // Российский физиологический журн. им. И.М. Сеченова. 2008. Т. 94. № 3. С. 267.
Нидеккер И.Г., Куприянова О.О. Количественный анализ сбалансированности нейрогенных влияний на ритм сердца // Физиология человека. 2010. Т. 36. № 2. С. 72.
Орлов Ю.П., Лукач В.Н., Долгих В.Т. и др. Патогенетическая значимость нарушенного обмена железа в формировании микроциркуляторных расстройств при реперфузии. Экспериментальное исследование // Сибирский медицинский журн. 2012. № 5. С. 71.
Cini C., Yip C., Attard C. et al. Differences intheresting platelet proteome and platelet releasate between healthy children and adults // J. Proteomics. 2015. V. 123. P. 78.
Li X., Chen M., Lei X. et al. Luteolin inhibits angiogenesis by blocking Gas6/Axl signaling pathway // Int. J. Oncol. 2017. V. 51. № 2. P. 677.
Jin C.W., Wang H., Chen Y.Q. et al. Gas6 delays senescence in vascular smooth muscle cells through the PI3K/Akt/FoxO signaling pathway // Cell Physiol. Biochem. 2015. V. 35. № 3. P. 1151.
Gustafsson A., Matuszewska D., Johansson M. et al. Differential expression of Axl and Gas6 in renal cell carcinoma reflecting tumor advancement and survival // Clin. Cancer Res. 2009. V. 15. № 14. P. 4742.
Caldentey G., García De Frutos P., Cristóbal H. et al. Serum levels of Growth Arrest-Specific 6 protein and soluble AXL in patients with ST-segment elevation myocardial infarction // Eur. Heart J. Acute Cardiovasc. Care. 2017. https://doi.org/10.1177/2048872617740833
Batchu S.N., Xia J., Ko K.A. et al. Axl modulates immune activation of smooth muscle cells in vein graft remodeling // Am. J. Physiol. Heart Circ. Physiol. 2015. V. 309. № 6. P. 1048.
Batlle M., Recarte-Pelz P., Roig E. et al. AXL receptor tyrosine kinase is increased in patients with heart failure // Int. J. Cardiol. 2014. V. 73. № 3. P. 402.
Lam G.K., Liao H.X., Xue Y. et al. Expression of the CD7 ligand K-12 in human thymic epithelial cells: regulation by IFN-gamma // J. Clin. Immunol. 2005. V. 25. № 1. P. 41.
Bade-Döding C., Göttmann W., Baigger A. et al. Autocrine GM-CSF transcription in the leukemic progenitor cell line KG1a is mediated by the transcription factor ETS1 and is negatively regulated through SECTM1 mediated ligation of CD7 // Biochim. Biophys. Acta. 2014. V. 1840. № 3. P. 1004.
Huyton T., Göttmann W., Bade-Döding C. et al. The T/NK cell co-stimulatory molecule SECTM1 is an IFN “early response gene” that is negatively regulated by LPS in human monocytic cells // Biochim. Biophys. Acta. 2011. V. 1810. № 12. P. 1294.
Lim W., Bae H., Sohn J.Y. et al. Dietary cholesterol affects expression of prostatic acid phosphatase in reproductive organs of male rats // Biochem. Biophys. Res. Commun. 2015. V. 456. № 1. P. 421.
Lambert N.G., ElShelmani H., Singh M.K. et al. Risk factors and biomarkers of age-related macular degeneration // Prog. Retin. Eye Res. 2016. V. 54. P. 64.
Zeng X.X., Yelon D. Cadm4 restricts the production of cardiac outflow tract progenitor cells // Cell Rep. 2014. V. 7. № 4. P. 951.
DeRoo E.P., Wrobleski S.K., Shea E.M. et al. The role of galectin-3 and galectin-3–binding protein in venous thrombosis // Blood. 2015. V. 125. № 11. P. 1813.
Gleissner C.A., Erbel C., Linden F. et al. Galectin-3 binding protein, coronary artery disease and cardiovascular mortality: Insights from the LURIC study // Atherosclerosis. 2017. V. 260. P. 121.
Sun Y.X., Gao C.Y., Wang X.Q. et al. Serum quantitative proteomic analysis of patients with keshan disease based on iTRAQ labeling technique: A first term study // J. Trace Elem. Med. Biol. 2017. V. 44. P. 331.
Nielsen C.T., Østergaard O., Rasmussen N.S. et al. A review of studies of the proteomes of circulating microparticles: key roles for galectin-3-binding protein-expressing microparticles in vascular diseases and systemic lupus erythematosus // Clin. Proteomics. 2017. V. 14. P. 11.
Xie H., Chen L., Liu H. et al. Expression of Mac-2 binding protein in human carotid atheroma is associated with plaque instability and clinical manifestations // Biomed. Pharmacother. 2019. V. 110. P. 465.
Gordon S.M., Chung J.H., Playford M.P. et al. High density lipoprotein proteome is associated with cardiovascular risk factors and atherosclerosis burden as evaluated by coronary CT angiography // Atherosclerosis. 2018. V. 278. P. 278.
Кисриева Ю.С., Петушкова Н.А., Саменкова Н.Ф. и др. Сравнительный анализ протеома плазмы крови больных на ранней стадии хронической церебральной ишемии // Биомедицинская химия. 2016. Т. 62. № 5. С. 599.
Cavassan N.R.V., Camargo C.C., de Pontes L.G. et al. Correlation between chronic venous ulcer exudate proteins and clinical profile: A cross-sectional study // J. Proteomics. 2019. V. 192. P. 280.
Zhang R., Kim A.S., Fox J.M et al. Mxra8 is a receptor for multiple arthritogenic alphaviruses // Nature. 2018. V. 557. № 7706. P. 570.
Yonezawa T., Ohtsuka A., Yoshitaka T. et al. Limitrin, a novel immunoglobulin superfamily protein localized to glia limitans formed by astrocyte endfeet // Glia. 2003. V. 44. № 3. P. 190.
Zhao M., Wu J., Li X., Gao Y. Urinary candidate biomarkers in an experimental autoimmune myocarditis rat model // J. Proteomics. 2018. V. 179. P. 71.
Balfoussia E., Skenderi K., Tsironi M. et al. A proteomic study of plasma protein changes under extreme physical stress // J. Proteomics. 2014. V. 98. P. 1.
Panossian A., Seo E.-J., Efferth T. Synergy assessments of plant extracts used in the treatment of stress and aging-related disorders // Synergy. 2018. V. 7. P. 39.
Ortega-Sáenz P., Macías D., Levitsky K.L. et al. Selective accumulation of biotin in arterial chemoreceptors: requirement for carotid body exocytotic dopamine secretion // J. Physiol. 2016. V. 594. № 24. P. 7229.
Von Zychlinski A., Kleffmann T. Dissecting the proteome of lipoproteins: New biomarkers for cardiovascular diseases? // Translational Proteomics. 2015. V. 7. P. 30.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


