Физиология человека, 2021, T. 47, № 2, стр. 101-115
Роль сигма-1 рецепторов в регуляции деятельности сердца. Часть 1. Структура, локализация и функциональная активность сигма-1 рецепторов в кардиомиоцитах
С. А. Крыжановский 1, *, И. А. Мирошкина 1
1 ФГБНУ “НИИ фармакологии имени В.В. Закусова”
Москва, Россия
* E-mail: sak-538@yandex.ru
Поступила в редакцию 09.05.2020
После доработки 09.06.2020
Принята к публикации 30.09.2020
Аннотация
В 1-ой части обзора подробно рассмотрена структура сигма-1 рецепторов, особенности их внутриклеточной локализации и транслокации. Приведены литературные данные, свидетельствующие о том, что сигма-1 рецепторы, находящиеся в составе так называемой липидной везикулы, не только стационарно располагаются на наружной мембране саркоплазматического ретикулума, но транслоцируются к внутренней поверхности клеточной мембраны и/или к наружной мембране ядра клетки. Также подробно рассмотрена роль сигма-1 рецепторов в регуляции функциональной активности кардиомиоцитов.
Открытые W.R. Martin в 1976 г. сигма рецепторы (σR) изначально рассматривали как один из подтипов опиоидных рецепторов [1]. Однако позднее было показано, что σR, в отличие от канонических опиоидных рецепторов, имеют крайне низкий аффинитет к налоксону и налтрексону, что позволило T.P. Su et al. в 1982 г. выделить σR в самостоятельную группу [2]. В настоящее время идентифицировано 2 подтипа σR – σ1R и σ2R, отличающиеся друг от друга по молекулярной массе, аффинитету к лигандам, а также распределением по тканям и органам [3, 4]. σ1R были выделены из микросом печени морской свинки в 1996 г. группой американских исследователей под руководством проф. M. Hanner [5]. Было показано, что σ1R не являются гомологами каких-либо других белков млекопитающих и представляют собой самостоятельный класс цитозольных рецепторов. Впоследствии σ1R были выделены также из тканей человека, мышей и крыс [6–10]. В 2007 г. T. Hayashi et al. показали, что σ1R являются шаперонами [11], а в 2011 г. E. Laurini et al. методом гомологичного моделирования создали трхмерную пространственную модель σR [12]. В 2014 г. K.A. Gromek et al. установили, что σ1R в наиболее активном состоянии имеет олигомерную конформацию [13], а в 2016 г. H.R. Schmidt et al. впервые описали кристаллическую структуру σ1R [14]. Показано, что σ1R экспрессируются в нейронах ЦНС (кора головного мозга, полосатое тело, гиппокамп), в клетках печени, почек, грудного отдела аорты и кардиомиоцитах [15]. На современном этапе σ1R рассматривают как эволюционно сформировавшийся “ремонтный комплекс”, обеспечивающий гомеостаз клетки и тем самым поддерживающий ее жизнедеятельность [16].
Если структура и биологическая роль σ1R в настоящее время достаточно хорошо изучены, то структура и биологическая роль σ2R до последнего времени оставалась неясной. σ2R, идентифицированные S.B. Hellewell, W.D. Bowen в 1990 г. в клетках феохромоцитомы (PC12) крысы, были определены как сайт связывания с высоким сродством к галоперидолу, умеренным к фенциклидину, но не к бензоморфанам [4]. Авторы данного исследования показали, что σ2R представляет собой внутриклеточный мембранный белок 18–22 кДа, однако ген, кодирующий σ2R, до последнего времени оставался неизвестным, что являлось главным препятствием для изучения его биологической роли. В 2011 г. J. Xu et al. высказали предположение, что σ2R является компонентом мембранного рецептора прогестерона 1 (PGRMC1) [17]. Однако в более поздних исследованиях было показано, что соответственно нокдаун PGRMC1 по siRNA [18] и нокаут PGRMC1 по CRISPR [19] генов мышиного и человеческого PGRMC1 не оказывают влияния на связывание σ2R. Лишь в 2017 г. A. Alon et al. с помощью метода аффинной хроматографии окончательно идентифицировали σ2R как TMEM97 [20]. Показано, что σ2R экспрессируются в нейронах ЦНС (мозжечок, моторная кора, черная субстанция, гиппокамп) [21], в клетках печени, почек и легких [22], а также в злокачественных клетках [17]. Убедительные данные, свидетельствующие о том, что σ2R экспрессируются в кардиомиоцитах, отсутствуют. В литературе представлена только одна работа, опубликованная в 2007 г., из результатов которой следует, что агонисты σ2R (трео-ифенпродил, LNP250A и 1,3-ди(2-толил)гуанидин) блокируют активность встроенных в клеточную мембрану кардиомиоцитов K+ каналов – hERG (Кv11.1), через которые протекает быстрый выходящий K+ ток замедленного выпрямления (IKr) [23]. Однако авторы данного исследования сообщают, что остается не выясненным вопрос, блокируют ли К+ каналы собственно активированные σ2R или блокада каналов осуществляется непосредственно использованными агонистами. В настоящее время σ2R рассматривают как перспективную биомишень для создания психотропных лекарственных средств [24], а также средств для диагностики и лечения злокачественных новообразований [25].
Первая часть настоящего обзора посвящена описанию структуры, внутриклеточной локализации и функциональной активности σ1R в кардиомиоцитах.
Структура σ1R
Показано, что σ1R представляет собой интегральный мембранный белок, преимущественно экспрессируемый в саркоплазматическом ретикулуме (СПР). Ген σ1R у человека локализован в коротком плече 9-й хромосомы, в положении 9p13.3 и кодирует 7 изоформ данного белка [26, 27]. Каноническая изоформа 1 σ1R имеет небольшие размеры (223 аминокислотных остатка с общей молекулярной массой 25250 Да). Аминокислотные последовательности данных сигнальных белков у человека, морских свинок, мышей и крыс совпадают на 90% [6, 15], т.е. σR является высококонсервативным белком млекопитающих [5, 28].
Единого мнения о пространственном строении σ1R не существует. До 2016 г. общепризнанной считалась модель σ1R с двумя трансмембранными доменами, располагающимися на N-терминале (аминокислотные остатки 81-101) и в центре белка (аминокислотные остатки 1-30) [11]. Особенностью трансмембранного домена является мотив GXXXG (Gly-87-Gly-88-Trp-89-Met-90-Gly-91), участвующий в олигомеризации белка из мономерного состояния, что приводит к изменению функциональной активности σ1R. Постулируется, что трансмембранный домен содержит лиганд-связывающий фармакофор [29]. Эта трансмембранная область σ1R по своему строению более чем на 80% идентична стероид-связывающему “карману” изомеразы стерола, что подтверждает предположение о том, что σ1R является стероид-связывающим белком, использующим встроенный в мембрану домен для ассоциации с липидными лигандами [5].
C-домен, состоящий из β-спирали и фланговых α-спиралей, обладает шаперонной активностью, препятствующей агрегации белка. Полагают, что этот домен σ1R, находящийся в просвете СПР, локализуется таким образом, что стабилизирует СПР-люменальные и/или СПР-мембранные белки [12]. Шаперонная активность этого домена σ1R регулируется прямым белково-белковым взаимодействием с другим шапероном (белок, связывающий иммуноглобулин или глюкозо-регулируемый белок теплового шока 78 kDa[BiP/GRP-78]), также расположенным в СПР [12].
В 2016 г. с помощью рентгеноструктурного анализа было показано, что σ1R является олигомером и представляет собой тримерную структуру с тройной некристаллографической осью симметрии, перепендикулярной к плоскости мембраны СПР (рис. 1) [14]. В отличие от большинства мембранных рецепторов, каждый из 3-х его протомеров содержит не два, а один трансмембранный домен. Трансмембранные домены σ1R отделены друг от друга и располагаются в каждом углу треугольного тримера (рис. 1, А). Мембранно-проксимальная сторона цитозольных доменов представляет собой чрезвычайно плоскую гидрофобную поверхность, которая прилежит/встроена в тело мембраны (рис. 1, Б). Цитозольный домен каждого из трех протомеров образует окруженную четырьмя α-спиралями β-бочкообразную складку, в центре которой находится активный, лиганд-связывающий центр σ1R. Лиганд-связывающий домен σ1R высоко консервативен и сохраняет свою аминокислотную последовательность как у млекопитающих, так и у человека [14]. Авторы этого и других подобных исследований полагают, что необычное пространственное расположение σ1R является уникальным среди других известных белковых структур.
Внутриклеточная локализация и транслокация σ1R
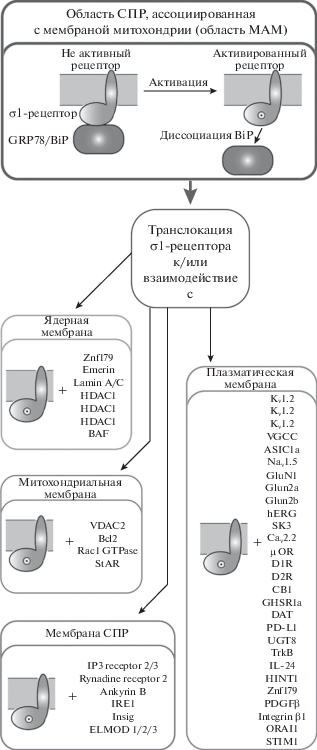
Согласно современным представлениям, σ1R локализуется в цитозоле клетки в сильно кластеризованных глобулярных структурах, содержащих умеренное количество свободного холестерина и нейтральных липидов, образующих детергентно-нерастворимые липидные микродомены (липидные плоты), называемые “липидной везикулой” (lipid droplet) [30]. В состав липидной везикулы, помимо собственно σ1R, входит IP3-рецептор 3-го типа (IP3R-3) и адаптерный якорный белок цитоскелета анкирин-B 220. Также имеются данные о том, что в липидной везикуле σ1R кo-локализован с белком кавеолином-2, связывающим холестерин и сфинголипиды [31].
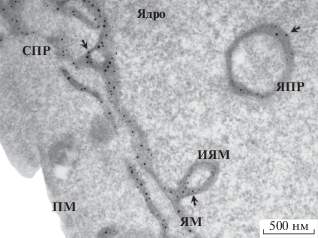
Липидные везикулы преимущественно локализуются на плазматической мембране СПР и располагаются в области его митохондрии-связывающего участка (МАМ), рядом с Са2+ каналом. Помимо СПР, отдельные пулы σ1R могут располагаться на наружной ядерной мембране (NE), мембране аппарата Гольджи и плазматических мембранах ряда внутриклеточных органелл [5]. В 2017 г. были опубликованы результаты исследования, свидетельствующие о том, что σ1R локализуются не только на наружной ядерной мембране, но и во внутриядерном пространстве. Авторы показали, что σ1R располагаются в нуклеоплазматическом ретикулуме – специализированном ядерном отсеке, образованном путем инвагинации NE в нуклеоплазму (рис. 2) [32].
Рис. 2.
Локализация σ1R в поперечном сечении мембраны NR (по [32]). Электронограмма, усиленная APEX2, с частицами золота. Шкала бар: 0.5 мкм. Обозначения: СПР – саркоплазматический ретикулум, ЯПР – ядерный плазматический ретикулум, ЯМ – ядерная мембрана, ИЯМ – инвагинация ядерной мембраны, ПМ – плазматическая мембрана. Черные точки – σ1R (указаны стрелкой).
В области МАМ σ1R в составе липидной везикулы имеют стационарную локализацию, по всей видимости, из-за их тесной связи с богатыми холестерином/церамидами липидными микродоменами [33]. Помимо стационарных пулов σ1R на плазматической мембране СПР и внутриклеточных органелл, представлены высокомобильные пулы σ1R, которые после активации рецептора могут транслоцироваться к другим органеллам и/или внутренней поверхности клеточной мембраны со скоростью, которая достигает около 8–10 мкм/мин [34]. Полагают, что высокомобильные пулы σ1R выполняют в цитозоле клетки функцию “скорой помощи” [35]. Концентрация высокомобильных пулов σ1R в клетке существенно выше, чем стационарных – соответственно 70 и 30% [35].
Стационарную локализацию липидной везикулы в области МАМ, по всей видимости, определяет наличие в структуре СПР двойного аргининового удерживающего мотива. При взаимодействии с лигандами σ1R перераспределяются от детергентно-нерастворимых липидных микродоменов к растворимым мембранным доменам [36]. В результате этого процесса σ1R приобретают подвижность и могут как самостоятельно, так и в составе липидной везикулы транслоцироваться от СПР к цитоплазматической мембране. Следует отметить, что транспорт белков из СПР в цитоплазматическую мембрану представляет собой достаточно быстрый процесс, и как правило, занимает от нескольких до 30 мин [37].
В литературе приводятся данные о том, что активированные σ1R были обнаружены и во внеклеточном пространстве, что дало основание авторам данного исследования высказать гипотезу о том, что σ1R могут действовать как шапероны и за пределами клетки [36].
Можно полагать, что именно со способностью σ1R свободно перемещаться в цитозоле клетки и встраиваться в структуру цитоплазматических мембран связана их способность модулировать/регулировать функциональную активность ионных каналов, внутриклеточных органелл, а также контролировать разнообразные внутриклеточные сигнальные каскады [35]. Также есть мнение о том, что σ1R выступают в роли сигнального модулятора, координирующего взаимосвязь отдельных внутриклеточных органелл, действуя не только локально – на мембране СПР, где они контролирует СПР–митохондриальную и СПР–ядерную сигнализацию, но и “отдаленно” – в области плазмолеммы, где они регулируют функциональные белки клеточной мембраны [29].
Роль σ1R в регуляции функциональной активности кардиомиоцитов
Исторически σ1R рассматривались как внутриклеточные регуляторные белки, играющие важную роль в регуляции функциональной активности нейронов [38, 39]. Однако после публикации результатов исследований М.S. Bhuiyan et al., свидетельствующих о том, что уровень экспрессии м-РНК σ1R в миокарде желудочков на порядок превышает таковой в нейронах ЦНС (рис. 3) [15], возник интерес к изучению роли σ1R в физиологии и патологии сердечной мышцы. Также в этой работе было показано, что σ1R в достаточно большом количестве экспрессируются и в гладкомышечных клетках аорты.
Рис. 3.
Уровень экспрессии σ1R в различных органах крысы (по [15]). а – крысы-самцы, б – крысы-самки. 1 – кора головного мозга, 2 – полосатое тело, 3 – гиппокамп, 4 – грудная аорта, 5 – левый желудочек сердца, 6 – правый желудочек сердца, 7 – левая почка, 8 – правая почка. Данные выражены в виде кратного экспрессии в коре головного мозга.

К настоящему времени накоплен достаточно большой литературный материал, позволяющий говорить о том, что σ1R являются важным внутриклеточным белком, поддерживающим/регулирующим функциональную активность сердечной мышцы, а их аномальная экспрессия играет существенную роль в генезе ее патологии.
Как было отмечено выше, активированные σ1R в составе липидной везикулы мигрируют к внутренней поверхности клеточной мембраны, где, в частности, встраиваясь в структуру потенциалзависимых трансмембранных Na+, К+ и Са2+ каналов, модулируют (оптимизируют/блокируют) их функциональную активность. Такая мобильность σ1R обусловлена способностью входящего в состав липидной везикулы анкирина В-220 транслоцироваться по микротрубочкам из СПР в область клеточной мембраны [31].
Показано, что модуляция ионных каналов σ1R не зависит от взаимодействия с G-белками или фосфорилирования каналов [40], а является следствием прямого белково-белкового взаимодействия между σ1R и каналом [41].
В экспериментах in vitro, выполненных на клеточной культуре неонатальных кардиомиоцитов мыши, показано, что селективные агонисты σ1R [(+)-SKF-10047 и (+)-пентазоцин] на ≈50% подавляют быстрый входящий Na+ ток (INa), протекающий через быстрые трансмембранные потенциалзависимые Na+ (Nav1.5) каналы (рис. 4). Не менее важно и то, что авторы этого исследования убедительно показали, что блокада INa агонистами σ1R обусловлена активацией этих рецепторов, поскольку в клетках с небольшой или нулевой экспрессией σ1R (клетки COS-7, клетки HEK-293, кардиомиоциты мышей, нокаутных по σ1R) (+)-SKF-10047 и (+)-пентазоцин не оказывают существенного влияния на INa [42].
Рис. 4.
Влияние агонистов σ1R на трансмембранный натриевый ток. А – подавление селективным агонистом σ1R (+)‑пентазоцином быстрого входящего Na+ тока (INa), протекающего через быстрые трансмебранные потенциалзависимые Na+ (Nav1.5) каналы, встроенные в клеточную мембрану кардиомиоцитов мыши [42]. Б – подавление селективным агонистом σ1R (+)-пентазоцином быстрого входящего Na+ тока (INa), протекающего через быстрые трансмебранные по-тенциалзависимые Na+ (Nav1.5) каналы, встроенные в клеточную мембрану интракардиальных нейронов [43].

В экспериментах in vitro, выполненных на клеточной культуре нейронов внутрисердечных ганглиев новорожденных крыс, показано, что селективный агонист σ1R (+)-пентазоцин вызывает дозозависимое подавление быстрого входящего INa, протекающего через Na+ каналы, встроенные в клеточную мембрану интракардиальных нейронов [43] (рис. 3). Анализируя полученные данные, авторы приходят к заключению, что активация σ1R приводит к подавлению функциональной активности и увеличению латентного периода потенциалзависимых Na+ каналов интракардиальных нейронов и способствует изменению конфигурации потенциала действия. Помимо этого, происходит смещение величины напряжения инактивации Na+ каналов в сторону отрицательных потенциалов, что, в свою очередь, приводит к уменьшению количества Na+ каналов, доступных для активации при нормальной величине диастолического потенциала (потенциал покоя).
Впервые о способности агонистов σ1R блокировать трансмебранные потенциалзависимые К+ каналы сообщили в 1999 г. O. Soriani et al. [44]. В экспериментах in vitro, выполненных на клеточной культуре меланотропных клеток гипофиза лягушки, было показано, что агонисты σ1R игмезин (JO 1784) и (+)-пентазоцин вызывают дозозависимую блокаду быстрого инактивируемого потенциалзависимого К+А-тока (IA; син. транзиторный выходящий К+ ток – Itо), протекающего через трансмембранные потенциалзависимые К+ каналы. Эти данные представляют интерес в контексте настоящего обзора, поскольку трансмембранные потенциалзависимые К+ каналы, через которые протекает IA, идентифицированы в кардиомиоцитах, где они обеспечивают формирование ранней фазы реполяризации и могут модулировать длительность потенциала действия [45].
В экспериментах in vitro показано, что агонисты σ1R (+)-SKF-10047, (+)-пентазоцин и дитолилгуанидин (DTG) ингибируют потенциалзависимые К+ каналы в терминалях нейронов гипофиза, подавляя (≈на 50%) как быстрый, так и медленный компоненты выходящего К+ тока задержанного выпрямления (IK) [46]. Также в экспериментах in vitro продемонстрировано, что σ1R модулируют/блокируют К+ ток через клеточную мембрану ооцитов шпорцевых лягушек посредством образования комплексов с К+ каналами Кv1.4 (К+ каналы Кv1.4, помимо клеточной мембраны ооцитов, идентифицированы и на клеточной мембране кардиомиоцитов) и Кv1.5 каналами как в присутствии, так и в отсутствии лигандов [41]. Авторы данного исследования делают заключение о том, что σ1R служат вспомогательными субъединицами потенциалзависимых K+ каналов и принимают участие в регуляции их функциональной активности в зависимости от наличия или отсутствия лиганда.
Помимо Кv1.4 и Кv1.5 каналов, активированные σ1R модулируют активность hERG K+ каналов (Кv11.1), через которые протекает быстрый выходящий K+ ток замедленного выпрямления (IKr), который, как известно, формирует 3-ю фазу реполяризации кардиомиоцитов. В экспериментах in vitro, выполненных на клеточной культуре К562, показано, что агонист σ1R (+)-пентазоцин обратимо, на 40.85 ± 2.83% подавляет IKr [47].
В экспериментах in vitro, выполненных на клеточной культуре нейронов внутрисердечных ганглиев новорожденных крыс, показано, что агонисты σ1R (+)-пентазоцин, ибогаин и DTG вызывают дозазависимую блокаду позднего выходящего К+ тока задержанного выпрямления (IK(DR)), протекающего через трансмембранные потенциалзависимые К+ каналы внутреннего выпрямления (Kir) [48] (рис. 5). Также в этом исследовании было показано, что агонисты σ1R блокируют IK(DR) непосредственно посредством активации σ1R, поскольку антагонист DTG – метафит (metaphit) полностью нивелировал каналотропное действие DTG. Авторы этого исследования приходят к заключению, что активированные σ1R подавляют активность множественных подтипов стробированных (открытых, но не активированных) K+ каналов и тем самым снижают возбудимость внутрисердечных парасимпатических нейронов и, как следствие этого, модулируют влияние парасимпатической системы на деятельность сердца.
Рис. 5.
Влияние агонистов σ1R на трансмембранные К+ токи. А – подавление агонистом (+)-SKF-10047 входящего К+ тока задержанного выпрямления (IK1), протекающего через трансмембранные потенциалзависимые быстро инактивируемые К+ каналы (Кv1.4), встроенные в клеточную мембрану ооцитов (по [41]). Б – подавление агонистами σ1R (+)-пентазоцином, ибогаином и DTG позднего выходящего К+ тока задержанного выпрямления (IK(DR)), протекающего через трансмембранные потенциалзависимые К+ каналы внутреннего выпрямления (Kir), встроенные в клеточную мембрану нейронов внутрисердечных ганглиев (по [48]).

В экспериментах in vitro, выполненных на культуре клеток линии RGC-5, показано, что агонист σ1R (+)-SKF-10047 в значительной мере подавляет трансмембранный медленный входящий Са2+ ток, протекающий через медленные потенциалзависимые Са2+ каналы L-типа [49] (рис. 6). Этот эффект (+)-SKF-10047 по интенсивности сопоставим с таковым, полученным для эталонного блокатора медленных Са2+ каналов нифедипина и полностью блокируется на фоне предварительного внесения в клеточную культуру BD1047 – антагониста σ1R.
Рис. 6.
Влияние агониста σ1R и эталонного антагониста ионов Са2+ нифедипина на трансмембранный Са2+ ток (по [49]). А – подавление агонистом (+)-SKF-10047 KCl-индуцированного тока ионов Са2+, протекающего через медленные потенциалзависимые трансмебранные Са2+ каналы L-типа, встроенные в клеточную мембрану клеток линии RGC-5. Б – подавление антагонистом ионов Са2+ нифедипином KCl-индуцированного тока ионов Са2+, протекающего через медленные потенциалзависимые трансмебранные Са2+ каналы L-типа, встроенные в клеточную мембрану клеток линии RGC-5. Кривые: а – KCl (20 мМ), б – KCl (20 мМ) + (+)-SKF-10047 (1 мкМ), в – KCl (20 мМ) + нифедипин (10 мкМ).

В экспериментах in vitro, выполненных на клеточной культуре симпатических нейронов шейных ганглиев и интракардиальных парасимпатических нейронах новорожденных крыс, впервые было продемонстрированно, что они активно экспрессируют σ1R [50]. Далее было показано, что агонисты σ1R (+)-пентазоцин, ибогаин и DTG эффективно подавляют пиковый Са2+ ток, протекающий через все типы Са2+ каналов (L, P, Q и R), встроенных в клеточную мембрану как нейронов шейных ганглиев, так и внутрисердечных нейронов, а также увеличивают скорость их инактивации.
На основании полученных данных авторы делают заключение о том, что активированные σ1R, локализованные в симпатических нейронах шейных ганглиев и парасимпатических интракардиальных нейронах, модулируют межклеточную сигнализацию в вегетативных ганглиях и, следовательно, контролируют регуляцию сердечной деятельности периферической нервной системой.
Таким образом, на основании литературных данных можно говорить о том, что в кардиомиоцитах σ1R играют значимую роль в регуляции/оптимизации функциональной активности трансмембранных потенциалзависимых быстрых Na+, К+ и медленных Са2+ каналов L-типа, а агонисты σ1R, вызывающие блокаду этих каналов, обладают свойствами антиаритмических лекарственных средств I, III и IV классов по классификации Vaughan Williams.
Также можно полагать, что способность активированных σ1R блокировать трансмембранные потенциалзависимые Са2+ каналы L-типа указывает на возможность того, что их агонисты могут защищать миокард от ишемического повреждения. Не менее важно и то, что σ1R, блокируя аномальную активность трансмембранных потенциалзависимых быстрых Na+, К+ и Са2+ каналов L, P, Q и R типов, встроенных в клеточную мембрану как шейных, так интракардиальных нейронов, препятствуют реализации избыточной тонической активности симпатического и парасимпатического отделов вегетативной нервной системы и тем самым уменьшают риск развития нарушений сердечного ритма и ишемических инцидентов, регулируют/оптимизируют пластичность миокарда и т.д.
Транслоцировавшиеся к клеточной мембране в составе липидной везикулы σ1R не только встраиваются в структуру ионных каналов, но и оптимизируют фосфолипидный состав клеточной мембраны за счет импорта в мембрану холестерина, входящего в состав липидной везикулы, и тем самым оказывают мембраностабилизирующее действие [51]. Известно, что уменьшение содержания в плазматической мембране холестерина (холестериновое истощение) приводит к снижению уровня ее плотности и развитию аноикиса (вариант апоптоза в ответ на нарушение адгезии клеток), снижению активности антиапоптотического белка Bcl-xL, инактивации протеинкиназы В (Akt) и активации каспазы-3 [52].
Уже было отмечено, что на наружной мембране СПР кардиомиоцитов локализуется стационарная форма липидных везикул, включающая в себя, помимо собственно σ1R, якорный белок анкирин-В 220 и инозитол-1,4,5-трифосфат связанный рецептор (IP3R). В отсутствии лиганда анкирин-В 220 выступает в качестве блокатора IP3R за счет высокой аффинности (константа диссоциации Kd 0.2 нМ) к С-концевой терминали IP3R [53]. При взаимодействии σ1R с агонистом анкирин-В 220 дислоцируется от С-терминали IP3R и последний стробируется (другими словами, в данном контексте, рецепторный канал IP3R переходит в открытое, но не активированное состояние). Далее стробированный IP3R взаимодействует со своим агонистом 1,4,5-инозитол-трифосфатом (IP3), в результате чего IP3R активируется и инициирует выход ионов Са2+ из депо СПР в цитоплазму [53].
IP3R представляет собой трансмембранный встроенный в плазматическую мембрану СПР канал-образующий белок, относящийся к суперсемейству ионных каналов с шестью трансмембранными доменами [54]. IP3R состоит из 3-х функциональных субъединиц: N-концевой лиганд-связывающей цитоплазматической субъединицы, модуляторной/связывающей субъединицы и C-концевой трансмембранной/каналообразующей субъединицы, расположенной рядом с Са2+-содержащими депо СПР [54]. IP3R является одним из самых больших из известных ионных каналов, каждая из 3-х его субъединиц содержит ≈2700 аминокислотных остатков. По своим размерам IP3R уступает только также встроенным в мембрану СПР трансмембранным рианодиновым Са2+-регулирующим рецепторам (RyR), каждая из 4-х субъединиц которых содержит ≈5000 аминокислотных остатков [55]. Для активации IP3R необходимо 4 молекулы IP3.
В настоящее время идентифицировано 3 изоформы IP3R – 1-го, 2-го и 3-го типа. Липидные везикулы, расположенные на мембране СПР нейронов, содержат в своем составе преимущественно изоформу IP3R 3-го типа (IP3R3) [11, 31, 56], экспрессия которой превалирует в нейронах ЦНС [57]. В сократительных кардиомиоцитах желудочков, в отличие от нейронов, в основном экспрессируется не 3-я, а 2-я изоформа IP3R (IP3R2). Согласно имеющимся литературным данным, липидная везикула, располагающаяся на плазматической мембране СПР кардиомиоцитов, содержит в своем составе IP3R рецепторы 2-го типа, которые переходят в открытое состояние при взаимодействии агониста с σ1R [58]. В этой работе показано, что вслед за опосредованной σ1R активацией IP3R2 активируются и расположенные на мембране СПР рианодиновые рецепторы 2-го типа (RyR2), которые так же, как и IP3R являются 6-ти доменными трансмембранными Са2+-проводящими каналами. RyR2 экспрессируются только в клетках сердечной мышцы [59], и в настоящее время их позиционируют в качестве ключевых игроков, регулирующих сократительную и ритмическую функцию кардиомиоцитов [60]. Несмотря на то, что RyR2 по своим размерам в 2 раза превосходят IP3R2, а их плотность на клеточной мембране СПР по сравнению с IP3R2 значительно больше – RyR2 : IP3R2 ≈ 100 : 1 [61], эти два рецептора демонстрируют большое сходство в своей функции, регуляции и строении. Например, аминокислотная последовательность их трансмембранных субъединиц совпадает на 37% [62].
Механизм активации, посредством которого σ1R активируют RyR2, не известен, однако можно полагать, что этот эффект опосредуется через IP3R2, поскольку известно, что активация последних при связывании с IP3 может вызывать сенсибилизацию соседних с ними RyR2, что приводит к кратковременному “мощному” выбросу ионов Са2+ из депо СПР – так называемому выбросу “искры Са2+” [63]. Синхронный выброс “искры Са2+” в цитозоль кардиомиоцитов из депо СПР через IP3R2 и RyR2 каналы обусловлен тем, что они физически и функционально связаны между собой таким образом, что активность отдельного канала координируется с соседним. Этот феномен носит название “сопряженное стробирование” [64].
Выброс ионов Са2+ из депо СПР является ключевым событием, связывающим деполяризацию мембраны кардиомиоцитов и их механическую (инотропную) активность в процессе электро-механического сопряжения клеток сердца.
Поскольку концентрация ионов Са2+, депонированных в СПР, на несколько порядков превышает их концентрацию в цитоплазме, ионы Са2+ диффундируют во внутриклеточное пространство, в результате чего концентрация ионов Са2+ в цитоплазме увеличивается с 10–7 до 10–6–10–5 М, что обеспечивает их взаимодействие с регуляторным глобулярным белком тропонином С (TnC). Образовавшийся комплекс Са2+/TnC сдвигает фибриллярный белок тропомиозин с активного центра волокон актина, что позволяет последнему присоединиться к миозину и инициировать сокращение кардиомиоцитов. Сразу же после завершения сокращения в мембране СПР в результате сАМР-опосредованной активации протеинкиназы А (РКА) фосфорилируется ключевой регулятор расслабления кардиомиоцитов белок фосфоламбан (PLB или PLN), который активирует Са2+-зависимую АТРазу (sarco/endoplasmicreticulum Ca2+-ATPase, SERCA2) – кальциевый насос СПР. SERCA2 стимулирует активный транспорт ионов Са2+ из цитоплазмы в депо СПР, где они связываются белком кальсеквестрином. По окончании работы кальциевого насоса СПР концентрация ионов Са2+ в цитозоле кардиомиоцитов снижается до 10–8 М, а в депо СПР – возрастает до 10–3 М. Помимо этого, РКА, фосфорилируя нити актина, снижает их чувствительность к ионам Са2+ и тем самым способствует расслаблению кардиомиоцитов.
Таким образом, σ1R, локализованные на плазматической мембране СПР, с одной стороны, принимают участие в обеспечении гомеостаза ионов Са2+ в цитозоле кардиомиоцитов, а с другой – играют важную роль в регуляции их электромеханического сопряжения и тем самым контролируют инотропную функцию сердечной мышцы.
Не исключено, что σ1R-опосредованная регуляция гомеостаза ионов Са2+ в цитозоле кардиомиоцитов может быть, в той или иной мере, связана с их шаперонной активностью. Выше уже говорилось о том, что шаперонная активность σ1R обусловлена их прямым белково-белковым взаимодействием с другим СПР-резидентным шапероном BiP [11]. Известно, что шаперон BiP играет непосредственную роль в контроле выброса “искры Са2+” из депо СПР путем закрытия трансмембранной “воронки” белкового комплекса Sec61 (син. SecYEG), встроенного в мембрану СПР, или регуляции активности SERCA2 [65].
Впервые о способности σ1R регулировать инотропную функцию сердца сообщили в 1994 г. C. Ela et al., которые в опытах на изолированных кардиомиоцитах крысы показали, что агонист σ1R (+)-пентазоцин и их антагонист галоперидол индуцировали специфические изменения сократительной способности электростимулированных кардиомиоцитов [66]. Позднее это было подтверждено в целом ряде исследований [58, 67–70].
Не менее важную роль σ1R играют и в регуляции энергообразующей и Са2+-регулирующей функций митохондрий. Известно, что функциональная взаимосвязь между СПР и митохондриями является ключевым фактором, контролирующим Са2+-опосредованные внутриклеточные сигнальные каскады и продукцию АТФ [71]. Это взаимодействие осуществляется за счет наличия на наружной мембране СПР расположенного в области Са2+ канала, образованного IP3R, высокоаффинного белкового комплекса, ассоциированного с мембраной митохондрий (mitochondria-associated endoplasmic reticulum membranes – MAM), который опосредует транспорт ионов Ca2+ из СПР в митохондрии [72]. Комплекс МАМ преимущественно формируется из шаперонов BiP, которые в большом количестве экспрессируются в митохондриях, и обеспечивает взаимодействие между IP3R и расположенным на наружной мембране митохондрий потенциалзависимым анионным каналом (voltage-dependet anion channel – VDAC). Шаперон BiP образует туннель, соединяющий IP3R с VDAC, по которому ионы Са2+ перемещаются из депо СПР к наружной мембране митохондрий [63]. σ1R, связанные с шапероном BiP, стабилизируют открытые IP3R и тем самым пролонгируют время перехода ионов Са2+ из СПР к митохондриям (рис. 7). По мере истощения запасов ионов Са2+, депонированных в СПР, σ1R диссоциируют от шаперонов BiP, что влечет за собой инактивацию IP3R [72]. Как полагают авторы этой публикации, σ1R является ключевым белком, обеспечивающим надлежащее поступление ионов Са2+ из СПР в митохондрии.
Рис. 7.
Схематическое отображение точек приложения действия σ1R в кардиомиоцитах. Объяснения в тексте.

Импортированные из СПР в митохондрии ионы Са2+ посредством прямого взаимодействия с такими ферментами как Са2+-зависимые пируватдегидрогеназа и фосфатаза, α-кетоглутаратдегидрогеназа и изоцитратдегидрогеназа увеличивают доступность НАДН+ и, следовательно, поток электронов вниз по дыхательной цепи, что влечет за собой увеличение/оптимизацию продукции АТФ [71]. Кроме того, физиологический “захват” ионов Ca2+ митохондриями ограничивает избыточный подъем его концентрации в цитоплазме, что, в свою очередь, подавляет процессы, инициирующие аутофагию, апоптоз и некроз клетки, а также обеспечивает быстрое затухание Са2+-опосредованных внутриклеточных сигналов [73, 74].
Помимо СПР, σ1R в составе липидной везикулы локализуются и на наружной поверхности ядерной мембраны. Функциональная роль σ1R, расположенных на ядерной мембране (NE) кардиомиоцитов, в настоящее время не ясна. Однако в литературе имеются сообщения о том, что активированные IP3R, встроенные в NE, регулируют активность различных наборов транскрипционных факторов, в частности семейств транскрипционных факторов – факторa усиления миоцитов – 2 (Mef2) и ядерного фактора активированных Т-клеток – NFAT [60]. Семейство транскрипционных факторов Mef2 состоит из 4-х транскрипционных белков: Mef2a, Mef2b, Mef2c и Mef2d, которые являются ключевыми регуляторами экспрессии сердечных генов [75]. Семейство транскрипционных факторов NFAT также состоит из 5-ти транскрипционных белков: NFATc1, NFATc2, NFATc3, NFATc4 и NFAT5, которые принимают активное участие в поддержании гомеостаза ионов Са2+ в кардиомиоцитах, а также регулируют транскрипцию генов, ответственных за экспрессию ростовых факторов [61]. Помимо этого, высказывается предположение о том, что IP3R, встроенные в NE, модулируют трансмембранный ток ионов Са2+ и тем самым защищают ядро от перегрузки ими во время систолы [60]. Кроме того, имеются данные о том, что σ1R контролируют в ядре экспрессию гена антиапоптотического белка Bcl-2 путем активации ядерного транскрипционного фактора kB (NFkB) [76]. Показано, что в условиях стресса СПР увеличение экспрессии σ1R препятствует прогрессированию апоптоза [72].
Говоря о роли σ1R в регуляции/оптимизации функциональной активности клеток, в частности кардиомиоцитов, необходимо отметить, что несмотря на достаточно большой литературный материал, посвященный этой проблеме, многие детали этого процесса остаются далеко не ясными в силу полифункционального влияния σ1R на клеточную функцию самых разнообразных белков и ионных каналов и, как следствие этого, шаперон-опосредованную модуляцию различных внутриклеточных, зачастую не сопряженных между собой, сигнальных путей.
Действительно, к настоящему времени идентифицировано более 50 внутриклеточных белков, с которыми непосредственно взаимодействуют σ1R (рис. 8) , в том числе 20 ионных каналов: (Na+ канал [Nav1.5], Cа2+каналы L- и N-типов [Саv1.2 и Саv2.2], Cа2+релиз-активированные каналы [CRAC/ ORAI1], 6 К+ каналов [Kv1.2; Kv1.3; Kv1.4; Kv1.5; Kv2.1 и hERG или Kv11.1], Са2+ активируемый К+ канал [SK3 или KCNN3], кислоточувствительный ионный канал 1a [ASIC1a], зависимый от напряжения анионный канал 2 [VDAC2], 2 изоформы инозитол-трифосфатных рецепторов [IP3R2 и IP3R3], рианодиновые рецепторы 2 типа [RyR2], 3 подтипа N-метил-d-аспартатных рецепторов [NMDAR Glun1, NMDAR Glun2a и NMDAR Glun2b]); 5 G белок-связанных рецепторов (μ опиоидный рецептор [μOPR], D1 дофаминовый рецептор [D1R], D2 дофаминовый рецептор [D2R], каннабиноидный рецептор 1-го типа [CB1] и рецептор грелина 1a [GHSR1a]); 26 различных белков (анкирин В [ANK2], иммуноглобулин-связывающий белок [BiP], транспортер дофамина [DAT], запрограммированный лиганд смерти 1 [PD-L1 или CD274], цереброзид-синтаза [UGT8], сенсор стресса саркоплазматического ретикулума – IRE1, тирозинкиназный рецептор B [BDNF/NT-3], интерлейкин-24 [IL-24], регулятор апоптоза Bcl2, малая GTPase Rac1, гистидин нуклеотид-связывающий белок 1 [HINT1], пинковый белок цинка 179 [Znf179], индуцированный инсулином ген 1 [INSIG1], 3 белка, содержащих домен ELMO [ELMOD1, ELMOD2 и ELMOD3], белок острой стероидной регуляции [StAR], рецептор тромбоцитарного фактора роста β [PDGFR-β], интегрин β1 [ITGB1], эмерин [EMD], ламин A/C [LMNA], 3 деацетилазы гистонов 1-го класса [HDAC1, HDAC2 и HDAC3], барьер для фактора автоинтеграции 1 [BANF1] и сенсор ионов Са2+ саркоплазматического ретикулума [STIM1]) [77, 78].
ЗАКЛЮЧЕНИЕ
Таким образом, имеющиеся к настоящему времени данные свидетельствуют о значимой роли σ1R в регуляции функциональной активности кардиомиоцитов: они модулируют/оптимизируют активность трансмембранных потенциалзависимых Na+, K+ и Ca2+ каналов, встроенных в клеточную мембрану как кардиомиоцитов, так и нейронов вегетативной нервной системы – интракардиальных ганглиев; стабилизируют наружную мембрану кардиомиоцитов и поддерживают в них гомеостаз ионов Са2+; регулируют процессы электромеханического сопряжения кардиомиоцитов и тем самым поддерживают инотропный статус сердечной мышцы; оптимизируют энергообеспечение кардиомиоцитов; обладают свойствами шаперонов; противодействуют стрессу СПР и являются ограничивающим фактором апоптоза; контролируют экспрессию ряда транскрипционных факторов и регулируют активность внутриклеточных сигнальных каскадов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Благодарности. Авторы выражают глубокую признательность за помощь в оформлении работы н.с. В.В. Барчукову (ФГБНУ “НИИ фармакологии имени В.В. Закусова”, Москва).
Список литературы
Martin W.R., Eades C.G., Thompson J.A. et al. The effects of morphine- and nalorphine-like drugs in the nondependent and morphine-dependent chronic spinal dog // J. Pharmacol. Exp. Ther. 1976. V. 197. № 3. P. 517.
Su T.P. Evidence for sigma opioid receptor: binding of [3H]SKF-10047 to etorphine-inaccessible sites in guinea-pig brain // J. Pharmacol. Exp. Ther. 1982. V. 223. № 2. P. 284.
Quirion R., Bowen W.D., Itzhak Y. et al. A proposal for the classification of sigma binding sites // Trends Pharmacol. Sci. 1992. V. 13. № 3. P. 85.
Hellewel S.B., Bowen W.D. A sigma-like binding site in rat pheochromocytoma (PC12) cells: decreased affinity for (+)-benzomorphans and lower molecular weight suggest a different sigma receptor form from that of guinea pig brain // Brain. Res. 1990. V. 527. № 2. P. 244.
Hanner M., Moebius F.F., Flandorfer A. et al. Purification, molecular cloning, and expression of the mammalian sigma1-binding site // Proc. Natl. Acad. Sci. U.S.A. 1996. V. 93. № 15. P. 8072.
Kekuda R., Prasad P.D., Fei Y.J. et al. Cloning and functional expression of the human type 1 sigma receptor (hSigmaR1) // Biochem. Biophys. Res. Commun. 1996. V. 229. № 2. P. 553.
Seth P., Leibach F.H., Ganapathy V. Cloning and structural analysis of the cDNA and the gene encoding the murine type 1 sigma receptor // Biochem. Biophys. Res. Commun. 1997. V. 241. № 2. P. 535.
Pan Y.X., Mei J., Xu J. et al. Cloning and characterization of a mouse sigma1 receptor // J. Neurochem. 1998. V. 70. № 6. P. 2279.
Seth P., Fei Y.J., Li H.W. et al. Cloning and functional characterization of a sigma receptor from rat brain // J. Neurochem. 1998. V. 70. № 3. P. 922.
Mei J., Pasternak G.W. Molecular cloning and pharmacological characterization of the rat sigma1 receptor // Biochem. Pharmacol. 2001. V. 62. № 3. P. 349.
Hayashi T., Su T.P. Sigma-1 receptor chaperones at the ER-mitochondrion interface regulate Ca(2+) signaling and cell survival // Cell. 2007. V. 131. № 3. P. 596.
Laurini E., Marson D., Fermeglia M., Pricl S. 3D homology model of Sigma1 receptor // Handb. Exp. Pharmacol. 2017. V. 244. P. 27.
Gromek K.A., Suchy F.P., Meddaugh H.R. et al. The oligomeric states of the purified sigma-1 receptor are stabilized by ligands // J. Biol. Chem. 2014. V. 289. № 29. P. 20 333.
Schmidt H.R., Zheng S., Gurpinar E. et al. Crystal structure of the human sigma receptor // Nature. 2016. V. 532. № 7600. P. 527.
Bhuiyan M.S., Fukunaga K. Targeting sigma-1 receptor signaling by endogenous ligands for cardioprotection // Expert Opin. Ther. Targets. 2011. V. 15. № 2. P. 145.
Середенин С.Б., Воронин М.В. Нейрорецепторные механизмы действия афобазола // Экспериментальная и клиническая фармакология. 2009. Т. 72. № 1. С. 3.
Xu J., Zeng C., Chu W. et al. Identification of the PGRMC1 protein complex as the putative sigma-2 receptor binding site // Nat. Commun. 2011. V. 2. P. 380.
Abate C., Niso M., Infantino V. et al. Elements in support of the ‘non-identity’ of the PGRMC1 protein with the sigma2 receptor // Eur. J. Pharmacol. 2015. V. 758. P. 16.
Chu U.B., Mavlyutov T.A., Chu M.L. et al. The sigma-2 receptor and progesterone receptor membrane component 1 are different binding sites derived from independent genes // EBioMedicine. 2015. V. 2. № 11. P. 1806.
Alon A., Schmidt H.R., Wood M.D. et al. Identification of the gene that codes for the σ2 receptor // Proc. Natl. Acad. Sci. U.S.A. 2017. V. 114. № 27. P. 7160.
Bouchard P., Quirion R. [3H]1,3-di(2-tolyl)guanidine and [3H](+)pentazocine binding sites in the rat brain:autoradiographic visualization of the putative sigma1 and sigma2 receptor subtypes // Neuroscience. 1997. V. 76. № 2. P. 467.
Hellewell S.B., Bruce A., Feinstein G. et al. Rat liver and kidney contain high densities of sigma 1 and sigma 2 receptors: characterization by ligand binding and photoaffinity labeling // Eur. J. Pharmacol. 1994. V. 268. № 1. P. 9.
Monassier L., Manoury B., Bellocq C. et al. Sigma(2)Receptor ligand-mediated inhibition of inwardly rectifying K(+) channels in the heart // J. Pharmacol. Exp. Ther. 2007. V. 322. № 1. P. 341.
Schmidt H.R., Kruse A.C. The Molecular Function of σ Receptors: Past, Present, and Future // Trends Pharmacol. Sci. 2019. V. 40. № 9. P. 636.
Van Waarde A., Rybczynska A.A., Ramakrishnan N.K. et al. Potential applications for sigma receptor ligands in cancer diagnosis and therapy // Biochim. Biophys. Acta. 2015. V. 1848. № 10. Pt. B. P. 2703.
Seth P., Leibach F.H., Ganapathy V. Cloning and structural analysis of the cDNA and the gene encoding the murine type 1 sigma receptor // Biochem. Biophys. Res. Commun. 1997. V. 241. № 2. P. 535.
Prasad P.D. Exon-intron structure, analysis of promoter region, and chromosomal localization of the human type 1 sigma receptor gene // J. Neurochem. 1998. V. 70. № 2. P. 443.
Brune S. The sigma enigma: in vitro/in silico site-directed mutagenesis studies unveil σ1Receptor ligand binding // Biochemistry. 2014. V. 53. № 18. P. 2993.
Su T.P., Hayashi T., Maurice T. et al. The sigma-1 receptor chaperone as an inter-organelle signaling modulator // Trends Pharmacol. Sci. 2010. V. 31. № 12. P. 557.
Hayashi T., Su T.P. The potential role of sigma-1 receptors in lipid transport and lipid raft reconstitution in the brain: implication for drug abuse // Life Sci. 2005. V. 77. № 14. P. 1612.
Hayashi T., Su T.P. Regulating ankyrin dynamics: Roles of sigma-1 receptors // Proc. Natl. Acad. Sci. U.S.A. 2001. V. 98. № 2. P. 491.
Mavlyutov T.A., Yang H., Epstein M.L. et al. APEX2-enhancedelectron microscopy distinguishes sigma-1 receptor localization in the nucleoplasmic reticulum // Oncotarget. 2017. V. 8. № 31. P. 51 317.
Hayashi T., Fujimoto M. DetergentResistant microdomains determine the localization of sigma-1 receptors to the endoplasmic reticulum-mitochondria junction // Mol. Pharmacol. 2010. V. 77. № 4. P. 517.
Hayashi T., Su T.P. Subcellular Localization and Intracellular Dynamics of Sigma-1 Receptors / Sigma Receptors: Chemistry, Cell Biology and Clinical Implications // Eds.: Su T.-P., Matsumoto R.R., Bowen W.D. Springer: New York, NY, USA, 2007. P. 151.
Katz J.L., Hong W.C., Hiranita T., Su T.P. A role for sigma receptors in stimulant self-administration and addiction // Behav. Pharmacol. 2016. V. 27. № 2–3 (Spec Issue). P. 100.
Hayashi T., Su T.P. Sigma-1 receptors (sigma(1) binding sites) form raft-like microdomains and target lipid droplets on the endoplasmic reticulum: roles in endoplasmic reticulum lipid compartmentalization and export // J. Pharmacol. Exp. Ther. 2003. V. 306. № 2. P. 718.
Schroder M., Kaufman R.J. The mammalian unfolded protein response // Annu. Rev. Biochem. 2005. V. 74. P. 739.
Kourrich S., Su T.P., Fujimoto M., Bonci A. The sigma-1 receptor: roles in neuronal plasticity and disease // Trends Neurosci. 2012. V. 35. № 12. P. 762.
Tsai S.A., Su T.P. Sigma-1 Receptors Fine-Tune the Neuronal Networks // Adv. Exp. Med. Biol. 2017. V. 964. P. 79.
Palmer C.P., Aydar E., Jackson M.B. σ Receptor modulation of ion channels / Sigma Receptors: Chemistry, Cell Biology, and Clinical Implications // Eds. Matsumoto R., Bowen W.D., Su T.P. New York, NY: Kluwer Acad, 2007. P. 127.
Aydar E., Palmer C.P., Klyachko V.A., Jackson M.B. The sigma receptor as a ligandRegulated auxiliary potassium channel subunit // Neuron. 2002. V. 34. № 3. P. 399.
Johannessen M.A., Ramachandran S., Riemer L. Voltage-gated sodium channel modulationby sigma receptors in cardiac myocytes andheterologous systems // Am. J. Physiol. Cell Physiol. 2009. V. 296. № 5. P. 1049.
Zhang H., Katnik C., Cuevas J. Sigma receptor activation inhibits voltage-gated sodium channels in rat intracardiac ganglion neurons // Int. J. Physiol. Pathophysiol. Pharmacol. 2009. V. 2. № 1. P. 1.
Soriani O., Foll F. Le, Galas L. The sigma-ligand (+)-pentazocine depresses M current and enhances calcium conductances in frog melanotrophs // Am. J. Physiol. 1999. V. 277. № 1. Pt. 1. P. E73.
Nerbonne J.M. Molecular basis of functional myocardial potassium channel diversity // Card. Electrophysiol. Clin. 2016. V. 8. № 2. P. 257.
Wilke R.A., Lupardus P.J., Grandy D.K. et al. K+ channel modulation in rodent neurohypophysial nerve terminals by sigma receptors and not by dopamine receptors // J. Physiol. 1999. V. 517. Pt 2. P. 391.
Crottès D., Martial S., Rapetti-Mauss R. et al. Sig1R protein regulates hERG channel expression through a post-translational mechanism in leukemic cells // J. Biol. Chem. 2011. V. 286. № 32. P. 27947.
Zhang H., Cuevas J. Sigma Receptor activation blocks potassium channels and depresses neuroexcitability in rat intracardiac neurons // J. Pharmacol. Exp. Ther. 2005. V. 313. № 3. P. 1387.
Tchedre K.T., Huang R.Q., Dibas A. Sigma-1 receptor regulation of voltage-gated calcium channels involves a direct interaction // Invest. Ophthalmol. Vis. Sci. 2008. V. 49. P. 4993.
Zhang H., Cuevas J. Sigma receptors inhibit high-voltage-activated calcium channels in rat sympathetic and parasympathetic neurons // J. Neurophysiol. 2002. V. 87. № 6. P. 2867.
Takebayashi M., Hayashi T., Su T.P. Sigma-1 receptors potentiate epidermal growth factor signaling towards neuritogenesis in PC12 cells: potential relation to lipid raft reconstitution // Synapse. 2004. V. 53. № 2. P. 90.
Li Y.C., Park M.J., Ye S.K. et al. Elevated levels of cholesterolRich lipid rafts in cancer cells are correlated with apoptosis sensitivity induced by cholesterol-depleting agents // Am. J. Pathol. 2006. V. 168. № 4. P. 1107.
Wu Z., Bowen W.D. Role of sigma-1 receptor C-terminal segment in inositol 1,4,5-trisphosphate receptor activation: constitutive enhancement of calcium signaling in MCF-7 tumor cells // J. Biol. Chem. 2008. V. 283. № 42. P. 28 198.
Mikoshiba K. IP3 receptor/Ca2+ channel: from discovery to new signaling concepts // J. Neurochem. 2007. V. 102. № 5. P. 1426.
Prole D.L., Taylor C.W. Structure and Function of IP3 Receptors // Cold Spring Harb. Perspect Biol. 2019. V. 11. № 4. P. a035063.
Ryskamp D.A., Korban S., Zhemkov V. et al. Neuronal Sigma-1 Receptors: Signaling Functions and Protective Roles in Neurodegenerative Diseases // Front. Neurosci. 2019. V. 13. P. 862.
harp A.H., Nucifora F.C., Jr., Blondel O. et al. Differential cellular expression of isoforms of inositol 1,4,5-triphosphate receptors in neurons and glia in brain // J. Comp. Neurol. 1999. V. 406. № 2. P. 207
Tagashira H., Bhuiyan M.S., Fukunaga K. Diverse regulation of IP3 and ryanodine receptors by pentazocine through σ1Receptor in cardiomyocytes // Am. J. Physiol. – Heart Circulat. Physiol. 2013. V. 305. № 8. P. 1201.
Fill M., Copello J.A. Ryanodine receptor calcium release channels // Physiol Rev. 2002. V. 82. № 4. P. 893.
Hohendanner F., McCulloch A.D., Blatter L.A., Michailova A.P. Calcium and IP3 dynamics in cardiac myocytes: experimental and computational perspectives and approaches // Front. Pharmacol. 2014. V. 5. P. 35.
Bootman M.D., Fearnley C., Smyrnias I. et al. An update on nuclear calcium signaling // J. Cell. Sci. 2009. V. 122. № 14. P. 2337.
Amador F.J., Stathopulos P.B., Enomoto M., Ikura M. Ryanodine receptor calcium release channels: lessons from structure-function studies // FEBS J. 2013. V. 280. № 21. P. 5456.
Harzheim D., Movassagh M., Foo R.S. et al. Increased InsP3Rs in the junctional sarcoplasmic reticulum augment Ca2+ transients and arrhythmias associated with cardiac hypertrophy // Proc. Natl. Acad. Sci. 2009. V. 106. № 27. P. 11406.
Marx S.O., Gaburjakova J., Gaburjakova M. et al. Coupled gating between cardiac calcium release channels (ryanodine receptors) // Circ. Res. 2001. V. 88. № 11. P. 1151.
Dudek J., Benedix J., Cappel S. et al. Functions and pathologies of BiP and its interaction partners // Cell. Mol. Life Sci. 2009. V. 66. № 9. P. 1556.
Ela C., Barg J., Vogel Z. et al. Sigma receptor ligands modulate contractility, Ca++ influx and beating rate in cultured cardiac myocytes // J. Pharmacol. Exp. Ther. 1994. V. 269. № 3. P. 1300.
Fialova K., Krizanova O., Jarkovsky J., Novakova M. Apparent desensitization of the effects of sigma receptor ligand haloperidol in isolated rat and guinea pig hearts after chronic treatment // Can. J. Physiol. Pharmacol. 2009. V. 87. № 12. P. 1019.
Novakova M., Sedlakova B., Sirova M. et al. Haloperidol increases expression of the inositol 1,4,5-trisphosphate receptors in rat cardiac atria, but not in ventricles // Gen. Physiol. Biophys. 2010. V. 29. № 4. P. 381.
Stracina T., Slaninova I., Polanska H. et al. Long-term haloperidol treatment prolongs qt interval and increases expression of sigma 1 and IP3 receptors in guinea pig hearts // Tohoku J. Exp. Med. 2015. V. 236. № 3. P. 199.
Mortl D., Agneter E., Krivanek P. et al. Dual rate-dependent cardiac electrophysiologic effects of haloperidol. Slowing of intraventricular conduction and lengthening of repolarization // J. Cardiovasc. Pharmacol. 2003. V. 41. P. 870.
Patron M., Raffaello A., Granatiero V. et al. The mitochondrial calcium uniporter (MCU): molecular identity and physiological roles // J. Biol. Chem. 2013. V. 288. № 15. P. 10750.
Mammucari C., Patron M., Granatiero V., Rizzuto R. Molecules and roles of mitochondrial calcium signaling // Biofactors. 2011. V. 37. № 3. P. 219.
De Stefani D., Rizzuto R., Pozzan T. Enjoy the Trip: Calcium in Mitochondria Back and Forth // Annu. Rev. Biochem. 2016. V. 85. P. 161.
Marchi S., Patergnani S., Missiroli S. et al. Mitochondrial and endoplasmic reticulum calcium homeostasis and cell death // Cell Calcium. 2018. V. 69. P. 62.
Anderson C.M., Hu J., Thomas R. Cooperative activation of cardiac transcription through myocardin bridging of paired MEF2 sites // Development. 2017. V. 144. № 7. P. 1235.
Meunier J., Hayashi T. Sigma-1 receptors regulate Bcl-2 expression by reactive oxygen species-dependent transcriptional regulation of nuclear factor kappa B // J. Pharmacol. Exp. Ther. 2010. V. 332. № 2. P. 388.
Soriani O., Rapetti-Mauss R. Sigma 1 receptor and ion channel dynamics in cancer / Sigma Receptors: Their Role in Disease and as Therapeutic Targets // Eds. Smith S.B., Su T.P. Springer Int. Publish. AG, 2017. P. 63.
Schmidt H.R., Kruse A.C. The molecular function of σ receptors: Past, present, and future // Trends Pharmacol. Sci. 2019. V. 40. № 9. P. 636.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека