Физиология человека, 2021, T. 47, № 2, стр. 72-82
Вертикальная ориентация в пространстве у больных паркинсонизмом при воздействии однократной “сухой” иммерсии и курса иммерсий
А. Ю. Мейгал 1, *, О. Г. Третьякова 1, Л. И. Герасимова-Мейгал 1, И. В. Саенко 2
1 ФГБОУ ВО Петрозаводский государственный университет
Петрозаводск, Россия
2 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: meigal@petrsu.ru
Поступила в редакцию 16.07.2020
После доработки 05.08.2020
Принята к публикации 30.09.2020
Аннотация
Целью данной работы являлась характеристика вертикальной ориентации тела у больных паркинсонизмом (БП) и здоровых молодых испытуемых (ЗМ) после однократного и курсового действия моделированной микрогравитации в виде “сухой” иммерсии (СИ), при помощи компьютерной стабилометрии. После однократной 45-минутной СИ параметры перемещения общего центра давления (ОЦД) у БП (n = 9) и ЗМ (n = 12) не изменялись (р > 0.05), хотя отмечена слабая тенденция к их уменьшению. Курс СИ (7 сеансов по 45 мин в течение 30 дней) у больных БП (n = 17) также не повлиял на параметры стабилометрии. Влияние однократной СИ не становилось более значимым к окончанию курса СИ. Применение пробы с закрыванием глаз не повлияло на эффект однократной СИ и курса СИ на параметры стабилометрии. Вместе с тем, после сеанса СИ у больных с БП число баллов по шкале UPDRS-III снижалось на 33% (p < 0.05), мышечная ригидность – на 37% (p < 0.05), тремор на 27% (p < 0.05), акинезия на 30% (p < 0.05). Таким образом, имеется несоответствие между влиянием СИ на клиниметрически и инструментально измеряемые величины, что может быть связано с: 1) недостаточной сложностью задания, 2) неучтенным влиянием СИ на траекторию стабилограммы отдельно во фронтальной и сагиттальной плоскости и 3) неучтенным фактором развития сигнала стабилометрии во времени.
Позный контроль включает в себя: 1) равновесие, т.е. функцию стабилизации тела при смещении центра тяжести при внешнем воздействии и активном движении, и 2) ориентацию тела в гравитационном поле, например, функцию вертикальности. При болезни Паркинсна (БП) изменены оба названных компонента позного контроля [1]. В частности, у больных с БП при спокойном стоянии увеличиваются основные параметры стабилометрии – длина траектории общего центра давления (ОЦД), скорость и площадь его перемещения [2, 3].
По мере прогрессирования БП позный контроль нарушается все больше [4, 5]. Функция вестибулярного аппарата у больных БП не страдает или изменена в соответствии с возрастом [6, 7], поэтому за видимые позные нарушения при БП могут отвечать другие сенсорные системы, такие как проприоцептивная, тактильная и зрительная [8–11]. На позный контроль могут влиять и некоторые характерные для БП моторные симптомы. Например, мышечная ригидность (избыточная жесткость суставов вследствие повышенного мышечного тонуса) при БП влияет на силу мышц, степень свободы суставов конечностей и, в конечном счете, на жесткость всего тела, что отражается на реактивности двигательной системы к пертурбациям [8]. Некоторые немоторные симптомы паркинсонизма, такие как апатия, депрессия и замедление моторно-когнитивных реакций также влияют на позный контроль [12].
Прием антипаркинсонических препаратов (леводопы) вызывает снижение ригидности суставов конечностей [13], но, в то же время, приводит к увеличению скорости и длины перемещения ОЦД [14, 15], ухудшению автоматических позных реакций [13]. Эти, на первый взгляд, негативные эффекты леводопы на самом деле указывают на улучшение функции вертикальной ориентации в пространстве, так как свидетельствуют о появлении реактивности тела на смещение ОЦД. Также, неспособность леводопы уменьшaть стабилометрические параметры может быть связана с тем, что леводопа снижает ригидность мышц конечностей, но неактивна в отношении ригидности аксиальной мускулатуры, которая собственно и поддерживает вертикальную стойку [6].
Ранее нами было показано, что курс моделированной микрогравитации в виде “сухой” иммерсии (СИ) заметно уменьшает ригидность [16]. Однократная СИ вызывала уменьшение косвенных признаков ригидности и тремора, видимых при помощи поверхностной электромиографии (ЭМГ) [17]. У молодых здоровых испытуемых длительная (3-дневная) СИ, применяемая в качестве наземной модели микрогравитации, вызывала увеличение траектории пути, скорости и площади перемещения ОЦД, жесткости суставов [18] и нарушение моторной координации [19]. Таким образом, СИ влияет на позный контроль. По нашим данным, модель СИ еще не применялась для изучения позного контроля у больных с БП. Подобное исследование было бы интересным с физиологической точки зрения, поскольку показало бы, как СИ влияет на избыточный тонус мышц и вертикальную ориентацию человека, и с точки зрения реабилитологии, поскольку СИ потенциально могла бы улучшить позную стабильность у больных с БП.
Прием леводопы также уменьшает время моторно-когнитивных реакций, например в тесте реакции выбора [20]. Поскольку при БП леводопа оказывает общее с СИ расслабляющее действие на мышечную ригидность, то потенциально СИ может подействовать на позный контроль и при помощи убыстрения моторно-когнитивных реакций. Возможность влияния моделированной микрогравитации в виде СИ на клинические двигательные симптомы и физиологические параметры у больных с БП косвенно подтверждается многочисленными работами по благоприятному действию на больных с БП т.н. “акватерапии” [21–23].
Представленные выше литературные данные позволяют предложить рабочую гипотезу о том, что проведение однократной СИ и курса СИ влияет на функцию вертикальной ориентации в пространстве у больных с БП. Влияние СИ на вертикальную стойку теоретически может проявиться в виде двух разнонаправленных эффектов: 1) увеличения перемещений ОЦД за счет увеличения реактивности двигательной системы на фоне уменьшении жесткости ее звеньев вследствие снижения мышечной ригидности и увеличения степеней свободы суставов, или 2) уменьшения перемещений ОЦД за счет улучшения поведенческого компонента позного контроля (когнитивно-эмоционального состояния) и скорости реакции у больных с БП. Также предполагается, что проба с закрыванием глаз (проба Ромберга) позволит выявить наличие характерного для больных с БП феномена “re-weighting” (“переоценки”) вклада сенсорных систем в позный контроль [11] после воздействия СИ.
Таким образом, выяснение эффекта СИ на функцию ориентации тела в пространстве у больных с БП в сравнении со здоровыми молодыми испытуемыми и является целью данной работы. В качестве модели ориентации тела в гравитационном поле выбрана вертикальная стойка, а метриками ее оценки – параметры перемещения ОЦД при компьютерной стабилометрии, которая считается надежным методом изучения позной стабильности у больных с БП [3].
МЕТОДИКА
В исследовании принимали участие 33 испытуемых, из них 12 здоровых молодых испытуемых и 21 больной с БП. Принципы отбора, критерии включения и невключения, и клинико-неврологическое обследование представлены в работах [16, 17]. Пять больных с БП выступили в качестве контрольной группы, т.е. проходили все те же исследования, что и другие больные с БП, но без применения курса СИ. Антропологические и клинические данные испытуемых с БП, их участие в разных разделах данной работы и применяемое лечение представлены в табл. 1. Средние данные в табл. 2. Испытуемые ЗМ (n = 12) представлены группой в возрасте 19–20 лет (5 м и 7 ж).
Таблица 1.
Антропологические и клинические данные испытуемых с БП
| № | Возраст и пол | Участие в разделах исследования | Рост (см), вес (кг) | Стаж БП (годы) | UPDRS-III (баллы) | Стадия по Хену и Яру | Клиническая форма | LED* (мг/день) |
|---|---|---|---|---|---|---|---|---|
| 1 | 66 ж | Э1 | 156, 53 | 7 | 41 | 2 | БП, РД | 188 |
| 2 | 68 ж | Э1, Э2 | 164, 90 | 8 | 32 | 2.5 | СП, РД | 169 |
| Benserasid 25 | ||||||||
| Piribedil 75 | ||||||||
| 3 | 62 м | Э1, Э2 | 180, 69 | 7 | 29 | 2 | БП, ДР | 822 |
| Piribedil 200 | ||||||||
| 4 | 57 м | Э1, Э2 | 178, 63 | 6 | 37 | 2.5 | БП, Д | 388 |
| Piribedil 200 | ||||||||
| 5 | 70 м | Э1, Э2, Э3 | 176, 74 | 2 | 37 | 3 | БП, Д | 187.5 |
| 6 | 53 м | Э1, Э2, Э3 | 171, 81 | 5 | 33 | 1.5 | БП, АР | 200 |
| Piribedil 150 | ||||||||
| 7 | 61 м | Э1, Э2, Э3 | 188, 83 | 6 | 15 | 1 | БП, Д | 312.5 |
| 8 | 58 ж | Э1, Э2, Э3 | 158, 65 | нд | 26 | 2 | БП, Д | Piribedil 150 |
| 9 | 47 м | Э1, Э2, Э3 | 182, 81 | 3 | 15 | 1 | БП, АР | Нет лечения |
| 10 | 71 м | Э2 | 170, 51 | 8 | 23 | 2 | БП, Д | Trihexyphenidil 6 |
| 11 | 66 ж | Э2 | 160, 67 | 2 | 8 | 2 | СП, Д | 188 |
| Trihexyphenidil 6 | ||||||||
| 12 | 68 м | Э2 | 167, 78 | 3 | 26 | 2 | БП, АР | 375 |
| 13 | 58 м | Э2 | 170, 60 | нд | 29 | 3 | БП, Д | 675 |
| 14 | 69 м | Э2 | 179, 69 | 4 | 25 | 3 | БП, Д | 250 |
| 15 | 65 ж | Э2 | 152, 78 | 7 | 13 | 1 | СП, АР | 1100 |
| 16 | 63 ж | Э2 | 162, 55 | 9 | 22 | 3 | БП, АР | 250 |
| 17 | 50 м | Э2, контр. | 171, 94 | 4 | 20 | 2 | БП, Д | 450 |
| 18 | 55 м | Э2, контр. | 178, 86 | 6 | 28 | 2 | БП, Д | 450 |
| 19 | 46 м | Контр. | 186, 114 | 3 | 15 | 1.5 | БП, Д | 550 |
| 20 | 65 м | Контр. | 164, 59 | 7 | 33 | 2 | БП, Д | 850 |
| 21 | 69 м | Контр. | 173, 93 | 4 | 33 | 2 | БП, Д | 1062.5 |
Примечание: * – LED (levodopa equivalent dose) рассчитана по формуле [24]. Также указаны препараты, не имеющие эффект эквивалентный леводопе, АР – акинетико-ригидная, Д – дрожательная форма, СП – сосудистый паркинсонизм, нд – нет данных.
Таблица 2.
Усредненные данные по группам с однократной СИ, курсом СИ и контрольной группе
| Группа | Возраст и пол | Рост (см), вес (кг) |
Стаж БП (годы) | UPDRS-III (баллы) | Стадия по Хену и Яру | LED* (мг/день) |
|---|---|---|---|---|---|---|
| СИ | 60.2 ± 7.4 | 172.5 ± 11 | 5.5 ± 2.1 | 29.4 ± 9.3 | 1.9 ± 0.68 | 324 ± 234 |
| 3 ж, 6 м | 73.2 ± 11.7 | |||||
| Курс СИ | 61.2 ± 7.2 | 171 ± 9.6 | 4.9 ± 2.2 | 24.6 ± 8.3 | 2.1 ± 0.7 | 507 ± 299 |
| 3 ж, 6 м | 73.2 ± 12.2 | |||||
| Контр. | 57 ± 9.8 | 174.4 ± 8.4 | 4.8 ± 1.6 | 25.8 ± 8.0 | 1.9 ± 0.2 | 575 ± 189 |
| 5 м | 89 ± 19.8 |
Структура исследования. В Эксперименте 1 (Э1) здоровые молодые (ЗМ) испытуемые и испытуемые с БП проходили однократное короткое воздействие СИ с измерением параметров стабилометрии “до и после” СИ. В Эксперименте 2 (Э2) приняли участие больные с БП, которые прошли курс СИ и больные с БП, которые составили контрольную группу (без прохождения курса БП). В Эксперименте 3 (Э3) участвовали больные с БП и молодые испытуемыe, которые согласились пройти стабилометрическое обследование до и после отдельных иммерсий в течение всего курса СИ. Исследование проводили в течение 2016–2019 гг. в Институте высоких биомедицинских технологий Петрозаводского государственного университета (ИВБМТ ПетрГУ, г. Петрозаводск).
Однократная СИ (Э1). СИ представляет собой погружение человека в ванну с теплой (Тв = 32–33°С) пресной водой, которая периодически фильтруется и аэрируется (комплекс МЕДСИМ, ГНЦ РФ ИМБП, Москва, Россия), но без прямого контакта с водой. Испытуемого перед погружением укладывали на ложемент, покрытый водонепроницаемой тонкой пленкой с большой площадью, которая позволяла образовывать складки и заворачивать в них испытуемого. Испытуемого также обертывали индивидуальной хлопчатобумажной простыней для комфортного контакта с пленкой. После 5 мин спокойного лежания, необходимых для привыкания к обстановке, измерения артериального давления (АД) и прикрепления электродов для электрокардиографии (ЭКГ) ложемент опускали в воду и испытуемый оказывался погруженным в воду завернутым в складки пленки. Над уровнем воды оставались лицо и верхняя часть груди. Руки испытуемый держал скрещенными на груди или вытягивал вдоль туловища. Процедура СИ длилась 45 мин, в течение которых на 15, 30 и 45-й мин измеряли АД и записывали ЭКГ для мониторинга возможных экстрасистол. Столь необычно короткое время СИ связано с тем, что испытуемые были людьми пожилыми и имели болезнь Паркинсона. В отличие от ЗМ-испытуемых, которые хорошо переносят более длительные сеансы СИ [19], у некоторых больных с БП имелась контролируемая артериальная гипертензия и остеохондроз, а также повышенная чувствительность мочевого пузыря к наполнению. В целом, это ограничивало сеанс однократной СИ временем в 45 мин [16] за счет риска повышения АД и появления боли в позвоночнике. Стабилометрию производили до и после СИ. Участвовало 9 больных с БП и 12 ЗМ. Исследование начинали в фиксированное время после приема антипаркинсонических препаратов (обычно в 9 ч утра).
Курс СИ (Э2). Курс СИ состоял из 7 однократных процедур СИ, которые проводили в течение 27–30 дней (через 3–4 дня в зависимости от удобного для испытуемого графика посещений лаборатории). Всего в течение 1 мес. испытуемые получали 5 ч и 15 мин “состояния моделированной микрогравитации”. Измерение стабилометрических параметров происходило перед курсом СИ (точка исследования “1”), сразу после курса (точка “2”), 2 нед. после курса (точка “3”) и 2 мес. после курса СИ (точка “4”). За один день до курса проводили пробную 15-минутную СИ для оценки реакции испытуемого на условия СИ и привыкания к самой процедуре.
Влияние курса СИ на действие однократной СИ (Э3). Пять больных с БП и 2 здоровых молодых испытуемых прошли 3 стабилометрических обследования при 1, 4 и 7-й иммерсии, до и после СИ, с открытыми и закрытыми глазами (всего 12 проб), для оценки взаимодействие курса СИ и однократной СИ.
Стабилометрия. Для исследования использовали силовую платформу ST150 (Мера, Россия). Прибор располагали на цокольном этаже здания Института высоких биомедицинских технологий ПетрГУ (г. Петрозаводск), на полу с бетонной “подушкой” для уменьшения помех, в комнате, где располагали и комплекс моделирования микрогравитации. Горизонтальность силовой платформы контролировали строительным уровнем. Здание ИМБВТ ПетрГУ экранировано другими зданиями ПетрГУ от уличного шума и вибрации. Во время стабилометрии испытуемые были одеты в футболку и шорты или тонкие спортивные штаны. На платформу становились босиком, в “Европейской стойке” (“пятки вместе, носки врозь”). Внутренние границы стоп образовывали угол 30°, что обозначено линиями на платформе. Испытуемые стояли спокойно и свободно, дышали ровно и смотрели перед собой на компьютерный экран с картинами природы на уровне глаз, на расстоянии 2.5 м. Руки свободно свисали вдоль туловища. Во время измерения в комнате не разговаривали, мобильные устройства были отключены для предотвращения реакций на звуки.
Тест Ромберга с закрыванием глаз. Первые 30 с испытуемые стояли на платформе с открытыми глазами, затем по голосовой команде компьютера закрывали глаза и стояли следующие 30 с. Из предлагаемых программным обеспечением стабилометра параметров выбраны следующие: 1) общая длина пути (L, мм) и 2) скорость перемещения ОЦД (V, мм/с), 3) площадь эллипса, включающего 95% точек стабилограммы (S, мм2).
Клиниметрическое исследование. При помощи UPDRS-III (Unified Parkinson’s disease rating scale, часть 3) измеряли ригидность (пункт 22), тремор (пункты 20–21) и акинезию (пункты 23–27). Измерение проводил врач-невролог.
Статистический анализ данных. Использовали лицензионные программы IBM SPSS Statistics 21.0 (IBM, США) и Statgraphics Centurion XV (Statgraphics Technologies Inc., США) и непараметрические критерии значимости, так как число испытуемых было ограниченным. В Э1 использовали критерий Крускалл-Уоллеса для парных связанных сравнений между состояниями “до СИ” и “после СИ”, а также между состояниями “глаза открыты” и “глаза закрыты”. Для оценки вклада факторов (наличия болезни, фактора СИ, фактора закрывания глаз, номера СИ) в вариабельность стабилометрических показательней использовали многофакторный ANOVA. В Э2 и Э3 использовали критерий Фридмана с поправкой Кейласа для множественных парных сравнений, поскольку стабилометрические параметры оценивали при трех и более повторяющихся условиях.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эксперимент 1. Характеристика вертикальной стойки у больных паркинсонизмом и здоровых испытуемых при однократном применении СИ. Сразу после сеанса СИ число баллов UPDRS-III снижалось в среднем с 30 до 20 (p < 0.05), мышечная ригидность – на 37% (с 7.5 до 4.7; p < 0.05), тремор на 27% (с 5.8 до 4.2; p < 0.05), акинезия – на 30% (с 11.8 до 8.3; p < 0.05) (рис. 1). Двое испытуемых согласились пройти измерения в течение 3 ч после СИ. Эффект СИ длился как минимум 3 ч после процедуры СИ (рис. 1).
Рис. 1.
Изменение клиниметрических показателей на основе шкалы UPDRS-III после процедуры СИ (А) и в течение трех часов после процедуры СИ (Б) у двух разных испытуемых.

Результаты стабилометрии представлены на рис. 2. Установлено, что у молодых испытуемых длина пути и скорость перемещения ОЦД имели тенденцию к уменьшению (на 5–6%), а площадь перемещений ОЦД – увеличивалась, что, однако, не достигало уровня статистической значимости (p > 0.05). При закрывании глаз все исследованные параметры изменялись в сторону увеличения (p < 0.05). После СИ при закрытых глазах параметры перемещений ОЦД изменялись так же, как и при открытых глазах (p > 0.05).
Рис. 2.
Изменение стабилометрических параметров после процедуры СИ. Статистически значимых различий между состоянием до и после СИ нет (p > 0.05). а – здоровые молодые испытуемые, глаза открыты, б – здоровые молодые испытуемые, глаза закрыты, в – больные с БП, глаза открыты, г – больные с БП, глаза закрыты. * – p < 0.05, ** – p < 0.01 для пары “глаза открыты – глаза закрыты”. В паре “до СИ – после СИ” различий нет (p > 0.05).
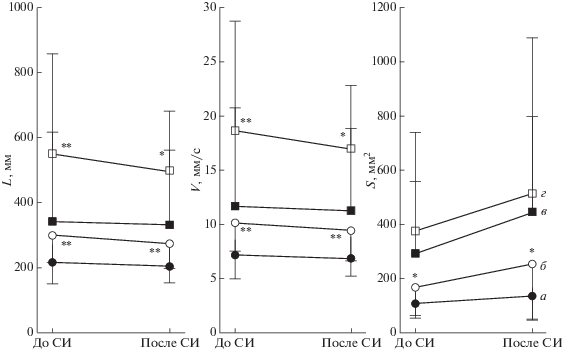
У больных с БП все стабилометрические параметры имели большие значения (p < 0.05) по сравнению с молодыми испытуемыми, во всех условиях. Сеанс СИ у больных БП не оказал значимого влияния на длину и скорость перемещений ОЦД (p > 0.05), хотя тенденция к уменьшению этих параметров (на 5–6%) была характерна, как и для молодых испытуемых. Закрывание глаз у больных с БП также изменяло стабилометрические параметры в сторону увеличения, за исключением площади эллипса перемещений ОЦД. Многофакторный анализ вариабельности показал, что наибольший вклад в вариацию стабилометрических параметров вносит наличие самой БП, а также проба с закрыванием глаз, тогда как СИ не оказала влияния на вариабельность параметров перемещения ОЦД (табл. 3). Таким образом, несмотря на явную тенденцию к снижению длины и скорости перемещения ОЦД, следует считать, что однократное применение СИ не оказало влияния на параметры стабилометрии ни в одной из двух групп испытуемых.
Таблица 3.
Вклад (%) факторов в вариабельность параметров стабилометрии
| Факторы | L (мм) | V (мм/с) | S (мм2) |
|---|---|---|---|
| Болезнь Паркинсона | 24.8*** | 25.8*** | 25.3*** |
| Проба Ромберга | 15.6*** | 16.8*** | 0.0 (p = 0.183) |
| Сухая иммерсия | 0.0 (p = 0.515) | 0.0 (p = 0.524) | 0.0 (p = 0.104) |
Эксперимент 2. Характеристика вертикальной стойки у больных паркинсонизмом во время и после курса СИ. Полный курс СИ прошли 16 больных с БП. Пять испытуемых, по разным причинам, не пришли на контрольное обследование в точке “4” (2 мес. после курса СИ), это было учтено при статистическом анализе. Полученные результаты указывают на то, что курс СИ не оказал влияния на исследованные стабилометрические параметры (табл. 4). Вместе с тем, отмечена тенденция к уменьшению длины пути ОЦД в состоянии “глаза закрыты” (p = 0.105), а в точке “2 недели после курса СИ” отмечено статистически значимое отличие от точки “до курса СИ”. В группе больных с БП, не проходившие курс СИ, изменений стабилометрических показателей не имеется (табл. 5).
Таблица 4.
Значения стабилометрических параметров у больных паркинсонизмом во время и после проведения курса “сухой” иммерсии (СИ)
| Условие проведения | До курса СИ | После курса СИ | 2 нед. после курса | 2 мес. после курса | P (критерий Фридмана) |
|---|---|---|---|---|---|
| L (мм) | |||||
| Глаза открыты | 306 ± 217 | 297 ± 207 | 293 ± 125 | 270 ± 124 | 0.814 |
| Глаза закрыты | 540 ± 275 | 506 ± 299 | 485 ± 201* | 510 ± 297 | 0.105 |
| V (мм/с) | |||||
| Глаза открыты | 10.5 ± 7.2 | 10.3 ± 6.8 | 11.04 ± 6.9 | 9.6 ± 4.1 | 0.602 |
| Глаза закрыты | 18.1 ± 8.9 | 17.2 ± 10.1 | 16.9 ± 6.9 | 17.6 ± 10.3 | 0.305 |
| S (мм2) | |||||
| Глаза открыты | 200 ± 221 | 240 ± 235 | 196 ± 227 | 211 ± 131 | 0.368 |
| Глаза закрыты | 334 ± 191 | 348 ± 294 | 366 ± 270 | 329 ± 268 | 0.570 |
Таблица 5.
Значения стабилометрических параметров в контрольной группе без проведения курса “сухой” иммерсии (СИ)
| Условие проведения | До курса СИ | После курса СИ | 2 нед. после курса | 2 мес. после курса | P (критерий Фридмана) |
|---|---|---|---|---|---|
| L (мм) | |||||
| Глаза открыты | 225 ± 54 | 233 ± 53 | 191 ± 33 | 177 ± 51 | 0.218 |
| Глаза закрыты | 345 ± 100 | 384 ± 74 | 329 ± 49 | 381 ± 88 | 0.266 |
| V (мм/с) | |||||
| Глаза открыты | 7.5 ± 2.2 | 7.8 ± 1.6 | 6.7 ± 1.1 | 6.3 ± 1.8 | 0.449 |
| Глаза закрыты | 12.7 ± 3.2 | 14.2 ± 4.0 | 12.0 ± 2.2 | 13.9 ± 2.4 | 0.819 |
| S (мм2) | |||||
| Глаза открыты | 123 ± 61 | 105 ± 27 | 119 ± 94 | 87 ± 83 | 0.449 |
| Глаза закрыты | 206 ± 125 | 281 ± 186 | 200 ± 124 | 201 ± 125 | 0.549 |
Эксперимент 3. Взаимодействие эффектов курса СИ и однократной СИ на вертикальную стойку у больных с БП и здоровых испытуемых в течение курса СИ. Пять больных с БП и 2 ЗМ-испытуемых прошли стабилометрическое обследование до и после СИ в течение всего курса СИ. Средние значения стабилометрических параметров в разные по номеру иммерсии представлены в табл. 6. Эффект однократной СИ становился статистически значимым для некоторых параметров только при выполнении последней 7-й иммерсии (при парном сравнении состояний до и после СИ), однако, многофакторный ANOVA не показал значимого влияния номера СИ на ее эффект (для всех параметров – p > 0.5).
Таблица 6.
Значения стабилометрических параметров до и после СИ в течение курса СИ
| Группа и состояние | L (мм) | V (мм/с) | S (мм2) | |
|---|---|---|---|---|
| СИ № 1 | ||||
| Глаза открыты | До СИ | 357.3 ± 311.7 | 12.1 ± 10.3 | 224.9 ± 207.7 |
| После СИ | 294.7 ± 276.7 (0.063) | 10.1 ± 9.1 (0.176) | 247.1 ± 192.8 (0.612) | |
| Глаза закрыты | До СИ | 522.4 ± 364.2 | 17.8 ± 11.8 | 222.2 ± 215.6 |
| После СИ | 396.6 ± 220.9 (0.091) | 13.4 ± 7.3 (0.063) | 301.6 ± 262.5 (0.612) | |
| СИ № 4 | ||||
| Глаза открыты | До СИ | 311.9 ± 215.0 | 10.5 ± 7.1 | 158.9 ± 165.4 |
| После СИ | 271.6 ± 210.2 (0.091) | 10.3 ± 6.6 (0.866) | 188.2 ± 143.2 (0.237) | |
| Глаза закрыты | До СИ | 516.7 ± 436.6 | 17.5 ± 14.4 | 250.1 ± 300.7 |
| После СИ | 382.7 ± 280.1 (0.091) | 14.1 ± 8.9 (0.176) | 298.8 ± 307.9 (0.735) | |
| СИ № 7 | ||||
| Глаза открыты | До СИ | 393.8 ± 435.0 | 13.1 ± 14.5 | 142.5 ± 97.5 |
| 0.651 | 0.964 | 0.368 | ||
| После СИ | 218.7 ± 163.5 (0.018) | 8.2 ± 5.1 (0.063) | 111.8 ± 78.9 (0.866) | |
| 0.066 | 0.028 | 0.102 | ||
| Глаза закрыты | До СИ | 519.8 ± 474.0 | 17.7 ± 15.7 | 279.3 ± 260.5 |
| 0.867 | 0.651 | 0.368 | ||
| После СИ | 329.0 ± 218.9 (0.091) | 11.6 ± 6.9 (0.018) | 230.5 ± 224.9 (0.866) | |
| Критерий Фридмана | 0.276 | 0.066 | 0.180 | |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе представлен результат влияния моделированной микрогравитации в виде СИ на такой компонент позного контроля, как поддержание вертикальной ориентации тела в пространстве у испытуемых с БП и здоровых молодых испытуемых при помощи стабилометрии.
Установлено, во-первых, что влияние однократной СИ на стабилометрические параметры у больных БП и испытуемых ЗМ не было статистически значимым, хотя имела место тенденция к уменьшению этих параметров после СИ. Во-вторых, курс СИ, состоящий из 7 однократных 45-минутных иммерсий, проведенных в течение 30 дней, не вызвал статистически значимых изменений стабилометрических параметров, за исключением уменьшения длины перемещения ОЦД в точке “2 недели после курса СИ” в состоянии “с закрытыми глазами”. В-третьих, эффект однократной СИ не становился более значимым к окончанию курса СИ. Также, наши результаты подтвердили ранее представленные данные о том, что факторы БП и закрывания глаз вносят значимый вклад в увеличение значений длины и скорости перемещения ОЦД [3].
Таким образом, не было получено веских свидетельств в пользу того, что моделированная микрогравитация влияет на параметры вертикальной стойки здорового молодого человека или больного с БП. Такой результат может объясняться несколькими причинами.
Во-первых, испытуемые с БП были достаточно разнообразны клинически (по форме, стадии и длительности болезни, числу баллов UPDRS-III, возрасту и полу, виду и дозе антипаркинсонической терапии). Это не позволило провести кластерный анализ, так как каждый испытуемый с БП был уникален по набору названных выше характеристик и, по сути, представлял собой отдельную группу исследования. Вместе с тем, отсутствие влияния СИ на вертикальную стойку у испытуемых ЗМ, т.е. очень однородной группы испытуемых, убеждает в том, что влияние СИ на больных с БП действительно отсутствует или является очень слабым.
Во-вторых, на результат нашей работы могли повлиять особенности проведения самой СИ – одного сеанса и всего курса. Так, наша гипотеза о возможности влияния СИ на вертикальную устойчивость у испытуемых с БП опиралась на исследование, где применялась более длительная (до 3 сут) СИ, что характерно для наземных космических экспериментов [18]. В нашей же работе применялись очень короткие (до 45 мин) однократные сеансы СИ, а между иммерсиями в курсе соблюдались перерывы до 3 дней. Таким образом, использованные нами способы применения как однократной (острой), так и курсовой СИ, могли просто оказаться недостаточными для проявления эффекта СИ.
В-третьих, на результат могли повлиять методологические факторы самой стабилометрии: 1) фактор изменения стабилометрического сигнала во времени (развитие сигнала), 2) фактор сложности задания, 3) фактор выбора стабилометрических показателей. Известно, что эффект re-weighting (“переоценки”) вклада сенсорных систем в ориентацию в пространстве (закрывание глаз, пертурбация опоры) становится наиболее заметным в так называемые переходные моменты (эффект “транзиторности”), когда резко изменяются условия выполнения задания [11]. Например, транзиторность при проведении пробы Ромберга проявляется в момент закрывания глаз и в первые несколько секунд после этого. Также известно, что наибольшая вариабельность положения ОЦД наблюдаются в течение первых 30 с после начала стабилометрии, а затем в течение 1–2 мин положение тела при вертикальной стойке является довольно стабильным [25]. Это указывает на важность фактора времени (фактора развития состояния и, соответственно, сигнала) при проведении стабилометрии. В нашем исследовании транзиторность, как отдельный фактор, не учитывалась в силу того, что программное обеспечение стабилометра оценивало среднее значение параметров за все время теста. Это вполне могло привести к тому, что значимые изменения стабилометрического сигнала в самом начале пробы Ромберга могли остаться неучтенными.
Фактор сложности задания также мог повлиять на результат данного исследования, так как мы выбрали наиболее простой вариант функции ориентации в пространстве в виде вертикальной свободной стойки. Сложность задания могла быть усилена при помощи размещения на силовой платформе слоя мягкого материала (поролона) с использованием теста “стопная реакция” или вибрации сухожилий мышц голени.
На результат мог повлиять и выбор стабилометрических параметров. Были использованы только 3 базовых описательных параметра, при этом только длина траектории ОЦД (L) являлась непосредственно измеряемой метрикой. Скорость траектории является производной длины по времени, а площадь, внутри которой перемещается ОЦД, является геометрической величиной. Другие доступные стабилометрические параметры также являются расчетными величинами. Также, длина траектории ОЦД является результатом перемещений в двух перпендикулярных направлениях – переднезаднем (в сагиттальной плоскости) и медиолатеральном (во фронтальной плоскости). С учетом того, что у больных с БП позная нестабильность (отклонение ОЦД) характерна в основном для медиолатерального направления [15], можно было бы провести сравнение длины пути ОЦД отдельно в обеих названных плоскостях, что, однако было ограничено инструментально.
Зрение, наряду с вестибулярным аппаратом и проприоцептивной информацией, имеет большое значение в осуществлении спокойного стояния и реагировании на пертурбации [11, 26]. Удельный вес этих сенсорных входов варьирует при их выборочном выключении, на него также влияет БП и возраст человека. Так, у больных с БП функция вестибулярного аппарата считается вполне нормальной [8] и в обычных условиях больные с БП в основном полагаются именно на вестибулярную информацию [26]. Молодые испытуемые также обычно полагаются на вестибулярную сенсорную систему, но при закрытых глазах – на проприоцептивную систему [26]. Пожилые люди, не страдающие БП, полагаются не только на проприоцептивную, но и на зрительную информацию, поэтому закрывание глаз у них серьезно изменяет соотношение между этими сенсорными потоками, что собственно и составляет феномен “re-weighting” [11]. В настоящем исследовании влияние зрения (закрывания глаз) действительно было значимым для одного из параметров – длины траектории в точке “2 недели после курса СИ”, когда этот параметр уменьшался именно при закрывании глаз. Это указывает на то, что фактор зрения (закрывание глаз), возможно, становится менее важным после применения СИ, что требует дальнейшего инструментального исследования.
В данной работе обнаружено, что ригидность суставов конечностей согласно шкале UPDRS-III во время острой однократной СИ довольно серьезно снижалась – примерно на 33%, причем как в руках, так и ногах. Вместе с тем, это клиническое улучшение не реализовалось в статистически значимое изменение стабилометрических параметров, которые было небольшим (<10%) и незначимым. В целом, для БП характерно подобное несоответствие между клиническими и инструментальными данными [8, 11, 13, 27–29]. Это, возможно, объясняется тем, что клинически (субъективно) определяемая ригидность и инструментальные методы измеряют близкие, но все же разнородные сигналы. Возможно также, что на уровне высокоинтегрированной функции, например, при выполнении вертикальной стойки, задействуются более сложные нервные механизмы, нивелирующие эффект СИ, который заметен при более простых заданиях, например, при односуставном движении или измерении ригидности при пассивном сгибании сустава.
ЗАКЛЮЧЕНИЕ
Полученные результаты показали, что такой компонент позного контроля, как ориентация тела в пространстве, исследованная при помощи стабилометрии во время вертикальной стойки, у больных паркинсонизмом и здоровых молодых испытуемых практически не изменяется после применения краткосрочной однократной и курсовой СИ. Вместе с тем, влияние однократной СИ становится более заметным и значимым к окончанию курса СИ. Применение пробы Ромберга с закрыванием глаз не повлияло на эффект однократной СИ и курса СИ на параметры стабилометрии. Клиническое обследование больных показало, что после сеанса СИ число баллов по шкале UPDRS-III статистически значимо снижается на 33%, мышечная ригидность – на 37%, тремор на 27%, акинезия – на 30%. Таким образом, наблюдается несоответствие между клиниметрически и инструментально измеряемыми величинами, что требует дальнейшего исследования с применением более прицельных инструментальных тестов, в которых следует учесть: 1) развитие стабилометрического сигнала во времени, 2) вклад проприоцепторов (стопной реакции) в поддержание вертикальной стойки и 3) направление траектории стабилограммы отдельно во фронтальной и сагиттальной плоскости. Вероятно, для окончательного решения вопроса о влиянии СИ на параметры спокойного стояния потребуется не только клиническое, но и инструментальное измерение ригидности, например, при помощи ЭМГ во время пассивного сгибания–разгибания конечности [30]. Также, можно измерить влияние СИ на вязко-эластические свойства скелетных мышц при помощи миотонометрии [31].
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом (объединенный этический комитет ПетрГУ и Министерства здравоохранения Республики Карелия, протокол № 31, 18.02.2015) (Петрозаводск, Республика Карелия).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках государственного задания Министерства науки и высшего образования РФ (тема № 0752-2020-0007).
Благодарности. Авторы благодарны добровольцам-испытуемым, которые согласились участвовать в исследовании.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Allen N.E., Schwarzel A.K., Canning C.G. Recurrent falls in Parkinson’s disease: A systematic review // Park. Dis. 2013. V. 2013. P. 906 274.
Paolucci T., Iosa M., Morone G. et al. Romberg ratio coefficient in quiet stance and postural control in Parkinson’s disease // Neurol. Sci. 2018. V. 39. № 8. P. 1355.
Błaszczyk J.W., Orawiec R. Assessment of postural control in patients with Parkinson’s disease: sway ratio analysis // Hum. Mov. Sci. 2011. V. 30. № 2. P. 396.
Mancini M., Carlson-Kuhta P., Zampieri C. et al. Postural sway as a marker of progression in Parkinson’s disease: a pilot longitudinal study // Gait Posture. 2012. V. 36. № 3. P. 471.
Corrêa P.S., Pagnussat A.S., Cabeleira M.E.P. et al. Is the dopaminergic loss associated with gait and postural impairments in subjects with Parkinson’s disease at different motor stages? // Eur. J. Neurosci. 2019. V. 50. № 12. P. 3889.
Pastor M.A., Day B.L., Marsden C.D. Vestibular induced postural responses in Parkinson’s disease // Brain. 1993. V. 116. Pt. 5. P. 1177.
Smith P.F. Vestibular functions and Parkinson’s disease // Front. Neurol. 2018. V. 9. P. 1085.
Wright W.G., Gurfinkel V.S., Nutt J. et al. Axial hypertonicity in Parkinson’s disease: direct measurements of trunk and hip torque // Exp. Neurol. 2007. V. 208. P. 38.
Konczak J., Corcos D.M., Horak F. et al. Proprioception and motor control in Parkinson’s disease // J. Mot. Behav. 2009. V. 41. № 6. P. 543.
Tagliabue M., Ferrigno G., Horak F. Effects of Parkinson’s disease on proprioceptive control of posture and reaching while standing // Neuroscience. 2009. V. 158. № 4. P. 1206.
Feller K.J., Peterka R.J., Horak F.B. Sensory Re-weighting for Postural Control in Parkinson’s disease // Front. Hum. Neurosci. V. 13. P. 126.
Hassan A., Vallabhajosula S., Zahodne L.B. et al. Correlations of apathy and depression with postural instability in Parkinson disease // J. Neurol. Sci. 2014. V. 338. № 1–2. P. 162.
Horak F.B., Frank J., Nutt J. Effects of dopamine on postural control in parkinsonian subjects: scaling, set, and tone // J. Neurophysiol. 1996. V. 75. № 6. P. 2380.
Nardone A., Schieppati M. Balance in Parkinson’s disease under static and dynamic conditions // Mov. Disord. 2006. V. 21. № 9. P. 1515.
Rocchi L., Chiari L., Cappello A., Horak F.B. Identification of distinct characteristics of postural sway in Parkinson’s disease: a feature selection procedure based on principal component analysis // Neurosci. Lett. 2006. V. 394. № 2. P. 140.
Meigal A., Gerasimova-Meigal L., Saenko I., Subbotina N. Dry immersion as a novel physical therapeutic intervention for rehabilitation of Parkinson’s disease patients: A feasibility study // Phys. Med. Rehab. Kuror. 2018. V. 28. № 5. P. 275.
Miroshnichenko G.G., Meigal A., Saenko I. et al. Parameters of Surface Electromyogram Suggest That Dry Immersion Relieves Motor Symptoms in Patients With Parkinsonism // Front. Neurosci. 2018. V. 12. P. 667.
Treffel L., Dmitrieva L., Gauquelin-Koch G. et al. Craniomandibular system and postural balance after 3-Day dry immersion // PLoS One. 2016. V 11. № 2. P. e0150052.
Tomilovskaya E., Shigueva T., Sayenko D. et al. Dry immersion as a ground-based model of microgravity physiological effects // Front. Physiol. 2019. V. 10. P. 284.
Müller T., Benz S., Przuntek H. Choice reaction time after levodopa challenge in parkinsonian patients // J. Neurol. Sci. 2000. V. 181. № 1–2. P. 98.
Pinto C., Salazar A.P., Marchese R.R. et al. The effects of hydrotherapy on balance, functional mobility, motor status, and quality of life in patients with Parkinson disease: A systematic review and meta-analysis // PM R. 2019. V. 11. № 3. P. 278.
Carroll L.M., Volpe D., Morris M.E. et al. Aquatic exercise therapy for people with Parkinson disease: A randomized controlled trial // Arch. Phys. Med. Rehabil. 2017. V. 98. № 4. P. 631.
Pérez de la Cruz S. Effectiveness of aquatic therapy for the control of pain and increased functionality in people with Parkinson’s disease: a randomized clinical trial // Eur. J. Phys. Rehabil. Med. 2017. V. 53. № 6. P. 825.
Nutt J.G., Burchiel K.J., Comella C.L. et al. Randomized, double-blind trial of glial cell line-derived neurotrophic factor (GDNF) in PD // Neurology. 2003. V. 60. № 1. P. 69.
Din S.D., Godfrey A., Coleman S. et al. Time-dependent changes in postural control in early Parkinson’s disease: What are we missing? // Med. Biol. Eng. Comput. 2016. V. 54. № 2–3. P. 401.
Peterka R.J. Sensorimotor integration in human postural control // J. Neurophysiol. 2002. V. 88. № 3. P. 1097.
Rätsep T., Asser T. The effect of subthalamic stimulation on viscoelastic stiffness of skeletal muscles in patients with Parkinson’s disease // Clin. Biomech. (Bristol, Avon). 2017. V. 44. P. 94.
Pullman S.L., Watts R.L., Juncos J.L. et al. Dopaminergic effects on simple and choice reaction time performance in Parkinson’s disease // Neurology. 1988. V. 38. № 2. P. 249.
Nardone A., Schieppati M. Balance in Parkinson’s disease under static and dynamic conditions // Mov. Disord. 2006. V. 21. № 9. P. 1515.
Ruonala V., Pekkonen E., Airaksinen O. et al. Levodopa-induced changes in electromyographic patterns in patients with advanced Parkinson’s disease // Front. Neurol. 2018. V. 9. P. 35.
Demangel R., Treffel L., Py G. et al. Early structural and functional signature of 3-day human skeletal muscle disuse using the dry immersion model // J. Physiol. 2017. V. 595. № 13. P. 4301.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


