Физиология человека, 2021, T. 47, № 3, стр. 20-30
Асимметрия показателей окуломоторного контроля при выполнении антисаккад у носителей полиморфных Val158Met вариантов гена катехоламин-о-метилтрансферазы
А. В. Киренская 1, *, А. М. Рябова 2, М. Грудень 3, В. Ю. Новотоцкий-Власов 1, З. И. Сторожева 1
1 ФГБУ Федеральный медицинский исследовательский центр психиатрии и наркологии
имени В.П. Сербского Минздрава России
Москва, Россия
2 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
3 ФГБУ Научно-исследовательский институт нормальной физиологии
имени П.К. Анохина ФАНО
Москва, Россия
* E-mail: neuro11@yandex.ru
Поступила в редакцию 09.01.2021
После доработки 21.01.2021
Принята к публикации 09.02.2021
Аннотация
В работе проведена комплексная оценка влияния полиморфизма Val158Met гена катехоламин-О-метилтрансферазы (КОМТ) на качество выполнения антисаккад (АС) и характеристики медленных потенциалов. Анализ характеристик саккад включал сторону предъявления стимула и направление саккады. В исследовании приняли участие 43 добровольца мужского пола. У носителей аллеля val показатель вариативности латентности саккад (коэффициент вариации – Квар) был выше по сравнению с носителями генотипа met/met, при значимых различиях для саккад на стимул слева (направленных вправо). Наряду с этим, у носителей генотипа val/val была увеличена амплитуда негативного отклонения, которое отражает активацию коры, в лобных отделах коры относительно носителей генотипа met/met. Эти результаты свидетельствуют об определенном преимуществе носителей генотипа met/met в выполнении АС. Для разных генотипов обнаружены специфичные асимметрии: у носителей гомозиготы met/met процент ошибок был почти вдвое выше в ответ на стимул слева, чем на стимул справа; у носителей аллеля val латентный период саккад и Квар на стимул слева были значимо выше, чем на стимул справа. Проведенный анализ показал относительное снижение эффективности правого полушария у носителей генотипа met/met, и левого полушария – у носителей генотипа val/val.
Ведущая роль в произвольном контроле поведения принадлежит префронтальной коре (ПФК). Активность нейронных сетей ПФК ассоциируется с такими когнитивными процессами как планирование, программирование и мониторинг поведения, селективное внимание, рабочая память, торможение реакций на внешние нерелевантные раздражители, оценка полученных результатов и др. [1, 2]. В англоязычной литературе эти функции объединяются термином “исполнительные функции” (executive functions).
Влияние восходящей мезокортикальной дофаминэргической (ДА) системы на ПФК рассматривается как важный фактор в обеспечении ее функций. ДА денервация дорзолатеральной ПФК сопровождается когнитивными нарушениями, выраженность которых сравнима с поражением или инактивацией ПФК [3]. Дофамин (ДА) осуществляет непрямое модулирующее влияние на нейроны ПФК через усиление или ослабление активности ДА рецепторов, синаптической трансмиссии и обеспечение оптимального уровня соотношения сигнал/шум [4, 5].
Фермент катехол-О-метилтрансфераза (КОМТ), метаболизирующий катехоламины, является одним из ключевых звеньев регуляции уровня ДА в префронтальной коре. Полиморфизм rs4680 (Val158Met) гена КОМТ оказывает влияние на активность фермента таким образом, что у “валинового” варианта активность КОМТ в 3–4 раза выше, чем у “метионинового” [6], и это обуславливает более низкое содержание ДА у носителей аллеля Val. Как полагают, низкий уровень ДА в ПФК снижает эффективность ДА нейротрансмиссии и оказывает влияние на когнитивные функции, опосредуемые ПФК.
В тесте с антисаккадами (АС) задача испытуемого состоит в том, чтобы в ответ на предъявление периферического целевого стимула перевести взгляд в противоположную сторону, симметрично относительно центра зрительного поля [7]. Парадигма АС широко используется для изучения когнитивных процессов, в обеспечении которых ПФК принадлежит ведущая роль, таких как программирование произвольных движений глаз, торможение рефлекторных саккад, зрительно-пространственная рабочая память и др. [8, 9]. Выполнение АС ассоциируется с активацией фронтальных кортикальных полей – дорзолатеральной ПФК, передней поясной извилины, орбитофронтальной коры, фронтального и дополнительного полей глаз [10].
АС относятся к потенциальным эндофенотипам шизофрении [11], т.е. на параметры выполнения теста существенное влияние оказывают генетические факторы, и с этим связан интерес к АС в генетических исследованиях.
Данные литературы об ассоциации полиморфизма rs4680 гена КОМТ c особенностями выполнения АС противоречивы. В ряде работ не выявлено влияния фактора генотипа на выполнение АС [12–15]. В нашем предыдущем исследовании [16] также не было обнаружено значимых различий по показателям выполнения АС у психически здоровых носителей разных вариантов rs4680. В двух исследованиях у носителей валиновой гомозиготы обнаружено преимущество в качестве выполнения АС: в группе val/val латентный период и его индивидуальная вариативность были ниже [17], а количество правильных ответов – выше [18] по сравнению с другими вариантами генотипа КОМТ. Во всех этих работах оценивали только поведенческие характеристики выполнения АС, вычисленные без учета стороны предъявления стимула и направления саккады. Однако, исходя из сведений об асимметрии ДА системы, более тесно связанной с левым полушарием и моторной функцией [19, 20], включение фактора направления в анализ представляется целесообразным.
Регистрация корковых потенциалов, связанных с событиями, при выполнении АС позволяет изучать характеристики активности мозга в период планирования и подготовки поведенческого ответа, моделью которого является АС. При обратном усреднении электроэнцефалограммы (ЭЭГ) от момента предъявления стимула-мишени получают вызванный потенциал, аналогичный условно-негативной волне (или CNV – Contingent Negative Variation) [21, 22]. Показано, что медленное негативное отклонение на поверхности коры отражает активацию больших клеточных групп неокортекса, направленную на фасилитацию процессов обработки стимулов и подготовки моторного выхода [23, 24]. Исследования характеристик медленных потенциалов, связанных с выполнением АС, также как и результаты функциональных магнитно-резонансных томографических (фМРТ) исследований, свидетельствуют об усилении активации фронтальных отделов коры у здоровых лиц [21, 22, 25, 26]. В связи с полиморфизмом rs4680 гена КОМТ исследования условно-негативной волны (УНВ) до настоящего времени не проводили.
Таким образом, актуальным представляется проведение комплексной оценки влияния rs4680 на качество выполнения АС, с включением в анализ стороны предъявления стимула и направления саккады, и на функциональную активность коры мозга по показателям амплитуды и топографии условно-негативной волны. Принимая во внимание сведения о влиянии пола на эффекты rs4680 [27–29], в исследование были включены испытуемые мужского пола.
МЕТОДИКА
В исследовании принимали участие 43 психически и неврологически здоровых добровольцев в возрасте от 19.7 до 40.5 лет (средний возраст 24.66 ± 3.72 лет). Все испытуемые были праворукими мужчинами. Испытуемые были разделены на три группы по генотипу КОМТ. В группу носителей генотипа met/met вошли 15 чел., в группу val/met – 15 чел., в группу val/val – 13 чел.
Выделение ДНК из образцов слюны и определение полиморфизма КОМТ проводили с использованием соответствующих наборов фирмы “Литех” (Россия).
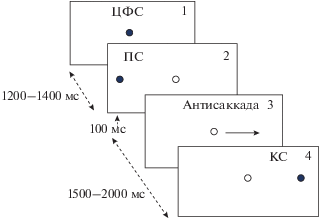
Испытуемые выполняли тест с АС, в котором давалась инструкция совершить саккаду в точку, расположенную в противоположном зрительном поле симметрично периферическому стимулу (ПС). Для зрительной стимуляции использовали три красных светодиода, расположенных на табло по горизонтальной линии на уровне глаз испытуемого на расстоянии 120 см. Светодиод в центре зрительного поля служил в качестве центрального фиксационного стимула (ЦФС), а светодиоды, расположенные в 10° справа и слева от ЦФС – ПС. Длительность предъявления ЦФС составляла от 1200 до 1400 мс, ПС включался на 100 мс одновременно с выключением ЦФС; затем через 2200 мс появлялся “коррекционный” стимул (КС) в точке, симметричной ПС (рис. 1). Инициация каждой реализации стимулов совершалась самим испытуемым нажатием клавиши. В ходе эксперимента испытуемым предъявляли 3 блока зрительных стимулов по 45 реализаций в каждом.
Рис. 1.
Схема стимуляции в задаче с антисаккадами. ЦФС – центральный фиксационный стимул, ПС – периферический стимул, КС – коррекционный сти-мул.
Исследования проводили в затемненной экранированной кабине. ЭЭГ регистрировали от 19 стандартных отведений, монополярно на нейрокартографе фирмы “МБН” (Россия) с постоянной времени 0.3 с. Регистрацию движений глаз осуществляли с помощью электроокулограммы (ЭОГ, 2 канала). Управление экспериментом, сбор и хранение данных проводили с использованием компьютера IBM PC.
В ходе анализа ЭЭГ предварительно производили полуавтоматическое подавление окулографических артефактов с использованием специально разработанной программы, основанной на факторном анализе ЭЭГ [30], с последующей визуальной отбраковкой реализаций, в которых артефакты остались. Начало саккад определяли автоматически по сигналу ЭОГ.
В анализ включали только регулярные саккады с латентностью от 120 мс. Качество выполнения теста оценивали как количество (в %) правильных саккад и ошибочных саккад (направленных к ПС). Для правильных саккад вычисляли средние значения латентного периода (ЛП) и его вариативности (как коэффициент вариации – Квар). Все вычисления проводили отдельно для саккад, направленных вправо и влево.
Для получения медленных потенциалов ЭЭГ производили трансформацию записи ЭЭГ к постоянной времени 5 с [31]. Для каждого испытуемого проводили обратное усреднение ЭЭГ, триггером для которого служил момент включения периферического целевого стимула. Усредняли отрезки записи ЭЭГ на интервале 1400 мс до и 500 мс после ПС. Медленные потенциалы получали только для правильных саккад. Среднюю амплитуду потенциалов оценивали в интервале 1000 мс до ПС. В качестве базовой линии использовали среднее значение потенциалов за 100 мс перед началом эпохи анализа. Для проведения количественной обработки данных с учетом динамики изменений потенциалов было выбрано 2 интервала: интервал I от 1000 до 800 мс до ПС, интервал II – последние 200 мс до ПС.
Для комплексной оценки характеристик выполнения АС и медленных потенциалов применяли дисперсионный анализ ANOVA с повторными измерениями и сравнение средних (Т-тест). Анализ характеристик саккад проводили по факторам “Генотип” и “Стимул” (в правом и левом полуполях). При анализе амплитуды потенциалов использовали ее средние значения в интервалах I и II в 13 отведениях (Fp1, Fp2, Fz, F3, F4, Cz, C3, C4, Pz, P3, P4, O1, O2). ANOVA проводили по факторам “Генотип”, “Область”, “Полушарие”. Наряду с этим, анализировали статистически значимые корреляции (по Спирмену) между характеристиками саккад и амплитудой медленных потенциалов отдельно для разных вариантов генотипа КОМТ. Для статистического анализа использовали пакеты программ SPSS 11.0 и STATISTICA 6.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для изучения ассоциаций показателей АС с полиморфными вариантами гена КОМТ применяли различные модели – аллельные, аддитивные (сравнение носителей гомозигот) и неаддитивные (носители гомо- и гетерозиготные), с объединением носителей одного аллеля в единую когорту.
Характеристики выполнения антисаккад. Анализ характеристик саккад для объединенных показателей на стимулы справа и слева не показал значимых различий у испытуемых с разными вариантами генотипа КОМТ.
Однако при раздельном анализе ошибочных саккад на стимулы слева и справа обнаружено взаимодействие факторов “Генотип” и “Сторона стимула” (F(2, 41) = 3.47, p = 0.041). Апостериорный анализ показал, что в подгруппе носителей генотипа met/met количество ошибок на стимул слева было значимо (р = 0.0017) выше, чем на стимул справа (рис. 2, А).
Рис. 2.
Характеристики выполнения теста с антисаккадами в подгруппах испытуемых с разными вариантами генотипа КОМТ. А – процент ошибок в ответ на стимулы слева (а) и справа (б). ** – p < 0.01 при парном сравнении в группе Met/Met. Б – латентный период саккад в ответ на стимулы слева (а) и справа (б). * – p < 0.05 при парном сравнении в группе Val/Val. В – вариативность латентного периода (Квар) у носителей генотипов Met/Met (1), Val/Met (2) и Val/Val (3). * – p < 0.05 при парном сравнении Квар на стимулы справа и слева в группе Val/Val + Val/Met; # – p < 0.05 при сравнении с соответствующим показателем в группе Met/Met.

Анализ латентного периода АС выявил значимый эффект фактора “Сторона стимула” (F(1, 42) = = 10.29, p = 0.003) независимо от генотипа, при этом, согласно результатам апостериорного сравнения, только в группе val/val ЛП на стимул слева был значимо выше, чем на стимул справа (р = = 0.037) (рис. 2, Б).
Наиболее низкие значения вариативности ЛП (Квар) наблюдались в группе met/met, наиболее высокие – в группе val/val (рис. 2, В). Достоверные различия получены при сравнении носителей метиониновой гомозиготы met/met с объединенной группой носителей валинового аллеля (val/val + val/met) – обнаружена значимость взаимодействия “Генотип × Сторона стимула” (F(1, 41) = = 5.84, p = 0.020). Анализ средних показал значимо (р = 0.034) более высокие значения вариативности латентности (Квар) у носителей валинового аллеля, по сравнению с группой met/met в ответ на стимул слева. Кроме того, парное сравнение значений Квар в группе носителей валинового аллеля на стимулы справа и слева также показало достоверно более высокие значения этого показателя в ответ на стимул слева (р = 0.037).
Характеристики саккадических потенциалов. Характеристики зарегистрированного комплекса медленных потенциалов, развивающихся в период ожидания ПС, в целом, соотносятся, с полученными ранее, в аналогичных условиях предъявления стимулов [26]. Интервалы анализа I и II УНВ соответствуют раннему и позднему этапам саккадической преднастройки. Во всех группах ранний этап УНВ характеризовался зоной негативности в лобно-центральной области. На позднем этапе зона негативности смещалась в левое полушарие, и наблюдалось два фокуса негативности: лобный и теменно-затылочный (рис. 3). Раннюю фазу негативности рассматривают как аналог ориентировочного компонента условно-негативной волны, который связан с когнитивными процессами мотивации, ожидания, внимания и принятия решения. Ведущая роль в осуществлении этих функций принадлежит лобным отделам коры мозга. Поздняя фаза негативной волны отражает предварительную активацию премоторных цепей различного уровня, непосредственно участвующих в осуществлении моторного ответа [21, 26, 32].
Рис. 3.
Карты распределения медленных негативных потенциалов по амплитуде в интервалах I (слева) и II (справа) в группах с разным генотипом КОМТ.

Анализ ANOVA, проведенный по схеме: 3 Генотипа × 2 Интервала × 5 Областей (Fp1, 2; F3, 4; C3, 4; P3, 4; O1, 2) × 2 Полушария – показал значимость взаимодействий “Интервал × Генотип × Область × × Полушарие” (F(1, 144) = 2.48, p = 0.015) и “Генотип × Область × Полушарие” (F(2, 144) = 2.00, p = 0.05). Таким образом, топография и динамика изменений негативной волны различались в группах испытуемых с разными вариантами генотипа КОМТ. Дальнейший анализ показал, что отличия между группами с разными генотипами относятся, главным образом, к лобным электродам Fp1, Fp2, Fz, F3, F4, что соответствует представлениям о роли КОМТ в префронтальной коре. Исходя из этого, анализировали данные только для лобных отведений, уделяя особое внимание гомозиготным вариантам генотипа Val158Met.
Сравнение генотипов met/met и val/val показало, что во всех отведениях, кроме правого передне-височного (Fp2) амплитуда негативного отклонения была выше в группе носителей валиновой гомозиготы (рис. 4).
Рис. 4.
Амплитуда медленных потенциалов в лобных отведениях в группах с генотипом Met/Met (1) и Val/Val (2) в интервалах анализа I (А) и II (Б). Уровень значимости: * – p < .05; # – p < .06.

При сравнении по 4 отведениям (Fp1, Fp2, F3, F4) по схеме: 2 интервала, 2 области × 2 полушария, был значимым фактор “Генотип × Полушарие” (F(1, 24) = 4.47, p = 0.045). В интервале I достоверным было взаимодействие “Генотип × × Область” (F(1, 26) = 4.41, p = 0.046). Фактор “Генотип” был значимым на уровне тенденции (F(1, 26) = 3.79, p = 0.062), в связи с более высокими значениями негативности в группе с генотипом val/val. Увеличение амплитуды негативности в группе носителей гомозиготы val/val статистически подтверждается также сравнением амплитуды потенциалов в отведениях левого полушария и средней линии в группах met/met и val/val (Fp1, Fz, F3): F(1, 26) = 5.15, p = 0.032. Сравнение средних выявило тенденцию к значимости при сравнении амплитуд медленных потенциалов в отведениях Fp2 (p = 0.054) и F4 (p = 0.071), обусловленную более высокой амплитудой негативности в F4 и позитивности – в Fp2 в группе val/val. В интервале II, достоверным на уровне тенденции, было взаимодействие “Генотип × Полушарие” (F(1, 24) = 4.00, p = 0.057). Значимость различий обусловлена высокими значениями негативности в левом полушарии и позитивности – в правом в группе val/val, и отсутствием такой закономерности в группе met/met.
При сравнении объединенной группы носителей аллеля met (met/met + val/met) и гомозиготы val/val межгрупповые отличия найдены только в интервале I – для основного фактора “Генотип” (F(1, 41) = 4.85, p = 0.033) и взаимодействия “Генотип × Область” (F(1, 41) = 3.90, p = 0.055). Сравнение средних показало достоверные (p = = 0.013) различия для правого лобного отведения F4, в котором в группе val/val регистрировалось негативное отклонение (−0.95 ± 0.53 мкВ), а в группе носителей аллеля met – слабая позитивность (+0.09 ± 0.13 мкВ).
Корреляции характеристик выполнения АС и амплитуды УНВ. С тем, чтобы изучить взаимосвязь между характеристиками выполнения АС и корковой активностью вычисляли корреляции между характеристиками саккад и амплитудой медленных потенциалов. В анализ были включены статистически значимые (p < 0.05) корреляции.
В группах носителей генотипов met/met и val/val были получены различные корреляционные паттерны (табл. 1).
Таблица 1.
Достоверные (p < 0.05) корреляции (по Спирмену) между характеристиками саккад и амплитудой медленных потенциалов в группах с генотипами met/met и val/val
| Показатели | Группа | ||
|---|---|---|---|
| met/met | val/val | ||
| Ошибки, % | На стимул слева | 11-Fz (r = -.58*); 2-Fz (r = -.66*) |
1-Fp2 (r = -.81***); 1-F4 (r = .64*); 1-O1 (r = .57*) |
| На стимул справа | − | 1-Fp2 (r = -.89***); 1-F4 (r = .67*); 1-O1 (r = .68*); 2-O1 (r = .64*) |
|
| Все | 1-Fp1 (r = .51*); 1-Fz (r = -.71**) |
1-Fp2 (r = -.87***); 1-F4 (r = .64*); 1-O1 (r = .65*) |
|
| Латентность, мс | На стимул слева | − | − |
| На стимул справа | 1-Fp2 (r = -.59*) | 2-Fp1 (r = -.66*) | |
| Все | 2-Fp1 (r = -.59*) | ||
| Квар, % | На стимул слева | 1-P4 (r = .61*); 2-P3 (r = .61*) |
1-Cz (r = -.59*) |
| На стимул справа | 1-P3 (r = -.62*); 2-P4 (r = .58*) |
1-C3 (r = -.64*) | |
| Все | 1-P4 (r = .60*); 2-P4 (r = .78**) |
− | |
Показатель процента ошибок в обеих группах ассоциировался с амплитудой медленных потенциалов в лобных отведениях. В группе met/met 4 из 11 корреляций (36.4%) относились к проценту ошибок, который коррелировал с амплитудой потенциалов в медиальном лобном (Fz) и левом передне-лобном (Fp1) отведениях, 3 корреляции из 4 найдены для интервала I (табл. 1). При этом корреляции с Fz носили парадоксальный характер – увеличение амплитуды негативности ассоциировалось с увеличением количества ошибок.
В группе val/val к показателю процента ошибок относилось большинство корреляций – 10 из 14 (71.4%), из них 9 – к интервалу I, при этом 6 корреляций найдено для лобных отведений правого полушария (Fp2 и F4), 4 – для левого затылочного отведения – O1. Увеличение амплитуды негативных потенциалов в зоне негативности в правой лобной области (F4) коррелировало со снижением количества ошибок. Кроме того, в этой группе со снижением количества ошибочных саккад ассоциировалось увеличение амплитуды негативности в зоне O1 и увеличение амплитуды позитивности в зоне Fp2. То есть успешное выполнение теста ассоциировалось с определенным паттерном распределения зон негативности и позитивности по коре.
Для ЛП саккад в обеих группах найдены единичные корреляции с отведениями Fp1 и Fp2.
С вариативностью латентности саккад (Квар) в группе met/met выявлено 54.5% корреляций (6/11), которые относились к теменным отведениям левого и правого полушария и двум интервалам анализа (табл. 1). Парадоксальный характер ассоциации наблюдался только для отведения P3 в интервале I. В группе val/val лишь 2 корреляции из 10 относились к Квар (табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный анализ характеристик саккад без учета стороны предъявления стимула не обнаружил значимых эффектов полиморфизма rs4680 гена КОМТ, что согласуется с результатами исследований, проведенных ранее [12–16]. Однако анализ, проведенный с учетом стороны предъявления стимула, позволил обнаружить следующие различия. Носители разных вариантов генотипа КОМТ отличались по показателю вариативности латентного периода правильных саккад (Квар) – у носителей аллеля val Квар был выше по сравнению с носителями гомозиготы met/met, при значимых различиях для саккад на стимул слева (направленных вправо). Этот результат свидетельствует об определенном преимуществе в выполнении теста носителей генотипа met/met. Кроме того, выявлены специфичные для каждой из групп асимметрии показателей. Для носителей гомозиготы met/met обнаружена асимметрия по показателю процента ошибок, который был почти вдвое выше в ответ на стимул слева. Для носителей гомозиготы val/val латентный период саккад на стимул слева был значимо выше, чем на стимул справа; а у носителей аллеля val показатель Квар был выше для саккад на стимул слева.
Для понимания выявленных различий необходимо учитывать физиологические процессы, которые включают показатели выполнения АС. Стимул, предъявленный в левом полуполе, попадает в правое полушарие, в котором осуществляется торможение рефлекторных саккад к ПС. Для успешной реализации этой задачи необходимо удержание внимания с опорой на внутренние репрезентации программы поведения. Соответственно, повышенный процент ошибок на стимул слева у носителей генотипа met/met, очевидно, отражает сниженный уровень функциональной активности правого полушария относительно левого.
Латентный период саккад (ЛП) и его вариативность связаны с подготовкой и реализацией моторной программы саккады, которые осуществляются в контрлатеральном направлению саккады полушарии. ЛП был удлинен, а Квар – увеличен у носителей аллеля val для правосторонних саккад (на стимул слева). Показатель вариативности ЛП саккад отражает функциональное состояние нейронных сетей ПФК, отвечающих за окуломоторный контроль и, по некоторым данным, также рассматривается как вероятный кандидат в эндофенотипы шизофрении [33]. Согласно результатам нейрональных исследований, проводившихся на приматах, время реакции в саккадических задачах определяется временем нарастания нейрональной активности во фронтальном поле глаз до порогового уровня, необходимого для генерации саккады [34]. Экспериментальное снижение уровня ДА в ПФК, выполненное на животных моделях шизофрении, сопровождалось дезорганизованной хаотичной импульсацией нейронов [35], следствием которой может быть увеличение вариативности времени реакции моторных ответов. Генотип Val158Met связывают с уровнем физиологического “шума” в ПФК, и носителям гомозиготы по валину свойственны наибольшие его значения [36], что, по-видимому, проявляется в повышении вариативности латентности саккад. Ранее было показано существенное увеличение этого показателя у больных шизофренией – носителей аллеля val [16, 37]. Таким образом, характер асимметрии показателей ЛП и Квар у носителей аллеля val свидетельствует об относительном снижении эффективности функций левого полушария.
Асимметрия влияния полиморфизма rs4680 гена КОМТ на межполушарный баланс может иметь, с одной стороны, отношение к латеральным особенностям ДА системы, которая связана преимущественно с левым полушарием и моторной функцией [20], а с другой – доминантностью левого полушария в процессах, связанных с моторным вниманием и подготовкой моторного ответа [19, 32]. Принимая во внимание реципрокный характер регуляции межполушарного баланса, можно ожидать его смещение в сторону левого полушария при генотипе met/met, который соотносится с низкой активностью КОМТ и повышенным уровнем нейротрансмиссии ДА в ПФК [6], а при генотипе val/val – в сторону правого полушария. Полученные результаты согласуются с данными об ассоциации между полиморфизмом rs4680 гена КОМТ и мануальной асимметрией [38].
Расхождения полученных результатов с исследованиями [17, 18], в которых у здоровых носителей генотипа val/val найдено более высокое качество выполнения АС, в том числе сниженная вариативность ЛП [17], может быть обусловлено методическими причинами, а именно существенными отличиями в экспериментальных схемах и включением в исследования смешанных по признаку пола выборок испытуемых.
Анализ медленных потенциалов обнаружил существенные различия между генотипами met/met и val/val в лобных отделах коры, и это согласуется с данными литературы о роли полиморфизма Val158Met гена КОМТ в модуляции уровня дофамина в ПФК [39] и влиянии на активацию и функции префронтальной коры [40]. В подгруппе с генотипом val/val амплитуда УНВ была увеличена в лобных отведениях, соответствующих ПФК, при значимых различиях с носителями гомозиготы met/met и с объединенной группой носителей аллеля met. При отсутствии преимуществ в качестве выполнения теста с антисаккадами, это свидетельствует о снижении функциональной эффективности префронтальной активации у здоровых испытуемых с валиновым полиморфизмом КОМТ. Полученные результаты согласуются с данными исследований тестов на рабочую память (N-back) [41] и на тормозный когнитивный контроль [42] с регистрацией активности мозга с помощью фМРТ, в которых найден более высокий уровень активации дорзолатеральной ПФК у носителей val аллеля по сравнению с носителями гомозиготы met/met при близком уровне выполнения тестов.
Кроме того, для группы val/val было характерно смещение межполушарного баланса активации в сторону правого полушария, что проявилось в увеличении амплитуды негативности в F4, по сравнению с подгруппой носителей аллеля met. Выявленные изменения согласуются с результатами анализа характеристик саккад.
На особенности в стратегии выполнения АС и различной функциональной организации нейронных сетей мозга, обеспечивающих выполнение АС у носителей met/met и val/val вариантов rs4680, указывают различия в профиле корреляционных связей между показателями выполнения теста и амплитудой медленных потенциалов.
Показатель количества ошибок в обеих группах ассоциировался, преимущественно, с амплитудой потенциалов в лобных отведениях в интервале I. Однако в группе c генотипом met/met корреляции найдены для отведений левого полушария и средней линии, а в группе c генотипом val/val – для лобных отведений правого полушария, что, по-видимому, обусловлено особенностями межполушарного баланса в исследуемых группах.
В группе met/met большинство корреляций относилось к Квар и теменным отведениям. Эта ассоциация представляется закономерной, т.к. задняя теменная кора связана со зрительно-пространственной рабочей памятью, а также является главным выходом зрительной системы в подкорковые окуломоторные центры [26, 32]. В группе val/val найдены лишь единичные корреляции с показателем Квар.
При рассмотрении корреляций между уровнем активации коры и характеристиками саккад в группе met/met обращает внимание их парадоксальный характер, т.е. повышение амплитуды негативности ассоциировалось с ухудшением выполнения теста. Одним из механизмов подобной ассоциации может быть нелинейная инвертированная U-образная зависимость между уровнем ДА и функциональной активностью ПФК [43].
Вместе с тем, для показателя Квар парадоксальные корреляции с амплитудой потенциалов обнаружены для обоих генотипов. Можно предположить, что регуляция этого показателя не коррелирует непосредственно с уровнем активации коры, и обеспечивается другими механизмами.
ЗАКЛЮЧЕНИЕ
Результаты исследования свидетельствуют об ассоциации между полиморфизмом Val158Met гена КОМТ и межполушарной асимметрией. Результаты анализа характеристик саккад показали относительное снижение эффективности правого полушария в группе met/met, и левого – в группе val/val. Правостороннее смещение межполушарного баланса в группе val/val в лобной области подтверждается увеличенной амплитудой негативного отклонения в зоне F4. Преимущество в выполнении АС найдено для носителей генотипа met/met, у которых, по сравнению с носителями аллеля val, вариативность латентности саккад на стимул слева была достоверно меньше, а амплитуда негативного отклонения в лобных отделах коры – ниже.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Национального медицинского исследовательского центра психиатрии и наркологии им. В.П. Сербского Минздрава России (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписан-ное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Goldman-Rakic P.S. Cellular basis of working memory // Neuron. 1995. V. 14. № 3. P. 477.
Miller E.K., Cohen J.D. An integrative theory of prefrontal cortex function // Annu. Rev. Neurosci. 2001. V. 24. P. 167.
Funahashi S., Bruce C.J., Goldman-Rakic P.S. Dorsolateral prefrontal lesions and oculomotor delayed-response performance: evidence for mnemonic “scotomas” // J. Neurosci. 1993. V. 13. № 4. P. 1479.
Ott T., Nieder A. Dopamine and Cognitive Control in Prefrontal Cortex // Trends Cogn. Sci. 2019. V. 23. № 3. P. 213.
Vijayraghavan S., Major A.J., Everling S. Neuromodulation of prefrontal cortex in non-human primates by dopaminergic receptors during rule-guided flexible behavior and cognitive control // Front. Neural Circuits. 2017. V. 11. P. 91.
Chen J., Lipska B.K., Halim N. et al. Functional analysis of genetic variation in catechol-O-methyltransferase (COMT): efects on mRNA, protein, and enzyme activity in postmortem human brain // Am. J. Hum. Genet. 2004. V. 75. № 5. P. 807.
Hallett P.E. Primary and secondary saccades to goals defined by instructions // Vision Res. 1978. V. 18. № 10. P. 1279.
Levy D.L., Mendell N.R., Holzman P.S. The antisaccade task and neuropsychological tests of prefrontal cortical integrity in schizophrenia: empirical findings and interpretative considerations // World Psychiatry. 2004. V. 3. № 1. P. 32.
Hutton S.B., Ettinger U. The antisaccade task as a research tool in psychopathology: A critical review // Psychophysiology. 2006. V. 43. № 3. P. 302.
McDowell J.E., Dyckman K.A., Austin B.P., Clementz B.A. Neurophysiology and neuroanatomy of reflexive and volitional saccades: Evidence from studies of humans // Brain Cogn. 2008. V. 68. № 3. P. 255.
Turetsky B.I., Calkins M.E., Light G.A. et al. Neurophysiological endophenotypes of schizophrenia: The viability of selected candidate measures // Schizophr. Bull. 2007. V. 33. № 1. P. 69.
Ettinger U., Kumari V., Collier D.A. et al. Catechol-O-methyltransferase (COMT) val158met genotype is associated with BOLD response as a function of task characteristic // Neuropsychopharmacol. 2008. V. 33. № 13. P. 3046.
Kattoulas E., Evdokimidis I., Stefanis N.C. et al. Monitoring antisaccades: inter-individual differences in cognitive control and the influence of COMT and DRD4 genotype variations // Exp. Brain Res. 2010. V. 203. № 2. P. 453.
Kasparbauer A.-M., Merten N., Aichert D.S. et al. Association of COMT and SLC6A3 polymorphisms with impulsivity, response inhibition and brain function // Cortex. 2015. V. 71. P. 219.
Demily C., Louchart-de-la-Chapelle S., Nkam I. et al. Does COMT val158met polymorphism influence P50 sensory gating, eye tracking or saccadic inhibition dysfunctions in schizophrenia? // Psychiatry Res. 2016. V. 246. P. 738.
Kirenskaya A.V., Storozheva Z.I., Gruden M.A., Sewell R.D.E. COMT and GAD1 gene polymorphisms are associated with impaired antisaccade task performance in schizophrenic patients // Eur. Arch. Psychiatry Clin. Neurosci. 2018. V. 268. № 6. P. 571.
Haraldsson H.M., Ettinger U., Magnusdottir B.B. et al. Catechol-O-methyltransferase Val 158 Met polymorphism and antisaccade eye movements in schizophrenia // Schizophr. Bull. 2010. V. 36. № 1. P. 157.
Cameron I.G.M., Wallace D.L., Al-Zughoul A. et al. Effects of tolcapone and bromocriptine on cognitive stability and flexibility // Psychopharmacology (Berl). 2018. V. 235. № 4. P. 1295.
Tucker D.M., Williamson P.A. Asymmetric neural control systems in human self-regulation // Psychol. Rev. 1984. V. 91. № 2. P. 185.
Хомская Е.Д. Об асимметрии блоков мозга. Нейропсихология сегодня. М.: МГУ, 1995. С. 14.
Славуцкая М.В., Шульговский В.В. Потенциалы головного мозга человека перед антисаккадами // Журн. высш. нервн. деят. им. И.П. Павлова. 2004. Т. 54. № 3. С. 320. Slavutskaia M.V., Shul’govski V.V. [Potential of the human cerebral cortex prior to antisaccades] // Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 2004 V. 54. № 3. P. 320.
Klein C., Heinks T., Andresen B. et al. Impaired modulation of the saccadic contingent negative variation preceeding antisaccades in schizophrenia // Biol. Psychiatry. 2000. V. 47. № 11. P. 978.
Birbaumer N., Elbert T., Canavan A.G.M., Rockstroh B. Slow potentials of cerebral cortex and behavior // Physiol. Rev. 1990. V. 70. № 1. P. 1.
Brunia C.H., van Boxtel G.J., Böcker K.B. et al. Negative slow waves as indices of anticipation: the Bereitschaftspotential, the contingent negative variation, and the stimulus-preceding negativity / The Oxford Handbook of Event-related Potential Components // Eds. Luck S., Kappenman E. New York, NY: Oxford University Press, Inc., 2012. P. 196.
Everling S., Krappmann P., Flohr H. Cortical potentials preceding pro- and antisaccades in man // Electroencephalogr. Clin. Neurophysiol. 1997. V. 102. № 4. P. 356.
Kirenskaya A.V., Myamlin V.V., Novototsky-Vlasov V.Y. et al. The contingent negative variation laterality and dynamics in antisaccade task in normal and unmedicated schizophrenic subjects // Span. J. Psychol. 2011. V. 14. № 2. P. 869.
Papaleo F., Sannino S., Piras F., Spalletta G. Sex-dichotomous effects of functional COMT genetic variations on cognitive functions disappear after menopause in both health and schizophrenia // Eur. Neuropsychopharmacol. 2015. V. 25. № 12. P. 2349.
Sannino S., Gozzi A., Cerasa A. et al. Genetic Reduction Produces Sexually Divergent Effects on Cortical Anatomy and Working Memory in Mice and Humans // Cereb. Cortex. 2015. V. 25. № 9. P. 2529.
Wu S., Upadhyay N., Lu J. et al. Interaction of Catechol-O-methyltransferase Val158Met polymorphism and sex influences association of parietal intrinsic functional connectivity and immediate verbal memory // Brain Behav. 2020. V. 10. № 10. P. e01784.
Новотоцкий-Власов В.Ю., Гарах Ж.В., Ковалев В.П. Метод подавления повторяющихся артефактов в многоканальной записи ЭЭГ // Физиология человека. 2007. Т. 33. № 2. С. 115. Novototsky-Vlasov V.Yu., Garah J.V., Kovalev V.P. A Method for Repetitive Artifact Suppression in Multichannel EEG Recordings // Human Physiology. 2007. V. 33. № 2. P. 231.
Ruchkin D.S., Sutton S., Mahaffey D., Glaser J. Terminal CNV in theabsence of motor response // Electroencephalogr. Clin. Neurophysiol. 1986. V. 63. № 5. P. 445.
Khonsari R.H., Lobel E., Milea D. et al. Lateralized parietal activity during decision and preparation of saccades // Neuroreport. 2007. V. 18. № 17. P. 1797.
Smyrnis N., Karantinos T., Malogiannis I. et al. Larger variability of saccadic reaction times in schizophrenia patients // Psychiatry Res. 2009. V. 168. № 2. P. 129.
Schall J.D. The neural selection and control of saccades by the frontal eye field // Phil. Trans. R. Soc. Lond. B. 2002. V. 357. № 1424. P. 1073.
O’Donnell P., Lewis B.L., Lerman D. et al. Effects of neonatal hippocampal lesions on prefrontal cortical pyramidal cell responses to VTA stimulation // Soc. Neurosci. Abstract. 1999. V. 25. P. 1659.
Winterer G., Coppola R., Goldberg T.E. et al. Prefrontal broadband noise, working memory, and genetic risk for schizophrenia // Am. J. Psychiatry. 2004. V. 161. № 3. P. 490.
Ira E., Zanoni M., Ruggeri M. et al. COMT, neuropsychological function and brain structure in schizophrenia: a systematic review and neurobiological interpretation // J. Psychiatry Neurosci. 2013. V. 38. № 6. P. 366.
Nogueira N.G.H.M., Fernandes L., Ferreira B.P. et al. Association Between the Catechol-O-Methyltransferase (COMT) Val158Met Polymorphism and Manual Performance Asymmetries // Percept. Mot. Skills. 2019. V. 126. № 3. P. 349.
Tunbridge E.M., Harrison P.J., Weinberger D.R. Catechol-o-methyltransferase, cognition, and psychosis: Val158Met and beyond // Biol. Psychiatry. 2006. V. 60. № 2. P. 141.
Mier D., Kirsch P., Meyer-Lindenberg A. Neural substrates of pleiotropic action of genetic variation in COMT: a meta-analysis // Mol. Psychiatry. 2010. V. 15. № 9. P. 918.
Egan M.F., Goldberg T.E., Kolachana B.S. et al. Effect of COMT Val108/158 Met genotype on frontal lobe function and risk for schizophrenia // Proc. Natl. Acad. Sci. U.S.A. 2001. V. 98. № 12. P. 6917.
Shehzad Z., DeYoung C.G., Kang Y. et al. Interaction of COMT val158met and externalizing behavior: relation to prefrontal brain activity and behavioral performance // Neuroimage. 2012. V. 60. № 4. P. 2158.
Seamans J.K., Gorelova N., Durstewitz D., Yang C.R. Bidirectional Dopamine Modulation of GABAergic Inhibition in Prefrontal Cortical Pyramidal Neurons // J. Neurosci. 2001. V. 21. № 10. P. 3628.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


