Физиология человека, 2022, T. 48, № 2, стр. 79-85
Изменение мощностных характеристик альфа-ритма у студентов с разным уровнем тревожности в условиях нормального сна и частичной депривации при решении задачи Go/NoGo
Е. А. Черемушкин 1, *, Н. Е. Петренко 1, Н. Н. Алипов 2, О. В. Сергеева 2
1 ФГБУН Институт высшей нервной деятельности
и нейрофизиологии РАН
Москва, Россия
2 ФГАОУ ВО Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова Минздрава РФ
Москва, Россия
* E-mail: khton@mail.ru
Поступила в редакцию 30.06.2021
После доработки 11.09.2021
Принята к публикации 21.09.2021
- EDN: TPRRDS
- DOI: 10.31857/S0131164622020047
Аннотация
У 26 студентов с разным уровнем личностной тревожности изучали влияние частичной депривации сна на когнитивный контроль. Оценивали реакции синхронизации-десинхронизации α-колебаний электроэнцефалографии (ЭЭГ) при выполнении теста Go/NoGo. У менее тревожных студентов сокращение времени сна в ночь накануне исследования приводит к уменьшению реакции десинхронизации на положительный кондиционирующий стимул (Go) и тем самым сглаживает различия с реакцией на стимул, тормозящий поведенческую реакцию (NoGo). Снижение выраженности реакций α-ритма после депривации на стимулы разной сигнальной значимости указывает на ухудшение у этой группы когнитивного контроля. У студентов с высоким уровнем тревожности различий в реакциях на стимулы Go/NoGo не наблюдалось ни после нормальной продолжительности ночного сна, ни после разового резкого его сокращения. Вероятно, у них снижен уровень когнитивного контроля, при этом он не зависит от частичной депривации сна.
Увеличившийся в последнее время темп жизни остро ставит проблему недостатка сна в жизни людей, особенно студентов. Малое время ночного сна вызывает рост тревожности [1–3]. Появление чувства беспокойства и усиление симптомов тревоги наиболее сильно проявляются на следующий день после недосыпания [4, 5]. Однако клинические исследования связи недостатка сна и тревогой дают противоречивые результаты. Было обнаружено, что хроническое лишение сна впоследствии может привести к развитию тревожных расстройств [2], другие авторы показали, что тревожные расстройства вызывают бессонницу, но не наоборот [6]. Еще с одной точки зрения, нарушение сна увеличивает риск развития тревоги или депрессии, а наличие тревожных или депрессивных симптомов увеличивает вероятность появления бессонницы [7]. Менее изучено, как изменяется биоэлектрическая активность мозга человека при сочетании факторов тревожности и депривации сна.
Согласно литературным данным как при тревожности [8], так и при депривации сна отмечаются изменения в активности префронтальных областей коры и ее взаимодействиях с другими областями мозга [9, 10]. Клинические исследования, направленные на выявление электроэнцефалографических (ЭЭГ) признаков тревожных расстройств, показали, что мощностные характеристики α-ритма ЭЭГ имеют большие величины в правой лобно-височной области по сравнению с левой [11]. С помощью нейровизуализационных исследований была показана отрицательная связь между тревожностью и объемом серого вещества в префронтальной коре [12]. В другом исследовании отмечается, что высокий уровень тревоги коррелирует с усилением кровотока в лобных зонах (ventral medial prefrontal cortex) правого полушария [8]. Высокая активность данной области мозга, полученная с помощью функциональной магнитно-резонансной томографии (фМРТ), обнаружена также у людей с нарушениями сна в состоянии спокойного бодрствования [13]. Использование позитронно-эмиссионной томографии (ПЭТ) показало, что депривация сна сопровождается обширными изменениями метаболической активности мозга, включая префронтальную кору [9, 10], которая играет ключевую роль в обеспечении тормозных процессов когнитивного контроля и регуляции поведения человека [14].
Хорошим тестом для оценки состояния этих процессов является методика Go/NoGo, которая применяется, в том числе, и в исследованиях тревожности [15, 16], вегетативной дисфункции [17] и нарушений сна [18]. Суть ее в следующем. В случае кондиционирующего положительного стимула (Go) обследуемый дожидается пускового стимула и нажимает на кнопку джойстика. Действие тормозного стимула (NoGo) отменяет моторную реакцию. Таким образом, кондиционирующие стимулы изменяют поведение обследуемых и позволяют изучать электрофизиологические маркеры тормозных процессов когнитивного контроля.
Целью исследования было оценить влияние продолжительности ночного сна на организацию когнитивной деятельности у студентов с разным уровнем тревожности. Задачей работы было выявить различия в синхронизации/десинхронизации α-ритма в ответ на стимулы Go/NoGo у студентов с высокой и низкой тревожностью в условиях нормальной продолжительности ночного сна и при частичной его депривации.
МЕТОДИКА
По результатам массового анкетирования студентов 2-го курса лечебного и педиатрического факультетов РНИМУ (г. Москва) с помощью теста Спилбергера выделяли группы с относительно низким (М = 34.2 ± 1.2 балла, 6 юношей и 7 девушек, группа I) и высоким (M = 65.0 ± 1.7 балла, 7 юношей и 6 девушек, группа II) уровнем личностной тревожности. Все испытуемые – практически здоровые люди, были ознакомлены с процедурой исследования и дали согласие на участие в нем.
В течение недели, предшествовавшей исследованию, испытуемые заполняли “Дневник сна” [19], в котором, в частности, отмечали длительность сна. Исследование проводили дважды: после обычной его продолжительности накануне (М = 6.5 ± 0.2 и М = 7.6 ± 0.5 ч, группы I и II соответственно) и при одноразовом сокращении, т.н. частичной депривации (М = 3.5 ± 0.2 и М = = 3.5 ± 0.3 ч). Опыты для каждого человека проводили с недельной паузой и чередовали в случайном порядке. Они начинались после второй академической “пары”, после 11.30. Исследуемый находился перед монитором в кресле с подголовником, в затемненном, звукоизолирующем и экранируемом помещении. Расстояние от экрана составляло 80 см. Испытуемому предъявляли комплексные стимулы (n = 68), состоящие из трех частей: S1 (восклицательный знак) – предупреждающего стимула, S2 – кондиционирующего стимула (Go/NoGo) и S3 – пускового стимула. С паузой в 2 с после начала предъявления стимула S1, экспонировался положительный (Go) или отрицательный (NoGo) кондиционирующий сигнал (S2) – круг диаметром 1 см зеленого или синего цвета. Цвета менялись в случайном порядке, при этом число сигналов Go и NoGo было одинаковым (по 34). Затем с паузой 2 с после начала предъявления S2 предъявляли пусковой стимул (S3) – световое пятно белого цвета. Если кондиционирующий стимул S2 был зеленого цвета, испытуемый должен был нажать на кнопку джойстика (Go). Если S2 был синего цвета, нажимать было не нужно (NoGo). Пауза между S2 и S3 была необходима для того, чтобы исключить влияние нейрофизиологических процессов, обеспечивающих моторный ответ при предъявлении стимула Go, на биоэлектрическую активность мозга. Тем самым “фактор нажатия” можно было не рассматривать при сопоставлении ЭЭГ-реакций, вызванных дифференцировочными стимулами Go и NoGo. Использовали фиксированную, а не задаваемую в случайном порядке, паузу между S2 и S3 для возможности сопоставления динамики упомянутых реакций на одинаковых временных интервалах. При этом учитывали эффект антиципации (прогнозирования) появления S3, влияющего на величину моторного ответа. Время экспозиции всех стимулов – 350 мс. Интервал между комплексами стимулов S1–S3 составлял 4–7 с и менялся в случайном порядке.
В течение всего опыта вели непрерывную запись ЭЭГ. Она включала в себя фоновые записи (при закрытых и открытых глазах) и записи во время тестирования испытуемого с помощью комплексных стимулов. Предъявление стимулов и их синхронизация с ЭЭГ осуществляли по программе системы “Неостимул” (“Neurobotics”). Отведение, усиление и фильтрацию ЭЭГ проводили с помощью пакета программ Neocortex-Pro (“Neurobotics”). Частота дискретизации – 250 Гц, полоса пропускания частот усилителя: 0.5–70 Гц. ЭЭГ регистрировали с помощью хлорсеребряных электродов (“Micromed”, Венгрия) с сопротивлением, не превышающим 5 кОм. Электрическую активность с поверхности головы отводили с помощью 16 электродов, расположенных в соответствии со схемой 10–20 (F3, F4, F7, F8, Fz, C3, C4, Cz, T3, T4, P3, P4, T5, T6, O1, O2). Для записи ЭЭГ использовали монополярный монтаж отведений, референт – объединенный ушной.
Независимо от длительности ночного сна в обеих группах испытуемых наблюдали единичные ошибки при нажатии на кнопку. Они представляли собой опережающий, импульсивный ответ: нажатие происходило на стимул Go, а не на пусковой стимул. Пробы с такой реакцией были удалены из дальнейшего анализа.
Обрабатывали отрезки записи ЭЭГ – 2 с в интервале между S2–S3 (от начала предъявления S2 до начала предъявления S3). На этих отрезках для каждого отведения ЭЭГ проводили непрерывное вейвлет-преобразование на основе “материнского” комплексного Morlet-вейвлета. В частотной полосе 8–13.5 Гц (диапазон α-ритма) с шагом 0.5 Гц и разрешением по времени 1 мс вычисляли значения модуля коэффициента вейвлет-преобразования (КВП), который характеризует мощность биопотенциалов. Суммировали КВП, полученные по всем отведениям ЭЭГ. Сглаженные таким образом мощностные характеристики ЭЭГ-реакций позволяют оценить общие тренды изменений, которые вызваны дифференцировочными стимулами. Важно подчеркнуть, что далее все последующие преобразования КВП и статистическую обработку проводили как для КВП каждого отведения ЭЭГ, так и для КВП, суммированного по всем отведениям.
Проводили усреднение частотного домена 8–13.5 Гц по всем входящим в него частотам. Далее выделяли 10 последовательных временны́х отрезков по 200 мс в интервале между S2–S3 и внутри них осуществляли усреднение КВП по времени. Чтобы оценить, на какую долю величина постстимульных потенциалов изменяется по отношению к предстимульным, выполняли следующую операцию. Из 10 величин, полученных с помощью описанных выше вычислений, вычитали полученную аналогичным образом на секундном отрезке ЭЭГ, непосредственно предшествующем S2 величину, делили на эту величину и умножали на 100.
Полученные таким образом характеристики постстимульных изменений в мощности α-ритма ЭЭГ анализировали с помощью многофакторного дисперсионного анализа (ANOVA RM) с использованием поправки Гринхауза–Гессера. В качестве внутригрупповых анализировали влияние факторов “ситуация” (2 уровня – нормальная продолжительность сна и его депривация); “стимул” (2 уровня – Go и NoGo); “время” (10 отрезков по 200 мс). В качестве межгруппового исследовали влияние фактора “группа” (2 уровня – группа с высокой и низкой тревожностью). Парные сравнения характеристик постстимульных изменений α-ритма между стимулами Go и NoGo проводили отдельно для ситуаций нормального сна и депривации, и отдельно для групп с высокой и низкой тревожностью. При этом использовали Т-критерий Стьюдента. Вычисления проводили с помощью пакетов программ Matlab 78.01 и SPSS 13.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У низко тревожных испытуемых время нажатия на кнопку в условиях нормальной продолжительности сна составляет 109.25 ± 7.28 мс, при недостаточной продолжительности – 130.26 ± 11.06 мс, у высоко тревожных испытуемых – 137.90 ± 6.48 и 156.27 ± 9.96 мс соответственно. Низкие средние значения моторной реакции являются следствием процессов антиципации, которые возникают при фиксированном интервале времени между стимулами. Таким образом, у испытуемых с высоким уровнем тревожности, по сравнению с низко тревожной группой, ответ на пусковой стимул, занимает более длительное время. Однако значимым это различие было только в условиях нормальной продолжительности сна (t = –2.94; df = 23; p = 0.007). При недостаточной продолжительности этот поведенческий показатель у групп сближается (t = –1.75; df = 23; p = 0.093). Депривация как у менее тревожных студентов, так и у высоко тревожных значимо увеличивала время нажатия (t = –4.08; df = 12; p = 0.002 и t = –4.33; df = 12; p = 0.001 соответственно).
Дисперсионный анализ усредненных по всем отведениям значений мощности α-ритма выявил статистически значимое совместное влияние на него факторов “ситуация $ \times $ стимул $ \times $ группа” (F(1; 24) = 4.57; p = 0.043) и “ситуация $ \times $ стимул $ \times $ × время $ \times $ группа” (F(4; 98) = 2.58; p = 0.041). Этот результат свидетельствует о различии в реактивности α-ритма в зависимости от длительности сна, типа стимула и группы испытуемых. Парные различия между положительным и тормозным кондиционирующими стимулами для суммарной ЭЭГ выявлены только для группы менее тревожных испытуемых в условиях нормальной продолжительности ночного сна в интервале с 1000 по 1600 мс (1000–1200 мс: t = –3.14; df = 12; p = 0.008; 1200–1400 мc: t = –4.19; df = 12; p = 0.001; 1400–1600 мс: t = –4.65; df = 12; p = 0.0005). Парные сравнения, проведенные для отдельных регионов в данной группе испытуемых, показали следующее. Значимые различия между ЭЭГ-реакциями, вызванными предъявлением положительного и тормозного стимулов, наблюдаются в интервале 600–800 мс в большинстве лобно-центральных отведений (С3Z = –2.85; p = 0.004; С4Z = –2.28; p = 0.022; F3Z = –2.18; p = 0.029; F7Z = –2.59; p = 0.009; F8Z = –2.89; p = 0.003; Т3Z = –2.02; p = = 0.043; Т4Z = –2.18; p = 0.022), в интервале 800–1000 мс – F4Z = –2.64; p = 0.008; F8Z = –1.92; p = = 0.054; С3Z = –1.92; p = 0.054; С4Z = –2.07; p = = 0.037. В лобно-височной области различия наблюдаются и в более поздний период с 1200–1400 мс (F8Z = –2.07; p = 0.037). Для каудальных областей различия между стимулами Go и NoGo статистически значимы только билатерально в теменных областях коры в интервале 600–800 мс (Р3Z = –2.28; p = 0.022; Р4Z = –2.13; p = 0.033).
Дисперсионный анализ, проведенный для отдельных отведений ЭЭГ, выявил следующее. Влияние депривации сна обнаружено только у менее тревожных студентов и только на стимул Go в лобно-центральных областях отведения ЭЭГ (F4: F(1; 24) = 9.03; p = 0.006, F7: F(1; 24) = 6.33; p = = 0.019, F8: F(1; 24) = 5.40, p = 0.029, С3: F(1; 24) = = 5.095; p = 0.033, Т3: F(1; 24) = 5.72; p = 0.025, Т4: F(1; 24) = 4.11; p = 0.05). После сна нормальной продолжительности у этих студентов наблюдалась выраженная десинхронизация α-ритма, а после частичной депривации она пропадала (рис. 1, I). У более тревожных студентов статистически значимых различий в реакциях биоэлектрической активности коры мозга после нормальной продолжительности сна и его депривации не наблюдалось ни на один из кондиционирующих стимулов (рис. 1, II).
Рис. 1.
Синхронизация/десинхронизация α-ритма ЭЭГ отведения F8 после предъявления стимулов Go/NoGo у испытуемых с высокой и низкой тревожностью в условиях нормального сна и частичной депривации. I – низкая тревожность, II – высокая; А – нормальный сон, Б – частичная депривация; заштрихованные столбики – Go, незаштрихованные – NoGo; по вертикали – изменение мощности α-ритма по отношению к предстимульному отрезку ЭЭГ, %; по горизонтали – интервалы времени, 200 мс; стрелками слева направо отмечено появление кондиционирующего (Go/NoGo) и пускового стимулов; значками “*” и “**” показаны различия между реакциями на стимулы Go и NoGo (p < 0.05 и p < 0.01 соответственно); показана ошибка среднего.
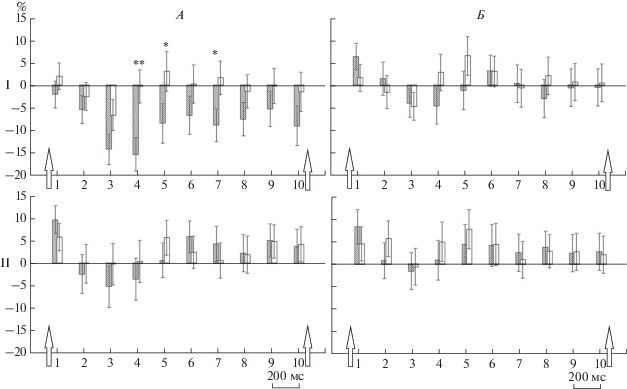
При анализе биоэлектрической активности между группами с разным уровнем тревожности показано различие в реакциях α-колебаний только в ответах на стимул Go и только при нормальной продолжительности сна (F3: F(1; 24) = 6.07; p = 0.021, F4: F(1; 24) = 6.45; p = 0.018, F8: F(1; 24) = = 7.95, p = 0.009 и С4: F(1; 24) = 6.61, p = 0.017). В этих отведениях реакция десинхронизации α-ритма существенно слабее выражена у студентов с высоким уровнем тревожности по сравнению с менее тревожными. На стимул NoGo статистически значимых различий между группами с разным уровнем тревожности выявлено не было ни при нормальной продолжительности сна, ни при его депривации.
Значимое влияние фактора “стимул” выявлено только для группы студентов с низким уровнем тревожности в ситуации нормальной длительности сна в регионах С4 (F(1; 24) = 5.09; p = 0.033), F4 (F(1; 24) = 4.45; p = 0.046) и F7 (F(1; 24) = 4.49; p = = 0.045). В этой группе при нормальной продолжительности сна в ответ на стимул Go наблюдается выраженная реакция десинхронизации α-потенциалов. На стимул NoGo реакция α-ритма носит менее выраженный характер и колеблется около изолинии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате исследований выявлено влияние длительности ночного сна на организацию когнитивной деятельности у студентов с разным уровнем тревожности. У всех испытуемых при выполнении задачи типа Go/NoGo уменьшение обычной продолжительности ночного сна приводило к увеличению моторной реакции в условиях отсроченного ответа на предъявление пускового стимула. Этот результат согласуется с описанным ранее ухудшением когнитивных функций при недостаточной продолжительности сна [9, 10].
Значимые различия в характеристиках α-ритма ЭЭГ между кондиционирующими стимулами, запускающими последующую моторную реакцию (Go) и отменяющими ее (NoGo), наблюдаются в передне-центральных областях только у группы с низкой тревожностью и только после сна обычной продолжительности. В ответ на стимул Go в этой группе наблюдается выраженная реакция десинхронизации, на стимул NoGo – небольшая синхронизация α-ритма. Согласно нашим ранним исследованиям, такой тип реакции (синхронизация α-ритма на стимул NoGo и его десинхронизация на Go) является нормативной реакцией данного ритма на эти стимулы [20]. Мы показали, что синхронизация α-ритма в ответ на стимулы NoGo имеет четко выраженный локализованный и латерализованный характер: она отмечалась в двигательной зоне левого полушария (отведения С3, FC3), т.е. в участке коры, непосредственно управляющем движением правой руки. В работе [21] также было показано, что при произвольном подавлении двигательной реакции руки происходит синхронизация α-ритма в ограниченном участке моторной коры, который имеет непосредственное отношение к подавляемым движениям. Участие центральных областей коры, являющихся моторными зонами, может быть связано с подготовкой моторного ответа на стимул Go. Эти же области, согласно данным фМРТ-исследования, участвуют в торможении иррелевантных действий при выполнении Go/NoGo теста [22].
Основные различия между стимулами Go и NoGo наблюдаются преимущественно в латеральной префронтальной коре (F3, F4, F7, F8), что соответствует представлениям о ключевой роли лобных областей в обеспечении процессов когнитивного контроля в умственной деятельности [14]. Префронтальная кора, наряду с цингулярной корой включена в обеспечение механизмов торможения [23]. В исследовании с одновременной регистрацией активности ретикулярных ядер таламуса и лобной коры показано участие кортико-таламической системы мозга в обеспечении процессов тормозного контроля, в том числе, и при выполнении задач Go/NoGo [24].
Частичная депривация сна в группе с более низкой тревожностью приводит к сглаживанию различий в реакциях Go/NoGo. Это происходит за счет резкого уменьшения реакции десинхронизации на стимул Go. В группе с выраженной тревожностью различий в реакциях на стимулы Go и NoGo нет как при нормальной продолжительности сна, так и при ее снижении. Практически везде наблюдается небольшая синхронизация α-потенциалов. Отсутствие дифференцированной реакции на разные кондиционирующие стимулы может отражать недостаток когнитивного контроля умственной деятельности. В группе с низким уровнем тревожности его ослабление происходит в условиях частичной депривации сна. У высоко тревожных студентов, вероятно, такое состояние когнитивного контроля от продолжительности сна не зависит. Нарушение когнитивного контроля у тревожных людей факт, описанный ранее [25, 26].
Ранее в наших исследованиях было показано, что студенты с трудностями в обучении демонстрировали существенное ослабление индуцированных реакций синхронизации/десинхронизации α-колебаний на кондиционирующие сигналы Go/NoGo, что приводило к отсутствию различий в постстимульных реакциях практически во всех отведениях ЭЭГ [27]. По-видимому, у этих студентов можно констатировать значительное снижение функциональной активности кортикоталамической системы селективного внимания и снижение уровня когнитивного контроля. Полученные в текущем исследовании близкие результаты (почти полное отсутствие разницы в реакциях α-колебаний на кондиционирующие стимулы разного сигнального значения – особенно у группы высоко тревожных студентов) позволяет предполагать у них существенные проблемы с уровнем когнитивного контроля. Следует отметить, что подобная картина наблюдается у тревожной группы при нормальной длительности ночного сна, и в условиях частичной депривации сна практически не изменяется – иначе говоря, признаки нарушения когнитивного контроля в этой группе не зависят от продолжительности сна накануне исследования. В группе менее тревожных испытуемых депривация сна приводит к исчезновению различий в реакциях между кондиционирующими стимулами и соответственно к появлению признаков ухудшения когнитивного контроля.
ЗАКЛЮЧЕНИЕ
Снижение длительности ночного сна накануне исследования отрицательно влияет как на поведенческие, так и на нейрофизиологические показатели когнитивной деятельности студентов с разным уровнем тревожности. У всех испытуемых при выполнении задачи типа Go/NoGo увеличивалась моторная реакция в условиях отсроченного ответа на предъявление пускового стимула. У студентов с более низким уровнем тревожности депривация приводит к уменьшению реакции десинхронизации α-ритма ЭЭГ на положительный кондиционирующий стимул (Go), тем самым нивелируя различия в реакциях α-ритма на стимулы разной сигнальной значимости. Этот результат свидетельствует об ухудшении уровня когнитивного контроля под влиянием уменьшения времени ночного сна. У студентов с высокой тревожностью отсутствуют различия в реакциях α-потенциалов на стимулы Go и NoGo как в условиях нормальной продолжительности ночного сна, так и при ее резком снижении. Таким образом, уровень когнитивного контроля у этих испытуемых не зависит от продолжительности сна.
Этические нормы. Исследование проведено в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрено этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана средствами государственного бюджета по государственному заданию Министерства образования и науки РФ на 2021–2023 гг.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Babson K.A., Trainor C.D., Feldner M.T., Blumenthal H. A test of the effects of acute sleep deprivation on general and specific self-reported anxiety and depressive symptoms: An experimental extension // J. Behav. Ther. Exp. Psychiatry. 2010. V. 41. № 3. P. 297.
Roberts R.E., Duong H.T. Is there an association between short sleep duration and adolescent anxiety disorders? // Sleep Med. 2017. V. 30. P. 82.
Полуэктов М.Г., Пчелина П.В. Расстройства сна и тревога // Эффективная фармакотерапия. Неврология и психиатрия. Спецвыпуск “Сон и его расстройства – 5”. 2017. Т. 35. С. 80.
Cox R.C., Sterba S.K., Cole D.A. et al. Time of day effects on the relationship between daily sleep and anxiety: An ecological momentary assessment approach // Behav. Res. Ther. 2018. V. 111. P. 44.
Bean Ch.A.L., Ciesla J.A. Naturalistic Partial Sleep Deprivation Leads to Greater Next-Day Anxiety: The Moderating Role of Baseline Anxiety and Depression // Behav. Ther. 2021. V. 52. № 4. P. 861.
Johnson E.O., Roth T., Breslau N. The association of insomnia with anxiety disorders and depression: Exploration of the direction of risk // J. Psychiatr. Res. 2006. V. 40. № 8. P. 700.
Jansson-Frojmark M., Lindblom K. A bidirectional relationship between anxiety and depression, and insomnia? A prospective study in the general population // J. Psychosom. Res. 2008. V. 64. № 4. P. 443.
Tian X., We D., Du X. et al. Assessment of trait anxiety and prediction of changes in state anxiety using functional brain imaging: A test–retest study // Neuroimage. 2016. V. 133. P. 408.
Cui J., Tkachenko O., Gogel H. et al. Microstructure of frontoparietal connections predicts individual resistance to sleep deprivation // NeuroImage. 2015. V. 106. P. 123.
de Almondes K.M., Junior F., Alves N.T. Sleep deprivation and implications for recognition and perception of facial emotions // Sleep Biol. Rhythms. 2016. V. 14. № 1. P. 13.
Al-Ezzi A., Kamel N., Faye I., Gunaseli E. Review of EEG, ERP, and Brain Connectivity Estimators as Predictive Biomarkers of Social Anxiety Disorder // Front. Psychol. 2020. V. 11. P. 730.
Montag C., Reuter M., Jurkiewicz M. et al. Imaging the structure of the human anxious brain: A review of findings from neuroscientific personality psychology // Rev. Neurosci. 2013. V. 24. № 2. P. 167.
Kay D.B., Buysse D.J. Hyperarousal and Beyond: New Insights to the Pathophysiology of Insomnia Disorder through Functional Neuroimaging Studies // Brain Sci. 2017. V. 7. № 3. P. 23.
Zhang S., Xu M., Chang W.-Ch. et al. Organization of long-range inputs and outputs of frontal cortex for top-down control // Nat. Neurosci. 2016. V. 19. № 12. P. 1733.
Leue A., Cano Rodilla C., Beauducel A. Worry-inducing stimuli in an aversive Go/NoGo task enhance reactivecontrol in individuals with lower trait-anxiety // Biol. Psychol. 2017. V. 125. P. 1.
Voegler R., Peterburs J., Lemke H. et al. Electrophysiological correlates of performance monitoring under social observation in patients with social anxiety disorder and healthy controls // Biol. Psychol. 2018. V. 132. P. 71.
Черемушкин Е.А., Петренко Н.Е., Яковенко И.А. и др. Особенности электрофизиологической активности мозга при изменении поведения в ответ на стимулы Go\NoGo у студентов с признаками вегетативной дисфункции и с нормальным вегетативным статусом // Международный научно-исследовательский журн. 2017. Т. 55. № 1-1. С. 171.
Петренко Н.Е., Черемушкин Е.А., Алипов Н.Н. и др. Нисходящий тормозный контроль у студентов с разным качеством сна в эксперименте со стимулами Go/NoGo при опознании лицевой экспрессии // Вестник неврологии, психиатрии и нейрохирургии. 2018. № 7. С. 64.
Maich K.H.G., Lachowski A.M., Carney C.E. Psychometric Properties of the Consensus Sleep Diary in Those With Insomnia Disorder // Behav. Sleep Med. 2018. V. 16. № 2. P. 117.
Костандов Э.А., Черемушкин Е.А., Петренко Н.Е., Яковенко И.А. Когнитивная гипотеза развития дифференцировочного коркового торможения у человека // Физиология человека. 2016. Т. 42. № 4. С. 5. Kostandov E.A., Cheremushkin E.A., Petrenko N.E., Yakovenko I.A. A cognitive hypothesis of the development of differentiative cortical inhibition in humans // Human Physiology. 2016. V. 42. № 4. P. 351.
Sauseng P., Gerloff Ch., Hummel F.C. Two brakes are better than one: The neural bases of inhibitory control of motor memory traces // Neuroimage. 2013. V. 65. P. 52.
Levy B.J., Wagner A.D. Cognitive control and right ventrolateral prefrontal cortex: Reflexive reorienting, motor inhibition, and action updating // Ann. N.Y. Acad. Sci. 2011. V. 1224. № 1. P. 40.
Garavan H., Ross T.J., Stein E.A. Right hemispheric dominance of inhibitory control: an event-related functional MRI study // Proc. Natl. Acad. Sci. U.S.A. 1999. V. 96. № 14. P. 8301.
Marzinzik F., Wahl M., Schneider G.-H. et al. The human thalamus is crucially involved in executive control operations // Cogn. Neurosci. 2008. V. 20. № 10. P. 1903.
Dong M., Xia L., Lu M. et al. A failed top-down control from the prefrontal cortex to the amygdala in generalized anxiety disorder: evidence from resting-state fMRI with Granger causality analysis // Neuroscience Letters. 2019. V. 707. Article 134 314. P. 1.
Morsel A.M., Dhar M., Hulstijn W. et al. Inhibitory control in euthymic bipolar disorder: Event related potentials during a Go/NoGo task // Clinical Neurophysiology. 2017. V. 128. № 4. P. 520.
Костандов Э.А., Черемушкин Е.А. Нарушение нисходящего когнитивного контроля у отстающих в учебе студентов // Физиология человека. 2017. Т. 43. № 4. С. 25. Kostandov E.A., Cheremushkin E.A. Disorders of top-down cognitive control in students with learning difficulties // Human Physiology. 2017. V. 43. № 4. P. 377.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


