Физиология человека, 2022, T. 48, № 2, стр. 42-50
Контрастная чувствительность зрительной системы в условиях 5-суточной “сухой” иммерсии с курсом высокочастотной электромиостимуляции
И. И. Шошина 1, 3, *, И. С. Зеленская 2, В. Ю. Карпинская 3, Е. С. Томиловская 2
1 ФГБУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
2 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
3 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: shoshinaii@mail.ru
Поступила в редакцию 01.06.2021
После доработки 27.07.2021
Принята к публикации 27.10.2021
- EDN: JDSSBW
- DOI: 10.31857/S0131164622020138
Аннотация
Цель настоящего исследования – изучение контрастной чувствительности зрительной системы в условиях 5-суточной “сухой” иммерсии (СИ) с курсом высокочастотной электромиостимуляции (ВЧЭМС). Контрастную чувствительность зрительной системы регистрировали в различных диапазонах пространственных частот, свидетельствующих о функциональном состоянии магно- и парвоцеллюлярной нейронных систем, формирующих дорзальный и вентральный потоки информации из каудальных во фронтальные отделы коры головного мозга. Исследования проводили с участием 6 испытуемых до начала иммерсии, на 1-е, 3-и, 5-е сутки СИ, а также через 5 ч после ее окончания. Каждый день СИ испытатели подвергались воздействию ВЧЭМС. Показано отсутствие достоверных изменений в контрастной чувствительности зрительной системы в диапазоне низких пространственных частот, к которым специфична магноцеллюлярная система, при смене условий гравитации (гравитация-микрогравитация-гравитация), по сравнению с результатами предыдущих исследований в условиях СИ без дополнительных воздействий. Можно предположить, что ВЧЭМС, увеличивая афферентный поток в условиях его дефицита при опорной разгрузке, нормализует взаимодействие дорзального и вентрального зрительных путей.
Для планирования космических миссий большое значение имеет понимание того, как мозг адаптируется к специфическим условиям полета. Зрение является основным каналом информации, необходимой мозгу для построения внутренней картины окружающего мира. При этом более половины космонавтов, возвращающихся из длительных полетов, имеют структурные и/или функциональные изменения мозга [1–3], офтальмологические проблемы, получившие название нейроокулярного синдрома, связанного с космическим полетом [3–7]. Уменьшение силы тяжести приводит к нарушению гравитационной вертикали, используемой мозгом для построения системы отсчета и ориентации в пространстве, ошибкам в оценке местоположения объекта и манипуляций с ним, слежении за движущимся объектом. В условиях гравитации центральная нервная система для построения системы отсчета использует информацию, поступающую преимущественно от вестибулярных и проприоцептивных источников, в условиях невесомости возрастает роль зрения [8, 9].
С позиций теории пространственно-частотной фильтрации информации зрительное восприятие обеспечивается в результате различения пространственно-частотных характеристик зрительных стимулов множеством относительно “узких” каналов [10]. Каналы представляют собой нейронные комплексы, настроенные на восприятие разных пространственных частот. Каналов много, однако, условно можно выделить основные из них – крупноклеточные магноцеллюлярные и мелкоклеточные парвоцеллюлярные каналы или системы. Взаимодействие магно- и парвоцеллюлярной систем обеспечивает целостность зрительного восприятия [11, 12]. Характеристики нейронов магно- и парвоцеллюлярной систем определяют особенности восприятия информации (пространственно-частотной фильтрации) на входе и высокоуровневых когнитивных процессов [11].
Парвоцеллюлярная система представлена мелкими ганглиозными клетками с проекциями к парвоцеллюлярным слоям латерального коленчатого тела и затем к слою 4Сβ первичной зрительной коры, а также слоям 4A и 6A [13–15]. Нейроны этой системы более чувствительны к высоким пространственным и низким временны́м частотам, обеспечивая медленное, по сравнению с магноцеллюлярными нейронами, проведение информации преимущественно к нейронам вентрального пути, пролегающего через нижневисочную зону коры головного мозга [14]. Эти свойства определяют ведущую роль парвоцеллюлярных каналов в процессах выделения отдельных объектов и деталей объектов, т.е. локального анализа зрительного поля [15].
Магноцеллюлярная система представлена большими ганглиозными клетками сетчатки с проекциями к магноцеллюлярным слоям латерального коленчатого тела и затем к слою 4Сα первичной зрительной коры [13–15]. Нейроны магноцеллюлярной системы, специфичные к восприятию низких пространственных и высоких временны́х частот, играют ведущую роль в обработке информации о глобальной организации стимула, процессах “предвнимания” [16], анализе положения в пространстве, движения и направления движения зрительного объекта, стереопсисе, восприятии контура [12, 15]. Нейроны магноцеллюлярной системы посылают свои отростки преимущественно к дорзальному потоку [14], пролегающему через заднюю теменную кору. Задняя теменная кора получает информацию от зрительной, слуховой и соматосенсорной систем, входит в состав функциональной системы регуляции позы и произвольных движений, системы внутреннего представления. Среди ее функций – формирование намерений, т.е. высокоуровневых когнитивных планов движения (движений глаз, дотягивания и захвата) [17]. Переработанная здесь информация далее поступает в различные области двигательной коры, дорсолатеральную префронтальную зону, фронтальное глазное поле.
Результаты психофизических исследований с регистрацией контрастной чувствительности зрительной системы на модели “сухой” иммерсии (СИ), используемой для имитации физиологических эффектов микрогравитации [18], свидетельствуют о перестройке взаимодействия магно- и парвоцеллюлярной нейронных систем [19]. Показано повышение контрастной чувствительности в диапазоне низких пространственных частот, к восприятию которых специфична магноцеллюлярная система, при смене условий гравитации (гравитация-микрогравитация-гравитация). Об изменении активности магноцеллюлярной системы при смене условий гравитации свидетельствуют и результаты исследований зрительной системы космонавтов до и после длительных орбитальных полетов [20]. Таким образом, можно говорить о роли магноцеллюлярной системы, формирующей дорзальный поток, в процессах адаптации к меняющимся условиям среды и возможности использования оценки ее состояния, как маркера адаптации, что важно в подготовке участников полетов к смене гравитационных условий при высадках на лунную или другую поверхность. Не менее важной является возможность использования оценки активности данной системы в целях мониторинга функционального состояния космонавтов во время и после полета, оценки эффективности методов компенсации отрицательных эффектов на организм человека условий среды.
Одним из средств обеспечения сохранности скоростно-силовых мышечных качеств и работоспособности космонавтов является использование высокочастотной электромиостимуляции (ВЧЭМС) [21, 22]. Ее влияние на двигательную систему исследовано достаточно хорошо, в то время как ее эффекты в других системах организма изучены в меньшей степени. В отличие от активных физических упражнений, ВЧЭМС не оказывает влияния на показатели работы сердечно-сосудистой системы, поэтому она может быть применена в качестве способа компенсации негативных влияний микрогравитации. Цель настоящего исследования – изучение контрастной чувствительности зрительной системы в условиях 5-суточной “сухой” иммерсии с курсом ВЧЭМС. Гипотеза исследования – использование ВЧЭМС сглаживает эффект микрогравитации на контрастную чувствительность в диапазоне низких пространственных частот, к которым специфична магноцеллюлярная система, играющая ведущую роль в анализе положения в пространстве, движения и направления движения зрительного объекта, стереопсисе, восприятии контура.
МЕТОДИКА
Для участия в исследовании предварительно отобрали 6 испытуемых (мужчины, средний возраст – 35.5 ± 1.7 года). Участники исследования были правши согласно результатам Эдинбургского опросника [23]. Все исследования были не инвазивными и дискомфорта не вызывали. Оборудование соответствовало нормам безопасности.
Каждый испытуемый на протяжении 5 сут находился в условиях СИ: погруженным в ванну размером 200 × 100 × 100 см, наполненную водой, температуру которой поддерживали на уровне 33.0 ± 0.5°С. Поверхность воды была покрыта свободно плавающей водонепроницаемой тканью, площадь которой более чем в 2 раза превосходила площадь зеркала воды. Таким образом, испытуемый, будучи погруженным в толщу воды, был изолирован от непосредственного контакта с ней. Режим дня во время СИ включал время на проведение экспериментальных процедур и гигиенических операций. Один раз в день испытателей извлекали из ванны и укладывали на каталку в строго горизонтальном положении для проведения гигиенических процедур.
Порядок проведения исследований был следующим: за 24 ч до начала СИ (Фон), затем – по одному исследованию на первые, третьи и пятые сутки СИ (СИ1, СИ3 и СИ5 соответственно) и после окончания СИ (СИ5 + 5 ч). Согласно данным предыдущих исследований восстановление сенсомоторных функций происходит в течение первых суток после завершения СИ, поэтому последнее исследование проводили через 5 ч после завершения иммерсии (СИ5 + 5 ч). Фоновое исследование проводили в заполненной ванне, в горизонтальном положении, при этом испытуемого погружали в ванну лишь на время исследования [19, 24]. Исследование проводили в первой половине дня, после завтрака и всех необходимых гигиенических процедур.
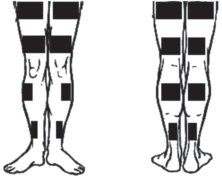
ВЧЭМС осуществляли с помощью аппарата “Амплидин-ЭСТ”. Стимулятор представлял собой источник переменного синусоидального тока несущей частоты 2000 Гц, прерываемого прямоугольными импульсами с частотой 50 Гц (полная амплитуда модуляции) и длительностью 10 с. Стимуляционную тренировку четырехглавой мышцы бедра (ЧБМ), трехглавой мышцы голени (ТМГ) и передней большеберцовой мышцы (ПБМ) проводили на двух конечностях испытуемого способом прямого биполярного электрического раздражения мышц по методике Я. Коц и В. Хвилон [25], но в изотоническом режиме сокращения мышц в положении лежа. Угол в коленном суставе составлял 180°, в голеностопном – порядка 130°. Физиотерапевтические токопроводящие прямоугольные электроды (40 × 100 мм – для ПБМ; 45 × 200 и 40 × 160 мм – для ЧМБ и 40 × 160 и 40 × 100 мм – для ТМГ) располагали по всей ширине стимулируемой мышцы (рис. 1). Во время тренировки силу электрического раздражения подбирали индивидуально – до порога переносимости. Тренировочная процедура состояла из 10 стимуляций длительностью по 10 с каждая с межстимульным перерывом 50 с. Стимуляцию проводили на протяжении всех 5 дней СИ в течение 20 мин в день при нахождении испытуемого вне ванны на мягкой поверхности. Перед началом СИ каждый испытуемый проходил одну ознакомительную сессию ВЧЭМС.
Контрастную чувствительность зрительной системы регистрировали в диапазоне низких, средних и высоких пространственных частот, к восприятию которых в разной степени специфичны нейроны магноцеллюлярной и парвоцеллюлярной систем, формирующих дорзальный и вентральный потоки. Исходили из того, что нейроны магноцеллюлярной системы более специфичны к восприятию низких пространственных частот, парвоцеллюлярной системы – высоких пространственных частот [14, 15]. Так как средние пространственные частоты обрабатываются нейронами обеих систем, контрастную чувствительность в этих пространственных частотах рассматривали, как меру рассогласования их взаимодействия.
Контрастная чувствительность – характеристика рецептивного поля, регистрируемая в ответ на паттерны из чередующихся светлых и темных полос с размытыми краями (синусоидальные решетки), с распределением света, интенсивность которого изменяется в соответствии с синусоидальной функцией. Контраст – отношение яркости между светлой и темной фазами паттерна. Контраст (K) определяют по Майкельсону:
(1)
${\text{К}} = {{L{\text{max}} - L{\text{min}}} \mathord{\left/ {\vphantom {{L{\text{max}} - L{\text{min}}} {L{\text{max}} + L{\text{min}},}}} \right. \kern-0em} {L{\text{max}} + L{\text{min}},}}$В качестве стимулов использовали элементы Габора, которые представляют собой синусоиду, умноженную на функцию Гаусса. Элемент Габора описывается следующим выражением (для вертикальной ориентации элемента):
(2)
$\begin{gathered} f(x,y,\sigma ,\nu ,\phi ) = {\text{sin(}}2\pi \nu x + \phi {\text{)}} \times \\ \times \,\,{{{\text{exp}}\left( {{{ - {\kern 1pt} (x2 + y2)} \mathord{\left/ {\vphantom {{ - {\kern 1pt} (x2 + y2)} {2\sigma 2}}} \right. \kern-0em} {2\sigma 2}}} \right)} \mathord{\left/ {\vphantom {{{\text{exp}}\left( {{{ - {\kern 1pt} (x2 + y2)} \mathord{\left/ {\vphantom {{ - {\kern 1pt} (x2 + y2)} {2\sigma 2}}} \right. \kern-0em} {2\sigma 2}}} \right)} {2\pi \sigma 2,}}} \right. \kern-0em} {2\pi \sigma 2,}} \\ \end{gathered} $Предъявляли элементы Габора с пространственной частотой: 0.4; 0.8; 1.0; 3.0; 6.0 и 10.0 цикл/град на экране монитора Toshiba Satellite A200-1M8, Intel® Core™2 Duo – T7100 1800 MГц/1024 Мб, дисплей 15.4′ TFT WXGA активная матрица повышенной яркости (Toshiba TruBrite), разрешение 1024 × 600 пикселей, частота обновления 60 Гц. Стимулы выводили в случайном порядке слева или справа от центра экрана (рис. 2). При анализе данных к диапазону низких пространственных частот относили частоты 0.4 и 0.8 цикл/град, средних – 1.0, и 3.0 цикл/град, высоких частот – 6.0 и 10.0 цикл/град. Задача испытуемого состояла в том, чтобы нажать на правую кнопку мыши, если он видит изображение справа, левую кнопку – если слева. Выбор просили делать и тогда, когда испытуемый не был уверен, что видит тестовое изображение.
Рис. 2.
Примеры изображений элементов Габора, предъявляемых в исследовании по оценке контрастной чувствительности зрительной системы.

Для предъявления элементов Габора и оценки контрастной чувствительности использовали компьютерную программу, позволяющую формировать тестовые изображения на мониторе любого типа без предварительной его калибровки. Программа разработана С.В. Прониным в Институте физиологии имени И.П. Павлова РАН (г. Санкт-Петербург). Для передачи яркостного профиля тестовых изображений в программе использованы вариации плотности случайно расположенных на черном фоне белых точек. Измерение порогового контраста реализовано с помощью адаптивной “лестничной” процедуры (adaptive staircase procedure). Начинали предъявления со стимулов с контрастом 0.5, трижды выполняя измерение видимости. В случае, если испытуемый три раза давал правильный ответ в какой половине экрана демонстрировалось изображение, программа снижала контраст на 20%. Если была сделана хотя бы одна ошибка, контраст повышался на 20%. Далее этот цикл повторялся с шагом изменения контраста 20%. В результате контраст тестового изображения постепенно понижался до порогового уровня, при котором испытуемый с вероятностью 0.5 делал хотя бы одну ошибку. Измерение завершали, когда значение контраста совершало 8 таких колебаний – “реверсий” для каждой тестовой пространственной частоты. Порог вычисляли программно, как среднее значение контрастов в точках “реверсий”. Порог при этом равнялся значению контраста, при котором испытуемый дал правильный ответ с вероятностью P = 0.794 (так как вероятность трех правильных ответов подряд равна P × P × P = 0.5, то P = = 3√0.5 ≈ 0.794).
Иммерсионную ванну с установленным на ней на расстоянии 1.5 м от испытуемого монитором, накрывали плотной черной тканью, не пропускающей солнечный свет. Монитор был установлен так, чтобы уровень расположения глаз испытуемого примерно соответствовал середине экрана. Наблюдение осуществляли бинокулярно. Острота зрения всех испытуемых соответствовала норме.
Статистический анализ достоверности различий выполняли в программе STATISTICA 10 с использованием непараметрического критерия Манна-Уитни. Все данные представлены в виде среднее ± стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты измерений контрастной чувствительности в разных диапазонах пространственных частот представлены на рис. 3. Фоновые значения контрастной чувствительности в диапазоне низких пространственных частот составили 12.35 ± ± 4.93, средних частот – 13.22 ± 5.51 и в диапазоне высоких пространственных частот – 3.78 ± 1.54. В первые сутки нахождения в условиях СИ (СИ1) контрастная чувствительность составила, соответственно, 15.45 ± 8.98, 10.16 ± 4.27 и 3.82 ± 1.65. На 3-и сутки СИ (СИ3) контрастная чувствительность в диапазоне низких пространственных частот составила 12.43 ± 5.12, средних – 12.64 ± 8.94, высоких пространственных частот – 3.69 ± 1.16. На 5-е сутки СИ (СИ5) контрастная чувствительность в диапазоне низких пространственных частот составила 12.99 ± 4.13, средних – 13.34 ± 8.89, высоких пространственных частот – 3.98 ± 1.67. После окончания иммерсии (СИ5 + 5 ч), она же в диапазоне низких пространственных частот – 11.87 ± 5.31, средних – 10.64 ± 7.62, высоких частот – 4.07 ± 1.28.
Рис. 3.
Контрастная чувствительность зрительной системы в условиях 5-суточной “сухой” иммерсии (СИ) с курсом высокочастотной электромиостимуляции (ВЧЭМС). Фон – за 24 ч до начала СИ; СИ1 – первые сутки СИ; СИ3 – третьи сутки СИ; СИ5 – пятые сутки СИ; СИ5 + 5 ч – через 5 ч после окончания СИ.
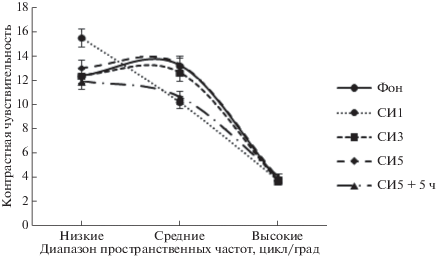
В первые сутки (СИ1) пребывания в условиях иммерсии достоверного повышения контрастной чувствительности в диапазоне низких пространственных частот, к восприятию которых более специфичны нейроны магноцеллюлярной системы, формирующей дорзальный поток, не установлено (р = 0.3). Также и относительно чувствительности в диапазоне высоких пространственных частот. Достоверное снижение контрастной чувствительности зарегистрировано в диапазоне средних пространственных частот (р = 0.01). После “выемки” (СИ5 + 5 ч) достоверных изменений контрастной чувствительности на смену гравитационных условий не установлено.
Полученные данные позволяют заключить, что в условиях СИ с курсом ВЧЭМС не наблюдается достоверного изменения контрастной чувствительности в диапазоне низких и высоких пространственных частот при смене условий гравитации (гравитация–микрогравитация–гравитация).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование контрастной чувствительности зрительной системы в разных диапазонах пространственных частот использовано нами для оценки состояния магно- и парвоцеллюлярной систем и характера их взаимодействия в условиях экстремального для организма воздействия – смены условий гравитации, к действию которой мозг приспособлен эволюционно. На различных моделях было показано, что изменение активности одной из систем приводит к рассогласованию в их взаимодействии [11, 19, 26–28].
Результаты исследований влияния микрогравитации на контрастную чувствительность зрительной системы в ходе 21-й суточной СИ свидетельствуют об изменении функционального состояния магноцеллюлярной системы при смене условий гравитации [19]. Показано повышение активности магносистемы и, как результат, смещение баланса во взаимодействии двух оппонентых систем в сторону доминирования механизма глобального анализа информации над локальным, другими словами, рассогласование во взаимодействии систем и, соответственно, механизмов. Полученные данные свидетельствуют о возможности использования активности магноцеллюлярной системы в качестве маркера функционального состояния, процесса адаптации и реадаптации. Результаты исследований по выполнению космонавтами задачи навигации также свидетельствуют о функциональной реорганизации дорзального пути [29].
Данные настоящего исследования в условиях 5-суточной СИ с курсом ВЧЭМС свидетельствуют о том, что в первые сутки пребывания в условиях СИ (СИ1) отсутствует достоверное повышение средних значений контрастной чувствительности в диапазоне низких пространственных частот, к восприятию которых более специфичны нейроны магноцеллюлярной системы, формирующей дорзальный поток. Между тем, статистически достоверно снижение контрастной чувствительности в диапазоне средних пространственных частот, восприятие которых обеспечивается обеими нейронными системами. Понижение контрастной чувствительности в диапазоне средних пространственных частот, возможно, отражает рассогласование во взаимодействии магноцеллюлярной и парвоцеллюлярной нейронных систем [11, 27]. В предыдущем исследовании с 21-суточным пребыванием в условиях СИ без ВЧЭМС на 3-й день погружения наблюдалось выраженное повышение контрастной чувствительности в диапазоне низких пространственных частот [19], т.е. повышение активности магноцеллюлярной системы (дорзальный поток). Таким образом, при смене условий гравитации в СИ с применением курса ВЧЭМС изменения контрастной чувствительности зрительной системы были сглажены. Можно предположить, что ВЧЭМС, увеличивая афферентный поток в условиях его дефицита при опорной разгрузке [30], нормализует взаимодействие дорзального и вентрального зрительных путей.
С позиций представления о двух потоках [27, 28] дорзальный поток для “действия” с проекциями из первичных зрительных областей в заднюю теменную кору играет решающую роль в контроле действий в реальном времени, преобразует информацию о местоположении и расположении целевых объектов в системы координат, используемые эффекторами для выполнения действия [31, 32]. Вентральный поток для “восприятия” с проекциями из первичных зрительных областей в нижнюю височную кору обеспечивает детальное описание объектов.
Кроме того, дорзальная и вентральная система вовлечены в две отличающиеся системы отсчета, обеспечивающие функцию пространственной ориентации [33–35]. Вычисления, необходимые для зрения “для восприятия”, сильно отличаются от вычислений, необходимых для зрения “для действия”. Дорзальная система обеспечивает эгоцентрическую систему отсчета, ориентированную на абсолютные величины и зрительно-пространственную ориентацию, вентральная система – аллоцентрическую систему отсчета, ориентированную на структуру сцены, кодирование размера, ориентации и расположения объектов относительно друг друга. Благодаря согласованной работе систем с перцептивными представлениями, основанными на объектах и сценах, обеспечивается целостное представление об окружающей среде, местоположении и направлении навигации в ней [34]. Экстремальные воздействия приводят к изменению характера их взаимодействия [15, 19, 27]. Результаты исследования в условиях СИ без дополнительных воздействий свидетельствуют о смещении локуса активности в сторону дорзальной системы [16]. Использование дополнительной афферентации с применением ВЧЭМС имеет перспективы использования для профилактики негативных эффектов микрогравитации на характер взаимодействия систем.
Влияние ВЧЭМС на показатели зрительного восприятия обоснованы принципами мультисенсорного взаимодействия, в частности на уровне задней теменной коры, через которую пролегает дорзальный путь передачи информации из каудальных во фронтальные отделы коры. Задняя теменная кора головного мозга – область сенсомоторной интеграции с различными субрегионами, предназначенными для планирования движений глаз, движений дотягивания и захвата [17], участвующими в системе формирования визуально-пространственных соотношений, преобразования сенсорного сигнала в двигательный.
Полагаем, что необходимы дальнейшие исследования влияния ВЧЭМС на контрастную чувствительность зрительной системы в условиях более продолжительного воздействия микрогравитации.
ЗАКЛЮЧЕНИЕ
Микрогравитация в условиях космического полета часто приводит к структурным и/или функциональным изменениям мозга, офтальмологическим проблемам, потере пространственного ориентира. Поиск способов компенсации этих эффектов одна из основных задач космической медицины.
“Сухая” иммерсия, на сегодняшний день, является одним из популярных методов моделирования эффектов гравитационной разгрузки в наземных условиях.
В настоящем исследовании в ходе 5-суточной СИ изучали контрастную чувствительность зрительной системы в различных диапазонах пространственных частот, к восприятию которых в разной степени специфичны магноцеллюлярная и парвоцеллюлярная зрительные системы, формирующие дорзальный и вентральный потоки информации из каудальных во фронтальные отделы коры. Каждый день СИ испытуемые подвергались воздействию ВЧЭМС. Показано отсутствие достоверных изменений контрастной чувствительности зрительной системы в диапазоне низких пространственных частот, к которым специфична магноцеллюлярная система, при смене условий гравитации (гравитация-микрогравитация-гравитация), по сравнению с результатами предыдущих исследований в условиях СИ без дополнительных воздействий. Можно предположить, что ВЧЭМС, увеличивая афферентный поток в условиях его дефицита при опорной разгрузке, нормализует взаимодействие дорзального и вентрального путей.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при поддержке РФФИ (грант №19-013-00036).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Grabherr L., Mast F.W. Effects of microgravity on cognition: the case of mental imagery // J. Vestib. Res. 2010. V. 20. № 1. P. 53.
McIntyre J., Lipshits M. Central processes amplify and transform anisotropies of the visual System in a test of visual–haptic coordination // J. Neurosci. 2008. V. 28. № 5. P. 1246.
Basner M., Dinges D.F., Howard K. et al. Continuous and Intermittent Artificial Gravity as a Countermeasure to the Cognitive Effects of 60 Days of Head-Down Tilt Bed Rest // Front. Physiol. 2021. V. 12. P. 643854.
Laurie S.S., Lee S.M.C., Macias B.R. et al. Optic disc edema and choroidal engorgement in astronauts during spaceflight and individuals exposed to bed rest // JAMA Ophthalmol. 2019. V. 138. № 2. P. 165.
Marshall-Goebel K., Damani R., Bershad E.M. Brain physiological response and adaptation during spaceflight // Neurosurgery. 2019. V. 85. № 5. P. E815.
Stahn A.C., Riemer M., Wolbers T. et al. Spatial Updating Depends on Gravity // Front. Neural Circuits. 2020. V. 14. P. 20.
Roberts D.R., Stahn A.C., Seidler R.D., Wuyts F.L. Towards understanding the effects of spaceflight on the brain // Lancet Neurol. 2020. V. 19. № 10. P. 808.
Липшиц М.И., Гурфинкель В.С., Лестьен Ф., Ролль Ж.-П. Нейрофизиологические исследования в невесомости. I. Регуляция позы и движений / Орбитальная станция Мир. Космическая биология и медицина. М.: Изд-во ГНЦ РФ ИМБП РАН, 2002. Т. 2. С. 479.
Липшиц М.И., Макинтайер Д., Бертоз А. Нейрофизиологические исследования в невесомости. II. Сенсомоторное взаимодействие и внутренняя система отсчета / Орбитальная станция Мир. Космическая биология и медицина. М.: Изд-во ГНЦ РФ ИМБП РАН, 2002. Т. 2. С. 495.
Campbell F.W., Robson J.G. Application of Fourier Analyses to the Visibility of Gratings // J. Physiol. 1968. V. 197. № 3. P. 551.
Шошина И.И., Шелепин Ю.Е. Механизмы глобального и локального анализа зрительной информации при шизофрении. СПб.: Изд-во ВВМ, 2016. 300 с.
Milner A.D. How do the two visual streams interact with each other? // Exp. Brain Res. 2017. V. 235. № 5. P. 1297.
Croner L.J., Kaplan E. Receptive fields of P and M ganglion cells across the primate retina // Vision Res. 1995. V. 35. № 1. P. 7.
Merigan W.H., Maunsell J.H.R. How parallel are the primate visual pathways? // Ann. Rev. Neurosci. 1993. V. 16. P. 369.
Nassi J.J., Callaway E.M. Parallel Processing Strategies of the Primate Visual System // Nat. Rev. Neurosci. 2009. V. 10. № 5. P. 360.
Keґi S., Antal A., Szekeres G. et al. Spatiotemporal visual processing in schizophrenia // J. Neuropsychiatry Clin. Neurosci. 2002. V. 14. № 2. P. 190.
Andersen R.A., Buneo C.A. Intentional maps in posterior parietal cortex // Annu. Rev. Neurosci. 2002. V. 25. P. 189.
Tomilovskaya E., Shigueva T., Sayenko D. et al. Dry Immersion as a Ground-Based Model of Microgravity Physiological Effects // Front. Physiol. 2019. V. 10. P. 284.
Шошина И.И., Соснина И.С., Зеленский К.А. и др. Контрастная чувствительность зрительной системы в условиях “сухой” иммерсии // Биофизика. 2020. Т. 65. № 4. С. 798. Shoshina I.I., Sosnina I.S., Zelenskiy K.A. et al. The Contrast Sensitivity of the Visual System in “Dry” Immersion Conditions // Biophysics. 2020. V. 65. № 4. P. 681.
Даниличев С.Н., Пронин С.В., Шелепин Ю.Е. и др. Оптические и психофизические исследования зрительной системы космонавтов до и после длительных орбитальных полетов // Оптический журнал. 2019. Т. 86. № 11. С. 21.
Коряк Ю.А., Козловская И.Б., Корниенко М.Б. Тренировка мышечного аппарата методом электрической стимуляции в условиях невесомости / Пилотируемые полеты в космос. XI Международная научно-практическая конференция. 10–12 ноября 2015 года. Звездный городок, Моск. обл. 2015. С. 421.
Козловская И.Б., Ярманова Е.Н., Фомина Е.В., Коряк Ю.А. Пассивные средства в российской системе профилактики неблагоприятных влияний невесомости / XVI Конференция по космической биологии и медицине с международным участием. 5−8 декабря 2016 года. М., 2016. С. 106.
Oldfield R.C. The assessment and analysis of handedness: the Edinburgh inventory // Neuropsychologia. 1971. V. 9. № 1. P. 97.
Sosnina I.S., Lyakhovetskii V.A., Zelenskiy K.A. et al. Effects of Five-Day “Dry” Immersion on the Strength of the Ponzo and the Müller-Lyer Illusions // Neurosci. Behav. Physiol. 2019. V. 49. № 7. Р. 847. Соснина И.С., Ляховецкий В.А., Зеленский К.А. и др. Влияние 5-суточной “сухой” иммерсии на силу иллюзий Понзо и Мюллер-Лайера // Ж. высш. нерв. деят. им. И.П. Павлова. 2018. Т. 68. № 3. С. 313.
Коц Я.М., Хвилон В.А. Тренировка мышечной силы методом электростимуляции. Сообщение II // Теория и практика физической культуры. 1971. № 4. С. 66.
Шошина И.И., Шелепин Ю.Е., Конкина С.А. и др. Исследование парвоцеллюлярных и магноцеллюлярных зрительных каналов в норме и при психопатологии // Рос. физиол. журн. им. И.М. Сеченова. 2012. Т. 98. № 5. С. 657. Shoshina I.I., Shelepin Y.E., Konkina S.A. et al. Studies of the Parvocellular and Magnocellular Visual Channels in Health and Psychopathology // Neurosci. Behav. Physiol. 2014. V. 44. № 2. P. 244.
Shoshina I., Zavyalova E., Sergienko R. The functional state of magnocellular and parvocellular visual pathways is the biomarker of chronic stress // Int. J. Psychophysiol. 2018. V. 131S. P. 93.
Shoshina I., Isajeva E., Mukhitova Y. et al. The internal noise of the visual system and cognitive functions in schizophrenia // Procedia Computer Science. 2020. V. 169. P. 813.
Cheron G., Leroy A., Palmero-Soler E. et al. Gravity Influences Top-Down Signals in Visual Processing // PLoS ONE. 2014. V. 9. № 1. P. e82371.
Foley R., Whitwell R., Goodale M. The two-visual-systems hypothesis and the perspectival features of visual experience // Conscious. Cogn. 2015. V. 35. P. 225.
Goodale M.A., Milner A.D. Separate visual pathways for perception and action // Trends Neurosci. 1992. V. 15. № 1. P. 20.
Goodale M.A. How (and why) the visual control of action differs from visual perception // Proc. Biol. Sci. 2014. V. 281. № 1785. P. 20140337.
Klatzky R.L. Allocentric and egocentric spatial representations: Definitions, distinctions, and interconnections. New York: Springer, 1998. V. 1. P. 1.
Foley R. The Two-Visual-Systems Hypothesis and the View From Here / Spatial Senses. New York: Routledge, 2019. P. 92. https://doi.org/10.4324/9781315146935-6
Gramann K., Onton J., Riccobon D. et al. Human Brain Dynamics Accompanying Use of Egocentric and Allocentric Reference Frames during Navigation // J. Cogn. Neurosci. 2010. V. 22. № 12. P. 2836.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека