Физиология человека, 2023, T. 49, № 2, стр. 44-53
Восьминедельная аэробная тренировка активирует биогенез внеклеточного матрикса в скелетной мышце человека
Е. М. Леднев 1, *, Е. А. Лысенко 1, В. Г. Згода 2, Г. Р. Газизова 3, Е. И. Шагимарданова 3, П. А. Махновский 1, О. Л. Виноградова 1, 4, В. Э. Дубров 4, Д. В. Попов 1, 4
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 ФГБНУ Научно-исследовательский институт биомедицинской химии
имени В.Н. Ореховича
Москва, Россия
3 Казанский государственный университет
Казань, Татарстан, Россия
4 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
* E-mail: ledhauz@gmail.com
Поступила в редакцию 10.03.2022
После доработки 07.06.2022
Принята к публикации 24.06.2022
- EDN: MJQLSU
- DOI: 10.31857/S013116462210023X
Аннотация
Целью работы было исследование влияния 8-недельных аэробных тренировок умеренной интенсивности без ударных воздействий на активацию экспрессии генов внеклеточного матрикса (ВКМ) в скелетной мышце. Механические ударные воздействия активируют биогенез ВКМ в скелетной мышце, поэтому в исследовании были использованы аэробные физические упражнения на велоэргометре, включающие только концентрические сокращения мышц. У семи молодых нетренированных мужчин были взяты пробы из m. vastus lateralis до и после 8-недельных аэробных тренировок. В пробах оценивали изменения транскриптома (РНК секвенирование) и протеома (панорамный количественный масс-спектрометрический анализ); белки, ассоциированные с ВКМ (объединенные общим термином “матрисом”), определяли по базе данных MatrisomeDB. После тренировки было обнаружено изменение (главным образом увеличение) содержания 14 белков ВКМ и 134 мРНК белков ВКМ. Наибольший прирост содержания белков найден для коллагенов 1 и 3 типа (1.7 и 2.2 раза, соответственно) – основные белки ВКМ скелетной мышцы человека, что согласовалось с увеличением соответствующих мРНК в 10–20 раз. Помимо этого, было найдено увеличение экспрессии более сотни мРНК коллагенов, гликопротеинов, протеогликанов и энзиматических регуляторов ВКМ, происходящее на фоне увеличения экспрессии генов основных ростовых факторов, регулирующих биогенез ВКМ (IGF1, PDGFs, TGFB1, MDK и др.). Таким образом, регулярные 8-недельные аэробные нагрузки без ударных воздействий на мышцы являются мощным стимулом для активации биогенеза ВКМ в скелетной мышце.
Одна из наиболее распространенных категорий травм опорно-двигательного аппарата – повреждения скелетных мышц, сухожилий и связок различной степени выраженности. Вероятность получения таких повреждений при выполнении повседневных физических нагрузок высока у людей среднего и пожилого возраста, а также у людей со сниженными функциональными возможностями опорно-двигательного аппарата (пониженные силовые возможности и работоспособность, а также прочность и эластичность связок и сухожилий). Снижение функциональных возможностей и толерантности скелетных мышц к повседневным физическим нагрузкам, как и увеличение их повреждаемости, наблюдается уже через несколько дней иммобилизации конечности, постельной гипокинезии или пребывания в условиях гипогравитации [1–3]. Это обусловлено рядом изменений, включающих снижение скорости синтеза мышечных белков и мышечной массы, митохондриальной плотности и окислительных возможностей мышц, увеличение воспаления, отека, появление болевого синдрома, а также нарушение биогенеза внутримышечных соединительнотканных структур, в том числе внеклеточного матрикса (ВКМ) [1, 4–8]. ВКМ играет ключевую роль в передаче усилия от сокращающихся мышечных волокон к сухожилиям, предотвращении повреждений мышечных мембран при физических нагрузках, доставке и удержании различных биомолекул (включая энзимы и ростовые факторы), а при восстановлении после травм мышц ВКМ отвечает за ориентирование мышечных волокон [9–13]. Поэтому разработка подходов к активации биогенеза ВКМ актуальна не только для предотвращения травм мышц при пониженных функциональных возможностях, но и для реабилитации после травм опорно-двигательного аппарата.
Регулярные силовые упражнения (короткие высокоинтенсивные физические нагрузки) эффективны для увеличения мышечной массы и силы и для активации биогенеза ВКМ [14–17]. Однако эти упражнения в большинстве случаев малоприменимы при реабилитации после травм и/или после длительной гиподинамии из-за высокой травматичности. Регулярные аэробные упражнения (низкоинтенсивные и продолжительные физические нагрузки) увеличивают аэробную работоспособность (выносливость), но слабо влияют на массу и силу мышц. При этом такие тренировки снижают повреждаемость мышечных мембран в ответ на однократную нагрузку [18–20], что предположительно связано с активацией биогенеза ВКМ. Однако молекулярные механизмы, отвечающие за активацию биогенеза ВКМ при аэробных тренировках, изучены фрагментарно [21, 22].
Целью настоящей работы было исследование влияния 8-недельных аэробных тренировок умеренной интенсивности без ударных воздействий на активацию экспрессии генов ВКМ в тренируемой скелетной мышце (m. vastus lateralis). Ударные нагрузки с эксцентрическими сокращениями мышц (такие, как бег) могут быть триггером для активации биогенеза ВКМ [23]. Для исключения таких эффектов в нашем исследовании были использованы аэробные физические упражнения на велоэргометре, включающие только концентрические сокращения мышц. ВКМ включает около трех сотен различных белков, разделенных на функциональные группы: коллагены (фибриллярные гликопротеины, наиболее представленные в ВКМ всех тканей человека и играющие ключевую роль в формировании структуры соединительной ткани), структурные гликопротеины и протеогликаны (образуют основное вещество ВКМ), а также около тысячи ассоциированных с ВКМ белков: энзиматические регуляторы (ферменты, непосредственно участвующие в ремоделировании ВКМ), секретируемые факторы (белки, секретируемые различными клетками мышечной ткани при ремоделировании ВКМ, в том числе факторы роста). Все вышеперечисленные функциональные группы белков объединены общим термином – матрисом. Ввиду большого количества белков матрисома использование широкозахватных методов (РНК секвенирование и масс-спектрометрический протеомный анализ) представляется логичным подходом, позволяющим оценить изменения в экспрессии практически всех мРНК белков, относящихся к ВКМ, и изменения содержания высокопредставленных белков (таких, как коллагены). Физиологические эффекты этой тренировочной программы и результаты транскриптомного и протеомного анализа были представлены и обсуждены ранее [24, 25]. В настоящем исследовании провели углубленный анализ влияния тренировок на экспрессию генов всех белков, относящихся к ВКМ. Список этих генов был взят из базы данных MatrisomeDB, содержащей исчерпывающую информацию о различных функциональных группах белков, ассоциированных с ВКМ [26–29].
МЕТОДИКА
В эксперименте принимали участие 7 нетренированных молодых мужчин (возраст – 21–24 года, масса тела – 72–79 кг, индекс массы тела – 22–25 кг/м2). Добровольцы на протяжении 8 нед. выполняли аэробные упражнения на электромагнитном велоэргометре (Ergoselect 200, Ergoline, Германия): 5 раз в неделю, 1 ч в день, как описано нами ранее [25]. Кратко, до тренировочного периода и каждые две недели добровольцы выполняли тест с возрастающей нагрузкой на велоэргометре (15 Вт/мин). Во время теста каждые две минуты брали пробы капиллярной крови для оценки концентрации лактата; порог анаэробного обмена (маркер аэробных возможностей организма) оценивали, как мощность при уровне лактата 4 мМ (LT4) [30]. Во время тренировочного периода добровольцы поочередно выполняли упражнения с постоянной (60 мин, 70% LT4) и переменной (3 мин 50% LT4 + 2 мин 85% LT4) × 12) мощностью. Пробы из m. vastus lateralis брали до и после тренировочного периода в базальном состоянии (через 48 ч после последнего упражнения) с помощью игольчатой биопсии под местной анестезией (2 мл 2% лидокаина), как описано нами ранее [25].
Панорамный масс-спектрометрический анализ. Подготовка проб и протеомный анализ описаны нами ранее [24]. Кратко, фрагмент замороженной ткани (~15 мг) гомогенизировали в буфере (4% додецилсульфат натрия в 0.1 М трис-HCl, pH 7.6, 0.1 М дитиотреитол), инкубировали 5 мин при 95°С, обрабатывали ультразвуком (2 раза по 10 с при 100 Вт) и центрифугировали (5 мин, 16 000 g). Алкилирование и трипсинолиз белков (12 ч, трипсин 1 : 100 (Tripsin Gold, Promega, США) в 40 мкл 0.1 М бикарбоната триэтиламмония) проводили на фильтре YM-30 (Millipore, Ирландия) методом FASP. Пептиды смывали с фильтра центрифугированием (10 мин, 14000 g) и метили изобарической меткой iTRAQ 8-plex (Sciex, США). Смесь меченых пептидов концентрировали и фракционировали при помощи колонок XBridge C18 (250 × 4.6 мм, размер частиц 5 мкм, Waters, Ирландия) на хроматографе Agilent 1200 Series (Agilent, США). Полученные фракции (30 шт) концентрировали и объединяли в 10 смешанных фракций. Каждую фракцию трижды разделяли на хроматографе Ultimate 3000 RSLCnano (предколонка Accalaim (0.5 × 3 мм, размер частиц 5 мкм) и колонка Acclaim Pepmap C18 (75 мкм × 150 мм, размер частиц 2 мкм); все Thermo Scientific, США) в градиентном режиме элюирования (90 мин) и анализировали на масс-спектрометре Q Exactive HF (Thermo Scientific, США).
Поиск и идентификацию репортерных ионов проводили, используя платформу MaxQuant (1.5.7.4) с настройками по умолчанию для false discovery rate (FDR) 1%. Данные обрабатывали на платформе Perseus (1.6.1.2): после фильтрации, для каждого белка рассчитывали отношение интенсивностей репортерных ионов (интенсивность “после” тренировки к интенсивности “до” тренировки); затем оценивали изменения интенсивностей репортерных ионов (содержание белков) с помощью знакового рангового критерия Вилкоксона при padj < 0.05 (поправка на множественное сравнение Бенджамини–Хохберга).
РНК секвенирование. Подготовка проб и анализ описан нами ранее [25]. Кратко, замороженные образцы ткани (~20 мг) гомогенизировали, РНК экстрагировали при помощи колонок RNeasy Mini Kit (Qiagen, Германия). Концентрацию РНК измеряли на флуориметре Qubit 3.0 (Thermo Scientific, США), целостность РНК оценивали с помощью капиллярного электрофореза (Bioanalyzer 2100, Agilent, США). Библиотеки готовили из 300 нг РНК с использованием набора NEB Next Ultra II RNA (New England Biolabs, США) согласно протоколу производителя. Концентрацию библиотек измеряли на флуориметре Qubit 3.0, распределение длин фрагментов библиотек оценивали, используя Bioanalyzer 2100. Эффективную концентрацию библиотек оценивали с помощью ПЦР в реальном времени. Библиотеки секвенировали на приборе NextSeq 500 (Illumina, США) в режиме одноконцевых прочтений. Среднее количество прочтений на образец составило 47 млн.
Качество данных оценивали с помощью FASTQC (v0.11.4); последовательности адаптеров и прочтения низкого качества удаляли с помощью Timmomatic (v0.36). Прочтения картировали на человеческий геном GRCh38. Выделяли белок-кодирующие гены и анализировали изменение их экспрессии, используя пакет DESeq2 R (анализ парных образцов) с критериями отсечения padj < 0.05 (поправка Бенджамини–Хохберга) и |log2(Fold Change)| > log2(1.25).
Анализ функционального обогащения. Для поиска генов/белков, относящихся к различных функциональным группам ВКМ, все детектированные нами гены/белки сопоставляли с базой данных MatrisomeDB, содержащей информацию о белках ВКМ: 44 коллагена, 195 гликопротеинов и 35 протеогликанов, а также о ВКМ-ассоциированных белках: 238 энзиматических регуляторов, 171 ВКМ-аффилированный белок и 344 секретируемых факторов. Для выявления функциональных групп, обогащенных генами, изменившими экспрессию после 8-недельной аэробной тренировки, относительно всех детектированных генов использовали тест χ2 (хи-квадрат) с поправкой Бонферрони при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Как было описано нами ранее [31], 8-недельные тренировки привели к выраженному приросту аэробной работоспособности на уровне организма: мощность на анаэробном пороге возросла на 35% (p < 0.01).
В образцах мышечной ткани, взятых до и после периода тренировок, было детектировано 13279 мРНК белок-кодирующих генов и 795 белков. Среди них мы выявили 501 мРНК и 32 белка, относящихся к матрисому. После 8 нед. тренировки было обнаружено изменение (главным образом, увеличение) содержания 1650 мРНК и 250 белков (табл. 1). Из них 9 детектированных белков и 34 мРНК относилось к группе коллагенов, 7 и 22, соответственно – к протеогликанам, 5 и 139 – гликопротеинам, 8 и 137 – энзиматическим регуляторам, 3 и 169 – секретируемым факторам (табл. 1).
Таблица 1.
Количество детектированных и увеличивших содержание мРНК (padj < 0.01) и белков (padj < 0.05) в латеральной головке четырехглавой мышцы бедра после 8-недельных аэробных тренировок
| Категория белков Matrisome | Кол-во белков в Matrisome | Детектировано мРНК | Детектировано белков | мРНК, увеличившие содержание | мРНК, снизившие содержание | Белки, увеличившие содержание | Белки, снизившие содержание |
|---|---|---|---|---|---|---|---|
| Коллагены | 44 | 34 | 9 | 16 | 0 | 8 | 0 |
| Регуляторы | 238 | 137 | 8 | 46 | 3 | 1 | 0 |
| Секретируемые факторы | 344 | 169 | 3 | 24 | 2 | 1 | 0 |
| Гликопротеины | 195 | 139 | 5 | 42 | 2 | 1 | 0 |
| Протеогликаны | 35 | 22 | 7 | 6 | 1 | 3 | 0 |
| Прочие (не матрисом) | 12 778 | 763 | 1516 | 587 | 236 | 2 | |
| Всего | 13 279 | 795 | 1650 | 595 | 250 | 2 |
Значимое (padj < 0.05) увеличение содержания белков было найдено, главным образом, для группы коллагенов (8 белков), а также для 3 белков протеогликанов и для 1 белка в каждой из групп гликопротеинов, секретируемых факторов и регуляторов ВКМ (табл. 1). Среди коллагенов наибольшее увеличение содержания белков было найдено для COL1A1/2 (1.7 раз) и COL3A1 (2.2 раза) (рис. 1) – основных белков ВКМ скелетной мышцы человека [32], что согласовалось с увеличением соответствующих мРНК в 19.7 для COL1A1, в 2.9 раз для COL1A2 и в 9.8 раз для COL3A1. Помимо этого, увеличение (padj < 0.01) содержания мРНК было показано для 14 других генов коллагенов, белковые продукты которых не были детектированы (рис. 1).
Рис. 1.
мРНК и белки коллагенов, увеличившие (padj < 0.01 и 0.05, соответственно) содержание в латеральной головке четырехглавой мышцы бедра после 8-недельной аэробной тренировки. Изменения содержания мРНК и белков представлены в виде log2.

В отличие от панорамного масс-спектрометрического анализа, РНК секвенирование позволяет оценить экспрессию практически всех экспрессируемых генов, в том числе относящихся к матрисому. Это дало возможность выделить обогащенные функциональные группы матрисома, т.е. группы, в которых доля генов, увеличивших экспрессию после периода тренировок, по отношению ко всем генам, увеличившим экспрессию, значимо больше, чем доля генов, относящихся к этой же функциональной группе, по отношению ко всем детектируемым белок-кодирующим генам. Значимое обогащение (p < 0.05) было обнаружено для групп коллагены, энзиматические регуляторы и гликопротеины (рис. 2).
Рис. 2.
Анализ обогащения различных функциональных групп генов матрисома. Показано количество генов, изменивших содержание мРНК в каждой группе, а также значения p в виде –log10.

При рассмотрении каждой функциональной группы некоторые из них (энзиматические регуляторы, секретируемые факторы) удалось разбить на подгруппы генов с различными функциями. Так, среди изменивших экспрессию мРНК энзиматических регуляторов (46 генов), выделяются подгруппы металлопротеиназ, регуляторов коллагеновой сети и регуляторов сигнального каскада IGF1 и регенерации мышечных волокон (рис. 3).
Рис. 3.
мРНК энзиматических регуляторов, изменившие содержание (padj < 0.01). Изменения содержания мРНК представлены в виде log2.
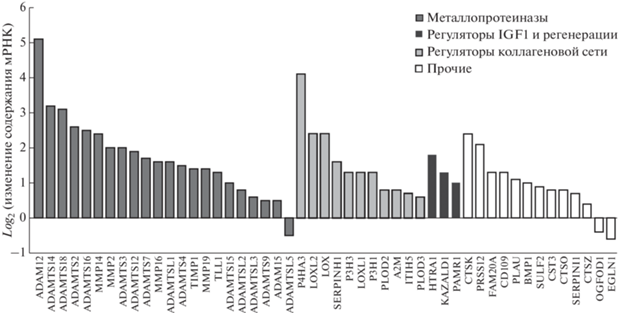
Среди увеличивших экспрессию мРНК секретируемых факторов (24 гена) выделяются подгруппы ростовых факторов и регуляторов костного метаболизма; оставшиеся секретируемые факторы включают несколько цитокинов (CCL2, CCL18, CXCL9 и IL34) (рис. 4).
Рис. 4.
мРНК секретируемых факторов, изменившие содержание (padj < 0.01). Остальные обозначения см. рис. 3.

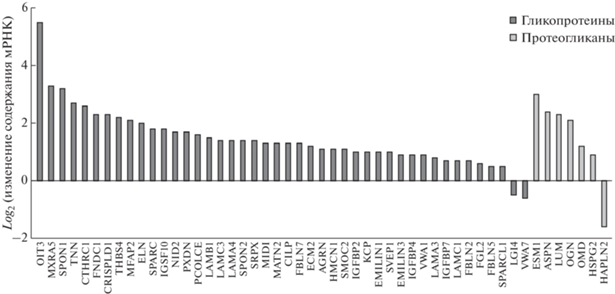
мРНК, увеличившие экспрессию (padj < 0.01) в группах гликопротеины и протеогликаны, представлены на рис. 5. Стоит отметить, что в группе гликопротеинов в 4 раза увеличил содержание мРНК ген ELN, кодирующий эластин – четвертый по представленности белок в ВКМ скелетной мышцы [32].
Рис. 5.
мРНК гликопротеинов и протеогликанов, изменившие содержание (padj < 0.01). Остальные обозначения см. рис. 3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Коллагены составляют две трети от всех белков ВКМ, при этом коллагены 1 и 3 типа составляют более 50% массы белков ВКМ в скелетной мышце человека [32]. Ранее в экспериментах на животных и с участием добровольцев было показано, что регулярные высокоинтенсивные кратковременные физические нагрузки, приводящие к росту мышечной массы (силовые упражнения), вызывают увеличение экспрессии генов, кодирующих коллагены, и активируют биогенез ВКМ. Так, 12-недельная силовая тренировка крыс (лазание по лестнице с отягощением) привела к росту экспрессии мРНК коллагенов 1 и 3 типа в скелетной мышце [14], экспрессии и активности металлопротеиназ (MMP 2 и 9) в скелетной мышце и крови [14, 15]. Силовая тренировка нижних конечностей (3 раза в неделю, 11 нед.) молодых (27 лет) нетренированных мужчин привела к значительному росту экспрессии генов в m.vastus lateralis – в частности, в 5.2 раза выросло содержание мРНК COL1A1 [16]. В другом исследовании 10-недельная силовая тренировка (жим ногами) молодых (26 лет) нетренированных мужчин привела к значительному усилению экспрессии генов, относящихся к ВКМ [17]. Эти данные согласуются с тем, что в скелетной мышце человека после регулярных силовых тренировок гены, увеличившие экспрессию, обогащены генами, связанными с ВКМ (мета-анализ транскриптомных данных) [33].
В нашей работе было показано, что тренировки без использования высокоинтенсивных и эксцентрических физических нагрузок, а именно аэробные тренировки умеренной интенсивности на велоэргометре, являются достаточным стимулом для выраженной активации биогенеза ВКМ, увеличения содержания основных белков ВКМ коллагенов 1 и 3 типов (в 2–3 раза), а также других коллагенов, выполняющих преимущественно структурные и регуляторные функции (коллагены 4, 6 типа и 11, 14, 15 типа, соответственно; в 1.2–1.7 раз). Эти изменения произошли на фоне увеличения экспрессии соответствующих мРНК, а также мРНК других коллагенов, белковые продукты которых не были детектированы нами, и около сотни мРНК, кодирующих гликопротеины, протеогликаны и энзиматические регуляторы биогенеза ВКМ. Кроме того, аналогичные изменения в транскриптоме наблюдались в различных работах с добровольцами. Так, 12-недельная (5 раз в неделю, 60 мин в день) тренировка на велоэргометре молодых (19–32 года) нетренированных мужчин привела к росту экспрессии генов ВКМ, в частности, коллагена 1 типа [34].
Интересно отметить, что сходные эффекты наблюдались для пожилых людей (64 года): 6-недельная аэробная тренировка на велоэргометре (5 раз в неделю, 60 мин в день, умеренная аэробная нагрузка) привела к выраженному росту экспрессии мРНК, в том числе коллагенов 3, 4 типа [35]. Двенадцать недель аэробной тренировки на велоэргометре (3 раза в неделю, 45 мин в день) пожилых добровольцев (68 лет) привели к изменениям экспрессии 397 генов, среди которых также увеличили экспрессию мРНК коллагенов COL3A1, COL6A3 и секретируемых факторов TNFSF10, CRLF3, а снизили экспрессию мРНК гликопротеинов IGFBP6 и DPT, энзиматических регуляторов F10, ADAMTS5 и секретируемых факторов S100A6 и CXCL14 [36].
Мы показали (рис. 3 и 4), что, помимо активации экспрессии коллагенов, регулярные аэробные физические нагрузки вызывают масштабное и выраженное увеличение экспрессии генов металлопротеиназ и других ферментов, участвующих в ремоделировании ВКМ, в основном, за счет деградации старых связей и молекул коллагенов (особенно 1, 3 и 4 типа) [37–41]. Помимо этого, нами было обнаружено увеличение экспрессии большого количества гликопротеинов (включая эластин – третий по представленности белок скелетных мышц человека), выполняющих различные структурные и регуляторные функции. Это полностью совпадает с результатами мета-анализа, изучавшего транскриптомные ответы на регулярные аэробные тренировки и показавшего, что в скелетной мышце человека набор генов, увеличивших экспрессию после регулярных аэробных тренировок, обогащен генами, связанными с ВКМ [42], однако эти данные не согласуются с другим мета-анализом [33].
Несмотря на отсутствие в нашей работе значимого обогащения генов секретируемых факторов (рис. 3), мы обнаружили увеличение (~2 раза) экспрессии отдельных генов ростовых факторов (рис. 5). В модельных исследованиях с изменением генной экспрессии было показано, что эти факторы играют важную роль в регуляции биогенеза ВКМ как в скелетной мышце: IGF1, MDK [43, 44], PDGFB и PDGFD [45], TGFB1 [46, 47], так и в других тканях: HGF [48, 49], INHBB [50], PGF [51]. Эти данные согласуются с результатами работы на грызунах с тенотомией мышц-синергистов (модель хронического увеличения нагрузки на мышцу), показавшей увеличение концентрации белков ВКМ и экспрессии Igf1 и Tgf в подошвенной мышце [52–54].
ЗАКЛЮЧЕНИЕ
Наши результаты показывают, что, несмотря на низкую интенсивность, регулярные аэробные физические упражнения без ударных нагрузок являются мощным стимулом для активации биогенеза ВКМ. В частности, обнаружили выраженный рост содержания основных белков ВКМ – коллагенов 1 и 3 типа, а также увеличение экспрессии более сотни мРНК коллагенов, гликопротеинов, протеогликанов и энзиматических регуляторов ВКМ, происходящие на фоне увеличения экспрессии генов основных ростовых факторов, регулирующих биогенез ВКМ (IGF1, PDGFs, TGFB1, MDK и др.). Благодаря применению широкозахватных методик впервые удалось оценить влияние длительных аэробных тренировок на экспрессию всех генов ВКМ, а также на содержание ключевых белков ВКМ. Аэробные упражнения без ударных воздействий, в отличие от силовых нагрузок и нагрузок с ударным и эксцентрическим компонентом (например, бег), применимы для бóльшего контингента людей, нуждающихся в восстановлении функции скелетных мышц (и, возможно, сухожилий и связок) – люди с пониженными функциональными возможностями, пациенты после травм и/или длительного периода гиподинамии, космонавты в период восстановления после полета и т.д. Поэтому использование аэробных упражнений может быть перспективно как для оптимизации существующих подходов к восстановлению после травм опорно-двигательного аппарата, так и для предотвращения травм при пониженных функциональных возможностях.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях и одобрены Комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва) (Протокол № 404).
Информированное согласие. Каждый участник исследования предоставил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках РНФ (грант № 14-15-00768) и бюджетной темы НИР ФФМ МГУ им. М.В. Ломоносова “Системные, клеточные и молекулярные механизмы функционирования организма в экстремальных условиях”. Масс-спектрометрические измерения выполнены на оборудовании ЦКП “Протеом человека” на базе НИИ биомедицинской химии им. В.Н. Ореховича (Москва).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Вклад авторов в публикацию. Е.М. Леднев, Е.А. Лысенко, О.Л. Виноградова, В.Э. Дубров и Д.В. Попов принимали участие в организации и проведении физиологического эксперимента с добровольцами. Е.М. Леднев, Д.В. Попов и В.Э. Дубров организовывали и проводили биопсии скелетной мышечной ткани. В.Г. Згода выполнял панорамный масс-спектрометрический протеомный анализ. Г.Р. Газизова и Е.И. Шагимарданова выполняли РНК секвенирование. Е.М. Леднев, Е.А. Лысенко, П.А. Махновский, О.Л. Виноградова, В.Э. Дубров и Д.В. Попов выполняли биоинформатический и статистический анализ полученных данных и готовили текст рукописи.
Список литературы
Narici M.V., Boer M.D. De. Disuse of the musculo-skeletal system in space and on earth // Eur. J. Appl. Physiol. 2011. V. 111. № 3. P. 403.
Hackney K.J., Ploutz-Snyder L.L. Unilateral lower limb suspension: Integrative physiological knowledge from the past 20 years (1991–2011) // Eur. J. Appl. Physiol. 2012. V. 112. № 1. P. 9.
Hyatt H., Deminice R., Yoshihara T., Powers S.K. et al. Mitochondrial dysfunction induces muscle atrophy during prolonged inactivity: A review of the causes and effects // Arch. Biochem. Biophys. 2019. V. 662. P. 49.
Bamman M.M., Clarke M.S.F., Feeback D.L. et al. Impact of resistance exercise during bed rest on skeletal muscle sarcopenia and myosin isoform distribution // J. Appl. Physiol. 1998. V. 84. № 1. P. 157.
Crossland H., Skirrow S., Puthucheary Z.A. et al. The impact of immobilisation and inflammation on the regulation of muscle mass and insulin resistance: different routes to similar end-points // J. Physiol. 2019. V. 597. № 5. P. 1259.
Hortobágyi T., Dempsey L., Fraser D. et al. Changes in muscle strength, muscle fibre size and myofibrillar gene expression after immobilization and retraining in humans // J. Physiol. 2000. V. 524. Pt. 1. P. 293.
Rudrappa S.S., Wilkinson D.J., Greenhaff P.L. et al. Human skeletal muscle disuse atrophy: Effects on muscle protein synthesis, breakdown, and insulin resistance-A qualitative review // Front. Physiol. 2016. V. 7. P. 361.
Yasuda N., Glover E.I., Phillips S.M. et al. Sex-based differences in skeletal muscle function and morphology with short-term limb immobilization // J. Appl. Physiol. 2005. V. 99. № 3. P. 1085.
Webster M.T., Manor U., Lippincott–Schwartz J., Fan C.M. Intravital imaging reveals ghost fibers as architectural units guiding myogenic progenitors during regeneration // Cell Stem Cell. 2016. V. 18. № 2. P. 243.
Gillies A.R., Lieber R.L. Structure and function of the skeletal muscle extracellular matrix // Muscle Nerve. 2011. V. 44. № 3. P. 318.
Heredia J.E., Mukundan L., Chen F.M. et al. Type 2 innate signals stimulate fibro/adipogenic progenitors to facilitate muscle regeneration // Cell. 2013. V. 153. № 2. P. 376.
Joe A.W.B., Yi L., Natarajan A. et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis // Nat. Cell Biol. 2010. V. 12. № 2. P. 153.
Trotter J.A., Purslow P.P. Functional morphology of the endomysium in series fibered muscles // J. Morphol. 1992. V. 212. № 2. P. 109.
Guzzoni V., Ribeiro M.B.T., Lopes G.N. et al. Effect of resistance training on extracellular matrix adaptations in skeletal muscle of older rats // Front. Physiol. 2018. V. 9. P. 374.
Sousa Neto I.V. de, Durigan J.L.Q., Guzzoni V. et al. Effects of resistance training on matrix metalloproteinase activity in skeletal muscles and blood circulation during aging // Front. Physiol. 2018. V. 9. P. 190.
Norheim F., Raastad T., Thiede B. et al. Proteomic identification of secreted proteins from human skeletal muscle cells and expression in response to strength training // Am. J. Physiol. Endocrinol. Metab. 2011. V. 301. № 5. P. E1013.
Damas F., Ugrinowitsch C., Libardi C.A. et al. Resistance training in young men induces muscle transcriptome-wide changes associated with muscle structure and metabolism refining the response to exercise-induced stress // Eur. J. Appl. Physiol. 2018. V. 118. № 12. P. 2607.
Vincent H.K., Vincent K.R. The effect of training status on the serum creatine kinase response, soreness and muscle function following resistance exercise // Int. J. Sports Med. 1997. V. 18. № 6. P. 431.
Fehrenbach E., Niess A.M., Schlotz E. et al. Transcriptional and translational regulation of heat shock proteins in leukocytes of endurance runners // J. Appl. Physiol. 2000. V. 89. № 2. P. 704.
Brancaccio P., Lippi G., Maffulli N. Biochemical markers of muscular damage // Clin. Chem. Lab. Med. 2010. V. 48. № 6. P. 757.
Kritikaki E., Asterling R., Ward L. et al. Exercise training-induced extracellular matrix protein adaptation in locomotor muscles: A systematic review // Cells. 2021. V. 10. № 5. P. 1022.
Csapo R., Gumpenberger M., Wessner B. Skeletal Muscle Extracellular Matrix – What Do We Know About Its Composition, Regulation, and Physiological Roles? A Narrative Review // Front. Physiol. 2020. V. 11. P. 253.
Willis C.R.G., Deane C.S., Ames R.M. et al. Transcriptomic adaptation during skeletal muscle habituation to eccentric or concentric exercise training // Sci. Rep. 2021. V. 11. № 1. P. 23930.
Makhnovskii P.A., Zgoda V.G., Bokov R.O. et al. Regulation of Proteins in Human Skeletal Muscle: The Role of Transcription // Sci. Rep. 2020. V. 10. № 1. P. 3514.
Popov D.V., Makhnovskii P.A., Shagimardanova E.I. et al. Contractile activity-specific transcriptome response to acute endurance exercise and training in human skeletal muscle // Am. J. Physiol. Endocrinol. Metab. 2019. V. 316. № 4. P. E605.
Naba A., Pearce O.M.T., Rosario A. Del et al. Characterization of the extracellular matrix of normal and diseased tissues using proteomics // J. Proteome Res. 2017. V. 16. № 8. P. 3083.
Naba A., Clauser K.R., Ding H. et al. The extracellular matrix: Tools and insights for the “omics” era // Matrix Biol. 2016. V. 49. P. 10.
Shao X., Taha I.N., Clauser K.R. et al. MatrisomeDB: The ECM-protein knowledge database // Nucleic Acids Res. 2020. V. 48. № D1. P. D1136.
Naba A., Clauser K.R., Hoersch S. et al. The matrisome: In silico definition and in vivo characterization by proteomics of normal and tumor extracellular matrices // Mol. Cell. Proteomics. 2012. V. 11. № 4. P. M111.014647.
Stegmann H., Kindermann W. Comparison of prolonged exercise tests at the individual anaerobic threshold and the fixed anaerobic threshold of 4 mmol.l(-1) lactate // Int. J. Sports Med. 1982. V. 3. № 2. P. 105.
Popov D.V., Lysenko E.A., Bokov R.O. et al. Effect of aerobic training on baseline expression of signaling and respiratory proteins in human skeletal muscle // Physiol. Rep. 2018. V. 6. № 17. P. e13868.
McKee T.J., Perlman G., Morris M., Komarova S.V. Extracellular matrix composition of connective tissues: a systematic review and meta-analysis // Sci. Rep. 2019. V. 9. № 1. P. 10542.
Pillon N.J., Gabriel B.M., Dollet L. et al. Transcriptomic profiling of skeletal muscle adaptations to exercise and inactivity // Nat. Commun. 2020. V. 11. № 1. P. 470.
Nishida Y., Tanaka H., Tobina T. et al. Regulation of muscle genes by moderate exercise // Int. J. Sports Med. 2010. V. 31. № 9. P. 656.
Riedl I., Yoshioka M., Nishida Y. et al. Regulation of skeletal muscle transcriptome in elderly men after 6 weeks of endurance training at lactate threshold intensity // Exp. Gerontol. 2010. V. 45. № 11. P. 896.
Radom-Aizik S., Hayek S., Shahar I. et al. Effects of Aerobic Training on Gene Expression in Skeletal Muscle of Elderly Men // Med. Sci. Sports Exerc. 2005. V. 37. № 10. P. 1680.
Cui N., Hu M., Khalil R.A. Biochemical and biological attributes of matrix metalloproteinases // Prog. Mol. Biol. Transl. Sci. 2017. V. 147. P. 1.
Visse R., Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: Structure, function, and biochemistry // Circ. Res. 2003. V. 92. № 8. P. 827.
Serra R. Matrix metalloproteinases in health and disease // Biomolecules. 2020. V. 10. № 8. P. 1138.
Alameddine H.S. Matrix metalloproteinases in skeletal muscles: Friends or foes? // Neurobiol. Dis. 2012. V. 48. № 3. P. 508.
Corcoran M.L., Hewitt R.E., Kleiner D.E., Steuer-Stevenson W.G. MMP-2: Expression, activation and inhibition // Enzyme Protein. 1996. V. 49. № 1–3. P. 7.
Makhnovskii P.A., Bokov R.O., Kolpakov F.A., Popov D.V. Transcriptomic signatures and upstream regulation in human skeletal muscle adapted to disuse and aerobic exercise // Int. J. Mol. Sci. 2021. V. 22. № 3. P. 1208.
Jones J.C., Kroscher K.A., Dilger A.C. Reductions in expression of growth regulating genes in skeletal muscle with age in wild type and myostatin null mice // BMC Physiol. 2014. V. 14. P. 3.
Ikutomo M., Sakakima H., Matsuda F. et al. Midkine-deficient mice delayed degeneration and regeneration after skeletal muscle injury // Acta Histochem. 2014. V. 116. № 2. P. 319.
Duffy F.J., Seiler J.G., Gelberman R.H., Hergrueter C.A. Growth factors and canine flexor tendon healing: Initial studies in uninjured and repair models // J. Hand Surg. Am. 1995. V. 20. № 4. P. 645.
Majewski M., Porter R.M., Betz O.B. et al. Improvement of tendon repair using miscle grafts transduced with TGF-β1 cDNA // Eur. Cells Mater. 2015. V. 23. P. 94.
Klein M.B., Yalamanchi N., Pham H. et al. Flexor tendon healing in vitro: Effects of TGF-β on tendon cell collagen production // J. Hand Surg. Am. 2002. V. 27. № 4. P. 615.
González M.N., Mello W. de, Butler-Browne G.S. et al. HGF potentiates extracellular matrix-driven migration of human myoblasts: Involvement of matrix metalloproteinases and MAPK/ERK pathway // Skelet. Muscle. 2017. V. 7. № 1. P. 20.
Karalaki M., Fili S., Philippou A., Koutsilieris M. Muscle regeneration: Cellular and molecular events // In Vivo (Brooklyn). 2009. V. 23. № 5. P. 779.
Arai K.Y., Nishiyama T. Developmental changes in extracellular matrix messenger RNAs in the mouse placenta during the second half of pregnancy: Possible factors involved in the regulation of placental extracellular matrix expression // Biol. Reprod. 2007. V. 77. № 6. P. 923.
Chen C.P., Yang Y.C., Su T.H. et al. Hypoxia and transforming growth factor-β1 act independently to increase extracellular matrix production by placental fibroblasts // J. Clin. Endocrinol. Metab. 2005. V. 90. № 2. P. 1083.
Williams P.E., Goldspink G. Connective tissue changes in surgically overloaded muscle // Cell Tissue Res. 1981. V. 221. № 2. P. 465.
Zamora A.J., Marini J.F. Tendon and myo-tendinous junction in an overloaded skeletal muscle of the rat // Anat. Embryol. (Berl). 1988. V. 179. № 1. P. 89.
White J.P., Reecy J.M., Washington T.A. et al. Overload-induced skeletal muscle extracellular matrix remodelling and myofibre growth in mice lacking IL-6 // Acta Physiol. 2009. V. 197. № 4. P. 321.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


