Физиология человека, 2023, T. 49, № 2, стр. 27-43
Изменение функций и архитектуры скелетной мышцы у человека под влиянием 21-суточной разгрузки двигательного аппарата без физической тренировки
Ю. А. Коряк 1, *, Т. Б. Кукоба 1, Д. Р. Бабич 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: yurikoryak@mail.ru
Поступила в редакцию 17.10.2021
После доработки 14.07.2022
Принята к публикации 05.08.2022
- EDN: GBPFFI
- DOI: 10.31857/S0131164622600604
Аннотация
В настоящем исследовании была рассмотрена гипотеза о том, что значительные изменения в архитектуре антигравитационных мышц могут произойти при экспозиции в условиях продолжительной “сухой” водной иммерсии (СИ) и, из-за общего снижения физической активности могут наблюдаться некоторые структурные изменения в постуральных мышцах. Десять мужчин-добровольцев (возраст (средняя ± средняя ошибка) – 24.5 ± 3.9 года, рост – 176.1 ± 1.2 м, масса – 71.1 ± 3.4 кг)) приняли участия в исследовании влияния 21-суточной разгрузки мышечного аппарата в условиях СИ. Во время экспозиции испытуемые не использовали физическую тренировку. Сократительные свойства мышц-разгибателей и сгибателей стопы (максимальная произвольная сила (МПС) и отношение сила-скорость) оценивали с использованием изокинетического динамометра. Внутреннюю архитектуру двух головок трехглавой мышцы голени (медиальной (МИМ) и латеральной (ЛИМ) икроножных мышц) определяли методом ультразвуковой визуализации в условиях in vivo при углах голеностопного сустава –15° (тыльное сгибание), 0° (нейтральная анатомическая позиция) и +30° (подошвенное сгибание) с углом в коленном суставе 180°. В каждой позиции были получены продольные ультразвуковые изображения (УЗИ) МИМ и ЛИМ на проксимальных уровнях 30% расстоянии между подколенной складкой и центром латеральной лодыжки. УЗИ были получены в состоянии покоя при каждой позиции голеностопного сустава с определением длины волокна (Lв) и угла наклона (Θв) мышечных волокон относительно их апоневроза. После СИ МПС мышц-разгибателей стопы снизилась в среднем на 19% (до 122.6 ± 43.1 Нм, после 99.5 ± 22.7 Нм), но не обнаружено значительных изменений в мышцах-сгибателей стопы. При изменении угла в голеностопном суставе с –15° до +30° Lв изменялась с 43 ± 1 до 32 ± 2 мм (25.6%, p < 0.01) в МИМ и с 45 ± 2 до 34 ± 1 мм (24.4%, p < 0.01) для ЛИМ и Θв увеличивался с 21° ± 1° до 26° ± 2° (23.8%) в МИМ и с 14° ± 1° до 18° ± 2° (28.6%) в ЛИМ. Данные позволяют предположить, что архитектура и функция перистых мышц человека взаимосвязаны in vivo. Большие изменения в антигравитационной МИМ по сравнению с ЛИМ, возможно, связаны с различиями в относительной нагрузке этих мышц во время ежедневной активности. Различные Lв и Θв и их изменения после разгрузки могут быть связаны с различиями в силовых способностях мышц и эластических характеристиках сухожилий и апоневрозов. Структурные мышечные изменения можно рассматривать как адаптационный процесс в ответ на неиспользование.
Эффекты длительного воздействия микрогравитации на организм человека хорошо изучены [1–3] и включают уменьшение объема, силы мышц и костной массы [4], аэробной [2, 5] и анаэробной производительности [6–8], а также ортостатическую непереносимость (9). Совсем недавно было обнаружено нарушение зрения, что, возможно, связано с изменениями внутричерепного давления [10], и это еще одно серьезное негативное влияние космического полета (КП). Отмеченные изменения расцениваются как самые большие проблемы для успешной работы космонавтов/астронавтов.
Гравитационная/физическая нагрузка необходима для поддержания размеров и силы скелетных мышц человека [11, 12]. Наиболее заметным эффектом разгрузки мышц является непропорционально большая потеря силы мышцы по сравнению с ее размером [11, 13]. Это указывает на то, что другие факторы, помимо общепризнанной атрофии, способствуют мышечной “слабости”. Более того, снижение управления произвольным движением [14–17], удельного напряжения, развиваемого отдельным мышечным волокном [18, 19], жесткости последовательно соединенного с мышцей сухожилия и мышечно-сухожильного комплекса (МСК) мышцы в целом [20–23], также обусловливает сокращение мышечной функции после неиспользования/разгрузки. Таким образом, потеря массы мышцы может только частично объяснить ослабление cократительных функций, а бóльшая часть, вероятно, объясняется уменьшением активации мышцы [14–16].
Сохранение механического выхода мышцы зависит от физической, гравитационной, нагрузки и, когда этот фактор устраняется, как, например, во время КП [24, 25] или наземных моделей, имитирующих эффекты микрогравитации, таких как иммобилизация [26, 27], “вывеска” нижней конечности [5, 27], жесткий постельный режим [15, 19, 21, 22, 28], антигравитационные мышцы, такие как разгибатели стопы и колена, особенно стопы, оказываются наиболее подвержены влиянию разгрузки [13, 29].
Мышечная архитектура, т.е. геометрическое расположение мышечных волокон, сильно определяет мышечную функцию, особенно отношения длина–натяжение и сила–скорость [30]. Поэтому неудивительно, что в некоторых исследованиях были обнаружены связи между параметрами мышечной архитектуры, в частности длиной пучка, и соотношением момент–угол [31], учитывая, что одним из предполагаемых механизмов изменения отношения длина–натяжение и сила–скорость может быть добавление большего количества саркомеров в серии [32]. Кроме того, другие факторы, влияющие на силу, такие как активация мышц, тип волокна и механическое поведение комплекса мышца-сухожилие, могут оказывать влияние на отношения длина–натяжение и сила–скорость [33]. Однако лишь несколько работ посвящены влиянию неиспользования на соотношение момент–угол и изменениям архитектуры мышц [34, 35]. Исследования, в которых анализировались изменения длины пучка, как функция изменения суставного угла, показали изменения длины волокна при удлинении мышцы [36]. Однако доступная информация об изменениях архитектуры мышц-разгибателей голеностопного сустава у человека при разгрузке мышечного аппарата крайне ограничена [37–41].
Внутренняя архитектура мышцы является важным детерминирующим фактором функциональных характеристик [42, 43]. Существует мало исследований о влиянии неиспользования [44] или моделируемой микрогравитации на мышечную архитектуру [11, 41]. Кроме того, внутренняя архитектура (длина и угол наклона волокон) различна для медиальной (МИМ) и латеральной (ЛИМ) икроножных мышц, которые формируют смешанную трехглавую мышцу голени [44].
В свете вышесказанного, целью данного исследования был анализ адаптаций функций и изменений внутренней архитектуры МИМ и ЛИМ после 3-недельной разгрузки без физической тренировки. Была выдвинута гипотеза о том, что значительные изменения в архитектуре антигравитационных мышц могут произойти под воздействием “сухой” водной иммерсии (СИ) и что в постуральных мышцах могут наблюдаться некоторые структурные изменения из-за общего снижения физической активности.
МЕТОДИКА
Для участия в эксперименте были приглашены молодые мужчины-добровольцы (n = 10; возраст – 24.5 ± 3.9 лет, рост – 176.1 ± 1.2 см и масса тела – 71.1 ± 3.4 кг). Участники эксперимента были отобраны после успешного прохождения медицинского и психологического отбора, а также после выполнения велоэргометрического нагрузочного теста11. Участники с употреблением наркотиков, алкоголя, с нарушением метаболизма кальция/костей, ортостатической непереносимости, вестибулярными расстройствами, заболеваниями мышц/суставов, хронической болью в спине, с хронической гипертензией и внутриглазной гипертензией, дефицитом железа, анемией, диабетом, артритом, гиперлипидемией и любым инфекционном или печеночном заболеванием или с положительным результатом на тромбофилию были исключены из списка. Все испытуемые были оценены клинически здоровыми, без неврологических расстройств и считались в хорошем физическом состоянии. В течение всего эксперимента испытуемые не принимали медицинских препаратов.
Дизайн исследования. Исследование выполняли в Институте медико-биологических проблем РАН (ИМБП РАН, г. Москва).
Общая цель исследования состояла в том, чтобы оценить влияние 21-суточной разгрузки мышечного аппарата в условиях СИ на сократительные (силовые и скоростно-силовые) свойства мышц-разгибателей и сгибателей стопы и на внутреннюю архитектуру МИМ и ЛИМ.
Все измерения выполняли на правой конечности испытуемых до и после 3-недельной экспозиции в условиях СИ. Тестирование включало измерение силы сокращения мышц-разгибателей и сгибателей стопы, отношения момент–суставной угол и мышечной архитектуру двух головок, составляющую сложную трехглавую мышцу голени.
Испытуемые выполняли две серии экспериментов: i) исследование силовых и скоростно-силовых свойств (эксперимент “Изокинез”) и ii) исследование взаимоотношения между суставными углами и архитектурой мышцы (длины и угла наклона мышечных волокон) ЛИМ и МИМ у человека в условиях in vivo при пассивном состоянии (эксперимент “Архитектура”). За день до начала экспозиции испытуемого в условия СИ выполняли эксперимент “Изокинез” (сбор исходных данных (СИД); СИД-1) и на следующий сутки после подъема (подъем (П); П +1) из ванны. Эксперимент “Архитектура” выполняли непосредственно в день экспозиции (СИД –0) испытуемого и сразу после подъема (П +0) из ванны. Испытуемые были ознакомлены с экспериментами во время предварительной сессии перед началом испытаний.
“Сухая” водная иммерсия. Для моделирования воздействия функциональной разгрузки мышечного аппарата использовали модель СИ [45]. Эта модель – удобный метод для исследований влияний разгрузки мышечного аппарата в наземных условиях.
Испытуемого помещали в специальную ванну с наполненной водой в “подвешенном” состоянии (закон Архимеда) на водонепроницаемую и высокоэластическую тканевую пленку, изолирующую поверхность тела испытуемого от контакта с водой. Температура воды в ванне была постоянной на уровне 33.4°C и автоматически поддерживалась на этом уровне в течение всего эксперимента. Продолжительность воздействия составляла 21 день, и испытуемый находился под постоянным медицинским наблюдением на протяжении 24 ч в течение всего воздействия. Испытуемый непосредственно в условиях иммерсионной ванны выполнял все функции, включая выделительные, прием пищи и все действия, связанные с личной гигиеной. Обслуживающий медицинский персонал постоянно присутствовал при транспортировании испытуемого, при выполнении личной гигиены, включая туалет и прием пищи, медицинском обслуживании в пределах ограничений протокола.
Мышечная функция
Изокинетическое тестирование. Испытуемые были дважды приглашены в лабораторию. Во время первого визита испытуемые были ознакомлены с экспериментальной установкой, с тестированием силовых и скоростно-силовых свойств мышц-разгибателей и сгибателей стопы с помощью изокинетического динамометра Biodex (Biodex Multi-Joint Systems, США). При последующем посещении (за сутки до экспозиции) был выполнен СИД-1. Все процедуры тестирования выполняли на правой конечности всех участников эксперимента.
Участники эксперимента удобно располагались в положении “сидя в кресле” изокинетического динамометра Biodex, при этом их туловище было закреплено к спинке сиденья поясными и плечевыми ремнями, чтобы гарантировать постоянное положение и минимальное движение. При этом тазобедренный сустав относительно жестко фиксировали под углом 120°, коленный сустав ~90° и голеностопный сустав с углом подошвенного сгибания 20°. Такая конфигурация положения суставов объясняется тем, что, когда коленный сустав находится в положении 90°, то комплекс икроножные мышцы−сухожилие становится относительно “слабым”, и, следовательно, чтобы дать компенсацию за этот эффект голеностопному суставу, было и придано положение подошвенного сгибания 20°. Латеральная лодыжка правой стопы была совмещена с осью вращения изокинетического динамометра, а центр коленного сустава был тщательно выровнен по оси вращения регистрирующего устройства динамометра. Участникам разрешали захватить боковые ручки, чтобы стабилизировать положение туловища.
Измерение максимального изометрического суставного момента. Всех испытуемых в первый день посещения лаборатории инструктировали воздерживаться в день тестирования от приема пищи (за 2 ч), кофеина (за 4 ч) и от применения физических упражнений (за 12 ч).
Перед проведением изокинетического тестирования испытуемый в течение 5 мин выполнял работу на велоэргометре с частотой педалирования 60–80 об./мин и с нагрузкой 25–50 Вт. Затем испытуемый выполнял стандартные процедуры разминки суставов, состоящие из пяти упражнений субмаксимальных повторений и двух-трех упражнений с максимальным повторением. После разминки испытуемые отдыхали не менее 2 мин.
После разминки обследуемого удобно размещали в кресле динамометра. Стопу конечности прикрепляли к специальной платформе динамометра с помощью неэластичных ремней, которые были прочно закреплены сзади и на нижней стороне платформы для предотвращения подъема пятки во время выполнения разгибания стопы. Если происходил подъем пятки или показатель суставного момента не возвращался к исходной величине, то протокол выполнения эксперимента останавливали и повторяли только после 3–5-мин отдыха. Испытуемые выполняли три произвольных максимальных изокинетических движений стопой из четырех подходов с угловой скоростью голеностопного сустава 0°/с–1, если третья попытка не превышала первых двух более чем на 10%. В этом случае проводили дополнительное испытание. Между каждой попыткой был отдых не менее 2 мин.
При тестировании изометрического суставного момента развиваемого мышцами-разгибателями или сгибателями стопы каждого испытуемого инструктировали “прикладывать максимальное усилие только в одном направлении” при каждом повторении и в каждом движении выполняемого теста и поддержать в течение 1–2 с. Суставной момент с поправкой на гравитацию в реальном времени отображался на экране компьютера. Во время тестирования никаких устных инструкций испытуемому не предоставляли. Наибольшее изометрическое значение суставного момента (пик момента) при 0°/с–1 принимали за показатель максимального произвольного сокращения (МПС). СИД-1 был выполнен за сутки перед экспозицией и последующие измерение на следующие сутки П +1 и протокол исследований был идентичным.
Измерение отношения изокинетического суставного момента к скорости. Тестирование мышц-разгибателей или сгибателей стопы выполняли в положении “сидя в кресле” изокинетического динамометра, причем угол коленного и голеностопного сустава составлял ~90° и 20°, соответственно, а ось голеностопного сустава совпадала с осью вращения регистрирующего устройства динамометра. Диапазон движения в случае максимального разгибания голеностопного сустава составлял ~25° и ~15° в случае максимального тыльного сгибания стопы.
Для каждого испытуемого регистрировали пик концентрического изокинетического суставного момента, развиваемого на каждой угловой скорости. Испытуемые были тщательно инструктированы выполнять каждое движение “как можно быстрее и сильнее”. Испытуемые выполняли две попытки из четырех повторений максимальных изокинетических разгибаний или сгибаний стопы с угловой скоростью 0°, 30°, 60°, 120° и 180°/с–1 с интервалом не менее 30 с между повторениями и 2 мин между угловыми скоростями [46].
Мышечная архитектура
Мышечную архитектуру измеряли в условиях in vivo в состоянии покоя. Измерения проводили на медицинской кровати в положении обследуемого “лежа на животе” под углом –6° с анатомическим положением голеностопного сустава и 0.5 длины голени “свисали” с края кровати. Стопу правой конечности обследуемого прижимали к специальной платформе устройства, закрепленного на медицинской кровати, позволяющей пассивно устанавливать голеностопный сустав в позицию –15° (подошвенное сгибание), 0° (нейтральная анатомическая позиция) и +30° (подошвенное разгибание). В каждой угловой позиции голеностопного сустава было получено продольное ультразвуковое изображение (УЗИ). Визуализацию МИМ и ЛИМ осуществляли в реальном времени в условиях in vivo с использованием В-режима ультразвуковой системы Edge (Edge, SonoSite, Inc., США) электронным линейным датчиком 7.5 МГц и апертурой 60 мм. Для лучшей акустической связи и, чтобы не травмировать кожную поверхность мышцы, сканирующую поверхность датчика покрывали трансмиссионным гелем и датчик ориентировали вдоль средне-сагиттальной плоскости мышцы перпендикулярно коже.
Датчик был выровнен в плоскости направления мышечного пучка (волокна), так, чтобы можно было рассматривать всю видимую часть пучков в окне сканирования. Качество УЗИ мышечного пучка достигалось регулировкой усиления по глубине и яркости ультразвукового сигнала. По УЗИ оценивали длину и угол наклона волокон мышцы. УЗИ мышц были получены на уровнях, соответствующих 30% МИМ и ЛИМ, расстояний между подколенной складкой и центром боковой лодыжки при нейтральном положении голеностопного сустава [47]. Каждый уровень соответствовал максимальной анатомической площади поперечного сечения соответствующей мышцы [48]. На этих уровнях помещали гиперэхогенный маркер, прикрепленный к коже, и ультразвуковой датчик устанавливали над маркером, который образовывал линию в окне УЗИ, и являлся индикатором положения датчика во время измерений длины и угла наклона мышечных волокон. Для повышения надежности при повторных измерениях местоположение датчика было зафиксировано, а во время повторных измерений сравнивали изображения до и после СИ, чтобы убедиться, что местоположение было одинаковым. Визуализацию мышц выполняли после предварительного 20-минутного отдыха для уравновешивания жидкостной среды организма [9, 49]. Во время УЗИ каждого испытуемого инструктировали – “полностью расслабить мышцы конечности”.
Угол наклона (Θв) волокон МИМ и ЛИМ определяли как угол вхождения волокна в глубокие слои апоневроза (рис. 1). Длину мышечных волокон (Lв) определяли как длину гипотенузы треугольника с углом, равным Θв, и стороной, противоположной этому углу, равной толщине мышцы (рис. 1).
Рис. 1.
Стандартные сагиттальные ультразвуковые изображения медиальной икроножной мышцы (МИМ). Ультразвуковой датчик располагался над мышцей на уровне 30%-го расстояния между подколенной складкой и центром боковой лодыжки. Длину волокна измеряли вдоль ультразвуковой сигнальной линии, проведенной параллельно волокну между глубоким и поверхностным апоневрозами. Угол наклона измеряли как угол, образованный линией, проведенной параллельно мышечному волокну между глубоким и поверхностным апоневрозами. Представлен угол (Θв) наклона и длина (Lв) волокна между глубоким и поверхностным апоневрозами. Маркер $ \downarrow $, расположенный между кожей и ультразвуковым датчиком, является ориентиром постоянства датчика во время измерений.
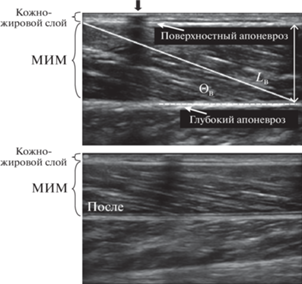
УЗИ записывали на жесткий диск Edge с последующим формированием файла. Архитектурные параметры УЗИ (Θв и Lв) мышц были количественно определены с использованием программного обеспечения для анализа изображений (Image J, 1.47v, National Institute of Health, США). При определении Lв видимая часть волокон была измерена непосредственно на экране ультразвукового окна. В некоторых случаях небольшая часть пучка выходила за пределы ультразвукового окна и, чтобы оценить невидимую часть, использовали линейную экстраполяцию волокон и апоневрозов [50, 51]. Такой методологический подход является правильным методом оценки длины мышечного волокна (пучка) [52] и надежность метода расчета крайне высока – значение внутриклассовой корреляции составляет 0.99. Ошибка линейной экстраполяции составляет не более 2–7% [52–54].
Расстояние между границей подкожно-жировой ткани и межмышечной фасцией определяли как толщину мышцы – ТМ (рис. 1). Физиологическая площадь поперечного сечения (ФППС) мышц была оценена в настоящем исследовании по следующему уравнению [54]:
Точность определения ΘB и LB с помощью ультразвука и с помощью анатомических измерений на рассеченной мышце ноги человека составляет ~94% [55], а оценка объема мышцы, рассчитанного с помощью магнитно-резонансной томографии, составляет ~97% от анатомических измерений [56]. Следовательно, изменения в архитектуре мышц можно изучать in vivo и не инвазивно с помощью ультразвука и расчетным методом.
УЗИ были собраны и проанализированы в цифровом виде одним и тем же оператором и у каждого обследуемого измеряли параметры не менее трех мышечных пучков, которые затем усредняли и использовали для дальнейшего анализа. Коэффициент вариации трех измерений находился в диапазоне 0–2% [57].
Статистика. Проверка переменных данных на нормальное распределение была выполнена с помощью теста Шапиро–Уилка. Различия переменных данных между фоновыми данными и данными, полученными после разгрузки опорно-двигательного аппарата, анализировали с помощью t-критериев независимых выборок. Процент изменения переменных данных при различных условиях был рассчитан как функция от исходной величины. Значимые различия между средними значениями были установлены на уровне 5% и данные выражены как средние ± ошибка средней.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Фоновые исследования показали, что сократительные свойства мышц-разгибателей/сгибателей стопы находились в пределах физиологической нормы, и испытуемые по своим функциональным возможностям могли быть охарактеризованы как практически здоровые люди, у которых отсутствовали нервно-мышечные расстройства и которые вели обычный двигательный образ жизни. Опорная разгрузка в течение 3 нед. показала существенные изменения как сократительных функций, так и внутренней архитектуры мышц.
Изменения мышечных функций
Изменение мышечной силы. Сила сокращения мышц-разгибателей стопы после 21-суточной разгрузки значительно снижалась. Так, величина максимального суставного момента (МПС) в среднем уменьшилась с 122.6 ± 33.7 до 99.5 ± ± 22.7 Н·м при угловой скорости 0°/с–1 (р < 0.001; n = 8), что соответствует относительному изменению 18.8 ± 3.0% (рис. 2), тогда как не было существенных изменений для мышц-сгибателей стопы. Величина максимального суставного момента снижалась с 36.4 ± 4.2 до 32.4 ± 6.6 Н·м при 0°/с–1, что соответствует относительному изменению 11.0 ± 2.3% (рис. 2).
Рис. 2.
Влияние 21-суточной “сухой” водной иммерсии на сократительные свойства. Максимальный суставной момент мышц-разгибателей и сгибателей стопы при выполнении произвольных сокращениях с угловой скоростью 0° при нейтральном положении угла голеностопного сустава до и после разгрузки (А). Скоростно-силовые показатели мышц-разгибателей (две верхних кривых) и сгибателей стопы (две нижних кривых) при выполнении произвольных концентрических движений с разной угловой скоростью до и после разгрузки (Б, В). * – p < 0.05; ** – p < 0.01; *** – p < 0.001.
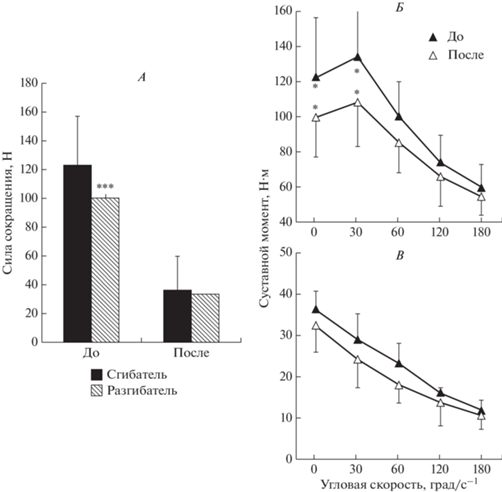
Изменение скоростно-силовых свойств. Анализ данных изменений функций сила−скорость показал, что максимальные суставные моменты, развиваемые мышцами-сгибателями и разгибателями стопы при произвольных концентрических движениях, были постоянно ниже фоновых во всем диапазоне угловых скоростей. Более того, обнаружено, что максимальный суставной момент в изокинетических условиях уменьшается как для мышц-разгибателей, так и сгибателей стопы при увеличении угловой скорости. Рис. 3 иллюстрирует типичную связь отношения “суставной момент–угловая скорость” для мышц-разгибателей и сгибателей стопы. Анализ максимального изометрического суставного момента, развиваемого мышцами на П +1 сут, свидетельствуют о снижении изометрической МПС (рис. 2).
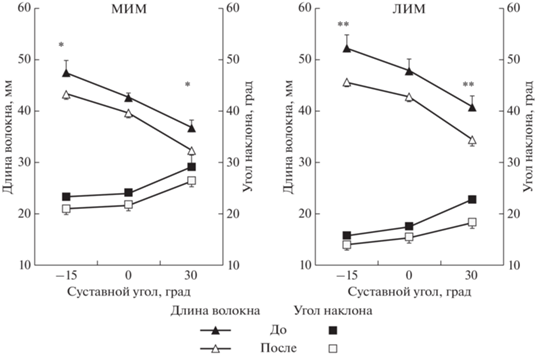
Рис. 3.
Архитектура смешанной трехглавой мышцы голени. Изменение длины (Lв) и угла наклона (Θв) волокон медиальной икроножной (МИМ, MG) и латеральной икроножной (ЛИМ, LG) мышц как функция угла голеностопного сустава. * – p < 0.05; ** – p < 0.01.
Как и ожидалось, при использовании изокинетической динамометрии определили, что максимальный суставной момент мышц-сгибателей при выполнении произвольных движений при концентрических сокращениях был постоянно меньше по сравнению с исходными данными на всех угловых скоростях (рис. 2). Однако не было обнаружено существенных различий в градиенте снижения максимального суставного момента при выполнении произвольных концентрических движений в низкоскоростном (силовом) режиме с угловой скоростью 0°/с–1 и 30°/с–1 (11 и 16%, соответственно) и умеренноскоростном и высокоскоростном режимах с угловой скоростью 120°/с–1 и 180°/с–1 (14–12% соответственно). Исключение составляют произвольные движения в концентрическом режиме с угловой скоростью 60°/с–1, когда было обнаружено относительно большее снижение максимального суставного момента (на 20%) (рис. 2, В).
Анализ данных изменения отношения сила-скорость мышц-разгибателей голеностопного сустава показал, во-первых, что максимальный суставной момент значительно больше по сравнению с показателем мышц-сгибателей голеностопного сустава (рис. 2, Б). Во-вторых, максимальный суставной момент в мышцах-разгибателях голеностопного сустава значительно уменьшался по всем угловым скоростям, как до, так и после СИ по данным изокинетической динамометрии. Однако анализ градиента изменений суставного момента, развиваемого при разных угловых скоростях в концентрических движениях, обнаружил значительные различия. Так, существенные изменения максимального суставного момента были обнаружены во время концентрических движений в низкоскоростном (силовом) режиме с угловой скоростью 0°/с–1 (19%), 30°/с–1 (19%) и 60°/с–1 (15%) и малосущественные изменения были обнаружены во время концентрических движений в умеренноскоростном и высокоскоростном режимах с угловой скоростью 120°/с–1 (11%) и 180°/с–1 (9%) (рис. 2, Б).
Следует отметить, что максимальные суставные моменты мышц-разгибателей голеностопного сустава изменялись в большей степени, чем у мышц-сгибателей. Большие изменения наблюдались при движениях в концентрическом низкоскоростном режиме с угловой скоростью 0°/с–1 и 30°/с–1.
Влияние разгрузки на архитектуру мышц
Длина волокон до СИ. При увеличении положения угла голеностопного сустава с –15° до +30° Lв МИМ снижалась с 47 ± 2 до 37 ± 2 мм, что соответствует относительному изменению 21.3% (p < < 0.01), а ЛИМ – с 52 ± 2 до 41 ± 1 мм, что соответствует относительному изменению 21.2% (р < < 0.01) (рис. 3, верхние кривые).
Угол наклона волокон до СИ. При увеличении положения угла голеностопного сустава с –15° до +30° Θв МИМ увеличивался с 23° ± 1° до 29° ± 2°, что соответствует относительному изменению 26.1% (p < 0.01), а ЛИМ – с 16° ± 1° до 22° ± 2°, соответствует относительному изменению 37.5% (p < 0.05) (рис. 3, нижние кривые).
Длина волокон после СИ. При увеличении положения угла голеностопного сустава – с 15° до +30° Lв МИМ уменьшалась с 43 ± 1 до 32 ± 2 мм, что соответствует относительному изменению 25.6% (p < 0.01), а ЛИМ – с 45 ± 2 до 34 ± 1 мм, что соответствует относительному изменению 24.4% (р < 0.01) (рис. 3, верхние кривые).
Угол наклона волокон после СИ. При увеличении положения угла голеностопного сустава с ‒15° до +30° Θв МИМ увеличивался с 21° ± 1° до 26° ± 2°, что соответствует относительному изменению 23.8%, а ЛИМ – с 14° ± 1° до 18° ± 2°, что соответствует относительному изменению 28.6% (рис. 3, нижние кривые).
Толщина мышц до и после СИ. До СИ существенная разница в ТМ была обнаружена между МИМ и ЛИМ. Так, TМ составляла 16.7 ± 0.05 мм в МИМ и 13.1 ± 0.05 мм – в ЛИМ. Снижение ТМ наблюдалось после СИ для всех мышц. По сравнению с исходным уровнем ТМ снижалась на 24.6% в МИМ и на 22.1% – в ЛИМ (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящем исследовании сравнивались архитектурные характеристики двух мышц нижних конечностей, которые вносят большой вклад в развиваемый суставной момент голеностопного сустава во время произвольных сокращений [56]. Данное исследование показывает значительное ремоделирование мышечной архитектуры основных локомоторных мышц (МИМ и ЛИМ), вызванной длительной разгрузкой опорно-двигательного аппарата. В исследовании впервые одновременно выполнены оценка степени изменений сократительных свойств (силовых и скоростно-силовых) мышц-разгибателей и сгибателей стопы, длины и угла наклона волокон (ультразвуковая визуализация) МИМ и ЛИМ у человека в условиях in vivo после длительной разгрузки. Основываясь на этих данных, продемонстрированы значительные изменения в ответ на 21-суточную разгрузку, о чем свидетельствуют уменьшение длины и угла наклона мышечных волокон и уменьшение силы сокращения мышцы.
Максимальная мышечная сила. После 21-суточной разгрузки отмечается снижение максимального суставного момента (18%), развиваемого мышцами-разгибателями стопы (рис. 2). Сопоставимые изменения (20–23%) оценивали для уменьшения максимальной динамической мышечной силы, применяя изокинетическую динамометрию [57–59]. Предыдущие исследования продемонстрировали аналогичные изменения в максимальной силе мышц трехглавой мышцы голени (ТМГ) после СИ [57–59] или КП [60, 61].
В настоящем исследовании меньшие изменения МПС (18%) противоречат ранее полученным результатам исследований с разгрузкой (7 сут), в которых были обнаружены большие изменения МПС (на 34%), основанные на регистрации активности отдельной мышцы [16, 60–63]. Меньшее изменение сократительных свойств, регистрируемых с помощью изокинетической динамометрии, свидетельствуют об активации мышц-антагонистов [64] и снижение роли эфферентного вклада в активацию этих мышц [64–66]. В условиях нормальной гравитации эфферентный вход имеет относительно низкую интенсивность, но, по-видимому, его роль увеличивается в условиях сниженной гравитации, когда опорная нагрузка как триггер, вызывающая важные события в опорно-двигательной системе, отсутствует, автоматически подавляя тоническую активность, вызывая ряд физиологических и структурных вторичных эффектов. Это первый и самый очевидный фактор. Кроме того, уменьшение длины и угла наклона мышечных волокон, как это наблюдалось в настоящем исследовании, может вызвать сдвиг в отношении момент-суставной угол, что может быть дополнительным фактором, способствующим снижению суставного момента (МПС). Во-вторых, уменьшение силы сокращения мышц после разгрузки не может быть объяснено исключительно уменьшением размера мышцы [67, 68]. Снижение способности к активации мышц, которое часто оказывается под угрозой из-за хронического неиспользования [15, 17, 61, 69], также является потенциальным фактором. И, наконец, третий фактор, потенциально способствующий снижению силы мышц, это уменьшение удельного напряжения отдельных мышечных волокон. Хотя это и не оценивалось в настоящем исследовании, но такие данные были обнаружены после жесткого постельного режима [70], и считается, что это связано с уменьшением количества активных поперечных мостиков, что до некоторой степени предполагает уменьшение плотности миофибрилл, а не силы на отдельный поперечный мостик [71]. Наконец, что не менее важно, это изменения в эластических свойствах сухожилия мышцы. Поскольку сухожилие влияет на длину мышечного волокна [72], что, в конечном итоге, влияет и на генерирование общей силы мышцы. Изменения жесткости МСК оказывает существенное влияние на общую длину мышцы и, соответственно на длину мышечных волокон [62, 63, 73] и в конечном итоге влияет на выработку силы. Более того, изменение жесткости МСК повлияет и на скорость передачи сократительной силы на скелет, что приведет к увеличению деформации сухожилия при данном уровне силы, действующей на мышцу. Хотя это и не оценивалось в настоящем исследовании, но изменение жесткости МСК было обнаружено после длительного пребывания в условиях постельного режима [12, 62, 63, 73].
В настоящем исследовании, как показывают полученные данные, угол наклона мышечных волокон после разгрузки был изменен в меньшей степени. Сила мышцы, как известно, увеличивается пропорционально величине угла Sin наклона волокна мышцы [74, 75]. С другой стороны, эффект развивающейся силы сокращения, действуя на апоневроз или сухожилие, уменьшится, когда угол наклона значительно увеличится и, таким образом, сила мышцы уменьшиться пропорционально величине угла Cos наклона волокна мышцы. От результата этих двух антагонистических эффектов максимальная сила сокращения мышцы будет увеличиваться с увеличениями угла наклона волокна мышцы, ограничивающийся верхним пределом 45° [74, 75]. Действительно, S. Ikegawa et al. [76] сообщили, что была обнаружена отрицательная корреляция между углом наклона и силой сокращения мышцы. Меньшее изменение угла наклона мышечных волокон после разгрузки частично компенсирует потерю силы из-за более эффективной передачи силы на сухожилие. Таким образом, это указывает, что адаптация к условиям разгрузки мышечного аппарата, происходящая в мышце и МСК, сопровождается уравновешиванием этих двух факторов для поддержания постоянным функциональный диапазон мышцы.
Концепция, обсуждаемая в контексте влияние СИ, заключается в том, что механическая разгрузка изменяет активацию и характер рекрутированных двигательных единиц, что влияет на мышечный результат в тестовых движениях. Простейшие условия для оценки адаптации сократительной функции мышц обеспечиваются изометрическими сокращениями, при которых длина мышц остается постоянной. Однако длина мышцы и нагрузка могут уменьшаться или увеличиваться в зависимости от внешних условий во время движений in vivo. Несмотря на свою сложность, связь между силой и скоростью на определенном уровне активации предсказуема для многих скелетных мышц, учитывая, что архитектура мышц и механика движения известны. Хотя функция и работоспособность мышц изменяются в условиях микрогравитации, основные механизмы, генерирующие мышечную силу, сохраняются [77]. Потенциал силы несколько выше, когда активированная мышца удлиняется при нулевой скорости. Следует также отметить, что сила уменьшается с увеличением скорости сокращения, и, наоборот, максимальная скорость увеличивается, когда сократительным элементам мышцы предъявляется минимальная нагрузка.
Влияние разгрузки на соотношение сила–скорость в ненагруженных условиях. Соотношение сила–скорость мышцы показывает увеличение силы, возникающей при уменьшении скорости сокращения, и наоборот [37–39, 78]. Визуально форма кривых, описывающая изменение длины пучков (волокон) и угла наклона волокон, были похожи между МИМ и ЛИМ. Данные результаты можно объяснить тем фактом, что ахиллово сухожилие является общим для указанных мышц [79], и что эти мышцы-синергисты сгибателей стопы демонстрируют механическое взаимодействие через их общий эпимизий [80]. Более того, было показано, что икроножные мышцы имеют сходную типологию [81] и архитектуру [82].
При динамических сокращениях длина мышцы укорачивается, когда сила мышцы преодолевает сопротивление. Показано, что максимальная скорость укорачивания мышцы пропорциональна длине мышечного волокна [83]. Это связано с тем, что длина волокон отражает количество саркомеров в серии, а скорость сокращения (укорочение) мышц является суммой скоростей укорачивания саркомеров в серии. Кроме того, угол наклона волокон также может влиять на скорость и силу сокращения мышц. Если угол наклона остается постоянным во время сокращений, скорость сокращения мышцы будет меньше, чем скорость сокращения мышечных волокон. Можно предположить, что изменение длины волокна МИМ и ЛИМ в зависимости от сокращения (т.е. при угловой скорости 120°/с–1 и заметном укорочении волокна при угловой скорости 180°/с–1 при нейтральном положении голеностопного сустава) является первопричиной в различиях сократительных способностей.
После 21-суточной разгрузки наблюдалась значительная потеря силы мышцы и изменение внутренней архитектуры мышц. Длина и угол наклона волокон были уменьшены, что свидетельствует об утрате как последовательно, так и параллельно расположенных саркомеров, соответственно. Потеря последовательно расположенных саркомеров означает, что, хотя каждый саркомер будет укорачиваться на ту же абсолютную величину, но общее укорачивание всего волокна будет уменьшено, что вероятно, повлияет как на соотношение сила–длина, так и на соотношение сила–скорость.
Длина волокон была различной при изокинетических скоростях 0°, 30°, 120° и 180°/с. Различия в длине волокон будут соответствовать различиям в длине саркомеров, которые расположены последовательно внутри волокна, соответственно. Поскольку длина саркомера является основным фактором, определяющим потенциал генерирования мышечной силы [84], то для оценки длины саркомера при максимальной силе, мы разделили длину волокна на количество саркомеров, соединенных последовательно в волокне MИМ (17.600 [85]) и результат наложили на соотношение сила–длина саркомера мышц человека [86] (рис. 5). Длины саркомеров достигали восходящей части в характеристической кривой сила–длина и саркомеры в состоянии покоя имели больший силовой потенциал, чем после разгрузки. При быстрых концентрических движениях (120°/с, 180°/с) саркомеры после разгрузки имели более высокий потенциал силы, чем при медленных концентрических движениях (0°/с, 30°/с) после разгрузки. Таким образом, разница в длинах волокон между двумя положениями может быть фактором, объясняющим одинаковые силы сухожилий при быстрых концентрических движениях и меньшую силу при медленных концентрических движениях.
Рис. 5.
Расчетные длины саркомеров медиальной икроножной мышцы (МИМ), которые были оценены путем деления длины волокна на среднее количество саркомеров в серии волокна [84] и наложены на соотношение сила–длина для мышц человека, полученное на основе данных [86]. Точки пересечения зависимости “сила–длина” и вертикальные линии показывают потенциал саркомера, генерирующий силу, на каждой длине. Заштрихованная линия под восходящей частью и участком плато кривой представляет рабочий диапазон саркомеров МИМ в данном исследовании, предполагая, что оптимальные углы голеностопного сустава для создания силы соответствуют длине саркомера 2.6 мк.

При обсуждении отношения сила–длина было использовано постоянное значение 17.600 для всех испытуемых в качестве постоянного числа саркомеров МИМ. Однако среднее количество саркомеров в МИМ человека варьирует от 15.333 до 18.500 (15.333 [87]; 16.614 [88]; 17.614 [85]; 18.400 [89]; 18.500 [90]). Следовательно, возможно, что межличностная вариабельность числа саркомеров может влиять на обсуждение, основанное на оценке длины саркомера. В настоящем исследовании для оценки саркомеров была использована величина на большем числе трупов (n = 8) и близка к значению, указанному в настоящем исследовании. Таким образом, межличностная изменчивость числа саркомеров не будет иметь большого влияния на обсуждение, основанное на оценке длин саркомера.
Угол наклона и длина мышечных волокон. Анализ полученных результатов настоящего исследования показал, что разгрузка опорно-двигательного аппарата привела к заметному уменьшению угла наклона и длины мышечных волокон и толщины МИМ и ЛИМ. После СИ, как толщина мышц, длина, так и угол наклона мышечных волокон были уменьшены, что позволяет предполагать потерю как последовательно, так и параллельно расположенных саркомеров. Это наблюдение согласуется с предыдущими результатами в условиях неиспользования [37–39, 72]. Потеря саркомеров предполагает, что рабочий диапазон каждого саркомера становится слишком большим. Когда рабочий диапазон саркомера превышает 3.65 мк, то нити актина и миозина при таком расстоянии перестают взаимодействовать [84], другими словами, волокна не способны развивать силу и мышечная сила не может быть произведена. Это обстоятельство, вероятно, влияет на соотношение длина–сила и скорость–сила. Уменьшение длины волокна изменит длину, при которой саркомер работает при любой длине мышца–сухожилие [91]. В результате саркомерам, возможно, придется функционировать на большей длине, характеристическая кривая растяжение–длина изменится, и сдвиг от оптимальной длины саркомера в соотношении длина–натяжение уменьшит активное напряжение для этих саркомеров, уменьшив тем самым общую силу мышечного сокращения.
Уменьшение длины волокон и увеличение угла наклона с увеличением длины мышцы можно рассматривать как фактор при объяснении “слабости” мышечной ткани [78]. В настоящем исследовании уменьшение длины волокон при пассивном сгибании подошвы от –15° до +30° предполагает, что мышечные волокна постепенно становятся “слабее” с увеличением угла голеностопного сустава. Анализ результатов показал, что после 3-недельной разгрузки изменение положения угла в голеностопном суставе с –15° до +30° длина волокон МИМ и ЛИМ снизились на 11, 16 и 11, 3%, а угол наклона волокон – на 32, 24 и 19, 11% соответственно. После 23 дней одностороннего “вывешивания” нижней конечности O.R. Seynnes et al. [92] сообщили, что угол наклона и длина волокон ЛИМ были снижены на 5 и 4%, соответственно. После аналогичного по продолжительности постельного режима Y. Kawakami et al. [93] сообщили, что угол наклона волокон МИМ и ЛИМ были снижены на 7 и 5%, соответственно. Интересно, что N.D. Reeves et al. [94] сообщили о 10 и 13% снижении, соответственно, длины и угла наклона волокон МИМ после 90 дней постельного режима. Кроме того, учитывая то, что в наших экспериментальных условиях ТМГ была не растянута и не напряжена, то такое состояние можно ассоциировать с физиологическим укорочением, и, можно предположить, что общее число последовательно расположенных саркомеров было снижено [95]. Это, возможно, и способствовало уменьшению толщины мышцы и угла наклона волокон. Кроме того, “флексорное” положение, или иными словами, поза “эмбриона”, наблюдаемое в условиях микрогравитации [96], устанавливала стопу в слегка согнутую позицию, и это обстоятельство усиливало эффект, наблюдаемый в МИМ и ЛИМ. Уменьшение длины волокон связано с уменьшением количества саркомеров последовательно соединенных, снижая способность генерировать силу и мощность мышц, что согласуется с ранее полученными данными [26].
Кроме того, уменьшение угла наклона волокон должно сделать мышцу относительно “слабой”, потому что, во-первых, теряются параллельно расположенные саркомеры. Во-вторых, уменьшение длины волокон приводит к тому, что саркомеры функционируют на большей длине, что ставит под угрозу общую выработку силы. Для поддержания постоянной абсолютной силы потребуется набирать большее количество двигательных единиц, что может привести к быстрой мышечной утомляемости.
Более низкий угол наклона мышечных волокон, наблюдаемый после разгрузки [37–40], частично компенсирует потерю силы, потому что передача силы на сухожилие становится более эффективной, несмотря на снижение жесткости МСК [62, 63, 73]. Такое снижение жесткости наблюдалось, на самом деле, у испытуемых после длительного воздействия условий, имитирующих микрогравитацию [62, 63], либо после пребывания в условиях реальной микрогравитации [97]. Снижение жесткости МСК при разгрузке указывает на то, что требуется гораздо большая деформация сухожилия для создания необходимой силы сокращения. Это обстоятельство изменит отношение длина–напряжение, сместив кривую зависимости силы сокращения мышечных волокон от расстояния между соседними пластинами Z влево, и, таким образом, сила мышечного сокращения будет снижена [84].
Возможным недостатком исследования является уменьшение толщины мышц после разгрузки, вызванное уменьшением длины пучка в икроножных мышцах, что, возможно, частично компенсируется большим потенциалом мощности исследованных мышц, которая в основном определяется ФППС [48], оцениваемая в настоящем исследовании соотношением между квадратом ТМ и длиной волокна [54]. Индекс ФППС является той переменной величиной, которая высоко коррелирует с пиковой мощностью мышц, что подтверждается данными и корреляциями, о которых сообщалось ранее [98].
Меньшая ТМ и угол наклона в мышце связан с меньшим количеством параллельных саркомеров, генерирующих соответственно меньшую силу мышцы [99]. Более того, меньшая длина волокон в мышце будет связана с меньшим количеством саркомеров, соединенных последовательно, и меньшую скорость укорачивания, диапазон силы, большие потери силы при высоких скоростях укорочения и даже меньшую способность производить мощность [48, 99, 100]. Таким образом, морфологические характеристики мышц могли бы объяснить, по крайней мере, частично, различия в сократительных свойствах, обнаруженных в настоящем исследовании, поскольку на икроножные мышцы приходится 38% общего генерируемого суставного момента голеностопного сустава во время максимального произвольного сокращения [56].
Насколько нам известно, это первое исследование, которое показывает нелинейные отношения между архитектурными переменными мышц (рис. 6). В двух проанализированных мышцах наблюдалась высокая взаимосвязь между индексом ФППС и углом наклона волокон (r 2 = 0.96–0.97, p < 0.001), хотя в одной из проанализированных мышц (ЛИМ) наблюдалась тенденция к экспоненциальной взаимосвязи между индексом ФППС и углом наклона волокон (r 2 = 0.89–0.96, p < 0.001). Углы наклона МИМ и ЛИМ до разгрузки увеличивались с большим увеличением (особенно для МИМ) с наибольшим индексом ФППС, в то время как после разгрузки углы наклона показывали иную тенденцию, особенно для МИМ: с меньшим увеличением по мере увеличения индекса ФППС. После разгрузки углы наклона ЛИМ обнаруживают тенденцию экспоненциального увеличения, с меньшим увеличением по мере увеличения индекса ФППС. Тем не менее, нелинейный подход, вероятно, лучше объяснил бы биологическую значимость в случае экстремального поведения людей. С нашей точки зрения, основными ограничениями настоящего исследования являются исследования, которые показали, что изменения механических характеристик сухожилия мышц и МСК, в целом, также играют значительную роль в различиях производительности силы. Показано снижение жесткости и продолжительный механический гистерезис в сухожилиях мышц человека in vivo после продолжительного периода неупотребления [12, 94, 101] и подобные результаты наблюдаются у пациентов с повреждением спинного мозга [102]. Таким образом, изменение архитектуры мышц может объяснить, по крайней мере, частично, различия в снижении их функций, обнаруженных в настоящем исследовании. Поскольку ТМГ вносит основной вклад в работу, выполняемую во время локомоций, то, вероятно, большая часть снижения функций мышцы объясняется уменьшением нервной активности [17, 60].
Рис. 6.
Взаимосвязь между ФППС-индексом и углом наклона волокон в двух исследованных мышцах. ФППС – физиологическая площадь поперечного сечения.

В настоящем исследовании относительно большие изменения в мышечной архитектуре позволяют предположить, что разгрузка мышечного аппарата, вызванная СИ, оказывает значительно больший эффект, о котором сообщалось ранее [30, 75]. Исследование показывает, что значительное ремоделирование мышечной архитектуры основных локомоторных мышц (МИМ и ЛИМ) сопровождает мышечную атрофию, вызванную длительной (3-недельной) разгрузкой и снижением сократительных свойств. Уменьшение толщины мышц наблюдалось и в других исследованиях при разгрузке и, вероятно, в основном является следствием снижения синтеза миофибриллярного белка [103, 104] и первоначального увеличения деградации белка [105]. Показано, что мышцы, составляющие сложную ТМГ, обычно поражаются в большей степени, чем мышцы, расположенные на передней поверхности голени [28, 29]. Более высокая восприимчивость к атрофии МИМ, по сравнению с передней большеберцовой мышцей, может быть связана со степенью нагрузки, которую испытывают обе мышцы во время нормальной ежедневной активности как для поддержания массы тела, так и продвижения тела вперед при локомоции. МИМ, будучи двухсуставной мышцей, подвергается воздействию голеностопного и коленного суставов в условиях нормогравитации. Таким образом, снятие мышечной нагрузки под воздействием СИ может привести к большей атрофии мышц-разгибателей стопы.
Результаты исследования показывают, что строение мышц изменяется после разгрузки, что подтверждается предыдущими исследованиями [11, 30] и, в частности, предполагается потеря как последовательных, так и параллельно расположенных саркомеров в серии. Ожидается, что уменьшение длины волокон повлияет на длину, с которой саркомеры будут работать при любой длине мышца–сухожилие [78]. Это может привести к тому, что саркомеры будут работать при большей длине, чем ранее, и рабочий диапазон может сместиться от их оптимальной длины, что приведет к снижению выработки силы для этих саркомеров.
Считается, что ремоделирование саркомеров, т.е. добавление или удаление последовательно и параллельно расположенных саркомеров, вызвано изменениями в структурах, участвующих в механо-преобразовании [78], опосредованными двумя основными путями [106]. Первый путь заключается в передаче механического стимула во внеклеточный матрикс и цитоскелет, который напрямую влияет на синтез белка или косвенно через деформацию ядра [107]. Во втором пути синтез белка индуцируется механохимическим преобразованием сигнала, где механический сигнал преобразуется в химический сигнал через костамерные комплексы. Считается, что фосфорилирование костамерного фермента FAK посредством механического нагружения, приводит к регуляции количества саркомера в нисходящем направлении [44]. M.D. de Boer et al. [20] показали, что активность FAK была снижена после 23 дней суспензии нижних конечностей, что привело к гипотезе о том, что костамеры также могут играть важную роль в изменении числа саркомеров при неиспользовании в результате снижения механической нагрузки.
ЗАКЛЮЧЕНИЕ
Полученные данные настоящего исследования показывают ухудшение структурных и функциональных свойств мышц в результате воздействия 3-недельной разгрузкой. Продолжительная разгрузка изменила архитектуру МИМ и ЛИМ. Различия в длине волокон и угле наклона волокон, которые наблюдались в мышцах, могут быть связаны с различиями в выработке силы и в эластических свойствах сухожилий и апоневрозов. Приведенные выше выводы имеют клиническое значение в плане реабилитации опорно-двигательной системы после разгрузки в моделях наземных или в реальных условиях микрогравитации. В совокупности нынешние данные позволяют предположить, что архитектура и сократительная способность перистых мышц человека взаимосвязаны. Это взаимодействие, по-видимому, включает специфические адаптационные реакции, вызванные разгрузкой мышечной системы.
Результаты настоящего исследования должны способствовать разработке более эффективных и основанных на фактических данных протоколов реабилитации после длительных КП.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при финансовой поддержке Министерства образования и науки (Соглашение № 075-1502020-919).
Благодарности. Авторы выражают благодарность всем добровольцам исследования за их приверженность и активное участие в исследовании, медицинскому и инженерному персоналу за вклад в организацию исследования и многим неназванным коллегам за помощь в проведении исследований.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Baker E.S., Barratt M.R., Wear M.L. Human Response to Space Flight / Principles of Clinical Medicine for Space Flight. Herausgeber: Barratt M.R., Lee P.S., 2000. P. 27.
Ploutz-Snyder L., Ryder J., English K., Haddad F.K.B. Evidence report: Risk of impaired performance due to reduced muscle mass, strength, and endurance. HRP 47072, NASA Lyndon B. Johnson Space Center, Houston, Texas, 2015. P. 1.
Sibonga J.D., Cavanagh P.R., Lang T.F. et al. Adaptation of the skeletal system during long-duration spaceflight // Clin. Rev. Bone Min. Metab. 2008. V. 5. P. 249.
Vico L., Collet P., Guignandon A. et al. Effects of long-term microgravity exposure on cancellous and cortical weight-bearing bones of cosmonauts // Lancet. 2000. V. 355. № 9215. P. 1607.
Adams G.R., Caiozzo V.J., Baldwin K.M. Skeletal muscle unweighting: spaceflight and ground-based models // J. Appl. Physiol. 2003. V. 95. № 6. P. 2185.
Capelli C., Antonutto G., Kenfack M.A. et al. Factors determining the time course of VO2(max) decay during bedrest: implications for VO2(max) limitation // Eur. J. Appl. Physiol. 2006. V. 98. № 2. P. 152.
Ferretti G., Berg H.E., Minetti A.E. et al. Maximal instantaneous muscular power after prolonged bed rest in humans // J. Appl. Physiol. 2001. V. 90. № 2. P. 431.
Rittweger J., Felsenberg D., Maganaris C.N., Ferretti J.L. Vertical jump performance after 90 days bed rest with and without flywheel resistive exercise, including a 180 days follow-up // Eur. J. Appl. Physiol. 2007. V. 100. № 4. P. 427.
Blaber A.P., Goswami N., Bondar R.L., Kassam M.S. Impairment of cerebral blood flow regulation in astronauts with orthostatic intolerance after flight // Stroke. 2011. V. 42. № 7. P. 1844.
Mader T.H., Gibson C.R., Pass A.F. et al. Optic disc edema, globe flattening, choroidal folds, and hyperopic shifts observed in astronauts after long-duration space flight // Ophthalmology. 2011. V. 118. № 10. P. 2058.
Kawakami Y., Akima H., Kubo K. et al. Changes in muscle size, architecture, and neural activation after 20 days of bed rest with and without resistance exercise // Eur. J. Appl. Physiol. 2001. V. 84. № 1–2. P. 7.
Kubo K., Akima H., Kouzaki M. et al. Changes in the elastic properties of tendon structures following 20 days bed-rest in humans // Eur. J. Appl. Physiol. 2000. V. 83. № 6. P. 463.
LeBlanc A., Gogia P., Schneider V. et al. Calf muscle area and strength changes after five weeks of horizontal bed rest // Am. J. Sport Med. 1988. V. 16. № 6. P. 624.
Antonutto G., Capelli C., Girardis M. et al. Effects of microgravity on maximal power of lower limbs during very short efforts in humans // J. Appl. Physiol. 1999. V. 86. № 1. P. 85.
Duchateau J. Bed rest induces neural and contractile adaptations in triceps surae // Med. Sci. Sports Exerc. 1995. V. 27. № 12. P. 1581.
Koryak Yu. Electromyographic study of the contractile and electrical properties of the human triceps surae muscle in a simulated microgravity environment // J. Physiol. 1988. V. 510. Pt. 1. P. 287.
Ruegg D.G., Kakebeeke T.H., Gabriel J.P., Bennefeld M. Conduction velocity of nerve and muscle fiber action potentials after a space mission or a bed rest // Clin. Neurophysiol. 2003. V. 114. № 1. P. 86.
Fitts R.H., Romatowski J.G., Peters J.R. et al. The deleterious effects of bed rest on human skeletal muscle fibers are exacerbated by hypercortisolemia and ameliorated by dietary supplementation // Am. J. Physiol. Cell Physiol. 2007. V. 293. № 1. P. C313.
Trappe S., Trappe T., Gallagher P. et al. Human single muscle flbre function with 84 day bed-rest and resistance exercise // J. Physiol. 2004. V. 557. Pt. 2. P. 501.
De Boer M.D., Maganaris C.N., Seynnes O.R. et al. Time course of muscular, neural and tendinous adaptations to 23 day unilateral lower-limb suspension in young men // J. Physiol. 2007. V. 583. Pt. 3. P. 1079.
Koryak Yu. Influence of simulated microgravity on mechanical properties in the human triceps surae muscle in vivo. I: Effect of 120 days of bed‑rest without physical training on human muscle musculo‑tendinous stiffness and contractile properties in young women // Eur. J. Appl. Physiol. 2014. V. 114. № 5. P. 1025.
Koryak Yu. Influence of simulated microgravity on mechanical properties in the human triceps surae muscle in vivo. II: Effect of 120 days of bed-rest with physical training on human muscle contractile properties and musculo-tendinous stiffness in young women // Central Eur. J. Sport Sci. Med. 2015. V. 11. № 3. P. 125.
Maganaris C.N., Reeves N.D., Rittweger J. et al. Adaptive response of human tendon to paralysis // Muscle Nerve. 2006. V. 33. № 1. P. 85.
LeBlanc A., Lin C., Shackelford L. et al. Muscle volume, MRI relaxation times (T2), and body composition after spaceflight // J. Appl. Physiol. 2000. V. 89. № 6. P. 2158.
Tesch P.A., Berg H.E., Bring D. et al. Effects of 17-day spaceflight on knee extensor muscle function and size // Eur. J. Appl. Physiol. 2005. V. 93. № 4. P. 463.
Narici M., Cerretelli P. Changes in human muscle architecture in disuse-atrophy evaluated by ultrasound imaging // J. Gravit. Physiol. 1998. V. 5. № 1. P. P73.
Sargeant A.J., Davies C.T., Edwards R.H. et al. Functional and structural changes after disuse of human muscle. // Clin. Sci. Mol. Med. 1977. V. 52. № 4. P. 337.
Akima H., Kubo K., Imai M. et al. Inactivity and muscle: effect of resistance training during bed rest on muscle size in the lower limb // Acta Physiol. Scand. 2001. V. 172. № 4. P. 269.
Alkner B.A., Tesch P.A. Efficacy of a gravity-independent resistance exercise device as a countermeasure to muscle atrophy during 29-day bed rest // Acta Physiol. Scand. 2004. V. 181. № 3. P. 345.
Reeves N.J., Maganaris C.N., Ferretti G., Narici M.V. Influence of simulated microgravity on human skeletal muscle architecture and function // J. Gravit. Physiol. 2002. V. 9. № 1. P. P153.
di Prampero P.E., Narici M.V. Muscles in microgravity: from fibres to human motion // J. Biomech. 2003. V. 36. № 3. P. 403.
Blazevich A.J. Effects of physical training and detraining, immobilisation, growth and aging on human fascicle geometry // Sports Med. 2006. V. 36. № 12. P. 1003.
Blazevich A.J., Cannavan D., Coleman D.R., Horne S. Influence of concentric and eccentric resistance training on architectural adaptation in human quadriceps muscles // J. Appl. Physiol. 2007. V. 103. № 5. P. 1565.
Lynn R., Morgan D.L. Decline running produces more sarcomeres in rat vastus intermedius muscle fibers than does incline running // J. Appl. Physiol. 1994. V. 77. № 3. P. 1439.
Noorkoiv M., Nosaka K., Blazevich A.J. Neuromuscular adaptations associated with knee joint angle-specific force change // Med. Sci. Sports Exerc. 2014. V. 46. № 8. P. 1525.
Reeves N.D., Maganaris C.N., Longo S., Narici M.V. Differential adaptations to eccentric versus conventional resistance training in older humans // Exp. Physiol. 2009. V. 94. № 7. P. 825.
Koryak Yu. Influence of long-duration space flight on human skeletal muscle architecture and function. – A pilot study // Amer. Sci. J. 2016. № 5. P. 7.
Koryak Yu.A. Architectural and functional specifics of the human triceps surae muscle in vivo and its adaptation to microgravity // J. Appl. Physiol. 2019. V. 126. № 4. P. 880.
Koryak Yu.A. Changes in human skeletal muscle architecture and function induced by extended spaceflight // J. Biomech. 2019. V. 97. P. 109408.
Коряк Ю.А., Кузьмина М.М., Бережинский И.В., Коваленко В.М. Продолжительная электромиостимуляционная тренировка мышц у человека в условиях механической разгрузки двигательного аппарата и ее влияние на архитектуру и функцию трехглавой мышцы голени // Фундамент. исслед. 2010. № 3. С. 68.
Gans C., Bock W.J. The functional significance of muscle architecture – a theoretical analysis // Ergeb. Anat. Entwicklungsgesch. 1965. V. 38. P. 115.
Gans C., Gaunt A.S. Muscle architecture in relation to function // J. Biomech. 1991. V. 24. Suppl. 1. P. 53.
Maganaris C.N., Baltzopoulos V., Sargeant A.J. Changes in Achilles tendon moment arm from rest to maximum isometric plantarflexion: observations in man // J. Physiol. 1998. V. 510. Pt. 3. P. 977.
Friederich J.A., Brand R.A. Muscle fiber architecture in the human lower limb // J. Biomech. 1990. V. 23. № 1. P. 91.
Шульженко Е.В., Виль-Вильямс И.Ф. Возможность проведения длительной водной иммерсии методом “сухого” погружения // Космич. биол. и авиакосмич. мед. 1976. Т. 10. № 2. С. 82.
Brown L.E., Weir J.P. ASEP procedures recommendation I: Accurate assessment of muscular strength and power // J. Exerc. Physiol. Online. 2001. V. 4. № 3. P. 1.
Kawakami Y., Ichinose Y., Fukunaga T. Architectural and functional features of human triceps surae muscles during contraction // J. Appl. Physiol. 1998. V. 85. № 2. P. 398.
Fukunaga T., Roy R.R., Shellock F.G. et al. Physiological cross-sectional area of human leg muscles based on magnetic resonance imaging // J. Orthop. Res. 1992. V. 10. № 6. P. 926.
Berg H.E., Tedner B., Tesch P.A. Changes in lower limb muscle cross-sectional area and tissue fluid volume after transition from standing to supine // Acta Physiol. Scand. 1993. V. 148. № 4. P. 379.
Csapo R., Alegre L.M., Baron R. Time kinetics of acute changes in muscle architecture in response to resistance exercise // J. Sci. Med. Sport. 2011. V. 14. № 3. P. 270.
Ando R., Taniguchi K., Saito A. et al. Validity of fascicle length estimation in the vastus lateralis and vastus intermedius using ultrasonography // J. Electromyog. Kinesiol. 2014. V. 24. № 2. P. 214.
Finni T., Ikegaw Sh., Lepola V., Komi P. In vivo behavior of vastus lateralis muscle during dynamic performances // Eur. J. Sport Sci. 2001. V. 1. № 1. P. 1.
Reeves N.D., Narici M.V., Maganaris C.N. Effect of resistance training on skeletal muscle-specific force in elderly humans // J. Appl. Physiol. 2004. V. 96. № 3. P. 885.
Blazevich A.J., Gil N.D., Zhou Sh. Intra- and intermuscular variation in human quadriceps femoris architecture assessed in vivo // J. Anat. 2006. V. 209. № 3. P. 289.
Narici M.V., Binzoni T., Hiltbrand E. et al. Human gastrocnemius muscle architecture from rest to the contracted state // J. Physiol. 1994. V. 475. 17 p.
Narici M.V., Landoni L., Minetti A.E. Assessment of human knee extensor muscles stress from in vivo physiological cross-sectional area and strength measurement // Eur. J. Appl. Physiol. 1992. V. 65. № 5. P. 438.
Reeves N.D., Narici.M.V. Behavior of human muscle fascicles during shortening and lengthening contractions in vivo // J. Appl. Physiol. 2003. V. 95. № 3. P. 1090.
Murray M.P., Guten G.N., Baldwin J.M., Gardner G.M. A comparison of plantar flexion torque with and without the triceps surae // Acta Orthop. Scand. 1976. V. 47. № 1. P. 122.
Григорьева Л.С., Козловская И.Б. Влияние семисуточной опорной разгрузки на скоростно-силовые свойства скелетных мышц // Косм. биол. и авиакосмич. мед. 1983. Т. 17. № 4. С. 21.
Григорьева Л.С., Козловская И.Б. Влияние невесомости и гипокинезии на скоростно-силовые свойства мышц человека // Космич. биол. и авиакосмич. мед. 1987. Т. 21. № 1. С. 27.
Григорьева Л.С., Козловская И.Б. Сравнительный анализ влияний невесомости и ее моделей на скоростно-силовые свойства и тонуса скелетных мышц человека // Космич. биол. и авиакосмич. мед. 1984. Т. 18. № 6. С. 22.
Koryak Yu. Electrically evoked and voluntary properties of the human triceps surae muscle: effects of long-term spaceflights // Acta Physiol. Pharmacol. Bulg. 2001. V. 26. № 1–2. P. 21.
Коряк Ю.А. Нервно-мышечная адаптация к кратковременным и продолжительным космическим полетам человека / Под ред. Григорьева А.И., Ушакова И.Б. Российский сегмент. М.: ИМБП РАН, 2011. Т. 2. С. 93.
Мартьянов В.А. Степень использования скоростно-силовых возможностей нервно-мышечного аппарата при произвольных усилиях // Физиол. журн. СССР им. И.М. Сеченова. 1974. Т. 60. № 9. С. 1416.
Мартьянов В.А., Копылов Ю.А., Гнутов М.И. Степень использования возможностей мышечного аппарата при максимальном произвольном усилии // Физиол. журн. СССР им. И.М. Сеченова. 1972. Т. 58. С. 1390.
Мартьянов В.А., Коряк Ю.А. Повышение произвольной силы под действием дополнительно вызванных афферентных влияний // Физиол. журн. СССР им. И.М. Сеченова. 1973. Т. 59. С. 1756.
Ploutz-Snyder L.L., Tesch P.A., Crittenden D.J., Dudley G.A. Effect of unweighting on skeletal muscle use during exercise // J. Appl. Physiol. 1995. V. 79. № 1. P. 168.
Tesch P.A., Trieschmann J.T., Ekberg A. Hypertrophy of chronically unloaded muscle subjected to resistance exercise // J. Appl. Physiol. 2004. V. 96. № 4. P. 1451.
Koryak Yu. Contractile properties of the human triceps surae muscle during simulated weightlessness // Eur. J. Appl. Physiol. 1995. V. 70. № 4. P. 344.
Trappe S., Trappe T., Gallagher P. et al. Human single muscle flbre function with 84 day bed-rest and resistance exercise // J. Physiol. 2004. V. 557. Pt. 2. P. 501.
Widrick J.J., Knuth S.T., Norenberg K.M. et al. Effect of a 17 day spaceflight on contractile properties of human soleus muscle fibres // J. Physiol. 1999. V. 516. Pt. 3. P. 915.
Narici M.V., Maganaris C.N. Adaptability of elderly human muscles and tendons to increased loading // J. Anat. 2006. V. 208. № 4. P. 433.
Коряк Ю.А. Продолжительное пребывание в условиях невесомости и ее влияние на механические свойства трехглавой мышцы голени у человека: электромеханическая задержка и мышечно-сухожильная жесткость // Успехи современ. естествознания. 2012. № 8. С. 41.
Alexander R.McN., Vernon A. The dimensions of knee and ankle muscles and the forces they exert // J. Human Mov. Studies. 1975. V. 1. P. 115.
Rutherford O.M., Jones D.A. Measurement of fibre pennation using ultrasound in the human quadriceps in vivo // Eur. J. Appl. Physiol. 1992. V. 65. № 5. P. 433.
Ikegawa S., Funato K., Tsunoda N. et al. Muscle force per cross-sectional area is inversely related with pennation angle in strength trained athletes // J. Strength Cond. Res. 2008. V. 22. № 1. P. 128.
Ranatunga K.W. Temperature-dependence of shortening velocity and rate of isometric tension development in rat skeletal muscle // J. Physiol. 1982. V. 329. P. 465.
Narici M.V., Maganaris C.N. Plasticity of the muscle-tendon complex with disuse and aging // Exerc. Sport Sci. Rev. 2007. V. 35. № 3. P. 126.
Chino K., Oda T., Kurihara T. et al. In vivo fascicle behavior of synergistic muscles in concentric and eccentric plantar flexions in humans // J. Electromyogr. Kinesiol. 2008. V. 18. № 1. P. 79.
Huijing P.A., Yaman A., Ozturk C., Yucesoy C.A. Effects of knee joint angle on global and local strains within human triceps surae muscle: MRI analysis indicating in vivo myofascial force transmission between synergistic muscles // Surg. Radiol. Anat. 2011. V. 33. № 10. P. 869.
Johnson M.A., Polgar J., Weightman D., Appleton D. Data on the distribution of fibre types in thirty-six human muscles. An autopsy study // J. Neurol. Sci. 1973. V. 18. № 1. P. 111.
Ward S.R., Eng C.M., Smallwood L.H., Lieber R.L. Are current measurements of lower extremity muscle architecture accurate? // Clin. Orthop. Relat. Res. 2009. V. 467. № 4. P. 1074.
Bodine S.C., Roy R.R., Meadows D.A. et al. Architectural, histochemical, and contractile characteristics of a unique biarticular muscle: the cat semitendinosus // J. Neurophysiol. 1982. V. 48. № 1. P. 192.
Gordon A.M., Huxley A.F., Julian F.J. The variation in isometric tension with sarcomere length in vertebrate muscle fibres // J. Physiol. 1966. V. 184. № 1. P. 170.
Huijing P.A. Architecture of the human gastrocnemius muscle and some functional consequences // Acta Anat. 1985. V. 123. № 2. P. 101.
Walker S.M., Schrodt G.R. I-segment lengths and thin filament periods in skeletal muscle fibers of the Rhesus monkey and the human // Anat. Rec. 1974. V. 178. № 1. P. 63.
Wickiewicz T.L., Roy R.R., Powell P.L., Edgerton V.R. Muscle architecture of the human lower limb. // Clin. Orthop. Relat Res. 1983. V. 179. P. 275.
Out L., Vrijkotte T.G., van Soest A.J., Bobbert M.F. Influence of the parameters of a human triceps surae muscle model on the isometric torque-angle relationship // J. Biomech. Eng. 1996. V. 118. № 1. P. 17.
Woittiez R.D., Rozendal R.H., Huijing P.A. The functional significance of architecture of the human triceps surae muscle // Biomechanics. 1985. V. IX-A. P. 21.
Bobbert M.F., Huijing P.A., van Ingen Schenau G.J. A model of the human triceps surae muscle-tendon complex applied to jumping // J. Biomech. 1986. V. 19. № 11. P. 887.
Alexander R.McN. Animal Mechanics / Lecturer in Zoology at the University College of North Wates. Bangor, London: Sidgwick & Jackson, 1968. 339 p.
Seynnes O.R., Maganaris C.N., de Boer M.D. et al. Early structural adaptations to unloading in the human calf muscles // Acta Physiol. 2008. V. 193. № 3. P. 265.
Kawakami Y., Abe T., Fukunaga T. Training-induced changes in muscle architecture and specific tension // Eur. J. Appl. Physiol. 1995. V. 72. № 1–2. P. 37.
Reeves N.D., Maganaris C.N., Ferretti G., Narici M.V. Influence of 90-day simulated microgravity on human tendon mechanical properties and the effect of resistive countermeasures // J. Appl. Physiol. 2005. V. 98. № 6. P. 2278.
Farkas G.A., Roussos C. Diaphragm in emphysematous hamsters: sarcomer adaptability // J. Appl. Physiol. 1983. V. 54. № 6. P. 1635.
Clément G., Gurfinkel V.S., Lestienne F. Mechanisms of posture maintenance in weightlessness / Vestibular and Visual Control on Posture and Locomotor Equilibrum // Ed. Black I. Basel, Switzerland: Karger, 1985. P. 158.
Koryak Yu.A. Influence of long-term space flight on mechanical properties of the human triceps surae muscle: Electro mechanical delay and musculo-tendinous stiffness // J. Skeletal Muscle. 2017. V. 1. № 1. P. 10.
Pandy M.G., Zajac F.E. Optimal muscular coordination strategies for jumping // J. Biomech. 1991. V. 24. № 1. P. 1.
Lieber R.L., Fridén J. Functional and clinical significance of skeletal muscle architecture // Muscle Nerve. 2000. V. 23. № 11. P. 1647.
Aagaard P., Andersen J.L., Dyhre-Poulsen P. et al. A mechanism for increased contractile strength of human pennate muscle in response to strength training: changes in muscle architecture // J. Physiol. 2001. V. 534. Pt. 2. P. 613.
Kubo K., Akima H., Ushiyama J. et al. Effects of 20 days of bed rest on the viscoelastic properties of tendon structures in lower limb muscles // Br. J. Sports Med. 2004. V. 38. № 3. P. 324.
Maganaris C.N., Reeves N.D., Rittweger J. et al. Adaptive response of human tendon to paralysis // Muscle Nerve. 2006. V. 33. № 1. P. 85.
Ferrando A.A., Lane H.W., Stuart C.A. et al. Prolonged bed rest decreases skeletal muscle and whole body protein synthesis // Am. J. Physiol. 1996. V. 270. № 4. Pt. 1. P. 627.
Stein T.P., Leskiw M.J., Schluter M.D. et al. Protein kinetics during and after long-duration spacefight on MIR // Am. J. Physiol. 1999. V. 276. № 6. Pt. 1. P. E1014.
Ferrando A.A., Paddon-Jones D., Wolfe R.R. Alterations in protein metabolism during spaceflight and inactivity // Nutrition. 2002. V. 18. № 10. P. 837.
Huijing P.A., Jaspers R.T. Adaptation of muscle size and myofascial force transmission: a review and some new experimental results // Scand. J. Med. Sci. Sports. 2005. V. 15. № 6. P. 349.
De Boer M.D., Selby A., Atherton P. et al. The temporal responses of protein synthesis, gene expression and cell signalling in human quadriceps muscle and patellar tendon to disuse // J. Physiol. 2007. V. 585. Pt. 1. P. 241.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека



