Физиология человека, 2023, T. 49, № 2, стр. 54-64
Влияние моделируемых гипомагнитных условий на некоторые физиологические показатели при 8-часовой экспозиции. Эксперимент “Арфа-19”
В. Ю. Куканов 1, *, А. Л. Васин 1, А. В. Демин 1, Д. В. Счастливцева 1, Ю. А. Бубеев 1, А. В. Суворов 1, Ю. А. Попова 1, Е. С. Лучицкая 1, А. Р. Ниязов 1, А. В. Поляков 1, С. О. Федяй 1, В. В. Кириченко 1, Р. Н. Зарипов 1, Р. Р. Гимадиев 2, А. Г. Кочетов 2, 3, Е. Э. Сигалева 1, О. Б. Пасекова 1, О. В. Попова 1, В. Б. Русанов 1, **, О. И. Орлов 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 ФГАОУ ВО “Российский университет дружбы народов” (РУДН)
Москва, Россия
3 АНО ДПО “Институт лабораторной медицины”
Москва, Россия
* E-mail: vk27031995@gmail.com
** E-mail: vasilyrusanov@gmail.com
Поступила в редакцию 23.03.2022
После доработки 06.06.2022
Принята к публикации 24.06.2022
- EDN: MPFIZE
- DOI: 10.31857/S0131164622600343
Аннотация
В данной статье представлены результаты двойного слепого рандомизированного плацебо-контролируемого исследования, моделирующего снижение магнитного поля Земли кратностью около 1000 раз. Изучены физиологические показатели организма 8 условно здоровых испытуемых мужского пола в возрасте от 27 до 38 лет, находившихся в гипомагнитных условиях в течение 8 ч. Пребывание в условиях сниженного магнитного поля не выявило существенных клинических рисков в малой выборке практически здоровых добровольцев.
Под влиянием многочисленных факторов космического полета (КП) возникают изменения в организме космонавтов. Стоит отметить, что большинство исследований в области космической биологии и медицины посвящены влиянию на организм человека космического излучения и микрогравитации [1].
Международная космическая станция (МКС) находится на низкой околоземной орбите в условиях магнитосферы Земли с ее защитными эффектами [2]. При осуществлении пилотируемых полетов и перелетов за ее пределы космонавты будут находиться в новых для них условиях [3].
Предполагается, что гипомагнитные условия (ГМУ) могут усилить воздействия факторов КП (радиации, микрогравитации и изоляции) и создать риски для здоровья экипажа космического летательного аппарата (КЛА) [4–6].
В настоящее время ГМУ являются самым неизученным фактором КП, однако перспективы межпланетных перелетов делают исследование влияния сниженного магнитного поля (МП) на организм человека актуальной задачей. Организация экспериментальных исследований с длительным нахождением человека в условиях сниженного геомагнитного поля связана с некоторыми биоэтическими проблемами, именно в силу незначительного количества данных о таком влиянии на организм.
Результаты клинико-физиологических обследований лиц, работавших в условиях пониженного в 4–10 раз МП Земли, показали функциональные изменения в ведущих системах организма человека. Так, со стороны центральной нервной системы (ЦНС) выявлены признаки дисбаланса нервных процессов, наблюдается дистония мозговых сосудов, обнаружены нарушения со стороны сердечно-сосудистой системы, выражающиеся в нейроциркулярной дистонии [7].
При изменении стабильности магнитной составляющей поля Земли, повышение k-индекса геомагнитной активности увеличивает риск развития кардиоваскулярных осложнений у больных острым коронарным синдромом [8], наблюдается рост уровня преступности и психических дисфункций [9].
В исследованиях на других живых организмах показано, что МП Земли помогает им ориентироваться и осуществлять миграцию в более благоприятные климатические зоны [10, 11].
В исследованиях с использованием лабораторных крыс линии SHR было обнаружено, что в условиях компенсированного магнитного поля у животных наблюдались резкие колебания артериального давления (АД) и частоты сердечных сокращений (ЧСС), но систематизировать эти эффекты не удалось вследствие влияния индивидуальных особенностей лабораторных животных на степень и характер проявления магнитобиологического эффекта [12].
Таким образом, основными системами, на которые оказывает воздействие снижение магнитного поля Земли, являются ЦНС (в части когнитивных и операторских способностей) и сердечно-сосудистая система (в части регуляторных процессов) [13, 14].
Актуальность исследования рисков, вызванных ГМУ, определяется чувствительностью биологических объектов к пребыванию в редуцированных геомагнитных условиях, что необходимо учитывать при планировании КП в дальний космос.
МЕТОДИКА
В экспериментальном исследовании принимали участие 8 условно здоровых11 испытуемых (n = 8) мужского пола в возрасте от 27 до 38 лет (рост не более 185 см, вес не более 90 кг), прошедших врачебно-экспертную комиссию ГНЦ РФ – ИМБП РАН (г. Москва), не принимавших за месяц и во время проведения эксперимента: алкогольные напитки, препараты, влияющих на нервную систему, высшую нервную деятельность, сердечно-сосудистую систему, на основе их устного заявления (табл. 1).
Таблица 1.
Возраст, рост, вес, индекс массы тела (ИМТ), Кср* испытуемых
| Испытуемые, n = 8 | Возраст | Рост, м | Вес, кг | ИМТ | Кср |
|---|---|---|---|---|---|
| А-19-001 | 32 | 1.73 | 64 | 21.4 | 974.9 |
| А-19-002 | 34 | 1.75 | 63 | 20.6 | 1275.7 |
| А-19-003 | 34 | 1.74 | 56 | 18.5 | 1030 |
| А-19-004 | 38 | 1.85 | 76 | 22.2 | 1510.1 |
| А-19-005 | 27 | 1.75 | 60 | 19.6 | 957.9 |
| А-19-006 | 33 | 1.83 | 80 | 23.9 | 1014 |
| А-19-007 | 38 | 1.81 | 80 | 24.4 | 580.7 |
| А-19-008 | 31 | 1.84 | 87 | 25.7 | 808.9 |
Эксперимент проводили в летне-осенний период, когда геомагнитная обстановка наиболее стабильна.
Дизайн исследования: рандомизированное двойное слепое плацебо контролируемое, что соответствует основным принципам доказательной медицины (ДМ). Серии воздействия и плацебо были зашифрованы. Дешифратор был отправлен исследователям только после окончания эксперимента.
Каждый доброволец (испытуемый) участвовал в 3-х исследованиях, график проведения которых был составлен таким образом, чтобы пауза между ними была не менее 7 дней.
Эксперимент 1: 4-часовая тренировочная сессия для адаптации испытателя к неизвестным ему условиям, методикам эксперимента, ограниченному движению, для минимизации индивидуальных реакций. Проводили предварительное обучение методикам.
Эксперимент 2: 8-часовое воздействие гипомагнитной среды. Среднее значение кратности ослабления геомагнитного поля составило 1018.8 ± ± 280.
Эксперимент 3: 8-часовое исследование в установке по созданию магнитных полей без создания гипомагнитной среды (плацебо).
Перечень исследований, проводившихся до, во время и после 8-часовой экспозиции в ГМУ, представлены в табл. 2. Так как постановщиков эксперимента интересовало как минимум 8-часовое воздействие (возможность экстраполирования данных на трудовую рабочую смену), цикл исследований электроэнцефалографии (ЭЭГ), когнитивные тесты и вызванные слуховые потенциалы проводили на 8-ом часу воздействия и продлевали экспозицию испытуемого на 1 ч (время проведения методик). Эксперимент с наличием воздействия или мнимой экспозицией (плацебо) рандомизировали.
Таблица 2.
Методологическое сопровождение экспериментальной программы
| Применяемые подходы и методы исследования | До ГМУ/ плацебо | Во время ГМУ/ плацебо | После | Пояснения |
|---|---|---|---|---|
| Создание ГМУ [13, 15 ] | – | + | – | Создание ГМУ (Z-ось) |
| Электроэнцефалография | + | +* | + | Неинвазивный метод оценки биоэлектрических потенциалов мозга |
| Когнитивные тесты | + | +* | + | Тесты, направленные на оценку памяти, внимания, скорости реакции, утомления |
| Спирометрия [16] Непрямая калориметрия [17] |
+ | + | + | Оценка функции внешнего дыхания Оценка газообмена и энерготрат в покое |
| Холтеровское мониторирование [18, 19] | + | + | + | Оценка вариабельности сердечного ритма |
| Тахиосцилография [20, 21] | + | +* | + | Изучение центральной гемодинамики |
| Тензоалгометрия и термоалгометрия | + | – | + | Оценка болевой чувствительности |
| Математическое моделирование работы сердечно- сосудистой системы [22, 23] | + | + | + | Исследование пульсовой волны, сатурации и математическое моделирование (расчет индекса Кердо) |
| Вызванные слуховые потенциалы [24–27] | + | + | + | Исследование функционального состояния внутреннего уха и ствола головного мозга |
Моделирование гипомагнитных условий. ГМУ создавали в ограниченном объеме методом компенсации естественного МП Земли системой обмоток с током (колец Гельмгольца), суммарный вектор МП которых направлен в противоположном направлении геомагнитного поля, – стенд "Арфа" (ИМБП).
Диаметр колец Гельмгольца, расстояние между ними и диапазон токов в них был подобран таким образом, чтобы создавать внутри установки рабочий объем с равномерно распределенным МП по значению и направлению. Аппаратное компенсирование геомагнитного поля осуществляли по вертикальной компоненте, параллельной максимальному размеру блока экспозиции. Установка позволяла компенсировать геомагнитное поле, создавая в рабочем объеме установки (блоке экспозиции) МП вплоть до нулевых значений индукции МП (0 мкТл), а также возможное получение отрицательных значений (обратного направления вектора геомагнитного поля). Изменение значений и направления двух других составляющих МП осуществляли при помощи поворота подвижной платформы и изменения угла наклона блока экспозиции. По граням блока экспозиции и по нижней плоскости подвижной платформы уложен провод для экранирования внешних квазистатических электрических полей, который образует так называемую камеру Фарадея. МП контролировали трехкомпонентным датчиком FL3-100 (Stefan Mayer Instruments, Германия).
Условия эксперимента. По условиям эксперимента до начала исследований испытуемые проходили утренний медицинский контроль (сбор анамнеза, контроль АД, физикальный осмотр) и предэкспозиционное исследование (до ГМУ/плацебо). При размещении внутри установки ограничивали движения испытуемого, каждые полтора часа проводили разминку (сидя). В свободное от исследований время испытуемым разрешали читать, рисовать. Туалет внутри установки осуществляли в мужскую “утку”. Питьевой режим был ограничен – 100 мл на каждый час нахождения в установке. За испытуемыми осуществлял контроль медицинский персонал (врач и медицинская сестра/лаборант), за стендом осуществляла контроль подготовленная инженерная группа. По завершению эксперимента испытуемый продолжал часть методик (например, 24-часовое холтеровское мониторирование до утра следующего дня). После экспозиционного исследования осуществляли вечерний медицинский контроль, а на утро следующего дня – телемедицинский контроль (измерение АД, сбор анамнеза). Циклограмма эксперимента предполагала прием пищи с энергетической ценностью от 112 до 287 ккал.
Внешние магнитные условия экспериментального исследования. Вариации естественного геомагнитного поля на экспериментальный день оценивали по данным обсерватории г. Москвы с локальными координатами: 55.48 град северной широты и 37.31 град восточной долготы. Были рассмотрены значения векторов для указанных координат (MOS): направление на магнитный север – MOSH; вектор по направлению на географический север (поворот на угол магнитного склонения относительно H) – MOSD; вектор вертикальной составляющей полного вектора геомагнитного поля, направленный к центру Земли – MOSZ. Значения усреднены по 553 мин (9.22 ч) с 11:20 до 20:32 на дату эксперимента.
Анализ данных вариаций геомагнитного поля свидетельствует о том, что в дни эксперимента магнитная обстановка была спокойной или слабовозмущенной, когда вариации магнитного поля были в пределах 40 нТл.
Таким образом, все экспериментальные дни – контроль (плацебо) и ГМУ, за исключением 1 дня, прошли в условиях спокойного или слабовозмущенного геомагнитного поля. Для двух испытателей (А-19-002 и А-19-003 – режим ГМУ) на 26 и 29 июля данные по геомагнитным возмущениям в базе обсерватории г. Москвы отсутствуют.
Внешние метеорологические условия и микроклимат. По данным https://yandex.ru/pogoda/ moscow: средняя температура за день в пределах от 11.8 до 25.14 град Цельсия; среднее атмосферное давление от 734.43 по 756.14 мм рт. ст.; относительная влажность от 43.8 до 77.0%; средняя скорость ветра от 0.73 до 5.77 м/с.
По данным прибора Psych orometer RST PRO (зарегистрирован в Швеции и Странах ЕС): средняя температура воздуха внутри помещения в пределах от 21.94 до 25.44 град Цельсия; средняя относительная влажность внутри помещения от 31.37 по 57.86%.
Перед началом каждого дня исследования оценивали геомагнитную активность, допускали слабые возмущения (к-индекс геомагнитной активности не более 4) для минимизации негативного влияния на физиологическое состояние испытуемого. При превышении данного показателя эксперимент переносили на другой день.
Мнимая экспозиция (плацебо) повторяла весь эксперимент, а в момент размещения в установку имитировалась работа оборудования. Циклограмма эксперимента была воспроизводима (идентична) для всех испытуемых.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Моделируемые магнитные условия в эксперименте. Полученные данные показывают, что кратность ослабления геомагнитного поля в режиме ГМУ (9 ч) для испытателей группы находились в пределах от Кср = 580.7 до 1510.1. Средние значения индукции МП в ГМУ составили 0.049 ± ± 0.015 мкТл. Среднее значение МП в режиме плацебо – 46.30 ± 0.36 мкТл. Кратность ослабления, рассчитанная из средних значений индукции МП, КB = BсрПлацебо/ВсрГМУ = 1018.
Анализ динамики изменений МП в экспериментальных режимах показал, что отдельные отклонения от среднего значения связаны с проведением медицинских методик, вызывающих в отдельных случаях небольшое локальное смещение подвижной платформы “Арфа” от выставленного положения, а также активными движениями испытателя в экспозиционном блоке. Однако эти вариации МП были незначительны и не повлияли на общие магнитные условия экспозиций.
Оценка функционального состояния ЦНС по данным ЭЭГ. По техническим причинам из 8 добровольцев были выбраны данные 6 чел. для анализа, у которых наблюдалось три вида индивидуально-типологических особенностей. У троих добровольцев наблюдался ЭЭГ-паттерн, организованный во времени и пространстве, с доминированием α-ритма (Аср 25–55 мкВ) и затылочно-лобным градиентом его амплитуды, с умеренно выраженной β-активностью (5–15 мкВ). У двух человек выявлен десинхронный ЭЭГ-паттерн с доминированием β-активности средней и высокой частоты с амплитудой до 30 мкВ и резко сниженным α-индексом (в 5–10 раз по сравнению с организованным типом ЭЭГ-паттерна). У одного добровольца наблюдалось замещение функциональной активности α-ритма на β1-ритм. Для нивелирования различий начального функционального состояния ЦНС добровольцев было проведено нормирование относительного значения мощности (ОЗМ) основных ЭЭГ-диапазонов, зарегистрированных в 4-х экспериментальных точках к фону.
Анализ данных. Ни в одном из измеренных и рассчитанных параметров не было обнаружено статистически достоверных различий. Исключение составило отношение сумм диапазонов ЭЭГ-спектра ОЗМ δ- и ОЗМ θ- к ОЗМ α- и ОЗМ β-активности (используется исследователями для различения ЭЭГ-нормы и отклонений от нее), при этом границей между ними является диапазон индекса от 0.2 до 0.8 [28]. В нашем случае, при отсутствии клинических проявлений, превышение максимального уровня индекса может свидетельствовать о сдвиге церебральной активности в сторону торможения, что является свидетельством развития утомления. Статистически достоверное различие было обнаружено по этому показателю на 2 точке исследования (условно в 15 ч 30 мин): в ГМУ на 82.5% выше, чем в плацебо (табл. 3).
Таблица 3.
Нормированные значения отношения ОЗМ δ + θ к ОЗМ α + β-диапазона в плацебо/ГМУ
| Плацебо | 13–30 | 15–30* | 17–30 | 19–30 | ГМУ | 13–30 | 15–30* | 17–30 | 19–30 |
|---|---|---|---|---|---|---|---|---|---|
| А-19-001 | –0.97427 | –2.77535 | 3.206822 | 0.710298 | А-19-001 | 4.588539 | 2.273682 | –0.36924 | –0.79026 |
| А-19-002 | 11.31637 | 0.849797 | 16.71925 | –80.9739 | А-19-002 | 0.905516 | 2.409459 | –1.80678 | –0.5025 |
| А-19-003 | 0.167563 | –0.94773 | –0.04621 | –0.11365 | А-19-003 | –1.06432 | 0.233381 | 11.90741 | 0.571958 |
| А-19-005 | –0.94441 | –6.12418 | 1.555754 | –6.41533 | А-19-005 | –0.02795 | –1.98772 | –1.78966 | –0.04935 |
| А-19-006 | –4.35029 | –3.61085 | –3.52765 | –3.71267 | А-19-006 | –2.11858 | –2.18663 | –2.24878 | –2.80399 |
| А-19-008 | –6.33632 | –5.18827 | –1.33856 | –1.28539 | А-19-008 | –1.5757 | –1.35375 | 2.16693 | –0.67718 |
Оценка функционального состояния кардиореспираторной системы по данным тахоосцилограммы. Наиболее информативными гемодинамическими показателями, которые анализировались в ходе проведенного эксперимента, были: ЧСС, динамика значений периферического кровяного давления (pSBP, pDBP), центрального давления в аорте (cSBP, cDBP), скорость распространения пульсовой волны (СРПВ), ударный объем (УО) и общее периферическое сосудистое сопротивление (ОПСС). Все эти показатели, измеренные с помощью прибора “Мобилограф” до и во время воздействия (либо его отсутствия) у каждого из испытателей были проанализированы отдельно, а также с вычислением средних значений для 8 чел.
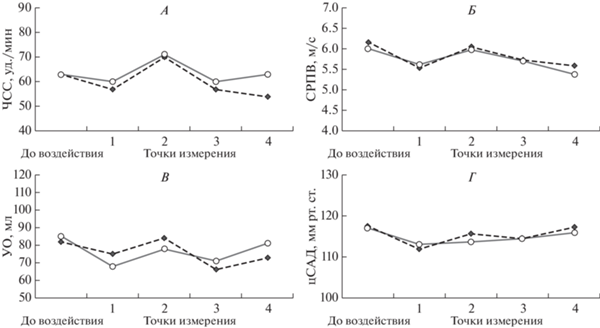
ЧСС менялась незначительно, у шести из восьми испытуемых наблюдалась одинаковая тенденция к снижению ЧСС во всех точках по сравнению с фоновым значением. Индивидуальные графики, отражающие изменение ЧСС отличаются незначительно, проявляют одинаковую тенденцию, а чаще всего, четко совпадают при сравнении ГМУ и плацебо. Лишь у одного испытуемого выявлена обратная тенденция, когда фоновые значения оказались ниже тех, что зафиксированы во время нахождения в установке “Арфа”, однако это, на наш взгляд, не связано с воздействием ГМУ и не может служить объективным доказательством того, что во время воздействия ЧСС увеличивается.
Скорость распространения пульсовой волны (СРПВ) в аорте считается “золотым стандартом” определения артериальной жесткости в клинической практике и имеет наиболее широкую доказательную базу прогностического значения в отношении риска возникновения сердечно-сосудистых осложнений. При анализе этого показателя было выявлено, что для большинства испытателей характерны лишь очень незначительные колебания, а во многих случаях – точное совпадение двух тестов, на основании чего, можно сделать вывод о том, что данные колебания происходят независимо от наличия или отсутствия ГМУ.
Отмечено отсутствие каких-либо выраженных тенденций и достоверных различий в изменении параметров центрального давления в аорте между ГМУ и плацебо.
Показатели ударного объема колебались в пределах до 20 мл, однако зависимости от наличия или отсутствия воздействия выявлено не было. Однонаправленные изменения УО в двух тестах, скорее всего, указывает на устойчивость гемодинамических показателей у испытуемых и, возможно, проявляющийся, таким образом, их биоритмологический профиль.
Примеры полученных результатов представлены на рис. 1.
Рис. 1.
Пример идентичности изменений показателей частоты сердечных сокращений (А), скорости распространения пульсовой волны (Б), ударного объема (В) и центрального систолического давления (Г) во время воздействия гипомагнитных условий (ГМУ) или плацебо.
Оценка вегетативного индекса Кердо (ВИК). В большинстве случаев (в 6 из 8), изменения в ГМУ связаны с повышением ВИК в среднем на 0.2 (на 20%), а в 2 из 8 случаев (у А-19-005 и A-19-008) с таким же понижением ВИК на 0.2 (на 20%). Это означает, что в состоянии покоя и положении сидя в условиях сниженного МП модулирующее влияние парасимпатической нервной системы значимо снизилось по сравнению с контролем в большинстве рассмотренных случаев. Более подробные результаты исследования ВИК, ЧСС и АД в ГМУ опубликованы в работе [29].
Оценка функции внешнего дыхания, изучение газообмена и энерготрат в покое. Установлено, что величины исследуемых спирометрических показателей (величины форсированной жизненной емкости легких (ФЖЕЛ), объема форсированного выдоха за первую секунду (ОФВ1) и их соотношение), характеризующих функцию внешнего дыхания, находились в пределах возрастной физиологической нормы, в ряде случаев – даже превышая должные величины (рассчитанные для каждого обследуемого индивидуально с учетом возраста и роста) и существенно не изменялись после экспериментального воздействия ни в одной из серий эксперимента.
Для сравнительной оценки легочной вентиляции анализировались следующие параметры спонтанного (спокойного) дыхания: дыхательный объем (вдох и выдох), частота дыхания, минутный объем дыхания в аналогичные периоды (через 3 и 8 ч воздействия ГМУ/плацебо). Полученные первичные данные вентиляции и газообмена усредняли по времени (за периоды по 30 с).
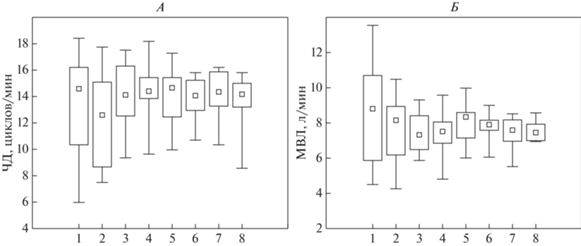
Анализ данных показал отсутствие выраженных различий между экспериментальными сериями в изучаемые периоды сравнения. Можно отметить, что в контролируемых условиях (в условиях эксперимента) параметры как частоты дыхания, так и уровня минутной вентиляции становятся менее вариабельными и более стабильными в отличие от первого измерения, проводимого после прибытия обследуемого в лабораторные условия (рис. 2). Отсутствие изменений частоты дыхания в ГМУ отмечали в длительном эксперименте и американские исследователи [30].
Рис. 2.
Показатели частоты дыхания (А) и минутной вентиляции легких (Б) в сравнительные периоды экспериментальных серий. Представлены медианы и интерквартильный размах. Точки измерения: 1 – ГМУ (гипомагнитные условия)–фон; 3 – ГМУ–воздействие через 3 ч; 5 – воздействие ГМУ через 5 ч; 7 – воздействие ГМУ через 8 ч; 2 – плацебо–фон; 4 – плацебо – через 3 ч; 6 – плацебо – через 5 ч; 8 – плацебо – через 8 ч.
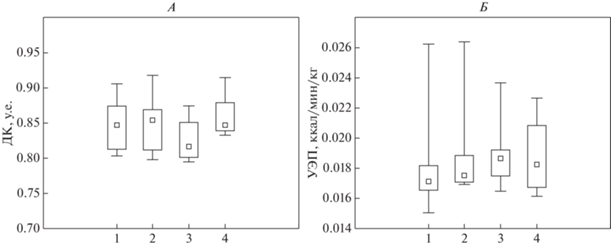
Оценка состояния газоэнергообмена показала также выраженную вариабельность показателей в “фоновом” утреннем исследовании до начала воздействия: у некоторых обследуемых дыхательный коэффициент превышал единицу вследствие недавнего приема пищи (завтрака). В течение экспериментального периода показатели стабилизировались, характеризовались меньшей вариабельностью, при этом, также можно отметить влияние легкого перекуса за 1–1.5 ч до проведения измерения в 16.00, в то время как величины, измеренные в 20.00 (через 4.5–5 ч после контролируемого перекуса) являются более корректными в методическом отношении. Сравнение уровня дыхательного коэффициента, характеризующего энергетическую интенсивность метаболических процессов в целом, показало статистически значимое различие в величине этого показателя (p = = 0.025 по критерию Вилкоксона) после 8 ч воздействия ГМУ (рис. 3). Это наблюдение вполне согласуется с данными, полученными J.-P. Fu et al. [31], свидетельствующими о снижении митохондриальной активности в клетках скелетных мышц мышей в условиях 3-суточного гипомагнитного воздействия. Тем не менее, расчет уровня энерготрат покоя (УЭП) (с использованием формулы Вейра) показал отсутствие различий данного показателя между сериями эксперимента.
Рис. 3.
Величины дыхательного коэффициента (А) и уровня энерготрат покоя (Б). Представлены медианы и интерквартильный размах. Точки измерения: 1 – воздействие гипомагнитных условий (ГМУ) через 3 ч; 3 – воздействие ГМУ через 8 ч; 2 – плацебо – через 3 ч; 4 – плацебо – через 8 ч.
Оценка вариабельности сердечного ритма (ВСР) с использованием методики холтеровского мониторирования. При анализе данных как отдельных испытателей, так и объединенных в группу, по усредненным почасовым показателям ВСР наметились тенденции, характеризующие рост активности регуляторных звеньев парасимпатического отдела вегетативной нервной системы. Часть этих трендов можно отнести к независимым от ГМУ, другие, возможно, связаны с 8-часовым воздействием, которое оказало непосредственное влияние на структуру суточной ВСР. У 5 испытателей, которые подвергались воздействию ГМУ в разные дни, время отхода ко сну (по снижению ЧСС в вечерние часы) было в среднем на 1 ч раньше, чем после плацебо воздействия. К независимым тенденциям стоит отнести однотипность и индивидуальный “рисунок” суточных ритмов при ГМУ и плацебо воздействии, который, с одной стороны, обусловлен одинаковой циклограммой эксперимента. С другой стороны, хронофизиологические процессы с наименьшей вероятностью могут изменяться в пределах околонедельных циклов (от 7 до 10 сут), поэтому в дальнейших исследованиях стоит придерживаться повторяемости исследований без сдвигов в сроках более чем на 2–3 дня. Применение методики дисперсионного анализа с повторными измерениями, при котором каждые 5-минутные фрагменты анализировались пошагово (ANOWA), выявило достоверные отличия большинства показателей ВСР (р < 0.0001). Снизилась частота пульса (с 63.6 ± 0.1 до 56.8 ± 0.3 уд./мин), при этом значительно выросла суммарная ВСР, отражаемая компонентами SDNN (c 87.3 ± 1.1 до 130.7 ± 4.1 мс) и TP (c 6.08 ± ± 0.1 до 11.2 ± 0.6 мс2). Существенно уменьшилась симпатическая иннервация, оцениваемая по показателям стресс-индекс (по Баевскому) с 45.9 ± ± 0.9 до 22.3 ± 1 у.е. и соотношением LF/HF (c 2.9 ± 0.1 до 1.8 ± 0.1). Параллельно наблюдалась значительная ваготоническая активация: увеличение RMSSD (с 47.9 ± 0.2 до 63.3 ± 0.9 мс) и pNN50 (с 26.8 ± 0.2 до 38.6 ± 0.6%), а также рост HF-высокочастотной области спектра (c 0.8 ± 0.02 до 1.06 ± 0.04 мс2). Интересно, что для частотного спектра ВСР наибольший прирост наблюдался в области ультранизкочастотных колебаний (ULF), который принято учитывать в анализе многочасовых и суточных записей. При этом снижение представленности ULF является неблагоприятным прогностическим признаком. Можно отметить, что только при ГМУ (по результатам кросскорреляционного анализа) наблюдался рост энтропии показателей ВСР c появлением компонентов “сложности” автономной регуляции синусового узла сердца.
Из полученных нами результатов следует, что адаптация к 8-часовому пребыванию в ГМУ происходит за счет достоверного повышения активности парасимпатического (вагусного) звена регуляции кардиоритма, менее затратного приспособительного процесса. Однако наличие в группе исследуемых представителя с предельно высоким тонусом вагуса (тренированного атлета), у которого воздействие ГМУ вызвало незначительную инверсию регуляторных механизмов в сторону симпатической активации (в пределах нижних границ нормальных значений), указывает на наличие “феномена” адаптации к ГМУ.
Оценка функционального состояния слуховой системы добровольцев. При анализе параметров задержанной вызванной отоакустической эмиссии (ЗВОАЭ) в адаптационно-тренировочный период и в период воздействия плацебо во время нахождения испытателя в установке “Арфа” отмечается тенденция к снижению показателя отношения “сигнал–шум” (дБ) на частотах 1–2 кГц и тенденция к увеличению данного показателя на частотах 3–4 кГц. В период воздействия ГМУ изменения на низких частотах (1–2 кГц) носили более плавный характер, сохраняя значения близкие к фону, несколько снижаясь лишь к концу воздействия. На частоте стимуляции 3 кГц изменения носили относительно разнонаправленный характер, с тенденцией к увеличению параметра “сигнал–шум” (дБ). На частоте стимуляции 4 кГц отмечалось отчетливое увеличение данного параметра. В периоде восстановления наблюдалось быстрое возвращение показателей к исходным, а в ряде случаев отмечались более высокие значения отношения “сигнал–шум” ЗВОАЭ в сравнении с фоновыми показателями.
При анализе параметров отоакустической эмиссии на частоте продукта искажения (ПИОАЭ) в адаптационно-тренировочный период во время нахождения испытателя в установке “Арфа” отмечалась тенденция к снижению показателя отношения “сигнал–шум” (дБ) на всех предъявляемых частотах стимуляции (556–684–988–1481–2222–2963 Гц), за исключением частоты 4444 Гц, где наблюдалась тенденция к плавному увеличению данного показателя. Аналогичные изменения параметров ПИОАЭ отмечались и в период воздействия плацебо. В период воздействия ГМУ показатель отношения “сигнал–шум” ПИОАЭ показал тенденцию к увеличению на частотах 556–684 Гц, на частотах 988–1481–2222–2963 Гц регистрировалось уменьшение показателей, а на частоте 4444 Гц отмечены разнонаправленные изменения с тенденцией к плавному увеличению отношения “сигнал–шум” ПИОАЭ.
Таким образом, динамика параметра отношения “сигнал–шум” отоакустической эмиссии (как ЗВОАЭ, так и ПИОАЭ) показала тенденцию к снижению, преимущественно в диапазоне низких и средних частот стимуляции в адаптационно-тренировочный период и в период воздействия плацебо. В период воздействия ГМУ отмечалось менее выраженное снижение амплитуд для всего частотного диапазона и тенденция к увеличению амплитуды ответа на низких частотах стимуляции. Показатели латентности пиков и межпиковых интервалов коротколатентных слуховых вызванных потенциалов (КСВП) на протяжении эксперимента находились в границах физиологических значений нормы. Достоверных статистических различий параметров ЗВОАЭ, ПИОАЭ и КСВП по критерию Вилкоксона не выявлено.
Оценка порога болевой чувствительности и уровня кортизола. Полученные данные не позволяют утверждать о существенном влиянии 8-часовой экспозиции ГМУ на показатели болевой чувствительности (ПБЧ) (p > 0.05). Полученные данные свидетельствуют об отсутствии существенного влияния циркадианных ритмов, а также суточной динамики уровня кортизола на ПБЧ как на фоне воздействия плацебо, так и на фоне воздействия ГМУ. Имеющиеся результаты подтверждают отсутствие существенного влияния функциональной асимметрии организма (в том числе нервной системы) на ПБЧ как на фоне воздействия плацебо, так и на фоне воздействия ГМУ (p > 0.05). Также результаты указывают на сопоставимость показателей ПБЧ, полученных методом тензоалгометрии как при однократном измерении, так и при использовании среднего значения, по итогам трехкратного измерения с интервалами в 30 с (рекомендованных в некоторых методиках алгометрии) как на фоне воздействия плацебо, так и на фоне воздействия ГМУ. Используемая методика алгометрии подтвердила хорошую сопоставимость и воспроизводимость результатов. Полученные данные не позволяют утверждать о существенном влиянии 8-часовой экспозиции ГМУ на уровень кортизола (p > 0.05), что, однако, может быть обусловлено недостаточной экспозицией ГМУ и/или недостаточным объемом выборки. Уровень кортизола (медиана и интерквартильная широта) в слюне ожидаемо значимо различался во время измерения утром, в 10.05-10.25 (0.617 (0.331–0.787) мкг/дл; в т. ч. плацебо – 0.551 (0.352–0.787) мкг/дл; ГМУ – 0.617 (0.331–0.794) мкг/дл), и вечером, в 20.30–20.50 (0.312 (0.211–0.369) мкг/дл; в т. ч. плацебо – 0.314 (0.211–0.365) мкг/дл; ГМУ – 0.302 (0.215–0.369) мкг/дл) (p < 0.05). Уровень кортизола в слюне ожидаемо коррелировал с ростом, весом и индексом массы тела испытуемых (p < 0.05). В то же время изолированное отсутствие корреляции (в отличие от всех остальных точек) между данными параметрами и уровнем кортизола после воздействия ГМУ, позволяет предположить наличие дополнительного фактора влияния, в роли которого могут выступать и ГМУ. Следует также отметить, что при обследовании вечером, после воздействия плацебо, отмечалась обратная корреляция между уровнем кортизола в слюне и показателями ПБЧ (p < 0.05), в то время как при обследовании после воздействия ГМУ подобная корреляция отсутствовала.
ЗАКЛЮЧЕНИЕ
В настоящее время ГМУ являются самым неизученным фактором на пути дальнейшего освоения космического пространства. Перспективы межпланетных полетов делают изучение влияния редуцированного МП на организм человека актуальной задачей. Авторы данной статьи пытались исследовать этот фактор шаг за шагом, начиная с системного уровня организации живой материи и переходя к ее более дифференцированным уровням. Согласно полученным данным, пребывание человека до 8 ч в условиях сниженного МП (кратность снижения в среднем составила 1018.8 ± ± 280 раз по сравнению с Земным МП) не выявило достоверных клинических рисков в малой выборке (n = 8) практически здоровых добровольцев.
Несмотря на то, что кратковременное 8-часовое воздействие ГМУ не оказало влияния на организм человека на системном уровне, несомненный интерес вызывает появление утомления ЦНС в исследуемых условиях по сравнению с плацебо.
Стоит отметить, что модулирующее влияние парасимпатической нервной системы в большинстве рассмотренных случаях значимо снизилось по сравнению с контролем. Выявленные различия в величине дыхательного коэффициента при воздействии ГМУ требуют уточнения при проведении дальнейших исследований. В результате применения различных методов изучения сердечно-сосудистой системы в ГМУ получены противоречивые результаты. Их сопоставление и выводы по сравнительному анализу полученных данных будут опубликованы авторами соответствующего раздела в последующих публикациях.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института медико-биологических проблем РАН (Москва). Протокол № 514 от 4 июня 2019 г.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Экспериментальное исследование выполнено в рамках базовой тематики РАН 64.1.
Благодарности. Авторы выражают благодарность Е.Ю. Берсеневу за предоставленные материалы для раздела «Оценка вариабельности сердечного ритма (ВСР) с использованием методики холтеровского мониторирования».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Afshinnekoo E., Scott R.T., MacKay M.J. et al. Fundamental Biological Features of Spaceflight: Advancing the Field to Enable Deep-Space Exploration // Cell. 2020. V. 183. № 5. P. 1162.
Hassler D.M., Zeitlin C., Wimmer-Schweingruber R.F. et al. Mars’ surface radiation environment measured with the Mars Science Laboratory’s Curiosity rover // Science. 2014. V. 343. № 6169. P. 1244797.
Patel Z.S., Brunstetter T.J., Tarver W.J. et al. Red risks for a journey to the red planet: The highest priority human health risks for a mission to Mars // NPJ Microgravity. 2020. V. 6. № 1. P. 33.
Jillings S., Van Ombergen A., Tomilovskaya E. et al. Macro- and microstructural changes in cosmonauts' brains after long-duration spaceflight // Sci. Adv. 2020. V. 6. № 36. P. eaaz9488.
Vernice N.A., Meydan C., Afshinnekoo E., Mason C.E. Long-term spaceflight and the cardiovascular system // Precis. Clin. Med. 2020. V. 3. № 4. P. 284.
Panasyuk M.I., Spassky A.V., Trukhanov K.A. Hypo-Magnetic Problems of the Deep Space Missions // J. Astrobiol. Outreach. V. 2. № 3. https://doi.org/10.4172/2332-2519.1000e106
Рагульская М.В. Влияние вариаций солнечной активности на функционально здоровых людей. Автореф. … канд. физ.-мат. наук. 01.03.03: М., 2005. 165 с.
Михайлова З.Д., Климкин П.Ф., Шаленкова М.А. и др. Оценка значимости уровня мелатонина и некоторых метеорологических и гелиогеофизических факторов у больных с острым коронарным синдромом // Клиническая медицина. 2017. Т. 95. № 10. С. 888.
Кравченко К.Л., Александрова Н.В., Язев С.А. Гелиофизические факторы и преступность в Иркутской области // Известия Иркутского государственного университета. Серия: Науки о Земле. 2010. Т. 3. № 2. С. 103.
Кишинёв Д.А., Чернецов Н.С. Магниторецепторные системы у птиц: обзор современных исследований // Журн. общей биологии. 2014. Т. 75. № 2. С. 104.
Селезнев В.П., Селезнева Н.В. Навигационная бионика. М.: Машиностроение, 1987. 256 с.
Куранова М.Л., Павлов А.Е., Спивак И.М. и др. Воздействие гипомагнитного поля на живые системы // Вестн. СПбГУ. Сер. 3. Биология. 2010. № 4. С. 99.
Саримов Р.М., Бинги В.Н., Миляев В.А. Влияние компенсации геомагнитного поля на когнитивные процессы человека // Биофизика. 2008. Т. 53. № 5. С. 856.
Гурфинкель Ю.И., Васин А.Л., Матвеева Т.А., Сасонко М.Л. Оценка влияния гипомагнитных условий на капиллярный кровоток, артериальное давление и частоту сердечных сокращений // Авиакосм. и экол. мед. 2014. Т. 48. № 2. С. 24. Gurfinkel Yu.I., Vasin А.L., Matveeva Т.А., Sasonko М.L. [Evaluation of the hypomagnetic environment effects on capillary blood circulation, blood pressure and heart rate] // Aviakosm. Ekol. Med. 2014. V. 48. № 2. P. 24.
Васин А.Л., Шафиркин А.В., Груфинкель Ю.И. Влияние искусственного периодического геомагнитного поля миллигерцового диапазона на показатели вариабельности сердечного ритма // Авиакосм. и экол. мед. 2019. Т. 53. № 6. С. 62. Vasin A.L., Shafirkin A.V., Gurfinkel Yu.I. [Effect of artificial alternating geomagnetic field in the millihertz range on the heart rate variability indices] // Aviakosm. Ekol. Med. 2019. V. 53. № 6. P. 62.
Culver B.H., Graham B.L., Coates A.L. et al. Recommendations for a standardized pulmonary function report an official American Thoracic Society Technical Statement // Am. J. Respir. Crit. Care Med. 2017. V. 196. № 11. P. 1463.
Fullmer S., Benson-Davies S., Earthman C.P. et al. Evidence analysis library review of best practices for performing indirect calorimetry in healthy and non-critically ill individuals // J. Acad. Nutr. Diet. 2015. V. 115. № 9. P. 1417.
Heart rate variability. Standards of measurement, physiological interpretation, and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology // Circulation. 1996. V. 93. № 5. P. 1043.
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В. и др. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем (методические рекомендации) // Вестник аритмологии. 2001. № 24. С. 65.
Лучицкая Е.С., Фунтова И.И., Tank J. и др. Измерение показателей, характеризующих раннее сосудистое старение с использованием осциллометрического метода в космическом полете // Авиакосм. и экол. мед. 2021. Т. 55. № 6. С. 23. Luchitskaya Е.S., Funtova I.I., Tank J. et al. [Measuring indicators characterizing early vascular aging using the oscillometric method in space flight] // Aviakosm. Ekol. Med. 2021. V. 55. № 6. P. 23.
Weber T., Wassertheurer S., Hametner B. et al. Noninvasive methods to assess pulse wave velocity: comparison with the invasive gold standard and relationship with organ damage // J. Hypertens. 2015. V. 33. № 5. P. 1023.
Kerdo I. Ein aus Daten der Blutzirkulation kalkulierter Index zur Beurteilung der vegetativen Tonuslage // Acta Neuroveg. 1966. V. 29. № 2. P. 250.
Gesche H., Grosskurth D., KuchlerG., Patzak A. Continuous blood pressure measurement by using the pulse transit time: comparison to a cuff- based method // Eur. J. Appl. Physiol. 2012. V. 112. № 1. P. 309.
Kemp D.T. Stimulated acoustic emissions from within the human auditory system // J. Acoust. Soc. Am. 1978. V. 64. № 5. P. 1386.
Brown A.M., Kemp D.T. Suppressibility of the 2f1–f2 stimulated acoustic emissions in gerbil and man // Hear. Res. 1984. V. 13. № 1. P. 29.
Gorga M.P., Neely S.T., Bergman B.M. et al. A comparison of transient-evoked and distortion product otoacoustic emissions in normal-hearing and hearing-impaired subjects // J. Acoust. Soc. Am. 1993. V. 94. № 5. P. 2639.
Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. М.: МЕДпресс информ, 2003. 264 с.
Schomer D.L., Lopes da Silva F.H. Niedermeyer’s Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. 6th Edition. Phaladelphia: Lippincott Williams & Wilkins, 2011. P. 1205.
Демин А.В., Суворов А.В., Орлов О.И. Особенности гемодинамики здоровых мужчин в гипомагнитных условиях // Авиакосм. и экол. мед. 2021. Т. 55. № 2. С. 63. Demin A.V., Suvorov A.V., Orlov O.I. [Peculiarities of hemodynamics in healthy men under hypomagnetic conditions] // Aviakosm. Ekol. Med. 2021. V. 55. № 2. P. 63.
Beischer D.E. Biomagnetics // Ann. N.Y. Acad. Sci. 1965. V. 134. № 1. P. 454.
Fu J.-P., Mo W.-Ch., Liu Y., He R.-Q. Decline of cell viability and mitochondrial activity in mouse skeletal muscle cell in a hypomagnetic field // Bioelectromagnetics. 2016. V. 37. № 4. P. 212.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


